浅发酵和冷加工泡菜(俗称“洗澡泡菜”)指在低温(5~20 ℃)或者常温(20~37 ℃)下由老卤水作为启动发酵剂发酵2~7 d而成的低盐、低酸即食发酵蔬菜制品,通常需要冷链运输销售,不但较好地保持了泡菜原有的色泽、风味与质地,保证了泡菜的低酸,也保持了乳酸菌的活性[1-2]。老卤水是影响泡菜发酵品质的关键,通过不断推陈出新的发酵方式,其中除了存在稳定的乳酸菌菌群和风味物质,同时也存在有害物质积累的风险[3],因此了解这些危害因子的生成规律并加以控制是提高泡菜安全品质的保障。
氨基甲酸乙酯(ethyl carbamate,EC)又名乌拉坦、乌来雅或者尿烷,是发酵食品在生产、储存过程中生成的一种有害物质,2002年联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)对EC的限量标准作出规定,含量不能超过20 μg/L[4]。EC 2007年被国际癌症研究机构列为2A级,即“可能令人类致癌的物质”,与甲醛同级[5],该物质广泛存在于发酵食品(泡菜、酱油、酒)中[6]。在发酵食品中温度是影响EC生成的主要因素[7],例如罗伊氏乳杆菌产生的酸性脲酶对EC有降解作用,这些EC降解相关酶系的活性受到温度因素的影响很大[8]。目前在泡菜规模化生产中多未进行发酵温度控制,因此发酵温度在不同季度差异较大(10~30 ℃),这样的生产现状势必对泡菜中EC的生成造成影响。因此,探明不同温度下泡菜中EC的生成规律可为泡菜生产过程安全控制提供可参考依据。
本研究在10、20、30 ℃下发酵萝卜,测定发酵过程中EC含量、理化指标和微生物数量、挥发性物质以及菌群结构,最后通过Pearson相关性分析讨论泡萝卜理化指标和菌群结构对不同温度下EC含量差异的成因分析。研究结果可为发酵泡菜EC的控制、食用安全及工业化生产提供科学依据和理论指导。
1 材料与方法
1.1 材料与试剂
老卤水,四川眉山市某泡菜厂;萝卜,四川成都市锦江区观音桥菜市场;食盐,四川顺城盐品股份有限公司;EC(CAS:51-79-6),标准品,纯度99.83%,上海源叶生物科技有限公司;正己烷、丙酮、二氯甲烷(均为色谱纯),天津市科密欧化学试剂有限公司;无水Na2SO4,成都市科龙化工试剂厂。
1.2 仪器与设备
Intuvo9000-5977b型气质联用色谱仪、20孔真空萃取装置,美国Agilent公司;Seven Compact S210型pH计,梅特勒-托利多仪器(上海)有限公司;Cleanert EC氨基甲酸乙酯专用固相萃取柱,厦门广晟达仪器设备有限公司;干式氮吹仪,上海梓桂仪器有限公司;SPME萃取纤维,50/30 μm DVB/CAR/PDMS,Supelco公司。
1.3 实验方法
1.3.1 泡萝卜准备
准备盐度4%(质量分数)的老卤水9坛,各1 800 mL,并分别加入萝卜块900 g,将泡菜坛水封后分别放入10、20、30 ℃培养箱进行发酵,于0、3、5、7 d取样,每次取3坛样品作为重复。微生物指标当天测定,剩余样品存放于-80 ℃冰箱用于其余指标测定。
1.3.2 EC的测定
1.3.2.1 EC标准溶液
用甲醇配制1.00 mg/mL的储备液,并依次配1、10、25、50、100、200 μg/L的标准曲线工作液。
1.3.2.2 样品中EC的提取
参考GB 5009.223—2014《食品安全国家标准 食品中氨基甲酸乙酯的测定》的方法,略有改动。
1.3.2.3 GC-MS条件
色谱条件:DB-WAX色谱柱(30 m×250 μm,0.25 μm),柱温50 ℃,保持1 min,然后以8 ℃/min的速度升至180 ℃程序运行完成后,以240 ℃后运行5 min,总运行时间17.5 min。载气He,流速1 mL/min;不分流进样,溶剂延迟11 min,进样量1 μL。
质谱条件:离子源温度230 ℃,电子能量70 eV,接口温度220 ℃,检测离子m/z 44、62、74、89,定量离子62。
1.3.3 理化指标分析检测
理化指标测定均取发酵卤水,采用电位法测定不同温度下泡萝卜卤水的pH值;采用酸、碱中和滴定法测定总酸含量[9];还原糖采用二硝基水杨酸法测定[10];尿素的测定参考GB/T 36859—2018《饲料中尿素含量的确定》;乙醇的测定参考魏晓霞[11]的方法。
1.3.4 挥发性物质测定
样品制备:取5 mL泡萝卜卤水,并加入1.5 g的NaCl于20 mL的顶空进样瓶中,待GC-MS分析,GC-MS条件参考侯新磊等[12]的方法。
1.3.5 微生物指标
于无菌条件下取不同发酵温度的泡萝卜水梯度稀释后选取适宜梯度样品液,涂布于MRS培养基并置于37 ℃培养箱培养2~3 d,计数为乳酸菌数量;涂布于孟加拉红培养基并置于30 ℃培养箱培养2~3 d,计数为真菌数量。
1.3.6 菌群结构的测定
取不同温度下发酵萝卜卤水,10 000 r/min离心10 min,取沉淀送金唯智测序公司进行提样和PCR扩增,所得扩增子由该公司应用Illumina Miseq平台进行测定。
1.4 数据处理与统计分析
采用SPSS 20.0软件分析数据之间的差异显著性,选取P<0.05。折线图使用GraphPad Prism 9软件,OPLS-DA使用SIMCA14.1,相关性热图分析使用Origin 2022b。
2 结果与分析
2.1 不同发酵温度对泡萝卜EC及其前体物质生成的影响
为明确发酵温度对泡萝卜EC生成规律的影响,监测了不同温度下泡萝卜在发酵过程中的EC及其前体物质含量变化。根据测定结果得回归方程为y=640.55x-17 044,R2=0.999 7。由图1-a可知,10 ℃中EC的含量变化与20和30 ℃中显著不同(P<0.05)。在20和30 ℃下,EC含量随着发酵时间呈减少趋势,发酵第3天时含量均低于FAO的最高允许限量标准20 μg/L[4];在10 ℃下,EC含量随着发酵时间呈先增加后减少趋势,在发酵第3天时,EC含量增加至79.64 μg/L,发酵7 d时减少到23.43 μg/L,仍高于FAO标准。微生物代谢活动产生的酸性脲酶、EC酶对EC都有间接或直接的降解作用,有研究表明EC酶在酸性条件下较稳定,且该酶在25~45 ℃稳定性较强,因此低温下EC在泡萝卜中的变化趋势与中高温组不同[13]。

a-EC含量;b-尿素;c-乙醇
图1 不同发酵温度对泡萝卜中EC及其前体物质含量的影响
Fig.1 Effects of different fermentation temperature on EC and its precursors content of radish Paocai
目前,形成EC的前体物质主要有尿素、乙醇、氰化物、瓜氨酸、焦碳酸二乙酯和氨甲酰磷酸等[14]。乙醇和尿素可自发生成EC,XIAO等[15]研究表明在酸性饮料中,90%的EC来源于乙醇和尿素的化学反应。泡菜中乙醇来源于酵母的代谢,尿素可能来源于酵母精氨酸酶分解精氨酸产生,也可能来源于蔬菜生长过程中富集土壤中的化肥尿素[8]。由图1-b可知,尿素在不同温度下,随着发酵的进行,前期都呈增加趋势,因此推测泡萝卜中尿素主要由原料带入;在发酵3 d时,10 ℃中的尿素含量低于中高温组,说明尿素分解速度大于生成速度,减少的尿素可能转化为EC。由图1-c可知,乙醇主要是由酵母代谢产生,10 ℃中乙醇一直下降,一方面可能是低温抑制酵母产乙醇的过程,另一方面可能是乙醇与尿素反应生成EC,导致乙醇消耗速度大于生成速度。因此,推测尿素和乙醇是泡萝卜中EC生成的重要前体物质。
2.2 不同发酵温度对泡萝卜发酵进程的影响
2.2.1 不同发酵温度对泡萝卜中还原糖含量的影响
由图2可知,10和20 ℃下的泡萝卜在0~3 d还原糖都呈增加趋势,这主要是萝卜中的还原糖在卤水中不断溶解所致;3 d后逐渐减少,且与10 ℃相比,由于20 ℃下微生物代谢速度更快,还原糖降低速率增加,30 ℃下在发酵3 d时还原糖基本消耗殆尽,表明温度升高后微生物对还原糖的代谢消耗增强。
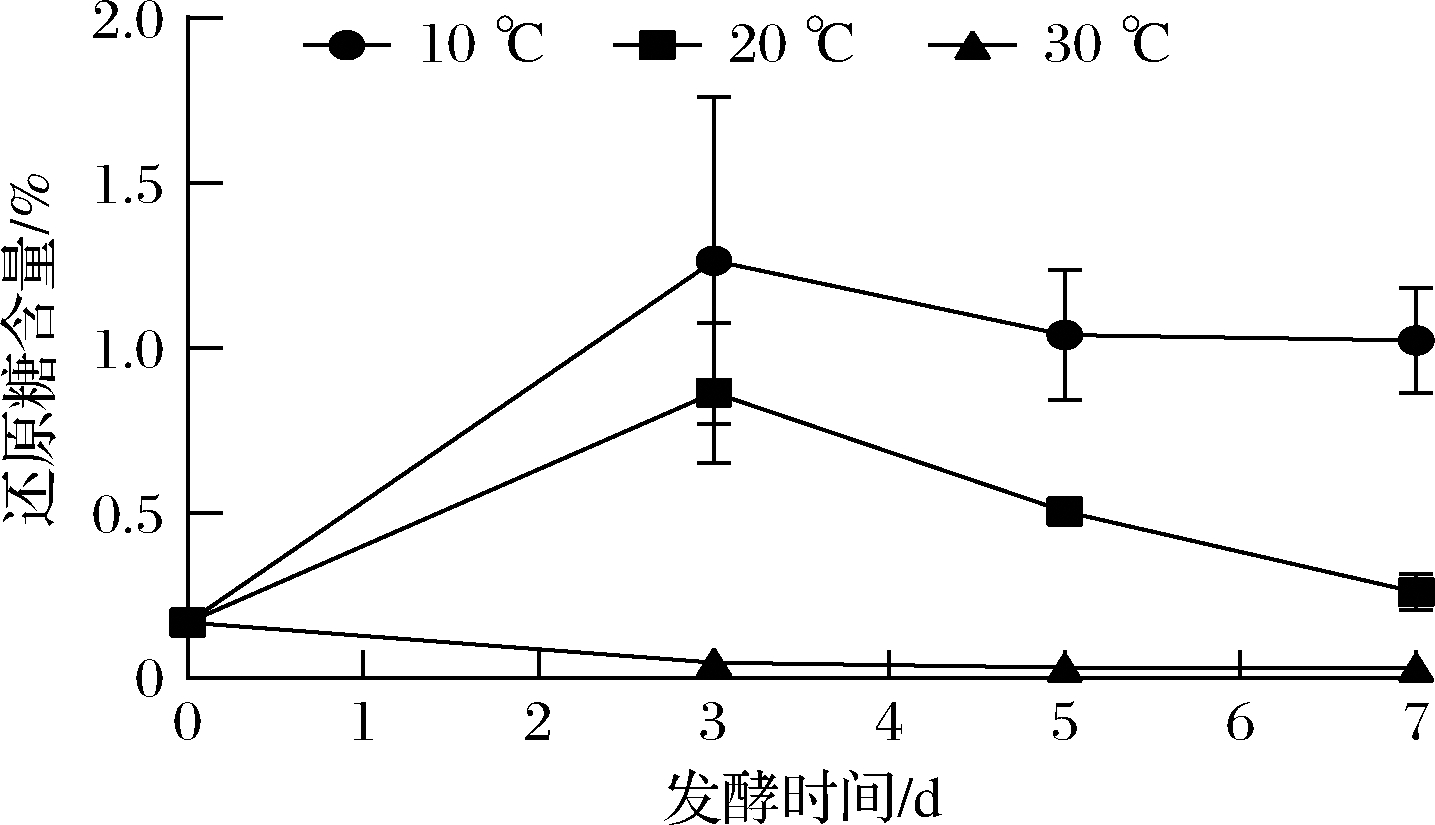
图2 不同发酵温度对泡萝卜中还原糖含量的影响
Fig.2 Effects of different fermentation temperature on reducing sugar in radish Paocai
2.2.2 不同发酵温度对泡萝卜pH和总酸的影响
由图3-a可知,在10 ℃下,pH先增加后稳定在3.9左右,可能由于萝卜加入卤水体系中导致卤水pH增加且低温乳酸菌代谢受抑制,因而pH在7 d发酵周期内无下降趋势。在30 ℃下的pH值较稳定,是由于老卤水中存在缓冲体系,导致pH降低到3.5左右时便不会随着酸增加而降低。
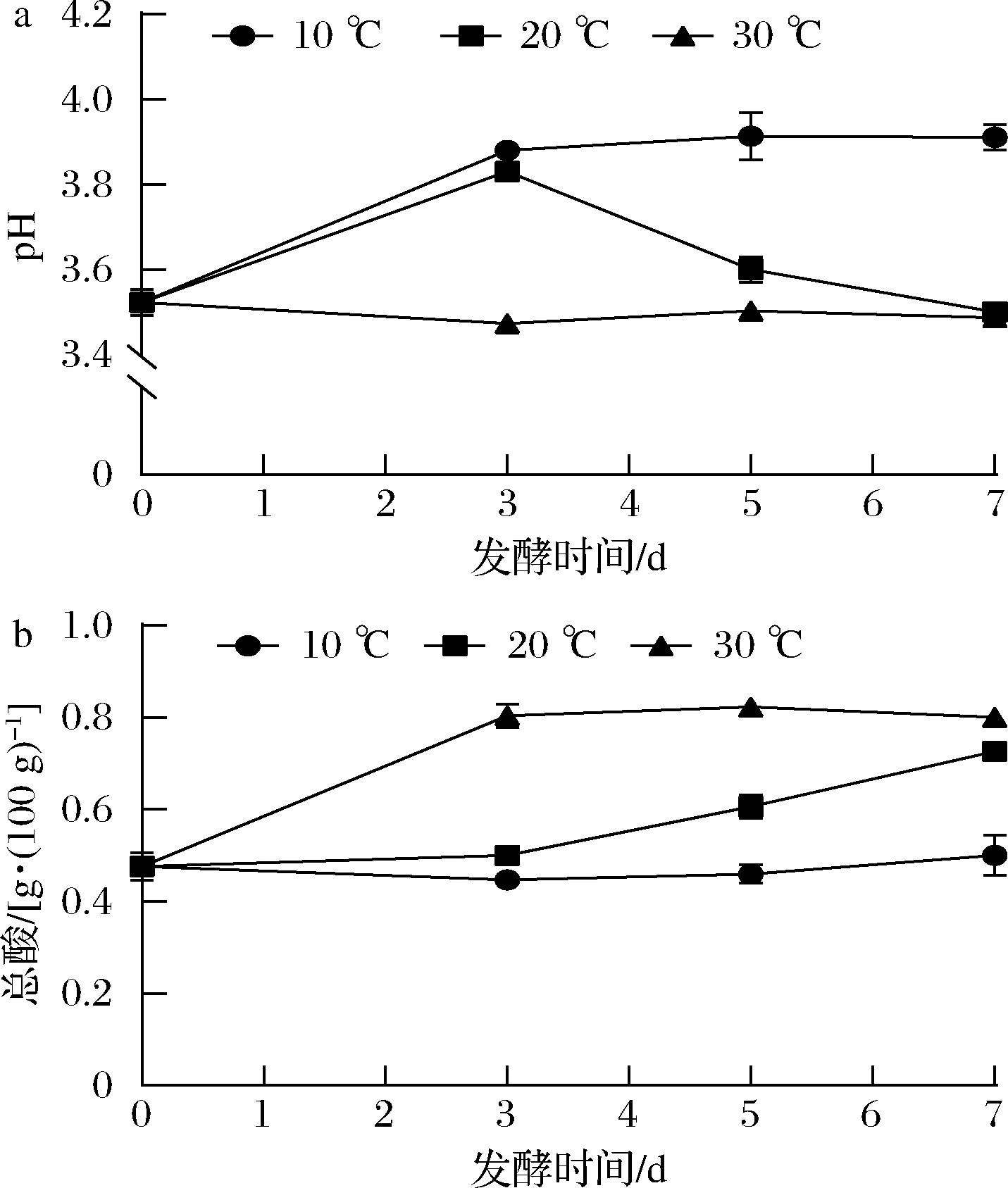
a-pH值;b-总酸
图3 不同发酵温度处理对泡萝卜pH和总酸的影响
Fig.3 Effects of different fermentation temperature on pH and total acidity content in radish Paocai
总酸是反映发酵环境中可电离和不可电离酸的总和,泡菜总酸含量在0.6~0.8 g/100 g内呈现最佳酸感[3]。由图3-b可知,不同发酵温度下,总酸随着发酵时间都呈增加趋势,是由于微生物的生长情况不同,导致乳酸菌产生的酸积累量不同。本实验中,10 ℃下泡萝卜发酵7 d后仍处于较高的pH和较低的总酸状态,故在较低温度下发酵时建议延长发酵时间。
2.3 不同发酵温度对泡萝卜挥发性物质的影响
挥发性风味物质是泡菜风味的重要组成部分,为了探究不同温度发酵对泡萝卜挥发性风味物质的影响,利用顶空固相微萃取-气相色谱质谱联用仪(headspace solid-phase microextraction and gas chromatography-mass spectrometry,HS-SPME-GC-MS)对3种温度下发酵第7天的泡萝卜的挥发成分检测,共检测到包括酯类、醇类、醚类、酸类、醛酮类等108种风味物质。以物质含量指标为X变量,不同温度处理组样本作为分类变量Y,对发酵第7天的3组样品进行正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA),该模型是一种多因变量对多自变量的回归建模方法,能够自动过滤与分组不相关的变量,结合差异性变量的重要性投影值(variable importance in projection,VIP)能够获得差异代谢物。该模型R2X为0.923、R2Y为1、Q2(cum)为0.992,置换检验结果显示R2=0.513,Q2=-1.63,表明该模型稳定可靠[16]。
由图4可知,发酵7 d,10 ℃下的化合物与20和30 ℃差异显著(图4-a和图4-b),VIP值>1的挥发性风味物质共找到47种(图4-c),这些物质可能是引起中高温组与10 ℃之间风味差异的主要差异化合物[17]。其中,酯类物质是相对含量最高的,也是泡菜的重要挥发性物质,尤其聚集在30 ℃周围,可能温度促进酸和醇类物质生成酯类物质;成熟泡菜的代表性挥发性物质如二甲基二硫、二甲基三硫、乙酸乙酯、芳樟醇、4-萜烯醇、α-松油醇等主要聚集在中高温周围[18]。通过图4-b也可知,10 ℃与中高温组的挥发性物质层次聚类相似性更低,说明温度显著影响泡萝卜的主体挥发性物质的积累。

a-biplot图;b-HCA图;c-VIP图
图4 不同发酵温度条件下的泡萝卜在发酵7 d后的挥发性物质OPLS-DA结果
Fig.4 OPLS-DA results of volatile compounds in radish Paocai at different fermentation temperature after 7 days
2.4 不同发酵温度对泡萝卜微生物数量的影响
发酵温度通过影响微生物的代谢活动进而影响泡菜的发酵进程。由图5-a可以看出,随着发酵的进行,乳酸菌数量在不同温度下都呈增加趋势,但不同温度下增长速度和规律都不同。在发酵第3天时,20和30 ℃的乳酸菌数量与10 ℃相比高出2 lg CFU/mL,说明低温会限制乳酸菌的生长。

a-乳酸菌;b-酵母
图5 不同发酵温度对泡萝卜中乳酸菌和酵母数量的影响
Fig.5 Effects of different fermentation temperature on counts of lactic acid bacteria and yeasts in radish Paocai
真菌是泡菜中的主要微生物之一,除了对泡菜的风味物质做出贡献外,研究表明其氮代谢路径也会产生EC的前体物质尿素等[19]。由图5-b可知,在不同的温度下,酵母的生长代谢规律不一样。在3 d后,10 ℃呈缓慢增长,但30 ℃快速减少,一方面可能是发酵体系中碳源耗尽,另一方面,发酵环境的酸积累特别是乙酸对酵母的生长存在较大的抑制作用。
2.5 不同发酵温度对泡萝卜菌群结构的影响
发酵温度可通过影响菌群结构进而影响产品品质。本研究采用扩增子测序技术揭示了不同温度下发酵萝卜过程中细菌、真菌类群构成,并对其门、属和种水平上的注释结果进行了分析(图6)。

a-细菌门水平;b-细菌属水平;c-细菌种水平;d-真菌门水平;e-真菌属水平;f-真菌种水平
图6 不同发酵温度对泡萝卜中菌群结构的影响
Fig.6 Effects of different fermentation temperature treatments on microbial structure in radish Paocai
细菌在门水平相对丰度99%隶属于厚壁菌门(图6-a),属水平上相对丰度>1%是乳杆菌属和片球菌属(图6-b),不同温度下细菌在种水平上随着发酵时间变化不同(图6-c)。在10 ℃下,Lactobacillus nagelii(58.12%~29.75%)随着发酵减少,而Pediococcus ethanolidurans(27.96%~48.86%)随着发酵相对丰度增加;20和30 ℃下的P.ethanolidurans与10 ℃的变化趋势相反,且不同乳杆菌的相对丰度差异较大。覃旋[20]分析酱油中EC前体物质与微生物的相关性,结果表明片球菌属与乙醇含量呈正相关性,且EC含量与乙醇含量的变化趋势一致。周万怡等[21]发现接种短乳杆菌和酿酒酵母组合发酵同单酿酒酵母发酵黄酒相比,可以减少发酵体系中68.4%的EC含量,表明乳杆菌属对EC的生成有抑制作用,这与本研究中EC在不同温度下变化规律一致。
真菌在发酵食品中发挥着重要作用,目前在泡菜发酵过程中对真菌的群落研究较少[22]。不同温度下泡萝卜在门、属和种水平上丰度较高的真菌群落分布见图6-d~图6-f。温度对真菌的菌群结构影响相对较小,其中相对丰度占比大于1%的是子囊菌门的酒香酵母属(Brettanomyces)和哈萨克斯坦酵母属(Kazachstania)。这些真菌是泡菜中主要的微生物,其存在提供了抵御环境变化的生物缓冲能力[23]。这2个属的酵母代谢均产乙醇,但在不同温度下酵母的生长情况和代谢能力不同。陈可[24]的研究表明,样品中EC的含量随着酵母的含量升高而缓慢降低。中高温组降解EC的水解酶活力高于低温组[25],降解大于生成速度,因此在20和30 ℃下EC含量随着发酵进行一直降低。这表明温度是引起群落差异和代谢速率的重要因素之一,并导致了代谢物EC的含量变化差异。
2.6 不同发酵温度下泡萝卜EC与理化指标和菌群结构的相关性
为进一步探究不同温度下EC含量与泡萝卜的理化指标和菌群种水平(相对丰度>1%)之间的相关性,对EC前体物质、微生物和理化指标与EC含量进行了Pearson相关性分析。由图7可知,EC含量与EC前体物质尿素和乙醇均呈正相关,表明尿素和乙醇是EC的重要前体物质。

图7 EC与泡萝卜品质指标含量的相关性热图
Fig.7 Correlation heat map between EC and quality indices of radish Paocai
注:*P≤0.05,**P≤0.05,***P≤0.05
但EC与乳酸菌数量、总酸呈显著负相关(P<0.01),与温度也呈负相关(P<0.05)。其中EC含量与丰度>1%的乳酸菌大多成负相关,与L.parafarraginis呈显著负相关(P<0.01),而P.ethanolidurans和L.nagelii与EC的积累呈正相关,相关系数分别为0.52和0.59,在测序结果中这2种乳酸菌在10 ℃发酵过程中相对丰度占比总和一直大于80%,说明这2种乳酸菌可能在低温发酵环境下更具有优势。其中,L.nagelii和L.parafarraginis、L.zymae和L.acetotolerans呈显著负相关(P<0.01),这3种乳酸菌在泡菜中产酸能力都较强[26],且与酵母菌和酵母数量呈显著负相关。以上结果表明温度影响泡萝卜的乳酸菌菌群结构,乳酸菌菌群结构又与EC的变化有相关性。不同发酵体系中温度对EC生成规律的影响存在差异,例如在白酒体系中EC含量随温度升高而增加,而在泡菜体系中EC含量随温度升高而降低,造成这种差异的原因是白酒体系和泡菜体系的主要发酵微生物菌群和理化环境不同[27-28]。泡菜体系中温度升高能促进乳酸菌的代谢,进而降低发酵环境的pH值,高酸环境会影响与EC生成相关的微生物代谢和一些酶类活性,因此适当升高泡菜发酵温度以加快发酵进程可有效降低EC的积累。
3 结论
本文从微生物、理化指标、挥发性物质和菌群结构方面探究了温度对泡萝卜的品质影响以及EC的生成规律,并分析了EC与理化品质指标及菌群结构之间的相关性,得出以下结论。EC的生成规律随温度变化不同,萝卜发酵3 d后,20、30、10 ℃之间有显著差异(P<0.01)。10 ℃发酵环境中,EC含量先增加再减少,发酵3 d后增加到79.64 μg/L,发酵7 d后仍高于FAO限量标准20 μg/L,而20和30 ℃在发酵3 d后已低于20 μg/L。EC前体物质尿素和乙醇在10 ℃下变化趋势一致,在发酵整体过程中都呈下降趋势,表明其消耗速率大于生成速率,推测减少的量可能转化为EC。不同温度环境下泡萝卜的发酵进程不同,随着温度增加还原糖消耗加快,pH降低和总酸积累速度加快。不同温度下泡萝卜的挥发性物质呈现了差异性,根据OPLS-DA结果,发酵7 d后,10 ℃下的泡萝卜挥发性物质与20和30 ℃有较大的差异,其中VIP值>1的有47种。成熟泡菜的代表性挥发性物质如二甲基二硫、二甲基三硫、乙酸乙酯、乙酸和芳樟醇等主要聚集在中高温组周围,表明温度显著影响主体挥发性物质的积累速度。在微生物数量方面,温度升高乳酸菌生长加快,发酵3 d后20和30 ℃下比10 ℃高2 lg CFU/mL,而对酵母生长影响相对较小;在菌群结构方面,扩增子测序结果显示,随温度增加乳杆菌属丰度增加而片球菌属丰度下降。Pearson相关性分析表明,EC含量与EC前体物质尿素和乙醇均呈正相关,表明尿素和乙醇是EC的重要前体物质,但与乳酸菌数量、总酸、温度和L.parafarraginis均呈负相关(P<0.05),而P.ethanolidurans和L.nagelii对EC的形成有一定的促进作用,相关系数分别为0.52和0.59。综上,不同温度下泡萝卜发酵进程差异较大,且发酵温度对EC的积累有较大影响,这可能与温度影响了乳酸菌生长及乳酸菌菌群结构有关,因此适当提高发酵温度有助于控制泡萝卜发酵过程中EC的含量。
[1] 陈功, 唐垚, 张其圣, 等.泡菜浅发酵与冷加工的研究及应用[J].食品与发酵科技, 2022, 58(2):1-8.
CHEN G, TANG Y, ZHANG Q S, et al.Research and application of shallow fermentation and cold processing of Paocai[J].Food and Fermentation Science &Technology, 2022, 58(2):1-8.
[2] 肖岚, 唐英明, 陈援援, 等.四川家庭自制菜与餐饮洗澡泡菜在腌制过程中的品质变化[J].食品科技, 2019, 44(1):91-97.
XIAO L, TANG Y M, CHEN Y Y, et al.Quality changes of homemade pickles and bathe pickles in the pickling process in Sichuan[J].Food Science and Technology, 2019, 44(1):91-97.
[3] 毛丙永, 殷瑞敏, 赵楠, 等.四川老卤泡菜基本理化指标及特征菌群分离鉴定[J].食品与发酵工业, 2018, 44(11):22-27.
MAO B Y, YIN R M, ZHAO N, et al.The physical and chemical properties of Sichuan old brined Paocai and the isolation of characteristic microbes[J].Food and Fermentation Industries, 2018, 44(11):22-27.
[4] 王照科, 王咏梅, 于清芹, 等.葡萄酒中氨基甲酸乙酸含量的分析[J].食品科学, 2008, 29(6):457-459.
WANG Z K, WANG Y M, YU Q Q, et al.Analysis of ethyl carbamate concentration in wine[J].Food Science, 2008, 29(6):457-459.
[5] LACHENMEIER D W.Consequences of IARC re-evaluation of alcoholic beverage consumption and ethyl carbamate on food control[J].Deutsche Lebensmittel-Rundschau, 2007, 103(7):307-311.
[6] GOWD V, SU H M, KARLOVSKY P, et al.Ethyl carbamate:An emerging food and environmental toxicant[J].Food Chemistry, 2018, 248:312-321.
[7] WEBER J V, SHARYPOV V I.Ethyl carbamate in foods and beverages:A review[J].Environmental Chemistry Letters, 2009, 7(3):233-247.
[8] 孟庆达. 微生物法减少白酒生产中氨基甲酸乙酯前体物质的研究[D].无锡:江南大学, 2017.
MENG Q D.Reduction of ethyl carbamate precursors by microbiological methods in Chinese liquor during production process[D].Wuxi:Jiangnan University, 2017.
[9] 赵楠. 四川泡菜的主要特性及其成因分析[D].无锡:江南大学, 2017.
ZHAO N.Analysis of the main characteristics of Sichuan Paocai and its formation mechanism[D].Wuxi:Jiangnan University, 2017.
[10] SHAO Y J, LIN A H M.Improvement in the quantification of reducing sugars by miniaturizing the Somogyi-Nelson assay using a microtiter plate[J].Food Chemistry, 2018, 240:898-903.
[11] 魏晓霞. 利用比色法测定葡萄酒的酒精度[J].广州化工, 2016, 44(21):114-116.
WEI X X.Determination of content of alcohol in wines by colorimetry[J].Guangzhou Chemical Industry, 2016, 44(21):114-116.
[12] 侯新磊, 赵楠, 葛黎红, 等.低温等离子体对低盐泡菜生花腐败的抑制及贮藏期品质的影响[J].食品科学, 2022,43(21):282-290.
HOU X L, ZHAO N, GE L H, et al.Effect of cold plasma treatment on the inhibition of pellicle-spoilage and the storage quality of low-salt Paocai, a traditional Chinese fermented vegetable food[J].Food Science, 2022,43(21):282-290.
[13] 孟凡徳, 史学伟.梅奇酵母氨基甲酸乙酯酶分离纯化与酶学性质分析及其对葡萄酒香气的影响[J].食品工业科技, 2022, 43(24):123-129.
MENG F D, SHI X W.Isolation, purification and characterization of ethyl earbamate degrading enzyme from Metschnikowia and its effect on wine aroma[J].Science and Technology of Food Industry, 2022, 43(24):123-129.
[14] 方若思. 传统黄酒发酵中氨基甲酸乙酯产生的代谢规律及抑制方法研究[D].杭州:浙江大学, 2017.
FANG R S.The metabolism mechanism and inhibition method of ethvl carbamate formation during traditional Chinese rice wine fermentation[D].Hangzhou:Zhejiang University, 2017.
[15] XIAO C, LU Z M, ZHANG X J, et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature daqu[J].Applied and Environmental Microbiology, 2017, 83(23):e01550-e01517.
[16] 李亚南, 崔传坚, 陈江琳, 等.基于挥发性风味物质的花椒产地溯源技术研究[J].食品工业科技, 2022, 43(2):293-303.
LI Y N, CUI C J, CHEN J L, et al.Tracing the geographical origin of Zanthoxylum bungeanum by volatile compounds[J].Science and Technology of Food Industry, 2022, 43(2):293-303.
[17] 斯波. 微生物发酵形成食品风味的研究[J].中国调味品, 2013, 38(2):4-5.
SI B.Research on formation of food flavor by microbial fermentation[J].China Condiment, 2013, 38(2):4-5.
[18] ZHAO N, ZHANG C C, YANG Q, et al.Multiple roles of lactic acid bacteria microflora in the formation of marker flavour compounds in traditional Chinese Paocai[J].RSC Advances, 2016, 6(92):89 671-89 678.
[19] ZHOU W Y, HU J J, ZHANG X L, et al.Application of bamboo leaves extract to Chinese yellow rice wine brewing for ethyl carbamate regulation and its mitigation mechanism[J].Food Chemistry, 2020, 319:126554.
[20] 覃旋. 酱油中氨基甲酸乙酯前体物质与微生物相关性研究[D].广州:仲恺农业工程学院, 2019.
QIN X.Study on the relationship between ethyl carbamate precursors and microorganisms in soy sauce[D].Guangzhou:Zhongkai University of Agriculture and Engineering, 2019.
[21] 周万怡, 舒琴, 张兴林, 等.短乳杆菌和酿酒酵母组合发酵方式应用于黄酒酿造调控氨基甲酸乙酯的形成研究[C].第十五届益生菌与健康国际研讨会摘要集.南京:中国食品科学技术学会, 2020:140-141.
ZHOU W Y, SHU Q, ZHANG X L, et al.Study on the application of combined fermentation of Lactobacillus brevis and Saccharomyces cerevisiae in rice wine brewing to regulate the formation of ethyl carbamate[C].Abstracts of the 15th International Symposium on probiotics and health.Nanjing:Chinese Institute of Food Science and Technology, 2020:140-141.
[22] VENTURINI COPETTI M.Yeasts and molds in fermented food production:An ancient bioprocess[J].Current Opinion in Food Science, 2019, 25:57-61.
[23] LOUCA S, POLZ M F, MAZEL F, et al.Function and functional redundancy in microbial systems[J].Nature Ecology &Evolution, 2018, 2(6):936-943.
[24] 陈可. 酱油中氨基甲酸乙酯的定量分析与形成条件初探[D].无锡:江南大学, 2012.
CHEN K.Qantification and accumulation conditions of ethyl carbamate in soy sauce[D].Wuxi:Jiangnan University, 2012.
[25] 王伟高, 陈坚, 周景文.赖氨酸芽孢杆菌产氨基甲酸乙酯水解酶的发酵条件优化[J].食品与生物技术学报, 2017, 36(3):259-265.
WANG W G, CHEN J, ZHOU J W.Optimization of the fermentation conditions for producing urethanase by Lysinibacillus fusiformis[J].Journal of Food Science and Biotechnology, 2017, 36(3):259-265.
[26] 曹佳璐. 传统四川泡菜盐水乳酸菌多样性的研究[D].北京:中国农业大学, 2017.
CAO J L.Diversity of lactic acid bacteria in brine of traditional Sichuan Paocai[D].Beijing:China Agricultural University, 2017.
[27] 田夏琼, 江华明, 关统伟, 等.浓香型白酒发酵过程中氨基甲酸乙酯形成的关联因子探究[J].中国酿造, 2022, 41(1):59-63.
TIAN X Q, JIANG H M, GUAN T W, et al.Correlation factors of ethyl carbamate formation during the fermentation of strong-flavor Baijiu[J].China Brewing, 2022, 41(1):59-63.
[28] 杨晓婷, 陆筑凤, 赵可及, 等.不同酿造条件对黄酒中精氨酸代谢的影响研究[J].酿酒科技, 2019(10):41-45.
YANG X T, LU Z F, ZHAO K J, et al.Effects of different fermenting conditions on arginine metabolism in Huangjiu[J].Liquor-Making Science &Technology, 2019(10):41-45.