我国是最大的稻米生产国,据国家统计局统计,2021年我国水稻总产量达2.128亿t。米糠是稻谷经脱壳处理,所得糙米再经精制后的副产物,约占稻谷的12%,其资源十分丰富,但利用率极低,主要用作动物饲料等,造成了资源浪费[1]。海水稻是一种生长于海边滩涂的耐盐碱水稻,生长环境害虫少,无需施用农药,食用更安全,有很高的营养价值;其米糠较精米和谷壳含有更多的营养成分,包括蛋白质、多糖、米糠油等重要成分[2-4],在医药、食品、保健等方面具有巨大的开发利用价值[5]。研究表明红米糠中所含的膳食纤维、微量元素和必需氨基酸等营养物质含量远高于优质白米糠[6-7]。此外,海红米糠(sea red rice bran, SRRB)更是比普通米糠含有更丰富的黄酮、γ-氨基丁酸等活性物质,因而具有抗炎、调控肠道微生物组成、改善抑郁症等功能特性[8]。探究SRRB的高值转化利用技术将有助于我国特种稻米及其加工产品的开发和利用,发挥我国稻米大国的天然优势。
微生物发酵通常可以降低原料的抗营养因子含量,还能产生有益的小分子物质,从而改善原料的营养组成及其品质特性,可提高发酵原料的利用价值[9]。近年来利用微生物发酵对大宗粮食副产物进行开发利用的技术应用日益广泛,其中利用乳酸菌发酵米糠的研究相对较少,主要集中在对米糠膳食纤维的改性研究[10]。近年来有不少研究报道了乳酸菌发酵对米糠或者脱脂米糠的影响,如李银霞[11]发现乳酸菌发酵可改善糜子米糠可溶性膳食纤维的结构、理化和功能特性;刘磊等[12]发现不同乳酸菌发酵对脱脂米糠中的糖和酚类物质影响差异显著,其中嗜酸乳杆菌降糖能力最强,发酵72 h 时,米糠中总糖和还原糖分别下降了 31.33%和 60.76%,不溶性酚类物质下降了 20.32%,嗜酸乳杆菌发酵脱脂米糠 24 h 时,可溶性酚类物质含量最高,提高了33.00%;张慧娟等[13]发现乳酸菌和酵母菌联合发酵显著改善了脱脂米糠膳食纤维的组成,显著提高了其中的总酚和总黄酮的含量,其对牛磺胆酸钠的吸附能力也得到显著增强,比未处理组提高了4.27倍。SRRB具有较多的活性物质,但以SRRB为研究对象,研究通过乳酸菌发酵对其基本成分和理化特性的影响仍未有报道。
因此,本研究以SRRB为原料,通过半干酶解SRRB来为乳酸菌发酵提供生长所需营养物质,对发酵前后SRRB的营养成分、结构及其功能特性进行比较分析,旨在为开发SRRB发酵产品、提高海红米的开发和产品附加值、充分利用我国特色稻全谷物价值提供技术指导。
1 材料与方法
1.1 材料与试剂
SRRB来自广东海洋大学农学院。嗜热链球菌、乳酸菌C111459,云南农业大学保藏;α-高温淀粉酶(20 000 U/g),北京索莱宝科技有限公司;MRS培养基,北京陆桥生物有限责任公司;胆固醇标品,色谱级,麦克林公司;NaNO2、对氨基苯磺酸、盐酸萘乙二胺、邻苯二甲醛、PBS、盐酸、NaCl、酚酞、NaOH、KBr、3,5二硝基水杨酸,均为国产分析纯级。
1.2 仪器与设备
SW CJ 1FD超净工作台、YXQ-50S11立式蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;TENSOR-27傅里叶红外光谱仪,德国Bruker公司;LRH-150生化培养箱,上海一恒科学仪器有限公司;Varioskan Flash多功能酶标仪、Lynx6000高速落地离心机,赛默飞世尔科技有限公司;JOYN-SXT-06B脂肪测定仪,上海乔跃电子科技有限公司;VAPODEST 450全自动凯氏定氮仪,德国格哈特分析仪器公司;FD8508真空冷冻干燥机,韩国ilShin公司;JSM-7610F热场发射扫描电镜,日本电子株式会社;N-1300V-W旋转蒸发仪,东京理化器械(株)独资工厂;STA449F3同步热分析仪,德国NETZSCH公司;PHS-3E 型pH计,上海雷磁仪器厂;HH-8数显恒温水浴锅,常州国华电器有限公司。
1.3 实验方法
1.3.1 半干法酶解SRRB工艺
参考刘磊等[12]的方法并略作修改,先制备半干法酶解SRRB,称取20 g已过60目筛的稳定化SRRB与高温α-淀粉酶悬浮液(酶活力为30 000 U),按料液比1∶1.5(g∶mL)混匀,分装于锥形瓶中,密封,沸水浴30 min后,121 ℃灭菌15 min,冷却即为半干法酶解SRRB。
1.3.2 发酵海红米糠(fermented sea red rice bran, FSRRB)的制备
参考刘磊等[12]的方法略作修改,以多糖含量为指标,根据预实验结果,最终选择嗜热链球菌、乳酸菌C111459作为复配菌种,将保存菌株活化后接种入制备好的半干法酶解SRRB中,2种复配菌菌种比例为1∶1,接种量为1%,37 ℃恒温发酵72 h。发酵结束后,121 ℃灭菌15 min,干燥,即为FSRRB。
1.3.3 乳酸菌发酵前后SRRB的基本成分变化
蛋白质、脂肪、灰分、水分、碳水化合物的测定分别依照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》、GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》、GB/T 5009.4—2016《食品安全国家标准 食品中灰分的测定》、GB 5009.3—2016《食品安全国家标准 食品中水分的测定》、GB 28050—2011《食品安全国家标准 预包装食品营养标签通则》进行。
1.3.4 乳酸菌发酵前后SRRB膳食纤维含量变化
膳食纤维、可溶性膳食纤维、不可溶性膳食纤维的测定依照GB 5009.88—2014《食品安全国家标准 食品中膳食纤维的测定》进行。
1.3.5 乳酸菌发酵前后SRRB的结构特性研究
1.3.5.1 扫描电子显微镜观察
取少量样品固定在导电胶上,洗耳球轻吹样品表面,使用离子溅射镀膜仪进行喷金处理,加速电压9.0 kV,放大倍数为400倍和1 000倍。
1.3.5.2 傅里叶变换红外光谱
将样品与KBr混合研磨后压片,在4 000~400 cm-1,用傅里叶红外光谱仪进行扫描。
1.3.5.3 热稳定性分析
采用示差扫描热量仪,以5 ℃/min 升温速率升温,温度30~500 ℃,对SRRB发酵前后热稳定性进行测定。
1.3.6 乳酸菌发酵SRRB的物化特性研究
1.3.6.1 持水力测定
参照LU等[14]的方法,略作修改,称取0.2 g样品溶解在2 mL蒸馏水中,37 ℃浸泡12 h, 8 000 r/min离心15 min后,弃去上清液,测定沉淀质量即为湿重m湿,恒重后,测干重m干。按公式(1)计算持水力:
持水力/(g/g)=(m湿-m干)/m干
(1)
1.3.6.2 持油力测定
参照王文欣[15]的方法,略作修改,称取0.2 g样品溶解在2 mL花生油中,玻棒混匀,37 ℃浸泡12 h,经8 000 r/min,15 min离心后,弃去上清液,测定吸油后样品的湿重m湿,倾倒上清液,并用滤纸吸附残余的油,测定干重m干。按公式(2)计算持油力:
持油力/(g/g)=(m湿-m干)/m干
(2)
1.3.6.3 溶解性分析
参考JIA等[16]的方法并加以修改,取0.05 g样品溶解在5 mL蒸馏水中,90 ℃水浴30 min,水浴过程中玻棒混匀,8 000 r/min离心15 min。按公式(3)计算溶解性:
溶解性/(g/g)=m上清液/m总
(3)
式中:m上清液,样品溶解后离心所得上清液干燥后的质量,g;m总,样品总质量,即0.05 g。
1.3.6.4 膨胀力测定
参照汪文君等[17]的方法稍作修改,将0.5 g的样品与15 mL蒸馏水混合,置于刻度试管中,摇匀放置24 h。读取样品吸水前后的体积分别记为V1、V2。膨胀力按公式(4)计算:
膨胀力/(mL/g)=(V2-V1)/0.5
(4)
1.3.7 乳酸菌发酵SRRB的亚硝酸盐和胆固醇吸附能力研究
1.3.7.1 亚硝酸盐吸附力(nitrite ion adsorption capacity, NIAC)的测定
参考李伟伟等[18]的方法稍作修改,在538 nm处测吸光值,以NO2-含量为横坐标,吸光度值为纵坐标做标准曲线。标准曲线方程y=0.007 x+0.006,R′=0.998。
分别取0.2 g SRRB及FSRRB于100 mL锥形瓶中,加入已用PBS调节体系pH值至2.0(模拟胃环境)和7.0(模拟肠道环境)的NaNO2 溶液(100 mol/L)40 mL,于37 ℃恒温反应30 min后,过滤,各取2 mL滤液,添加2 mL质量分数为0.4%的对氨基苯磺酸溶液,摇匀并静放5 min,再添加1 mL 0.2%质量分数的盐酸萘乙二胺溶液,混匀静置15 min,538 nm处测定其吸光值,并基于标准曲线进行定量。NIAC按公式(5)计算:
NIAC/(μmol/g)=(n1-n2)/m0
(5)
式中:n1,吸附前溶液中亚硝酸盐的含量,μmol;n2,吸附后溶液中亚硝酸盐的含量,μmol;m0,样品的质量,g。
1.3.7.2 胆固醇吸附力(cholesterol adsorption capacity, CAC)的测定
胆固醇标准曲线的绘制:以胆固醇为标准品,采用邻苯二甲醛法测定标准曲线,标准曲线方程y=0.007 1 x-0.287,R′=0.993 4。
根据龙小梅[19]的方法并稍以修改。取新鲜鸡蛋黄,以V(蛋黄)∶V(蒸馏水)=1∶9比例加入蒸馏水,搅打至乳液状,称取0.5 g样品,加入稀释蛋黄液12.5 g,混匀,调节体系pH值至2.0(模拟胃环境)和7.0(模拟肠道环境),37 ℃、150 r/min混合2 h,5 000 r/min离心20 min,取上清液,在550 nm处测定吸光度,计算样品的胆固醇吸附能力。CAC 计算如公式(6)所示:
CAC/(mg/g)=(n3-n4)/m0
(6)
式中:n4,吸附前溶液中胆固醇的质量,mg;n3,吸附后溶液中胆固醇的质量,mg;m0,样品的质量,g。
1.3.8 数据统计分析
所有试验重复3次,试验结果以平均值±标准差来表示。图形及数据采用Origin 2021及SPSS 26软件进行数据处理和分析,采用单因素方差分析法检验,显著性水平为P<0.05。
2 结果与分析
2.1 乳酸菌发酵前后SRRB的基本成分变化
比较发酵前后SRRB基本成分含量(表1)可知,SRRB经乳酸菌固态发酵后脂肪含量显著减少,灰分含量显著增加,碳水化合物及蛋白质含量有所增加,这与刘磊等[12]研究趋势相同,即乳酸菌发酵过程中消耗了SRRB中的脂肪等营养物质。
表1 SRRB发酵前后基本成分含量变化
Table 1 Basic constituents of SRRB and FSRRB

基本成分/%蛋白质脂肪碳水化合物灰分水分SRRB11.00a14.04a57.19a8.40a9.31aFSRRB11.77a8.41b58.59a11.92b9.31a
注:同列不同小写字母表示差异显著(P<0.05)(下同)。
2.2 乳酸菌发酵前后SRRB的膳食纤维含量变化
比较发酵前后SRRB膳食纤维含量(表2)可知,乳酸菌固态发酵72 h后可以显著提高SRRB膳食纤维及不可溶性膳食纤维的含量,这与利用乳酸菌发酵米糠的其他研究结果相一致[11-13],也解释了表1结果中灰分含量显著增加的原因,可溶性膳食纤维含量显著下降的原因可能是随着发酵时间的增加,部分可溶性膳食纤维被乳酸菌所利用。
表2 SRRB发酵前后膳食纤维含量变化 单位:g/100 g
Table 2 Content of dietary fiber in SRRB and FSRRB

基本成分膳食纤维可溶性膳食纤维不可溶性膳食纤维SRRB31.2a2.3a28.9aFSRRB43.0b1.1b41.9b
表1与表2表明乳酸菌发酵能够改变SRRB的营养组成并使其中的膳食纤维含量得到显著提高。
2.3 乳酸菌发酵前后SRRB的结构变化
2.3.1 乳酸菌发酵前后SRRB微观结构
由图1可知,FSRRB空间结构松散,且与SRRB相比,FSRRB的颗粒更小,比表面积也有所增加。松散的结构有利于样品的水化和吸附性能。这与王旭等[20]的研究结果一致。

a-SRRB(400倍);b-FSRRB(400倍);c-SRRB(2 000倍);d-FSRRB(2 000倍) 图1 发酵前后SRRB的扫描电子显微镜图
Fig.1 Scanning electron microscope images of SRRB and FSRRB
2.3.2 傅里叶变换红外光谱
图2为发酵前后SRRB的红外光谱图。3 365 cm-1 附近强而宽的峰由纤维素和半纤维素的O—H伸缩振动形成;在3 011和2 851 cm-1附近的吸收峰归属于—CH2的反对称伸缩振动和对称伸缩振动吸收峰;在1 711 cm-1附近峰为脂类曲振动和蛋白质酰胺I带的贡献;在1 526~1 160 cm-1是多糖和蛋白质的混合振动吸收区;1 056 cm-1附近的吸收峰主要是来自木质素或半纤维素的醚键,此峰变平,可能是发酵后多糖降解所致[11]。根据红外变换光谱,乳酸菌发酵SRRB中的多糖发生降解,得到利用。

图2 样品的傅里叶变换红外光谱图
Fig.2 Fourier transform infrared spectra of samples
2.3.3 热稳定性分析
由图3可知,样品第一阶段的降解温度范围为30~210 ℃,这主要是由于样品中自由水和结晶水的蒸发所致。SRRB的第一次挥发温度为162 ℃左右,FSRRB的第一次挥发温度为149 ℃左右。发酵处理后,FSRRB的水分挥发温度降低,这可能是由于发酵后SRRB的结构变得更为松散,从而水分易于挥发。第二阶段的降解温度范围为210~400 ℃,发酵前后样品均出现在290 ℃左右,这一阶段的降解与多糖的降解有关。第三阶段的降解温度范围为400~500 ℃,此阶段为生物炭化过程。此外,FSRRB在热降解过程的失重比SRRB更少。结果表明乳酸菌固态发酵没有改变SRRB主要成分的降解过程,有较好的热稳定性。
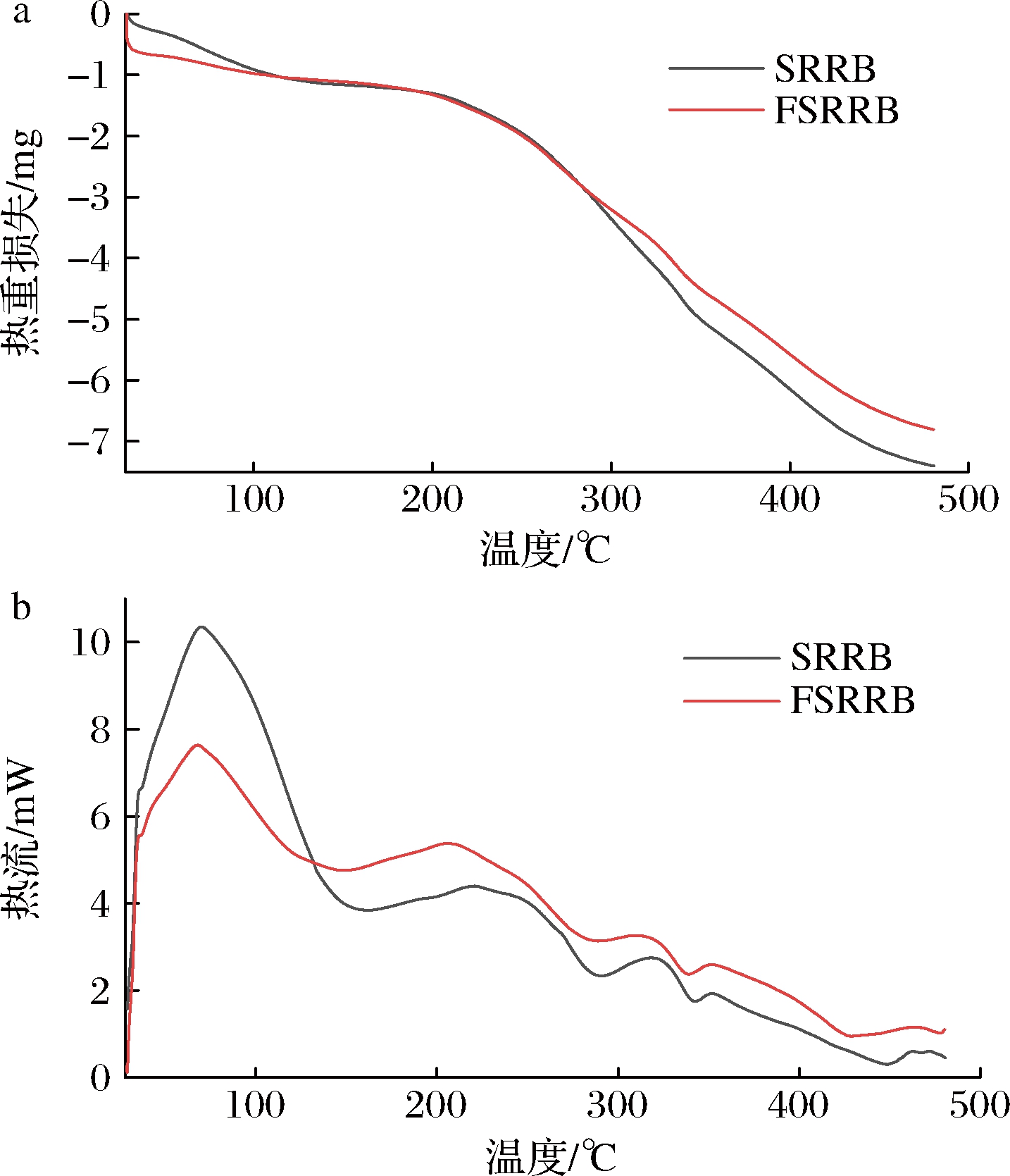
a-发酵前后样品的TGA曲线;b-发酵前后样品的DSC曲线
图3 发酵前后SRRB的热稳定性
Fig.3 Thermo-stability of SRRB and FSRRB
2.4 乳酸菌发酵前后SRRB的物化特性变化
由于物化特性可能会直接影响产品的生理功能特性,因此通过研究乳酸菌发酵对SRRB物化特性的影响是对发酵SRRB产品特性的重要评价方式之一。发酵前后样品的物化特性见表3。
表3 发酵前后SRRB物化特性
Table 3 Physical and chemical properties of SRRB and FSRRB

物化特性持水性/(g/g)持油性/(g/g)溶解性/(g/g)膨胀力/(mL/g)SRRB4.22±0.33a0.13±0.02a0.19±0.03a2.40±0.40aFSRRB4.51±0.27b0.05±0.01b0.28±0.10b2.27±0.23b
由表3可知,SRRB发酵后溶解性及持水性得到显著提升,持油性及膨胀力显著降低。相比起SRRB,FSRRB持油性下降,可能是因为SRRB经发酵后,其纤维结构被破坏,大分子物质长链断裂,因此对油脂吸附能力下降。FSRRB溶解性及持水性得到提升,这可能是由于乳酸菌发酵后,破坏了纤维素和半纤维素的分子间氢键等,将膳食纤维和蛋白质等大分子物质分解为小分子物质;同时,由微观结构结果可知,发酵可以增加SRRB的比表面积,形成松散中空的结构,从而使更多的极性基团出现,与水形成更多的氢键或偶极子。此外,暴露在极性基团下的比表面积也更大[11]。结果表明,乳酸菌发酵可增强SRRB的持水性和溶解性。
2.5 乳酸菌发酵前后SRRB的吸附性变化
2.5.1 亚硝酸盐吸附能力
NO2-能与仲胺、叔胺等物质反应,形成亚硝胺类,而亚硝胺是一种强的致癌物质,对人体有害,因此,NO2-清除能力的研究对人体健康有十分重要的意义。由图4可知, pH对发酵前后SRRB的亚硝酸盐吸附能力有较大影响,每个样品在pH值为2.0(胃环境)时的亚硝酸盐吸附能力均高于pH值为7.0(小肠环境)时,这与其他研究结果有相似之处[11,17]。发酵前后SRRB对亚硝酸盐的吸附量较强,可达1 163.10和1 065.48 μmol/g(pH 2.0),926.79和660.12 μmol/g (pH 7.0),而李银霞[11]利用乳酸菌发酵制备糜子膳食纤维,发酵前后其膳食纤维的 NIAC 值仅分别为228.7和232.6 μg/g (pH 2.0),227.4和230.0 μg/g (pH 7.0)。SRRB经发酵后NaNO2吸附能力降低,可能是因为乳酸菌发酵过程更长,消耗了NaNO2吸附能力较强的可溶性膳食纤维,这与表2结果相符。

图4 乳酸菌发酵对SRRB亚硝酸盐的吸附能力的影响
Fig.4 Effect of lactic acid bacteria fermentation on the nitrite adsorption capacity of SRRB
2.5.2 胆固醇吸附能力
高胆固醇摄入可使血清胆固醇水平升高,与动脉粥样硬化、高血压等心血管疾病的发病密切相关。由图5可知,SRRB经乳酸菌发酵后其对胆固醇的吸收能力得到显著增加,且在pH 2.0时增强更多。当pH值为2.0时,FSRRB对胆固醇的吸附能力为0.22 mg/g,是SRRB的7.3倍;当pH 值为7.0时,FSRRB对胆固醇的吸附能力为0.20 mg/g,是SRRB的2倍。这可能是因为强酸性环境下,样品结构发生变化,此结果与其他研究有一致之处[18-21],且SRRB经发酵后在酸性条件下对胆固醇吸附能力有极大的提升。故乳酸菌发酵SRRB可以增加其对胆固醇的吸收,使其有潜力成为食品工业中降低胆固醇的功能成分。

图5 乳酸菌发酵对SRRB胆固醇的吸附能力的影响
Fig.5 Effect of lactic acid bacteria fermentation on the cholesterol adsorption capacity of SRRB
3 结论
基于我国广东湛江等地区海红米资源丰富,但产品开发和利用率有限,产品附加值低等现状,本研究以SRRB为原料,利用复合乳酸菌对其进行发酵,研究了其发酵前后颗粒结构及功能特性变化。研究结果表明,乳酸菌固态发酵能使SRRB中的纤维素和木质素发生部分降解,增加其蛋白质含量,改变其营养组成,使颗粒表面结构被破坏,疏松多孔,比表面积增大,同时有更多的亲水活性集团暴露出来,从而使持水性和溶解性显著增加,且经发酵的SRRB胆固醇吸附能力显著提升。因此,乳酸菌固态发酵可改善SRRB的结构及功能特性,从而提高对海红米这一我国特种稻的综合利用,带来更多的经济效益和生态效益。
[1] SPAGGIARI M, DALL’ASTA C, GALAVERNA G, et al.Rice bran by-product:From valorization strategies to nutritional perspectives[J].Foods (Basel, Switzerland), 2021, 10(1):85.
[2] WANG G, JIA X J, SONG B B, et al.Extraction optimization, UHPLC-triple-TOF-MS/MS analysis and antioxidant activity of ceramides from sea red rice bran[J].Foods (Basel, Switzerland), 2022, 11(10):1399.
[3] HENDERSON A J, OLLILA C A, KUMAR A, et al.Chemopreventive properties of dietary rice bran:Current status and future prospects[J].Advances in Nutrition, 2012, 3(5):643-653.
[4] 段智红, 黄永梅, 吕应年, 等.2, 4-二硝基氟苯柱前衍生HPLC-UV法测定海稻米中的γ-氨基丁酸含量[J].食品工业科技, 2019, 40(2):257-261;270.
DUAN Z H, HUANG Y M, LYU Y N, et al.Determination of γ-aminobutyric acid in sea rice by HPLC-UV method with 2, 4-dinitrofluorobenzene pre-column derivatization[J].Science and Technology of Food Industry, 2019, 40(2):257-261;270.
[5] 覃发玠, 赖开平.米糠的功能组分及其在化妆品中的应用[J].中国油脂, 2020, 45(1):111-114.
QIN F J, LAI K P.Functional components of rice bran and its application in cosmetics[J].China Oils and Fats, 2020, 45(1):111-114.
[6] RAMOS DA SILVA L, VELASCO J I, FAKHOURI F M.Bioactive films based on starch from white, red, and black rice to food application[J].Polymers, 2022, 14(4):835.
[7] 常乐. 中日大米及米糠类产品的开发利用进展[J].粮食与油脂,2021,34(10):12-14.
CHANG L.Development and utilization of rice and rice bran products in China &Japan[J].Cereals &Oils, 2021, 34(10):12-14.
[8] 李晓红, Rabia Parveen, 杨志友, 等.海红米米糠对慢性应激诱导小鼠抑郁样行为和异常肠道微生物及神经递质的改善作用[J].中国粮油学报, 2022, 37(3):25-30.
LI X H, PARVEEN R, YANG Z Y, et al.Sea red rice bran improved depression-like behavior, abnormal gut microbes and monoamine neurotransmitters induced by chronic unpredictable mild stress[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(3):25-30.
[9] HUANG J Q, DAI Y M, HUANG T, et al.Comparison of nutritional value, bioactivity, and volatile compounds of soybean meal-corn bran mixed substrates fermented by different microorganisms[J].Letters in Applied Microbiology, 2023, 76(2):ovad012.
[10] ARDIANSYAH. A short review:Bioactivity of fermented rice bran[J].Journal of Oleo Science, 2021, 70(11):1 565-1 574.
[11] 李银霞. 乳酸菌发酵对糜子米糠膳食纤维理化和功能性质的影响及其在糜子粉复配蛋糕中的应用[D].杨凌:西北农林科技大学, 2022.
LI Y X.Effects of lactic acid bacteria fermentation on the physicochemical and functional properties of prosomillet bran dietary fiber and its application in brosomillet flour mixed cake[D].Yangling:Northwest A &F University, 2022.
[12] 刘磊, 冉玉兵, 张名位, 等.乳酸菌发酵对脱脂米糠营养成分的影响[J].中国食品学报, 2020, 20(1):118-126.
LIU L, RAN Y B, ZHANG M W, et al.Effect of lactic acid bacteria fermentation on nutritional component of defatted rice bran[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(1):118-126.
[13] 张慧娟, 冯雪佳, 曹欣然, 等.生物改性对脱脂米糠营养特性及功能特性的影响[J].中国油脂, 2021, 46(5):109-116.
ZHANG H J, FENG X J, CAO X R, et al.Effects of biological modification on nutritional and functional properties of defatted rice bran[J].China Oils and Fats, 2021, 46(5):109-116.
[14] LU Y F, KOKJE T, SCHUTYSER M A I, et al.The effect of colloid milling on the microstructure and functional properties of asparagus dietary fibre concentrates[J].LWT, 2022, 169:114013.
[15] 王文欣. 双孢菇可溶性膳食纤维的提取及其在曲奇中的应用[D].上海:上海应用技术大学, 2018.
WANG W X.Extraction of soluble dietary fiber from Agaricus bisporus and its application in cookies[D].Shanghai:Shanghai Institute of Technology, 2018.
[16] JIA M Y, CHEN J J, LIU X Z, et al.Structural characteristics and functional properties of soluble dietary fiber from defatted rice bran obtained through Trichoderma viride fermentation[J].Food Hydrocolloids, 2019, 94:468-474.
[17] 汪文君, 周宁, 韩东晶, 等.改性对柿子渣不溶性膳食纤维的理化特性和结构的影响[J].食品与发酵工业,2023,49(6):221-226
WANG W J, ZHOU N, HAN D J, et al.Effects of modification on physicochemical properties and structure of insoluble dietary fiber from persimmon pomace[J].Food and Fermentation Industries, 2023,49(6):221-226.
[18] 李伟伟, 曲俊雅, 周才琼.真菌及乳酸菌联合发酵对豆渣膳食纤维及理化特性的影响[J].食品与发酵工业, 2018, 44(11):159-166.
LI W W, QU J Y, ZHOU C Q.Effects of combined fermentation of fungi and lactic acid bacteria on dietary fiber and physicochemical properties of soybean dregs[J].Food and Fermentation Industries, 2018, 44(11):159-166.
[19] 龙小梅. 豆渣中可溶性膳食纤维的制备、结构表征及功能特性研究[D].雅安:四川农业大学, 2020.
LONG X M.Study on preparation, structural characterization and functional properties of soluble dietary fiber from okara[D].Ya’an:Sichuan Agricultural University, 2020.
[20] 王旭, 梁栋, 徐杨, 等.挤压膨化辅助提取米糠可溶性膳食纤维及其特性研究[J].中国粮油学报, 2017, 32(9):153-159.
WANG X, LIANG D, XU Y, et al.Extrusion-assisted extraction process of rice bran soluble dietary fiber and its properties[J].Journal of the Chinese Cereals and Oils Association, 2017, 32(9):153-159.
[21] 杨多, 王安, 陆兆新, 等.纳豆芽胞杆菌发酵对小米糠膳食纤维结构和理化特性的影响[J].南京农业大学学报, 2023, 46(1):179-188.
YANG D, WANG A, LU Z X, et al.Effects of Bacillus natto fermentation on the structure and physicochemical properties of millet bran dietary fiber[J].Journal of Nanjing Agricultural University, 2023, 46(1):179-188.