管道、设备、包装等表面致病菌残留所造成的食品污染是导致食源性疾病和经济损失的重要原因之一[1-3]。抗生素等一系列药物被用来对抗微生物感染,然而随着其广泛使用,细菌的耐药水平逐渐提高,耐药谱不断扩大,甚至出现超级细菌,对人类健康构成威胁[4-5],因此亟需研究和开发新型抗菌材料和技术。
抗菌肽因其生物安全性、可降解性以及裂解病原体细胞膜的能力而具有成为下一代抗生素的潜力,广泛受到研究者的关注。乳酸链球菌素(nisin)是目前唯一被世界卫生组织(World Health Organization,WHO)认可可用于食品保鲜的抗菌肽[6-7],其抑菌机制有2个方面,一是对细胞膜的穿孔和破坏,二是与糖脂合成酶上的巯基反应抑制其活性,阻止细胞壁的合成,从而导致微生物的死亡,是一种安全高效的抗菌剂[8]。
壳聚糖是自然界中存在的一种碱性多糖,来源丰富且安全无毒,其独特的分子结构易于化学改性,也有很好的生物相容性。一些研究表明,壳聚糖具有优良的成膜性能,能作为其他材料的基材制备复合材料。将其与抗菌剂进行复配后可以得到具有抗菌能力的膜材[9-11],这类具有抗菌效果的复合材料因其突出的物理性质、机械性能和抗菌效果,有着非常大的应用潜力[12-15]。
京尼平是从栀子果实中提炼出来的桅子苷经β-葡萄糖苷酶水解后的产物,是一种天然生物交联剂。相较于传统化学交联剂如戊二醛等,京尼平具有生物相容性好、交联能力强和细胞毒性低等优点。本文以壳聚糖为成膜基料,nisin为抗菌剂,通过京尼平将二者交联制备复合抗菌膜,并对该复合抗菌膜的物理性质、机械性能和抗菌能力进行表征,以期为该复合抗菌膜在相关领域的应用提供依据。
1 材料与方法
1.1 实验试剂和材料
金黄色葡萄球菌ATCC6538,中国北京通用微生物培养物保藏中心;京尼平(纯度≥98%)和nisin(≥1 000 IU/mg),中国上海阿拉丁生物科技股份有限公司;脱乙酰度为95%的壳聚糖(chitosan,CS,Mw=200 kDa),中国上海麦克林有限公司。酵母提取物、胰蛋白胨和氯化钠,中国北京索莱宝科技有限公司。所有其他化学试剂(AR级)均购自中国上海国药控股化学试剂有限公司。
1.2 实验方法
1.2.1 复合抗菌膜的制备
精确称取8 g壳聚糖溶解于388 g无菌超纯水中,边搅拌边慢慢滴加4 g乙酸。室温下搅拌6 h,待完全溶解后静置脱除气泡,得到2%(质量分数)壳聚糖溶液。准确称量0.5 g京尼平,溶解于9.5 g,1%(体积分数)乙酸溶液中,形成0.5%(质量分数)京尼平溶液。将2%的壳聚糖溶液、0.5%的京尼平溶液、nisin和增塑剂甘油[m(甘油)∶m(干物质)=1∶5]按照表1分别混合于6只烧杯中,过滤以除尘除菌,磁力搅拌0.5 h使得各组分均匀混合,用真空干燥箱除去气泡后取20 mL的膜液均匀展开到有机玻璃板上,面积为80 cm2,置于50 ℃真空干燥箱中干燥整晚成膜。冷却后揭膜,将抗菌膜保存在含有硅胶的干燥器内。
表1 抗菌膜的组成
Table 1 Composition of antimicrobial films
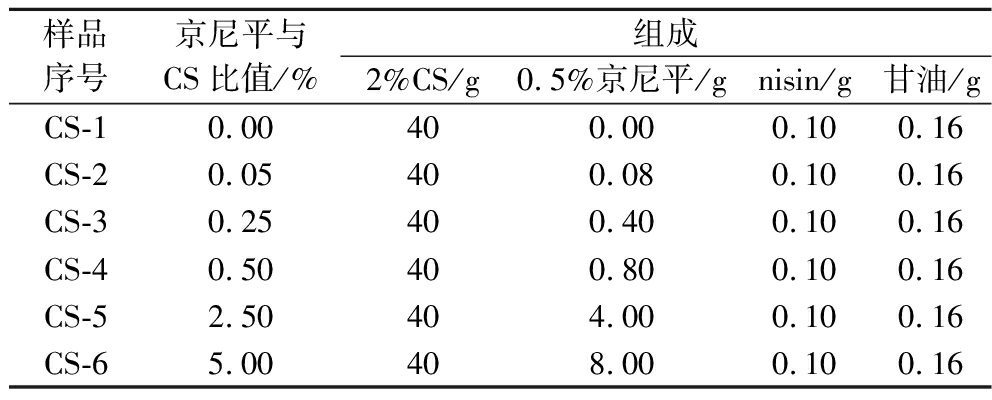
样品序号京尼平与CS比值/%组成2%CS/g0.5%京尼平/gnisin/g甘油/gCS-10.00400.000.100.16CS-20.05400.080.100.16CS-30.25400.400.100.16CS-40.50400.800.100.16CS-52.50404.000.100.16CS-65.00408.000.100.16
1.2.2 傅里叶红外光谱测定
使用傅里叶变换红外光谱仪的全反射模式测定得到抗菌膜的红外光谱图,从4 000~600 cm-1的扫描范围内测试32次,分辨率为4 cm-1。
1.2.3 扫描电子显微镜测试
将制备好的抗菌膜裁剪成小块,喷金后在TM3030台式扫描电子显微镜下进行观察,拍取不同倍数下的照片,观察各组样品的孔隙率和孔径大小。
1.2.4 厚度测定
用WD手持螺旋测微仪随机测定抗菌膜不同位置的厚度并取平均值,每组3张抗菌膜,每张取3个位置。
1.2.5 机械性能测试
将制好的膜材料样品裁剪成40 mm×10 mm的长方形样条。采用TA-XT plus质构仪(探头TGA)按照ASTM D882的方法在室温条件下测定样品的拉伸强度(tensile strength,TS)和断裂伸长率(elongation at break,EB)。拉伸速度为10 mm/min,标距20 mm。膜材拉伸强度和断裂伸长率的计算如公式(1)、公式(2)所示:
(1)
式中:σ,膜材拉伸强度,MPa;F,膜材断裂前承受最大应力,N;S,膜材横截面积,mm2。
(2)
式中:e,膜材断裂伸长率,%;Lo,膜材初始长度,mm;Lt,膜材断裂长度,mm。
1.2.6 透光率测定
使用紫外可见光分光光度计测定膜材在不同波长条件下的透光率。将膜材裁成30 mm×10 mm的样条,贴于石英比色皿侧面,以空白比色皿作为对照,测试波长为200~800 nm。膜材透光率的计算如公式(3)所示:
T/%=10-A×100
(3)
式中:T,透光率,%;A,吸光度,L/(g·cm)。
1.2.7 O2和CO2透过率测定
根据阴彤彤等[16]的方法并略作修改测定抗菌膜的气体透过率。在50 mL锥形瓶中加入1 mL的亚油酸,锥形瓶口用所制膜材覆盖并用石蜡密封。在温度为25 ℃、相对湿度小于5%的条件下,每天称重并记录,持续3 d,通过质量的增加计算氧气透过率。在50 mL锥形瓶中加入5 mL饱和KOH溶液,锥形瓶口用所制膜覆盖并用石蜡密封。在温度为25 ℃、相对湿度小于5%的条件下,每天称重并记录,持续3 d,通过质量的增加计算CO2的透过率。膜材气体透过率的计算如公式(4)所示:
(4)
式中:P,O2或CO2透过率,g/(m2·d);Δm,质量的增加量,mg;S,膜材面积,m2;t,测量时间间隔,d。
1.2.8 水蒸气透过率测定
根据阴彤彤等[16]的方法并略作修改。无水CaCl2经烘箱干燥2 h后准确称取5.00 g置于50 mL的锥形瓶中,瓶口覆盖膜材且用石蜡密封。在温度为25 ℃的条件下,锥形瓶放置在含有饱和KCl溶液的密封容器中,每隔3 h称重并记录。25 ℃时,纯水的饱和蒸汽压为3.169 kPa,KCl饱和溶液的蒸汽压为纯水的84.34%。膜材水蒸气透过率的计算如公式(5)所示:
(5)
式中:TWV,水蒸气透过率,g·mm/(m2·d·kPa);Δm,水蒸气迁移量,g;L,膜材厚度,mm;S,膜材面积,m2;T,测量时间间隔,h;ΔP,膜材两侧压差,kPa。
1.2.9 溶胀率测定
根据JIN等[17]的方法并稍作修改。将样品裁成10 mm×10 mm样条,每个样品准确称重,将样品置于pH=7.4的PBS缓冲液中,每隔5 min后取出,用滤纸吸干表面水分后称重,直至样品质量不再增加。膜材溶胀率的计算如公式(6)所示:
(6)
式中:ESR,膜材溶胀率,%;mo,膜材初始质量,mg;mt,膜材溶胀后质量,mg。
1.2.10 水溶性测定
根据GENNADIOS等[18]的方法并稍作修改。将干燥样品裁剪成20 mm×20 mm样条,准确称量其初始质量,将其置于含有30 mL无菌超纯水的50 mL离心管中。使用摇床在室温以150 r/min的速度连续摇动24 h。使用高速冷冻离心机在25 ℃以8 000×g离心20 min,得到未溶解的碎片。将碎片置于50 ℃干燥箱中24 h以获得干燥的未溶解的膜物质,准确称量质量。膜材水溶性的计算如公式(7)所示:
(7)
式中:WS,膜材水溶性,%;mi,膜材初始质量,mg;mf,溶于水后干燥且未溶解的膜材质量,mg。
1.2.11 差示扫描量热仪分析
使用214 Polyma DSC确定抗菌膜的热学性能。使用铟热谱图进行温度校准和热流校准。将薄膜样品(2~5 mg)准确称量到铝坩埚中,密封压紧后放入DSC样品池内。25 ℃条件下平衡5 min后在25~250 ℃温度范围内以10 ℃/min的加热速率进行扫描。空铝坩埚用作对照。得到相应的差示扫描量热法(differential scanning caborimetry,DSC)扫描曲线,并进一步通过Proteus Analysis软件分析得到各变性峰的相应温度和焓值。
1.2.12 抗菌活性测定
根据KHAN等[19]的方法并加以改进。按照表2固定京尼平浓度且调整nisin浓度制备膜材样品,将待测膜材裁剪成直径1 cm的圆形样品,紫外灭菌15 min。将100 μL浓度约105 CFU/mL金黄色葡萄球菌液均匀涂布在已经凝固的LB琼脂培养基上,静置20 min。将圆形膜材样品置于固体培养基上,37 ℃培养24 h。测量抑菌圈直径并拍摄琼脂平板菌落形成单位的照片。
表2 抗菌实验中膜材的组成
Table 2 Composition of films in the antimicrobial experiment
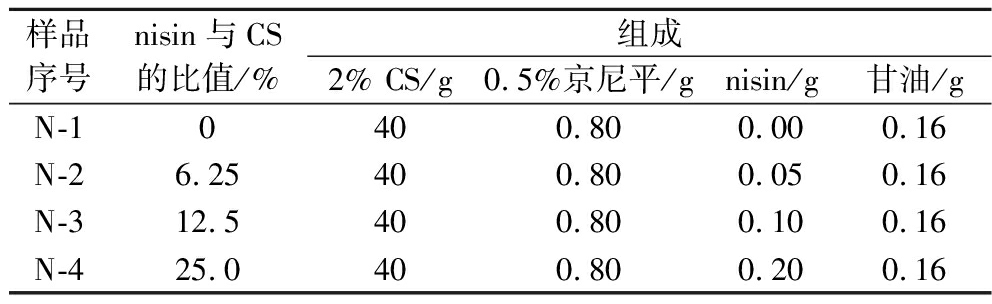
样品序号nisin与CS的比值/%组成2% CS/g0.5%京尼平/gnisin/g甘油/gN-10400.800.000.16N-26.25400.800.050.16N-312.5400.800.100.16N-425.0400.800.200.16
1.3 数据处理与统计学分析
采用Excel 2016和SPSS Statistics 26.0对每组数据进行方差分析(analysis of variance,ANOVA),组间差异比较用Duncan检测,P<0.05时差异显著,P>0.05时差异不显著。采用Origin 2018软件拟合作图。
2 结果与讨论
2.1 复合抗菌膜的表征及SEM分析
Nisin和壳聚糖具有氨基,使用京尼平作为交联剂可以将nisin与壳聚糖交联,制备含有nisin的抗菌膜。图1为加入不同浓度京尼平交联后的抗菌膜照片,其中CS-1、CS-2、CS-3、CS-4、CS-5和CS-6的京尼平含量分别为0.00%、0.05%、0.25%、0.50%、2.50%和5.00%。通过大体观察,各组抗菌膜表面平整、均匀,外形上无显著差别。其中CS-1为未添加交联剂的组别,呈无色。随着交联剂浓度的增加,所制抗菌膜颜色逐渐加深,由浅蓝色逐渐变为深蓝色,交联程度相应增大[20]。

图1 抗菌膜的照片
Fig.1 Photo of antimicrobial films
抗菌膜的红外光谱如图2所示,随着京尼平浓度增加,CS-1到CS-6在1 060 cm-1处吸收增加,1 026 cm-1减少,这是由于壳聚糖和京尼平在交联过程中形成杂环京尼平交联物,壳聚糖上的C—O形成了C—N键。另外,壳聚糖的伯胺基团与京尼平上的酯基团结合形成仲酰胺键,引起1 639和1 548 cm-1处吸收度比率增加。从微观尺度看,在抗菌膜的SEM图中(图3),未添加交联剂京尼平的CS-1组的孔隙较少,随着京尼平浓度增加,抗菌膜的孔隙增大,孔隙数量也随之增加,壳聚糖和京尼平反应加强,分子间交联程度增大,网络结构增多,这与红外光谱中更多的C-N键、仲酰胺键形成相一致。

图2 抗菌膜的红外光谱
Fig.2 FT-IR spectra of antimicrobial films

a-CS-1;b-CS-2;c-CS-3;d-CS-4;e-CS-5;f-CS-6
图3 抗菌膜的SEM图
Fig.3 SEM micrographs of antimicrobial films
2.2 抗菌膜的拉伸强度和断裂伸长率
膜材的拉伸强度是指单位截面薄膜在拉伸断裂时的拉力,表明膜材抵抗拉伸的能力,是衡量膜材性能的重要指标之一。抗菌膜的拉伸强度如表3中所示,未交联的壳聚糖膜拉伸强度为(58.65±1.21)MPa;当京尼平含量增加到0.05%、0.25%和0.50%时,膜材的拉伸强度分别增长至(59.20±5.45)、(93.62±3.92)、(144.42±1.71)MPa;随着交联剂京尼平的浓度进一步增加到2.50%和5.00%时,膜材拉伸强度下降至(73.43±1.42)、(67.68±5.34)MPa。
表3 抗菌膜的厚度、拉伸强度和断裂生长率
Table 3 Thickness, tensile strength, and fracture growth rate of antimicrobial films
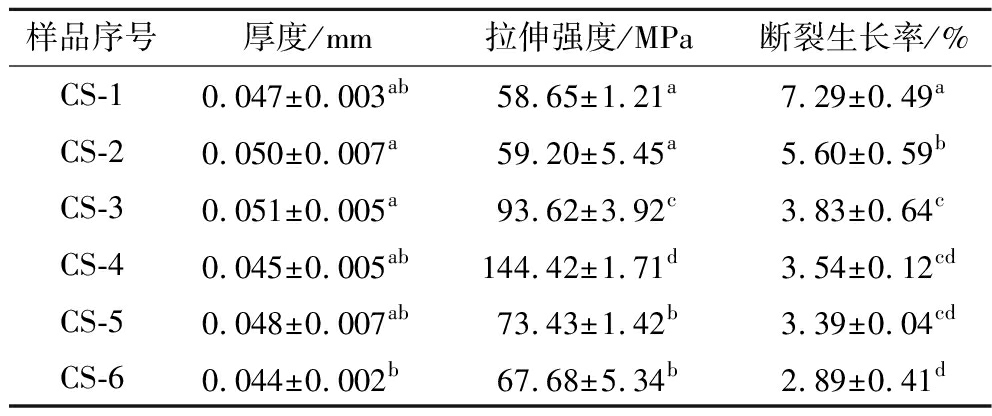
样品序号厚度/mm拉伸强度/MPa断裂生长率/%CS-10.047±0.003ab58.65±1.21a7.29±0.49aCS-20.050±0.007a59.20±5.45a5.60±0.59bCS-30.051±0.005a93.62±3.92c3.83±0.64cCS-40.045±0.005ab144.42±1.71d3.54±0.12cdCS-50.048±0.007ab73.43±1.42b3.39±0.04cdCS-60.044±0.002b67.68±5.34b2.89±0.41d
注:同一列中不同小写字母(上标)表示数值之间存在显著性差异(P<0.05)(下同)。
断裂伸长率是指当进行断裂拉伸试验时,薄膜样品断裂时薄膜长度增加的百分率,用来衡量薄膜在未断裂时的延伸能力。如表3所示,随着材料中交联剂浓度的增加,膜材的断裂生长率逐渐下降,从(7.29±0.49)%降低至(2.89±0.41)%。
2.3 抗菌膜的透光率
表4为抗菌膜在波长200~800 nm的透光率。当波长维持不变时,随着交联剂浓度的提高,更多的交联产物使得膜材透光率趋于下降,这与图1中抗菌膜的颜色变深相对应。对于单个交联后的抗菌膜样品来说,其在紫外区域内的透光率较低;在可见光区域内,膜材的透光率整体上随着波长的增加呈上升趋势,但在600 nm波长处明显降低,这是由于京尼平与氨基反应生成的交联产物在590~600 nm处存在特征吸收峰导致的[20]。
表4 抗菌膜在不同波长下的透光率
Table 4 Light transmission of antimicrobial films at different wavelengths

样品序号透光率/%200 nm300 nm400 nm500 nm600 nm700 nm800 nmCS-10.07±0.02a58.28±0.45a83.56±0.48a88.44±0.47a89.61±0.78a90.23±0.78a90.37±0.54aCS-20.05±0.01a44.32±1.23b77.18±0.38b83.95±0.82b80.91±0.53b88.11±1.15b88.24±0.47bCS-30.06±0.02a14.30±0.84c52.16±1.20c63.83±1.04c43.56±1.42c77.63±0.51c86.02±0.76cCS-40.04±0.01ab4.73±0.15d39.96±1.11d55.73±1.27d29.79±1.07d72.44±0.47d82.17±1.34dCS-50.01±0.00b0.05±0.01e6.65±0.63e16.24±0.34e1.24±0.04e39.40±0.19e65.93±1.23eCS-60.01±0.00b0.04±0.00e3.44±0.04f12.01±0.88f0.56±0.10f34.87±0.92f47.05±1.79f
2.4 抗菌膜的O2、CO2及水蒸气透过率
气体及水蒸气的透过率是衡量膜材性能的一个重要指标。表5为不同京尼平浓度下该复合抗菌膜的O2、CO2及水蒸气透过率。可以看出,不同交联度对该复合抗菌膜的O2、CO2及水蒸气透过率影响差异不显著(P>0.05)。
表5 抗菌膜的O2、CO2及水蒸气透过率
Table 5 O2, CO2, and water vapor transmission rate of antimicrobial films

样品序号O2透过率/[g·(m2·d)-1]CO2透过率/[g·(m2·d)-1]水蒸气透过率/[g·mm·(m2·d·kPa)-1]CS-12.41±0.06a33.23±1.18ab1.69±0.08aCS-22.55±0.69a34.06±1.64ab1.66±0.05aCS-32.56±0.39a37.87±1.46b1.69±0.07aCS-42.53±0.47a32.29±3.24a1.62±0.26aCS-52.42±0.40a31.88±2.21a1.63±0.18aCS-62.47±0.59a36.51±2.40ab1.64±0.13a
2.5 抗菌膜的溶胀率和水溶性
抗菌膜的溶胀率与材料的交联度有关,也与膜的物质透过与运输性质息息相关,在一定程度上也会影响细菌细胞在膜材料上的粘附与增殖[21]。由表6可知,未交联抗菌膜溶胀率为(425.71±2.80)%,加入交联剂后抗菌膜的溶胀率随之下降。当京尼平含量达到5.00%时,其溶胀率下降至(134.79±10.38)%,是未交联抗菌膜溶胀率的31.66%。
表6 抗菌膜的溶胀率和水溶性
Table 6 Swelling rate and water solubility of antimicrobial films
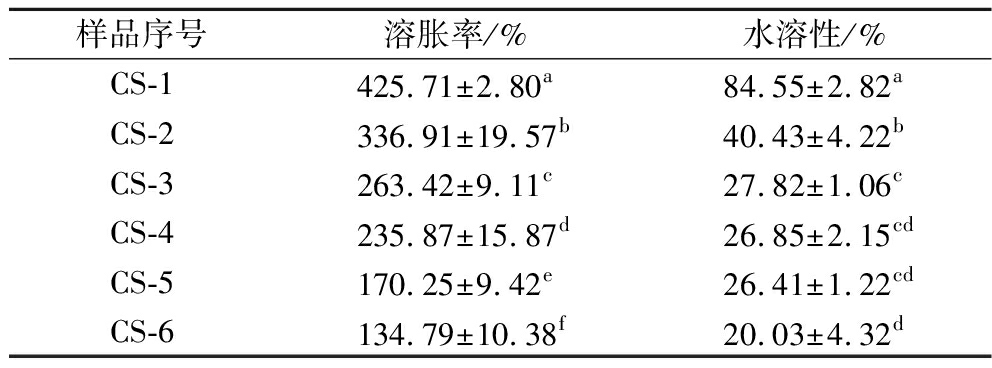
样品序号溶胀率/%水溶性/%CS-1425.71±2.80a84.55±2.82aCS-2336.91±19.57b40.43±4.22bCS-3263.42±9.11c27.82±1.06cCS-4235.87±15.87d26.85±2.15cdCS-5170.25±9.42e26.41±1.22cdCS-6134.79±10.38f20.03±4.32d
水溶性可以预测高耐水性膜材的稳定性,是包装材料非常重要的参数之一。抗菌膜的水溶性如表4所示。未交联时膜材的水溶性为(84.55±2.82)%,膜材几乎完全溶解;当京尼平浓度为0.05%时,膜材水溶性为(40.43±4.22)%,水溶性显著降低,膜材不完整且呈现蜷缩状;当京尼平浓度进一步升高至5.00%时,膜材的水溶性下降至(20.03±4.32)%,膜材整体保持完整且不蜷缩。
2.6 抗菌膜的DSC分析结果
CS-1、CS-3和CS-5在40~120 ℃的DSC曲线如图4所示,曲线上吸热峰的初始温度(To)、峰值温度(Tp)、终止温度(Te)和热焓(ΔH)如表7所示。膜材的吸热峰和放热峰一般与非晶相聚合物分子的链段运动有关,是影响膜材热稳定性和机械性能的因素之一。与未交联的膜材相比,交联后膜材的吸热峰向温度升高方向移动,表明交联后膜材热稳定性有所提高,同时也表明膜材的刚性增加,与交联后膜材更高的拉伸强度相对应。对于不同交联剂浓度的膜材,其吸热峰位置变化不明显[22]。

图4 抗菌膜的DSC曲线
Fig.4 DSC curves of antimicrobial films
表7 抗菌膜的吸热峰
Table 7 Endothermic peak of antimicrobial films
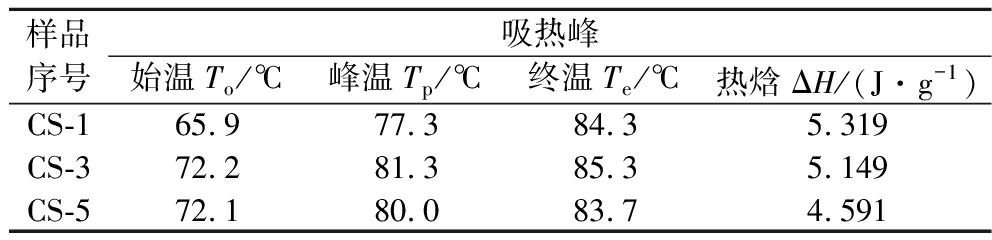
样品序号吸热峰始温To/℃峰温Tp/℃终温Te/℃热焓ΔH/(J·g-1)CS-165.977.384.35.319CS-372.281.385.35.149CS-572.180.083.74.591
2.7 抗菌膜的抗菌活性
本文采用CS-4组的京尼平含量(0.50%)制备一系列nisin含量不同(与壳聚糖比值分别为0%、6.25%、12.5%、25.0%)的膜材样品,分别记作N-1、N-2、N-3和N-4,其对金黄色葡萄球菌的抑菌圈照片如图5所示,抑菌圈直径如图6所示。

图5 膜材的抗菌活性
Fig.5 Antimicrobial activity of the films

图6 抑菌圈直径
Fig.6 Diameter of the clear inhibition zone
由图可知,对于金黄色葡萄球菌,未添加nisin的壳聚糖膜(N-1)没有观察到明显的抑菌圈,而分别交联了6.25%(N-2)、12.5%(N-3)和25.0%(N-4)nisin的复合膜的抑菌圈直径分别达到(1.32±0.07)、(1.45±0.03)和(1.55±0.06)cm,表明与单一壳聚糖膜相比,复合抗菌膜对金黄色葡萄球菌具有较强的抗菌活性,且膜材的抗菌活性随着nisin含量的增加逐步增强。
3 结论
本文通过京尼平将壳聚糖和乳酸链球菌素交联制备获得复合抗菌薄膜。随着京尼平含量增加,该抗菌膜颜色加深,透光率下降,孔隙增大,孔隙数量增加,溶胀率和水溶性下降,而氧气、二氧化碳及水蒸气透过率无显著变化;同时,该抗菌膜的拉伸强度随着京尼平含量的增加先上升后下降,而断裂伸长率逐步下降且热稳定性逐渐提高;另外,与单一壳聚糖膜相比,所制备的复合抗菌膜对金黄色葡萄球菌具有较强的抗菌活性。
[1] DEWEY-MATTIA D, MANIKONDA K, HALL A J, et al.Surveillance for foodborne disease outbreaks - United States, 2009-2015[J].Mmwr Surveillance Summaries, 2018, 67(10):1-11.
[2] MOTELICA L, FICAI D, FICAI A, et al.Biodegradable antimicrobial food packaging:Trends and perspectives[J].Foods, 2020, 9(10):1438.
[3] LIN S, YANG L, CHEN G, et al.Pathogenic features and characteristics of food borne pathogens biofilm:Biomass, viability and matrix[J].Microb Pathog, 2017, 111:285-291.
[4] KARAKONSTANTIS S, KRITSOTAKIS E I, GIKAS A.Multifunctional tissue-adhesive cryogel wound dressing for rapid nonpressing surface hemorrhage and wound repair[J].Journal of Antimicrobial Chemotherapy, 2020, 75(2):271-282.
[5] SUNDIN G W, WANG N.Antibiotic resistance in plant-pathogenic bacteria[J].Annual Review of Phytopathology, 2018, 56:161-180.
[6] YU X J, LU N Y, WANG J Y, et al.Effect of N-terminal modification on the antimicrobial activity of nisin[J].Food Control, 2020, 114:107227.
[7] SHIN J M, GWAK J W, KAMARAJAN P, et al.Biomedical applications of nisin[J].Journal of Applied Microbiology, 2016, 120(6):1 449-1 465.
[8] HARRIS L J, FLEMING H P, KLAENHAMMER T R.Characterization of two nisin-producing Lactococcus lactis subsp.lactis strains isolated from a commercial sauerkraut fermentation[J].Applied and Environmental Microbiology, 1992, 58(5):1 477-1 483.
[9] ZHANG W L, JIANG W B.Antioxidant and antibacterial chitosan film with tea polyphenols-mediated green synthesis silver nanoparticle via a novel one-pot method[J].International Journal of Biological Macromolecules, 2020, 155:1 252-1 261.
[10] LI M, ZHANG Z Y, LIANG Y P, et al.Multifunctional tissue-adhesive cryogel wound dressing for rapid nonpressing surface hemorrhage and wound repair[J].ACS Applied Materials &Interfaces, 2020, 12(32):35 856-35 872.
[11] YADAV S, MEHROTRA G K, DUTTA P K.Chitosan based ZnO nanoparticles loaded Gallic-acid films for active food packaging[J].Food Chemistry, 2021, 334:127605.
[12] ILYAS R A, AISYAH H A, NORDIN A H, et al.Natural-fiber-reinforced chitosan, chitosan blends and their nanocomposites for various advanced applications[J].Polymers, 2022, 14(5):874.
[13] YANG Y T, LIANG Y P, CHEN J Y, et al.Mussel-inspired adhesive antioxidant antibacterial hemostatic composite hydrogel wound dressing via photo-polymerization for infected skin wound healing[J].Bioactive Materials, 2022, 8:341-354.
[14] ZHANG J J, TAN W Q, LI Q, et al.Preparation of cross-linked chitosan quaternary ammonium salt hydrogel films loading drug of gentamicin sulfate for antibacterial wound dressing[J].Marine Drugs, 2021, 19(9):479.
[15] AHMED M K, MOYDEEN A M, ISMAIL A M, et al.Wound dressing properties of functionalized environmentally biopolymer loaded with selenium nanoparticles[J].Journal of Molecular Structure, 2021, 1225:129138.
[16] 阴彤彤. 大豆蛋白交联玉米淀粉/Nano-TiO2包装膜的制备及圣女果保鲜应用[D].哈尔滨:东北农业大学, 2019.
YIN T T.Preparation of soy protein and crosslinked corn starch/nano-TiO2 packaging film and application of cherry tomatoes preservation[D].Harbin:Northeast Agricultural University, 2019.
[17] JIN J, SONG M, HOURSTON D J.Novel chitosan-based films cross-linked by genipin with improved physical properties[J].Biomacromolecules, 2004, 5(1):162-168.
[18] GENNADIOS A, HANDA A, FRONING G W, et al.Physical properties of egg white-dialdehyde starch films[J].Journal of Agricultural and Food Chemistry, 1998, 46(4):1 297-1 302.
[19] KHAN A, SALMIERI S, FRASCHINI C, et al.Genipin cross-linked nanocomposite films for the immobilization of antimicrobial agent[J].ACS Applied Materials &Interfaces, 2014, 6(17):15 232-15 242.
[20] 贾伟建, 李真真, 丁珊, 等.基于京尼平交联的壳聚糖膜的制备及性能研究[J].功能材料, 2017, 48(5):5 070-5 076.
JIA W J, LI Z Z, DING S, et al.Preparation and properties of chitosan membrane crosslinked by genipin[J].Journal of Functional Materials, 2017, 48(5):5 070-5 076.
[21] 朱丽英, 姚善泾.壳聚糖/纤维素硫酸钠复合膜性能的研究[J].食品与生物技术学报, 2012, 31(2):166-170.
ZHU L Y, YAO S J.Study on the properties of complex films based on chitosan and sodium cellulose sulfate[J].Journal of Food Science and Biotechnology, 2012, 31(2):166-170.
[22] LIU Y Y, CAI Z X, SHENG L, et al.Structure-property of crosslinked chitosan/silica composite films modified by genipin and glutaraldehyde under alkaline conditions[J].Carbohydrate Polymers, 2019, 215:348-357.