罗非鱼(Oreochromis niloticus)含有丰富的氨基酸,是一种高蛋白的经济鱼类[1],中国是罗非鱼生产大国,2020年罗非鱼养殖产量达165.54万t,占淡水鱼总产量的6.4%[2],具有极好的发展前景。但罗非鱼在储运过程中易出现品质劣化,其中质地变化是当前研究热点,因此,提高罗非鱼鱼肉在贮藏储运期间的质地品质具有重要意义。
鱼肉质构劣化主要归因于肌肉组织解体。鱼肉肌原纤维中含量最多的2种蛋白是肌动蛋白和肌球蛋白,它们分别组装成肌原纤维的粗丝和细丝[3]。肌原纤维粗丝和细丝的解离会破坏肌原纤维的完整性,研究发现肌原纤维粗丝和细丝的解离与牛肉嫩度具有相关性[4-5]。WANG等[6]发现草鱼(Ctenopharyngodon idellus)死后12 h内肌原纤维粗丝的解离与鱼肉质构劣化相关。
研究表明内源蛋白酶与肌原纤维解离具有紧密联系,但国内外对于内源蛋白酶与肌原纤维降解的研究较多,其中发挥主要作用的是组织蛋白酶B、L、D和钙激活蛋白酶[7]。然而,内源蛋白酶对肌原纤维蛋白的降解并不能完全解释鱼体死后的复杂生化变化,因此有必要考虑其他系统的参与。有研究表明肌原纤维粗丝和细丝的解离与热休克蛋白有紧密的关系。鱼死后肌肉营养和氧气大量损失,应激状态下产生热休克蛋白(heat shock proteins, HSP)来维持内环境的稳定,经常被用于肉类质量品质的研究[8]。葛黎红[7]发现热休克蛋白90和UNC 45含量的减少会导致草鱼肌原纤维粗丝的解离,且组织蛋白酶B、L、D和钙激活蛋白酶对这2种热休克蛋白具有降解作用。张喜才[9]通过蛋白质组学发现HSP 70与石斑鱼(Epinephelus spp.)的胶黏性有关,并通过体外模拟实验发现组织蛋白酶L能显著降解HSP 70。何燕富[10]采用蛋白质组学发现HSP 70与罗非鱼鱼肉软化相关。
目前有关内源蛋白酶、HSP 70与罗非鱼肌原纤维解离关系的报道较少,本研究以尼罗罗非鱼为研究对象,分析罗非鱼鱼肉冷藏期间内源蛋白酶、HSP 70、肌原纤维小片化指数(myofibril fragmentation index, MFI)以及解离的肌球蛋白重链(dissociated myofibrillar heavy chain, dMHC)和肌动蛋白(dissociated actin, dAC)含量变化和相关性,为罗非鱼贮藏期间质构变化机理研究提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜罗非鱼[(800±50) g],广州某超市;NuPAGETMBis-Tris预制胶(12%,体积分数)、NuPAGETMMOPS SDS 电泳缓冲液(20×),英潍捷基贸易有限公司;BeyoColorTM彩色预染蛋白、5×SDS-PAGE上样缓冲液、考马斯亮蓝染色液,上海碧云天生物技术有限公司;Z-Arg-Arg-AMC、Z-Phe-Arg-AMC、N-Suc-Leu-Tyr-AMC,Sigma公司;鱼热休克蛋白-70(HSP-70)酶联免疫吸附测定试剂盒,上海茁彩生物科技有限公司;1-乙基-3-(3-三甲氨丙基)碳二甲胺盐酸盐,广州都宏生物科技有限公司。
1.2 仪器与设备
IKA-T25组织匀浆机,德国IKA公司;HH-4快速恒温数显水浴箱,常州澳华仪器公司;Sun-rise-basic吸光酶标仪,德国TECAN公司;CT3质构仪,美国Brookfield公司;3K30台式高速冷冻离心机,德国Sigma公司;Mini Gel Tank蛋白电泳槽,美国Invitrogen公司;基础电泳仪,美国BIO-RAD公司;Image ScannerIII扫描仪,美国GE公司;Cary Eclipse荧光分光光度计,美国VARIAN公司。
1.3 实验方法
1.3.1 样品处理
将鲜活罗非鱼击晕宰杀,去鱼头、鱼皮和内脏,取背部肌肉切成2 cm×2 cm×1 cm块状,真空包装,于4 ℃条件冷藏。
1.3.2 pH的测定
参考GB 5009.237—2016《食品安全国家标准 食品pH值的测定》的方法进行测定。
1.3.3 MFI的测定
参考张诗泉等[11]的方法稍作修改,取2 g鱼肉,加入25 mmol/L缓冲液A(100 mmol/L KCl,1 mmol/L EDTA,1 mmol/L MgCl2,pH 7.0)30 mL,在冰浴均质1 min,期间停歇30 s,用纱布过滤,滤液在4 ℃、10 000 r/min条件下离心15 min,保留沉淀。将沉淀溶于20 mL磷酸盐缓冲液,再以10 000 r/min转速离心15 min,所得沉淀用上述缓冲液复溶,用试剂盒测定蛋白浓度,并稀释至蛋白浓度为0.5 mg/mL,在540 nm处测定其吸光值,吸光值乘以200即为肌原纤维小片化指数。
1.3.4 肌原纤维蛋白的提取
参考葛黎红[7]的方法提取肌原纤维蛋白。称取2 g碎鱼肉,用10 mL的缓冲液B(5 mmol/L EDTA,50 mmol/L KCl,10 mmol/L Tris-HCl,pH 7.5)浸泡20 min,均质后用纱布过滤;滤渣加入10 mL的缓冲液C(2 mmol/L MgCl2,50 mmol/L KCl,10 mmol/L Tris-HCl,pH 7.5)浸泡20 min;过滤后滤渣再用缓冲液D(0.1 mmol/L CaCl2,50 mmol/L KCl,10 mmol/L Tris-HCl,pH 7.5)浸泡20 min;最后将滤渣用10 mL的缓冲液C均质30 s,停歇20 s降温后再均质30 s。混合物在4 ℃、11 000 r/min下离心15 min。沉淀复溶于缓冲液C中即为罗非鱼肌原纤维蛋白。
1.3.5 肌原纤维蛋白与EDC交联反应
肌原纤维蛋白与1-乙基-3-(3-三甲氨丙基)碳二甲胺盐酸盐[1-ethyl-3-(3-trimethylaminopropyl)carbodiimide,EDC]交联反应参考MIDDE等[12]的方法。将罗非鱼肌原纤维蛋白样品稀释为蛋白质量浓度4 mg/mL,取1 mL加入2 mmol/L的EDC溶液10 μL,室温反应20 min后,加入1 mL终止液(质量分数1% SDS,100 mmol/L DTT,60 mmol/L Tris-HCl,pH 8.3)终止交联反应。将反应液置于沸水中加热5 min,离心15 min(4 ℃,10 000 r/min)。取上清液与上样缓冲液混合,体积比为3∶2。混合液于沸水中加热5 min,得到电泳样品。电泳电压设置为100 V,染色1 h,脱色1 h,染色剂为考马斯亮蓝R250,脱色液由10%醋酸,40%乙醇和50%水组成。
1.3.6 HSP 70含量的测定
使用鱼热休克蛋白-70(HSP-70)酶联免疫吸附测定试剂盒测定。
1.3.7 内源蛋白酶的提取与酶活的测定
1.3.7.1 钙激活蛋白酶和组织蛋白酶B、L的提取及活性测定
钙激活蛋白酶和组织蛋白酶B、L的提取及活性测定参考岑剑伟[13]的方法。
取10 g碎鱼肉加入20 mmol/L Tris溶液(pH 7.5)20 mL,均质20 s,降温后均质,在4 ℃条件下搅拌30 min,4 ℃、16 000 r/min下离心20 min,上清液即为粗酶提取液。
取粗酶0.5 mL,与0.25 mL缓冲液混合且在37 ℃恒温箱中预热10 min,加入对应的反应底物,在37 ℃条件下反应0.5 h后加入2.5 mL终止液(50 mmol/L Tris-HCl,质量分数1% SDS,pH 7.0)。采用荧光分光光度计测定7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)的释放量。测定条件为激发波长(λex)340 nm、发射波长(λem)440 nm。酶活力单位定义为1 min内释放出1 μmol/L AMC所需的酶量。
组织蛋白酶B缓冲液:352 mmol/L KH2PO4,48 mmol/L Na2HPO4,4 mmol/L Na2EDTA,pH 6.0,使用前配制为含8 mmol/L L-半胱氨酸溶液;组织蛋白酶L缓冲液:340 mmol/L NaAc,60 mmol/L HAc,4 mmol/L Na2EDTA,pH 5.5,使用前配制成含8 mmol/L DTT溶液;钙激活蛋白酶缓冲液:150 mmol/L Tris-HCl,7.5 mmol/L CaCl2,pH 6.0。
1.3.7.2 组织蛋白酶D的提取与活性测定[13]:
称取15 g碎鱼肉,加入10倍体积的预冷丙酮,均质后用布氏漏斗过滤,滤液风干,得到干品,加入20 mL的KCl溶液(2%,质量分数),混匀后离心15 min(4 ℃,10 000 r/min),所得上清液即为组织蛋白酶D粗酶液。取0.5 mL的粗酶液,加入0.5 mL的酸变性血红蛋白(5%质量分数)以及1.5 mL的麦基尔文缓冲液(pH 3.0),在37 ℃条件下放置1 h,加入2.5 mL TCA(5%质量分数)终止反应,离心15 min(25 ℃,7 000 r/min),通过参考Lowry法测定上清液中的多肽,每个酶活力单位定义为1 min之内释放1 μmol/L酪氨酸(Tyr)所需要的酶量。
1.4 数据处理
采用SPSS 23和Origin 8.5软件处理实验数据、进行相关性分析和显著性分析,显著性水平设为0.05,采用Image J对电泳图谱中条带灰度进行相对定量分析。
2 结果与分析
2.1 贮藏期间罗非鱼鱼肉MFI的变化
MFI是反应肌原纤维完整性的一个指标,MFI越大说明肌原纤维结构遭受破坏的程度越大[14]。动物在被宰杀后,组织蛋白酶和钙激活蛋白酶被激活,肌间蛋白、连接蛋白发生降解,造成Z线结构的消失,使得肌原纤维碎片化[15]。罗非鱼冷藏过程中MFI变化如图1所示,罗非鱼的MFI变化整体呈增加的趋势,在0~12 h内增加显著(P<0.05),在12~24 h内变化不显著(P>0.05),在48 h时MFI为初始值的3.52倍。对冷藏时间和MFI进行相关性分析,发现MFI与冷藏时间呈极显著正相关(P≤0.01,r=0.958),说明在贮藏过程中罗非鱼肌原纤维完整性被破坏。AYALA等[16]使用扫描电镜对冷藏的金头鲷(Sparus aurata L.)进行微观研究,发现贮藏时间越长,肌原纤维碎片化现象越严重,这与本实验结论一致。

图1 冷藏过程中罗非鱼鱼肉肌原纤维小片化指数变化
Fig.1 Changes of myofibril fragmentation index of tilapia during refrigeration
注:不同字母间具显著性差异(P<0.05)(下同)。
2.2 贮藏期间肌原纤维粗丝和细丝的解离变化
肌原纤维粗丝和细丝的解离是导致鱼肉质构品质劣化的原因之一。为研究罗非鱼冷藏期间肌原纤维蛋白粗丝和细丝的结构变化,采取零臂长交联剂EDC处理罗非鱼鱼肉肌原纤维蛋白,通过SDS-PAGE图谱探究鱼肉解离的蛋白变化。EDC通过共价作用将蛋白分子的羧基和伯胺交联,主要连接氨基酸残基上的羧基和伯胺[17]。图2和表1分别为罗非鱼肌原纤维蛋白在EDC交联后的SDS-PAGE图谱及图谱中dMHC和dAC的相对灰度变化。罗非鱼冷藏期间dMHC和dAC的含量显示升高的趋势,在0~2 h内dAC含量无显著变化(P>0.05),表明这段时间内肌原纤维蛋白粗丝和细丝形成肌动球蛋白,此时鱼肉处于尸僵状态。在2~8 h内dMHC和dAC含量无显著性变化(P>0.05),这意味着解僵过程的开始,即肌原纤维粗丝和细丝的分离。在8~48 h内dMHC和dAC含量均为显著性增加(P<0.05),解离出的肌动蛋白和肌球蛋白重链的灰度随着贮藏时间的延长而不断增加。WANG等[6]研究发现草鱼宰后12 h内肌原纤维粗丝解离程度随贮藏时间的延长而增加。葛黎红[7]研究发现草鱼在冷藏条件下贮藏48 h内,dMHC和dAC含量随贮藏时间的延长而增加。dMHC和dAC含量增加是鱼肌肉品质劣化的重要指标之一,这种劣化与肌球蛋白解离程度密切相关。OKITANI等[18]还发现鱼肉中积聚的AMP和IMP可以分离肌动球蛋白。因此,对这些肌肉中导致肌原纤维解离的因素进行研究,针对这些因素制定能维持鱼类死后肌肉中肌原纤维完整性的策略,以改善肉质。
表1 冷藏罗非鱼鱼肉肌原纤维蛋白与EDC交联后的SDS-PAGE图谱中条带灰度变化
Table 1 The gray scale of the bands in SDS-PAGE profile of myofibrillar protein of chilled tilapia flesh after cross-linking with EDC
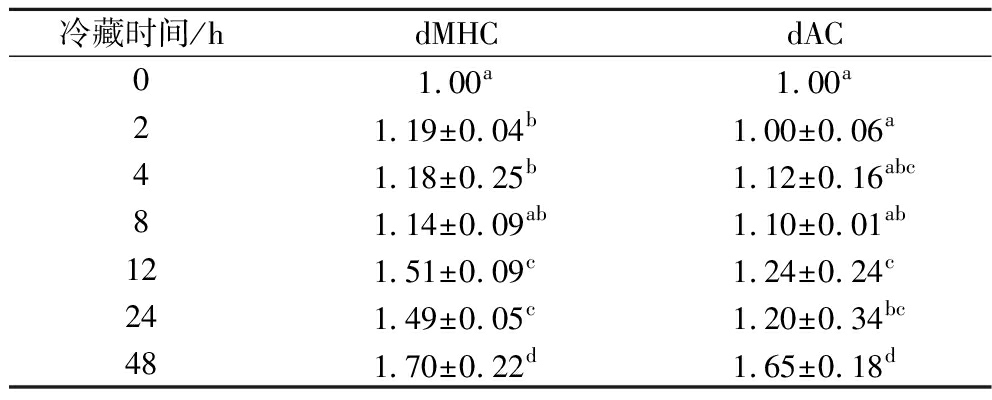
冷藏时间/hdMHCdAC01.00a1.00a21.19±0.04b1.00±0.06a41.18±0.25b1.12±0.16abc81.14±0.09ab1.10±0.01ab121.51±0.09c1.24±0.24c241.49±0.05c1.20±0.34bc481.70±0.22d1.65±0.18d
注:数据表示为平均值±标准偏差,同一列中不同的字母表明组内存在显著性差异(P<0.05)。

图2 冷藏过程中罗非鱼肌原纤维蛋白与EDC交联后的SDS-PAGE图谱
Fig.2 SDS-PAGE profile of tilapia myofibrillar crosslinked with EDC during refrigeration
注:MHC-肌球蛋白重链;Actin-肌动蛋白
2.3 罗非鱼鱼肉pH在贮藏期间的变化
鱼肉贮藏过程中pH变化反应肌肉组织的生理环境变化,生理环境的改变会影响肌肉品质[19]。冷藏期间pH变化总体呈先下降后升高的趋势(图3),这与CHEMAT等[20]研究结果一致。在2~8 h内鱼肉pH显著性下降(P<0.05),这可能是鱼体内糖原分解生成的乳酸和ATP降解生成的磷酸所导致的,在24~48 h内鱼肉pH略有回升,可能是内源酶和微生物降解蛋白质生成的碱性胺类物质引起的。卢涵[21]发现4 ℃冷藏的鳙鱼肌肉pH在8 h后pH呈回升趋势。本实验在24 h后pH呈上升趋势,这可能是因为真空包装延缓了蛋白质的降解。
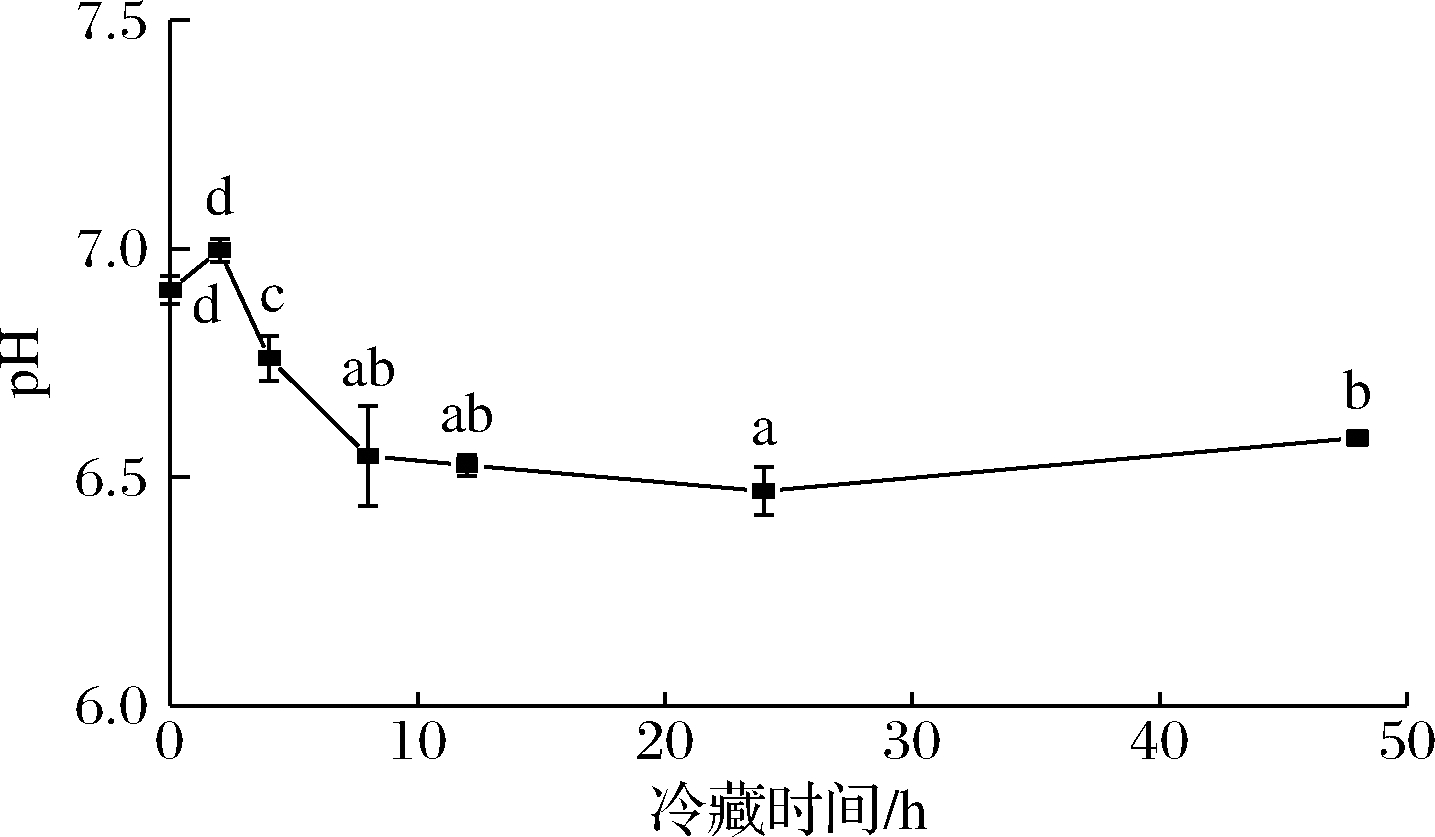
图3 冷藏过程中罗非鱼鱼肉pH变化
Fig.3 pH changes of tilapia during refrigeration
2.4 罗非鱼鱼肉内源蛋白酶活性在贮藏期间变化
冷藏期间罗非鱼组织蛋白酶B、L活性变化如图4所示,组织蛋白酶B活性在冷藏期间整体呈现不断上升的趋势,在24~48 h期间其活性无显著性增加(P>0.05),说明组织蛋白酶B活性在24 h后趋于平稳。组织蛋白酶L在整个贮藏期间内活性处于升高的趋势,且在12~48 h呈显著性增加(P<0.05),代表组织蛋白酶L随着贮藏期延长其活性仍有可能继续提高。冷藏期间罗非鱼组织蛋白酶D活性变化如图5所示,组织蛋白酶D活性在0~8 h显著性增加(P<0.05),在8 h到达最大值,为初始值的1.23倍,而后随着贮藏时间的延长其活性降低,最终其活性与初始值相近。WANG等[6]发现草鱼死后12 h内组织蛋白酶B活性呈升高趋势,组织蛋白酶D活性先升高后降低,且在 8 h 达到最大值。沈妮[22]研究了4 ℃冷藏的带鱼在贮藏期间内组织蛋白酶B、L活性变化,结果表明组织蛋白酶B、L活性在0~3 d内呈升高趋势。组织蛋白酶B、L的最适pH为6.5~7.0,而组织蛋白酶D的最适pH为5.5以下[19],本研究中鱼肉pH变化范围为6.5~7.0,因此,在鱼肉软化过程中组织蛋白酶B、L可能比组织蛋白酶D贡献更大。

图4 冷藏过程中罗非鱼鱼肉组织蛋白酶B、L活性变化
Fig.4 Changes of cathepsin B, L activity of tilapia during refrigeration

图5 冷藏过程中罗非鱼鱼肉组织蛋白酶D活性变化
Fig.5 Changes of cathepsin D activity of tilapia during refrigeration
钙激活蛋白酶是一种存在于肌浆中的半胱氨酸蛋白酶[23]。冷藏期间罗非鱼钙激活蛋白酶活性变化如图6所示。钙激活蛋白酶活性整体呈先增加后降低的趋势,在0~12 h内显著性增加(P<0.05),12~48 h内其活性显著性降低(P<0.05),最终值与初始值相比降低了25.4%。葛黎红[7]对草鱼贮藏期内钙激活蛋白酶活性变化进行研究,发现在整个贮藏期间内钙激活蛋白酶活性呈先上升后下降的趋势,且在12 h时其活性达到最大值,这与该实验结果一致。钙激活蛋白酶活性增加的原因可能是内质网中积累的钙离子大量释放导致钙激活蛋白酶被激活,其活性降低可能是由于其本身的自溶作用以及鱼肉中的钙蛋白酶抑素发挥作用[24]。从钙激活蛋白酶活性变化来看,其在贮藏前12 h内发挥作用,随着贮藏时间的延长,对鱼肉软化的贡献降低。

图6 冷藏过程中罗非鱼鱼肉钙激活蛋白酶活性变化
Fig.6 Changes of calpain activity of tilapia during refrigeration
2.5 贮藏过程中罗非鱼鱼肉HSP70含量变化
热休克蛋白是机体在应激条件下大量合成的分子伴侣蛋白,研究者发现热休克蛋白在肉类质构品质劣化过程中具有重要作用[24-25]。动物被宰杀后,肌细胞在应激条件下热休克蛋白被大量合成并与肌原纤维蛋白结合稳定其结构[26]。何燕富[10]通过蛋白质组学发现HSP 70含量与罗非鱼质构品质具有相关性,但并未对机理进行深入研究。宰杀后冷藏罗非鱼鱼肉中HSP 70含量变化如图7所示,HSP 70含量呈先升高后下降的趋势,且在4 h时达到最大值,为初始值的1.33倍,在4~48 h内呈下降趋势,48 h时相比初始值下降了22.27%。细胞损伤的刺激导致HSP 70的合成,HSP 70含量在短时间内剧烈增加。HSP 70含量减少可能是由于内源蛋白酶的作用,张喜才[9]通过体外模拟实验发现石斑鱼中组织蛋白酶L对HSP 70具有良好的降解效果,其降解率达到90%。
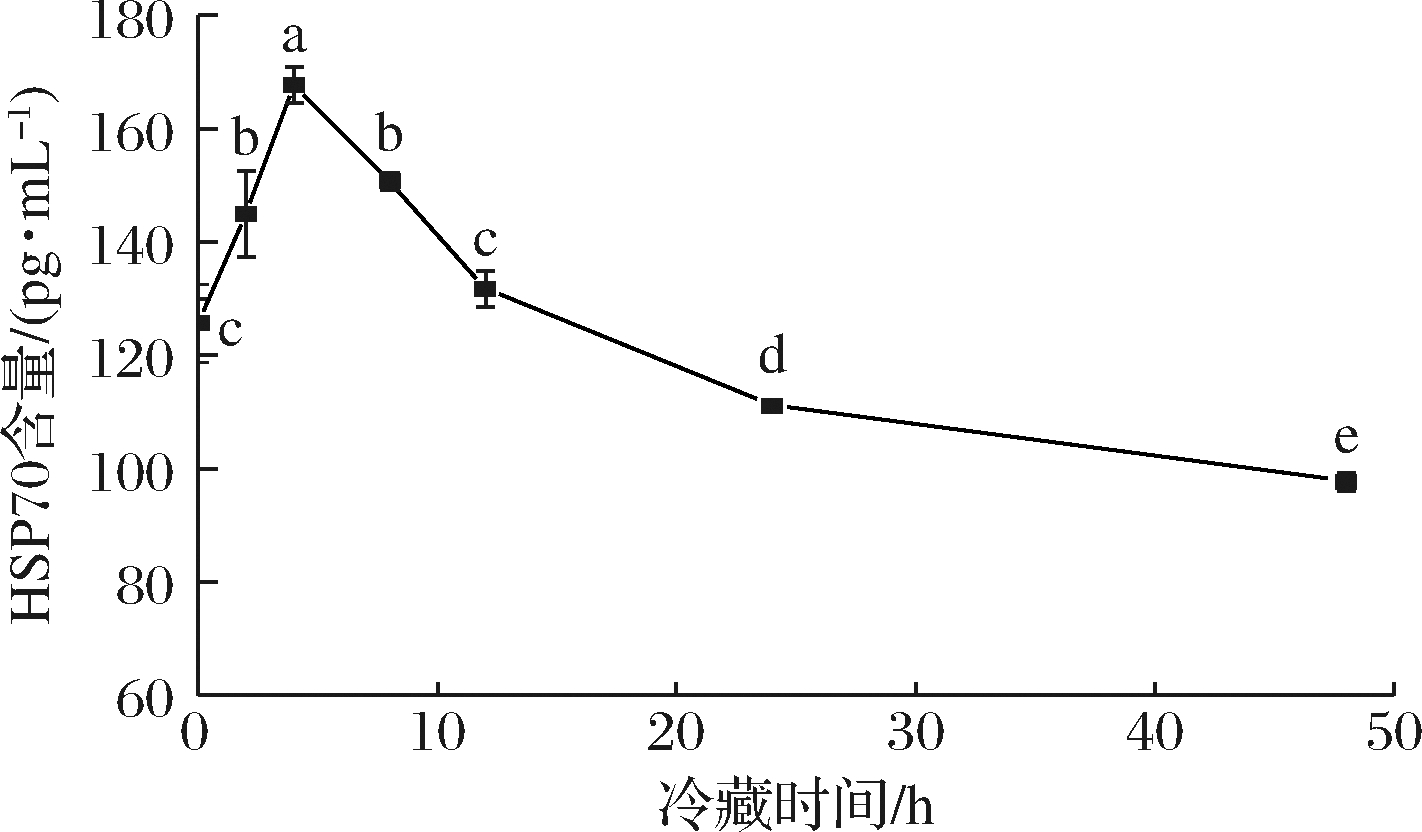
图7 冷藏过程中罗非鱼鱼肉中HSP 70含量变化
Fig.7 Changes of HSP70 content in tilapia during refrigeration
2.6 MFI、内源蛋白酶活性、HSP70含量、dMHC和dAC含量相关性分析
罗非鱼鱼肉贮藏期间MFI和HSP 70含量变化与组织蛋白酶B、L、D、钙激活蛋白酶活性、dMHC及dAC含量的相关性分析如表2所示。鱼肉MFI与组织蛋白酶B、L活性呈极显著正相关(P≤0.01),与组织蛋白酶D和钙激活蛋白酶活性无显著相关(P>0.05),表明组织蛋白酶B、L是可能直接参与鱼肉质构劣化的组织蛋白酶,这与葛黎红[7]的研究结果一致。可能的原因是组织蛋白酶B、L的最适pH值与贮藏期间鱼肉pH值范围相同,使其能发挥最大作用,且组织蛋白酶B、L能降解的肌原纤维蛋白种类多于组织蛋白酶D和钙激活蛋白酶。
表2 罗非鱼冷藏期间MFI、组织蛋白酶B、L、D和钙激活蛋白酶活性、HSP70含量、dMHC和dAC含量的相关性分析
Table 2 Correlation analysis of MFI, cathepsin B, L, D and calpain activities, HSP70 content, dMHC and dAC content in tilapia during refrigeration

鱼肉测定指标组织蛋白酶B活性组织蛋白酶L活性组织蛋白酶D活性钙激活蛋白酶活性dMHCdACMFI热休克蛋白70含量-0.315-0.503∗0.465∗0.322-0.636∗∗-0.629∗∗-0.434∗MFI0.938∗∗0.934∗∗0.1730.3480.825∗∗0.814∗∗1
鱼肉MFI与dMHC和dAC含量均呈极显著正相关(P≤0.01),表明肌原纤维粗丝和细丝的解离导致鱼肉肌原纤维完整性破坏;MFI与HSP 70含量呈显著负相关(P≤0.05),且HSP 70含量与dMHC和dAC呈极显著负相关(P≤0.01),表明在鱼体死后HSP 70可能与肌原纤维粗丝和细丝结合稳定其结构。HSP 70含量与组织蛋白酶B和钙激活蛋白酶活性无显著性相关(P>0.05),与组织蛋白酶D活性呈显著正相关(P≤0.05),与组织蛋白酶L呈显著负相关(P≤0.05),表明组织蛋白酶L可能具有降解HSP 70的能力,这与张喜才[9]的研究结果一致。
3 结论
贮藏期间,随着冷藏时间延长,罗非鱼样品中反应质构变化的指标MFI品质下降,组织蛋白酶B、L活性、dMHC和dAC含量呈现升高的趋势,pH呈下降的趋势,组织蛋白酶D、钙激活蛋白酶活性和HSP 70含量呈先升高后降低的趋势。通过相关性分析可知组织蛋白酶B、L可能是破坏肌原纤维完整性的两个关键作用酶;鱼体死后HSP 70可能与肌原纤维粗丝和细丝结合稳定其结构,组织蛋白酶L的介入可能导致HSP 70的降解,造成鱼肉肌原纤维粗丝和细丝的解离。因此,为了提高鱼片产品的质量,可以采取抑制组织蛋白酶B、L活性,维持HSP 70含量稳定来缓解鱼肉在贮藏期间质构劣化。
[1] 袁圆玥, 岑剑伟, 李来好, 等.二氧化碳麻醉对罗非鱼生理及品质的影响[J].南方水产科学, 2022, 18(4):147-155.
YUAN Y Y, CEN J W, LI L H, et al.Effect of carbon dioxide anesthesia on physiology and quality of tilapia[J].South China Fisheries Science, 2022, 18(4):147-155.
[2] 农业部渔业渔政管理局. 中国渔业统计年鉴[M].北京:中国农业出版社, 2021.
Fishery and Fishery Administration of the Ministry of Agriculture and Rural Affairs.China Fishery Statistical Yearbook[M].Beijing:China Agriculture Press, 2021.
[3] 刘瑞, 李睿智, 王嵬, 等.碱性蛋白酶降解鲢鱼肌原纤维蛋白的组学分析[J].中国食品学报, 2021, 21(3):43-52.
LIU R, LI R Z, WANG W, et al.Proteomics analysis of myofibrillar proteins of silver carp in degraded by alcalase[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(3):43-52.
[4] OKITANI A, ICHINOSE N, ITOH J, et al.Liberation of actin from actomyosin in meats heated to 65 ℃[J].Meat Science, 2009, 81(3):446-450.
[5] LANA A, LONGO V, DALMASSO A, et al.Omics integrating physical techniques:Aged Piedmontese meat analysis[J].Food Chemistry, 2015, 172:731-741.
[6] WANG D Y, ZHANG M H, DENG S Y, et al.Postmortem changes in actomyosin dissociation, myofibril fragmentation and endogenous enzyme activities of grass carp (Ctenopharyngodon idellus) muscle[J].Food Chemistry, 2016, 197:340-344.
[7] 葛黎红. 内源蛋白酶在低温保鲜草鱼质构劣化中的作用与控制研究[D].无锡:江南大学, 2017.
GE L H.Study on correlation of endogenous proteases with texture deterioration of grass carp (Ctenopharyngodon idella) during chilled storage and quality control[D].Wuxi:Jiangnan University, 2017.
[8] 赵妍, 罗欣, 毛衍伟, 等.小热休克蛋白对牛肉嫩度影响机制的研究进展[J].食品与发酵工业, 2021, 47(12):294-301.
ZHAO Y, LUO X, MAO Y W, et al.Research progress on the mechanism of the effect of small heat shock protein on the beef tenderness[J].Food and Fermentation Industries, 2021, 47(12):294-301.
[9] 张喜才. 石斑鱼冷藏过程中品质评价、蛋白变化以及内源性蛋白酶作用机制研究[D].上海:上海海洋大学, 2020.
ZHANG X C.Study on quality evaluation, protein changes and mechanism of endogenous protease of grouper(Epinephelus coioides) during refrigerated storage[D].Shanghai:Shanghai Ocean University, 2020.
[10] 何燕富. 三种内源性蛋白酶对罗非鱼贮藏品质的影响机理研究[D].南京:南京农业大学, 2018.
HE Y F.The effects of three endogenous proteases on storage quality of Tilapia and its mechanism[D].Nanjing:Nanjing Agricultural University, 2018.
[11] 张诗泉, 刘永峰, 葛鑫禹, 等.鸭肉宰后成熟过程中食用品质、营养品质及嫩度变化研究[J/OL].食品与发酵工业, 2022.DOI:10.13995/j.cnki.11-1802/ts.032891.
ZHANG S Q, LIU Y F, GE X Y, et al.Study on the changes of edible quality, nutritional quality and tenderness during post-slaughter maturation of duck meat[J/OL].Food and Fermentation Industries, 2022.DOI:10.13995/j.cnki.11-1802/ts.032891.
[12] MIDDE K, RICH R, MARANDOS P, et al.Comparison of orientation and rotational motion of skeletal muscle cross-bridges containing phosphorylated and dephosphorylated myosin regulatory light chain[J].Journal of Biological Chemistry, 2013, 288(10):7 012-7 023.
[13] 岑剑伟. 冰温气调结合高压静电场对罗非鱼片保鲜及其机理研究[D].广州:华南农业大学, 2016.
CEN J W.Effect of high voltage electrostatic field combined with modified atmosphere packaging and controlled freezing-point storage on the quality of tilapia fillet and its mechanism research[D].Guangzhou:South China Agricultural University, 2016.
[14] 陈春梅, 周惠健, 沈银涵, 等.煮制时间对鹅肉蛋白结构的影响[J].食品工业科技, 2021, 42(4):6-11.
CHEN C M, ZHOU H J, SHEN Y H, et al.Effect of cooking time on the protein structure of goose meat[J].Science and Technology of Food Industry, 2021, 42(4):6-11.
[15] 杨媛媛, 韩云胜, 李敬, 等.舍饲、放牧对滩羊股二头肌纤维特性及宰后成熟过程中蛋白降解的影响[J].中国畜牧兽医, 2021, 48(8):2 797-2 808.
YANG Y Y, HAN Y S, LI J, et al.Effects of concentrates and pasture feeding on muscle fiber characteristics of biceps femoris in Tan sheep and its protein degradation during postmortem aging[J].China Animal Husbandry &Veterinary Medicine, 2021, 48(8):2 797-2 808.
[16] AYALA M D, ABDEL I, SANTAELLA M, et al.Muscle tissue structural changes and texture development in sea bream, Sparus aurata L., during post-mortem storage[J].LWT - Food Science and Technology, 2010, 43(3):465-475.
[17] RIVERA-SANTIAGO R F, SRISWASDI S, HARPER S L, et al.Probing structures of large protein complexes using zero-length cross-linking[J].Methods, 2015, 89:99-111.
[18] OKITANI A, ICHINOSE N, KOZA M, et al.AMP and IMP dissociate actomyosin into actin and myosin[J].Bioscience, Biotechnology, and Biochemistry, 2008, 72(8):2 005-2 011.
[19] 施晓予, 刘雪, 刘少伟, 等.低温贮藏对鸡胸肉肌原纤维蛋白结构及热诱导凝胶性能的影响[J].食品安全质量检测学报, 2022, 13(8):2 594-2 601.
SHI X Y, LIU X, LIU S W, et al.Effects of low temperature storage on the structure and heat-induced gelation properties of myofibrillar protein prepared from chicken breast muscle[J].Journal of Food Safety &Quality, 2022, 13(8):2 594-2 601.
[20] CHEMAT F, KHAN M K.Applications of ultrasound in food technology:Processing, preservation and extraction[J].Ultrasonics Sonochemistry, 2011, 18(4):813-835.
[21] 卢涵. 鳙鱼肉低温贮藏过程中蛋白氧化、组织蛋白酶活性与品质变化规律的研究[D].北京:中国农业大学, 2017.
LU H.Protein oxidation, cathepsins activity and the quality changes of bighead carp (Aristichthys nobilis) during low-temperature storage[D].Beijing:China Agricultural University, 2017.
[22] 沈妮. 带鱼低温贮藏蛋白氧化、组织蛋白酶活性及鱼肉质地结构的变化规律[D].杭州:浙江大学, 2019.
SHEN N.Protein oxidation, cathepsins activity, texture and structure of muscle changes of hairtail during low-temperature storage[D].Hangzhou:Zhejiang University, 2019.
[23] 孙蕾蕾, 黄卉, 李来好, 等.影响宰后鱼肉能量代谢和质构的酶及其活性测定方法研究进展[J].食品科学, 2014, 35(11):348-355.
SUN L L, HUANG H, LI L H, et al.Enzymes associated with postmortem energy metabolism and texture of fish muscle and assays to detect them[J].Food Science, 2014, 35(11):348-355.
[24] MIDDLETON A J.A Structural Basis for Different Antifreeze Protein Roles[M].Kingston:Queen’s University, 2012.
[25] CARVALHO M E, GASPARIN G, POLETI M D, et al.Heat shock and structural proteins associated with meat tenderness in Nellore beef cattle, a Bos indicus breed[J].Meat Science, 2014, 96(3):1 318-1 324.
[26] LOMIWES D, FAROUK M M, WIKLUND E, et al.Small heat shock proteins and their role in meat tenderness:A review[J].Meat Science, 2014, 96(1):26-40.