利用蛋白酶酶解制备生物活性肽可显著改善蛋白质原有的理化功能特性,如降低蛋白黏度、增加表面疏水性等,同时多肽与大分子蛋白质相比具有独特的生物活性,因此多肽在未来食品加工领域中可能具有更高的应用价值。通过酶解制备得到的生物活性肽不仅具有较强的生物活性,也具备诸多良好的功能特性。江锟[1]发现经胰蛋白酶酶解后的鲈鱼蛋白多肽相较于鲈鱼蛋白表现出更好的溶解性、起泡性以及乳化性。崔帅[2]研究发现鲻鱼抗氧化肽具有较好的溶解性、起泡性以及乳化性等基本功能特性。姜海洋[3]对牦牛骨抗氧化肽的吸油性、乳化性以及起泡性等基本特性进行了研究。
生物活性肽的活性与其分子质量息息相关,因此要获得较高活性的多肽通常需要经过一系列的分离纯化。目前对多肽进行分离纯化的方法较多,其中超滤技术以操作简单、分离系数高、分离前后样品不发生相变等特点得到广泛应用[4]。众多研究表明,通过超滤截留可以获得生物活性更高的多肽组分,何小庆[5]对波纹巴非蛤酶解产物进行超滤截留发现分子质量较低的超滤组分具有更高的脾淋巴细胞相对增殖率。慈傲特[6]对山核桃多肽酶解产物进行超滤分离发现<3 kDa超滤组分相比其他分子质量组分具有更强的抗氧化活性。徐兆刚[7]对河蚌抗氧化肽进行超滤截留发现<3 kDa超滤组分的还原力显著高于未进行超滤截留的河蚌多肽以及其他分子质量的超滤组分。
综上所述,研究生物活性肽的功能特性对于其后续的开发与应用具有重要的意义,因此,本文通过超滤截留获得不同分子质量的鲐鱼多肽,测定鲐鱼多肽不同分子质量组分的基本功能特性,同时研究各分子质量组分的抗氧化活性与免疫活性,以期为今后利用鲐鱼多肽进行加工应用提供参考,也希望能为海洋低值鱼的高值化加工利用奠定一定的理论基础。
1 材料与方法
1.1 材料与试剂
新鲜鲐鱼,购于宁波市路林市场;中性蛋白酶、刀豆蛋白A(concanavalin A,Con A)、脂多糖(lipopolysaccharide,LPS)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide,MTT],索莱宝生物科技有限公司;DPPH,阿拉丁试剂有限公司;小鼠脾淋巴细胞,上海赛百慷生物科技有限公司,由本实验室复苏培养;小鼠单核巨噬细胞RAW 264.7,中科院上海细胞所,由本实验传代培养;胎牛血清、RPMI-1640培养基、DMEM培养基,美国Gibco公司;其余试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
Labscale TFF超滤系统,美国Millipore公司;超低温高速离心机,日本日立公司;倒置显微镜,日本OLYMPUS公司;超净工作台,上海智诚分析仪器制造公司;CO2细胞培养箱,美国Thermo公司;酶标仪,美国Bio-Rad公司;LCJ-25C型冷冻干燥机,北京四环科学仪器厂有限公司产品。
1.3 实验方法
1.3.1 鲐鱼多肽的制备
根据前期优化实验确定的制备条件进行恒温水浴酶解,称取100 g鲐鱼鱼肉,以料液比1∶5(g∶mL)添加pH 7.0的磷酸盐缓冲溶液,选用中性蛋白酶进行酶解,酶添加量为8 800 U/g,52 ℃酶解7 h,酶解结束后沸水浴灭酶30 min,于10 000 r/min离心20 min,取一部分上清液进行真空冷冻干燥,为后续实验中酶解液组的样品,取另一部分上清液进行下一步超滤分级。
1.3.2 超滤分级
取上述酶解上清液,先经0.45 μm微孔滤膜过滤,以去除原酶解液中残留的固形物及杂质,防止在超滤时造成滤膜堵塞,影响超滤分离效果。本试验采用截留分子质量为10和5 kDa的滤膜进行逐级分离,得到3个超滤组分,分子质量分别为>10 kDa、5~10 kDa、<5 kDa,超滤进口压力控制在0.25 MPa。将超滤截留得到的组分进行真空冷冻干燥,保持干燥状态保存于-40 ℃冰箱中。
1.3.3 鲐鱼多肽不同分子质量组分水解度的测定
水解度根据公式(1)计算,其中氨基酸态氮含量采用GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》中的酸度计法测定;总氮含量采用GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法测定。
水解度![]()
(1)
1.3.4 鲐鱼多肽不同分子质量组分的基本功能特性
1.3.4.1 溶解性测定
参考刘建垒[8]的方法并略作修改,取0.2 g样品溶于20 mL蒸馏水中,分别调节样品溶液pH至3、4、5、6、7、8、9、10、11,室温下涡旋搅拌1 h,8 000 r/min离心15 min,以牛血清蛋白为标准测定上清液中蛋白含量,以凯式定氮法测定样品中蛋白含量,溶解性按照公式(2)计算。
溶解性![]()
(2)
1.3.4.2 持水性测定
参考NOMAN等[9]的方法并略作修改,取0.5 g样品,加入10 mL蒸馏水,涡旋30 s后室温静置6 h,3 000 r/min离心20 min,测定加入蒸馏水体积与离心后上清液体积之差。持水性以每克样品吸附水的体积(mL)表示。
1.3.4.3 持油性测定
参考张思思[10]的方法并略作修改,取0.5 g样品,加入5 mL大豆油,涡旋30 s后室温静置6 h,3 000 r/min离心20 min,测定所加大豆油体积和离心后上清液体积之差。持油性以每克样品吸附大豆油的体积(mL)表示。
1.3.4.4 起泡性与起泡稳定性
参考李永武[11]的方法并略作修改,用0.2 mol/L的pH 7.0的磷酸盐缓冲溶液配制10 g/L的样品溶液,取100 mL样液,10 000 r/min均质2 min,分别记录均质停止时、静置30 min后的泡沫体积。起泡性和起泡稳定性按公式(3)、公式(4)计算。
起泡性![]()
(3)
起泡稳定性![]()
(4)
式中:V0,均质停止时的泡沫体积,mL;V30,均质停止30 min后的泡沫体积,mL。
1.3.4.5 乳化性与乳化稳定性
参考PEARCE等[12]的方法并略作修改,用0.2 mol/L的pH 7.0的磷酸盐缓冲溶液配制1 g/L的样品溶液,取15 mL样液,加入5 mL大豆油,10 000 r/min均质2 min,分别在均质结束和静置10 min后取乳液100 μL,以体积分数0.1% SDS溶液稀释100倍,混匀后于500 nm处测定吸光值,0.1% SDS作空白对照。乳化性和乳化稳定性按公式(5)、公式(6)计算。
乳化性![]()
(5)
乳化稳定性![]()
(6)
式中:n,稀释倍数;A,500 nm处乳化液的吸光值;ρ,样品质量浓度,g/mL;φ,乳化液中油相的比例;A0,初始乳化液的吸光值;A10,10 min时的吸光值。
1.3.5 鲐鱼多肽不同分子质量组分的抗氧化活性
1.3.5.1 DPPH自由基清除率测定
参考罗敏等[13]的方法并略作修改,取3 mL样品溶液(取冷冻干燥后的样品溶于蒸馏水,样品质量浓度为500 μg/mL),加入3 mL 0.2 mmol/L DPPH溶液,避光条件下反应30 min,用蒸馏水进行调零,于517 nm处测定吸光值,维生素C作为对照组。DPPH自由基清除率按公式(7)计算。
清除率![]()
(7)
式中:A0,3 mL蒸馏水+3 mL DPPH的吸光值;A,3 mL样品溶液+3 mL DPPH的吸光值。
1.3.5.2 ·OH清除率的测定
参考申彩红[14]的方法并略作修改,取1 mL样品溶液,加入1 mL 9 mmol/L的FeSO4和水杨酸-乙醇溶液,最后加入1 mL体积分数0.1% H2O2,混匀,37 ℃反应1 h,于510 nm处测定吸光值,维生素C作为对照组。·OH清除率按公式(8)计算。
清除率![]()
(8)
式中:A1,样品溶液的吸光值;A2,等体积蒸馏水代替H2O2的吸光值;A0,等体积蒸馏水代替样品溶液的吸光值。
1.3.6 鲐鱼多肽不同分子质量组分的免疫活性
1.3.6.1 小鼠脾淋巴细胞相对增殖率的测定
参考李志永[15]的方法并略做修改,以MTT法测定小鼠脾淋巴细胞相对增殖率。选取对数生长期的小鼠脾淋巴细胞进行实验,调整细胞浓度为5×105个/mL。样品组每孔加入100 μL细胞悬液和100 μL样品溶液(样品质量浓度为500 μg/mL,取冻干后的样品粉末以RPMI-1640完全培养基溶解,经0.22 μm无菌滤膜过滤),Con A组加入100 μL细胞悬液和100 μL含有Con A的细胞培养基(Con A终质量浓度为25 μg/mL,以RPMI-1640完全培养基配制,经0.22 μm无菌滤膜过滤),空白组以相同体积的RPMI-1640完全培养基代替样品,每组设5个复孔,在96孔板的最外圈每孔加入200 μL无菌PBS,置于37 ℃、5% CO2细胞培养箱中培养48 h,避光条件下,每孔加入20 μL MTT溶液(质量浓度为5 mg/mL,以无菌PBS溶解,经0.22 μm无菌滤膜过滤),继续培养4 h、4 000 r/min离心5 min,弃去上清液,每孔加入100 μL 二甲基亚砜(dimethyl sulfoxide,DMSO),室温振荡2 min,测定593 nm处的吸光值,根据公式(9)计算小鼠脾淋巴细胞相对增殖率。
相对增殖率![]()
(9)
式中:A1,样品组在593 nm处的吸光值;A0,空白组在593 nm处的吸光值。
1.3.6.2 小鼠单核巨噬细胞RAW 264.7相对增殖率的测定
参考胡旭阳[16]的方法并略作修改。采用MTT法测定小鼠单核巨噬细胞RAW 264.7细胞相对增殖率。倒置显微镜下观察小鼠单核巨噬细胞RAW 264.7的贴壁状态,选择对数生长期的细胞进行实验,调整细胞浓度为4×105个/mL。每孔接种200 μL细胞悬液,置于37 ℃、5%CO2细胞培养箱中培养24 h,吸弃上清液,样品组加入200 μL样品溶液(样品质量浓度为500 μg/mL,取冻干后的样品粉末溶于含有体积分数10%胎牛血清的DMEM培养基,经0.22 μm无菌滤膜过滤)。空白对照组加入200 μL含有体积分数10%胎牛血清的DMEM培养基。阳性对照组加入200 μL含有LPS的细胞培养基(LPS终质量浓度为10 μg/mL,用含体积分数10%胎牛血清的DMEM培养基配制,经0.22 μm无菌滤膜过滤),每组设5个复孔。继续培养48 h,根据公式(10)计算小鼠单核巨噬细胞RAW 264.7相对增殖率。
相对增殖率![]()
(10)
式中:A1,样品组在593 nm处的吸光值;A0,空白组在593 nm处的吸光值。
1.3.7 鲐鱼多肽不同分子质量组分的氨基酸组成分析
根据GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》测定鲐鱼多肽的氨基酸含量。
1.3.8 数据分析
所有数据均用平均值±标准偏差(n=5)表示。采用Excel 2019进行数据处理及绘图,采用SPSS 22.0软件进行数据显著性分析。
2 结果与分析
2.1 鲐鱼多肽不同分子质量组分的水解度
研究表明,水解度高低会在一定程度上影响多肽的功能特性,因此在研究鲐鱼多肽的功能特性之前有必要对其水解度进行测定。由图1可知,鲐鱼多肽经过超滤截留后,水解度发生明显变化,而且随着分子质量的降低,鲐鱼多肽的水解度显著升高(P<0.05),其中未经超滤截留的鲐鱼多肽原酶解液的水解度为51.92%,鲐鱼多肽<5 kDa超滤组分的水解度为57.27%,显著高于原酶解液和其他分子质量组分(P<0.05)。这可能是因为经过超滤截留富集了酶解液中的小分子肽,导致水解度升高。文飞[17]对羊肝蛋白经碱性蛋白酶酶解后的酶解液进行超滤截留,发现羊肝多肽不同分子质量超滤组分的水解度与原酶解液相比差异显著,其中<3 kDa超滤组分的水解度最高,达60.54%,而原酶解液的水解度仅为40.31%。
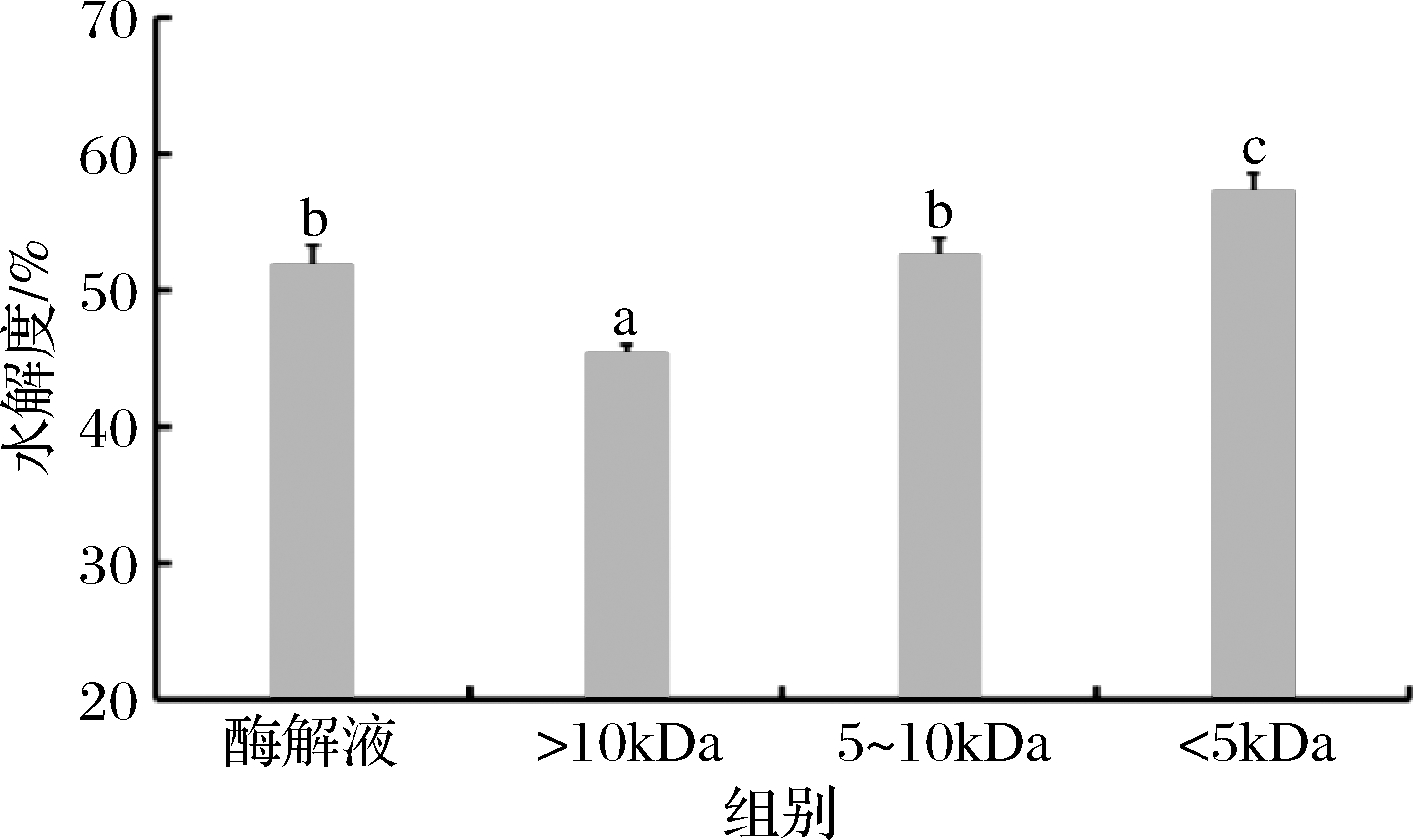
图1 鲐鱼多肽各超滤组分的水解度
Fig.1 Hydrolysis of different molecular weight components of chub mackerel peptides
注:组间不同字母表示存在显著差异(P<0.05)(下同)。
2.2 鲐鱼多肽不同分子质量组分的溶解性
多肽的溶解性高低会影响多肽其他的功能特性,由图2可知,当pH为3~11时,鲐鱼多肽均具有较好的溶解性,其中鲐鱼多肽<5 kDa超滤组分的溶解性最好。当pH为3~5时,随着pH的增加,鲐鱼多肽的溶解性均呈现下降趋势,当pH为5时,鲐鱼多肽原酶解液与各分子质量组分的溶解性均达到最低,此时>10 kDa超滤组分的溶解性为75.12%。当pH为5~7时,鲐鱼多肽的溶解性均随着pH的上升而增加。当pH为7~11时,鲐鱼多肽的溶解性均未有明显的升高。邓成萍等[18]对大豆多肽进行功能特性研究时发现不同pH值条件下,大豆多肽的溶解性比大豆分离蛋白好,且随着分子质量减小,大豆多肽溶解性呈现升高趋势。慈傲特[6]分别通过3、5、10 kDa的滤膜对山核桃粕蛋白酶解产物进行超滤分级,研究发现各超滤组分在pH 3~11的溶解性均大于60%。
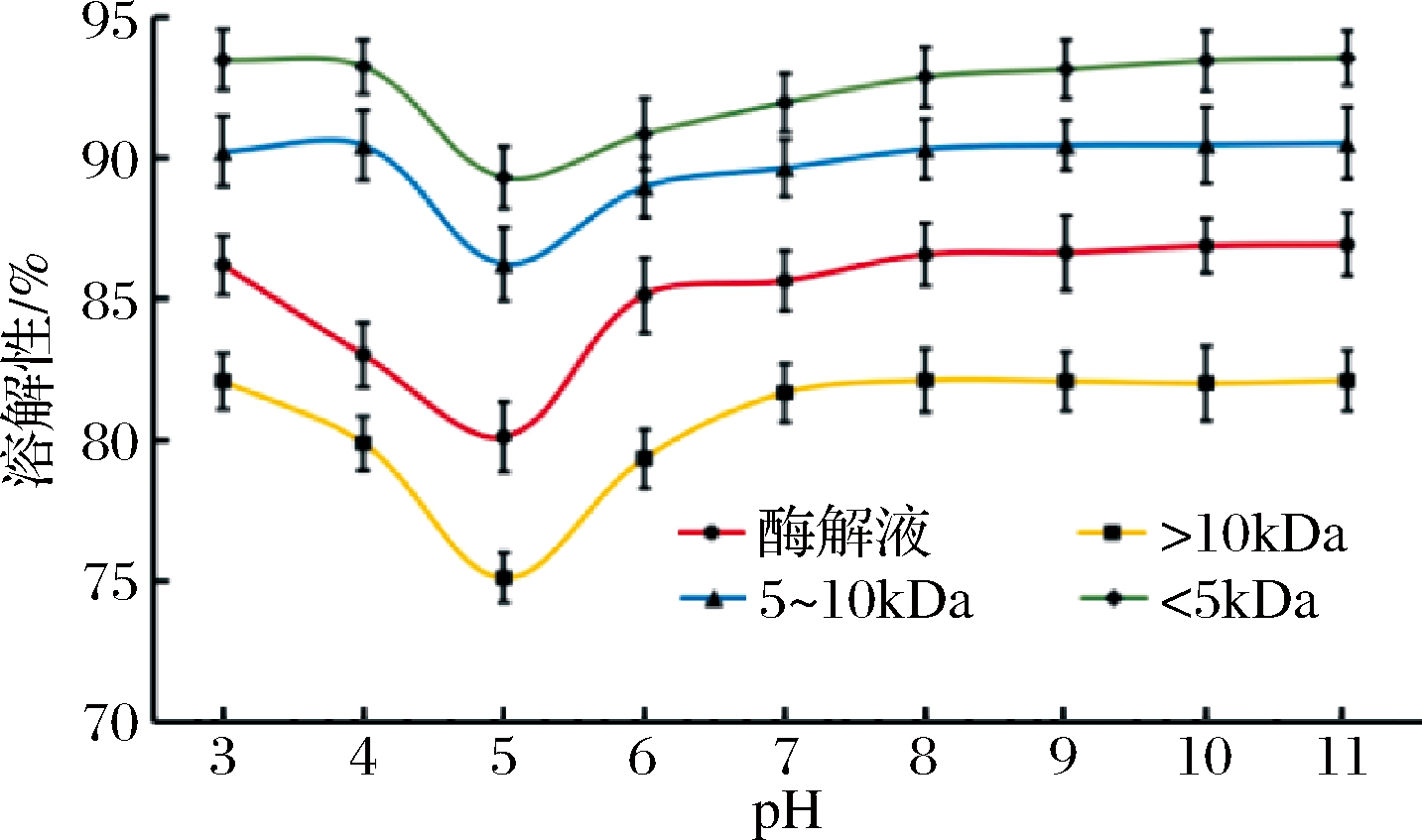
图2 鲐鱼多肽不同分子质量组分的溶解性
Fig.2 Solubility of different molecular weight components of chub mackerel peptides
2.3 鲐鱼多肽不同分子质量组分的持水性
持水性又称保水性,是蛋白质功能特性的一种,研究表明持水性的强弱容易受到其分子质量大小以及内部肽链的空间结构等的影响。由图3可知,鲐鱼多肽原酶解液与各超滤组分的持水性存在显著差异(P<0.05),随着分子质量的降低,鲐鱼多肽的持水性呈现下降趋势,鲐鱼多肽<5 kDa超滤组分的持水性最差,且显著低于原酶解液与其他分子质量组分,鲐鱼多肽>10 kDa超滤组分与5~10 kDa超滤组分的持水性要显著高于原酶解液的持水性(P<0.05)。祝靖等[19]研究不同分子质量的海鲈鱼胶原蛋白肽组分的功能特性时发现,低分子质量多肽组分的持水性明显弱于大分子质量多肽组分。
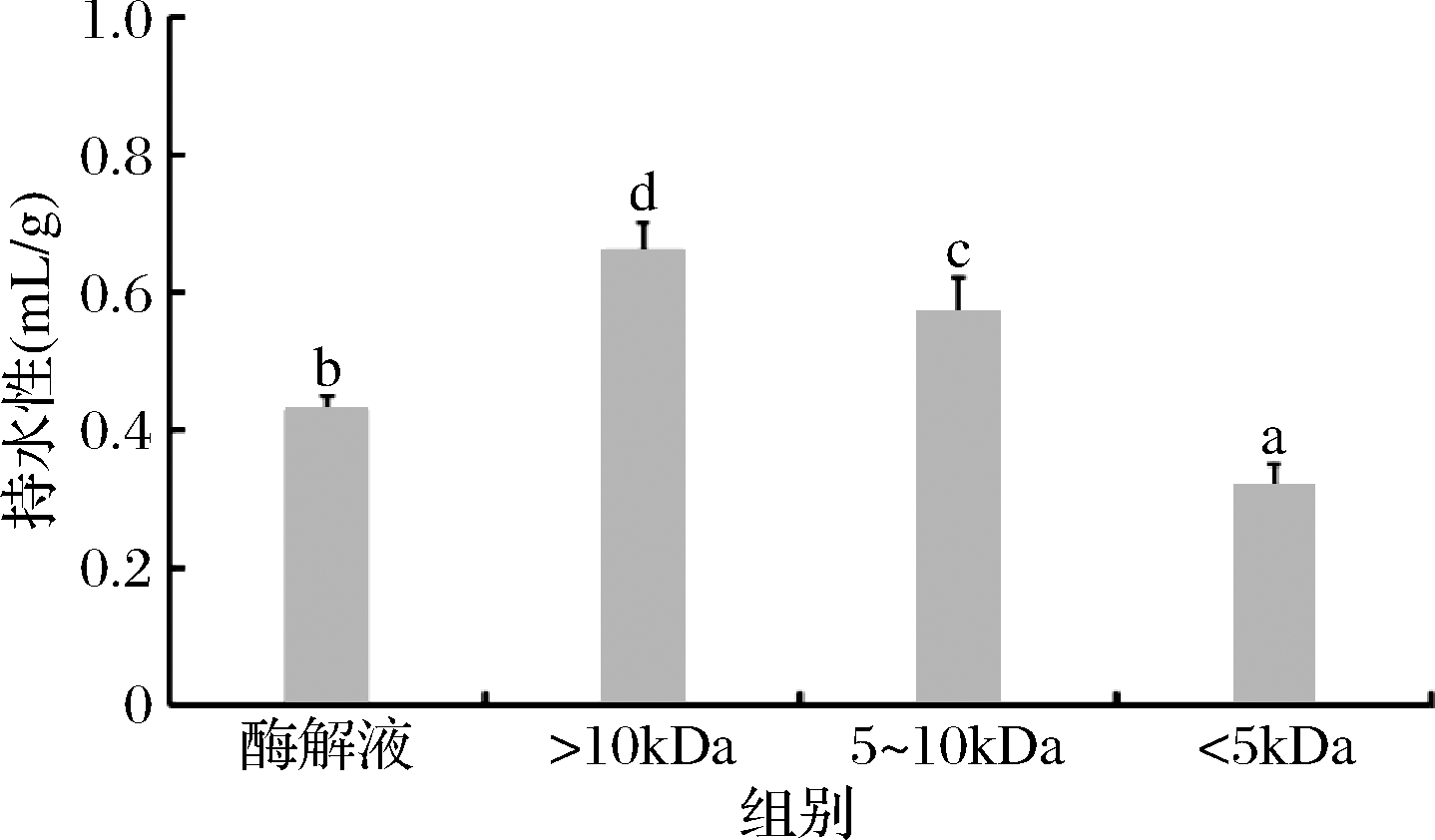
图3 鲐鱼多肽不同分子质量组分的持水性
Fig.3 Water-holding of different molecular weight components of chub mackerel peptides
2.4 鲐鱼多肽不同分子质量组分的持油性
由图4可知,鲐鱼多肽原酶解液与各超滤组分的持油性存在显著差异(P<0.05),随着分子质量的减少,鲐鱼多肽的持油性不断提高,其中鲐鱼多肽<5 kDa超滤组分的持油性显著高于原酶解液与其他分子质量的超滤组分(P<0.05),同时也可以看出,鲐鱼多肽原酶解液的持油性显著高于>10 kDa超滤组分和5~10 kDa超滤组分(P<0.05)。研究发现多肽的持油性大小与肽链中含有的疏水性基团之间存在着一定的联系,鲐鱼多肽不同分子质量组分之间的持油性存在明显差别可能是因为中性蛋白酶酶切作用改变了大分子蛋白质内部原本的疏水性基团分布位点,且随着分子质量的减小,鲐鱼多肽超滤组分中小分子肽含量越多,疏水性基团的暴露可能越明显,从而使样品的持油性变高。
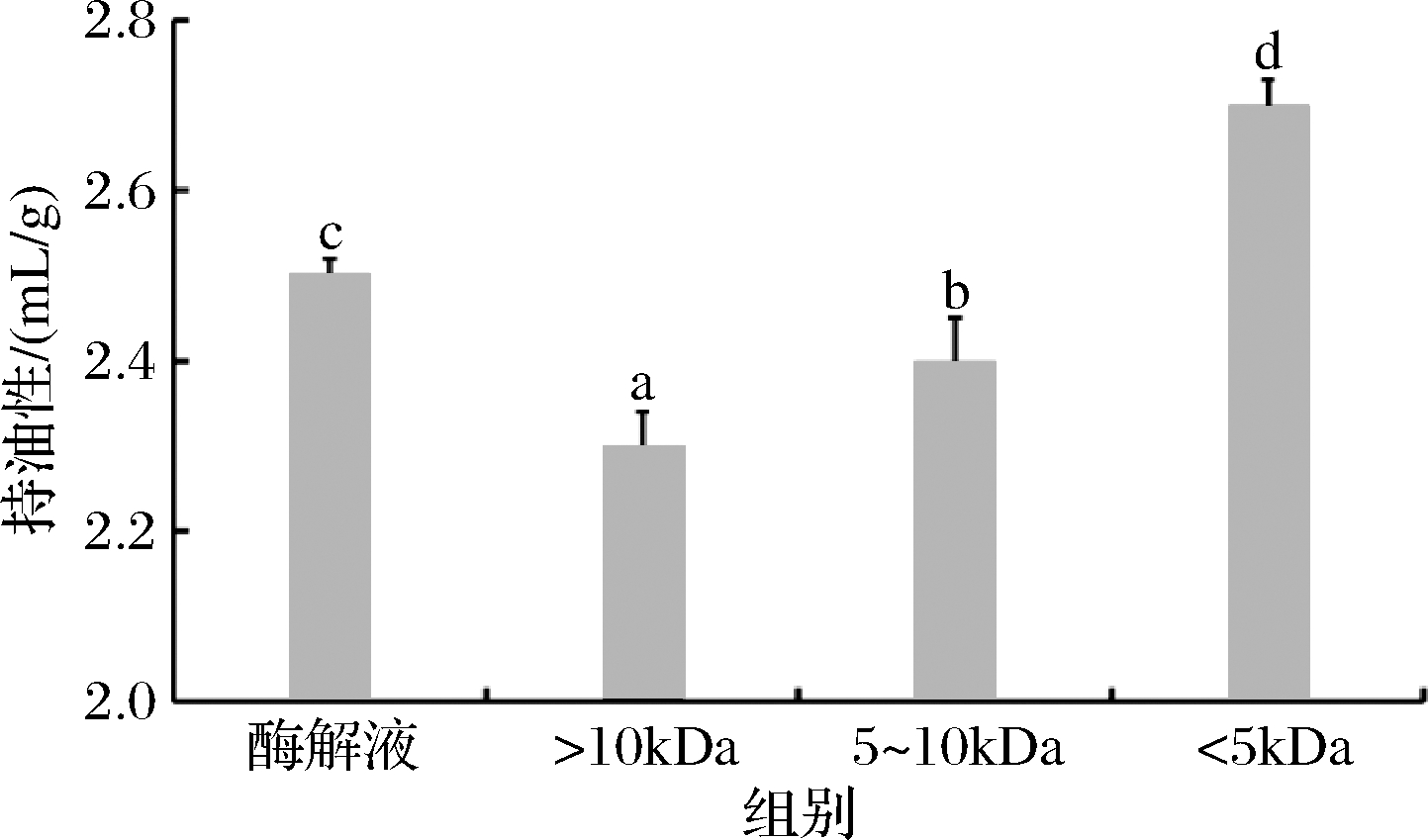
图4 鲐鱼多肽不同分子质量组分的持油性
Fig.4 Oil-holding capacity of different molecular weight components of chub mackerel peptides
2.5 鲐鱼多肽不同分子质量组分的起泡性与起泡稳定性
由图5可知,鲐鱼多肽不同分子质量组分间的起泡性与起泡稳定性相差较大,且随着分子质量的降低,二者均呈现下降趋势,其中>10 kDa超滤组分的起泡性与起泡稳定性显著高于其他分子质量组分(P<0.05)。已有研究发现多肽的起泡能力与其分子质量大小密切相关,因为随着分子质量的减小,样品溶液中多肽肽链变短,肽段的黏性降低,表面形成的液膜越脆弱,导致其起泡性与稳定性变差[20]。因此>10 kDa超滤组分的起泡性与起泡稳定性较好可能是因为溶液中肽链较长,导致分子间黏性增强,更有利于泡沫的形成及其稳定性。这一点与徐兆刚[7]对河蚌抗氧化肽超滤组分起泡性的研究结果相似。
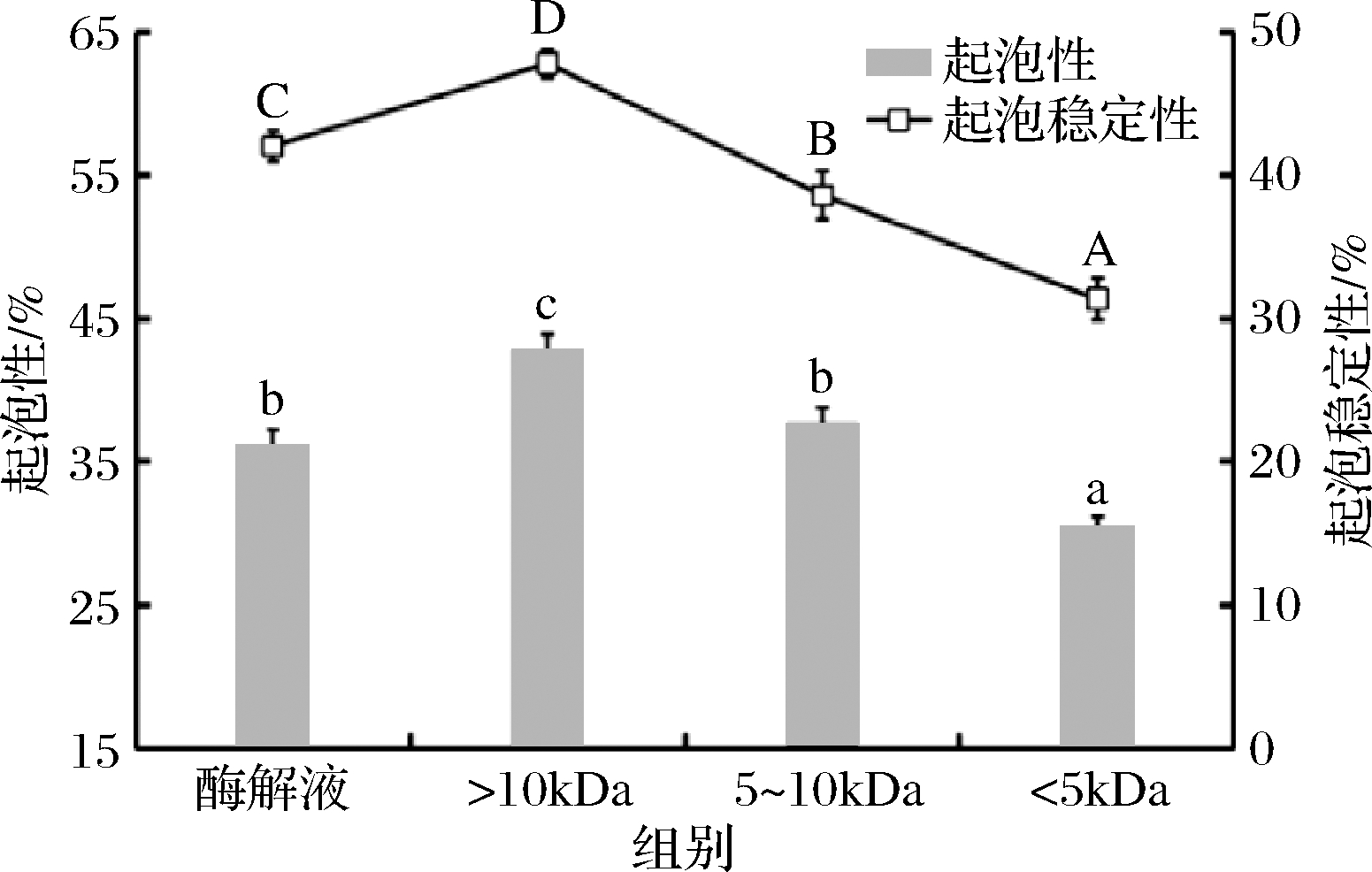
图5 鲐鱼多肽不同分子质量组分的起泡性与起泡稳定性
Fig.5 Foaming ability and foaming stability of different molecular weight components of chub mackerel peptides
2.6 鲐鱼多肽不同分子质量组分的乳化性与乳化稳定性
研究发现影响多肽乳化性的因素有很多,除了其表面基团的特性外,还与分子质量大小、溶解性高低等因素有关[21]。王金水[22]研究发现,对蛋白质进行适度酶解有助于乳化性质的改善。由图6可知,鲐鱼多肽不同分子质量组分之间的乳化性与乳化稳定性存在一定差别,随着分子质量的降低,乳化性与乳化稳定性均呈先上升后下降的趋势,其中鲐鱼多肽5~10 kDa超滤组分的乳化性与乳化稳定性显著高于鲐鱼多肽原酶解液与其他分子质量组分(P<0.05)。<5 kDa超滤组分的乳化性与乳化稳定性最低,这可能是因为<5 kDa超滤组分的水解度较高,所含肽段分子质量小,致使过多的疏水基团暴露,从而使乳化性降低。同时因为分子质量低,肽链较短,分子之间空间结构的作用力减弱,从而阻碍油水界面上保护膜的形成,致使乳化稳定性降低。该结果与文飞[17]对羊肝多肽各超滤分级组分的乳化性与乳化稳定性研究结果类似。
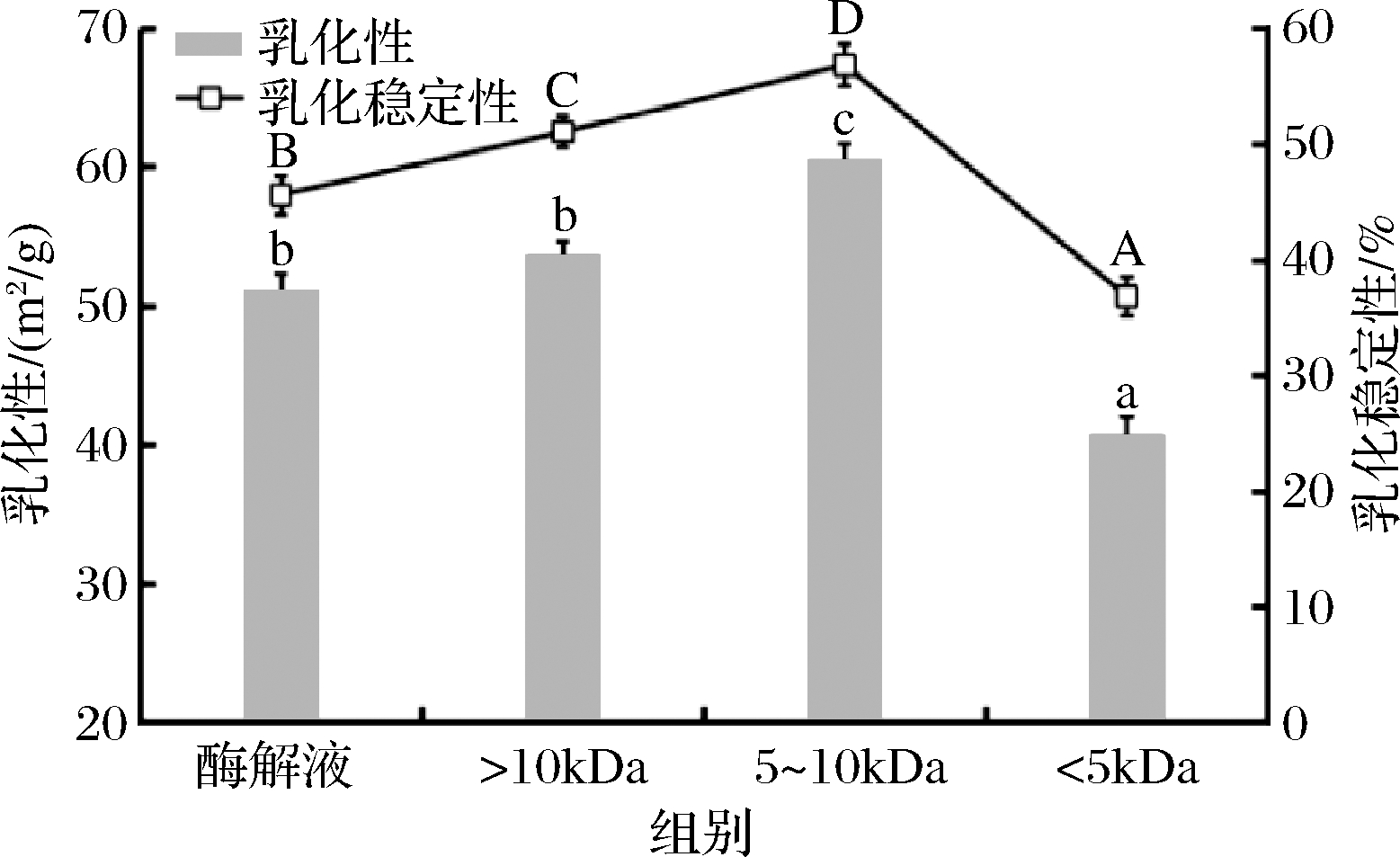
图6 鲐鱼多肽不同分子质量组分的乳化性与乳化稳定性
Fig.6 Emulsifying ability and emulsifying stability of different molecular weight components of chub mackerel peptides
2.7 鲐鱼多肽不同分子质量组分的抗氧化活性
2.7.1 鲐鱼多肽不同分子质量组分的DPPH自由基清除率
多肽的抗氧化能力与分子质量大小存在着一定的联系,如图7所示,鲐鱼多肽不同分子质量组分均具有一定的清除DPPH自由基的能力,且随着分子质量的降低,DPPH自由基清除率呈现上升趋势,鲐鱼多肽<5 kDa超滤组分的DPPH自由基清除率显著高于鲐鱼多肽原酶解液与其他分子质量组分(P<0.05),其DPPH自由基清除率为74.18%。鲐鱼多肽原酶解液的DPPH自由基清除率为59.88%。毕秋芸[23]对裙带菜多肽进行超滤分级发现<1 kDa组分的抗氧化能力强于5~10 kDa和>10 kDa超滤组分的抗氧化能力。
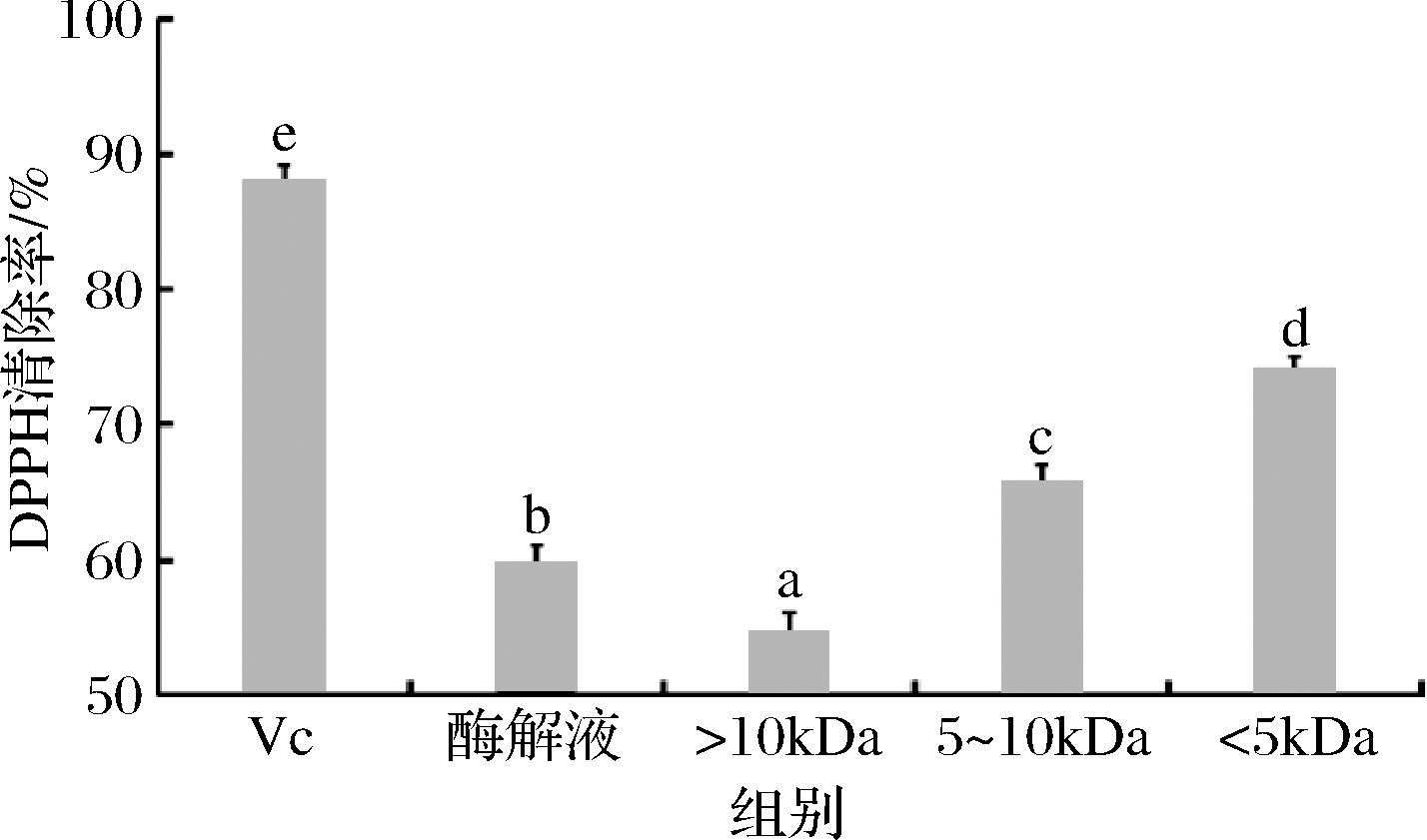
图7 鲐鱼多肽不同分子质量组分的DPPH自由基清除率
Fig.7 DPPH free radical scavenging rate of different molecular weight components of chub mackerel peptides
2.7.2 鲐鱼多肽不同分子质量组分的·OH清除率
如图8所示,鲐鱼多肽原酶解液与各超滤组分均表现出较强的·OH清除能力,随着分子质量的降低,鲐鱼多肽各超滤组分的·OH清除率呈上升趋势,鲐鱼多肽<5 kDa超滤组分的·OH清除率为77.60%,显著高于鲐鱼多肽原酶解液和其他超滤组分(P<0.05),该结果与牛瑞等[24]对鳕鱼多肽进行超滤截留后各分子质量组分的·OH清除率结果相似。
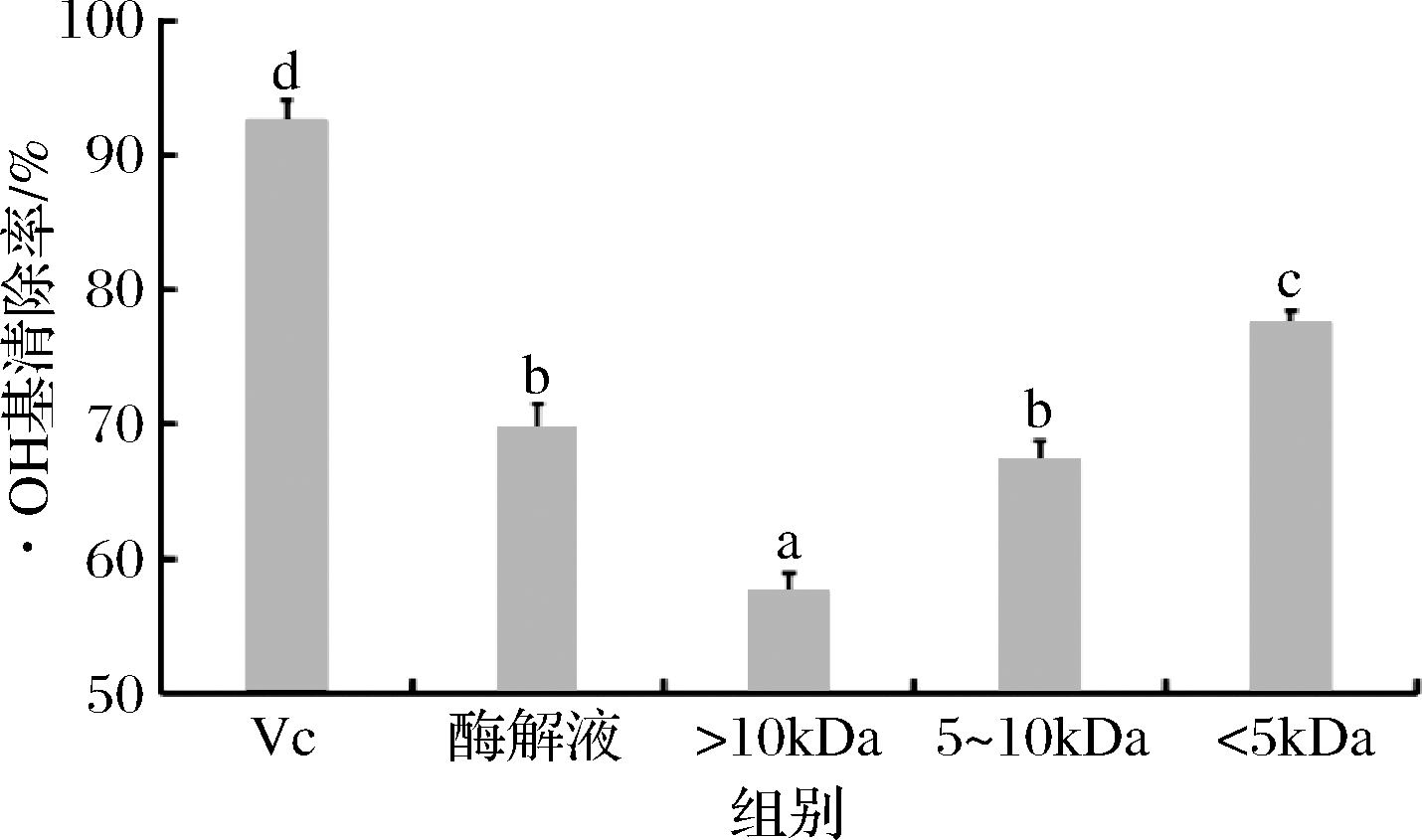
图8 鲐鱼多肽不同分子质量组分的·OH清除率
Fig.8 Hydroxyl radical scavenging rate of different molecular weight components of chub mackerel peptides
2.8 鲐鱼多肽不同分子质量组分的免疫活性
2.8.1 鲐鱼多肽不同分子质量组分的小鼠脾淋巴细胞相对增殖率
Con A是一种非特异性有丝分裂源,能够促进小鼠脾淋巴细胞增殖转化,由图9可知,经Con A处理后的小鼠脾淋巴细胞相对增殖率显著高于鲐鱼多肽各分子质量组分(P<0.05),其细胞相对增殖率达60.06%。随着分子质量的降低,鲐鱼多肽对小鼠脾淋巴细胞的增殖效果呈升高趋势,其中<5 kDa超滤组分的小鼠脾淋巴细胞相对增殖率为56.78%,显著高于鲐鱼多肽原酶解液与其他分子质量组分(P<0.05)。同时也可以看出,鲐鱼多肽原酶解液的小鼠脾淋巴细胞相对增殖率显著高于>10 kDa超滤组分与5~10 kDa超滤组分(P<0.05),其细胞相对增殖率为52.28%,这可能是因为原酶解液中多肽分子质量分布不均一,活性成分未进行分离,其中含有较多的低分子质量的活性肽段。李婉等[25]对牡蛎酶解产物进行10、5、2.5 kDa超滤截留,发现各超滤组分均具有较强的免疫活性,其中分子质量较小的<2.5 kDa超滤组分和2.5~5 kDa超滤组分免疫活性最佳。
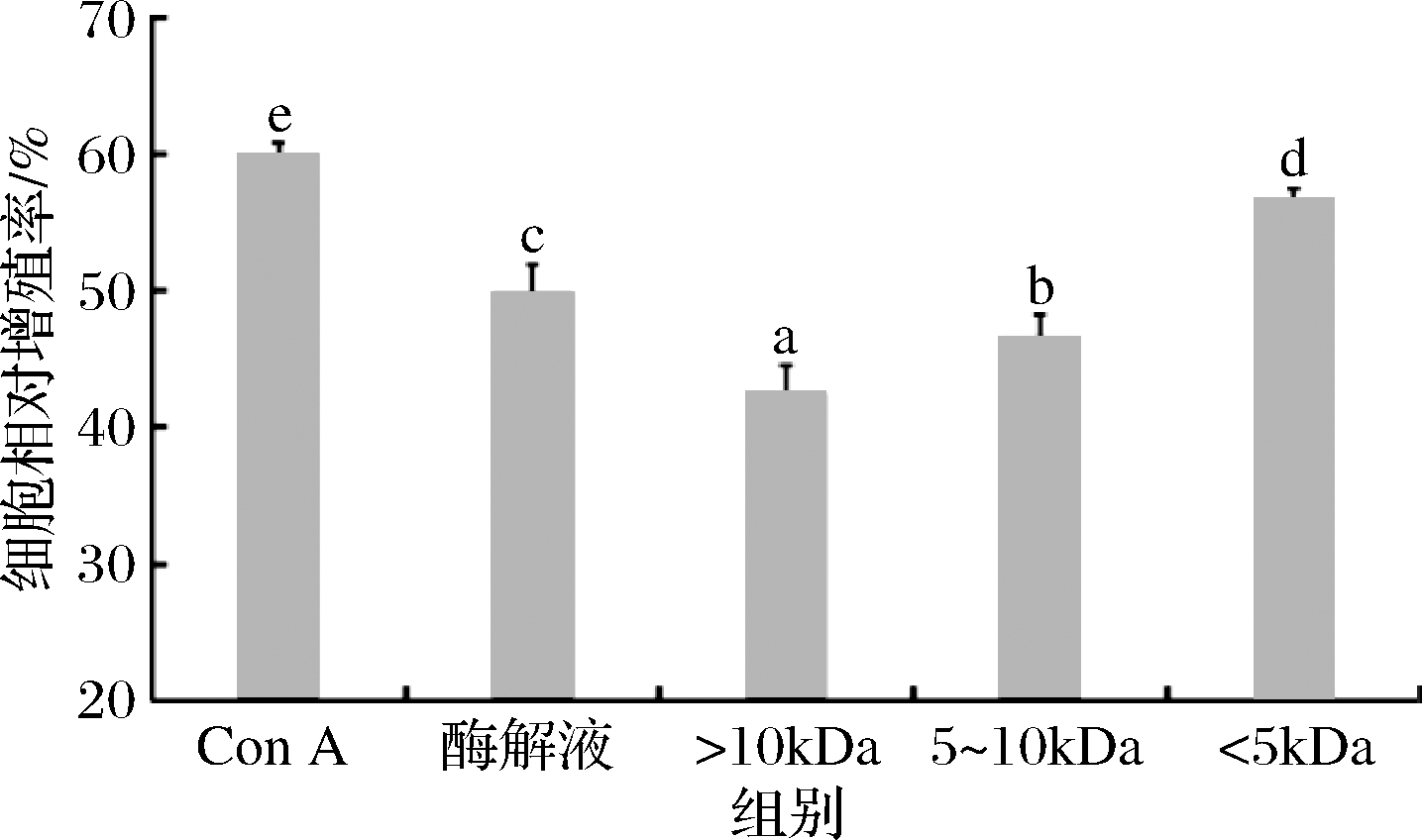
图9 鲐鱼多肽不同分子质量组分的脾淋巴细胞相对增殖率
Fig.9 Relative proliferation rate of spleen lymphocytes of different molecular weight components of chub mackerel peptides
2.8.2 鲐鱼多肽不同分子质量组分的小鼠单核巨噬细胞RAW 264.7相对增殖率
LPS是一种由革兰氏阴性菌产生的病原体,研究发现其具有能激活巨噬细胞功能,进而促进巨噬细胞增殖的特点,故常被用作阳性对照出现在测定巨噬细胞免疫活性的相关研究中。如图10所示,经LPS处理后的小鼠单核巨噬细胞RAW 264.7细胞相对增殖率达69.10%,显著高于鲐鱼多肽各分子质量组分的细胞相对增殖率(P<0.05)。同时也可以看出鲐鱼多肽各分子质量组分对小鼠单核巨噬细胞RAW 264.7均有一定的促进增殖的作用,且随着分子质量的降低,细胞相对增殖率呈现升高趋势,其中<5 kDa超滤组分的细胞相对增殖率为57.22%,显著高于鲐鱼多肽原酶解液与其他分子质量组分(P<0.05)。其中原酶解液的小鼠单核巨噬细胞RAW 264.7的细胞相对增殖率为50.20%。
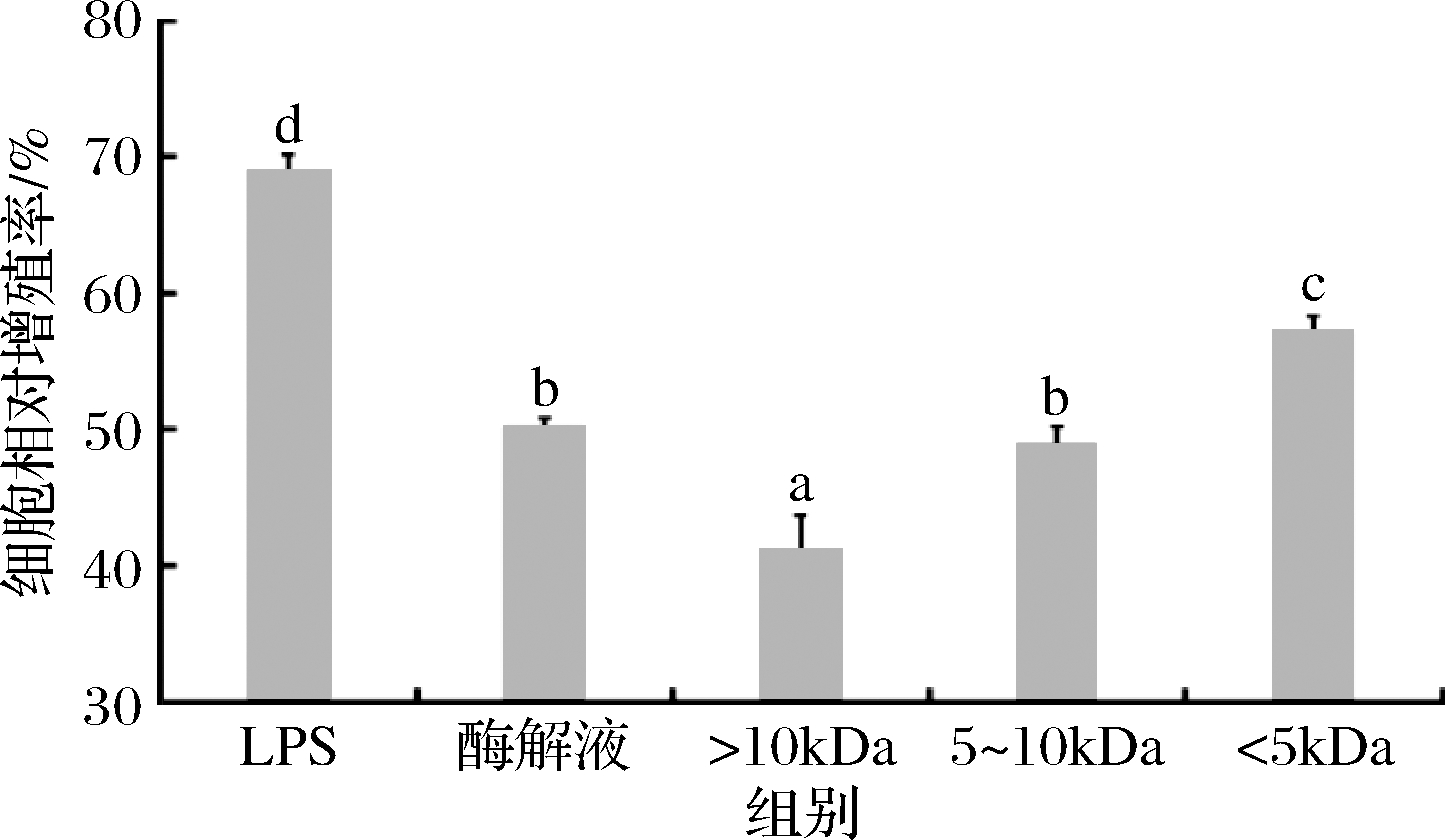
图10 鲐鱼多肽不同分子质量组分的小鼠单核巨噬细胞
RAW 264.7相对增殖率
Fig.10 Relative proliferation rate of mouse monocyte macrophage RAW 264.7 with different molecular weight components of chub mackerel peptides
2.9 鲐鱼多肽不同分子质量组分的氨基酸组成分析
由表1可知,鲐鱼多肽不同分子质量组分的氨基酸含量丰富,其中谷氨酸、亮氨酸、赖氨酸以及天冬氨酸的含量较高。同时也可以看出鲐鱼多肽各分子质量组分均含有较高的疏水性氨基酸,其中<5 kDa超滤组分中疏水性氨基酸含量为35.71%,明显高于鲐鱼多肽原酶解液和其他分子质量组分。
表1 鲐鱼多肽不同分子质量组分的氨基酸组成分析 单位:g/100 g
Table 1 Amino acid composition analysis of different molecular weight components of chub mackerel peptides
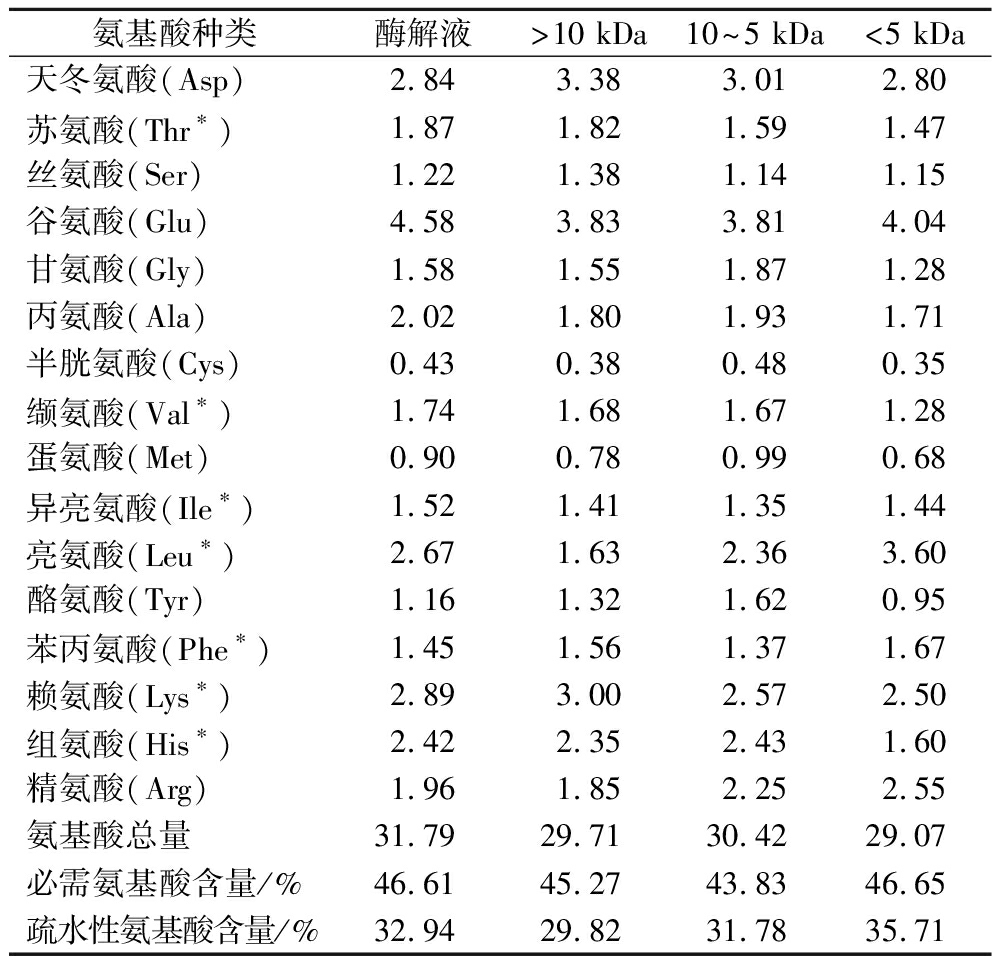
氨基酸种类酶解液>10 kDa10~5 kDa<5 kDa天冬氨酸(Asp)2.843.383.012.80苏氨酸(Thr∗)1.871.821.591.47丝氨酸(Ser)1.221.381.141.15谷氨酸(Glu)4.583.833.814.04甘氨酸(Gly)1.581.551.871.28丙氨酸(Ala)2.021.801.931.71半胱氨酸(Cys)0.430.380.480.35缬氨酸(Val∗)1.741.681.671.28蛋氨酸(Met)0.900.780.990.68异亮氨酸(Ile∗)1.521.411.351.44亮氨酸(Leu∗)2.671.632.363.60酪氨酸(Tyr)1.161.321.620.95苯丙氨酸(Phe∗)1.451.561.371.67赖氨酸(Lys∗)2.893.002.572.50组氨酸(His∗)2.422.352.431.60精氨酸(Arg)1.961.852.252.55氨基酸总量31.7929.7130.4229.07必需氨基酸含量/%46.6145.2743.8346.65疏水性氨基酸含量/%32.9429.8231.7835.71
注:*为必需氨基酸,疏水性氨基酸总量为Ala、Val、Met、Ile、Leu、Phe的氨基酸总和。
DAROIT等[26]研究发现疏水性氨基酸含量较高的肽段可以通过增强与机体中脂类的相互作用,使其能更容易地进入靶细胞,进而发挥免疫细胞的免疫调节功能。CHALAMAIAH等[27]研究报道了当多肽具有大量疏水性氨基酸时会表现出更好的免疫调节作用。候虎[28]选用胰蛋白酶进行酶解,从阿拉斯加鳕鱼中分离出3个具有免疫活性的多肽,其氨基酸序列分别为Asn-Gly-Met-Thr-Tyr、Asn-Gly-Leu-Ala-Pro和Trp-Thr,获得的3条肽段序列均含有疏水性氨基酸。L PEZ-ZABALZA等[29]发现1个富含丙氨酸、亮氨酸等疏水性氨基酸的15肽,可以刺激免疫细胞分泌细胞因子IL-1α、IL-6。
PEZ-ZABALZA等[29]发现1个富含丙氨酸、亮氨酸等疏水性氨基酸的15肽,可以刺激免疫细胞分泌细胞因子IL-1α、IL-6。
3 结论
本文对经超滤截留后的鲐鱼多肽不同分子质量组分的功能特性进行了研究,结果显示经超滤截留后各分子质量组分的水解度发生一定变化。pH在3~11,鲐鱼多肽均具有较好的溶解性。同时随着分子质量的降低,鲐鱼多肽的功能特性发生显著变化,其中鲐鱼多肽<5 kDa超滤组分的持水性较差,持油性较好,起泡性与乳化性最低,且稳定性较差。同时鲐鱼多肽不同分子质量组分均具有一定的抗氧化活性,其中<5 kDa超滤组分的抗氧化活性显著高于鲐鱼多肽原酶解液与其他分子质量组分,其DPPH自由基清除率和·OH清除率分别为(74.18±0.86)%和(77.60±0.89)%。随着分子质量的降低,鲐鱼多肽的免疫活性呈现升高趋势,其中<5 kDa超滤组分的小鼠脾淋巴细胞相对增殖率与小鼠单核巨噬细胞RAW 264.7相对增殖率分别为(56.78±0.96)%和(57.22±1.08)%,显著高于原酶解液与其他分子质量组分。最后对鲐鱼多肽不同分子质量组分进行氨基酸组成分析,结果显示,鲐鱼多肽氨基酸含量丰富,其中<5 kDa超滤组分中疏水性氨基酸含量为35.71%,显著高于鲐鱼多肽原酶解液和其他分子质量组分。
[1] 江锟. 鲈鱼蛋白的酶解工艺优化及活性肽的功能特性研究[D].武汉:华中农业大学, 2013.
JIANG K.Studies of bass protein hydrolysis process optimization and active peptide functional properties[D].Wuhan:Huazhong Agricultural University, 2013.
[2] 崔帅. 酶解鲻鱼蛋白制备抗氧化肽的研究[D].杭州:浙江工商大学, 2018.
CUI S.Preparation of antioxidant peptides from grey mullet protein by enzymatic hydrolysis[D].Hangzhou:Zhejiang Gongshang University, 2018.
[3] 姜海洋. 牦牛骨抗氧化胶原多肽的制备及其分离纯化和鉴定[D].雅安:四川农业大学, 2018.
JIANG H Y.Preparation, purification and identification of antioxidant collagen peptides from yak bone[D].Ya’an:Sichuan Agricultural University, 2018.
[4] 贺东亮. 紫苏多肽分离纯化及其抗肿瘤活性研究[D].太原:中北大学, 2019.
HE D L.Study on purification and anti-cancer effects of peptides derived from Perilla frutescens[D].Taiyuan:North University of China, 2019.
[5] 何小庆. 波纹巴非蛤活性肽的酶法制备及其免疫活性的研究[D].湛江:广东海洋大学, 2014.
HE X Q.Enzymatic preparation and immunocompetence research of Paphia undulata peptides[D].Zhanjiang:Guangdong Ocean University, 2014.
[6] 慈傲特. 山核桃饼粕抗氧化肽的制备与鉴定[D].合肥:合肥工业大学, 2018.
CI A T.Preparation and identification of antioxidant peptide from pecan meal[D].Hefei:Hefei University of Technology, 2018.
[7] 徐兆刚. 河蚌抗氧化肽的制备及其特性研究[D].长春:吉林大学, 2016.
XU Z G.Research on the preparation and properties of antioxidant peptides from mussel[D].Changchun:Jilin University, 2016.
[8] 刘建垒. 燕麦蛋白的提取及其亚基与功能特性研究[D].太谷:山西农业大学, 2013.
LIU J L.Oat protein isolate:Extraction, protein subunits and functional properties[D].Taigu:Shanxi Agricultural University, 2013.
[9] NOMAN A, XU Y S, AL-BUKHAITI W Q, et al.Influence of enzymatic hydrolysis conditions on the degree of hydrolysis and functional properties of protein hydrolysate obtained from Chinese sturgeon (Acipenser sinensis) by using papain enzyme[J].Process Biochemistry, 2018, 67:19-28.
[10] 张思思. 扁桃仁蛋白特性及多肽的功能活性研究[D].太谷:山西农业大学, 2014.
ZHANG S S.Study on protein characteristic and polypeptide’s functional activity of almond[D].Taigu:Shanxi Agricultural University, 2014.
[11] 李永武.绿豆清蛋白的提取及其功能特性和理化性质研究[D].大庆:黑龙江八一农垦大学, 2014.
LI Y W.Study on extraction of mung bean albumin and their functional and physico-chemical property[D].Daqing:Heilongjiang Bayi Agricultural University, 2014.
[12] PEARCE K N, KINSELLA J E.Emulsifying properties of proteins:Evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry, 1978, 26(3):716-723.
[13] 罗敏, 陈德经, 季晓辉.米胚多糖的组成及抗氧化性研究[J].天然产物研究与开发, 2018, 30(6):923-929;935.
LUO M, CHEN D J, JI X H.The composition and antioxidant activity of rice germ polysaccharide[J].Natural Product Research and Development, 2018, 30(6):923-929;935.
[14] 申彩红. 海参肽的酶法制备及其抗氧化、抗疲劳活性研究[D].泉州:华侨大学, 2015.
SHEN C H.Study on the enzymatic preparation of sea cucumber peptide and its antioxidant and anti-fatigue activities[D].Quanzhou:Huaqiao University, 2015.
[15] 李志永. 蚕蛹蛋白免疫肽的分离纯化、结构鉴定及功能分析[D].镇江:江苏科技大学, 2019.
LI Z Y.Purification, identification, and functional analysis of the novel immunomodulatory peptides from silkworm pupa protein[D].Zhenjiang:Jiangsu University of Science and Technology, 2019.
[16] 胡旭阳. 日本黄姑鱼肉活性肽的制备及其免疫调节作用研究[D].舟山:浙江海洋大学, 2019.
HU X Y.Studies on the preparation and immunoregulatory effect of peptides from Nibea japonica[D].Zhoushan:Zhejiang Ocean University, 2019.
[17] 文飞. 羊肝蛋白多肽的制备及抗氧化活性研究[D].贵阳:贵州大学, 2017.
WEN F.Polypeptide preparation of sheep liver protein and its antioxidant activity[D].Guiyang:Guizhou University, 2017.
[18] 邓成萍, 薛文通, 孙晓琳, 等.不同分子量段大豆多肽功能特性的研究[J].食品科学, 2006, 27(5):109-112.
DENG C P, XUE W T, SUN X L, et al.Functional properties of different molecular weight segments of soybean peptides[J].Food Science, 2006, 27(5):109-112.
[19] 祝婧, 刘磊, 张名位, 等.不同分子量海鲈鱼胶原蛋白肽组分的功能特性比较[J].现代食品科技, 2014, 30(12):113-118.
ZHU J, LIU L, ZHANG M W, et al.Comparing the functional properties of sea bass collagen peptides(SBCP) with different molecular weights[J].Modern Food Science and Technology, 2014, 30(12):113-118.
[20] WOUTERS A G B, ROMBOUTS I, LEGEIN M, et al.Air-water interfacial properties of enzymatic wheat gluten hydrolyzates determine their foaming behavior[J].Food Hydrocolloids, 2016, 55:155-162.
[21] GBOGOURI G A, LINDER M, FANNI J, et al.Influence of hydrolysis degree on the functional properties of salmon byproducts hydrolysates[J].Journal of Food Science, 2004, 69(8):C615-C622.
[22] 王金水. 酶解—膜超滤改性小麦面筋蛋白功能特性研究[D].广州:华南理工大学, 2007.
WANG J S.Functional properties of modified wheat gluten by enzymatic hydrolysis-membrane ultrafiltration[D].Guangzhou:South China University of Technology, 2007.
[23] 毕秋芸. 裙带菜多肽的制备及其抗氧化活性的研究[J].中国调味品, 2019, 44(5):104-110.
BI Q Y.Study on the preparation and antioxidant activity of polypeptides fromUndaria pinnatifida[J].China Condiment, 2019, 44(5):104-110.
[24] 牛瑞, 于建生.鳕鱼多肽的抗氧化活性及其分离纯化[J].食品与生物技术学报, 2010, 29(4):562-566.
NIU R, YU J S.Antioxidant activity and purification of pollock peptides[J].Journal of Food Science and Biotechnology, 2010, 29(4):562-566.
[25] 李婉, 曹文红, 章超桦, 等.牡蛎酶解产物的组成特点及其体外免疫活性[J].食品工业科技, 2017, 38(16):35-42.
LI W, CAO W H, ZHANG C H, et al.Composition characteristics of oyster enzymatic hydrolysate and its immune activity in vitro[J].Science and Technology of Food Industry, 2017, 38(16):35-42.
[26] DAROIT D J, BRANDELLI A.In vivo bioactivities of food protein-derived peptides:A current review[J].Current Opinion in Food Science, 2021, 39:120-129.
[27] CHALAMAIAH M, YU W L, WU J P.Immunomodulatory and anticancer protein hydrolysates (peptides) from food proteins:A review[J].Food Chemistry, 2018, 245:205-222.
[28] 侯虎. 鳕鱼免疫活性肽的可控制备及其免疫活性研究[D].青岛:中国海洋大学, 2011.
HOU H.The controllable preparation of pollock immunomodulating peptide and its immunity activity[D].Qingdao:Ocean University of China, 2011.
[29] L PEZ-ZABALZA M J, MART
PEZ-ZABALZA M J, MART NEZ-LAUS
NEZ-LAUS N S, BENGOECHEA-ALONSO M T, et al.Signaling pathway triggered by a short immunomodulating peptide on human monocytes[J].Archives of Biochemistry and Biophysics, 1997, 338(2):136-142.
N S, BENGOECHEA-ALONSO M T, et al.Signaling pathway triggered by a short immunomodulating peptide on human monocytes[J].Archives of Biochemistry and Biophysics, 1997, 338(2):136-142.