谷氨酰胺(glutamine,Gln)是一种条件必需氨基酸,可改善肠黏膜上皮细胞的代谢,有助于肠黏膜上皮细胞的修复、再生。从理论上讲,Gln有助于减轻化疗对肠道的损伤,保护肠黏膜结构和屏障功能[1]。大量事实说明,Gln在应急状态下对胃肠黏膜功能有很好的保护作用;当人体处于外伤、感染、疲劳等应激状态下,肠道黏膜上皮细胞的Gln很快被消耗殆尽,由此导致肠道黏膜萎缩、绒毛脱落、隐窝变浅、通透性增加等形态方面的改变,进而引起肠道免疫功能、吸收功能严重受损,这时需要及时补充大量的Gln以满足机体需要[2];Gln已实现人工合成,但Gln单体难溶于水,其在水溶液中不稳定、易降解。而以肽段形式存在的Gln则能克服游离Gln的缺点,在水溶液中稳定,且溶解度较高。小麦肽低聚肽具有多种生理活性,如抗氧化、降血压、抗疲劳、增强免疫力等[3-5]。小麦低聚肽中的Gln含量较高,为开发小麦低聚肽的市场应用,需对其功能特征肽段成分进行研究。
本研究以谷阮粉为原料,依次经复合蛋白酶酶解、分离、纯化、浓缩、喷雾干燥制备小麦低聚肽,旨在分析小麦低聚肽的理化性质、氨基酸组成、分子质量分布以及具有功能活性的特征肽段成分,为小麦肽的差异化产品开发和营养保健功能应用提供一定的研究基础。
1 试验材料和仪器
1.1 材料与试剂
谷阮粉,北京中食海氏生物科技有限公司;碱性蛋白酶、中性蛋白酶,诺维信公司;低聚肽标准品焦谷氨酰谷氨酰胺酰脯氨酸三肽(pyroglutamyl glutamyl proline tripeptide,pEQP)、缬氨酰谷氨酰胺酰谷氨酰胺三肽(valyl glutamyl glutamine tripeptide,VQQ)、丙氨酰谷氨酰胺二肽(alanyl glutamine dipeptide,AQ)、丝氨酰谷氨酰胺二肽(sericyl glutamine dipeptide,SQ)、异亮氨酰谷氨酰胺二肽(isoleucyl glutamine dipeptide,IQ)(纯度均≥99%),上海吉尔生化有限公司;乙腈(色谱纯),德国Merck公司;甲酸(色谱纯),迪马科技;蒸馏水,屈臣氏;其余药品均为分析纯。
1.2 仪器与设备
凯氏定氮仪,海能科学仪器公司;离心机,苏州珀西瓦尔实验设备有限公司;喷雾干燥器,无锡市阳光干燥设备有限公司;DU-20恒温水浴锅,上海一恒科学仪器有限公司;L-8900日立全自动氨基酸分析仪,天美(中国)科学仪器有限公司;LC-20AD型高效液相色谱仪、Nexera X2色谱仪与三重四极杆质谱仪联用系统(LCMS-8060,配有LabSolutions Ver.5.91色谱工作站),日本岛津公司。
2 试验方法
2.1 小麦低聚肽的制备
称取适量谷阮粉加水调浆,混合均匀后,调节蛋白溶液的pH至8.5,加入碱性蛋白酶和中性蛋白酶,酶解4 h,酶解结束后,100 ℃灭酶15 min。冷却后,3 000 r/min离心15 min,取上清液。将上清液用截留分子质量为1 000 u的超滤膜超滤,得到分子质量小于1 000 u的滤过液,并经旋转蒸发器进行浓缩,最后利用喷雾干燥器进行喷雾干燥,最终得到小麦低聚肽干粉。
2.2 分子质量分布的测定
采用高效凝胶过滤色谱法测定分子质量的分布:按照林峰等[6]选取的色谱条件制作相对分子质量校正曲线,然后将小麦低聚肽用流动相配成1 mg/mL的溶液,经聚四氟乙烯过滤膜(孔径0.2 μm)过滤后,上样进行高效凝胶过滤,使用GPC软件对色谱图分析。
2.3 小麦低聚肽蛋白和氨基酸组成测定
蛋白质含量测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》的方法;氨基酸含量参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》的方法。
2.4 小麦低聚肽结构序列的鉴定
用蒸馏水将小麦低聚肽样品稀释100倍,10 000 r/min离心10 min后取上清液,用孔径为0.22 μm尼龙过滤膜过滤后,制得待测样品,依次经LCMS-8060对小麦低聚肽样品进行前体离子(Q3)扫描、产物离子扫描(product ion scan,PIS),多反应监测(multiple reaction monitoring,MRM)优化及肽段序列定量,MRM参数如表1所示。液相色谱条件:色谱柱:Inertsil ODS-3(5 μm,2.1 mm×250 mm);流动相A为纯水(含0.1%甲酸),流动相B为乙腈(含0.1%甲酸),流速0.2 mL/min。梯度洗脱程序:0~15 min,流动相B 0%~50%;15~20 min,流动相B 50%~100%;20~25 min,流动相B 100%;25.1~35 min,流动相B 0%;进样体积10 μL;柱温40 ℃。质谱条件:离子化模式:ESI,正离子模式;离子喷雾电压4.5 kV;雾化气N2流速3.0 L/min;加热气N2流速10 L/min;干燥气N2流速10 L/min;DL温度250 ℃;加热模块温度400 ℃;离子源温度300 ℃;扫描模式MRM;驻留时间100 ms;延迟时间3 ms。
表1 肽段序列的MRM优化参数
Table 1 MRM optimization parameters of peptide sequences

序列前体离子(m/z)产物离子(m/z)Q1 Pre Bias/VCE/VQ3 Pre Bias/VpEQP355.284.1-11-38-17355.2116.2-11-12-13VQQ374.372.6-20-33-15374.3130.2-19-29-14AQ218.244.1-15-34-17218.2130.6-12-16-26SQ234.259.9-28-22-24234.2130.4-27-19-27IQ260.286.2-14-21-18260.2130.1-14-20-26
2.5 统计学处理
采用Origin 9软件对试验数据进行处理,试验结果以平均值±标准偏差表示。
3 结果分析与讨论
3.1 小麦低聚肽的分子质量分布
小麦低聚肽的凝胶色谱图如图1所示,经GPC专用软件对色谱峰进行分析计算即可得小麦低聚肽的分子质量分布,结果如表2所示。

图1 小麦低聚肽的凝胶色谱图
Fig.1 Gel chromatogram of wheat oligopeptides
表2 小麦低聚肽的分子质量分布
Table 2 Molecular weight distribution of wheat oligopeptides
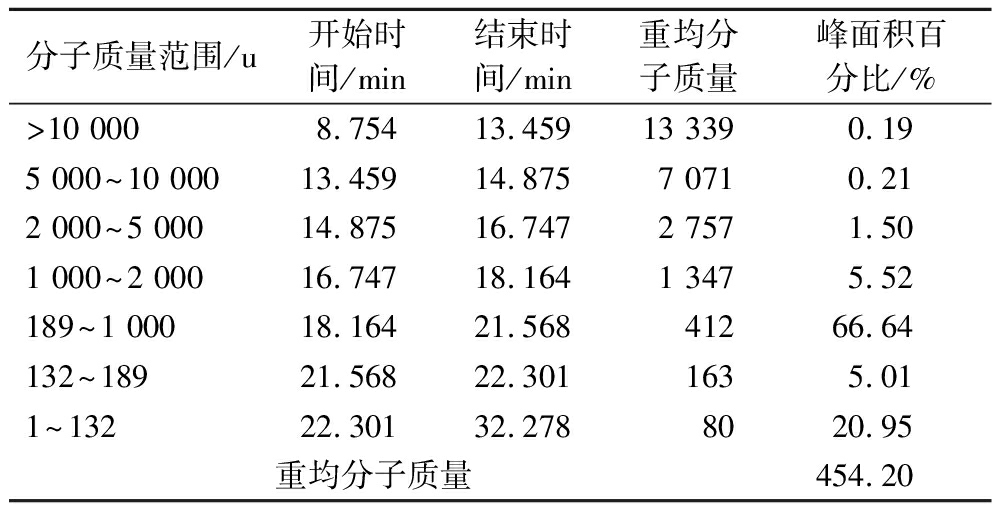
分子质量范围/u开始时间/min结束时间/min重均分子质量峰面积百分比/%>10 0008.75413.45913 3390.195 000~10 00013.45914.8757 0710.212 000~5 00014.87516.7472 7571.501 000~2 00016.74718.1641 3475.52189~1 00018.16421.56841266.64132~18921.56822.3011635.011~13222.30132.2788020.95重均分子质量454.20
小麦低聚肽的分子质量主要分布在1 000 u以下,占分子质量总量的92.60%。研究表明人体肠道中存在着一种特殊的多肽转运系统,此体系能直接将小分子肽转运至小肠黏膜上内皮细胞内而迅速被消化吸收,且多数氨基酸是以寡肽形式被吸收的,其吸收速度为游离氨基酸的2~2.5倍[7-8],所以肽比蛋白质和游离氨基酸的吸收效率快,消耗能量低,因此我们可以推断出小麦低聚肽具有良好的吸收效率。
3.2 小麦低聚肽的蛋白质和氨基酸组成
小麦低聚肽中总蛋白和酸溶蛋白质含量(干基)分别为93.27%和82.76%,肽含量(干基)为79.77%,其蛋白质含量较高,肽含量也较高,而其他成分含量较少,可作为一种优质的蛋白质。
肽的基本组成单位是氨基酸,氨基酸的种类和含量对其功能活性有非常大的影响。从表3可知,小麦低聚肽含有17种氨基酸,其中含有人体必需的7种氨基酸和2种半必需氨基酸(组氨酸和精氨酸),其含量分别为21.12%、4.30%,对人体的营养价值较高;必需氨基酸(essential amino acid,EAA)/氨基酸总量(total amino acid,TAA)和EAA/非必需氨基酸(non-essential amino acid,NEAA)占比分别为23.07%和76.93%。此外,小麦低聚肽中谷氨酸含量占比最高,研究表明谷氨酰胺是小肠细胞的主要能量来源,在修复胃肠黏膜组织、增加蛋白合成、防止肌肉分解等方面发挥着重要作用。
表3 小麦低聚肽的氨基酸含量
Table 3 Amino acid content of wheat oligopeptides

氨基酸含量/%氨基酸含量/%天冬氨酸(Asp)a2.87±0.22亮氨酸(Leu)5.92±0.40谷氨酸(Glu)b37.13±0.68酪氨酸(Tyr)2.91±0.23苏氨酸(Thr)2.19±0.49苯丙氨酸(Phe)4.72±0.32丝氨酸(Ser)4.16±0.21赖氨酸(Lys)1.22±0.16甘氨酸(Gly)3.21±0.54组氨酸(His)1.66±0.05丙氨酸(Ala)2.58±0.15精氨酸(Arg)2.64±0.48缬氨酸(Val)3.21±0.18脯氨酸(Pro)12.21±0.54蛋氨酸(Met)1.22±0.07胱氨酸[(Cys)2]c1.07±0.24异亮氨酸(Ile)2.64±0.14TAA91.56±0.38EAA21.12±0.45NEAA70.44±0.26EAA/TAA23.07±0.37EAA/NEAA76.93±0.36
注:a-天冬氨酸+天冬酰胺;b-谷氨酸+谷氨酰胺;c-半胱氨酸符号缩写是Cys,表格中数据为胱氨酸含量,符号为(Cys)2
3.3 小麦低聚肽的结构序列鉴定
为减少小麦低聚肽组分间的相互干扰,便于对肽段进行定性分析,首先要对小麦低聚肽样品进行分离纯化。小麦低聚肽样品经分子排阻色谱分离所得到的液相色谱图如图2所示,检测波长为214 nm时,组分主要集中在25~50 min,故从第25~50 min,每分钟收集1个组分,用于下一阶段的结构分析。

图2 利用分子排阻色谱对小麦低聚肽分离和收集
Fig.2 Separation and collection of wheat oligopeptides by size exclusion chromatography
通过Q3扫描采集高峰度质荷比信息,以便获得肽段的前体离子信息。利用高效液相色谱串联质谱对组分进行前体离子扫描,分析分子排阻色谱分离组分中主要肽段的总离子流图,主要肽段序列对应的前体离子质荷比为355.2、374.3、218.2、234.2、260.2。利用PIS对高峰度前体离子裂解,采集肽段的碎片离子信息,以便获得其产物离子信息。对上述5个前体离子进行二级扫描,获得相应的产物离子,并分析对应的肽段结构。以主要色谱峰对应的m/z为355.2为例,将355.2作为前体离子分析,在正离子模式下碰撞能量分别为-25 V和-35 V,得到m/z为355.2前体离子的产物离子谱图如图3所示,经分析,主要肽段序列为pyroGlu-Gln-Pro(pEQP)。

a-产物离子质谱图(-35 V);b-产物离子质谱图(-25 V) 图3 前体离子为355.2的产物离子质谱图
Fig.3 Product ion mass spectrum with precursor ion of 355.2
结合产物离子信息、NCBI数据库、UniProt数据库及原创肽段数据库来确定肽段的序列结构,最终从小麦低聚肽中共鉴定出5条肽段序列,如表4所示。
表4 小麦低聚肽中鉴定出的5条肽段序列
Table 4 Sequences of five peptides identified in wheat oligopeptides
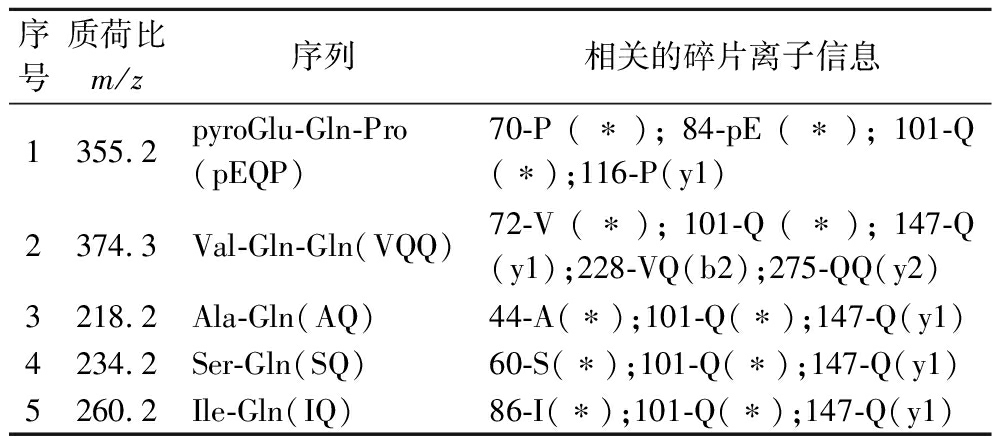
序号质荷比m/z序列相关的碎片离子信息1355.2pyroGlu-Gln-Pro(pEQP)70-P(∗);84-pE(∗);101-Q(∗);116-P(y1)2374.3Val-Gln-Gln(VQQ)72-V(∗);101-Q(∗);147-Q(y1);228-VQ(b2);275-QQ(y2)3218.2Ala-Gln(AQ)44-A(∗);101-Q(∗);147-Q(y1)4234.2Ser-Gln(SQ)60-S(∗);101-Q(∗);147-Q(y1)5260.2Ile-Gln(IQ)86-I(∗);101-Q(∗);147-Q(y1)
经过与源蛋白序列比较分析,小麦醇溶蛋白序列中存在着已鉴定出的肽段序列位点(用不同颜色标出小麦醇溶蛋白序列中已鉴定的肽段,说明通过定向酶解技术可以将小麦蛋白分解为若干低聚肽序列),在图4中突出显示。

图4 已鉴定出的肽段在小麦醇溶蛋白序列中对应的位点
Fig.4 Corresponding positions of the identified peptides in wheat gliadin sequence
小麦蛋白是目前为止发现的含谷氨酰胺最丰富的天然蛋白源。谷氨酰胺是小肠细胞的主要能量来源,在修复胃肠黏膜组织、增加蛋白合成、防止肌肉分解等方面发挥着重要作用。将小麦蛋白酶解,可获得丰富的性质稳定的小分子谷氨酰胺肽,更有利于谷氨酰胺生理功能的发挥[9-10]。谷氨酰胺对胃肠黏膜细胞生长及分化作用已相当明显,以及谷氨酰胺在临床上已被作为辅助治疗胃炎、胃溃疡、十二指肠溃疡等胃肠道疾病的药物使用,本研究开发的小麦低聚肽谷氨酰胺含量非常丰富,所以,将保护胃肠黏膜作为小麦低聚肽功能研究的重要方面;后续将开展这5条关键肽段的改善胃肠黏膜功能的细胞学功能评价,以明确小麦低聚肽中核心关键肽段的功效作用机制。
利用HPLC-MS/MS自动优化功能对标准品进行了定量离子对和电压的优化,所得到的MRM优化参数见表1。利用MRM优化参数对7个批次小麦低聚肽各肽段进行了定量,以pEQP肽段定量色谱图及校准曲线为例说明如图5所示,其余肽段的校准曲线方程如表5所示。

a-pEQP肽段标准品定量色谱图;b-样品定量色谱图;c-校准曲线
图5 pEQP肽段标准品和样品定量色谱图及校准曲线
Fig.5 Standard and sample quantitative chromatogram and calibration curve of pEQP peptide
表5 五条肽段的校准曲线方程
Table 5 Calibration curve equations of 5 peptides
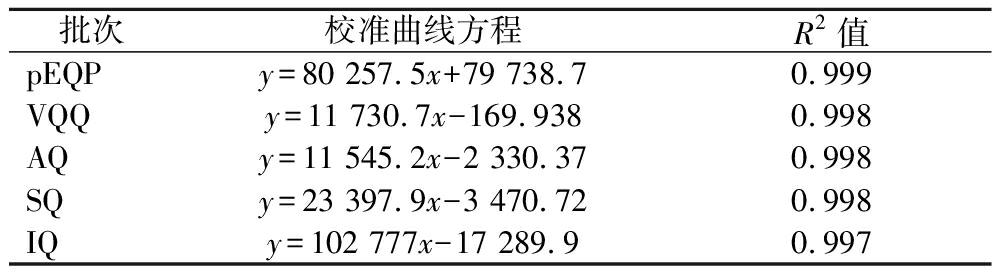
批次校准曲线方程R2值pEQPy=80 257.5x+79 738.70.999VQQy=11 730.7x-169.9380.998AQy=11 545.2x-2 330.370.998SQy=23 397.9x-3 470.720.998IQy=102 777x-17 289.90.997
结果显示各批次小麦低聚肽间各目标肽段含量稳定,含谷氨酰胺肽段含量从高至低依次为pEQP、SQ、AQ、IQ、VQQ,各批次小麦低聚肽中目标肽段含量见表6。
表6不同批次小麦低聚肽肽段含量 单位:%
Table 6 Content of different batches of wheat oligopeptides

批次pEQPVQQAQSQIQ批次10.4590.0470.1860.4300.146批次20.4980.0500.2030.4800.159批次30.4730.0430.1770.4070.142批次40.4710.0500.1880.4540.138批次50.4560.0450.1900.4470.145批次60.4670.0490.2140.4800.154批次70.4250.0410.1810.4210.132平均值0.4640.0460.1910.4460.145标准偏差0.0220.0040.0130.0280.009
4 结论
本研究以谷阮粉通过酶解分离纯化浓缩喷雾干燥制备小麦低聚肽粉,其中总蛋白、酸溶蛋白和肽(干基)含量依次为97.27%、82.76%和79.77%,小麦低聚肽的氨基酸组成丰富,富含人体必需氨基酸和半必需氨基酸(组氨酸和精氨酸),其中谷氨酸占比最高,小麦低聚肽的分子质量小于1 000 u的肽段含量高达92.60%以上,以二肽和三肽为主;经超快速液相色谱串联三重四极杆质谱对小麦低聚肽前体离子、产物离子以及MRM优化进行扫描,并从中分离鉴定出5条含有谷氨酰胺特征活性肽段成分,且小麦低聚肽批次间含量稳定,为小麦低聚肽保护胃肠黏膜的营养保健应用提供了一定的理论支持,但对于5条肽段保护胃肠黏膜的作用机制尚需进一步探讨。
[1] 刘刚, 周建平, 董明.谷氨酰胺临床研究进展[J].中国实用外科杂志, 2018, 38(9):1 081-1 083;1 085.
LIU G, ZHOU J P, DONG M.Advances in clinical research on glutamine[J].Chinese Journal of Practical Surgery, 2018, 38(9):1 081-1 083;1 085.
[2] 吴岩, 王禹, 崔起超, 等.谷氨酰胺强化肠外营养在小动物临床中的应用进展[J].云南畜牧兽医, 2020(5):41-44.
WU Y, WANG Y, CUI Q C, et al.Progress in application of glutamine-enriched parenteral nutrition in small animals[J].Yunnan Journal of Animal Science and Veterinary Medicine, 2020(5):41-44.
[3] 凌空, 张铭晧, 高丽辉, 等.体外模拟消化对小麦低聚肽抗氧化活性影响[J].食品工业, 2021, 42(4):82-86.
LING K, ZHANG M H, GAO L H, et al.Effect on the antioxidant activity of wheat oligopeptides after in vitro digestion[J].The Food Industry, 2021, 42(4):82-86.
[4] 邵剑钢, 钱平, 刘晋, 等.小麦低聚肽的功能作用研究进展及应用前景展望[J].中国食物与营养, 2016, 22(10):72-74.
SHAO J G, QIAN P, LIU J, et al.Research advancement and application prospect of function properties of wheat oligopeptides[J].Food and Nutrition in China, 2016, 22(10):72-74.
[5] 李明亮, 尹曼, 凌空, 等.大豆肽和小麦肽抗疲劳功能的实验研究[J].食品科技, 2019, 44(9):303-307.
LI M L, YIN M, LING K, et al.Experimental study on the antifatigue function of soybean peptide and wheat peptide[J].Food Science and Technology, 2019, 44(9):303-307.
[6] 林峰, 马勇, 徐亚光, 等.基于分子质量分布的食源性低聚肽品质评价[J].食品与发酵工业, 2008, 34(9):128-131.
LIN F, MA Y, XU Y G, et al.Study on the quality evaluation of food-derived oligopeptides based on the molecular weight distribution[J].Food and Fermentation Industries, 2008, 34(9):128-131.
[7] 范喜宽, 庄磊, 赵一敏, 等.大豆蛋白活性肽的研究现状及应用前景[J].饮料工业, 2009, 12(5):1-4.
FAN X K, ZHUANG L, ZHAO Y M, et al.Current situation of research and prospects of use of soybean peptides[J].The Beverage Industry, 2009, 12(5):1-4.
[8] 方磊, 李国明, 徐珊珊, 等.牡蛎肽和三文鱼皮胶原肽低致敏性和抗过敏活性研究[J].食品与发酵工业, 2018, 44(9):91-97.
FANG L, LI G M, XU S S, et al.Study of low sensitization and antiallergic activity of oyster peptides and salmon skin collagen peptides[J].Food and Fermentation Industries, 2018, 44(9):91-97.
[9] 周健, 司继刚.丙氨酰谷氨酰胺的临床应用进展[J].中国药房, 2016, 27(26):3 739-3 741.
ZHOU J, SI J G.Progress in clinical application of alanyl glutamine[J].China Pharmacy, 2016, 27(26):3 739-3 741.
[10] 李清. 丙氨酰谷氨酰胺的临床应用及研究进展[J].中国基层医药, 2017, 24(24):3 819-3 822.
LI Q.The clinical application and research progress of alanyglutamine[J].Chinese Journal of Primary Medicine and Pharmacy, 2017, 24(24):3 819-3 822.