中国传统干腊肉历史悠久,形成了自己独特的风味。根据加工技术,中国传统肉制品可分为七大类:腌制产品、酱汁腌制产品、熏烤产品、干燥产品、油炸产品、香肠产品和火腿产品[1]。干腌肉是其中最重要的一类。随着肉制品的成熟,内部会发生激烈的生化反应。肌肉蛋白不断被内源性蛋白酶分解,产生游离氨基酸和短肽,给肉制品带来了独特的风味[2]。
据ARIHARA[3]报道,食源性生物活性肽具有大量对人体有益的生物活性物质,可发挥抗氧化、降压、抗菌、阿片激动剂、免疫调节、益生素、矿物质结合和抗血栓作用。例如,金华干腌火腿肽提取物显示出很强的清除DPPH自由基的活性,并且这些肽提取物可以有效地保护PC12细胞免受H2O2诱导的氧化损伤[4]。同样,从中国羊肉火腿中分离纯化出3种新的多肽,这些多肽具有有效的ABTS阳离子自由基清除能力,并能保护机体免受Fenton试剂诱导的蛋白质氧化和DNA损伤[5]。很多野生动物的肽被认为可以降低血压,特别是从消化的鹿肉中提取的异亮氨酸-赖氨酸-谷氨酸-缬氨酸-苏氨酸-谷氨酸-精氨酸(IKEVTER)[6]。此外,来自牛血红蛋白α亚基的多肽(VNFKLLSHSLLVTLASHL)对大肠杆菌、金黄色葡萄球菌和白色念珠菌显示出抗菌活性[7]。
从肉类蛋白中释放生物肽的方法很多,酶水解全蛋白是目前最广泛使用的方法[8]。然而,在我们的日常饮食中,来自干腌肉类的天然生物活性肽是最有可能在日常饮食过程中被人类所吸收的。此外,关于中国传统干腌肉中抗癌活性的报道也很少。因此,本研究选取了8种具有代表性的中国传统干腌肉制品,从中提取多肽,即四川风干牛肉肽(BP)、内蒙古风干羊肉肽(MP)、金华火腿肽(HP)、江西咸鸭肽(DP)、湖北风干鸡肉肽(CP)、安徽风干鹅肽(GP)、鲢鱼风干肽(SCP),研究它们各自的抗氧化和抗癌活性。通过测定8种风干肉粗肽的·OH清除率、DPPH自由基清除率和ABTS阳离子自由基清除率来评定火腿中生物活性肽的抗氧化活性能力。用MTT法检测8种肽液对于4种不同的癌细胞的抑制效果。并通过BP对于SH-SY5Y细胞凋亡作用以及细胞周期的影响,在一定程度上解释了相关肽的作用机理。
1 材料与方法
1.1 材料与试剂
材料:金华火腿,金华金字火腿有限公司(中国金华);风干鲢鱼,中国扬州倪松食品有限公司;风干牛肉,红原市玉芳寨牦牛牛肉厂(中国四川);风干羊肉,阿尔巴斯牧场(中国内蒙古);风干黄鱼,中国舟山市当地市场;风干鸡,中国湖北当地市场;风干鹅,安徽当地市场;风干鸭,中国江西当地市场。
试剂选择:ABTS、DPPH、MTT、1,10-菲咯啉,Sigma-Aldrich(上海)贸易有限公司;HeLa、SH-SY5Y、A549、HCT-116细胞,中国上海生物化学与细胞生物学研究所中国细胞库;盐酸、无水乙醇、牛血清蛋白、NaOH、邻二氮菲、H2O2,国药集团化学试剂有限公司;CuSO4·5H2O、四水合酒石酸钾钠、Na2HPO4、NaH2PO4、FeSO4,上海凌峰化学试剂有限公司;三氯乙酸、谷胱甘肽(glutathione, GSH),上海阿拉丁试剂有限公司。所有其他化学品和试剂均为分析级。
1.2 仪器与设备
可见光分光光度计,上海仪电分析仪器有限公司;多功能离心机,Eppendorf/艾本德;数显恒温水浴锅,金坛市杰瑞尔电器有限公司;循环水真空泵,上海聚昆仪器设备有限公司;精密电子天平,常州万泰天平仪器有限公司;旋转蒸发仪,上海亚荣生化仪器厂;电热恒温干燥箱,上海精宏实验设备有限公司;多管架自动平衡离心机,湖南湘仪实验室仪器开发有限公司;高速分散机(匀浆机)、涡旋混合器,德国IKA集团。
1.3 实验方法
1.3.1 粗肽的提取
根据ZHU等[9]的方法进行修改。采用盐酸提取法,为了避免样品中盐分对于抗癌活性测试的影响,提前采用蒸馏水浸渍法减少样品盐分,8个样品未切块,整体在蒸馏水中浸泡3 d,每8 h更换1次蒸馏水。根据ZHOU等[2]的研究,肉制品的多肽主要存在于肌肉组织,在未做酸处理前,清水浸泡溶出的量很少。相比于盐分对实验结果的影响,多肽的溶出损失对结果的影响较小。剥去肉眼可见的脂肪和结缔组织。采用盐酸水解法提取多肽,用匀浆机将50 g肌肉在250 mL 0.01 mol/L盐酸中匀浆。均质采用4次冲程,每次30 s,在冰水中冷却。匀浆在低温下离心(12 000×g,4 ℃,20 min),快速定性滤纸过滤后,用3倍量乙醇变性沉淀上清液中的蛋白质组分。将混合物在4 ℃下放置20 min,然后再在4 ℃下以12 000×g离心20 min。然后,将混合物在50 ℃下干燥,在旋转蒸发器中除去乙醇,然后冷冻干燥并储存在-20 ℃中进行进一步检测。
1.3.2 抗氧化活性
采用ABTS法、DPPH法和·OH清除法,研究了8种粗肽(BP、MP、HP、DP、CP、GP、SCP和YCP)在质量浓度1 mg/mL下的抗氧化能力。粗肽含量的测定参照徐娟等[10]的方法,得到回归线方程为y=0.128 1x-0.000 2,R2=0.999 7,进而求得多肽含量。
1.3.2.1 ABTS阳离子自由基清除活性
根据ZHU等[9]的方法,将5 mL 7 mmol/L的ABTS溶液与88 μL 140 mmol/L的K2S2O8溶液混合,在20 ℃下放置20 h,加入约3倍体积75%乙醇,在734 nm处的吸光度为(0.70 ±0.02),得到ABTS阳离子自由基。样品由9.8 mL稀释的ABTS阳离子自由基溶液和0.2 mL 1 mg/mL粗肽组成。以0.2 mL蒸馏水和9.8 mL稀释的ABTS阳离子自由基溶液的混合物为空白,以1 mg/mL粗肽0.2 mL和9.8 mL蒸馏水为对照。所有混合物在室温下放置0.5 h,用分光光度计在734 nm处测定。ABTS阳离子自由基清除活性按公式(1)计算:
ABTS阳离子自由基清除活性![]()
(1)
式中:As,Ac和Ab分别表示样品、对照和空白的吸光度。
1.3.2.2 DPPH自由基清除活性
采用LI等[11]的方法测定了8种粗肽对DPPH自由基的清除作用。样品为2 mL多肽溶液(1 mg/mL)和2 mL 0.1 mmol/L DPPH溶液(95%乙醇溶解)。空白为95%乙醇2 mL+0.1 mmol/L DPPH 2 mL。所有混合物在20 ℃下振荡0.5 h,用分光光度计在517 nm处测定。清除作用如公式(2)所示:
DPPH自由基清除活性/%=(Ab-As)/Ab×100
(2)
式中:As,Ab分别代表样品和空白的吸光度。
1.3.2.3 ·OH清除能力
采用LI等[11]的方法,混合物由4 mL 5 mmol/L的1,10-邻菲咯啉和4 mL 5 mmol/L的FeSO4组成,然后加入3 mL磷酸盐缓冲液(pH 7.4),然后加入3 mL H2O2(0.01%,体积分数)和4 mL粗肽(1 mg/mL)。最后,将混合物在36 ℃下放置1 h,在536 nm处测量吸光度。对照:用蒸馏水代替多肽溶液,其他试剂与样品相同。空白:用蒸馏水代替H2O2,其他试剂与样品相同。使用公式(3)测定·OH清除活性:
·OH清除活性/%=(As-Ac)/(Ab-Ac)×100
(3)
式中:As,Ac和Ab分别代表样品、对照和空白的吸光度。
1.3.3 抗增殖活性
1.3.3.1 MTT细胞活力检测
细胞处理:当细胞汇合至90%时,遵从细胞传代操作方法获取细胞悬液,离心,吸取上清液,加入4 mL完全培养基后,用移液枪轻轻吹打均匀,用台酚蓝对细胞进行染色,染色后对细胞计数,在96孔板中均匀接种细胞,接种密度5×104个/mL,接种体积90 μL。然后将96孔板置于37 ℃,5% CO2培养箱中,培养过夜。
加药:根据实验要求用完全培养基配制不同浓度的药物,每组设置3个平行复孔。加药结束后将96孔板置于37 ℃,5% CO2培养箱中,继续培养48 h。
检测:给药培养48 h后,将10 mL MTT溶液按顺序加到96孔板中继续孵育4 h。然后用真空泵吸弃上清液,每孔加入100 μL DMSO,立即使用酶标仪,检测96孔板在570和630 nm处的吸光度值。
1.3.3.2 Annexin V-FITC/PI双染细胞凋亡分析
细胞处理:按1.3.3.1节的方法对细胞培养染色后计数,在6孔板中均匀接种细胞,接种密度1×105个/mL,接种体积3 mL。将6孔板置于37 ℃,5% CO2培养箱中,培养过夜。
加药:根据实验要求用培养基配制不同质量浓度的样品(0.5、1、2 mg/mL),每孔加入300 μL,然后将6孔板置于37 ℃,5% CO2培养箱中,继续培养48 h。
检测:给药培养48 h后,先用200 μL不含EDTA的胰酶消化细胞,用离心机以2 000×g离心5 min收集细胞,吸弃上清液,用预冷的1×PBS洗涤2次,2 000×g离心5 min。吸弃上清液后加入500 μL的1×Binding Buffer悬浮细胞,再分别依次加入3 μL的Annexin V-FITC和PI,用移液枪混匀后,用锡箔纸包好,在室温条件下避光孵育15 min,最后轻轻吹打均匀后用流式细胞仪分析。
1.3.3.3 细胞周期检测
细胞处理及加药方法同1.3.3.2节。
检测:给药培养48 h后,先用200 μL不含EDTA的胰酶消化细胞,用离心机以2 000×g离心5 min收集细胞,吸弃上清液,用预冷的1×PBS进行洗涤,次数为2次,2 000×g离心5 min。吸弃上清液后加入1 mL 75%乙醇,4 ℃放置过夜,固定细胞。待固定24 h后以2 000×g离心5 min收集细胞,吸弃上清液,用预冷的1×PBS洗涤2次,2 000×g离心5 min。再分别加入细胞周期检测试剂,在室温条件下避光孵育30 min,最后轻轻吹打均匀后用流式细胞仪分析。
1.3.3.4 Hoechst 33258染色细胞形态学分析
细胞处理:按1.3.3.1节的方法对细胞培养染色后计数,在24孔板中均匀接种细胞,每个孔接种的密度是8×104个/mL,加的体积是1 mL。将24孔板置于37 ℃,5% CO2培养箱中,培养过夜。
加药:根据实验要求用培养基配制不同质量浓度的cattle(0.5、1、2 mg/mL),每孔加入100 μL将24孔板置于37 ℃,5% CO2培养箱中,继续培养48 h。
检测:药物培养48 h后,用1 mL预冷的1×PBS洗涤细胞3次,再加入1 mL体积分数4%的多聚甲醛固定液室温固定15 min。吸弃多聚甲醛固定液,用500 μL预冷的1×PBS洗涤3次,接着每个孔加入500 μL Hoechst 33258(0.5 μg/mL)溶液对细胞进行染色,室温条件下避光15 min。染色完后用真空泵吸弃多聚甲醛固定液,再用1 mL预冷的1×PBS洗涤3次。先分别在盖玻片上面滴1滴甘油,随后小心翼翼将24孔板中的盖玻片取出,倒扣在载玻片上。用倒置相差荧光显微镜观察,并拍照。
1.4 数据分析与统计处理
采用DPS 7.05进行完全统计分析的单变量方差分析,进行最小显著差别(least significant difference,LSD)分析,P<0.05为差异显著。使用Origin 9.1绘图,Microsoft Excel工作表统计数据。
2 结果与分析
2.1 抗氧化活性
在干腌火腿的长时间成熟过程中,内源酶分解肌浆蛋白和肌原纤维蛋白释放许多小肽和游离氨基酸[12]。干腌羊肉、火腿和干腌牛肉也会经历同样的过程,并产生许多生物活性肽。XING等[1]从宣威火腿中提取了四肽Asp-Leu-Glu-Glu,该肽具有较高的抗氧化活性。此外,大量的海鱼种类已被确定具有潜在的抗氧化价值[13]。JE等[14]从金枪鱼骨骼蛋白中纯化出一种抗氧化肽,鉴定为VKAGFAWTANQLS(1 519Da)。中国传统干腌肉类在其制作过程中,经历了长时间的风干发酵,在此期间蛋白质发生降解,生成许多肽类,其中也不乏富含抗氧化活性的生物活性肽,这也是干腌肉类具有抗氧化能力的原因。
2.1.1 DPPH自由基清除活性
DPPH可用于评价抗氧化剂的抗氧化活性,在517 nm处有较强的吸收。当DPPH遇到抗氧化剂,如带正电荷的抗氧化肽时,DPPH自由基被清除,吸光度降低[15]。如图1显示了8种不同多肽在相同质量浓度(1 mg/mL)下对DPPH自由基的清除能力。在本研究中,CP(87.1±1.7)%、SCP(83.4±1.3)%和YCP(81.5±0.5)%表现出较高的DPPH清除能力。SUN等[16]报道,木瓜蛋白酶水解制备的鸡胸肉蛋白水解物在质量浓度为3~5 mg/mL时,能够消除约90%的DPPH自由基。此外,CHI等[17]从番红花鱼肌肉蛋白水解物中分离纯化出的一种抗氧化肽(Tyr-Leu-Met-Ser-Arg)显示出对DPPH的高清除活性(EC50为1.35 mg/mL)。鸡肉和黄鱼可能含有可以水解成抗氧化肽的大分子蛋白质。在漫长的风干过程中,鸡肉、鲢鱼和黄花鱼的蛋白质被内源性酶水解,释放出足够的短肽来中和DPPH自由基。HP对DPPH自由基的清除能力为(60.8±1.6)%,略高于MP的(54.7±1.1)%和BP的(48.4±1.8)%。ZHU等[12]报道了金华火腿中清除DPPH自由基活性最强的多肽是GKFNV,当质量浓度为1 mg/mL时,其抗氧化活性为92.7%。ESCUDERO等[18]使用LC-MS/MS对从西班牙干腌火腿中提取的27种新型多肽进行测序,它们对DPPH的清除率为10%~40%(1 mg/mL)。西班牙火腿和中国火腿都富含抗氧化肽,风味独特。DP对DPPH的清除能力为(59.0±1.7)%,接近GP的(58.1±2.7)%。这些结果表明,中国风干肉制品在自然风干过程中产生了大量的DPPH清除肽。

图1 DPPH自由基清除活性
Fig.1 DPPH radical scavenging activity
2.1.2 ABTS阳离子自由基清除活性
DPPH和ABTS阳离子自由基清除活性的变化趋势相似,提示DPPH和ABTS的作用机制可能是相互关联的。图2显示了8种不同多肽在相同质量浓度(1 mg/mL)下的ABTS阳离子自由基清除能力。YCP对ABTS的清除能力最强为(49.6±0.5)%。SCP(42.3±0.3)%和BP(40.2±1.2)%表现出较低的ABTS阳离子自由基清除能力。CP(45.0±0.8)%、HP(44.9±0.7)%、GP(46.1±0.6)%、DP(46.9±0.6)%和MP(48.0±0.8)%清除能力相近。WANG等[5]从中国干腌羊肉肽中提纯了9个组分,当质量浓度为0.5 mg/mL时,ABTS阳离子自由基的清除率为40%~60%。多肽的分子质量是影响ABTS阳离子自由基清除能力的关键因素。分子质量越小,ABTS阳离子自由基清除活性越高,这与SU等[19]的结果相同。ALIAGA等[20]报道了多肽与ABTS之间的反应速度取决于侧基的性质,其反应活性顺序为:半胱氨酸>色氨酸>酪氨酸>组氨酸>胱氨酸。这8种风干肉肽可能含有大量上述氨基酸,这可能解释了这些多肽具有较高的ABTS阳离子自由基清除能力的原因。

图2 ABTS阳离子自由基清除活性
Fig.2 ABTS cation radical scavenging activity
2.1.3 ·OH清除活性
·OH的化学活性很高,它可以与氨基酸、蛋白质和DNA等生物分子反应,对人体造成损害。因此,清除·OH可能是维持人类健康的最有效的方法之一[21]。图3显示了8种不同多肽在相同质量浓度(1 mg/mL)下清除·OH的能力。与DPPH效应相比,SCP(48.3±1.0)%和CP(41.8±2.0)%仍保持较高的·OH清除率。本研究中的多肽具有较强的·OH清除活性,可将·OH转化为危害较小的化合物,并中断自由基连锁反应。

图3 ·OH清除活性
Fig.3 ·OH scavenging activity
2.2 抗癌活性
2.2.1 抗增殖活性
本研究以SH-SY5Y、HeLa、A549和HCT-116四种肿瘤细胞株为研究对象,分别用不同浓度的8种多肽作用72 h,并用MTT法进行检测。实验结果如表1~表4所示,DP和CP对癌细胞的抑制效果最好。关于鸡肉、鸭肉和鹅肉中生物活性肽的抗癌作用的报道很少。DP和CP的抑制率明显高于GP。造成这一现象的可能原因是鸡鸭鲜肉中抗癌肽含量相对较低,但经过较长时间的风干,鸡肉和鸭肉在内源酶的作用下积累了大量高活性的抗癌肽。然而,鹅的生产工艺与前2种肉不同。鹅的风干期较短,为1~2周。鹅不能产生如此多的抗癌肽来产生明显的抗癌效果。
表1 MTT法研究多肽对SH-SY5Y细胞增殖的抑制作用
Table 1 Proliferation inhibition of peptides on SH-SY5Y cell lines by MTT assay
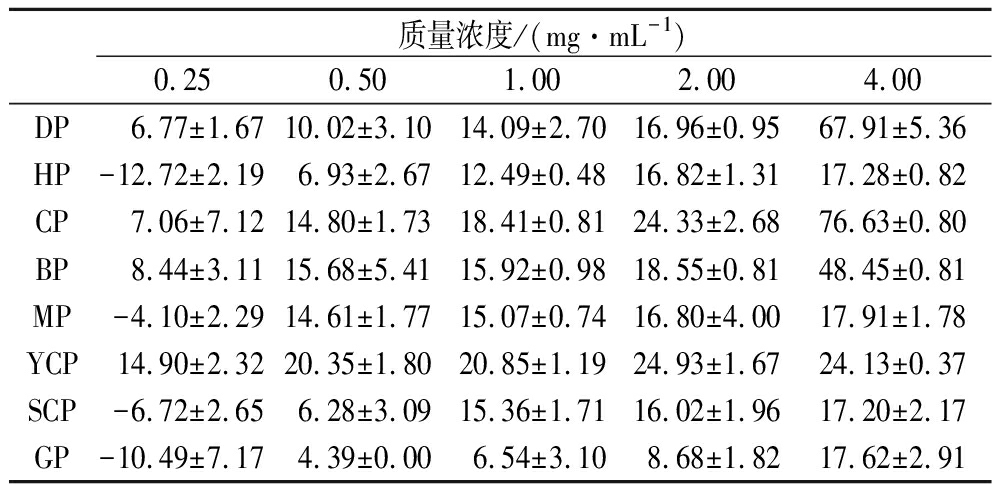
质量浓度/(mg·mL-1)0.250.501.002.004.00DP 6.77±1.6710.02±3.1014.09±2.7016.96±0.9567.91±5.36HP-12.72±2.196.93±2.6712.49±0.4816.82±1.3117.28±0.82CP7.06±7.1214.80±1.73 18.41±0.8124.33±2.6876.63±0.80BP8.44±3.1115.68±5.41 15.92±0.9818.55±0.8148.45±0.81MP-4.10±2.2914.61±1.77 15.07±0.7416.80±4.0017.91±1.78YCP14.90±2.3220.35±1.80 20.85±1.1924.93±1.6724.13±0.37SCP-6.72±2.656.28±3.09 15.36±1.7116.02±1.9617.20±2.17GP-10.49±7.174.39±0.00 6.54±3.108.68±1.8217.62±2.91
表2 MTT法研究多肽对HeLa细胞增殖的抑制作用
Table 2 Proliferation inhibition of peptides on HeLa cell lines by MTT assay

质量浓度/(mg·mL-1)0.250.501.002.004.00DP-0.86±0.47 3.00±0.4018.44±0.9934.80±1.9861.58±4.66HP-3.99±2.08-5.46±0.534.36±1.575.41±1.3318.84±1.79CP1.91±2.052.60±2.086.09±0.7620.00±0.8443.27±3.22BP2.86±0.671.45±1.311.19±1.449.33±0.7820.30±0.59MP1.57±1.22-5.37±0.72-4.06±1.4612.42±0.0526.87±1.75YCP3.11±0.190.98±0.181.96±1.6914.72±0.3829.54±1.00SCP-8.14±1.180.60±0.03-0.98±0.55-1.79±0.090.48±1.25GP-7.00±0.14-8.93±3.433.73±0.088.32±1.4825.83±5.80
表3 MTT法研究多肽对A549细胞增殖的抑制作用
Table 3 Proliferation inhibition of peptides on A549 cell lines by MTT assay

质量浓度/(mg·mL-1)0.250.501.002.004.00DP -1.44±4.63-1.45±0.56 4.41±0.6612.92±1.1031.30±0.49HP0.46±0.398.47±1.6014.09±0.9213.58±1.0116.21±1.01CP-0.55±3.7413.18±1.54 19.79±1.2122.74±0.1230.42±2.20BP-4.38±10.936.52±3.93 6.15±5.227.71±0.188.20±1.66MP5.38±2.159.99±1.10 11.27±1.5511.59±0.9417.23±2.15YCP6.09±2.7524.40±0.62 25.82±2.2628.58±0.3234.36±1.34SCP0.74±1.570.06±4.06 3.46±4.360.71±1.70-6.27±6.64GP-3.09±5.985.87±4.44 10.31±2.9112.92±6.794.25±1.69
表4 MTT法研究多肽对HCT-116细胞增殖的抑制作用
Table 4 Proliferation inhibition of peptides on HCT-116 cell lines by MTT assay

质量浓度/(mg·mL-1)0.250.501.002.004.00DP 5.30±4.026.79±7.2215.11±2.7823.09±1.6632.35±1.18HP8.02±2.8412.50±1.1421.21±3.2822.82±1.0226.43±0.63CP-0.26±1.4118.65±0.26 30.65±1.6838.49±1.8247.87±1.09BP13.22±1.6812.72±2.70 19.43±3.5619.47±4.4534.37±5.11MP11.44±0.1021.06±2.52 29.64±2.5242.98±1.2642.98±2.05YCP14.50±2.9917.68±0.90 26.62±0.2029.63±0.9729.74±3.71SCP2.54±4.7311.35±2.27 9.44±4.9014.75±6.1313.89±6.70GP1.97±3.555.83±3.82 3.91±8.1917.71±5.0023.49±6.12
羊肉、牛肉和火腿都是传统风干肉类的红肉,但牛肉和羊肉的抗癌效果要好于火腿。JANG等[22]从牛肉蛋白中分离纯化了4个多肽,在0.4 mg/mL时对MCF-7细胞的活力有20%的抑制作用。KIM等[23]从韩宇牛肉中提纯了一种新的肽(Cys-Ser-Val-Gln-Lys),通过磷酸化ERK、JNK和p38激酶,对HCT116细胞的活力抑制了25.24%。SU等[24]从山羊肝脏中分离纯化了一种抗肿瘤活性多肽(ACBP)。在建立的MGC-803胃癌细胞模型中,ACBP对癌细胞的增殖有明显的抑制作用。虽然有关火腿活性肽的抗氧化活性已有大量报道,但其抑制癌细胞增殖的能力尚不清楚。在自然风干过程中,火腿、牛肉和羊肉也经历了相似的内源酶解过程。今后有必要进一步探讨干腌羊肉、干腌牛肉和火腿的抗癌作用及其机理。
SCP对HeLa和A549细胞无抑制作用,甚至有促生长作用。鱼是抗癌和抗氧化肽的良好来源。HSU等[25]利用木瓜蛋白酶和蛋白酶XXIII水解暗肌肉产生2种抗增殖多肽,它们对MCF-7细胞的IC50值分别为8.1和8.8 μmol/L,呈现剂量依赖性抑制作用。尽管鱼肽在以往的抗氧化实验中取得了良好的效果,尤其是对DPPH自由基的清除能力。但对癌细胞的抑制作用很低,说明其抗癌和抗氧化机制不同。
2.2.2 细胞凋亡分析
用Annexin-V FITC/PI荧光双染试剂盒检测BP对SH-SY5Y细胞凋亡的影响。如图4所示,与对照组相比,BP处理后细胞凋亡率明显增加。随着BP浓度的增加,细胞凋亡比例逐渐增加,表现出一定的浓度依赖性。当BP质量浓度为2 mg/mL时,凋亡率为42.66%。说明BP可诱导SH-SY5Y细胞凋亡。

图4 Annexin-V-FITC/PI荧光双染色试剂盒检测BP对SH-SY5Y细胞凋亡的影响
Fig.4 Annexin-V FITC/PI fluorescent double staining kit was used to detect the effect of BP on SH-SY5Y cell apoptosis
2.2.3 细胞周期分析
用细胞周期检测试剂盒(PI)检测BP对SH-SY5Y细胞周期的影响。如图5所示,与对照组相比,BP处理48 h后,S期明显增加,为43.13%。随着BP浓度的增加,S期阻滞越明显,表现出一定的浓度依赖性。这表明BP通过引起SH-SY5Y细胞周期阻滞而抑制细胞增殖。

a-对照;b-0.5 mg/mL;c-1.0 mg/mL;d-2.0 mg/mL
图5 用Hoechst 33258观察SH-SY5Y形态
Fig.5 Morphologic observation of SH-SY5Y with Hoechst 33258
2.2.4 Hoechst 33258染色细胞的形态学分析
图6为SH-SY5Y细胞用Hoechst 33258染色。用霍希斯特33258染色的正常细胞核是圆形的,里面有深蓝色颗粒。BP处理后,细胞核呈椭圆形、新月形、多边形等非圆形。形态和细胞核明显缩小,并存在浓度依赖性。结果表明,BP可损伤SH-SY5Y细胞并诱导其凋亡。

图6 流式细胞术分析血压治疗后SH-SY5Y细胞与对照细胞的细胞周期进程和百分比
Fig.6 Flow cytometric analysis of cell cycle progression and percentages of the SH-SY5Y cells in comparison with control cells after treatment of BP
3 结论与讨论
本研究对从中国传统干腌肉类中提取的8种肽的抗氧化和抗癌活性进行了研究,采用了ABTS法、DPPH法和·OH清除法,研究了8种粗肽(BP、MP、HP、DP、CP、GP、SCP和YCP)在质量浓度为1 mg/mL时抗氧化能力的差异。总体而言,CP、SCP和YCP表现出较强的抗氧化活性,CP(1 mg/mL)对DPPH自由基的清除率为(87.1±1.7)%,YCP(1 mg/mL)对ABTS阳离子自由基的清除率为(49.6±0.5)%,SCP(1 mg/mL)对·OH的清除率为(48.3±1.0)%,而其他的抗氧化活性相对较低。此外,还研究了8种肽的抗癌活性,结果显示,DP、CP和BP对癌细胞有较强的抑制作用。如BP对SH-SY5Y细胞的抑制率达(48.45±0.81)%,BP可将SH-SY5Y阻滞在S期并产生抑制作用。CP在4 mg/mL时对SH-SY5Y、HeLa、A549和HCT-116的抑制率分别为(76.63±0.80)%、(43.27±3.22)%、(30.42±2.20)%和(47.87±1.09)%。CP可清除活性氧凋亡信号因子,抑制癌细胞增殖。从抑制癌细胞增殖角度,传统的中国干腌肉制品对人体健康是有益的。在未来,传统的中国干腌肉可能会被证明是减缓癌症患者癌症病情的一种很好的食物来源。
造成不同肽抗氧化和抗癌活性差异的原因不仅在于不同肉类品种自身的多肽含量不同,也与加工条件有关。在加工过程中,多肽的长度、种类和结构可能会发生变化。加工后的多肽比预处理后的多肽和游离氨基酸具有更强的抗氧化性。随着风干时间的延长,风干肉制品中活性肽总量不断增加。随着内源酶对大分子蛋白质的不断分解,活性肽(尤其是小肽)的种类越来越多。然而,不适当的加工条件,如潮湿和黑暗的环境,会加速微生物的生长,导致肉制品变质。因此,控制肉制品的加工条件对肉制品的质量至关重要。传统干腌肉制品作为食源性生物活性肽重要的来源之一可作为功能性食品的一个新方向,依然具有很大的研究空间。
[1] XING L J, HU Y Y, HU H Y, et al.Purification and identification of antioxidative peptides from dry-cured Xuanwei ham[J].Food Chemistry, 2016, 194:951-958.
[2] ZHOU G H, ZHAO G M.Biochemical changes during processing of traditional Jinhua ham[J].Meat Science, 2007, 77(1):114-120.
[3] ARIHARA K.Strategies for designing novel functional meat products[J].Meat Science, 2006, 74(1):219-229.
[4] HU Y Y, XING L J, ZHOU G H, et al.Antioxidant activity of crude peptides extracted from dry-cured Jinhua ham[J].Journal of Food and Nutrition Research, 2016, 4(6):377-387.
[5] WANG J Y, LU S L, LI R T, et al.Identification and characterization of antioxidant peptides from Chinese dry-cured mutton ham[J].Journal of the Science of Food and Agriculture, 2020, 100(3):1 246-1 255.
[6] TAKEDA S, KANEKO S, SOGAWA K, et al.Isolation, evaluation, and identification of angiotensin I-converting enzyme inhibitory peptides from game meat[J].Foods, 2020, 9(9):1168.
[7] HU J H, XU M L, HANG B L, et al.Isolation and characterization of an antimicrobial peptide from bovine hemoglobin α-subunit[J].World Journal of Microbiology and Biotechnology, 2011, 27(4):767-771.
[8] RYAN J T, ROSS R P, BOLTON D, et al.Bioactive peptides from muscle sources:Meat and fish[J].Nutrients, 2011, 3(9):765-791.
[9] ZHU C Z, ZHANG W G, KANG Z L, et al.Stability of an antioxidant peptide extracted from Jinhua ham[J].Meat Science, 2014, 96(2):783-789.
[10] 徐娟, 吕嘉枥.乳蛋白水解液中多肽含量测定方法的研究[J].食品科技, 2010, 35(12):275-278.
XU J, LYU J L.Determination of content of peptides in milk protein hydrolysates[J].Food Science and Technology, 2010, 35(12):275-278.
[11] LI Y H, JIANG B, ZHANG T, et al.Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J].Food Chemistry, 2008, 106(2):444-450.
[12] ZHU C Z, ZHANG W G, ZHOU G H, et al.Identification of antioxidant peptides of Jinhua ham generated in the products and through the simulated gastrointestinal digestion system[J].Journal of the Science of Food and Agriculture, 2016, 96(1):99-108.
[13] SENEVIRATHNE M, KIM S K.Development of bioactive peptides from fish proteins and their health promoting ability[J].Advances in Food and Nutrition Research, 2012, 65:235-248.
[14] JE J Y, QIAN Z J, BYUN H G, et al.Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry, 2007, 42(5): 840-846.
[15] ESCUDERO E, ARISTOY M C, NISHIMURA H, et al.Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J].Meat Science, 2012, 91(3):306-311.
[16] SUN Y Y, PAN D D, GUO Y X, et al.Purification of chicken breast protein hydrolysate and analysis of its antioxidant activity[J].Food and Chemical Toxicology, 2012, 50(10):3 397-3 404.
[17] CHI C F, HU F Y, WANG B, et al.Purification and characterization of three antioxidant peptides from protein hydrolyzate of croceine croaker (Pseudosciaena crocea) muscle[J].Food Chemistry, 2015, 168:662-667.
[18] ESCUDERO E, MORA L, FRASER P D, et al.Identification of novel antioxidant peptides generated in Spanish dry-cured ham[J].Food Chemistry, 2013, 138(2-3):1 282-1 288.
[19] SU G W, ZHENG L, CUI C, et al.Characterization of antioxidant activity and volatile compounds of Maillard reaction products derived from different peptide fractions of peanut hydrolysate[J].Food Research International, 2011, 44(10):3 250-3 258.
[20] ALIAGA C, LISSI E A.Reactions of the radical cation derived from 2, 2′-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS·+) with amino acids.Kinetics and mechanism[J].Canadian Journal of Chemistry, 2000, 78(8):1 052-1 059.
[21] ZHONG S Y, MA C W, LIN Y C, et al.Antioxidant properties of peptide fractions from silver carp (Hypophthalmichthys molitrix) processing by-product protein hydrolysates evaluated by electron spin resonance spectrometry[J].Food Chemistry, 2011, 126(4):1 636-1 642.
[22] JANG A, JO C, KANG K-S, et al.Antimicrobial and human cancer cell cytotoxic effect of synthetic angiotensin-converting enzyme (ACE) inhibitory peptides[J].Food Chemistry, 2008, 107(1):327-336.
[23] KIM H J, YANG S R, JANG A.Anti-proliferative effect of a novel anti-oxidative peptide in Hanwoo beef on human colorectal carcinoma cells[J].Korean Journal for Food Science of Animal Resources, 2018, 38(6):1 168-1 178.
[24] SU L Y, XU G H, SHEN J, et al.Anticancer bioactive peptide suppresses human gastric cancer growth through modulation of apoptosis and the cell cycle[J].Oncology Reports, 2010, 23(1):3-9.
[25] HSU K C, LI-CHAN E C Y, JAO C L.Antiproliferative activity of peptides prepared from enzymatic hydrolysates of tuna dark muscle on human breast cancer cell line MCF-7[J].Food Chemistry, 2011, 126(2):617-622.