灵菌红素类色素是一类线性三吡咯结构的生物碱类化合物,包括灵菌红素、十一烷基灵菌红素、环烷基灵菌红素、间环灵菌红素、灵菌红素R1、链玉红菌素B等[1]。其中,灵菌红素作为黏质沙雷氏菌、弧菌、假单胞菌等的次生代谢产物,具有多种生物活性。KAVITHA等[2]报道,灵菌红素可以诱导HeLa肿瘤细胞凋亡,半抑制浓度(half maximal inhibitory concentration, IC50)为700 nmol/L。灵菌红素对阿霉素敏感肺癌细胞和耐阿霉素肺癌细胞具有细胞毒性,IC50值均为10 μmol/L[3];YIP等[4]研究表明,10 μg灵菌红素即可抑制粪肠球菌、金黄葡萄球菌、大肠杆菌生长。抑菌实验发现灵菌红素还可以抑制铜绿假单胞菌、蜡样芽孢杆菌等细菌生长,也对白念珠菌、黑曲霉、青霉等真菌生长具有抑制作用[5-6];灵菌红素还可抑制藻类生长,1 μg/L灵菌红素可导致90%多环旋沟藻细胞凋亡,3 μg/L可使90%铜绿微囊藻细胞凋亡[7];HAN等[8]研究发现灵菌红素具有免疫抑制性,其通过抑制IL-2/IL-2R信号通路中受体蛋白IL-2Rα的表达阻止T细胞激活产生免疫抑制。近年来,灵菌红素在医学、食品等领域均具有很大的应用潜力和广阔的市场前景[9],日益受到国内外学者的关注。
目前,灵菌红素主要通过黏质沙雷氏菌发酵获得,其产量受培养基、发酵方法等多种因素制约。常用的发酵培养基有溶菌肉汤培养基(lysozyme broth, LB)[10]、营养肉汤培养基(nutrient broth, NB)[11]和蛋白胨-甘油培养基[12]。研究人员尝试调整培养基成分以提高灵菌红素产量。FARAAG等[13]将L-酪氨酸添加到NB培养基中,使灵菌红素提取物产量从10 mg/L提高到30 mg/L。WEI等[14]在发酵培养基中添加10 g/L的脯氨酸后,十一烷基灵菌红素的提取量达到2.5 g/L。WEI等[15]使用改良添加葵花油的LB培养基发酵类灵菌红素,色素提取物产量达到790 mg/L。张丹峰等[16]用大豆油培养黏质沙雷氏菌发酵灵菌红素,发酵36 h后灵菌红素提取量达到2.98 g/L。目前国内1 mg 98%纯度的灵菌红素价格约3 000元,其高昂的价格限制了进一步的开发和应用,如何优化微生物发酵条件提高灵菌红素产率依然是国内外学者的研究重点。
本文以从槐树根际土壤筛选出的一株产灵菌红素菌株为研究对象,通过单因素试验和正交试验优化发酵条件,旨在以较低的生产成本获得高产量的灵菌红素,为进一步工业化生产提供科学依据。
1 材料与方法
1.1 材料与试剂
液相分析用甲醇、乙腈、甲酸(均为色谱纯),美国Mreda公司;细菌基因组DNA提取试剂盒,北京天根生化科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Infinite M200 Pro多功能酶标仪,美国Tecan;1200型高效液相色谱、1200-1946D型液相色谱质谱联用仪,美国安捷伦公司。
1.3 实验方法
1.3.1 培养基配置
营养琼脂(nutrient agar, NA)培养基(g/L):蛋白胨10,牛肉浸粉3,NaCl 5,pH 7.2, 琼脂粉 20。
筛选培养基(g/L):葡萄糖10,(NH4)2SO4 0.5,酵母浸粉0.5,NaCl 0.3,KCl 0.3,MgSO4 0.3,FeSO4 0.03,MnSO4 0.03,卵磷脂0.2,CaCO3 1,琼脂粉20,pH 7.2。
发酵培养基(g/L):蔗糖10,(NH4)2SO4 0.5,酵母浸粉0.5,NaCl 1,KCl 0.5,CaCO3 1,pH 6.8。
1.3.2 菌种筛选
取得的土样过筛(200目)后,将称取1 g土样加入无菌水充分振荡,梯度稀释至10-5、10-6、10-7,取200 μL土壤稀释液涂布于筛选培养基,30 ℃恒温培养48 h,挑取红色菌落在NA培养基上划线纯化得到单菌落,菌液用体积分数25%甘油在-80 ℃下保存。
1.3.3 菌种鉴定
菌株形态学鉴定:将纯化的菌株划线于NA上培养1 d,观察该菌菌落形态。
分子生物学鉴定:以16S rDNA序列分析法鉴定该菌种。使用细菌基因组DNA提取试剂盒提取菌株基因组DNA,将提取的基因组DNA送至生工生物工程(上海)股份有限公司测定细菌16S rDNA序列,测序结果进行拼接后输入到NCBI核酸数据库进行BLSAT分析(http://www.ncbi.nlm.nih.gov/blast)。使用MEGA 6.0软件,以Neighbor-Joining法构建系统发育树。
1.3.4 紫外吸收法评估色素合成能力
利用紫外吸收法检测菌株在发酵液中的产色素能力,参照BHAGWAT等[17]的方法,并稍作修改。发酵完成后将发酵液充分摇匀,取2 mL,10 000 r/min离心2 min,倒掉上清液,菌体用去离子水润洗后加入4 mL用0.05 mol/L盐酸调pH 3的甲醇溶液,充分振荡混匀后继续振荡10 min,10 000 r/min离心2 min,上清液用pH 3的甲醇溶液稀释10倍后测530 nm吸光度。通过OD530来比较H04色素产量。
1.3.5 发酵条件优化
1.3.5.1 单因素试验
发酵培养基作为基础培养基,考察不同碳源(蔗糖、可溶性淀粉、葡萄糖)、不同氮源[(NH4)2SO4、酵母浸粉、蛋白胨]、碳源浓度、氮源浓度、NaCl浓度、KCl浓度、CaCO3浓度、发酵温度、接种量及发酵时间对H04发酵色素产量的影响。
1.3.5.2 正交试验
在单因素的基础上将碳源、氮源、NaCl、KCl、CaCO3、温度设计6因素3水平正交试验L27(36),以530 nm吸光度作为评价指标探究各因素对H04发酵合成色素能力的影响。
1.3.6 灵菌红素提取及表征
发酵液以8 500 r/min离心5 min后去掉上清液,沉淀用等体积去离子水洗2次,加入等体积0.05 mol/L盐酸酸化的甲醇溶液(pH 2)提取色素,充分振荡使色素悬浮于溶液中,振荡20 min后,8 500 r/min离心5 min,重复上述操作至菌体无色素残留,收集合并色素溶液,40 ℃旋蒸干燥后称重计算得率,最后将色素用酸性甲醇复溶,以供进一步分析。
将色素分别用pH为3、7、9的甲醇溶液溶解后使用紫外分光光度计进行全波长扫描,扫描范围300~700 nm。
HPLC检测条件:色谱柱为Shim-pack GIST C18反相色谱柱(3 μm,4.6 mm×250 mm),进样量10 μL,流速0.5 mL/min,检测波长530 nm,流动相A为0.05%甲酸水溶液,流动相B为0.05%甲酸乙腈溶液,梯度洗脱流程:0~20 min:10%B~100%B,20~25 min:100%B。
LC-MS检测条件进样量、流动相、洗脱条件同液相分析一致。选择正负2种离子模式进行质谱扫描并采集数据,质荷比(m/z)扫描范围为40~1 700。
1.4 数据处理
每个实验进行3次平行实验,采用Excel 2016,Origin 2017,SPASSAU进行数据处理。
2 结果与分析
2.1 菌株形态及鉴定色素产量优化
纯化后的菌株H04在NA上生长24 h后菌落呈橙红色,表面及边缘光滑,为圆形凸起状,见图1-a。菌株H04的16S rDNA序列与NCBI数据库BLAST比对,选取并下载11个同源性高的模式菌序列,用MEGA 6.0构建系统发育树。菌株H04与黏质沙雷氏菌(Serratia marcescens)亲缘关系最接近,序列相似度均高于99%,其中,H04与S.marcescens NBRC 102204的序列相似度最高(99.44%),而H04与Serratia ureilytica NiVa 51的序列相似性为98.26%(图1-b),表明H04属于黏质沙雷氏菌(S.marcescens)。

a-菌落形态;b-系统发育树
图1 H04菌落形态及16S rDNA系统发育树
Fig.1 Colony morphology and 16S rDNA phylogeny tree of H04
2.2 色素产量优化灵菌红素表征
2.2.1 单因素试验
碳源单因素试验结果如图2-a所示,相比于葡萄糖、可溶性淀粉,蔗糖为发酵灵菌红素的最佳碳源。因此,选用蔗糖作为发酵碳源。

a-碳源;b-氮源
图2 不同碳源和氮源对灵菌红素产量的影响
Fig.2 The influence of different carbon source and nitrogen source on prodigiosin production
氮源单因素试验测定了酵母浸粉、(NH4)2SO4、蛋白胨、酵母浸粉-(NH4)2SO4、(NH4)2SO4-蛋白胨对H04发酵灵菌红菌红素的影响,结果表明,酵母浸粉-(NH4)2SO4(1∶1,质量比)最适合发酵灵菌红素(图2-b)。
蔗糖单因素试验结果表明,随蔗糖添加量增加,H04合成色素逐渐增多,当蔗糖添加量>10 g/L时,色素产量维持高值平台(图3-a),因此,以10 g/L作为正交试验中碳源浓度的中间水平。

a-碳源;b-氮源[1∶1,酵母浸粉-(NH4)2SO4];c-KCl;d-NaCl;e-CaCO3
图3 培养基成分对灵菌红素产量的影响
Fig.3 The influence of medium compositions on prodigiosin production
氮源质量浓度为1 g/L时最适宜灵菌红素的合成,氮源添加量>1 g/L时,色素产量开始降低(图3-b),KCl添加量为0.5 g/L时,最适宜色素合成,但继续提高KCl浓度,色素产率会降低(图3-c)。
NaCl添加量为0~3 g/L时色素产量随NaCl浓度升高而升高,当NaCl质量浓度>3 g/L时,色素产量随浓度升高而降低(图3-d)。因此,以3 g/L作为正交试验中NaCl质量浓度的中间水平。
添加CaCO3与不添加相比,H04合成灵菌红素的能力有明显提高,在添加0.5 g/L CaCO3时最适宜灵菌红素合成(图3-e)。因此,以0.5 g/L作为正交试验中CaCO3质量浓度的中间水平。
脯氨酸和甘氨酸作为灵菌红素合成途径中的前体物质[18],两者在微生物合成灵菌红素途径中分别合成4-甲氧基-2,2′-二吡咯-5-甲醛和2-十一烷基吡咯[19],考察2种氨基酸加入到培养基中能否提高菌株H04的灵菌红素产量。研究发现,加入脯氨酸可以提高色素产量,但是,加入甘氨酸会抑制灵菌红素的合成(图4-a)。随脯氨酸添加量提高,菌株合成灵菌红素产量提高,当脯氨酸质量浓度>10 g/L时,菌株合成灵菌红素的能力减弱。

a-氨基酸种类;b-脯氨酸质量浓度
图4 氨基酸对灵菌红素产量的影响
Fig.4 The influence of amino acids on prodigiosin production
接种量为1%~3%(体积分数)时,色素产量逐渐上升,但当接种量>3%时,色素产量开始下降(图5-a),因此,以3%的接种量进行发酵。

a-接种量;b-温度;c-发酵时间
图5 发酵条件对灵菌红素产量的影响
Fig.5 The influence of fermentation conditions on prodigiosin production
考察温度对H04合成灵菌红素的影响实验中,以25、30、35 ℃下进行发酵,其中30 ℃最适合色素合成(图5-b),因此,以30 ℃作为正交试验中发酵温度的中间水平。
图5-c考察了发酵时间对灵菌红素产量的影响,在发酵24 h时色素形成达到稳定,发酵时间延长产率不再增长。
2.2.2 正交试验
根据单因素试验结果确定正交试验各因素水平(表1),并按照表2进行正交试验,以OD530为实验效果的评价指标。22号实验组所得评价指标吸光度值最高,其培养条件为A3B2C1D3E2F2,即15 g/L蔗糖、1 g/L氮源[0.5 g/L(NH4)2SO4,0.5 g/L酵母浸粉]、1 g/L NaCl、0.75 g/L KCl、0.5 g/L CaCO3、发酵温度30 ℃,说明在正交试验中此条件最适合色素合成。
表1 正交试验因素和水平
Table 1 Factors and levels of orthogonal design
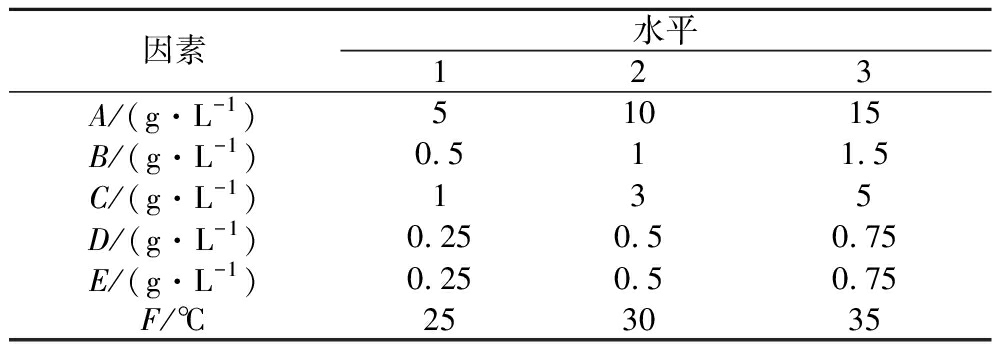
因素水平123A/(g·L-1)51015B/(g·L-1)0.511.5C/(g·L-1)135D/(g·L-1)0.250.50.75E/(g·L-1)0.250.50.75F/℃253035
注:A表示蔗糖,B表示氮源(酵母浸粉∶(NH4)2SO4=1∶1),C表示NaCl,D表示KCl,E表示CaCO3,F表示温度(下同)。
表2 L27(36)正交表及结果
Table 2 L27(36) orthogonal design and results

编号因素ABCDEFOD53011111110.139±0.01321122230.099±0.00931133320.166±0.08741212310.389±0.03351223130.002±0.00161231220.604±0.01171313210.591±0.06081321330.038±0.00991332120.399±0.015102113230.089±0.016112121320.113±0.001122132110.253±0.033132211130.014±0.004142222220.547±0.009152233310.444±0.085162312330.029±0.021172323120.223±0.099182331210.698±0.077193112320.141±0.003203123110.240±0.026213131230.208±0.002223213220.730±0.026233221310.374±0.043243232130.055±0.012253311120.448±0.029263322210.365±0.096273333330.351±0.099
对实验数据进行极差和方差分析,极差分析中,Ki为该因素i水平实验结果值之和,ki为该因素i水平实验结果的平均值。根据极差分析(表3)和方差分析(表4)知,因素的影响由大到小为:发酵温度>CaCO3浓度>氮源浓度>NaCl浓度>KCl浓度>碳源浓度,其中,发酵温度、CaCO3浓度、氮源浓度对H04发酵产色素影响显著(P<0.05),据此推测最优发酵条件为A3B2C3D3E2F1,即15 g/L蔗糖、1 g/L氮源[0.5 g/L(NH4)2SO4,0.5 g/L酵母浸粉]、5 g/L NaCl、0.75 g/L KCl、0.5 g/L CaCO3、发酵温度25 ℃。由于该推测的最优组合未出现在实验组中,故将该推测组合与22号实验组进行验证实验,结果表明,以22号实验组条件发酵可得色素提取物3.8 g/L,按推测最优条件实际发酵所得色素提取物为4.5 g/L,比正交优化前提高了2.3倍,确认该推测条件为最优发酵条件。
表3 正交试验结果极差分析
Table 3 Ranges analysis of orthogonal experiments result

评价指标因子碳源氮源NaClKClCaCO3温度K10.830 0.466 0.857 0.935 0.592 1.165 K20.642 1.075 0.668 0.759 1.367 1.144 K31.006 1.047 1.115 0.946 0.655 0.331 k10.270 0.145 0.286 0.293 0.197 0.388 k20.214 0.351 0.222 0.253 0.437 0.374 k30.324 0.349 0.353 0.315 0.218 0.098 极差R0.110 0.206 0.131 0.062 0.240 0.290 较好水平A3B2C3D3E2F1因素主次顺序534621
表4 正交试验结果方差分析
Table 4 Variances analysis of orthogonal experiments result

方差来源平方和自由度均方F值P碳源浓度0.02420.0121.5230.252氮源浓度0.19720.09912.3970.001∗∗NaCl浓度0.10120.056.3430.011∗KCl浓度0.02220.0111.3840.283CaCO3浓度0.3620.1822.6040.000∗∗温度0.45220.22628.4350.000∗∗残差0.111140.008
2.3 灵菌红素表征
色素提取物在不同pH下紫外吸收光谱结果表明(图6),pH 3酸性条件下,色素在530 nm处有最大吸收峰;pH 7中性条件下,色素颜色由粉色变为红色,在530 nm处有最大吸收,与酸性条件相比,吸光度降低;碱性条件下,色素最大吸收波长蓝移,溶液呈黄色,在470、530 nm处有吸收,470 nm为最大吸收波长,上述特征与已报道的灵菌红素相同[20]。

图6 色素提取物的紫外吸收光谱图
Fig.6 UV spectra of pigment extract
HPLC分析表明,在530 nm下,保留时间为10.413 min,对应积分面积为100%(图7)。对色素进行LC-MS分析(图8),正离子主要碎片峰m/z 324 [M+H]+和m/z 325 [M+2H]+以及负离子碎片峰m/z 322 [M-H]-,确定化合物的相对分子质量为323,即C20H25N3O,与文献对照,该化合物为灵菌红素[21]。
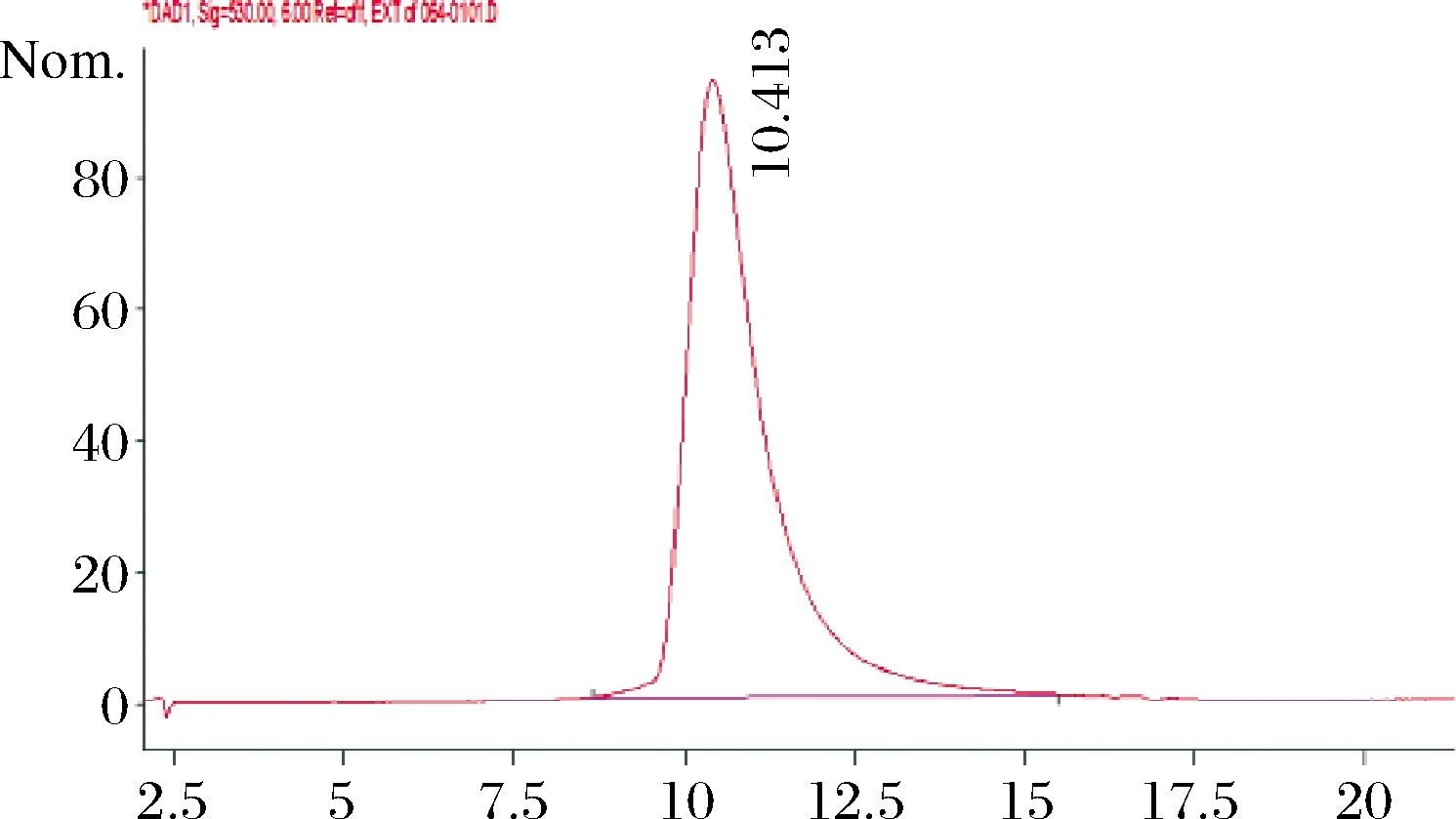
图7 色素提取物的液相色谱图
Fig.7 HPLC spectrum of pigment extract

a-正离子模式;b-负离子模式
图8 色素提取物的质谱图
Fig.8 LC-MS spectra of pigment extract
3 结论
从槐树根际土壤中筛选出产红色素菌株H04,经16S rDNA鉴定为黏质沙雷氏菌。通过单因素试验和正交试验,确定最佳发酵条件:培养基组成为15 g/L蔗糖、0.5 g/L酵母浸粉、0.5 g/L(NH4)2SO4、5 g/L NaCl、0.75 g/L KCl、0.5 g/L CaCO3、10 g/L脯氨酸,按3%接种量在25 ℃、180 r/min摇床发酵24 h,可得产量4.5 g/L,比正交试验前提高了2.3倍。该菌所产色素物质经紫外光谱和液质联用分析确定为灵菌红素。
本文将酵母浸粉和(NH4)2SO4共同作为氮源加入培养基中进行发酵,正交试验方差分析得知,该氮源浓度对H04合成灵菌红素影响显著(P<0.05)。与培养基添加大豆油相比[16],本实验得到的优化发酵条件降低了发酵成本、提高了色素产量,可为进一步提高灵菌红素产量提供参考。单因素试验结果和正交试验方差分析结果表明,培养基中CaCO3浓度对灵菌红素产率有显著性影响(P<0.05),CaCO3在培养基可以起到稳定pH的作用,避免微生物在生长过程中产生有机酸导致发酵液pH降低,使发酵液pH维持在适宜菌体生长的范围。综上所述,通过优化后的培养基提高了发酵灵菌红素产量,为灵菌红素进一步工业化生产提供科学依据。
[1] HAN R, XIANG R J, LI J L, et al.High-level production of microbial prodigiosin:A review[J].Journal of Basic Microbiology, 2021, 61(6):506-523.
[2] KAVITHA R, AISWARIYA S, RATNAVALI C M G.Anticancer activity of red pigment from Serratia marcescens in human cervix carcinoma[J].International Journal of PharmTech Research, 2010, 2(1):784-787.
[3] CHIU W J, LIN S R, CHEN Y H, et al.Prodigiosin-emerged PI3K/beclin-1-independent pathway elicits autophagic cell death in doxorubicin-sensitive and-resistant lung cancer[J].Journal of Clinical Medicine, 2018, 7(10):321.
[4] YIP C H, MAHALINGAM S, WAN K L, et al.Prodigiosin inhibits bacterial growth and virulence factors as a potential physiological response to interspecies competition[J].PLoS One, 2021, 16(6):e0253445.
[5] SHAIKH Z.Biosynthesis of prodigiosin and its applications[J].IOSR Journal of Pharmacy and Biological Sciences, 2016, 11:1-28.
[6] DARSHAN N, MANONMANI H K.Prodigiosin inhibits motility and activates bacterial cell death revealing molecular biomarkers of programmed cell death[J].AMB Express, 2016, 6(1):1-12.
[7] LIU W J, YANG J, TIAN Y N, et al.An in situ extractive fermentation strategy for enhancing prodigiosin production from Serratia marcescens BWL1001 and its application to inhibiting the growth of Microcystis aeruginosa[J].Biochemical Engineering Journal, 2021, 166:107836.
[8] HAN S B, PARK S H, JEON Y J, et al.Prodigiosin blocks T cell activation by inhibiting interleukin-2R alpha expression and delays progression of autoimmune diabetes and collagen-induced arthritis[J].The Journal of Pharmacology and Experimental Therapeutics, 2001, 299(2):415-425.
[9] DARSHAN N, MANONMANI H K.Prodigiosin and its potential applications[J].Journal of Food Science and Technology, 2015, 52(9):5 393-5 407.
[10] KIMYON Ö, DAS T, IBUGO A I, et al.Serratia secondary metabolite prodigiosin inhibits Pseudomonas aeruginosa biofilm development by producing reactive oxygen species that damage biological molecules[J].Frontiers in Microbiology, 2016, 7:972.
[11] LAPENDA J L, ALVES V P, ADAM M L, et al.Cytotoxic effect of prodigiosin, natural red pigment, isolated from Serratia marcescens UFPEDA 398[J].Indian Journal of Microbiology, 2020, 60(2):182-195.
[12] HERR EZ R, MUR A, MERLOS A, et al.Using prodigiosin against some gram-positive and gram-negative bacteria and Trypanosoma cruzi[J].The Journal of Venomous Animals and Toxins Including Tropical Diseases, 2019, 25:e20190001.
EZ R, MUR A, MERLOS A, et al.Using prodigiosin against some gram-positive and gram-negative bacteria and Trypanosoma cruzi[J].The Journal of Venomous Animals and Toxins Including Tropical Diseases, 2019, 25:e20190001.
[13] FARAAG A, EL-BATAL A, EL-HENDAWY H.Characterization of prodigiosin produced by Serratia marcescens strain isolated from irrigation water in Egypt[J].Nature and Science, 2017, 15(5):55-68.
[14] WEI Y H, YU W J, CHEN W C.Enhanced undecylprodigiosin production from Serratia marcescens SS-1 by medium formulation and amino-acid supplementation[J].Journal of Bioscience and Bioengineering, 2005, 100(4):466-471.
[15] WEI Y H, CHEN W C.Enhanced production of prodigiosin-like pigment from Serratia marcescens SMΔR by medium improvement and oil-supplementation strategies[J].Journal of Bioscience and Bioengineering, 2005, 99(6):616-622.
[16] 张丹峰, 杨培周, 操丽丽, 等.粘质沙雷氏菌摇瓶发酵产灵菌红素的工艺优化[J].食品科学, 2015, 36(13):119-124.
ZHANG D F, YANG P Z, CAO L L, et al.Optimization of shake flask cultivation conditions for prodigiosin production by Serratia marcescens[J].Food Science, 2015, 36(13):119-124.
[17] BHAGWAT A, PADALIA U.Optimization of prodigiosin biosynthesis by Serratia marcescens using unconventional bioresources[J].Journal, Genetic Engineering &Biotechnology, 2020, 18(1):26.
[18] 陈新颜, 操丽丽, 杨培周, 等.响应面试验优化黏质沙雷氏菌利用菜籽饼粕产灵菌红素工艺[J].食品科学, 2017, 38(4):231-236.
CHEN X Y, CAO L L, YANG P Z, et al.Response surface optimization of prodigiosin production of Serratia marcescens using rapeseed meal[J].Food Science, 2017, 38(4):231-236.
[19] WILLIAMSON N R, FINERAN P C, LEEPER F J, et al.The biosynthesis and regulation of bacterial prodiginines[J].Nature Reviews Microbiology, 2006, 4(12):887-899.
[20] LEWIS S M, CORPE W A.Prodigiosin-producing bacteria from marine sources[J].Applied Microbiology, 1964, 12(1):13-17.
[21] LI D, LIU J, WANG X, et al.Biological potential and mechanism of prodigiosin from Serratia marcescens subsp.lawsoniana in human choriocarcinoma and prostate cancer cell lines[J].International Journal of Molecular Sciences, 2018, 19(11):3465.