冬枣(Ziziphus jujuba Mill.)是我国一种重要的优良晚熟鲜食品种,多分布在山东、河北、陕西、新疆等地。冬枣营养价值较高,富含糖类、酚类、维生素以及大量对人体有益的矿物质,其中维生素C含量达到245~327 mg/100 g[1]。但冬枣含水量较高,不耐贮藏,易发生酒软变质。因此,为减少经济损失,将冬枣进行干制可延长枣果的货架期,有利于运输和储存,提高冬枣的经济利用价值。
双酶协同酶解工艺作为一种干燥前预处理技术,可促进营养物质的溶出以及粉体特性的提升,已被广泛应用在食品工业中。马利华等[2]运用淀粉酶和纤维素酶制备的速溶复合南瓜粉,物化特性、营养特性以及抗氧化生物活性均有较大的提高。涂招秀等[3]采用双酶协同酶解工艺制备葛根粉,不仅成品率提高而且葛根粉颗粒更加光滑。马强等[4]研究发现复合酶酶解后的猴头菌子实体粉,多糖溶出量增多同时保护胃黏膜作用提升。目前对冬枣粉的研究大多都是直接干燥,对干燥前双酶协同酶解预处理的研究较少。由于冬枣果肉中含有55%果胶和70%纤维素[5],导致冬枣果汁的黏度较大、出汁率较低,喷雾干燥集粉率较低,因此需要加入酶来分解果胶、纤维素,提高出汁率进而促进可溶性物质的溶出。在果蔬加工过程中使用的酶有果胶酶、纤维素酶、淀粉酶、鼠李糖苷酶、中性蛋白酶等,最常用的为果胶酶和纤维素酶。
因此,本研究将新鲜的冬枣进行果胶酶和纤维素酶双酶协同酶解预处理,并通过喷雾干燥技术制备得到冬枣粉,通过探讨对照组和处理组冬枣粉的理化性质及结构特征的影响,以期为冬枣的深加工提供理论参考。
1 材料与方法
1.1 材料与试剂
陕西大荔冬枣,市售。
果胶酶、纤维素酶、麦芽糊精,浙江一诺生物科技;甲醇、H2SO4、HCl、NaOH、乙酸乙酯、正己烷、FeCl3(均为分析纯),成都科龙化工试剂;福林酚试剂、Trolox、DPPH、ABTS(均为分析纯),美国Sigma。
1.2 仪器与设备
SCIENTZ-20F喷雾干燥机,上海乔枫实业有限公司;Cilio BT-020M破壁机,广州飞展公司;PAL-1手持折射仪,日本ATAGO;RV 10旋转蒸发仪,德国IKA公司;AH-BASIC 30高压均质机,苏州安拓思纳米技术有限公司;Ultra Scan Pro测色仪,美国Hunter Lab;Phenom Pro扫描电子显微镜,荷兰Phenom World;Spectrun100傅里叶红外光谱仪,美国Perkin Elmer;X’Pert PRO X射线衍射仪,荷兰帕纳科公司;TG209F1热重分析仪,德国耐驰公司;Synegy H1MG酶标仪,美国基因;Mastersizer 3000激光粒度仪,马尔文帕纳科;TU-1950双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;1-15PK离心机,美国Sigma公司。
1.3 实验方法
1.3.1 冬枣粉制作工艺
冬枣→去核切分→超声→破碎→双酶协同酶解处理→灭酶→过滤→浓缩→加助干剂→均质→喷雾干燥→产品
将清洗干净的冬枣去核后切分为8瓣,加入冬枣质量3倍的纯水,超声20 min后用破壁机破碎,在之前实验的基础上确定冬枣最佳双酶协同酶解工艺为果胶酶添加量0.3%,纤维素酶添加量0.5%,酶解时间40 min,酶解温度50 ℃。酶解结束后,在微波700 W下灭酶3 min后过滤,将得到的滤液浓缩至可溶性固形物含量15%,添加助干剂麦芽糊精后用高压均质机进行均质,再进行喷雾干燥,得到冬枣粉成品。
1.3.2 冬枣粉理化性质测定
1.3.2.1 粒径测定
利用激光粒度仪测定冬枣粉的粒径及其分布。粒度分布的宽度(span)计算如公式(1)所示:
(1)
式中:D90、D10、D50分别表示累计粒度分布达到90%、10%和50%所对应的粒径。
1.3.2.2 色度测定
以白板为标准,采用测色仪测定冬枣粉的亮度值L*、红绿值a*,黄蓝值b*和色差值ΔE。ΔE的计算如公式(2)所示:
(2)
式中:ΔL、Δa、Δb分别表示与标准白板色度差值。
1.3.2.3 溶解时间测定
称取1.0 g的冬枣粉,加入100 mL 25 ℃的蒸馏水,使用电动搅拌器搅拌溶解,并记录从开始到完全溶解所需要的时间。
1.3.2.4 溶解度测定
向50 mL蒸馏水的100 mL的烧杯中加入5.0 g(m1)冬枣粉,搅拌均匀,离心(3 000 r/min,10 min),取5 mL上清液置于已恒重的称量瓶(m2)中,在(105±2) ℃的温度下干燥至恒重,此时,记为m3。溶解度的计算如公式(3)所示:
溶解度![]()
(3)
1.3.2.5 溶胀性及复水性测定
参考BI等[6]的方法。
1.3.2.6 容积密度测定
参考ZHANG等[7]的方法并稍作修改,将粉末样品填充到10 mL量筒(m1)中,直至达到刻度线标记并称重(m2),容积密度的计算如公式(4)所示。
容积密度![]()
(4)
1.3.2.7 持水力及持油力测定
参考夏晓霞等[8]的方法。
1.3.2.8 休止角及滑动角测定
休止角测定:参考HUANG等[9]的方法并稍作修改。将漏斗垂直固定平面顶部,平面高度(H)距离漏斗出口约3 cm。随后,将粉末样品倒入漏斗中,直到粉末堆尖端触到漏斗出口。圆锥半径测量为R。休止角(α)的计算如公式(5)所示:
(5)
滑动角测定:将约5.0 g冬枣粉倒在长度(L)为135 mm的正方形玻璃板上,通过提起玻璃板直到粉末表面开始滑动来确定滑动角。测量倾斜玻璃板顶部和水平面之间的垂直高度(H),将倾斜玻璃和水平面之间的角度定义为滑动角(β),β的计算如公式(6)所示:
(6)
1.3.2.9 集粉率测定
集粉率的计算如公式(7)所示:
集粉率![]()
(7)
式中:m1,喷雾干燥后成品质量,g;m2,麦芽糊精添加质量,g;ω,浓缩液可溶性固形物含量,%。
1.3.2.10 功能性成分测定
参考付晓伟等[10]的方法测定维生素C的含量;采用GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》测定还原糖的含量;采用蒽酮-硫酸法测定多糖的含量;参考SUN等[11]的方法测定黄酮的含量;参考贾雨朦等[12]的方法测定多酚的含量。
1.3.2.11 抗氧化活性测定
枣粉提取液的制备参考贾雨朦等[12]的方法。
DPPH自由基清除能力测定:参考WANG等[13]的方法,以Trolox为阳性对照。得回归方程:y=0.216 1x-0.021 6(R2=0.990 8),DPPH自由基清除率的计算如公式(8)所示:
DPPH自由基清除率![]()
(8)
式中:Ai,样品与DPPH吸光值;Aj,空白溶液与DPPH吸光值。
Fe3+还原能力测定:参考TABART等[14]的方法。以Trolox为阳性对照,得回归方程:y=0.801 7x+0.083 7(R2=0.999 2)。
ABTS阳离子自由基清除能力:参考JEONG等[15]的方法。以Trolox为阳性对照,得回归方程:y=68.932 0x+27.621 4(R2=0.998 6),ABTS阳离子自由基清除率的计算如公式(9)所示:
ABTS阳离子自由基清除率![]()
(9)
式中:Ai,ABTS储备液与样品溶液反应吸光值;Aj,ABTS储备液与空白溶液反应吸光值。
1.3.3 结构特征测定
1.3.3.1 外观形态及扫描电镜分析
采用肉眼观察与扫描电子显微镜在电压10 kV、压力60 Pa和距离10 mm下,2种放大倍数(2 000倍和500倍)下观察样品的形态特征。
1.3.3.2 傅里叶红外光谱扫描
将干燥的KBr与3 mg冬枣粉以100∶1的质量比混合于玛瑙研钵中,充分研磨后加入压膜器内压片,然后放入仪器中扫描,扫描范围400~4 000 cm-1,扫描分辨率4 cm-1,扫描32次。
1.3.3.3 X-射线衍射
使用载玻片将冬枣粉压在铝盘上,在10°~50°的衍射角(2θ)扫描,扫描速率为2 °/min。
1.3.3.4 热重分析
取3~5 mg冬枣粉,在N2流下从30~800 ℃进行热重分析,升温速率为10 ℃/min。
1.4 数据分析方法
每组试验平行测定3次,结果采用SPSS Statistics 18.0数据分析软件进行差异显著性分析,并用Origin 2019作图。
2 结果与分析
2.1 双酶协同酶解对冬枣粉理化性质的影响
2.1.1 粒径
双酶协同酶解处理前后冬枣粉的粒径见表1和图1。由表1可知,与对照组未经酶解处理得到的冬枣粉相比,处理组的粉体粒径显著减小(P<0.05),平均粒径由32.24 μm降到8.75 μm,下降了72.86%,原因可能是酶解过程中破坏了细胞壁以及大分子物质,使得制得的粉体颗粒更小。Span随粒径减小而显著降低,由26.42下降到15.61,下降了69.25%,说明酶解处理后冬枣粉粒度分布更均匀;由图1可知,处理组粉体粒径的分布曲线整体向左移动,表明酶解后冬枣粉的总体粒径下降[16]。

图1 双酶协同酶解处理前后冬枣粉的粒径分布图
Fig.1 Particle size distribution of winter jujube powder before and after enzymatic hydrolysis
表1 双酶协同酶解处理前后冬枣粉的粒径分布
Table 1 Particle size of winter jujube powder before and after enzymatic hydrolysis
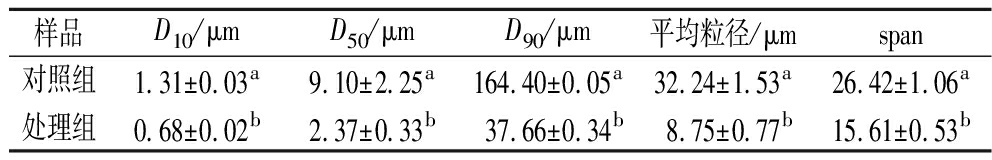
样品D10/μmD50/μmD90/μm平均粒径/μmspan对照组1.31±0.03a9.10±2.25a164.40±0.05a32.24±1.53a26.42±1.06a处理组0.68±0.02b2.37±0.33b37.66±0.34b8.75±0.77b15.61±0.53b
注:D10、D50和D90表示累计粒度分布数达到10%、50%和90%时所对应的粒径;同列不同小写字母表示差异显著(P<0.05)(下同)。
2.1.2 色度
由图2可知,与对照组相比,处理组颜色更加白亮。采用色差仪对冬枣粉进行色度值测定,结果如表2所示。

图2 双酶协同酶解处理前后冬枣粉的外观图
Fig.2 Appearance diagram of winter jujube powder before and after enzymatic hydrolysis
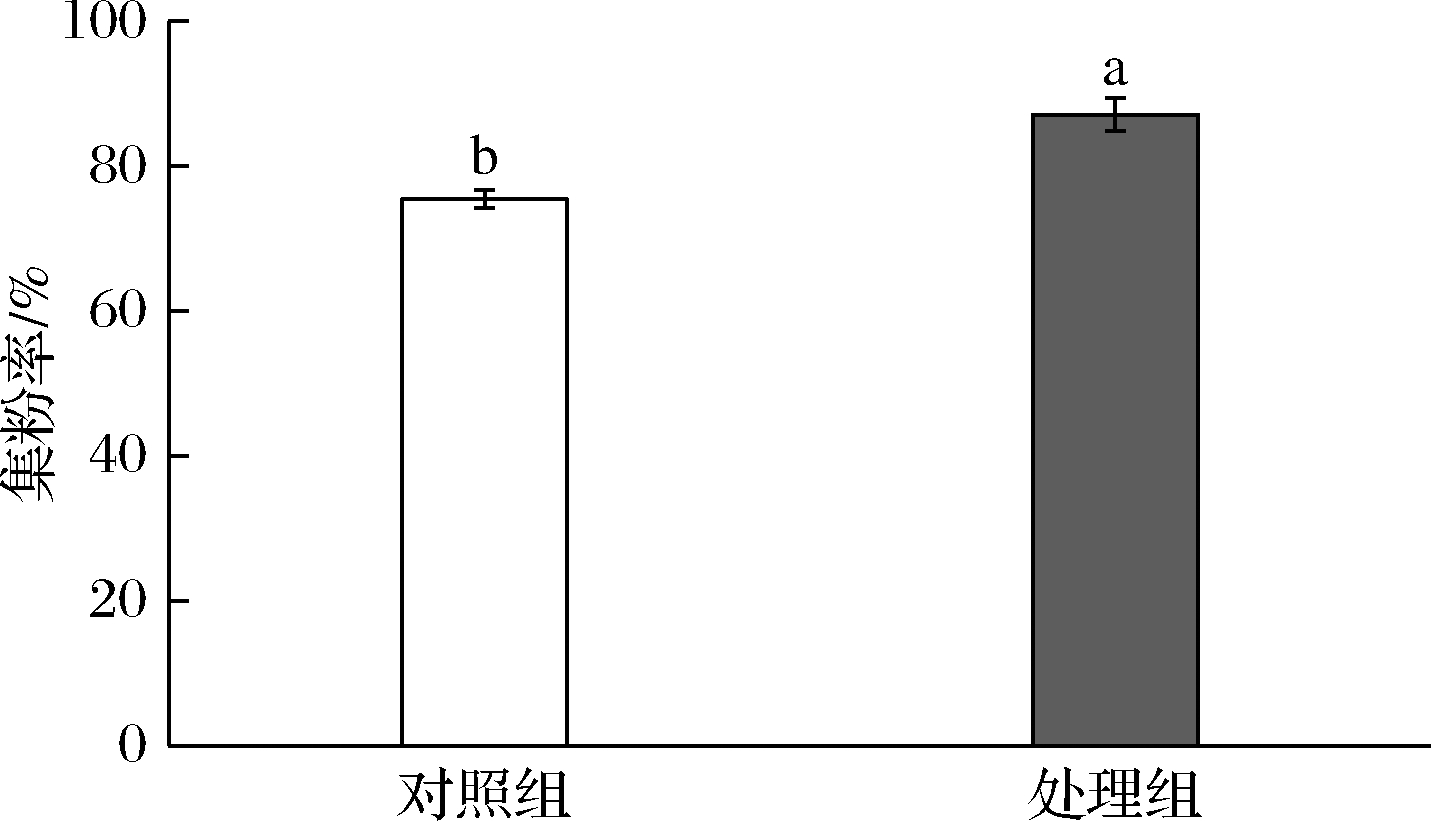
图3 双酶协同酶解处理前后冬枣粉的集粉率
Fig.3 The collection rate of winter jujube powder before and after enzyme hydrolysis
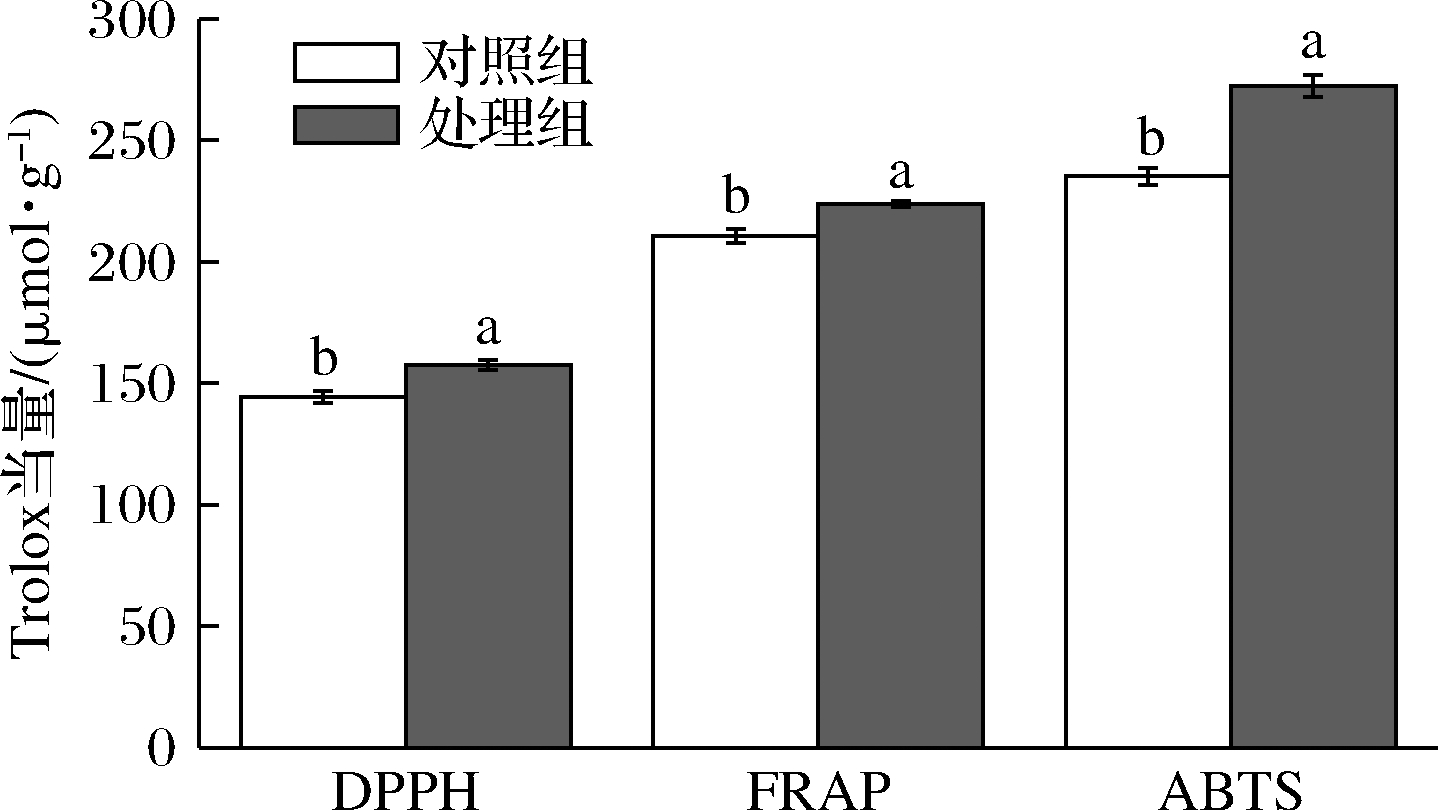
图4 双酶协同酶解处理前后冬枣粉的抗氧化活性
Fig.4 Antioxidant activity of winter jujube powder before and after enzymatic hydrolysis
表2 双酶协同酶解处理前后冬枣粉的色度变化
Table 2 Color changes of winter jujube powder before and after enzymatic hydrolysis
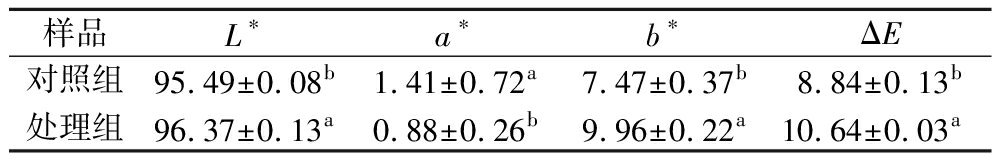
样品L∗a∗b∗ΔE对照组95.49±0.08b1.41±0.72a7.47±0.37b8.84±0.13b处理组96.37±0.13a0.88±0.26b9.96±0.22a10.64±0.03a
由表2可知,L*值从95.49增加到96.37,增加了0.92%;a*值从1.41降低到0.88,下降了60.22%;b*值从7.47增加到9.96,增加了33.33%,表明双酶协同酶解处理后冬枣粉的亮度和黄度增加,红度降低,更偏向冬枣本身的黄绿色。同时,与标准白板色差值ΔE相比,处理组比对照组有明显增加(P<0.05)。
2.1.3 溶解时间及溶解度
由表3可知,冬枣粉溶解时间由83.29 s降低到54.81 s,降低了51.96%,原因可能是处理组冬枣粉体颗粒较小,与水的接触面积增大进而缩短了溶解时间;同时双酶协同酶解处理改变了冬枣粉的溶解度,溶解度由原来的83.94%增加到86.44%,增加了2.98%,可能是由于颗粒越小,粉体溶解度越强。
表3 双酶协同酶解处理前后冬枣粉的理化特性
Table 3 Physicochemical properties of winter jujube powder before and after enzyme hydrolysis
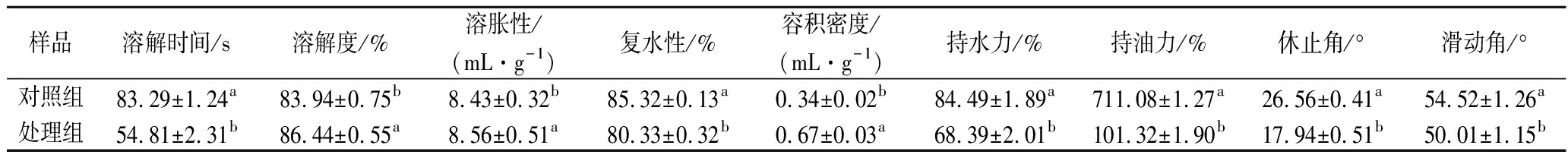
样品溶解时间/s溶解度/%溶胀性/(mL·g-1)复水性/%容积密度/(mL·g-1)持水力/%持油力/%休止角/°滑动角/°对照组83.29±1.24a83.94±0.75b8.43±0.32b85.32±0.13a0.34±0.02b84.49±1.89a711.08±1.27a26.56±0.41a54.52±1.26a处理组54.81±2.31b86.44±0.55a8.56±0.51a80.33±0.32b0.67±0.03a68.39±2.01b101.32±1.90b17.94±0.51b50.01±1.15b
2.1.4 溶胀性及复水性
由表3可知,处理组溶胀性由8.43 mL/g上升到8.56 mL/g,上升了1.54%(P<0.05),说明处理组溶于水后稳定性及悬浮性更好。然而,较对照组,处理组复水性降低了6.21%(P<0.05),原因可能是复水性与粒径呈正相关,粒径越小,复水性越小。
2.1.5 容积密度
容积密度是制备片剂或胶囊产品时的重要参数,容积密度越高越有利于产品的形成和运输[17]。由表3可知,与对照组相比,处理组容积密度显著增加(P<0.05),由0.34 mL/g增加到0.67 mL/g,原因可能是处理组粒径较小,其颗粒之间的孔隙也较小,从而导致体积密度增加,该结果与HUANG等[9]的研究结果一致。
2.1.6 持水力及持油力
由表3可知,与对照组相比,处理组持水力和持油力都显著减小(P<0.05),持水力由84.49%下降到68.39%,下降了23.54%,持油力由711.08%下降到101.32%,下降了601.81%,可能是双酶协同酶解处理后,冬枣粉粒径减小,对水的束缚能力减弱,更不易吸收水分;持油性主要是粉体中亲油性物质所决定,对照组由于粒径大,形状不规则,孔隙较大,从而使油脂很好的填充其中,而处理组在酶解后,颗粒孔隙减小因此持油力降低[18]。
2.1.7 休止角及滑动角
休止角和滑动角是评定粉末流动性的参数。通常,休止角和滑动角越小,粉末的流动性越好[6]。由表3可知,与对照组相比,处理组休止角和滑动角均显著减小(P<0.05),休止角由26.56°下降到17.94°,下降了48.05%,滑动角由54.42°下降到50.01°,下降了8.82%,表明双酶协同酶解处理后冬枣粉的流动性较好,原因可能是经酶解处理后冬枣粉颗粒成圆球状,并且相较于对照组表面更均匀圆滑,如图5所示,使得处理组的流动性较好[9]。研究表明,粉体流动性与颗粒的粒径、形状、密度、表面粗糙程度等因素有关。颗粒形状愈接近于球形,粉体流动性越好[19]。

图5 双酶协同酶解处理前后冬枣粉的扫描电镜图
Fig.5 Scanning electron microscopy of winter jujube powder before and after enzymatic hydrolysis
2.1.8 集粉率
由图3可知,处理组集粉率显著增加,由75.48%增加到87.13%,增加了15.43%,原因可能是酶解处理破坏了冬枣的细胞壁,促进了营养物质的溶出,可溶性固形物含量增加从而成品质量增加。
2.1.9 功能性成分
果蔬中植物细胞的主要成分是纤维素和果胶等,而果胶酶、纤维素酶可以破坏细胞壁,促进功能性成分的溶出。由表4可知,对照组和处理组的维生素C含量分别为295.60、256.55 mg/100 g,是橙子(68.88 mg/100 g)的数十倍[20]。与对照组相比,处理组的维生素C含量显著降低(P<0.05),其原因可能是维生素C是热敏性物质,酶解处理后的微波灭酶工艺会导致维生素C降解进而导致含量的降低[21]。还原糖及总糖含量分别增加了6.65%、11.45%(P<0.05),表明双酶协同酶解处理有利于冬枣粉糖类物质的保留。同时,总酚和黄酮含量分别增加了20.50%、13.00%(P<0.05),表明双酶协同酶解处理会促进冬枣粉中黄酮和总酚的释放,这与RAKARIYATHAM等[22]的研究结果一致。
表4 双酶协同酶解处理前后冬枣粉的功能性成分
Table 4 Functional components of winter jujube powder before and after enzymatic hydrolysis
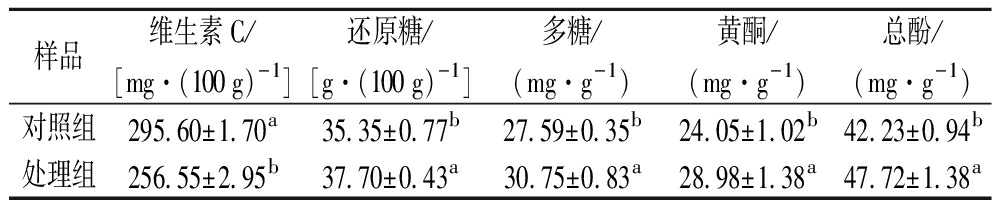
样品维生素C/[mg·(100 g)-1]还原糖/[g·(100 g)-1]多糖/(mg·g-1)黄酮/(mg·g-1)总酚/(mg·g-1)对照组295.60±1.70a35.35±0.77b27.59±0.35b24.05±1.02b42.23±0.94b处理组256.55±2.95b37.70±0.43a30.75±0.83a28.98±1.38a47.72±1.38a
2.1.10 抗氧化活性
如图4所示,处理组的抗氧化活性均显著优于对照组,原因可能是酶解处理促进了冬枣内酚类等抗氧化活性物质的溶出,同时处理组粒径减小,增加了冬枣粉表面积进而促进了活性物质的释放,这与SANTOS等[23]的研究结果一致。
2.2 双酶协同酶解对冬枣粉结构特征的影响
2.2.1 扫描电镜分析
图5为对照组和处理组冬枣粉分别在2 000与5 000倍的扫描电镜图。
可以看出,相比对照组,处理组颗粒分布更为均匀,形状更接近于光滑球状并且大颗粒塌陷较少,这可能是由于粒径减小后其表面吸附力增强,粉体之间的相互作用力增大,表现出较强的稳定性,不易在空气中受到破坏。
2.2.2 红外光谱分析
由图6可知,处理组与对照组的峰位置和形状基本相似,只是强度出现差异,说明双酶协同酶解处理对冬枣粉中的官能团没有明显影响。冬枣粉的主要吸收峰中,3 271、3 257 cm-1附近的吸收峰是由CH![]() CH2伸缩振动引起的;在2 921、2 886 cm-1附近的吸收峰是由氨基上的不对称伸缩振动引起的;1 643、1 647 cm-1附近的吸收峰是由于OH和CH2振动引起;1 404、1 403 cm-1附近的吸收峰是CH3对称弯曲振动引起;1 015、1 016 cm-1处的吸收峰可能是由C—O—C、C—O—H振动引起[24]。
CH2伸缩振动引起的;在2 921、2 886 cm-1附近的吸收峰是由氨基上的不对称伸缩振动引起的;1 643、1 647 cm-1附近的吸收峰是由于OH和CH2振动引起;1 404、1 403 cm-1附近的吸收峰是CH3对称弯曲振动引起;1 015、1 016 cm-1处的吸收峰可能是由C—O—C、C—O—H振动引起[24]。

图6 双酶协同酶解处理前后冬枣粉的傅里叶红外光谱图
Fig.6 FTIR spectra of winter jujube powder before and after enzymatic hydrolysis
2.2.3 X-射线衍射分析
由图7可知,对照组和处理组冬枣粉在18°有一个衍射强度弱的峰,其他位置几乎没有衍射峰,呈现出明显的无定形特征,原因可能是冬枣粉中含有大量的糖类物质以及有机酸,这些物质在干燥过程中迅速脱水形成无定形粉末[25]。另外,对照组和处理组冬枣粉的衍射强度无明显差异,说明双酶协同酶解处理并未改变冬枣粉的结晶结构。
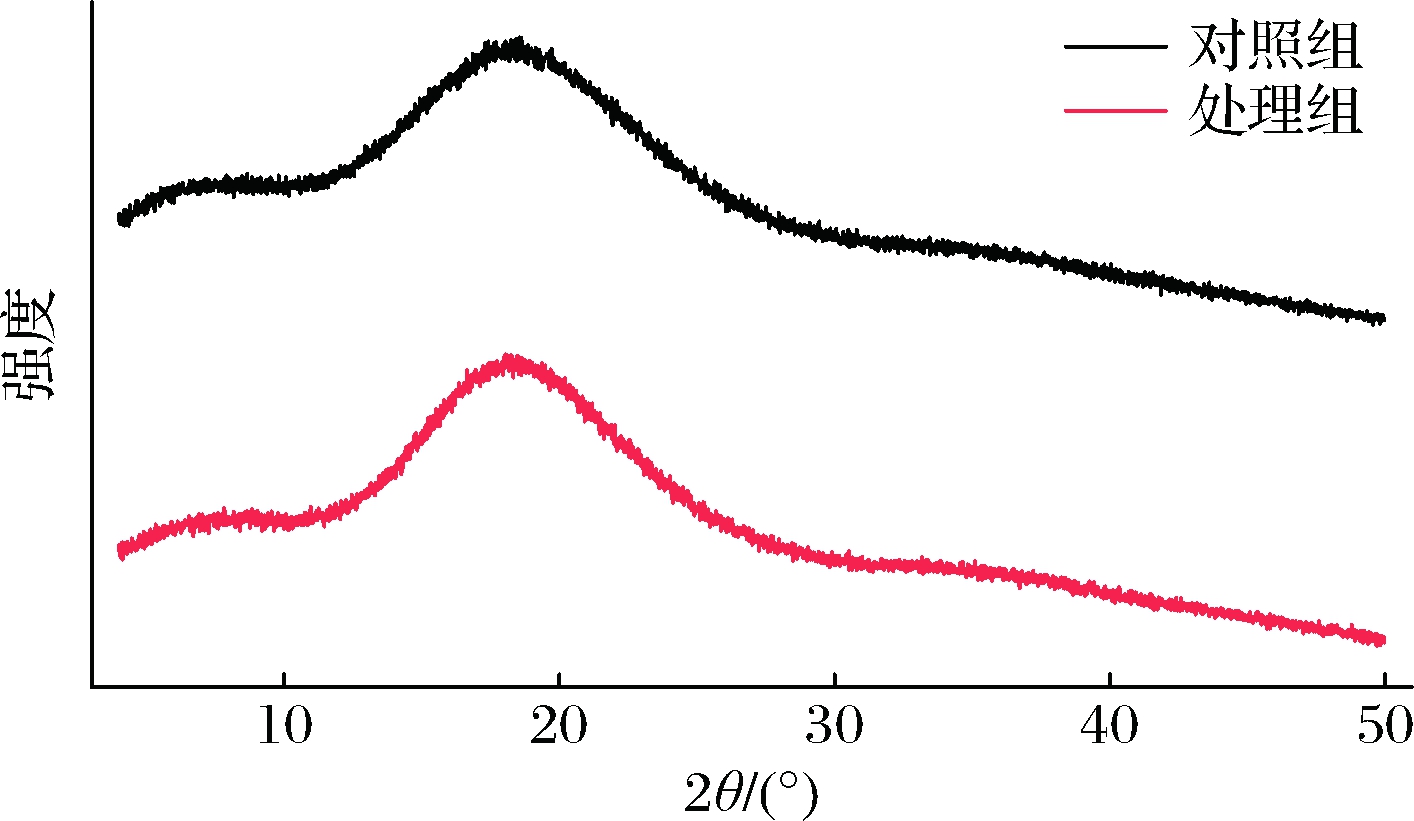
图7 双酶协同酶解处理前后冬枣粉的X-射线衍射图
Fig.7 X-ray diffraction pattern of winter jujube powder before and after enzymatic hydrolysis
2.2.4 热重分析
热重(thermogravimetry, TG)曲线反映了枣粉质量随温度上升的变化,热重微分曲线(derivative thermogravimetry, DTG)是TG对时间的一阶导数,表示质量的变化率。由图8可知,对照组与处理组冬枣粉的失重大致可分为3个阶段:第1阶段为20~170 ℃,该阶段冬枣粉主要失去自由水、结晶水以及小分子碳氢化合物,50 ℃达到最大失重速率。第2个失重阶段是热分解过程的主要阶段,温度为120~400 ℃,在此阶段,冬枣粉的失重率均显著增加(P<0.05),原因可能是在该温度范围内,多糖自身发生了剧烈的热裂解反应,碳链和氢键发生断裂,生成H2O和CO2[26]。500 ℃之后,冬枣粉热分解进入平缓的第3阶段,此阶段主要是热解残余物缓慢分解。同时双酶协同酶解处理前后冬枣粉在TG、DTG曲线中都具有相似的趋势且变化较小。

a-DG分析图;b-DTG分析图
图8 双酶协同酶解处理前后冬枣粉的热重分析
Fig.8 Thermogravimetric analysis of winter jujube powder before and after enzymatic hydrolysis
3 结论
双酶协同酶解处理后冬枣粉粒径显著降低,色泽更偏向黄绿色,溶解时间、溶解度、溶胀性随粒径的减小而有所改善;粉体流动性得到显著提升;功能性成分除维生素C含量显著降低,还原糖、黄酮、总酚均显著增高,且集粉率和抗氧化性得到显著提高;相较于对照组,处理组的晶体结构及热稳定性无明显变化。综上所述,双酶协同酶解处理作为一种干燥前预处理技术,在未改变喷雾干燥冬枣粉晶体结构及热稳定性的基础上,有效改善了冬枣粉的理化性质,促进了生物活性物质的溶出,同时提高了集粉率和抗氧化活性,为冬枣的深加工提供一定的理论指导意义,同时验证双酶协同酶解处理在冬枣粉加工业中具有一定应用前景。
[1] 芮玉奎, 申琳, 生吉萍.冬枣果实中微量元素和重金属含量研究[J].光谱学与光谱分析, 2008(8):1 928-1 930.
RUI Y K, SHEN L, SHENG J P.Content of trace elements and heavy metals in Chinese winter jujube fruit[J].Spectroscopy &Spectral Analysis, 2008, 28(8):1 928-1 930.
[2] 马利华, 宋慧, 陈学红, 等.复合酶法制备速溶复合南瓜粉的研究[J].徐州工程学院学报(自然科学版), 2017, 32(1):38-43.
MA L H, SONG H, CHEN X H, et al.Preparation of compound instant-powder of pumpkin by composite enzymatic method[J].Journal of Xuzhou Institute of Technology (Natural Sciences Edition), 2017, 32(1):38-43.
[3] 涂招秀, 罗斌, 李雄辉, 等.复合酶制备葛根粉的工艺研究[J].江西化工, 2013(3):76-79.
TU Z X, LUO B, LI X H, et al.Preparation of kuzdu vine with mixed-enzymes[J].Jiangxi Chemical Industry, 2013(3):76-79.
[4] 马强, 杨焱, 张忠, 等.猴头菌子实体粉的复合酶解及其功能特性[J].食用菌学报, 2022, 29(2):54-64.
MA Q, YANG Y, ZHANG Z, et al.Multienzyme complex hydrolysis of Hericium erinaceus fruiting body powder and in vitro activity of the released polysaccharides[J].Acta Edulis Fungi, 2022, 29(2):54-64.
[5] 王霞伟, 王曼, 邓豪, 等.雾化熏蒸结合气调包装技术在冬枣采后贮运保鲜中的应用[J].现代食品科技, 2021, 37(10):153-161.
WANG X W, WANG M, DENG H, et al.Application of atomization fumigation combined with modified atmosphere packaging technology in storage, transportation and preservation of winter jujube[J].Modern Food Science and Technology, 2021, 37(10):153-161.
[6] BI J F, CHEN Q Q, ZHOU Y H, et al.Optimization of short- and medium-wave infrared drying and quality evaluation of jujube powder[J].Food and Bioprocess Technology, 2014, 7(8):2 375-2 387.
[7] ZHANG J T, DONG Y S, NISAR T, et al.Effect of superfine-grinding on the physicochemical and antioxidant properties of Lycium ruthenicum Murray powders[J].Powder Technology, 2020, 372:68-75.
[8] 夏晓霞, 寇福兵, 薛艾莲, 等.超微粉碎对枣粉理化性质、功能特性及结构特征的影响[J].食品与发酵工业, 2022, 48(12):37-45.
XIA X X, KOU F B, XUE A L, et al.Effect of superfine grinding on physicochemical properties, functional and structure characteristics of jujube powder[J].Food and Fermentation Industries, 2022, 48(12):37-45.
[9] HUANG X, LIANG K H, LIU Q, et al.Superfine grinding affects physicochemical, thermal and structural properties of Moringa oleifera leaf powders[J].Industrial Crops and Products, 2020, 151:112472.
[10] 付晓伟, 吴晓, 姜莉莉, 等.紫外分光光度法测定水果中维生素C含量[J].山东化工, 2020, 49(24):102-103;105.
FU X W, WU X, JIANG L L, et al.Deter mination of vitamin C in fruits by UV spectrophotometry[J].Shandong Chemical Industry, 2020, 49(24):102-103;105.
[11] SUN L J, ZHANG J B, LU X Y, et al.Evaluation to the antioxidant activity of total flavonoids extract from persimmon (Diospyros kaki L.) leaves[J].Food and Chemical Toxicology, 2011, 49(10):2 689-2 696.
[12] 贾雨朦, 陈芹芹, 毕金峰, 等.滁菊的功能成分及其体外抗氧化活性[J].食品科学, 2019, 40(23):66-72.
JIA Y M, CHEN Q Q, BI J F, et al.Functional components and in vitro antioxidant activity of Chrysanthemum flower (Chrysanthemum morifolium Ramat) from Chuzhou[J].Food Science, 2019, 40(23):66-72.
[13] WANG Y T, LIU F X, CAO X M, et al.Comparison of high hydrostatic pressure and high temperature short time processing on quality of purple sweet potato nectar[J].Innovative Food Science &Emerging Technologies, 2012, 16:326-334.
[14] TABART J, KEVERS C, EVERS D, et al.Ascorbic acid, phenolic acid, flavonoid, and carotenoid profiles of selected extracts from Ribes nigrum[J].Journal of Agricultural and Food Chemistry, 2011, 59(9):4 763-4 770.
[15] JEONG J H, JUNG H, LEE S R, et al.Anti-oxidant, anti-proliferative and anti-inflammatory activities of the extracts from black raspberry fruits and wine[J].Food Chemistry, 2010, 123(2):338-344.
[16] 寇福兵, 夏晓霞, 薛艾莲, 等.超微粉碎对板栗粉理化特性及结构特征的影响[J].食品与发酵工业, 2022, 48(13):155-162.
KOU F B, XIA X X, XUE A L, et al.Effect of superfine grinding on physicochemical properties and structural characteristics of Chinese chestnut powder[J].Food and Fermentation Industries, 2022, 48(13):155-162.
[17] HUANG X, DOU J Y, LI D, et al.Effects of superfine grinding on properties of sugar beet pulp powders[J].LWT, 2018, 87:203-209.
[18] WANG T, SUN X H, ZHOU Z X, et al.Effects of microfluidization process on physicochemical properties of wheat bran[J].Food Research International, 2012, 48(2):742-747.
[19] 王阳, 颜才植, 叶发银, 等.膳食纤维粉体流动性与其颗粒结构的关系[J].食品科学, 2018, 39(10):84-88.
WANG Y, YAN C Z, YE F Y, et al.Relationship between flowability and particle structure of dietary fiber powders[J].Food Science, 2018, 39(10):84-88.
[20] 张馨媛, 井乐刚.不同水果中维生素C含量及降解动力学的研究[J].哈尔滨师范大学自然科学学报, 2022, 38(2):68-74.
ZHANG X Y, JING L G.Content and degradation kinetics of vitamin C in different fruits[J].Natural Science Journal of Harbin Normal University, 2022, 38(2):68-74.
[21] CHEN Q Q, BI J F, ZHOU Y H, et al.Multi-objective optimization of spray drying of jujube (Zizyphus jujuba miller) powder using response surface methodology[J].Food and Bioprocess Technology, 2014, 7(6):1 807-1 818.
[22] RAKARIYATHAM K, LIU X Y, LIU Z Y, et al.Improvement of phenolic contents and antioxidant activities of Longan (Dimocarpus longan) peel extracts by enzymatic treatment[J].Waste and Biomass Valorization, 2020, 11(8):3 987-4 002.
[23] SANTOS ARAUJO H C, JESUS M S, LEITE NETA M T S, et al.Effect of maltodextrin and gum Arabic on antioxidant activity and phytochemical profiles of spray-dried powders of sapota (Manilkara zapota) fruit juice[J].Drying Technology, 2021, 39(3):392-404.
[24] 翁诗甫. 傅里叶变换红外光谱分析[M].2版.北京:化学工业出版社, 2010.
WENG S F.Fourier Transform Infrared Spectroscopy Analysis[M].Beijing:Chemical Industry Press, 2010.
[25] CAPARINO O A, TANG J, NINDO C I, et al.Effect of drying methods on the physical properties and microstructures of mango (Philippine ‘Carabao’ var.) powder[J].Journal of Food Engineering, 2012, 111(1):135-148.
[26] 史早, 张甫生, 杨金来, 等.超微粉碎对方竹笋全粉理化特性及微观结构的影响[J].食品工业科技, 2021, 42(24):40-47.
SHI Z, ZHANG F S, YANG J L, et al.Effect of superfine grinding on physicochemical properties and microstructure of Chimonobambusa quadrangularis shoot powder[J].Science and Technology of Food Industry, 2021, 42(24):40-47.