醛类物质是白酒中一类微量成分,其产生于白酒生产的全过程,可能来源于生产原料、发酵过程中美拉德反应、贮存过程中氧化还原反应等[1-4]。白酒中含多种醛类,有的呈香强烈,是白酒香气风味的重要组成,如丁醛、乙缩醛等能产生花香、水果香[5-6];有的具有一定生物活性,如3,4-二羟基苯甲醛、5-羟甲基糠醛有抗炎作用[7];但某些醛类也会危害人体健康,存在一定的安全隐患[8]。
甲醛是一种无色、有刺激性气味的物质,可刺激神经系统、消化道和眼睛,能与蛋白质结合,诱发疾病[9]。甲醛及其前体物质天然存在于植物中,只要微生物发酵,进行新陈代谢就会产生甲醛,因此它广泛存在于各类天然植物甚至动物食品中[10-12]。美国环境保护局(US Environment Protection Agency,US EPA)规定甲醛的每日可接受摄取量为0.2 mg/kg[13]。在我国,食品中禁止使用甲醛作为添加剂。
甲醛存在于各类白酒产品中,但由于其沸点低、易挥发的性质使得其在白酒中的研究较少[14]。我国食品中甲醛测定标准及相关规定共有6项,每项标准均只针对某一食品品类的甲醛进行测定,而国际上有关食品中甲醛测定方法的标准较少,仅美国分析化学家协会(Association of Official Analytical Chemists, AOAC)和US EPA有相关检测方法标准[15],主要有分光光度法和色谱法[16-17]。分光光度法对仪器设备要求低,但检出限高、选择性差、准确性较低、易出现假阳性[18]。色谱法具有较高的检测准确性,但白酒中高浓度乙醇会使目标物产生基质增强效应,降低方法稳定性;白酒中其他醛类如糠醛、乙缩醛、异戊醛等色谱行为都与甲醛相似,对色谱法甲醛检测的准确性有较大影响[19-22];此外,色谱法采用2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)柱前衍生,反应专一性差,几乎能与所有酮、醛发生反应,衍生产物复杂,不适用于白酒类样品的甲醛检测[23]。高效液相色谱-高分辨质谱(ultra performance liquid chromatography-Q/Orbitrap high resolution mass spectrometry,UPLC-Q/Orbitrap HRMS)不仅具有分离效果好、灵敏度高等优点,还具有较高的选择性,通过准分子离子可以直接对目标物进行定性定量分析,能够有效排除白酒样品大量挥发性成分及其他醛类物质的干扰,准确度高、检出限低[24-25]。
本方法对白酒样品直接衍生或稀释后衍生、检测,无需提取、蒸馏,简化了前处理过程,仪器分析时长仅10 min;使用乙酰丙酮衍生,选择性好,与甲醛反应生成2,6-二甲基-3,5-二乙酰基-1,4-二氢吡啶,特异性强[23],与色谱法相比,利用一级分子离子定量,二级碎片离子辅助定性,降低了白酒中复杂基质的干扰,提高了检测特异性和准确度,适用于白酒样品分析检测,能满足酿造过程中痕量甲醛的分析需求。通过该方法考察了某企业酱香型白酒生产过程中甲醛含量变化及规律,为白酒生产过程中甲醛的产生、控制及消除提供参考。
1 材料和方法
1.1 材料与试剂
样品:某酱香型白酒企业生产的某一轮次内不同蒸馏阶段酱香基酒、1年内7个发酵轮次酱香基酒及新勾兑的酱香成品酒;不同品牌酱香型白酒产品,市售。
标准品:甲醛标准品(10.1 mg/mL),中国计量科学研究院。
试剂:乙酸铵(色谱纯),Fisher chemical;乙酸、乙腈(均为色谱纯),TEDIA公司;乙酰丙酮(分析纯),上海沪试;无水乙醇(分析纯),天津市大茂化学试剂厂。
1.2 仪器与设备
Q Exactive Focus超高效液相-高分辨质谱仪,Thermo Scientific;电子天平(0.000 1 g),美国OHAUS公司;QT-1涡旋混合器,上海琪特分析仪器有限公司;数显恒温水浴锅,常州国华电器有限公司。
1.3 试验方法
1.3.1 溶液配制
乙酰丙酮衍生剂:称取12.50 g乙酸铵置于100 mL容量瓶,少许超纯水溶解,加入1.5 mL乙酸和0.20 g乙酰丙酮,超纯水定容至100 mL,4 ℃冰箱中避光保存。
甲醛标准储备液:准确吸取0.1 mL甲醛标准品于10 mL容量瓶中,用超纯水溶解并准确配制成质量浓度为101.0 mg/L的标准储备液,4 ℃冰箱中避光保存。
甲醛系列标准工作溶液:准确移取适量甲醛标准储备液,超纯水配制质量浓度为202.0、152.0、101.0、50.5、20.2、10.1、5.1 μg/L的标准系列工作溶液。
1.3.2 样品前处理
样品衍生:分别准确吸取1 mL 53%乙醇溶液(空白)、标准系列工作溶液、待测酒样于10 mL试管中,加入0.1 mL乙酰丙酮衍生剂,涡旋混匀,置于60 ℃水浴锅中衍生30 min,冷却后过0.22 μm滤膜,上机检测分析;若待测样品超过该方法线性范围,可对样品稀释后再进行该前处理。
1.3.3 分析条件
色谱条件:Hypersil GOLD色谱柱(100 mm×2.1 mm,1.9 μm);柱温35 ℃;进样体积5 μL;流动相:无机相为超纯水(A),有机相为乙腈(B);流速0.4 mL/min;梯度洗脱:0~0.5 min,95% A;0.5~5.0 min,95%~5% A;5.0~5.5 min,5% A;5.5~6.0 min,5%~95% A;6.0~10.0 min,95% A。
质谱条件:离子源为加热电喷雾电离源(heated electrospray ionization,H-ESI),负离子模式扫描;检测模式为全扫描/数据依赖性二级扫描(Full MS-ddMS2);扫描范围m/z 50~200;喷雾电压2.5 kV;鞘气流速50 arb;辅助气流速15 arb;离子源加热温度350 ℃;离子传输管温度320 ℃。
2 结果与分析
2.1 方法优化
2.1.1 衍生温度及时间优化
以待测酒样为研究对象,按1.3所述方法,分别考察在50和60 ℃衍生10、20、30、40、50、60 min后目标物的变化情况。以衍生时间为横坐标,目标物峰面积为纵坐标绘制曲线(n=3),其变化结果如图1所示。在50 ℃衍生50 min后目标物峰面积达到最大值,随后下降;而在60 ℃衍生30 min时,目标物峰面积便达到最大随后趋于平缓,并且在60 ℃衍生30 min以上时,各组数据间标准偏差更小,目标物峰面积更稳定,因此本研究选择60 ℃衍生30 min为试验最佳条件。
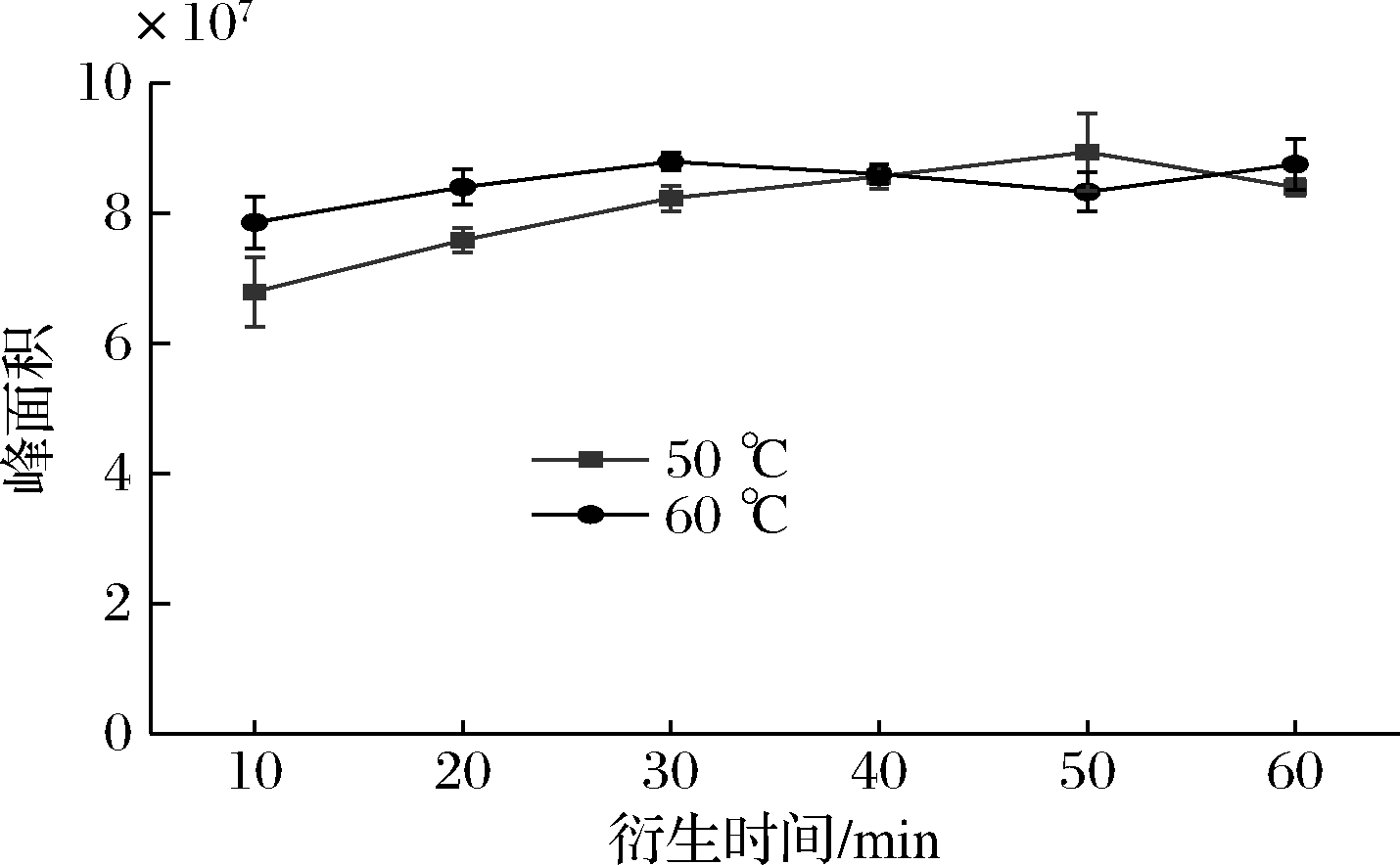
图1 衍生时间及温度对目标物峰面积的影响
Fig.1 Effect of derivation time and temperature on peak area
2.1.2 质谱条件优化
取标准工作溶液为实验样品,分别比较其正、负离子扫描模式下质谱行为,结果如图2所示。目标物在正离子响应略高于负离子,但是正离子模式下峰宽大,保留时间长,综合考虑选择负离子模式作为扫描模式。

a-正离子;b-负离子
图2 不同扫描模式下目标物的提取离子流图
Fig.1 Extracted ion current of target under different scanning modes
2.1.3 色谱条件优化
适量的酸和盐可以减少次级保留,去除前沿峰和拖尾峰,提高响应。以50.5 μg/L甲醛标准液为实验样品,分别比较了乙腈-水体系、乙腈-0.1%甲酸水体系和乙腈-5 mmol乙酸铵水溶液体系下目标物的色谱行为,结果如图3所示。在不同体系中目标物保留时间没有变化,酸和盐在本方法中均起到抑制作用,在乙腈-水体系下,目标物的响应最高,保留时间稳定,色谱峰行为好,因此选择乙腈-水体系作为色谱流动相。

a-乙腈-水溶液体系;b-乙腈-0.1%甲酸水体系;c-乙腈-5 mmol乙酸铵水溶液体系
图3 不同流动相体系目标物色谱图
Fig.3 Chromatograms of target substances in different mobile phase systems
2.2 目标物定性分析
由于甲醛分子质量低,易挥发,为了准确检测其含量,故采用乙酰丙酮衍生法,在过量铵盐和酸性条件下,2分子的乙酰丙酮与1分子甲醛生成稳定化合物2,6-二甲基-3,5-二乙酰基-1,4-二氢吡啶(C11H15NO2),其质谱信息如表1所示。为排除假阳性,采用Full MS-ddMS2采集模式,对分子离子进行碎裂,利用一级分子离子定量,二级碎片离子辅助定性,Mass Frontier 8.0裂解途径推测与二级质谱图,如图4所示。准分子离子[M-H]-(m/z 193)脱去一分子CH2![]() C
C![]() O(质量数为42的中性碎片离子)生成m/z 150离子,脱去2分子CH2
O(质量数为42的中性碎片离子)生成m/z 150离子,脱去2分子CH2![]() C
C![]() O的中性碎片,生成m/z 108离子。
O的中性碎片,生成m/z 108离子。
表1 甲醛衍生物质谱分析相关参数
Table 1 Related parameters of mass spectrym analysis for formaldehyde-derived substances

化合物相对分子质量加和方式分子离子(m/z)(定量离子)碎片离子(m/z)(定性离子)碰撞能/eV保留时间/minC11H15NO2193.24[M-H]192.101 91108.080 51150.091 26 133.4

a-裂解途径;b-二级质谱图
图4 目标物主要裂解途径推测及二级质谱图
Fig.4 Main cracking mechanism and secondary mass spectrometry of target
2.3 方法线性、检出限及定量限
为考察方法线性,以目标物定量离子峰面积为纵坐标,甲醛标准溶液质量浓度为横坐标,绘制标准曲线。目标物在5.1~202.0 μg/L范围下线性良好,线性方程为:Y=4.389 37e7+986 478X,相关系数R2>0.994 4,方法线性良好。由于实验环境、研究对象都含有痕量甲醛。本实验选择本底值较低的样品为研究对象,按照实验操作分析的全部步骤,分别取样25次做平行实验,计算测定结果的标准偏差,以3倍标准偏差为方法检出限(limit of detection,LOD),3倍检出限为定量限(limit of quantification,LOQ)。测得该方法LOD为1.2 μg/L,LOQ为3.6 μg/L。
2.4 方法精密度和回收率
通过样品加标的方式分别考察了方法的精密度和回收率,选取2种不同酒精度的白酒样品酱香53% vol-J01,浓香42% vol-N01为研究对象,并配制加标质量浓度为50.5和101.0 μg/L的甲醛标准品,按照实验操作分析的全部步骤分析,结果见表2,在不同香型及酒精度浓度白酒样品中,其相对标准偏差均小于5.0%,加标回收率在85.72%~116.38%,满足检测需求。
表2 白酒样品中甲醛的加标精密度及回收率
Table 2 Standard precision and recovery of formaldehyde in Baijiu

样品酒中甲醛本底检测结果/(μg·L-1)(n=5)相对标准偏差/%(n=5)加标量/(μg·L-1)检测结果/(μg·L-1)(n=5)回收率范围/%(n=5)53%vol-J0126.42、28.81、29.33、28.71、28.534.050.585.67、80.23、83.49、80.70、71.9886.37~113.48101.0118.19、119.70、125.54、114.94、118.7785.72~96.21 42%vol-N0137.34、38.86、40.95、40.93、39.743.950.597.32、93.29、91.38、88.65、91.5697.18~114.36101.0133.22、147.01、131.68、142.02、135.7491.20~106.38
2.5 酱香型白酒生产过程中甲醛变化规律
白酒中的甲醛属于内源性,主要来源于生产过程中的化学反应和微生物生化代谢;如胺类的脱氨反应、组蛋白的甲基化和脱甲基化、糖类的酸化水解、醇类的氧化及氨基化合物的美拉德反应等[9]。为研究酱香型白酒生产过程中甲醛产生的关键风险点,对2022年某轮次不同甑次蒸馏阶段基酒及2021年轮次酒跟踪分析,其结果如图5所示。蒸馏过程中,基酒甲醛含量为40.88~150.27 μg/L,在酒头1处呈现最大值,随后逐渐降低,在中段酒阶段含量先上升后下降,酒尾呈逐渐下降趋势。甲醛挥发性强,易在蒸馏初期馏出,达到峰值,随后降低;但是在持续加热蒸馏过程中,又会产生新的甲醛,再次馏出,呈现上升趋势,随后逐渐降低直至蒸馏结束。朱梦旭等[26]研究推测白酒固态蒸馏后期甲醇氧化或1,1-二乙氧基甲烷水解可以产生甲醛,因此在蒸馏过程中呈现先下降,再上升随后下降的趋势。不同轮次基酒样品中,甲醛质量浓度为333.84~4 530.17 μg/L,不同车间轮次基酒甲醛含量略有差异,但是其变化趋势一致。一轮次基酒中甲醛含量最低,随后依轮次增加逐渐上升,到第六轮次达到最高值,在第七轮次含量下降。饮料酒中甲醛主要来自于甲醇和其他结合态醛,如1,1-二乙氧基甲烷等,经贮存后,不同轮次基酒甲醛含量上的差异,主要由于不同轮次酒中甲醛前体物含量差异导致[27]。

a-不同蒸馏阶段;b-不同轮次
图5 酱香型白酒酿造过程中甲醛含量变化规律
Fig.5 Change rule of formaldehyde content in Maotai-flavor Baijiu brewing process
2.6 酱香新酒与成品酒甲醛含量分析
为进一步研究酱香型白酒生产过程中甲醛产生的关键风险点,对某企业生产的酱香新酒及新勾兑成品酒进行了甲醛检测分析,结果如表3所示。
表3 酱香新酒与成品酒甲醛含量
Table 3 Formaldehyde content of new and finished Maotai-flavor Baijiu

类型检测结果/(mg·L-1)类型检测结果/(mg·L-1)新酒-10.14成品酒-12.43新酒-20.18成品酒-22.67新酒-30.2成品酒-31.89新酒-40.21成品酒-42.50新酒-50.25成品酒-52.01新酒-60.18成品酒-62.71新酒-70.15成品酒-71.76新酒-80.17成品酒-82.74新酒-90.18成品酒-91.51新酒-100.2成品酒-103.62
新酒甲醛质量浓度为0.14~0.25 mg/L,成品酒甲醛质量浓度1.51~3.62 mg/L,成品酒甲醛含量远高于新酒,独立样本的t检测显示(表4),新酒与成品酒甲醛含量差异显著(P<0.05)。甲醛可以与其他化合物,如醇类形成结合态醛,在一定条件下可以重新转化为游离态醛,白酒生产过程中大量的醇使得游离态甲醛更易形成结合态醛被储存;此外,酱香型白酒贮存多使用陶罐,透气性好且存在大量金属元素,促进了甲醛的生成。在酱香型白酒生产过程中,贮存过程甲醛含量发生显著性变化,经老熟的轮次酒甲醛含量可达新酒的10~20倍,是酱香型白酒生产过程中甲醛产生的关键风险点。
表4 新酒与成品酒甲醛含量t检验
Table 4 T test of formaldehyde content in new Baijiu and finished Baijiu

方差方程的Levene检验均值方程的t检验F显著性t自由度显著性(双尾) 均值差值标准误差值差分的95%置信区间上限下限检测结果假设方差相等15.7180.001-11.302180.000-2.1980.194-2.607-1.789假设方差不相等-11.3029.0470.000-2.1980.194-2.638-1.758
2.7 市售不同品牌甲醛含量检测
结合本文建立的方法分析了市售不同品牌酱香成品酒,共计20份样品,测定结果见表5。
表5 市售不同酱香品牌白酒甲醛的含量
Table 5 Formaldehyde content of Maotai-flavor Baijiu of different brands on sale
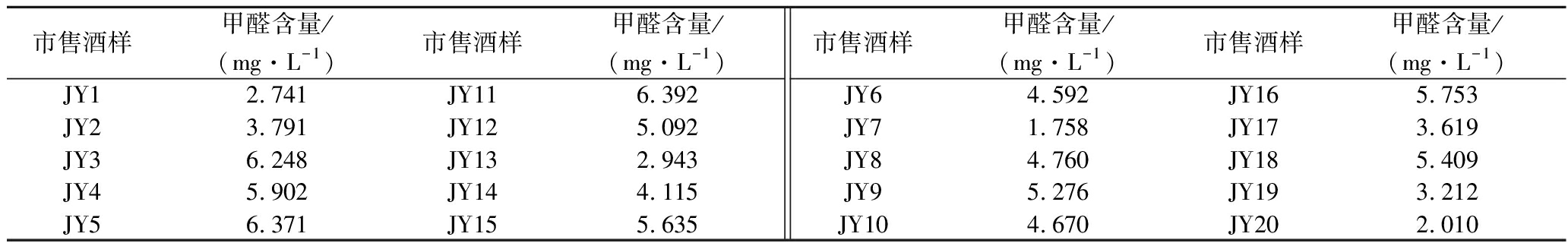
市售酒样甲醛含量/(mg·L-1)市售酒样甲醛含量/(mg·L-1)市售酒样甲醛含量/(mg·L-1)市售酒样甲醛含量/(mg·L-1)JY12.741JY116.392JY23.791JY125.092JY36.248JY132.943JY45.902JY144.115JY56.371JY155.635JY64.592JY165.753JY71.758JY173.619JY84.760JY185.409JY95.276JY193.212JY104.670JY202.010
结果显示,市售不同品牌酱香型白酒甲醛质量浓度从1.758~6.392 mg/L。目前,已在葡萄酒、啤酒、水果蒸馏酒、龙舌兰酒、威士忌、白兰地和伏特加等酒精性饮料中检出甲醛,其普遍存在于各类酒精饮料中[28-29]。
3 结论
本研究以乙酰丙酮为衍生剂,建立了白酒中甲醛的超高分辨液相色谱高分辨质谱分析方法。该方法前处理简单、检出限低,检测效率高,为酒类产品甲醛检测提供了新方法。运用该方法分析了某企业酱香型白酒生产过程中甲醛的变化规律,发现酱香型白酒中甲醛主要产生于存贮过程,其中三、四、五、六轮次基酒甲醛含量变化最高,可能是其含有较多的甲醛前体物质和结合态醛类,是甲醛产生的关键风险点。对市售不同品牌酱香酒进行甲醛检测分析发现,其含量从1.758~6.392 mg/L,在不考虑其他甲醛摄入途径情况下,体重60 kg的人每天饮用酱香酒1.9 L(按甲醛含量最高6.392 mg/L计算)才会超过US EPA规定标准。
目前,已发现甲醛普遍存在于酒精性饮料中,主要来源于果胶水解而成的甲醇氧化产生[25]。但是酱香型白酒酿造过程中还涉及复杂的微生物代谢及氧化还原反应,除了甲醇氧化外,甲醛的生成是否还有其他途径;对于主要产生于贮存过程中的甲醛,在生产过程中通过“掐头去尾”能否有效降低甲醛产生及四、五、六轮次基酒中生成甲醛的关键物质及影响条件等仍需进一步研究。
[1] HONG J X, ZHAO D R, SUN B G.Research progress on the profile of trace components in Baijiu[J].Food Reviews International, 2021:1-27.
[2] 郭学武, 范恩帝, 马冰涛, 等.中国白酒中微量成分研究进展[J].食品科学, 2020, 41(11):267-276.
GUO X W, FAN E D, MA B T, et al.Recent progress in micro components of Chinese Baijiu[J].Food Science, 2020, 41(11):267-276.
[3] 庄名扬, 王仲文, 孙达孟, 等.美拉德反应与酱香型白酒[J].酿酒, 1999, 26(4):42-47.
ZHUANG M Y, WANG Z W, SUN D M, et al.Maillard reaction and Maotai-flavor liquor[J].Liquor-Making, 1999, 26(4):42-47.
[4] LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].Journal of Agricultural and Food Chemistry, 2018, 66(22):5 425-5 432.
[5] 孙文佳, 汪廷彩, 雷毅, 等.基于静态顶空-气质联用法分析酱香型白酒空杯香气成分[J].中国酿造, 2021, 40(11):93-97.
SUN W J, WANG T C, LEI Y, et al.Lingering aroma composition in empty glass of sauce-flavor Baijiu by SHS-GC/MS[J].China Brewing, 2021, 40(11):93-97.
[6] 牛云蔚, 朱全, 肖作兵.茅台酒香气组成及关键香气成分间的协同作用[J].中国食品学报, 2021, 21(10):215-226.
NIU Y W, ZHU Q, XIAO Z B.The aroma composition and synergistic effect among key aroma compounds in Moutai Baijiu[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(10):215-226.
[7] 龙亚飞, 唐佳代, 王相勇, 等.中国白酒中健康因子及其富集途径的研究进展[J].中国酿造, 2022, 41(2):23-28.
LONG Y F, TANG J D, WANG X Y, et al.Research progress on health factors and their enrichment pathways in Baijiu[J].China Brewing, 2022, 41(2):23-28.
[8] REINGRUBER H, PONTEL L B.Formaldehyde metabolism and its impact on human health[J].Current Opinion in Toxicology, 2018, 9:28-34.
[9] AUTHORITY E F S.Endogenous formaldehyde turnover in humans compared with exogenous contribution from food sources[J].EFSA Journal, 2014, 12(2):3550.
[10] 韩颜, 江海鹏, 巨修练.生物体内甲醛参与的化学反应研究进展[J].武汉工程大学学报, 2018, 40(1):8-16;27.
HAN Y, JIANG H P, JU X L.Advances in chemical reaction of formaldehyde in organisms[J].Journal of Wuhan Institute of Technology, 2018, 40(1):8-16;27.
[11] JEONG H S, CHUNG H, SONG S H, et al.Validation and determination of the contents of acetaldehyde and formaldehyde in foods[J].Toxicological Research, 2015, 31(3):273-278.
[12] NOWSHAD F, ISLAM M N, KHAN M S.Concentration and formation behavior of naturally occurring formaldehyde in foods[J].Agriculture &Food Security, 2018, 7(1):17.
[13] US EPA, Formaldehyde.Document 0419[R].Washington: Environmental Protection Agency, 1998.
[14] 唐平, 山其木格, 王丽, 等.白酒风味化学研究方法及酱香型白酒风味化学研究进展[J].食品科学, 2020, 41(17):315-324.
TANG P, SHAN Q M G, WANG L, et al.A review of research methods in Baijiu flavor chemistry and recent progress in the flavor chemistry of Maotai-flavored Baijiu[J].Food Science, 2020, 41(17):315-324.
[15] 马雪丰, 陈果, 秦德萍, 等.食品中甲醛检测标准与分析技术研究进展[J].现代食品, 2022, 28(11):156-159.
MA X F, CHEN G, QIN D P, et al.Research progress in the detection standards and analytical techniques of formaldehyde in food[J].Modern Food, 2022, 28(11):156-159.
[16] 孙晓玲, 张伟, 栾绍乐.食品中甲醛含量的检测方法研究进展[J].现代食品, 2021(3):71-73.
SUN X L, ZHANG W, LUAN S L.Research progress on detection methods of formaldehyde content in food[J].Modern Food, 2021(3):71-73.
[17] 邵仕萍, 相大鹏, 李华斌, 等.乙酰丙酮衍生化高效液相色谱-荧光检测法测定食品中的甲醛[J].食品科学, 2015, 36(16):241-245.
SHAO S P, XIANG D P, LI H B, et al.Determination of formaldehyde in foods by high-performance liquid chromatography with fluorescence detection through derivatization with acetylacetone[J].Food Science, 2015, 36(16):241-245.
[18] 赵云鹏, 徐晓飞, 刘星汶, 等.食品中甲醛含量的检测方法研究进展[J].中国食品添加剂, 2020, 31(12):112-116.
ZHAO Y P, XU X F, LIU X W, et al.Research progress in detection methods for formaldehyde[J].China Food Additives, 2020, 31(12):112-116.
[19] 曹萍, 赵娜, 冯博洪.高效液相色谱法检测食品中的甲醛含量[J].食品安全导刊, 2020(30):121.
CAO P, ZHAO N, FENG B H.Determination of formaldehyde in food by high performance liquid chromatography[J].China Food Safety Magazine, 2020(30):121.
[20] 芮露明, 彭增起, 汪敏, 等.GC-MS法测定烟熏腊肉中的甲醛含量[J].食品科学, 2014, 35(8):142-146.
RUI L M, PENG Z Q, WANG M, et al.Determination of formaldehyde content in smoked meat by GC-MS[J].Food Science, 2014, 35(8):142-146.
[21] 牛灿杰, 徐腾洋, 张水锋, 等.在线衍生-双三元高效液相色谱同时检测水产品中的甲醛及双乙酸钠含量[J].食品科学, 2022, 43(4):340-345.
NIU C J, XU T Y, ZHANG S F, et al.Simultaneous determination of formaldehyde and sodium diacetate in aquatic products by dual-gradient liquid chromatography with on-line derivatization[J].Food Science, 2022, 43(4):340-345.
[22] WANG T, GAO X L, TONG J, et al.Determination of formaldehyde in beer based on cloud point extraction using 2, 4-dinitrophenylhydrazine as derivative reagent[J].Food Chemistry, 2012, 131(4):1 577-1 582.
[23] 王圣庆, 郭瑛, 马言顺, 等.柱前衍生高效液相色谱法测定啤酒中微量甲醛[J].化学研究与应用, 2006, 18(2):214-216.
WANG S Q, GUO Y, MA Y S, et al.Determination of trace formaldehyde in beer by HPLC with precolumn derivatization and UV detection[J].Chemical Research and Application, 2006, 18(2):214-216.
[24] 李红洲, 彭小东, 陈大鹏, 等.超高效液相色谱-离子肼质谱联用法测定米粉中甲醛[J].食品与发酵科技, 2020, 56(3):108-112.
LI H Z, PENG X D, CHEN D P, et al.Determination of formaldehyde in rice noodles by high performance liquid chromatography ion-trap mass spectrometry[J].Food and Fermentation Sciences &Technology, 2020, 56(3):108-112.
[25] 廖艳华, 周劭桓, 林文斯.同位素内标法-高效液相色谱-串联质谱法测定海产品中的甲醛含量[J].食品安全质量检测学报, 2020, 11(19):7 063-7 068.
LIAO Y H, ZHOU S H, LIN W S.Determination of formaldehyde content in seafood by isotope internal standard method-high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety &Quality, 2020, 11(19):7 063-7 068.
[26] 朱梦旭, 范文来, 徐岩.我国白酒蒸馏过程以及不同年份产原酒和成品酒中甲醛的研究[J].食品与发酵工业, 2015, 41(9):153-158.
ZHU M X, FAN W L, XU Y.Characterization of formaldehyde from distillation cut, raw liquor of different vintage, and finished Chinese liquor[J].Food and Fermentation Industries, 2015, 41(9):153-158.
[27] 朱梦旭. 白酒中易挥发的有毒有害小分子醛及其结合态化合物研究[D].无锡:江南大学, 2016.
ZHU M X.Volatile, toxic and small molecular aldehydes and their derivatives in Chinese liquor[D].Wuxi:Jiangnan University, 2016.
[28] JENDRAL J A, MONAKHOVA Y B, LACHENMEIER D W.Formaldehyde in alcoholic beverages:Large chemical survey using purpald screening followed by chromotropic Acid spectrophotometry with multivariate curve resolution[J].International Journal of Analytical Chemistry, 2011, 2011:797604.
[29] MONAKHOVA Y B, JENDRAL J A, LACHENMEIER D W.The margin of exposure to formaldehyde in alcoholic beverages[J].Arhiv Za Higijenu Rada i Toksikologiju, 2012, 63(2):227-237.