燕窝是中国传统的高档滋补品,它是由金丝雀的唾液和羽毛混合搭成的窝,富含唾液酸、蛋白质、微量元素等营养物质,具有养阴润燥、补中益气、入胃补脾、化痰止咳等功效,是一种安全有效的防止流感病毒、增强免疫力的天然物[1]。近年来,随着人们对健康的重视,燕窝深受消费者青睐。但由于燕窝产量低,需求量大,因此燕窝掺假事件时有发生。各种廉价材料因外观或蛋白质含量与燕窝相似,如蛋清、银耳、猪皮等[2],被掺入燕窝中来增加净重。另一种较高手段的掺假是向干燕窝中加入廉价的市售合成来源唾液酸,提高干燕窝等级来达到高价售卖的目的。由于天然来源唾液酸和合成来源唾液酸的理化性质并无差异,因此这类掺假使用常规检测手段难以辨别[3-6]。因此,亟需建立一种准确可靠鉴别天然来源和合成来源唾液酸的方法,以保证消费者权益、维护公平竞争和市场稳定。
稳定同位素技术被证实是可用于食品掺假检测和真实性鉴别的有效技术手段,已经在葡萄酒[7-9]、蜂蜜[10-11]、果汁[12-13]等领域有广泛的应用。同位素技术可分为2类,即全样品稳定同位素分析(bulk stable isotope analysis, BSIA)和特定化合物稳定同位素分析(compound specific isotope analysis, CSIA)。目前,有关应用稳定同位素技术对干燕窝掺假判别的研究较少,ZHANG等[14]利用元素分析仪——稳定同位素比值质谱(elementary analyzer-stable isotope ratio mass spectrometers, EA-IRMS)测定干燕窝和掺入不同比例市售唾液酸等物质后的全样品稳定同位素比值,建立分析模型和判别方程来提高样品同位素比值的内聚力,获得高准确性掺假判别。CSIA技术可实现在线分离样品中目标物并准确测定其稳定同位素比值。液相色谱-稳定同位素比值质谱(liquid chromatography-isotope ratio mass spectrometry, LC-IRMS)是CSIA常用的技术,LC-IRMS可用于非挥发性化合物的测定,具有样品无需衍生化预处理等优势,该技术自开发以来广泛应用于食品真实性领域[15]。目前,尚无应用LC-IRMS对燕窝中唾液酸δ13C值准确分析的报道。
因此,为考察燕窝中唾液酸和合成来源唾液酸的δ13C值差异,采用LC-IRMS对燕窝中的特征成分唾液酸进行碳稳定同位素分析,建立燕窝真伪鉴别新应用。实验针对干燕窝各成分和唾液酸的化学特征,建立离线前处理方法结合在线LC-IRMS测定燕窝中唾液酸δ13C值,对方法进行优化和验证并应用到样品中,测定天然唾液酸和合成唾液酸δ13C值特征。
1 材料与方法
1.1 材料与试剂
甘蔗糖购自电商平台,纯度98%;5个从电商平台购买的不同厂家生产的合成来源唾液酸,纯度98%;唾液酸标准品,上海叶源生物科技有限公司;6个由厂家直供的马来西亚、印度尼西亚两地干燕窝,其真实性有保障。所有干燕窝样品高速研磨成细粉处理后的样品均在4 ℃条件下储存备用,在保质期内对样品进行处理分析。
浓硫酸(分析纯)、磷酸(分析纯)、过硫酸钠(分析纯),国药集团化学试剂有限公司;NaOH(分析纯)、正丁醇(分析纯),上海麦克林生化科技有限公司;三氯甲烷(分析纯),天津市富宇精细化工有限公司;乙腈(色谱纯),德国Meker公司。
乙醇BCR-656[δ13CV-PDB=(-26.91±0.07)‰]购自欧洲标准局,作为碳稳定同位素比值分析的参考物质。
1.2 仪器与设备
恒温水浴锅,北京科伟永兴仪器有限公司;十万分之天平,瑞士Mettler-Toledo公司;高速离心机,天津市泰斯特仪器有限公司;HPLC(配有可变波长紫外检测器),岛津企业管理(中国)有限公司;LC端(LC IsoLink + ConFlo IV)、稳定同位素质谱仪(IRMS, Delta V Advantage),美国Thermo Scientific公司。
1.3 前处理方法
准确称取2 g干燕窝,加入100 mL 0.05 mol/L H2SO4溶液。100 ℃高温水浴20 min,取出后冷却至室温,离心后取上清液加NaOH溶液调节pH至中性,浓缩上清液至约30 mL。加入7 mL Sevage试剂[V(三氯甲烷)∶V(正丁醇)=5∶1]振荡25 min,离心收集上层水相,重复该过程至无白色沉淀产生。上层水相水浴浓缩至一定体积,待测。
1.4 前处理方法加标回收率
对燕窝样品唾液酸含量重复测定3次,取其平均值为本底值,在样品中各加入不同含量的唾液酸标准品,配制成低中高浓度水平的样品溶液,每个浓度3个平行,按照优化后的前处理步骤操作,进行加标回收率实验。
1.5 仪器条件
1.5.1 HPLC条件
样品中唾液酸含量和加标回收率均按照GB/T 30636—2014 《燕窝及其制品中唾液酸的测定 液相色谱法》中液相色谱条件进行测定。
1.5.2 LC-IRMS测定条件
色谱条件:色谱柱Hyper REZ XP Carbohydrate H+柱 (300 mm×7.7 mm,8 μm);柱温30 ℃;流动相:90% B(H2O)+10%D(pH 2 H2SO4);流速0.25 mL/min;进样体积10 μL。磷酸溶液和过二硫酸钠溶液作为反应助剂,流速0.050 mL/min,将色谱分离的有机物转化成CO2。反应炉温度99.5 ℃。
质谱条件:离子源为电子轰击离子源(EI源);扫描方式为正离子扫描;氦气压力为0.4 MPa;离子源电压为9.488 kV;真空度为2.6×10-6 mBar。每次测定样品前后分别测定3次CO2标准参考气(每次20 s)。
1.6 校准与计算
稳定同位素比率的计算是将已知同位素比率的标准品作为参考,未知样本稳定同位素比率的相对值按公式(1)计算,结果以δ(千分差,‰)表示。
δ13C=(R样品/R标准-1)×1 000
(1)
式中:R样品,样品中重同位素与轻同位素的丰度比,即13C/12C;R标准,国际标准物质美国南卡罗莱纳州白垩系Pee Dee组拟箭石化石的碳重同位素与轻同位素的丰度比。选择乙醇BCR-656[δ13CV-PDB=(-26.91±0.07)‰]为实际测定的参考物质。实验结果由Thermo Electron Isodat 3.0 软件进行数据处理和计算δ13C。实验数据origin 2019处理并作图。
2 结果与分析
2.1 样品前处理对δ13C值测定的影响
干燕窝样品除唾液酸外,还富含水溶性蛋白质等大分子物质,这些物质的存在易导致液相色谱分析过程中存在柱压升高、基质干扰等问题,需长时间冲色谱柱来降低堵塞色谱柱的风险。因此,离线前处理先酸水解提取唾液酸、Sevage法分离纯化并富集目标物。经前处理优化后,有效去除基质干扰, 并解决了管路堵塞问题。选择市售唾液酸纯品和燕窝样品进行加标回收率测定,结果见表1,该方法的回收率范围为75.2%~100.6%,Sevage法除蛋白效果较好[16-17],满足LC-IRMS测定唾液酸的碳稳定同位素比值。
表1 前处理方法加标回收率测定
Table 1 Pretreatment method recovery determination
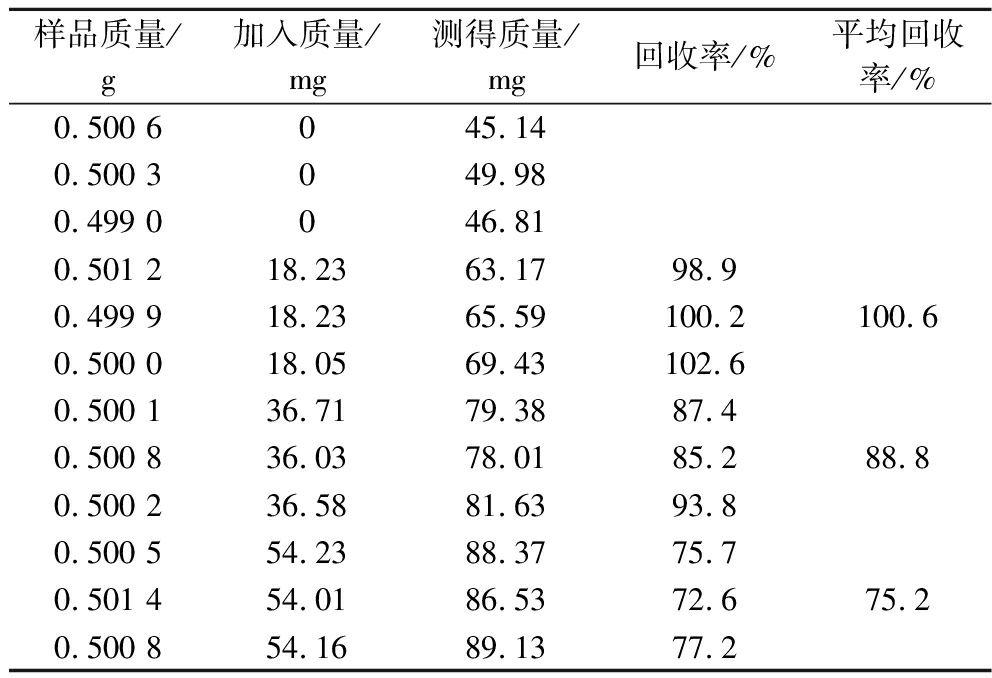
样品质量/g加入质量/mg测得质量/mg回收率/%平均回收率/%0.500 6045.14 0.500 3049.980.499 0046.810.501 218.2363.1798.90.499 918.2365.59100.2100.60.500 018.0569.43102.60.500 136.7179.3887.40.500 836.0378.0185.288.80.500 236.5881.6393.80.500 554.2388.3775.70.501 454.0186.5372.675.20.500 854.1689.1377.2
前处理过程涉及水解、沉淀、离心等步骤。若唾液酸的回收率没有达到100%,就要考虑同位素分馏的可能性。因此,实验验证了前处理方法是否会引起碳稳定同位素分馏。以市售唾液酸纯品和甘蔗糖为研究对象[LC-IRMS测定2种物质δ13C分别为(-28.83±0.18)‰和(-13.60±0.08)‰,n=5],准确称取市售唾液酸0.5 g和甘蔗糖1 g共3份,按照前处理步骤进行水解、纯化后,测定唾液酸的δ13C值,3次测量的结果为(-28.60±0.05)‰(表2)。结果表明,唾液酸前处理后的测定值与直接测定值的标准偏差最大为0.28‰,在LC-IRMS的测定误差范围内(0.3‰),可得出结论,该前处理步骤不会影响唾液酸δ13C值的准确分析。
表2 验证前处理过程对唾液酸碳稳定同位素分析的影响
Table 2 Validation of the effect of pre-treatment processes on carbon stable isotope analysis of sialic acid
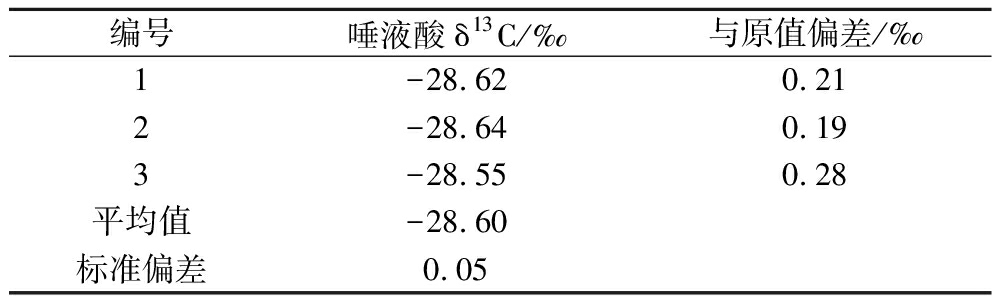
编号唾液酸δ13C/‰与原值偏差/‰1-28.620.212-28.640.193-28.550.28平均值-28.60标准偏差0.05
2.2 色谱条件优化
LC-IRMS在线将目标物和其他物质分开,并将目标物中碳元素转化成CO2测定,LC-IRMS方法在应用上存在局限性,要求流动相不含有机溶剂、对流速、柱温等也有一些要求[15,18]。因此,对色谱柱的要求比较高。唾液酸是一种“酸性糖”,因此实验选择对极性物质保留较好且耐纯水溶液的Hyper REZ XP Carbohydrate H+(300 mm×7.7 mm,8 μm) 色谱柱,通过实验优化确定最佳色谱条件。
2.2.1 流动相比例条件优化
LC-IRMS对流动相的局限性很大,实验通过改变水-硫酸溶液(pH 2)的比例优化唾液酸峰型。当流动相为纯水时,唾液酸峰图分离度不佳(图1-b);加入硫酸溶液后唾液酸峰分离度较高(图1-a),随着硫酸溶液占比增加,峰型无明显变化,但出峰时间延迟。这与文献[8]的研究结果不同,该研究认为在分离乙醇和甘油时以纯水为流动相可满足基线分离[8],造成这一现象的原因可能是不同物质性质不同,所需的流动相pH梯度不同。为提高分析效率,最后选择流动相比例90% B(H2O)+10% D(pH 2 H2SO4)进行后续实验。

a-流动相为90% H2O和10% pH 2 H2SO4溶液的色谱图;b-流动相为100%纯水时的色谱图
图1 流动相对唾液酸δ13C值测定影响的色谱图
Fig.1 Chromatogram of the effect of mobile phase on the determination of δ13C values of sialic acid
2.2.2 流速条件优化
由于LC-IRMS流动相黏滞性高,流速要比普通液相低,流动相流速的变化会影响测定的重复性和再现性[19]。本文以唾液酸标准品为研究对象,探究了在0.200~0.400 mL/min流速变化对唾液酸δ13C测定的影响,每个流速下的标准品重复测定3次后的平均值结果见表3。
表3 流速对唾液酸δ13C值的影响
Table 3 Effect of flow rate on sialic acid δ13C values
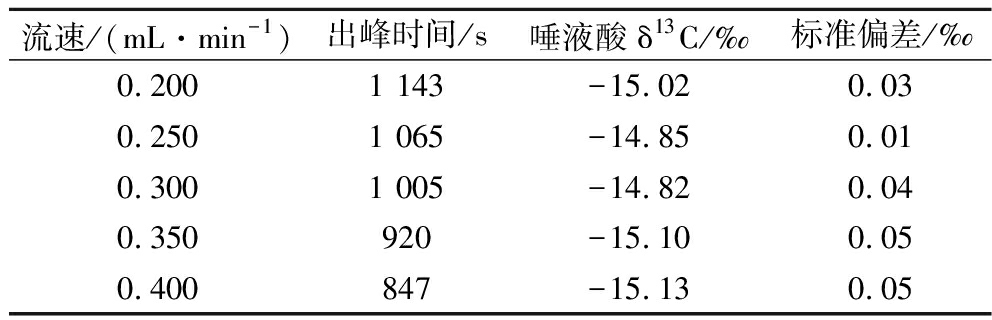
流速/(mL·min-1)出峰时间/s唾液酸δ13C/‰标准偏差/‰0.2001 143-15.020.030.2501 065-14.850.010.3001 005-14.820.040.350920-15.100.050.400847-15.130.05
由表3可知,不同流速下的唾液酸δ13C值变化较大,但同一流速下δ13C值测定结果较稳定,每个流速出峰时间相差约70 s。综合考虑,选择0.250 mL/min作为流动相的流速,并通过同位素参考物质校正测定结果。
2.2.3 柱温条件优化
一般认为使样品完全氧化,色谱柱温度设置较高为宜。实验用唾液酸标准品为研究对象,探究不同的柱温对唾液酸测定的影响,结果见表4。色谱柱温度在25~45 ℃,唾液酸δ13C的标准偏差≤0.12‰,对唾液酸来说,柱温对其δ13C值测定无明显影响,随着温度逐渐升高,目标物出峰时间稍许推迟,实验选择30 ℃作为色谱柱的温度。
表4 柱温对唾液酸δ13C值的影响
Table 4 Effect of column temperature on δ13C values of sialic acid
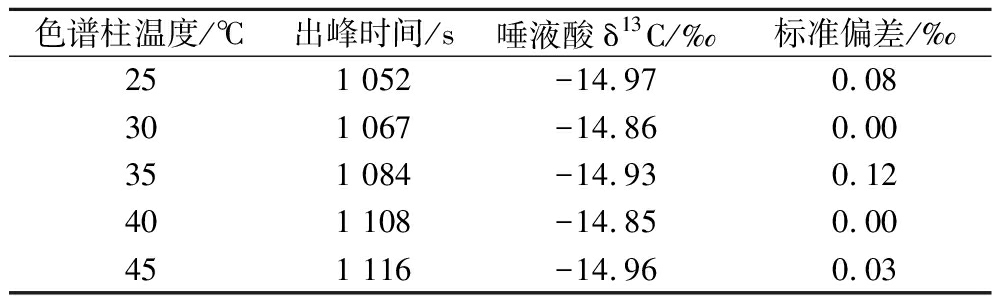
色谱柱温度/℃出峰时间/s唾液酸δ13C/‰标准偏差/‰251 052-14.970.08301 067-14.860.00351 084-14.930.12401 108-14.850.00451 116-14.960.03
综上,考虑到优化结果、测定效率和成本等方面因素,确定LC-IRMS测定唾液酸δ13C的色谱条件为流动相H2O-H2SO4(90∶10,体积比)、流速0.25 mL/min、柱温30 ℃。使用优化后的液相条件测定燕窝样品中唾液酸δ13C值,其色谱图见图2,目标物峰型较好,无其他杂质峰干扰。

图2 燕窝样品中唾液酸δ13C值测定的色谱图
Fig.2 Chromatogram for the determination of δ13C values of sialic acid in bird’s nest samples
2.3 方法稳定性
为验证唾液酸测定结果的稳定性,选择前处理后的燕窝样品和唾液酸标准品,在1天内分别平行测定6次;选择同一份燕窝样品和唾液酸标准品在相同条件下每天测定3次,连续测定6 d。计算结果的平均值和偏差,结果见表5,唾液酸的标准偏差均小于0.10‰,测定结果较为稳定。
表5 方法稳定性分析 单位:‰
Table 5 Analysis of method stability
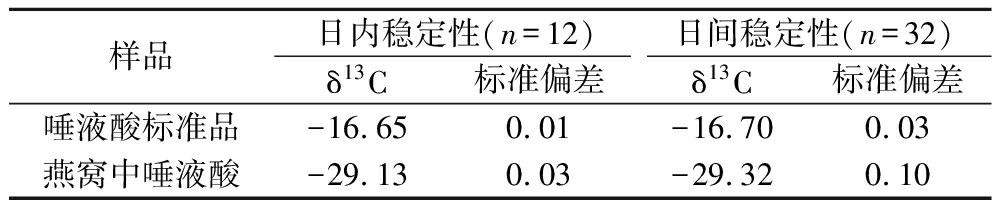
样品日内稳定性(n=12)日间稳定性(n=32)δ13C标准偏差δ13C标准偏差唾液酸标准品-16.650.01-16.700.03燕窝中唾液酸-29.130.03-29.320.10
2.4 方法重复性
为了验证建立方法的重复性,准确称取同一燕窝样品6份,同时按照1.3节前处理步骤处理后,对获得的含唾液酸的溶液进行δ13C值测定,结果见表6。结果表明唾液酸的δ13C值重复性标准偏差为0.25‰,说明该方法重复性较好。
表6 方法重复性分析
Table 6 Analysis of method reproducibility
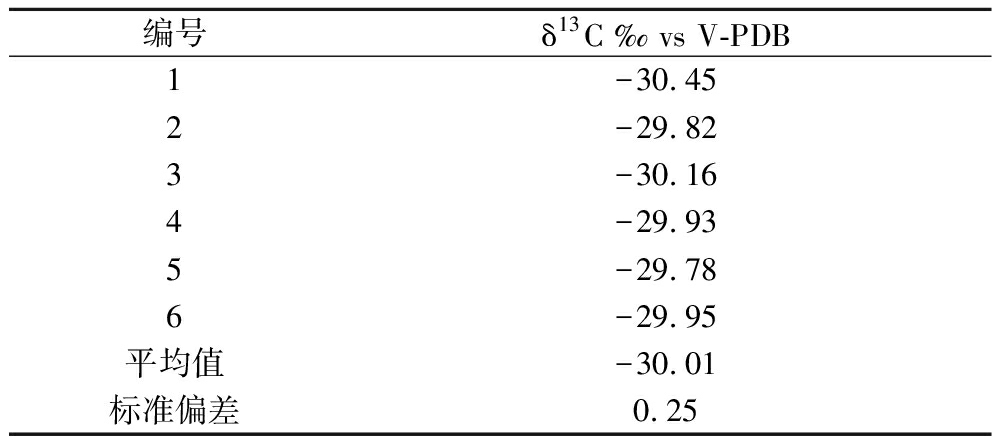
编号δ13C ‰ vs V-PDB1-30.452-29.823-30.164-29.935-29.786-29.95平均值-30.01标准偏差0.25
2.5 方法应用
2.5.1 燕窝样品中唾液酸δ13C值测定
实验选择马来西亚和印度尼西亚两个产地不同月份的干燕窝为研究对象,对干燕窝前处理后测定了其唾液酸δ13C值。燕窝中唾液酸δ13C值范围为-30.05‰~-29.05‰ (表7),分布较集中。燕窝是金丝雀及其同属鸟类用唾液或羽毛和唾液等物质混合而成的巢,燕窝中唾液酸δ13C值分布受金丝雀饮食和环境等因素影响[20-21],金丝雀主要以有机生物为食,包括小蜂蜜、白蚁和飞虫[22],这些昆虫主要以C3循环的植物为食,其平均δ13C值为-28.00‰。
表7 燕窝中唾液酸δ13C值测定结果
Table 7 Results of the determination of sialic acid δ13C values in bird’s nests

样品编号产地δ13C ‰ vs V-PDB干燕窝1马来西亚-29.50干燕窝2马来西亚-29.05干燕窝3马来西亚-29.79干燕窝4印度尼西亚-30.05干燕窝5印度尼西亚-29.36干燕窝6印度尼西亚-29.17平均值-29.55标准偏差0.39
2.5.2 合成来源唾液酸δ13C值测定
实验测定了4个市售唾液酸δ13C值,合成来源唾液酸δ13C分布在(-15.18±2.45)‰(表8)。市面上合成来源唾液酸大多是由发酵法生产的,发酵法生产唾液酸具有成本低、产量高等优势。而发酵所用底物通常以甘油、山梨醇和葡萄糖为碳源,玉米浆、蛋白胨等为氮源。发酵底物包含C3和C4来源植物,由于尚无标准化生产发酵来源唾液酸的方法,导致不同厂家生产的唾液酸δ13C值有一定差异。
表8 市售唾液酸δ13C值测定结果
Table 8 Results of the determination of commercial sialic acid δ13C value

样品编号δ13C ‰ vs V-PDB1-16.902-12.153-14.244-17.42平均值-15.18标准偏差2.45
2.6 建立燕窝掺假检出限
通过测定真实燕窝中唾液酸和市售唾液酸的δ13C值,发现两种不同来源的唾液酸有显著区别。将测定的(-29.55±0.39)‰和(-15.18±2.45)‰分别作为天然来源和合成来源唾液酸的平均值和标准偏差,向燕窝中添加市售唾液酸的比例从0%增加至100%,做一条带误差棒的标准曲线,结果见图3。

图3 燕窝中掺入市售唾液酸的误差图
Fig.3 Error diagram for adulteration of commercial sialic acid in bird’s nests
黑色方块为用天然和合成唾液酸的平均值分别乘以掺入比例的和计算而来的混合物的平均值,竖线为由两组的标准偏差之和乘以贡献百分比计算得到的标准偏差。为验证该图的有效性,向干燕窝样品(δ13C=-29.50‰)中掺入0%、28%、51%、71%和100%的唾液酸标准品(δ13C=-16.67‰),制备的混合物测定值分别为-29.32‰、-26.01‰、-22.77‰、-19.92‰和-16.58‰(表中橙色点)。结果表明:掺假样品的测定值在图中误差范围内,说明该图可有效检测到外源添加合成唾液酸。此外,-28.11‰是可能检测到燕窝样品中最低10%非法添加市售唾液酸的值。
3 结论
采用稳定同位素技术对燕窝制品掺假鉴别具有独特优势。本研究建立离线前处理结合在线LC-IRMS测定干燕窝中唾液酸δ13C值的方法。通过对样品进行提取、分离纯化等步骤的优化,最大程度减少样品中唾液酸的损失获得满足稳定同位素测定的含量。该方法的加标回收率良好且前处理方法不会造成明显同位素分馏,同时优化了LC-IRMS测定唾液酸δ13C值的色谱条件。对6个干燕窝中的唾液酸和4个市售唾液酸分布测定,两种不同来源的唾液酸碳稳定同位素分布特征显著。建立燕窝掺假比例检出限图,并对该图有效性进行验证。为后续鉴别燕窝制品中是否外源添加市售唾液酸提供基础,有利于促进规范燕窝市场,保障消费者利益。
[1] DAI Y W, CAO J, WANG Y Y, et al.A comprehensive review of edible bird’s nest[J].Food Research International, 2021, 140:109875.
[2] 白伟娟, 林素琼, 柳训才, 等.燕窝真伪鉴别研究进展[J].安徽农学通报, 2020, 26(21):124-127.
BAI W J, LIN S Q, LIU X C, et al.Research progress for authentication of edible bird’s nest[J].Anhui Agricultural Science Bulletin, 2020, 26(21):124-127.
[3] 陈筱婷. 多重RT-PCR法检测燕窝及其制品掺伪成分[J].食品安全质量检测学报, 2019, 10(11):3 493-3 500.
CHEN X T.Determination of adulterated components in edible bird’s nests and their products by multiplex RT-PCR[J].Journal of Food Safety &Quality, 2019, 10(11):3 493-3 500.
[4] 马雪婷, 张九凯, 陈颖, 等.燕窝多元素的分布及溯源信息研究[J].食品与机械, 2019, 35(2):66-71.
MA X T, ZHANG J K, CHEN Y, et al.Study on the distribution characteristics and traceability information of multi-elements in edible bird’s nest[J].Food &Machinery, 2019, 35(2):66-71.
[5] CHUA Y G, CHAN S H, BLOODWORTH B C, et al.Identification of edible bird’s nest with amino acid and monosaccharide analysis[J].Journal of Agricultural and Food Chemistry, 2015, 63(1):279-289.
[6] GUO L L, WU Y J, LIU M C, et al.Determination of edible bird’s nests by FTIR and SDS-PAGE coupled with multivariate analysis[J].Food Control, 2017, 80:259-266.
[7] 岳涛, 王道兵, 李安军, 等.白酒大生产过程中乙醇稳定碳同位素变化特征研究[J].食品与发酵工业, 2023, 49(2):63-67.
YUE T, WANG D B, LI A J, et al.Stable carbon isotopic variation in ethanol during Baijiu processing[J].Food and Fermentation Industries, 2023, 49(2):63-67.
[8] CABA ERO A I, RECIO J L, RUPÉREZ M.Simultaneous stable carbon isotopic analysis of wine glycerol and ethanol by liquid chromatography coupled to isotope ratio mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2010, 58(2):722-728.
ERO A I, RECIO J L, RUPÉREZ M.Simultaneous stable carbon isotopic analysis of wine glycerol and ethanol by liquid chromatography coupled to isotope ratio mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2010, 58(2):722-728.
[9] JIN X Y, ZHANG L M, WU S M, et al.Developing an authentication approach using SPME-GC-IRMS based on compound-specific δ13C analysis of six typical volatiles in wine[J].Food Quality and Safety, 2021, 5:31.
[10] 费晓庆, 沈崇钰, 吴斌, 等.元素分析-碳同位素比值质谱法在蜂王浆掺假鉴定中的应用[J].质谱学报, 2014, 35(2):144-148.
FEI X Q, SHEN C Y, WU B, et al.Detection of royal jelly adulteration using elemental analyzer-carbon isotope ratio mass spectrometry[J].Journal of Chinese Mass Spectrometry Society, 2014, 35(2):144-148.
[11] CHOWDHURY S A, CARTER J F, ANUJ S R, et al.The validity of protein in Australian honey as an internal standard for C4 sugar adulteration[J].Food Analytical Methods, 2021, 14(4):823-833.
[12] 钟其顶, 王道兵, 熊正河.稳定氢氧同位素鉴别非还原(NFC)橙汁真实性应用初探[J].饮料工业, 2011, 14(12):6-9.
ZHONG Q D, WANG D B, XIONG Z H.Application of stable hydrogen and oxygen isotope in authenticity assessment of NFC orange juice[J].The Beverage Industry, 2011, 14(12):6-9.
[13] SCHELLENBERG A, CHMIELUS S, SCHLICHT C, et al.Multielement stable isotope ratios (H, C, N, S) of honey from different European regions[J].Food Chemistry, 2010, 121(3):770-777.
[14] ZHANG M J, HU H X, ZENG G F, et al.Discrimination and quantification of adulterated edible bird’s nest based on their improved cohesion stable isotope ratios[J].Food Control, 2022, 140:109111.
[15] PERINI M, BONTEMPO L.Liquid Chromatography coupled to Isotope Ratio Mass Spectrometry (LC-IRMS):A review[J].TrAC Trends in Analytical Chemistry, 2022, 147:116515.
[16] XIONG Q P, HUANG S, CHEN J H, et al.A novel green method for deproteinization of polysaccharide from Cipangopaludina chinensis by freeze-thaw treatment[J].Journal of Cleaner Production, 2017, 142:3 409-3 418.
[17] CHEN L, LONG R, HUANG G L, et al.Extraction and antioxidant activities in vivo of pumpkin polysaccharide[J].Industrial Crops and Products, 2020, 146:112199.
[18] KÖSTER D, SANCHEZ VILLALOBOS I M, JOCHMANN M A, et al.New concepts for the determination of oxidation efficiencies in liquid chromatography-isotope ratio mass spectrometry[J].Analytical Chemistry, 2019, 91(8):5 067-5 073.
[19] DONG H, XIAO K J, XIAN Y P, et al.Authenticity determination of honeys with non-extractable proteins by means of elemental analyzer (EA) and liquid chromatography (LC) coupled to isotope ratio mass spectroscopy (IRMS)[J].Food Chemistry, 2018, 240:717-724.
[20] LEE P L, CLAYTON D H, GRIFFITHS R, et al.Does behavior reflect phylogeny in swiftlets (Aves:Apodidae)? A test using cytochrome b mitochondrial DNA sequences[J].Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(14):7 091-7 096.
[21] CHAN K S, TAN J, GOH W L, et al.Diet profiling of house-farm swiftlets (Aves, Apodidae, Aerodramus sp.) in three landscapes in Perak, Malaysia, using high-throughput sequencing[J].Tropical Ecology, 2019, 60(3):379-388.
[22] CASTILLO-ALANIS L A, GONZ LEZ-HERN
LEZ-HERN NDEZ A E, QUIJANO-MATEOS A, et al.Standardization of a culture medium for Megaselia scalaris (Diptera:Phoridae) for entomotoxicological studies[J].Journal of Medical Entomology, 2020, 57(5):1 421-1 431.
NDEZ A E, QUIJANO-MATEOS A, et al.Standardization of a culture medium for Megaselia scalaris (Diptera:Phoridae) for entomotoxicological studies[J].Journal of Medical Entomology, 2020, 57(5):1 421-1 431.