我国是羊肉生产和消费大国,羊肉的产量占世界总产量近1/3,并呈递增趋势。活羊被屠宰的同时,产生大量羊皮。这些羊皮除部分用于皮革生产,大部分并没有得到很好的利用,造成资源的浪费。从构造上分析,羊皮主要包括表皮层和真皮层,表皮层主要由角蛋白组成,而真皮层主要由胶原蛋白和网硬蛋白组成。羊皮富含水分、蛋白质及脂肪等营养物质,《食疗本草》中有“去毛,煮羹:补虚劳”的记载,且研究发现羊皮中提取的胶原肽具有抗氧化活性[1]。
水分是影响食品质构和风味的重要因素。不易流动水减少会导致白煮蛋在贮藏过程中硬度和咀嚼性增强,感官品质变差[2]。干腌火腿加工过程中风味物质己醛和1-辛烯-3-醇的含量与水分活度呈负相关[3]。目前,肌肉组织在低温贮藏[4]、煮制[5]、炸制[6]以及烤制[7]过程中的水分迁移研究较多。香气是食品能否被人们接受的关键因素,生肉几乎没有香气,大部分的香气物质来源于热加工过程中脂质氧化、Strecker降解及美拉德反应等途径[8]。目前关于羊肉香气的研究较多,不同加工方式可以改变挥发性风味物质的含量,但是对关键风味物质的种类影响不大[9]。己醛、壬醛、庚醛、(E)-2-辛烯醛、1-辛烯-3-醇和2-戊基呋喃等被认为是羊肉中的关键挥发性物质。
然而,目前对于羊皮食品的研究只停留在工艺方面,加工过程中各种理化指标的变化研究很少涉及。鉴于此,本研究以宁夏滩羊羊皮为研究对象,采用低场核磁共振(low-field nuclear magnetic resonance, LF-NMR)技术结合顶空固相微萃取-气相色谱-质谱(headspace solid-phase microextraction-gas chromatography-mass spectrometry, HS-SPME-GC-MS)技术对羊皮煮制过程中的水分迁移规律及挥发性风味物质进行分析研究。采用气味活度值(odor activity values, OAV)法筛选出羊皮煮制过程中的关键性风味物质,并对羊皮水分和关键性风味物质进行皮尔森相关性分析。通过对煮制羊皮的研究以期为新型羊皮食品的开发奠定理论基础。
1 材料与方法
1.1 材料与试剂
新鲜羊皮(6月龄,盐池滩羊),宁夏鑫海食品有限公司;1,2-二氯苯(色谱纯)、正构烷烃(C6~C26),美国Sigma-Aldrich公司。
1.2 仪器与设备
C22-IH91电磁炉,苏泊尔集团有限公司;NMI20型核磁共振成像仪,上海纽迈电子有限公司;WB100-2型数显恒温水浴锅,LABFISH实验仪器有限公司;QP2010ultra型GC-MS联用仪,日本岛津公司;LPS-3002型电子天平,浙江普森电器有限公司;VM-300旋涡混匀仪,群安实验仪器有限公司。
1.3 实验方法
1.3.1 样品的制备
将羊皮清洗干净,割除羊头皮、羊蹄、小腿皮、尾巴、黏连的大块油脂及肉块,并用70 ℃左右的热水对羊皮进行热烫脱毛处理,将脱毛后的羊皮清洗干净,备用。将准备好的羊皮切成2 cm×2 cm的长条,水沸后放入锅中进行煮制,煮制时间为0、20、30、40、50、60 min。煮制结束的羊皮取出自然冷却至室温后进行指标测定。
1.3.2 水分含量的测定
擦干羊皮表面残留水分置于105 ℃烘箱内烘干至恒重,计算烘干前后羊皮质量差,得出羊皮水分含量,按公式(1)计算:
(1)
式中:X,样品中水分含量,%;m0,培养皿的质量,g;m1,干燥前样品和培养皿的质量,g;m2,干燥后样品和培养皿的质量,g。
1.3.3 低场核磁共振的测定
取出羊皮样品,用滤纸沾去羊皮表面水分后,切成1 cm×1 cm的条状放入核磁管中。参考王永瑞等[10]的方法进行测定。主要参数:测试温度32 ℃;质子共振频率18 MHz;90°和180°脉冲时间分别为16 μs和33 μs;采样点数143 140;重复时间1 500 ms;扫描次数16;回波数2 000。扫描结束后进行信号反演得到T2的反演谱。
1.3.4 挥发性物质的萃取及分析
1)挥发性物质的提取
参考柏霜等[11]的方法,将羊皮剁碎并称取(2±0.01) g置于15 mL顶空瓶中,加入质量浓度为6.42 μg/mL的内标液1,2-二氯苯4 μL,密封后置于涡旋仪上混匀。涡旋完成后,将顶空瓶置于55 ℃的水浴中平衡20 min,然后将萃取头插入密封的顶空瓶中进行吸附,保持30 min。萃取挥发性物质后立即将其转移到GC进样口250 ℃下解吸5 min。
2)GC-MS条件
GC条件:DB-WAX色谱毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:40 ℃保持3 min,以5 ℃/min升至90 ℃,再以8 ℃/min升到230 ℃,保持10 min;载气(He)流速为1.8 mL/min;进样口温度250 ℃。
MS条件:电子轰击(electron ionization, EI)离子源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;质量扫描范围m/z 20~350。扫描方式全扫描,溶剂延迟3 min。
3)定性与定量分析
定性分析:取正构烷烃(C6~C26)混标按照和样品相同的操作进行GC-MS分析,记录每个正构烷烃的出峰时间,根据出峰时间计算挥发性物质的保留指数,与质谱数据库NIST对比鉴定。
定量分析:根据内标液的峰面积计算出煮制羊皮中各挥发性物质的含量。挥发性物质含量的计算如公式(2)所示:
(2)
式中:Ax,目标化合物的峰面积;Ai,内标化合物的峰面积;ρi,内标化合物的质量浓度,μg/mL;Mx,目标化合物的含量,μg/kg。
1.3.5 OAV的计算
OAV的计算如公式(3)所示:
(3)
式中:ωi,化合物的含量,μg/kg;OTi,该化合物在水中的嗅觉阈值,μg/kg。
1.4 数据统计分析
所有数据均使用Excel 2019进行分析,最终结果以平均值±标准偏差表示。使用Origin 2021进行绘图。使用SPSS 17.0进行差异显著性分析。
2 结果与分析
2.1 煮制过程中羊皮的水分分析
2.1.1 水分含量变化
水分是羊皮的主要成分之一,不同煮制时间下羊皮的水分含量如图1所示。羊皮煮制过程中的水分含量存在显著性差异(P<0.05)。生羊皮中水分含量最高,达到79.74%。随着煮制时间的延长,羊皮的水分含量先减少后增加,煮制30 min时,水分含量最低,为69.82%。煮制过程中,氢键断裂、胶原纤维向高度无序结构连续转化,导致持水力降低[12]。煮制后期水分含量上升可能由于汤汁中的明胶浓度越来越高,明胶凝胶附着在样品表面,导致水分含量升高。

图1 不同煮制时间羊皮的水分含量
Fig.1 Moisture content of sheepskin at different cooking times
注:小写字母表示差异显著(P<0.05)。
2.1.2 水分分布状态及迁移规律
横向弛豫时间T2的变化可以用来衡量羊皮中水分的分布以及不同状态水之间的化学渗透[13]。羊皮中的水有3种状态,其中T2值主要分布在1~8 ms、27~40 ms、270~340 ms等3个区间内,分别代表结合水、不易流动水和自由水[14]。T2反演图谱上对应的峰积分面积代表相应状态水的含量。煮制过程中羊皮水分状态的变化如图2所示。

图2 不同煮制时间羊皮的LF-NMR反演谱
Fig.2 LF-NMR inversion spectrum of sheepskin with different cooking time
弛豫时间T2的大小代表水分的自由度,T2越小,水分的自由度越低,与大分子物质结合更紧密,反之,水分的自由度越高。由表1可知,T21随煮制时间的延长先减小后增大。T21在0~20 min内显著降低,可能是肌原纤维蛋白热变性导致纤维间的水分受限制,与蛋白的结合力增强了[6],羊皮内部生成了密集的蛋白质网络——凝胶,通过毛细管作用力可有效地保持水分胶凝体。20 min之后,T21增大,可能是煮制时间过长,胶原纤维完全被破坏,造成结构性失水[12]。生羊皮中未检测出不易流动水,煮制时间对T22无显著影响(P>0.05)。生羊皮的T23值最小,煮制20~50 min处于较高水平,说明此阶段的自由水自由度高,流动性强。煮制50 min后明显降低(P<0.05),可能是由于此阶段的动力主要来源于内部水分向外扩散的速率[15]。
表1 不同煮制时间羊皮弛豫时间和相对含量的变化
Table 1 LF-NMR parameters including relaxation time and relative percentage obtained from sheepskin during cooking

煮制时间/minT21/msT22/msT23/msA21/%A22/%A23/%07.72±1.44a0.00±0.00b271.18±25.32b3.71±2.69a0.00±0.00b96.30±2.69a201.94±1.38c33.10±3.54a353.45±9.85a2.87±0.06a14.44±0.54a81.49±2.17b305.51±0.47ab31.51±0.00a334.12±37.18a2.89±0.15a17.76±0.05a79.36±0.20bc405.87±0.41ab36.23±0.00a353.93±0.00a3.59±0.33a19.89±0.22a76.51±0.11c504.37±0.55bc39.11±12.50a347.05±26.87a6.89±3.71a21.25±6.47a71.86±2.76d604.47±0.02bc27.41±0.00a313.47±0.00ab2.93±0.18a17.05±0.09a80.03±0.09bc
注:同列不同小写字母表示差异显著(P<0.05)(下同)。
A21、A22、A23分别代表结合水、不易流动水、自由水的相对含量。煮制时间对A21影响不显著(P>0.05),这可能由于煮制过程中结合水在向不易流动水和自由水发生迁移,导致结合水维持较低水平。A22在0~50 min阶段上升,50 min后下降,A22的上升主要是煮制过程中,由于不易流动水处于肌原纤维内,相较于自由水不易失去,自由水扩散至汤汁中,导致不易流动水相对含量的上升。在煮制50 min后,羊皮中肌原纤维完全变性,导致肌原纤维蛋白网络中的不易流动水向自由水转变,所以不易流动水的相对含量降低。A23呈现先减小(0~50 min)后增加(50~60 min)的趋势,这是因为煮制是一个失水的过程,自由水受分子束缚力最弱,在加工过程中最先失去,在煮制50 min后,不易流动水转化为自由水,弥补了自由水的损失。甄少波等[16]研究表明,自由水比例越高,肉的保水性越差,说明羊皮煮制过程中的保水性较差。
2.2 不同煮制时间羊皮的挥发性成分分析
2.2.1 不同煮制时间羊皮挥发性物质的变化规律
采用HS-SPME结合GC-MS对不同煮制时间羊皮挥发性风味物质进行萃取分析,结果如表2所示。在6个羊皮样本中共检测出43种挥发性风味物质,其中包括醛类12种、醇类10种、酸类6种、酮类6种、杂环类3种、其他类6种。在0、20、30、40、50、60 min样本中检出的挥发性风味物质分别有24种、29种、36种、32种、31种、29种。羊皮中的挥发性风味物质的种类随着煮制时间的延长先增加后减少,煮制30 min时种类最多。其中,壬醛、己醛、4-甲氧基苯酚、(E)-2-辛烯-1-醇辛酸、苯甲酸、戊醇、辛醇、己醇、庚醇、1-辛烯-3-醇、对甲苯酚和甲苯在6个羊皮样品均有检出。
表2 不同煮制时间羊皮中的挥发性风味物质 单位:μg/kg
Table 2 Volatile flavor compounds in sheepskin with different cooking times

序号化合物名称保留指数阈值/(μg·kg-1)煮制时间/min020304050601辛醛1 2810.7—27.39±5.24a51.60±13.71a36.32±7.66a34.80±2.06a32.61±4.64a2壬醛1 38014.85±0.45c29.02±7.96ab64.37±15.19a49.30±6.20ab43.97±1.29ab35.47±1.22b3己醛1 0704.50.70±0.40d344.59±53.28ab429.99±20.17a328.77±81.47ab233.57±12.39bc160.73±0.19c4庚醛1 1823—1.64±1.27c64.58±9.31a43.67±6.98b——5呋喃甲醛1 5028—20.50±4.54a5.19±1.13bc10.21±1.23b5.59±0.51b3.76±0.01c64-甲氧基苯甲醛2 017UN1.61±0.16a2.79±0.69a3.02±0.60a2.78±0.58a2.27±0.30a1.56±0.13a7苯甲醛1 511350—4.49±0.62ab7.01±1.40a6.43±0.99a2.91±0.83b3.06±0.47b8(E)-2-辛烯醛1 4360.2—1.10±0.35a1.50±0.40a1.23±0.37a1.10±0.22a0.81±0.05b9(E)-2-壬烯醛1 1600.08—0.65±0.10b1.56±0.32a—0.88±0.27b0.82±0.16b10(E)-2-庚烯醛1 53713—0.68±0.07a0.89±0.28a0.85±0.07a0.62±0.18a—11(E)-2-癸烯醛1 6940.3—0.84±0.17b1.84±0.06a——1.12±0.26b12癸醛1 48911——2.58±0.21a2.32±0.90a1.59±0.01a—13(E)-2-辛烯-1-醇1 622UN3.02±0.65ab2.66±0.74ab3.30±0.54a2.71±0.38ab1.51±0.20bc0.96±0.01c14戊醇1 2624 5008.54±0.48ab12.45±1.72a11.63±3.48a8.93±0.99ab6.57±0.40ab4.2±0.17b15辛醇1 5765410.39±2.10a5.09±1.29ab8.41±1.82ab7.29±0.35ab6.16±0.33b4.79±0.56b16己醇1 3592007.78±1.78a4.74±0.90ab7.40±1.95a4.82±0.54ab4.23±0.10ab2.68±0.28b17庚醇1 3625205.68±1.90a3.70±1.23a7.44±1.76a5.17±0.40a4.43±0.18a3.31±0.19a181-辛烯-3-醇1 459131.24±1.95a33.62±7.88a34.34±12.73a27.18±6.55a22.60±1.40a11.53±0.22a19丁醇1.5865002.73±0.80a—6.80±1.06a5.80±0.32a6.84±0.90a—201-甲氧基-2-丙醇1 149UN9.47±8.33b—19.37±0.14a19.55±3.05a—6.59±3.77b214-甲基-5-噻唑乙醇2 283UN2.73±0.19b—7.20±0.82a5.05±1.30ab4.62±0.83ab3.01±0.08b221-戊烯-3-醇1 159UN21.68±1.59a—————23辛酸2 0693 0001.09±0.06b2.50±0.43a2.59±0.25a1.95±0.39ab1.78±0.29ab1.10±0.05b24壬酸2 1733 000—3.12±0.59ab3.45±0.62a2.92±0.46ab2.50±0.33ab1.90±0.14b25乙酸1 46022 0004.50±2.39a—2.13±0.30b1.90±0.30b1.62±0.16b—26庚酸1 9513 000—————0.54±0.01a27丙酸1 558UN——0.30±0.06a———28苯甲酸1 831UN0.84±0.06a1.30±0.23a1.34±0.24a0.90±0.28a0.84±0.13a0.68±0.11b293-辛酮1 25921.41.90±0.12a0.74±0.30b0.67±0.23b0.71±0.08b0.50±0.07b—306-甲基-2-庚酮1 236UN—1.20±0.17a1.75±0.73a—1.01±0.16b1.07±0.04b312,3-辛二酮1 319UN—94.18±26.09a101.26±36.48a102.83±17.72a65.65±8.79a40.00±1.52a322,3-戊二酮1 07320——2.96±0.47a———333-羟基-2-丁酮1 306UN——3.38±0.12a2.21±0.40b——34苯乙酮1 637UN0.36±0.03a—————352-戊基呋喃1 2306—7.14±1.93b8.51±1.87b8.93±0.87b20.25±6.35a17.09±1.23ab362-乙酰噻唑1 620UN—2.00±0.61a1.70±0.27ab1.24±0.17ab1.74±0.20ab0.94±0.08b37苯并噻唑1 915UN0.73±0.10a—————38癸酸甲酯1 697UN3.01±1.01a—————394-乙基辛烷956UN—2.71±0.32b—4.44±1.46ab8.62±2.67a6.70±1.69ab40苯酚2 0095 9007.19±0.54a2.38±0.52b1.97±0.24b1.41±0.21bc1.55±0.26bc0.77±0.06c412-甲氧基苯酚1 872UN1.25±1.26a—————42对甲苯酚2 0605543.81±11.38a12.25±3.38b15.59±2.75b10.23±1.67b11.26±1.54b4.89±0.40b43甲苯1 03414025.43±3.43a24.51±4.31a20.07±11.74a46.78±11.83a45.02±15.11a41.65±8.85a
注:同行不同小写字母表示平均值差异显著(P<0.05);“—”表示未检出;“UN”表示未查到相关阈值。
各类物质的总含量如图3所示。随煮制时间的延长,醛类、酸类、酮类和杂环类物质的总含量均先增加后减少,醇类物质的总含量先减少后增加再减少,其他类物质的总含量先减少后增加。

图3 不同煮制时间羊皮中各类物质的总含量
Fig.3 Total content of various substances in sheepskin at different cooking times
脂质氧化和氨基酸Strecker降解是醛类物质的主要来源[17]。在煮制羊皮挥发性风味物质中,醛类占总含量的60%~70%,主要有壬醛、己醛、呋喃甲醛等。醛类物质的含量高、嗅觉阈值低,对肉类食品的风味贡献较大。己醛、壬醛和辛醛含量随着煮制时间的延长先增加后减少,其中己醛在30 min时含量最高,达到429.99 μg/kg。己醛主要呈现青草味,共轭亚油酸和花生四烯酸是其前体物质[18],壬醛和辛醛则是来自油酸和亚油酸的分解产物,呈果香味。呋喃甲醛可能来源于戊糖的受热分解,呈生土豆味[19]。苯甲醛源于苯丙氨酸的Strecker降解,呈焦糖和杏仁味[20]。(E)-2-辛烯醛可能来源于亚油酸的分解,有烤肉味和花生味[21]。
脂肪氧化是醇类物质的主要产生途径[22]。醇类物质占煮制羊皮挥发性物质总含量的9%~12%,主要有戊醇、辛醇、1-辛烯-3-醇、己醇和庚醇等。戊醇、辛醇、己醇和庚醇为饱和醇,嗅觉阈值较高,对羊皮的整体风味贡献不如醛类,大多呈现清新的花草香味。1-辛烯-3-醇为不饱和醇,嗅觉阈值低,是肉类中重要的挥发性风味物质,主要来源于花生四烯酸和反式亚油酸的氧化水解[23],有浓烈的蘑菇香味。
脂肪氧化和美拉德反应是酮类物质的主要来源[24]。大多数酮类物质的感觉阈值都比较高,因而对煮制羊皮的整体风味贡献较小。2,3-辛二酮在酮类物质中的含量最高,普遍存在于食草性动物肌肉中,可能来源于氨基酸分解或β-氧化甘油三酯受热产生的脂肪酸[17],呈现烤豆香味。
脂肪氧化裂解是酸类物质产生的主要途径。酸类物质种类少,含量低,感觉阈值高,因此对煮制羊皮的整体风味贡献较小。研究表明4-甲基辛酸、4-乙基辛酸等甲基侧链的脂肪酸是引起羊肉膻味的主要原因[25],本实验中并未检测到这2种致膻成分,说明滩羊皮的膻味较轻。杂环类物质的主要来源有脂质氧化、硫胺素热降解和美拉德反应。杂环类物质占煮制羊皮挥发性物质总含量的1%~4%。2-戊基呋喃是引起的总含量变化的主要物质,可通过n-6或n-3不饱和脂肪酸如亚油酸和亚麻酸的热氧化形成,呈现果香味[26]。2-乙酰噻唑属于噻唑类化合物,由半胱胺与2-丙酮反应产生[27],有米糠香气。
2.2.2 羊皮煮制过程中挥发性风味物质的OAV
OAV法是用来评价各组分风味物质对整体风味贡献的重要方法。因此基于GC-MS对羊皮挥发性风味物质的定性、定量分析,采用OAV筛选煮制羊皮的关键风味物质。一般,OAV越大表明该组分对羊皮风味的贡献越大;通常将OAV≥1的组分视为关键风味物质。参考《化合物香味阈值汇编(第二版)》及《食用调香术》[28-29],在煮制羊皮样品中共筛选出10种关键风味物质(OAV≥1),分别为辛醛、壬醛、己醛、庚醛、呋喃甲醛、(E)-2-辛烯醛、(E)-2-壬烯醛、(E)-2-癸烯醛、1-辛烯-3-醇、2-戊基呋喃,其中醛类有8种,醇类有1种,杂环类有1种。由图4可知,0、20、30、40、50、60 min样本中的关键风味物质分别有3、10、10、8、8、9种。壬醛、己醛和1-辛烯-3-醇是所有样本中共有的关键风味物质。煮制30 min时,除2-戊基呋喃外,其余9种关键风味物质均具有最大的OAV,因此煮制30 min时羊皮的香气最浓郁。
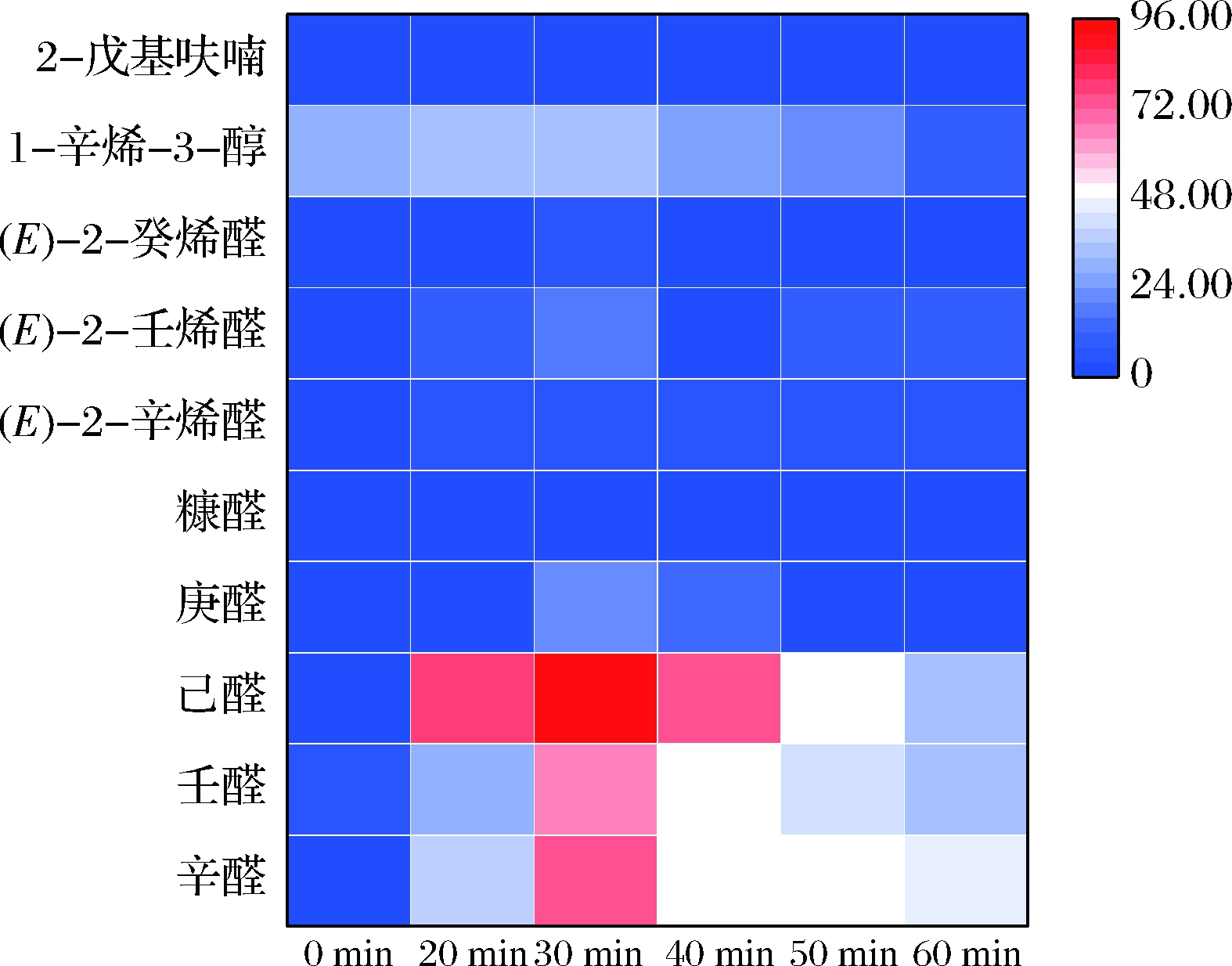
图4 不同煮制时间羊皮中关键风味物质热图
Fig.4 Heatmap of key volatile flavor compounds in sheepskin at different cooking times
2.3 水分和挥发性物质的相关性分析
将煮制羊皮的水分和关键性风味物质的含量进行相关性分析,结果见图5。辛醛、壬醛、己醛和(E)-2-辛烯醛的含量与水分含量呈负相关(P<0.01)。辛醛和(E)-2-辛烯醛的含量与不易流动水的相对含量呈正相关(P<0.05)。水在香气-蛋白质相互作用的形成中必不可少[30],许多风味化合物,包括酮类、醛类和酯类通过疏水作用与蛋白质结合。水分的变化导致了蛋白质结构的变化,蛋白质与挥发性物质的结合位点发生变化,进而影响了挥发性风味物质[31]。

A-辛醛;B-壬醛;C-己醛;D-庚醛;E-呋喃甲醛;F-(E)-2-
辛烯醛;G-(E)-2-壬烯醛;H-(E)-2-癸烯醛;I-1-辛烯-3-醇;J-2-戊基呋喃;X-水分含量;A1-结合水相对含量;A2-不易流动水相对含量;A3-自由水相对含量
图5 羊皮中的水分和挥发性物质的相关性分析
Fig.5 Correlation analysis of moisture and volatile substances in sheepskin
注:*代表P≤0.05,**代表P≤0.01
3 结论
本研究采用LF-NMR和HS-SPME-GC-MS技术对不同煮制时间羊皮(0、20、30、40、50、60 min)的水分分布及挥发性风味物质进行研究,并结合OAV筛选出关键挥发性物质。结果表明:煮制羊皮中水分的主要存在形式为自由水;T21随煮制时间的延长先减小后增大,煮制时间对T22无显著影响。6个样本中共鉴定出43种化合物,其中醛类12种、醇类10种、酸类6种、酮类6种、杂环类3种、其他类6种。通过OAV筛选出关键挥发性风味物质11种,分别为辛醛、壬醛、己醛、庚醛、呋喃甲醛、(E)-2-辛烯醛、(E)-2-壬烯醛、(E)-2-癸烯醛、1-辛烯-3-醇、2-戊基呋喃。关键挥发性风味物质辛醛、壬醛、己醛和(E)-2-辛烯醛的含量与水分总含量显著负相关(P<0.01);辛醛和(E)-2-辛烯醛的含量与不易流动水的相对含量呈正相关(P<0.05)。下一步将研究调味品对煮制羊皮品质变化的影响,指导新型羊皮食品的开发。
[1] 王贝贝, 于哲, 李强, 等.模拟胃肠消化对羊皮胶原肽抗氧化活性的影响及其消化保护分析[J].食品科学, 2022, 43(7):128-138.
WANG B B, YU Z, LI Q, et al.Effects of simulated gastrointestinal digestion on antioxidant activity of sheepskin collagen peptides and their digestive protection[J].Food Science, 2022, 43(7):128-138.
[2] 段云霞, 赵英, 迟玉杰.基于低场核磁共振技术分析不同贮藏条件下白煮蛋水分分布及品质变化[J].食品科学, 2018, 39(9):26-32.
DUAN Y X, ZHAO Y, CHI Y J.Low field nuclear magnetic resonance analysis of moisture distribution and quality variation in boiled eggs under different storage conditions[J].Food Science, 2018, 39(9):26-32.
[3] ZHANG J, PAN D D, ZHOU G H, et al.The changes of the volatile compounds derived from lipid oxidation of boneless dry-cured hams during processing[J].European Journal of Lipid Science and Technology, 2019, 121(10):1900135.
[4] 卢骁, 董鹏程, 张一敏, 等.微冻贮藏对牛肉保水性的影响[J].食品科学, 2021, 42(7):253-259.
LU X, DONG P C, ZHANG Y M, et al.Effect of superchilled storage on water-holding capacity of beef muscle[J].Food Science, 2021, 42(7):253-259.
[5] 单启梅, 罗瑞明, 杨波, 等.不同贮藏期冷却滩羊肉煮制后挥发性气味物质的变化[J].食品科学, 2022, 43(6):265-271.
SHAN Q M, LUO R M, YANG B, et al.Changes of volatile odor substances in chilled Tan sheep meat stored for different periods and cooked[J].Food Science, 2022, 43(6):265-271.
[6] 刘丽美, 刘骞, 孔保华, 等.基于低场NMR研究油炸温度对牛肉干水分分布与品质的影响[J].中国食品学报, 2016, 16(5):238-244.
LIU L M, LIU Q, KONG B H, et al.Effect of deep-frying temperature on moisture distribution and quality of beef jerky based on low field NMR[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(5):238-244.
[7] 王永瑞, 柏霜, 罗瑞明, 等.焙烤对宁夏滩羊羊脂水分分布和关键性香气成分的影响[J].食品科学, 2022, 43(6):287-294.
WANG Y R, BAI S, LUO R M, et al.Effect of roasting on moisture migration and key aroma compounds of mutton tallow[J].Food Science, 2022, 43(6):287-294.
[8] LIU H, WANG Z Y, ZHANG D Q, et al.Generation of key aroma compounds in Beijing roasted duck induced via Maillard reaction and lipid pyrolysis reaction[J].Food Research International, 2020, 136:109328.
[9] LIU H, HUI T, FANG F, et al.The formation of key aroma compounds in roasted mutton during the traditional charcoal process[J].Meat Science, 2022, 184:108689.
[10] 王永瑞, 薛美芳, 罗瑞明, 等.羊肉烤制过程中水分的分布与迁移规律[J].中国食品学报, 2022, 22(3):297-308.
WANG Y R, XUE M F, LUO R M, et al.Moisture distribution and migration law of mutton during the roasting process[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(3):297-308.
[11] 柏霜, 王永瑞, 罗瑞明, 等.不同高温烹饪方式加工过程中滩羊肉风味化合物的差异比较[J].食品科学, 2021, 42(24):166-174.
BAI S, WANG Y R, LUO R M, et al.Formation of and changes in volatile flavor compounds in Tan sheep meat during processing by different high-temperature cooking methods[J].Food Science, 2021, 42(24):166-174.
[12] WAN Y F, GAO Y F, SHAO J H, et al.Effects of ultrasound and thermal treatment on the ultrastructure of collagen fibers from bovine tendon using atomic force microscopy[J].Food Chemistry, 2021, 347:128985.
[13] 马舒义, 郑亦舟, 王杰, 等.磁弛豫时间在食品安全检测中的应用研究进展[J].上海师范大学学报(自然科学版), 2018, 47(6):719-725.
MA S Y, ZHENG Y Z, WANG J, et al.Application of magnetic relaxation time in food safety testing[J].Journal of Shanghai Normal University (Natural Sciences), 2018, 47(6):719-725.
[14] SONG Y, HUANG F, LI X, et al.Water status evolution of pork blocks at different cooking procedures:A two-dimensional LF-NMR T1-T2 relaxation study[J].Food Research International, 2021, 148:110614.
[15] 马慧俐, 王松磊, 贺晓光, 等.不同干燥方式下黄牛肉水分分布迁移规律研究[J].核农学报, 2021, 35(1):138-146.
MA H L, WANG S L, HE X G, et al.Water distribution and migration of yellow beef under different drying methods[J].Journal of Nuclear Agricultural Sciences, 2021, 35(1):138-146.
[16] 甄少波, 刘奕忍, 郭慧媛, 等.低场核磁共振分析猪肉宰后成熟过程中的水分变化[J].食品工业科技, 2017, 38(22):66-70.
ZHEN S B, LIU Y R, GUO H Y, et al.Analysis of moisture changes of pork during postmortem aging by low-field NMR[J].Science and Technology of Food Industry, 2017, 38(22):66-70.
[17] 毕永昭, 单启梅, 罗瑞明, 等.不同冻结速率手抓羊肉挥发性风味物质差异分析[J].食品科学,2023,44(2):288-295.
BI Y Z, SHAN Q M, LUO R M, et al.Differences in volatile flavor compounds in hand grab mutton frozen at different freezing rates[J].Food Science, 2023,44(2):288-295.
[18] 王永瑞, 柏霜, 罗瑞明, 等.基于电子鼻、GC-MS结合化学计量学方法鉴别烤羊肉掺假[J].食品科学, 2022, 43(4):291-298.
WANG Y R, BAI S, LUO R M, et al.Identification of adulteration of roast mutton using electronic nose and gas chromatography-mass spectrometry combined with chemometric methods[J].Food Science, 2022, 43(4):291-298.
[19] 李淑荣, 王丽, 张春红, 等.烘烤花生中关键香味化合物的研究[J].中国农业科学, 2010, 43(15):3 199-3 203.
LI S R, WANG L, ZHANG C H, et al.Analysis of the key odorants of roasted peanut[J].Scientia Agricultura Sinica, 2010, 43(15):3 199-3 203.
[20] 柏霜, 王永瑞, 罗瑞明.传统工业大锅与小锅炒制羊肉臊子挥发性风味物质差异分析[J].食品科学, 2021, 42(14):180-186.
BAI S, WANG Y R, LUO R M.Analysis of differences in volatile flavor compounds between traditional industrial large wok and small wok stir-fried diced mutton[J].Food Science, 2021, 42(14):180-186.
[21] SOHAIL A, AL-DALALI S, WANG J N, et al.Aroma compounds identified in cooked meat:A review[J].Food Research International, 2022, 157:111385.
[22] 姚敏, 谢国芳, 杨蓉, 等.红烧肉制备过程中关键环节的风味化合物分析[J].食品与机械, 2022, 38(1):15-23;43.
YAO M, XIE G F, YANG R, et al.Analysis of flavor compounds in the process of stewed pork at key stages[J].Food &Machinery, 2022, 38(1):15-23;43.
[23] 李文博, 罗玉龙, 刘畅, 等.饲养方式对苏尼特羊肉挥发性风味成分和脂肪酸组成的影响[J].食品科学, 2019, 40(24):207-213.
LI W B, LUO Y L, LIU C, et al.Effects of feeding patterns on volatile flavor components and fatty acid composition of sunit sheep meat[J].Food Science, 2019, 40(24):207-213.
[24] QIAN M, ZHENG M Y, ZHAO W H, et al.Effect of marinating and frying on the flavor of braised pigeon[J].Journal of Food Processing and Preservation, 2021, 45(3):e15219.
[25] 姬云云, 詹萍, 田洪磊.炖煮时间对羊肉汤风味品质的影响[J].中国食品学报, 2020, 20(12):256-267.
JI Y Y, ZHAN P, TIAN H L.Effects of different stewed times on sensory quality of mutton soup[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(12):256-267.
[26] LI J, YANG Y Y, TANG C H, et al.Changes in lipids and aroma compounds in intramuscular fat from Hu sheep[J].Food Chemistry, 2022, 383:132611.
[27] 解万翠, 卢宽, 于靖, 等.水产品香气研究进展[J].食品科学技术学报, 2022, 40(1):11-21.
XIE W C, LU K, YU J, et al.Research progress on aroma of aquatic products[J].Journal of Food Science and Technology, 2022, 40(1):11-21.
[28] 里奥·范海默特.化合物嗅觉阈值汇编[M].北京:科学出版社, 2018.
VAN GERMERT L.Compilation of Olfactory Thresholds for Compounds[M].Beijing:Science Press, 2018.
[29] 孙宝国, 陈海涛.食用调香术[M].3版.北京:化学工业出版社, 2017.
SUN B G CHEN H T.Edible Perfumer[M].3rd ed. Beijing:Chemical Industry Press, 2017.
[30] SEUVRE A M, ESPINOSA DIAZ M A, VOILLEY A.Retention of aroma compounds by β-lactoglobulin in different conditions[J].Food Chemistry, 2002, 77(4):421-429.
[31] ZHANG J, KANG D C, ZHANG W G, et al.Recent advantage of interactions of protein-flavor in foods:Perspective of theoretical models, protein properties and extrinsic factors[J].Trends in Food Science &Technology, 2021, 111:405-425.