果胶类物质是一种高分子质量复合物的酸性结构多糖的异质基团,存在于植物组织中。主链是通过α-1,4糖苷键聚合而成的D-吡喃半乳糖醛酸;侧链由各种多糖组成,如L-鼠李糖(2%~4%)、L-阿拉伯糖、D-半乳糖和β-D-木糖等[1-2]。果胶类物质的存在形式多种多样,美国化学学会根据其结构将其分为4大类[3],分别是原果胶、果胶酸、果胶酯酸和果胶[3-5]。
果胶酶是多种酶的总称,能够分解果胶物质[6],可将其分为原果胶酶、果胶酯酶和解聚酶[4]。动植物和微生物均可产生果胶酶[7],其中产果胶酶微生物主要包括放线菌、酵母菌、镰孢菌、真菌、细菌等[1,8-9]。在果胶酶的天然来源中,微生物果胶酶因其易于生产和独特的物理化学性质(如微生物生长速度快、寿命短、具有广泛的生物多样性和对基因操作的敏感性)而被频繁使用[10],微生物果胶酶更能满足工业需求。微生物酶因其更具特异性、更环保、更节能等特点,正逐渐取代化学催化剂。
根据最佳酶活性pH的不同又可将果胶酶分为碱性和酸性[9-11]。碱性果胶酶应用广泛,可用于预处理食品加工业中含果胶的废水、植物韧皮纤维的加工和脱胶[12],纺织物工业中亚麻、红麻和黄麻等植物纤维的浸湿[13],棉织物的生物制备和黄麻、棉混纺织物的酶促抛光,且可在造纸工业中漂白纸浆和处理造纸厂废水,提高红茶品质。酸性果胶酶可用于提取和澄清果汁和果酒(尤其是葡萄酒)、蔬菜和水果的浸渍、精油提取的改进和婴儿食品产量的提高[1]。
随着果胶酶在商业市场的需求和应用不断增加,果胶酶已占全球酶市场的25%[14],因此,果胶酶是商业领域不可或缺的酶之一。然而,相比于国外,我国对于果胶酶的研究起步晚[5, 15],缺乏产生高酶活力的菌种,导致效价高的商品果胶酶产量仍很低,产酶成本高,在理论深度还是开发应用方面与国外相比都有一段距离[15-16],目前能应用于工业中的果胶酶多为真菌产生[4]。于振林等[17]对1株白地霉所产的果胶酶分离纯化,酶活力提高到8 036.34 U/mL;罗雯等[18]从土壤中筛选出1株野生型黑曲霉菌株Aspergillus sp.CM3,其产果胶酶活力为2 115.4 U/mL,通过发酵条件的优化可将酶活力提高到3 942.7 U/mL。相对于真菌来说,细菌繁殖速度快、易于培养等,然而目前细菌产果胶酶的活力仍有待提高,吕秀红[19]采用碘液法从土壤中筛选出1株产耐热性酸性果胶酶的菌株,经鉴定为甲基营养型芽孢杆菌ZJ1407,其酶活力为338 U/mL;于平等[9]筛选出1株产碱性果胶酶的枯草芽孢杆菌ZGL14,其酶活力为306.59 U/mL;REHMAN等[20]等从腐烂的茄子中筛选出1株产果胶酶的地衣芽孢杆菌,其酶活力为341 U/mL。本试验从上海海洋大学橘园中采集土壤,通过刚果红染色法筛选出能产果胶酶的菌株,再通过DNS法测酶活力复筛出一株有良好的酸碱耐受性的高产果胶酶的野生型细菌菌株,对其进16S rDNA基因序列分析、形态学鉴定、理化试验以及其所产果胶酶的初步酶学性质研究,以期为工业上生产果胶酶提供理论基础,促进微生物产果胶酶的进一步研究和利用。
1 材料与方法
1.1 实验材料
1.1.1 土样采集
样品取自上海海洋大学橘园,用无菌采样器通过三点采样法采集距离地表8~10 cm的土样,置于无菌袋中,并于4 ℃保存备用。
1.1.2 主要化学试剂
果胶、葡萄糖、蛋白胨、酵母粉、刚果红、DNA提取试剂盒,Sigma公司;一水合柠檬酸、Na2HPO4·12H2O,国药集团;PCR扩增试剂盒,上海百力格生物技术公司;其他试剂均为国产分析纯。
1.1.3 培养基
基础培养基(g/L):蛋白胨10,牛肉粉3,NaCl 5,pH 7.5,121 ℃灭菌30 min。
斜面培养基(g/L):蛋白胨10,牛肉粉3,NaCl 5,琼脂15,pH 7.3,121 ℃灭菌30 min。
初筛培养基(g/L):果胶8,NH4Cl 1.4,KH2PO4 2,K2HPO4·3H2O 6,MgSO4·7H2O 0.1,琼脂15,自然pH,121 ℃灭菌30 min。
发酵培养基(g/L):葡萄糖10,酵母粉5,蛋白胨5,KH2PO4 3,K2HPO4·3H2O 9,pH 6.0,121 ℃灭菌30 min。
1.2 仪器与设备
UV-1800PC紫外可见分光光度计,上海美普达仪器有限公司;TGL-16G台式高速离心机,上海安亭科学仪器厂;CX41RF光学显微镜,日本奥林巴斯公司;GelDocXR凝胶成像仪、PTC200型PCR扩增仪,Bio-Rad(美国)公司;DYY-6C电泳仪,北京六一仪器厂。
1.3 实验方法
1.3.1 产果胶酶菌株的初步筛选
称取土样10 g加入到含90 mL无菌水的锥形瓶中,振荡摇匀,制成土壤样品溶液。再从锥形瓶中吸取1 mL样品溶液加入到99 mL基础培养基中,于37 ℃、160 r/min富集培养24 h。用质量分数为0.85%的无菌生理盐水将富集培养过的菌悬液进行10倍系列稀释,然后将稀释过的菌悬液各自取200 μL涂布到初筛培养基上,每个梯度进行3组平行实验,于37 ℃培养箱培养48 h。待长出菌落后,挑取单菌落分离纯化并将纯化后的菌株转接到斜面培养基,培养24 h后置于4 ℃冰箱保存,同时将纯化后的菌株点种到初筛培养基上,进行3组平行实验,37 ℃静置培养48 h,用10 g/L刚果红染色液染色30 min,再用1 mol/L NaCl溶液静置洗脱色30 min,挑选出产透明圈的菌株,比较透明圈直径(R)/菌落直径(r),选R/r值较大的菌株进行复筛[9]。
1.3.2 产果胶酶菌株的复筛
将初筛得到R/r值较大的菌株接种到基础培养基中于37 ℃、160 r/min培养24 h,再将活化24 h的培养物按体积分数为4%的接种量接到发酵培养基(50/250 mL)中,于37 ℃、160 r/min发酵72 h,采用DNS法测各菌株的酶活力,挑选出最大酶活力的菌株,用甘油管保存于-80 ℃冰箱。
1.3.3 果胶酶活力的测定
1.3.3.1 葡萄糖标准曲线的制作
称取0.1 g葡萄糖,使用pH 6.0的一水合柠檬酸-Na2HPO4缓冲溶液定容到100 mL,即为的葡萄糖标准溶液。
分别在9组比色管中加入0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL葡萄糖标准溶液(1.0 mg/mL)于比色管用水定容至4 mL,再分别加入5 mL DNS溶液,振荡摇匀,沸水浴5 min,立即冷却,最后定容到25 mL,于540 nm处测OD值,并进行3组重复试验。横坐标为葡萄糖含量(mg),纵坐标为吸光度(OD540),绘制葡萄糖标准曲线。
1.3.3.2 果胶酶活力的测定
取培养物于4 ℃、10 000 r/min离心10 min,上清液即为粗酶液。采用DNS法,取5 mL 10 g/L的果胶溶液于比色管中,50 ℃水浴预热5 min,加入4 mL pH 6.0的缓冲溶液,再加入1 mL稀释后的酶液,于50 ℃水浴反应30 min;取反应液的1/5(2 mL)加入另一比色管中,加2 mL蒸馏水,再加入5 mL DNS,沸水浴加热5 min,立即冷却,最后定容到25 mL。于540 nm处测OD值。对照组将稀释后的酶液沸水浴灭活10 min,其余条件和实验组相同。
果胶酶活力定义:在一定条件下,1 mL酶液1 min分解果胶产生1 μg半乳糖醛酸为1个酶活力单位(U/mL)。
用测得的OD540值带入标准曲线中计算出葡萄糖的量(G),再转换成半乳糖醛酸的量(W)。
果胶酶活力(U/mL)=G×194/180×1 000×n×5/t
(1)
式中:n,酶液稀释倍数;t, 反应时间,min。
1.4 菌种的鉴定
1.4.1 形态学鉴定
将复筛得到最高酶活力的菌株划线分离纯化,37 ℃培养24 h后观察菌落形态及革兰氏染色。
1.4.2 生理生化鉴定
参考《常见细菌系统鉴定手册》[25]和《伯杰氏细菌鉴定手册》[26],对筛选出的菌株进行生理生化试验。
1.4.3 16S rDNA鉴定和构建系统发育树
用细菌提取DNA试剂盒提取目标菌株的DNA作为PCR扩增的模板,PCR扩增总体系共25 μL,分别是通用引物27F和1492R各1 μL,模板DNA 2 μL,2×PCR Master 12.5 μL和ddH2O 8.5 μL。用15 g/L的琼脂糖凝胶电泳检测PCR扩增产物,并送上海生物公司测序。所得的序列在NCBI数据库中通过BLAST比对分析,选较高同源性的菌株,利用MEGA 7.0软件构建系统发育树[9,27]。
1.5 酶学性质的初步研究
1.5.1 发酵时间对菌株Z-5的生长和产果胶酶活性的影响
将活化24 h的菌株Z-5接到发酵培养基中,37 ℃、160 r/min培养96 h,每隔6 h取样测菌液浓度即生长量和果胶酶活力,设置3组平行实验取平均值。
1.5.2 果胶酶最适反应温度的研究
将发酵液于4 ℃、10 000 r/min离心10 min得粗酶液,经稀释后,测定各反应温度(20、30、40、45、50、55、60、70、80 ℃)下样品的果胶酶活力。将最大酶活力定义为100%,计算相对酶活力。
1.5.3 果胶酶的热稳定性研究
取稀释后的粗酶液于无菌试管中,分别在40、50、60、70、80 ℃保温处理2 h,每隔30 min测1次酶活力,将处理前的酶活力定义为100%,计算相对酶活力。
1.5.4 果胶酶最适反应pH的研究
分别配制3种不同的缓冲溶液:pH 3.0~7.0的一水合柠檬酸-Na2HPO4缓冲溶液、pH 8.0~9.0的PBS缓冲溶液、pH为10.0的NaHCO3-NaOH缓冲溶液。用不同pH的缓冲溶液稀释粗酶液并配制相应pH的果胶底物,测定不同pH的果胶酶活力,将最大酶活力定义为100%,计算相对酶活力。
1.5.5 果胶酶的pH稳定性的研究
将粗酶液在不同pH缓冲溶液中处理1、2 h,测定果胶酶活力,将处理前的酶活力定义为100%,计算相对酶活力。
1.5.6 金属离子对果胶酶活力的影响
将稀释后的粗酶液与金属离子(Ca2+、Mg2+、Cu2+、Mn2+、Fe2+、Ba2+、Zn2+、Hg2+)混匀,使金属离子浓度为1 mmol/L,测添加了不同金属离子粗酶液的果胶酶活力,将原始粗酶液为对照组并定义其活力为100%,计算相对酶活力。
2 结果与分析
2.1 产果胶酶菌株的筛选
2.1.1 初筛
在以果胶为唯一碳源的初筛培养基上点种经划线分离纯化的150株菌种,37 ℃培养48 h后,用10 g/L的刚果红染色30 min,然后用1 mol/L的NaCl溶液静置洗脱色30 min,筛选出16株能产透明圈的菌种,从中挑选出8株R/r≥5的菌株进行复筛。
2.1.2 复筛
对挑选出的8株R/r>5的菌株于发酵培养基培养72 h进行产酶复筛,测各菌株产果胶酶的酶活力。
2.1.3 果胶酶活力的测定
2.1.3.1 葡萄糖标准曲线的制作
根据1.3.3.1节的方法制作标准曲线,线性回归方程为y=0.657 2x-0.109 9,R2=0.999 3,线性拟合程度良好,可用于计算果胶酶活力。
2.1.3.2 酶活力的测定
如表1所示,菌株Z-5酶活力最高为(879±2.733) U/mL,所以后续实验均选择菌株Z-5进行。
表1 产果胶酶菌株的筛选结果
Table 1 Screening results of pectinase-producing strains

菌株编号透明圈直径r/mm菌落直径R/mmR/r酶活力/(U/mL)Z-321.63.95.54796±2.845bZ-419.33.85.08783±2.088cZ-529.34.17.14879±2.733aZ-819.53.95.00743±3.439dZ-920.01.910.50695±2.376efZ-1321.84.25.19689±4.799fZ-2133.13.110.68657±5.957gZ-2431.02.811.07698±5.417e
注:不同小写字母表示差异显著(P<0.05)。
2.2 菌株Z-5的鉴定
2.2.1 形态学鉴定
如图1-a所示,菌株Z-5在初筛培养基上产生的透明圈。如图1-b所示,菌株Z-5在营养琼脂平板上的菌落形态,其菌落为淡黄色,表面不光滑干燥,有褶皱,不透明,边缘不规则。在显微镜下可看到单个菌体为杆状,经革兰氏染色鉴定为阳性菌(图1-c)。

a-初筛培养基上的透明圈结果;b-平板菌落形态;c-油镜下的菌体形态
图1 菌株Z-5在初筛培养基上产的透明圈、平板上的
菌落形态和油镜下的菌体形态
Fig.1 Transparent zone on primary screening medium, colony morphology on plates, and bacterial morphology under oil microscope of strain Z-5
2.2.2 生理生化鉴定
菌株Z-5的生理生化试验结果如表2所示。菌株Z-5为革兰氏阳性菌,能形成内生孢子,可利用柠檬酸、葡萄糖、乳糖、淀粉,V-P试验为阳性,而吲哚、M.R试验、H2S试验均为阴性,且利用葡萄糖时不产气等等,综合形态学鉴定和生理生化试验可初步判定为芽孢杆菌属。
表2 菌株Z-5的生理生化特征
Table 2 Biochemical characteristics of strain Z-5
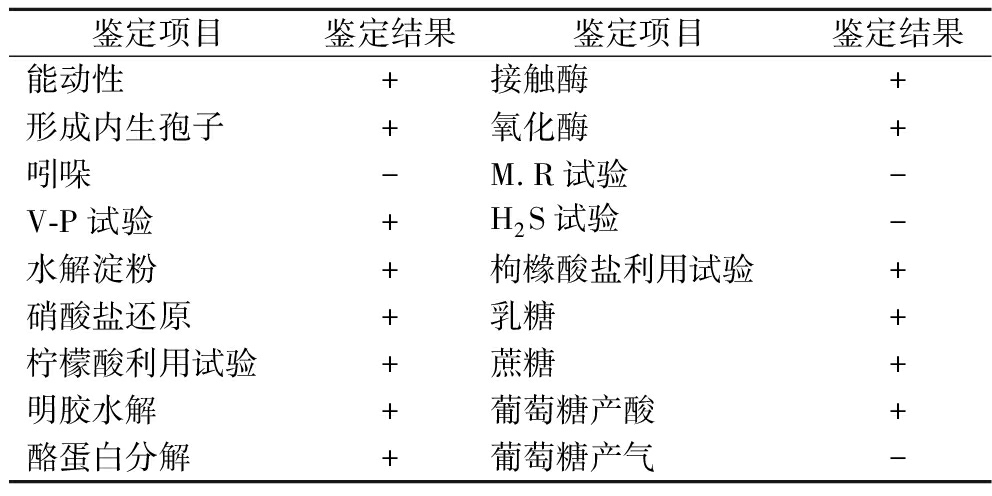
鉴定项目鉴定结果鉴定项目鉴定结果能动性+接触酶+形成内生孢子+氧化酶+吲哚-M.R试验-V-P试验+H2S试验-水解淀粉+枸橼酸盐利用试验+硝酸盐还原+乳糖+柠檬酸利用试验+蔗糖+明胶水解+葡萄糖产酸+酪蛋白分解+葡萄糖产气-
注:“+”阳性,“-”阴性。
2.2.3 16S rDNA鉴定及系统发育树构建
菌株Z-5经过16S rDNA测序后得到的序列长度为1 459 bp。利用MEGA软件构建的系统发育树[28],如图2所示。菌株Z-5与Bacillus subtilis(AB042061)在同一支,且相似度为98.83%,Bootstrap检验值为100,综合生理生化试验和菌落形态结果可确定为枯草芽孢杆菌(Bacillus subtilis)[29],命名为Bacillus subtilis Z-5。

图2 基于16S rDNA序列分析的菌株Z-5的系统发育树
Fig.2 Phylogenetic tree of strain Z-5 based on 16S rDNA sequence analysis
2.3 B.subtilis Z-5产果胶酶的酶学性质
2.3.1 发酵时间对B.Z-5的生长和产果胶酶活性的影响
如图3所示,0~6 h时,菌体量增加缓慢,为停滞期;6~12 h时,菌株繁殖迅速,为对数期;12~72 h时,菌株缓慢增长直到维持稳定;72~96 h,菌体量开始下降,菌株开始走向死亡。然而菌株Z-5的产酶水平随着时间的增加逐渐上升,当菌株稳定期结束时,果胶酶活力达到最大值;78~96 h时,随着菌体量的减少,产酶能力开始降低。所以此菌株的最佳发酵时间是72 h,后续实验都采用72 h作为发酵时间。
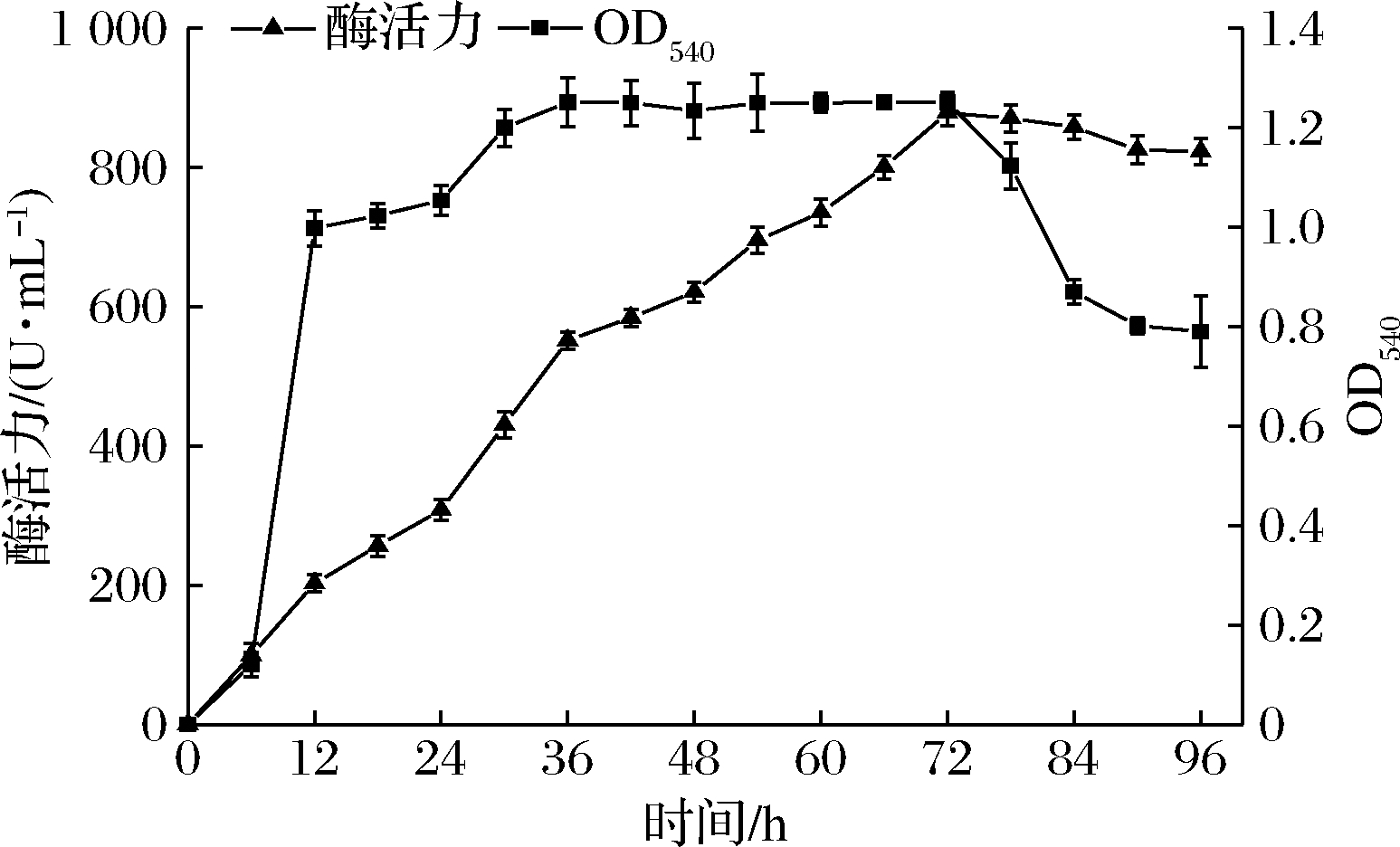
图3 菌株Z-5的生长曲线和产果胶酶曲线
Fig.3 Growth curve and pectinase-producing curve of strain Z-5
2.3.2 B.subtilis Z-5果胶酶的最适作用温度
如图4所示,当温度在20~60 ℃时,果胶酶活力在不断升高;当温度在60~80 ℃时,酶活力在急剧下降,所以果胶酶的最适作用温度在60 ℃。55~60 ℃时,酶活力基本保持在最大酶活力的80%及以上;60~70 ℃时,酶活力基本保持在最大酶活力的50%以上,说明此酶有一定的耐高温的能力。
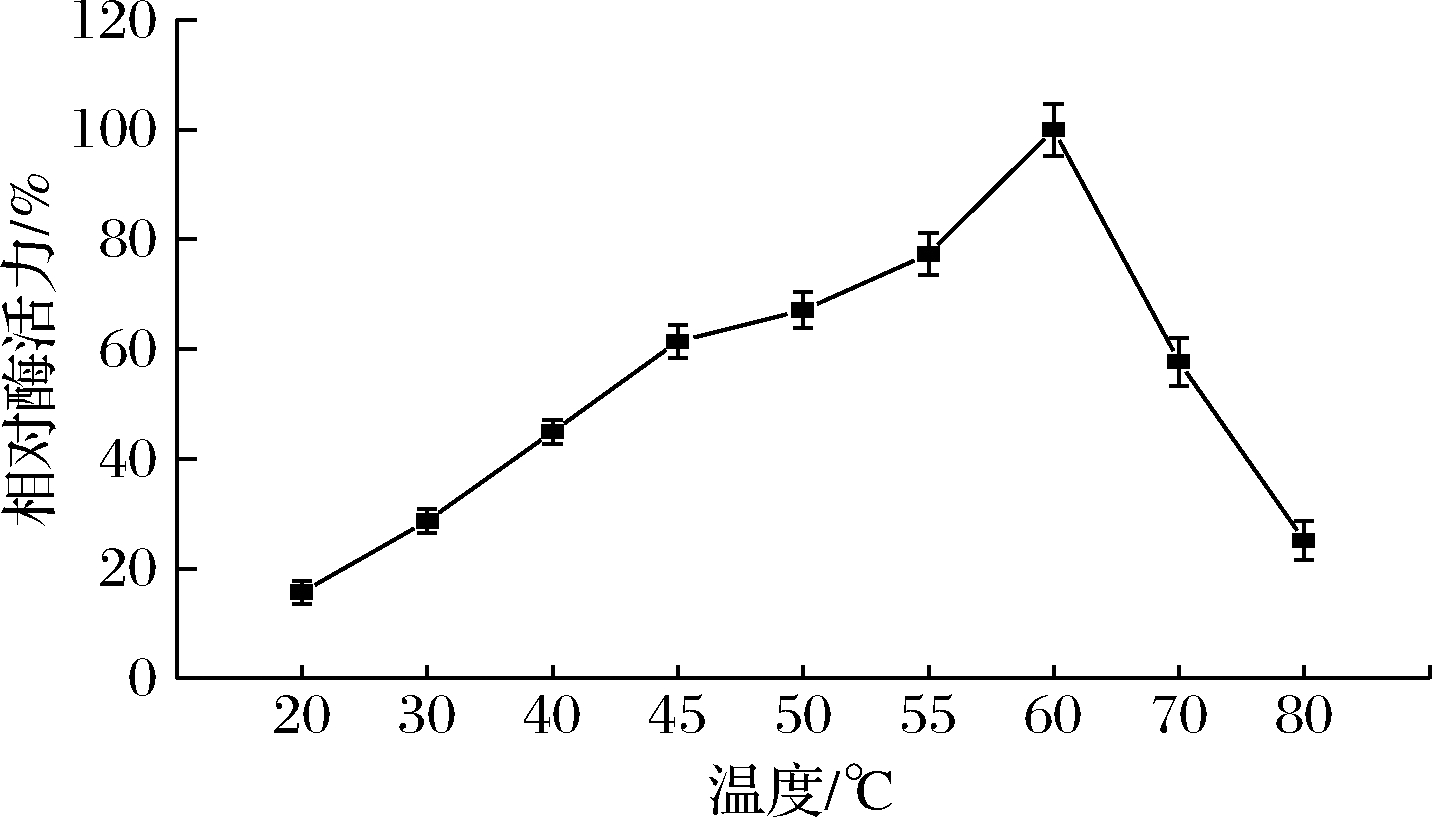
图4 温度对果胶酶活性的影响
Fig.4 Effect of temperature on pectinase activity
2.3.3 B.subtilis Z-5果胶酶的热稳定性
如图5所示,当温度在70~80 ℃时,处理30 min,酶活力急剧下降,仅为20%左右,但当继续处理1.5 h之后,酶活力变化不大,这与2.3.2中得到的此酶有一定的耐高温能力相符合。60 ℃处理30 min之后,酶活力保持在50%左右,继续处理30 min后,酶活力下降到40%左右,再处理1 h之后,酶活力大约保持在20%。当温度在40~50 ℃处理2 h后,酶活力仍可以维持在60%左右,说明该酶的热稳定性良好。
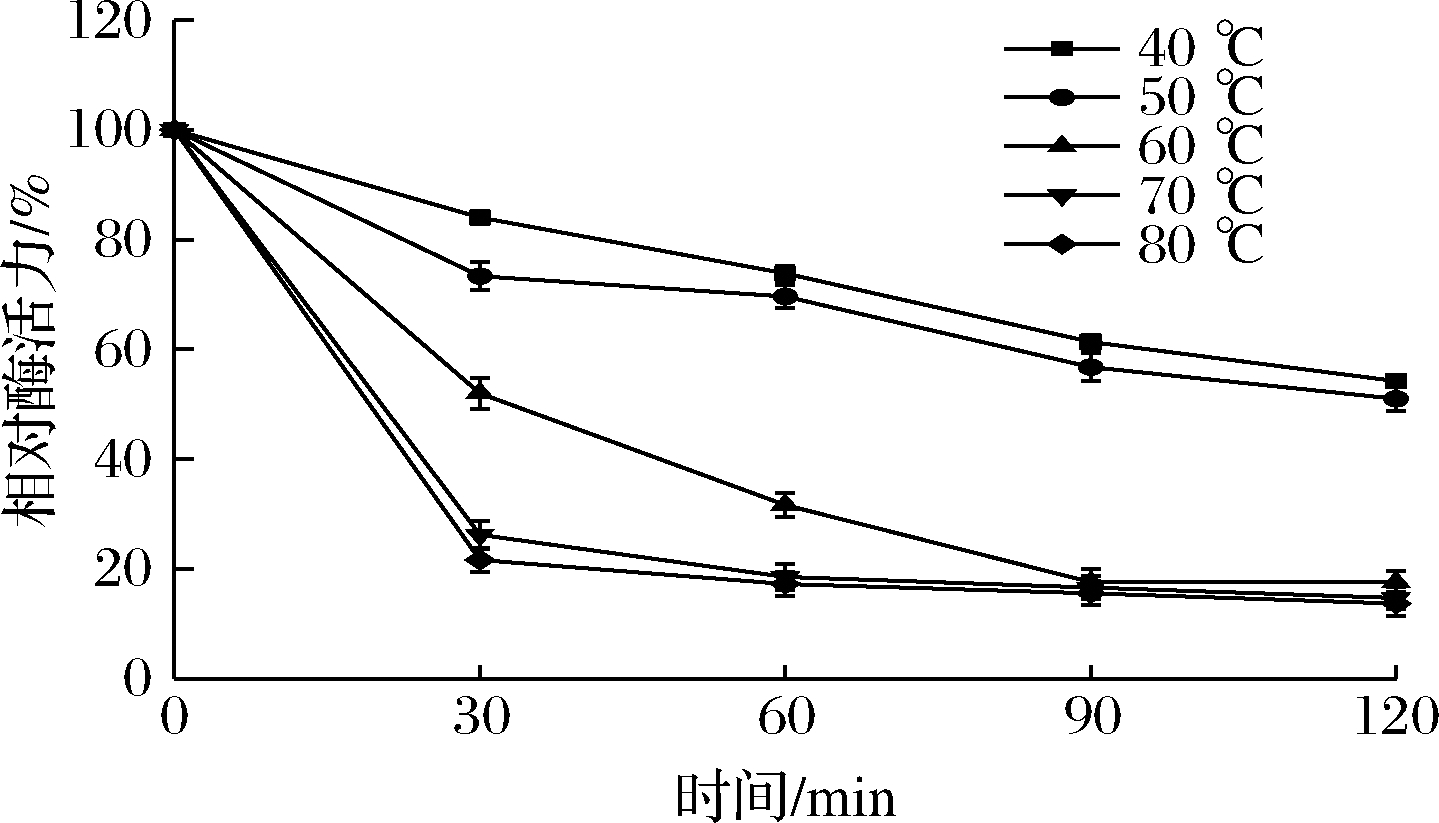
图5 温度对果胶酶稳定性的影响
Fig.5 Effect of temperature on pectinase stability
2.3.4 Bacillus subtilis Z-5果胶酶的最适pH
如图6所示,pH为3.0~4.0时,酶活力很低;当pH>4.0时,酶活力急剧上升;当pH 5.0时,酶活力达到了最大值的80%左右;当pH 6.0时,酶活力上升至最大值,但当pH继续增大,酶活力开始下降,所以该酶的最适pH是6.0,属于弱酸性酶。

图6 pH对果胶酶活性的影响
Fig.6 Effect of pH on pectinase activity
2.3.5 B.subtilis Z-5果胶酶的pH稳定性
如图7所示,当pH为5.0~9.0时,处理2 h之后,相对酶活力仍可以保持在50%及以上,说明此酶pH稳定性较好,且pH 6.0处理2 h之后,相对酶活力最为稳定,可保留在80%左右。当pH升至6.0~9.0时,此酶pH稳定性逐渐降低,但仍可以保持在60%及以上。pH 10.0处理2 h后,此酶活力急剧下降,但仍维持在40%左右,所以此果胶酶具有良好的pH稳定性。

图7 pH对果胶酶稳定性的影响
Fig.7 Effect of pH on pectinase stability
2.3.6 金属离子对B.subtilis Z-5果胶酶活力的影响
如图8所示,Ba2+、Fe2+、Ca2+、Cu2+处理组相对酶活力显著大于对照组,说明Ba2+、Fe2+、Ca2+、Cu2+对该果胶酶有显著的促进作用,其中Ba2+、Cu2+极显著,Ba2+将相对酶活力提高了51%,处理组相对酶活力约为对照组的1.93倍。可能是由于Ba2+、Cu2+与酶结合后改变了酶的空间结构,稳定了酶蛋白活性的构像,进而提高酶活力。Zn2+、Mn2+处理组相对酶活力显著小于对照组,可能是由于Zn2+和Mn2+破坏了该酶的三维构象,使其更易发生失活的现象,所以Zn2+、Mn2+对该果胶酶有显著的抑制作用,其中Zn2+抑制了大约40%的果胶酶活力,Mn2+抑制效果其次。而Mg2+、Hg2+处理组相对酶活力与对照组相比无明显差异,所以Mg2+、Hg2+对该果胶酶活力无明显影响。

图8 金属离子对果胶酶活性的影响
Fig.8 Effect of metal ions on pectinase activity
注:*表示与对照组有显著差异(P<0.05),**表示与对照组有极显著差异(P<0.01)。
3 讨论
本实验通过以果胶为唯一碳源,采用透明圈法和DNS法从上海海洋大学橘园的土壤中分离出1株产果胶酶的菌株Z-5,经过形态学特征、生理生化试验和16S rDNA测序分析,并将其序列通过BLAST比对,建立系统发育树,最后鉴定得出该菌株属于枯草芽孢杆菌(Bacillus subtilis),命名为Bacillus subtilis Z-5。对该菌株进行了初步酶学性质探究,此菌株产果胶酶最适反应温度为60 ℃,最适反应pH为6.0。连续发酵72 h后,该酶的酶活力到达最高值,为(879±2.733) U/mL。此外,该酶经过50 ℃处理2 h后仍可维持60%的酶活力;在70~80 ℃处理2 h后,没有完全失活,仍保留了18%左右的酶活力,表明该酶有一定的耐高温能力。在pH为3.0~10.0处理2 h,其酶活力均可维持40%左右,表明该果胶酶的酸碱耐受性较好,在后续研究中通过酶活力的提高及酶性质深入研究,B.subtilis Z-5有望展现其食品工业应用的一定潜力。
[1] YU P, XU C C.Production optimization, purification and characterization of a heat-tolerant acidic pectinase from Bacillus sp.ZJ1407[J].International Journal of Biological Macromolecules, 2018, 108:972-980.
[2] 李健军, 许昭, 王仲孚, 等.果胶多糖可控性降解及果胶寡糖的制备[J].西北药学杂志, 2017, 32(6):726-730.
LI J J, XU Z, WANG Z F, et al.Controlled degradation of citrus pectin polysaccharide and preparation of oligogalacturonic acids from pectic acid[J].Northwest Pharmaceutical Journal, 2017, 32(6):726-730.
[3] GUAN Y, WANG D H, LV C, et al.Archives of microbiology:Screening of pectinase-producing bacteria from citrus peel and characterization of a recombinant pectate lyase with applied potential[J].Archives of Microbiology, 2020, 202(5):1 005-1 013.
[4] JAYANI R S, SAXENA S, GUPTA R.Microbial pectinolytic enzymes:A review[J].Process Biochemistry, 2005, 40(9):2 931-2 944.
[5] 昝梦华. 黑曲霉SH312-26-19产聚半乳糖醛酸酶的分离纯化及鉴定[D].太谷:山西农业大学, 2016.
ZAN M H.Isolation, purification and identification of polygalacturonase from Aspergillus niger SH312-26-19[D].Taigu:Shanxi Agricultural University, 2016.
[6] 张占军, 王富花, 曾晓雄.果胶酶在食品工业中应用的研究进展[J].中国酿造, 2010, 29(10):4-6.
ZHANG Z J, WANG F H, ZENG X X.Research progress of pectinase application in food industry[J].China Brewing, 2010, 29(10):4-6.
[7] 池彬彬, 倪莹, 陈慧英, 等.1株产果胶酶中度嗜盐菌(Aspergillus aculeatus GLUT-01)的鉴定及产酶条件优化[J].江苏农业科学, 2022, 50(2):239-246.
CHI B B, NI Y, CHEN H Y, et al.Identification and optimization of enzyme production conditions of a strain of Aspergillus aculeatus GLUT-01[J].Jiangsu Agricultural Sciences, 2022, 50(2):239-246.
[8] ALQAHTANI Y S, MORE S S, KEERTHANA R, et al.Production and purification of pectinase from Bacillus subtilis 15A-B92 and its biotechnological applications[J].Molecules (Basel, Switzerland), 2022, 27(13):4195.
[9] 于平, 王欣馨, 任倩, 等.产碱性果胶酶菌株的筛选和鉴定及其酶学性质[J].中国食品学报, 2018, 18(9):288-296.
YU P, WANG X X, REN Q, et al.Screening and identification of a high-yield alkaline pectinase strain and enzymatic properties of alkaline pectinase[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(9):288-296.
[10] AMIN F, BHATTI H N, BILAL M.Recent advances in the production strategies of microbial pectinases:A review[J].International Journal of Biological Macromolecules, 2019, 122:1 017-1 026.
[11] 张翠. 根霉液体发酵生产碱性果胶酶及应用研究[D].无锡:江南大学, 2009.
ZHANG C.Alkaline pectinase production by submerged fermentation with Rhizopus sp.and its application[D].Wuxi:Jiangnan University, 2009.
[12] KOHLI P, GUPTA R.Alkaline pectinases:A review[J].Biocatalysis and Agricultural Biotechnology, 2015, 4(3):279-285.
[13] 徐君飞, 张居作.微生物果胶酶新进展[J].怀化学院学报, 2013, 32(11):34-36.
XU J F, ZHANG J Z.Recent research advance in microbial pectinases[J].Journal of Huaihua University, 2013, 32(11):34-36.
[14] SHRESTHA S, RAHMAN M S, QIN W S.New insights in pectinase production development and industrial applications[J].Applied Microbiology and Biotechnology, 2021, 105(24):9 069-9 087.
[15] 卢晓华.果胶酶产生菌的筛选鉴定、产酶条件优化及酶学性质研究[D].武汉:湖北工业大学, 2016.
LU X H.Screen and identification of pectinase-production strains, optimization of pectinase-production conditions and study on characterization of pectinase[D].Wuhan:Hubei University of Technology, 2016.
[16] 蓝丽精. 高产果胶酶菌株的筛选、发酵条件优化及其应用的研究[D].金华:浙江师范大学, 2012.
LAN L J.Studies on screening, fermentation optimizing and applications of a high pectinase-producting strain[D].Jinhua:Zhejiang Normal University, 2012.
[17] 于振林, 刘亚琼, 王颉, 等.白地霉红枣果胶酶的分离纯化及酶学性质的研究[J].食品科技, 2017, 42(10):253-261.
YU Z L, LIU Y Q, WANG J, et al.Purification and enzymatic properties of jujube pectinase from Galactomyces candidum[J].Food Science and Technology, 2017, 42(10):253-261.
[18] 罗雯, 徐珂盼, 王怡, 等.果胶酶生产菌株的筛选、发酵优化及其酶学性质研究[J].食品科技, 2022, 47(4):6-13.
LUO W, XU K P, WANG Y, et al.Screening, fermentation optimization and enzymatic properties of pectinase-producing strains[J].Food Science and Technology, 2022, 47(4):6-13.
[19] 吕秀红. 产耐热型酸性果胶酶菌株的筛选、发酵条件优化及酶学性质的研究[D].杭州:浙江工商大学, 2016.
LYU X H.Study on screening of heat-tolerant acidic-pectinase producing strain, fermenta-tion optimizing and the enzymatic properties[D].Hangzhou:Zhejiang Gongshang University, 2016.
[20] REHMAN H U, SIDDIQUE N N, AMAN A, et al.Morphological and molecular based identification of pectinase producing Bacillus licheniformis from rotten vegetable[J].Journal of Genetic Engineering and Biotechnology, 2015, 13(2):139-144.
[21] 王小敏, 吴文龙, 闾连飞, 等.分光光度计法测定果胶酶活力的方法研究[J].食品工业科技, 2007, 28(5):227-229.
WANG X M, WU W L, LV L F, et al.Study on the spectrophotometric analysis of peclinase activity[J].Science and Technology of Food Industry, 2007, 28(5):227-229.
[22] 张飞, 岳田利, 费坚, 等.果胶酶活力的测定方法研究[J].西北农业学报, 2004, 13(4):134-137.
ZHANG F, YUE T L, FEI J, et al.Research on measuring method of PG activity[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2004, 13(4):134-137.
[23] 顾燕松. 纺织生物助剂果胶酶酶活的测定方法[J].纺织科学研究, 2002, 13(3):29-35.
GU Y S.Determination of pectinase activity of textile biological assistant[J].Textile Science Research, 2002, 13(3):29-35.
[24] 谷艺明. 果胶酶高产菌株的筛选、发酵优化及酶学性质的研究[D].常州:常州大学, 2021.
GU Y M.Screening of high-yielding pectinase strains, optimization of fermentation and study of enzymatic properties[D].Changzhou:Changzhou University, 2021.
[25] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.
DONG X Z, CAI M Y.Identification Manual of Common Bacterial Systems[M].Beijing:Science Press, 2001.
[26] GARRITY G, BELL J, LILBURN T.Bergey’s Manual of Systematic Bacteriology[M].(Ninth Edition) New York:Springer, 2004.
[27] 陈成, 宁喜斌.产β-内酰胺酶菌株的筛选、鉴定及酶学性质初步研究[J].食品与发酵工业, 2019, 45(24):77-83.
CHEN C, NING X B.Screening, identification and analysis of β-lactamase-producing strains[J].Food and Fermentation Industries, 2019, 45(24):77-83.
[28] 华宝玉, 林娟, 严芬, 等.产果胶酶菌株的筛选鉴定及其产酶条件的研究[J].福州大学学报(自然科学版), 2012, 40(3):412-417.
HUA B Y, LIN J, YAN F, et al.Screening and identification of pectinase-producing strains and studying on the enzyme-producing conditions[J].Journal of Fuzhou University (Natural Science Edition), 2012, 40(3):412-417.
[29] 毛多斌, 黄晓玉, 周利峰, 等.枯草芽孢杆菌分离鉴定及其对烟叶化学成分和吸味品质的影响[J].烟草科技, 2022, 55(8):10-19.
MAO D B, HUANG X Y, ZHOU L F, et al.Isolation and identification of a Bacillus subtilis strain and its effects on chemical composition and sensory quality of tobacco leaves[J].Tobacco Science &Technology, 2022, 55(8):10-19.