玫瑰花是一种药食同源的花卉,又名刺玫花、笔头玫瑰、穿心玫瑰等,是多种蔷薇科蔷薇属花卉的通称[1],玫瑰多酚是玫瑰花中的主要化学成分,具有抗氧化[2]、降血糖[3-5]、抗衰老[6]等多种功效,在延长食品保质期[7]、制作抗老化化妆品[8]、治疗糖尿病[9]、心脑血管[10]疾病中具有良好的效果,但是多酚分子结构中含有大量的羟基,所以其化学性质不太稳定,而且非常容易受外界环境的影响,在光照下很容易失活,在空气中也容易被氧化成醌类物质。因此,提高玫瑰多酚的稳定性对其高效利用非常重要。
壳聚糖(chitosan, CS)是一种几丁质衍生物聚阳离子多糖,由在虾、蟹、蚕、藻类等物质中广泛存在的甲壳素经脱乙酰化所得[11]。CS是一种具有生物相容性、可生物降解且几乎无毒的聚合物,具有抗菌、乳化、膳食、螯合、抗氧化、絮凝和益生元等特性,是一种用途广泛的材料,可用于农业、食品工业、化妆品业等多个行业中[12],并可与其他材料结合,在生物医学应用方面具有巨大的潜力。有研究表明,壳聚糖用作药物载体具有提高药物稳定性的优点[13],因此,将CS和生物活性物质进行复合来提高其生物活性具有良好的应用前景。研究表明把多酚类物质和CS结合在一起制备成多酚-壳聚糖纳米粒[14],既可以增强多酚的生物利用率和稳定性,还可以提高其应用价值。
本研究采用离子交联法将其包埋在壳聚糖中制备成玫瑰多酚-壳聚糖纳米粒,通过单因素试验优化制备条件,以DPPH自由基和ABTS阳离子自由基为评价指标,考察玫瑰多酚和玫瑰多酚-壳聚糖纳米粒在光照、空气中的稳定性,通过小鼠实验考察其抗氧化和降血糖效果。研究结果将为玫瑰花的高值化利用提供新思路,在食品、药品、化妆品等行业领域具有广泛的应用前景。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
玫瑰多酚(纯度为88.5%),实验室提取;SPF级成年雄性昆明小鼠,体重(23±1) g,中国食品药品检定研究院,许可证号:SCXK(京)2017-0005。
1.1.2 实验试剂
CS、三聚磷酸钠(tripolyphosphate, TPP)(均为食品级),河南万邦实业有限公司;链脲佐菌素(USP级),上海源叶生物科技有限公司;DPPH、ABTS(均为分析纯),上海麦克林生化科技有限公司;小鼠胰岛素ELISA检测试剂盒,上海酶联生物科技有限公司;超氧化物歧化酶(superoxide dismutase, SOD)检测试剂盒、丙二醛(malondialdehyde, MDA)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒,南京建成生物工程研究所。
1.1.3 主要仪器设备
ME204型分析天平、PHSJ-4A型pH计,梅特勒-托利多仪器有限公司;DF-Ⅱ型集热式磁力加热搅拌器,江苏金怡仪器科技有限公司;QL-902型旋涡混合器,海门市其林贝尔仪器有限公司;Centrifuge 5804R型台式高速离心机,德国Eppendorf;FD-1型真空冷冻干燥机,上海田枫实业有限公司;580型鱼跃血糖仪,江苏鱼跃医疗设备股份有限公司。
1.2 实验方法
1.2.1 玫瑰多酚壳聚糖纳米粒的制备
参考PATEL等[15]的方法并稍作修改,将壳聚糖完全溶解于体积分数为1%乙酸溶液中制备成2 mg/mL壳聚糖乙酸溶液,再将4 mL壳聚糖乙酸溶液与1 mL 2 mg/mL的玫瑰多酚溶液混合均匀;边搅拌边缓慢滴加2 mL 2 mg/mL的TPP溶液,滴加完成后,在磁力搅拌器上继续搅拌20 min。最后,8 000 r/min离心10 min,所得沉淀即为玫瑰多酚-壳聚糖纳米粒。
1.2.2 包封率和多酚负载率的测定
玫瑰多酚-壳聚糖纳米粒包封率和玫瑰多酚负载率的计算如公式(1)、公式(2)所示:
包封率![]()
(1)
负载率=ρ0×V×包封率/m
(2)
式中:ρ0,多酚在溶液中的初始质量浓度,mg/mL;ρf,多酚在溶液中的最终残留质量浓度,mg/mL;V,溶液的体积,mL;m,玫瑰多酚-壳聚糖纳米粒的干重,g。
1.2.3 玫瑰多酚-壳聚糖纳米粒制备条件的优化
参考蒋悦颖[16]的方法并稍作修改,以包封率为评价指标进行单因素试验,考察CS与TPP质量比(1∶1、2∶1、3∶1、4∶1、5∶1)、乙酸体积分数(0.1%、0.5%、1%、1.5%、2%)、多酚质量浓度(1、2、3、4、5 mg/mL)对玫瑰多酚-壳聚糖纳米粒包封率的影响。
1.2.4 玫瑰多酚-壳聚糖纳米粒稳定性的测定
1.2.4.1 光照对多酚-壳聚糖纳米粒稳定性的影响
参考杜洁等[17]的方法并稍作修改,将玫瑰多酚和玫瑰多酚-壳聚糖纳米粒置于光照培养箱中,于光照强度3 500 LX条件下放置15 d,在第1、3、5、10、15天取样检测其DPPH自由基和ABTS阳离子自由基的清除率,探究光照对多酚和多酚-壳聚糖纳米粒稳定性的影响。
1.2.4.2 室温下放置时间对多酚-壳聚糖纳米粒稳定性的影响
参考杜洁等[17]的方法并稍作修改,将玫瑰多酚和玫瑰多酚-壳聚糖纳米粒在室温下避光放置15 d,于第1、3、5、10、15天取样检测其DPPH自由基和ABTS阳离子自由基的清除率,探究室温下放置时间对玫瑰多酚和玫瑰多酚-壳聚糖纳米粒稳定性的影响。
1.2.5 玫瑰多酚-壳聚糖纳米粒小鼠灌胃实验
1.2.5.1 动物模型的制备
所有操作均按照《天津科技大学实验动物管理办法》进行,伦理批准编号:TUST2021010。昆明小鼠适应性喂养7 d后,随机将小鼠分为正常对照组和高血糖造模组,造模组小鼠腹腔注射40 mg/kg 链脲佐菌素(streptozocin, STZ)溶液;正常对照组小鼠腹腔注射相同量的柠檬酸缓冲液。注射5 d后,全部小鼠禁食不禁水8 h,采用血糖仪以断尾采血法,测定空腹血糖值(fasting blood glucose, FBG),并测定体重(bodyweight, BW),血糖值高于11.1 mmol/L的小鼠为高血糖模型小鼠[18]。
1.2.5.2 分组及给药
本实验由48只高血糖小鼠和8只正常小鼠组成。将48只高血糖小鼠,随机分为6组,每组8只,正常组由8只正常小鼠组成,共7组小鼠。按照以下剂量每天灌胃1次,连续灌胃28 d,其中玫瑰多酚壳聚糖纳米粒的剂量按照其玫瑰多酚负载率计算。
正常对照组(N)及模型对照组(M):灌胃蒸馏水;阳性对照组(P):灌胃盐酸二甲双胍,160 mg/kg;玫瑰多酚低剂量组(RL):灌胃玫瑰多酚,80 mg/kg;玫瑰多酚高剂量组(RH):灌胃玫瑰多酚,160 mg/kg;玫瑰多酚-壳聚糖纳米粒低剂量组(KL):灌胃玫瑰多酚-壳聚糖纳米粒,376 mg/kg;玫瑰多酚-壳聚糖纳米粒高剂量组(KH):灌胃玫瑰多酚-壳聚糖纳米粒,753 mg/kg。
1.2.5.3 小鼠体重的测定
将各组小鼠禁食不禁水8 h,记录第0、7、14、21、28天小鼠BW的变化情况,比较各组间体重的差异。
1.2.5.4 空腹血糖测定
将各组小鼠禁食不禁水8 h,采用断尾取血的方法,在第0、7、14、21、28天测定小鼠空腹血糖值。
1.2.5.5 口服糖耐量试验
参考ZHU等[19]的方法,在动物实验结束前一周进行口服糖耐量试验,首先检测初始空腹血糖值(0 min)。然后所有小鼠灌胃2 g/kg葡萄糖溶液,分别检测0.5、1和2 h的血糖值。血糖曲线下面积(area under curve, AUC)的计算如公式(3)所示:
AUC=0.5×(G0h+G0.5h)×0.5+0.5×(G0.5h+G1h)×0.5+0.5×(G1h+G2h)×1
(3)
式中:G0h、G0.5h、G1h、G2h分别表示0、0.5、1、2h的血糖值。
1.2.5.6 血液指标的测定
灌胃28 d后,小鼠去眼球取血,将血液置于室温下自然凝固10~20 min,再置于离心机中3 000 r/min离心15 min,取上清液,冷冻保存,用于各血清指标的测定。采用指定试剂盒对SOD、GSH-Px、MDA等进行测定;采用ELISA试剂盒进行空腹胰岛素(insulin releasing test, INS)含量的测定。
1.2.6 数据分析
采用SPSS 26.0统计软件进行差异显著分析,Origin 2018软件作图。
2 结果与分析
2.1 玫瑰多酚-壳聚糖纳米粒的制备
2.1.1 CS与TPP质量比对玫瑰多酚-壳聚糖纳米粒包封率的影响
由图1可见,当CS与TPP的质量比从1∶1到5∶1时,其包封率先增大后减小。随着CS与TPP质量比的升高,玫瑰多酚-壳聚糖纳米粒的包封率首先呈上升趋势。当CS与TPP质量比为2∶1时,玫瑰多酚-壳聚糖纳米粒的包封率达到最大,为91.79%,而后再增加CS与TPP的质量比,制备玫瑰多酚-壳聚糖纳米粒的过程中包封率反而下降,这可能是由于CS和TPP的质量比会影响到两者之间的静电作用力[20],导致包封率有所变化。因此选取CS与TPP质量比为2∶1进行后续实验。

图1 CS与TPP质量比对玫瑰多酚-壳聚糖
纳米粒包封率的影响
Fig.1 Effect of mass ratio of CS and TPP on encapsulation efficiency of rose polyphenol-chitosan particle
2.1.2 乙酸体积分数对玫瑰多酚-壳聚糖纳米粒包封率的影响
由图2可见,随着乙酸体积分数的增加,玫瑰多酚-壳聚糖纳米粒的包封率逐步下降。可能是因为随着乙酸体积分数的逐步增大,溶液的pH逐步减小,pH越低溶液中产生的H+就越多,会抑制壳聚糖中NH4+的电离,不易与三聚磷酸钠发生交联反应,玫瑰多酚-壳聚糖纳米粒的包封率下降,并且若溶液酸性过强也会影响玫瑰多酚的活性。但是,当乙酸体积分数为0.1%时,在制备过程中,会产生絮状、不均匀的杂质。综合考虑,选择乙酸体积分数为0.5%进行后续实验的优化。

图2 乙酸体积分数对玫瑰多酚-壳聚糖纳米粒包封率的影响
Fig.2 Effect of volume fraction of acetic acid on encapsulation efficiency of rose polyphenol-chitosan particles
2.1.3 玫瑰多酚质量浓度对玫瑰多酚-壳聚糖纳米粒包封率的影响
由图3可见,当多酚质量浓度在1~5 mg/mL内,随着多酚浓度的增加,包封率逐步下降,并且趋于平缓,这可能是由于壳聚糖和三聚磷酸钠的用量有限制,包封率的大小受到纳米粒形成量的影响[11]。

图3 多酚质量浓度对玫瑰多酚-壳聚糖纳米粒包封率的影响
Fig.3 Effect of polyphenol concentration on encapsulation efficiency of rose polyphenol-chitosan particles
玫瑰多酚质量浓度过高会导致壳聚糖不易和三聚磷酸钠发生交联反应,使纳米粒形成量减少,进而使包封率下降。当多酚的质量浓度增大到3 mg/mL时,包封率为94.85%,再增加多酚浓度并不会对多酚-壳聚糖纳米粒的包封率有较大影响,并且此时玫瑰多酚的负载率为21.26%,高于多酚质量浓度为1和2 mg/mL时的负载率。为获得较高的玫瑰多酚负载率,同时也为避免多酚量使用过多造成实验材料的浪费,因此选择最适的多酚质量浓度为3 mg/mL。
2.2 玫瑰多酚-壳聚糖纳米粒稳定性的测定
2.2.1 光照对多酚以及多酚-壳聚糖纳米粒稳定性的影响
由图4可知,随着光照时间的增加,DPPH自由基和ABTS阳离子自由基清除率都逐步下降,多酚-壳聚糖纳米粒和多酚稳定性下降。光照15 d时,多酚-壳聚糖纳米粒和多酚对DPPH自由基的清除率与第1天相比较,分别下降了10.20%和18.74%,对ABTS阳离子自由基的清除率与第1天相比,分别下降了7.53%和21.43%。由于光照会引起多酚类成分发生部分氧化或降解,导致DPPH自由基和ABTS阳离子自由基的清除率下降,因此从自由基清除率下降值大小可以看出多酚-壳聚糖纳米粒的稳定性优于玫瑰多酚的稳定性。

a-DPPH自由基;b-ABTS阳离子自由基
图4 光照对多酚以及多酚-壳聚糖纳米粒稳定性的影响
Fig.4 Effect of light on stability of polyphenols and polyphenol-chitosan particles
2.2.2 室温下放置时间对多酚以及多酚-壳聚糖纳米粒稳定性的影响
由图5能够看出,随着室温下放置时间的延长,DPPH自由基和ABTS阳离子自由基的清除率都逐步下降,多酚-壳聚糖纳米粒和多酚稳定性下降。第15天时,多酚-壳聚糖纳米粒和多酚对DPPH自由基的清除率与第1天相比较,分别下降了8.25%和14.39%,对ABTS阳离子自由基的清除率与第1天相比,分别下降了8.66%和18.78%。由于多酚类化合物暴露在空气中会被氧化成醌类物质,导致DPPH自由基和ABTS阳离子自由基的清除率下降,因此从自由基清除率下降值大小可以看出多酚-壳聚糖纳米粒的稳定性优于玫瑰多酚的稳定性。

a-DPPH自由基;b-ABTS阳离子自由基
图5 室温下放置时间对多酚-壳聚糖纳米粒和多酚稳定性的影响
Fig.5 Effect of storage time on the stability of polyphenol-chitosan particles and polyphenols at room temperature
2.3 玫瑰多酚-壳聚糖纳米粒小鼠体内抗氧化、降血糖活性
2.3.1 小鼠体重变化情况
体重下降是糖尿病的典型特征,由表1可知,给药初始阶段与N相比,各组小鼠体重都极显著低于N(P<0.01),表明动物模型制备成功。灌胃28 d后,M组小鼠体重持续下降,其余组小鼠体重均有所上升,表明灌胃玫瑰多酚和玫瑰多酚-壳聚糖纳米粒对小鼠高血糖症状有所缓解,与M相比,RH、CH组小鼠体重显著高于M(P<0.01)。通过体重增加率可知,给药组小鼠体重增加率均极显著高于M(P<0.01),给药高剂量组的效果较好,给药组剂量越大小鼠体重率越大,而且CH与P无显著性差异(P>0.05),表明高剂量玫瑰多酚-壳聚糖纳米粒效果与二甲双胍效果相当。说明玫瑰多酚-壳聚糖纳米粒可以延缓小鼠体重下降,对高血糖产生的症状有缓解作用。
表1 小鼠体重变化情况
Table 1 Changes in body weight of mice

组别第0天体重/g第28天体重/g体重增加率/%N42.04±1.1847.33±1.80##&&12.58±0.016##&&M35.48±2.11∗∗35.34±2.15∗∗&&-0.39±0.003∗∗&&P37.64±1.57∗∗39.43±1.89∗∗##4.76±0.012∗∗##RL34.54±2.93∗∗34.94±2.22∗∗&1.21±0.002∗∗##&&RH37.66±2.82∗∗38.90±2.40∗∗##3.29±0.008∗∗##&CL36.21±3.82∗∗37.28±3.18∗∗2.95±0.011∗∗##&&CH39.00±3.41∗∗40.68±2.29∗∗##4.31±0.028∗∗##
注:**,与N比较P<0.01;##,与M比较P<0.01;&,&&,与P比较P<0.05、P<0.01(下同)。
2.3.2 空腹血糖值变化情况
由表2可知,给药初始阶段,与N相比较,注射STZ后的各组小鼠空腹血糖值明显升高(P<0.01)。给药28 d后,N血糖值基本保持不变,M血糖值上升,与M组相比,各给药组空腹血糖值均极显著下降(P<0.01)。从血糖下降率可知,给药组小鼠血糖下降率均极显著高于M(P<0.01),表明玫瑰多酚和玫瑰多酚-壳聚糖纳米粒具有降低血糖的效果。而且给药高剂量组的效果较好,给药组剂量越大小鼠血糖下降率越大,而且CH与P无显著性差异(P>0.05),表明高剂量玫瑰多酚-壳聚糖纳米粒效果与二甲双胍效果相当。玫瑰多酚-壳聚糖纳米粒具有降低小鼠的血糖的作用,可能是由于其可以修复机体对血糖的调节能力。
表2 小鼠空腹血糖值变化情况
Table 2 Changes of fasting blood glucose in mice
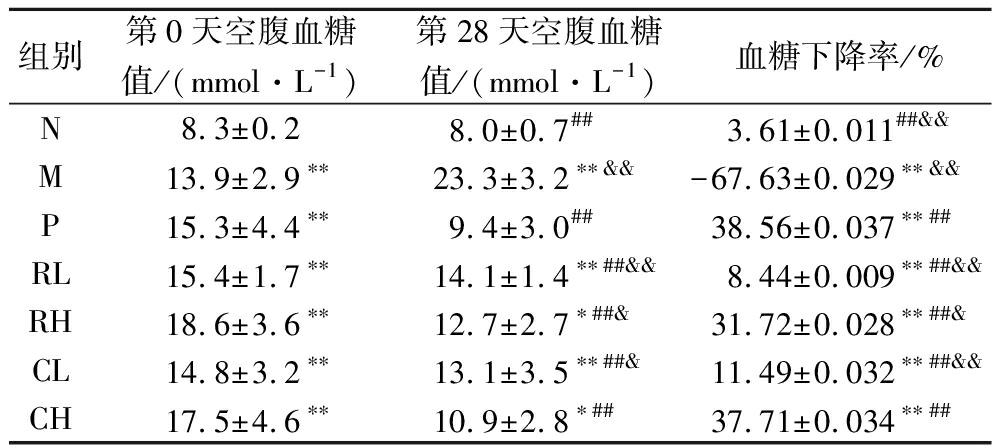
组别第0天空腹血糖值/(mmol·L-1)第28天空腹血糖值/(mmol·L-1)血糖下降率/%N8.3±0.28.0±0.7## 3.61±0.011##&&M13.9±2.9∗∗23.3±3.2∗∗&&-67.63±0.029∗∗&&P15.3±4.4∗∗9.4±3.0##38.56±0.037∗∗##RL15.4±1.7∗∗14.1±1.4∗∗##&&8.44±0.009∗∗##&&RH18.6±3.6∗∗12.7±2.7∗##&31.72±0.028∗∗##&CL14.8±3.2∗∗13.1±3.5∗∗##&11.49±0.032∗∗##&&CH17.5±4.6∗∗10.9±2.8∗##37.71±0.034∗∗##
注:*,与N比较P<0.05。
2.3.3 口服糖耐量实验
口服葡萄糖耐量(oral glucose tolerance test, OGTT)实验是一种葡萄糖负荷实验,在糖尿病的确诊实验中被广泛使用,用来评价胰岛β细胞的功能和机体调节血糖的能力[21]。在给药第21天进行口服葡萄糖耐量实验。由图6可以看出,正常对照组(N)的小鼠灌胃葡萄糖溶液后,血糖变化平稳,并且2 h后能够恢复至正常水平。模型对照组(M)灌胃葡萄糖后,血糖快速上升至32.1 mmol/L,并且2 h后,不能恢复到初始血糖值,对葡萄糖的耐受能力很差。

图6 口服葡萄糖耐量
Fig.6 Oral glucose tolerance
由图7各组小鼠口服糖耐量的AUC可知,高血糖小鼠葡萄糖的AUC极显著高于N(P<0.01),这表明高血糖小鼠对葡萄糖耐受量较小。与M相比较,其余给药组均能够极显著降低AUC(P<0.01),表明玫瑰多酚及玫瑰多酚壳聚糖纳米粒能够提高高血糖小鼠的葡萄糖耐受能力。口服葡萄糖耐量的实验结果与空腹血糖的结果相一致,可能是因为玫瑰多酚-壳聚糖纳米粒可以保护胰岛β细胞提高对葡萄糖的刺激耐量,控制α-淀粉酶或α-葡萄糖苷酶活力,并通过激活机制信号通路提高葡萄糖刺激水平由此达到降血糖的作用[22]。

图7 口服糖耐量曲线下面积
Fig.7 Area under oral glucose tolerance curve
2.3.4 小鼠血清胰岛素含量
胰岛素是由胰腺中的胰岛β细胞分泌的一种具备降血糖作用的蛋白质激素。而高血糖患者则因为对胰腺功能出现了损害,机体有代偿性地分泌过多胰岛素来维护血糖的平衡,从而形成高胰岛素血症[18]。从图8可以看出,与N相比,M血清胰岛素含量极显著高于N(P<0.01),与M相比,RH、CH血清胰岛素含量极显著低于M(P<0.01),CH、RL显著低于M(P<0.05),表明玫瑰多酚和玫瑰多酚-壳聚糖纳米粒能够明显降低血清胰岛素含量,可能是由于玫瑰多酚-壳聚糖纳米粒可以通过缓解高胰岛素血症来降低高血糖小鼠的血糖值。

图8 胰岛素含量
Fig.8 Insulin content
2.3.5 小鼠血清SOD活力变化
SOD是酶促防御系统的主要成分,可以防止机体抗氧化能力被破坏,它活性的高低能够反映去除对人体健康有害的超氧自由基的能力。而高血糖则会导致SOD的抗氧化能力减弱,从而产生抗氧化压力,破坏细胞内部结构,损害细胞功能[23]。从图9中可发现,M的SOD数值明显小于N的SOD数值(P<0.01),表明小鼠受到一定程度的氧化损伤。与M相比,RL组和CL组SOD值显著高于M(P<0.05),RH组和CH组SOD值极显著高于M(P<0.01),表明玫瑰多酚和玫瑰多酚-壳聚糖纳米粒具有提高SOD活力、清除氧自由基、保护细胞免受损伤等作用,能够增强小鼠机体的抗氧化能力,其效果与剂量呈正相关。

图9 各组小鼠血清SOD活力变化
Fig.9 Changes of SOD activity in serum of mice in each group
2.3.6 小鼠血清GSH-Px活力变化
GSH-Px能够催化谷胱甘肽(glutathione, GSH)变为氧化型谷胱甘肽(glutathione oxidized, GSSG),促使H2O2分解,测定其活力大小能够反映机体抗氧化能力大小。由图10可知,与M相比,RL、RH、CL、CH组的GSH-Px活力极显著高于M组(P<0.01),与N组相比,M组的GSH-Px活力极显著低于N组(P<0.01),CH组的GSH-Px活力极显著高于N组(P<0.01)。表明玫瑰多酚和玫瑰多酚-壳聚糖纳米粒具有抗氧化能力,其效果与剂量呈正相关。可能是由于多酚类化合物自身发生化学反应,出现带电荷基团,与H2O2反应,从而降低机体被氧化的风险,增强机体的抗氧化能力。也可能是因为多酚在机体内刺激了GSH-Px的生成,使体内GSH-Px含量增加,催化GSH变为GSSG,促使H2O2分解,抗氧化活性增加。

图10 各组小鼠血清GSH-Px活力变化
Fig.10 Changes of serum GSH-Px activity in each group
2.3.7 小鼠血清MDA含量变化
MDA是超氧自由基破坏细胞后引起膜系统发生脂质过氧化作用的产物[24],MDA的含量越高,表明细胞膜脂质过氧化水平越高,细胞膜受到的损害越严重,通过测定小鼠血清中MDA含量可以判断其衰老程度。由图11可知,与M相比,RL、RH、CL、CH组的MDA含量极显著低于M组(P<0.01),与N相比,M的MDA含量极显著高于N(P<0.01),RH和CH的MDA含量极显著低于N(P<0.01)。表明玫瑰多酚和玫瑰多酚-壳聚糖纳米粒可以降低小鼠血清MDA含量,可能是由于其降低了脂质的过氧化,并且其抗氧化能力与剂量呈正相关。

图11 各组小鼠血清MDA含量变化
Fig.11 Changes of MDA content in serum of mice in each group
3 结论
本文将玫瑰多酚和性质稳定的壳聚糖结合在一起制备了玫瑰多酚-壳聚糖颗粒,以包封率为评价指标,将制备条件进行单因素试验,优化后的条件为:CS与TPP质量比为2∶1,乙酸体积分数为0.5%,玫瑰多酚浓度为3 mg/g,包封率为94.85%,较优化前提高了4.43%,此时,玫瑰多酚负载率为21.26%。其包封率和负载率较DING等[25]制备的原花青素-壳聚糖纳米粒包封率高了77.37%,负载率高了13.77%。以DPPH和ABTS阳离子自由基清除能力为评价指标,进行稳定性实验,结果表明玫瑰多酚-壳聚糖纳米粒比玫瑰多酚更稳定,同时也表明玫瑰多酚-壳聚糖纳米粒具有体外抗氧化性。选取雄性昆明小鼠,注射链脲佐菌素制备高血糖小鼠模型,灌胃一定剂量玫瑰多酚、玫瑰多酚-壳聚糖颗粒以及降糖药28 d。实验结果表明玫瑰多酚壳聚糖纳米粒能减缓小鼠体重下降,降低空腹血糖值,提高口服葡萄糖耐量,降低血清中胰岛素水平;使小鼠体内SOD、GSH-Px活力增加,MDA减少,表明玫瑰多酚-壳聚糖纳米粒具有体内抗氧化和降血糖活性。为玫瑰多酚的综合利用提供了新思路,在食品、制药和化妆品领域具有广泛的应用前景。
[1] 孙迪, 付本宁, 张志国.玫瑰花生物活性物质的研究进展[J].食品工业, 2016, 37(7):243-245.
SUN D, FU B N, ZHANG Z G.Research progress of roses bioactive substances[J].The Food Industry, 2016, 37(7):243-245.
[2] YAN N N, ZHANG H F, ZHANG Z H, et al.The extraction, antioxidant and against β-amyloid induced toxicity of polyphenols from Alsophila spinulosa leaves[J].Arabian Journal of Chemistry, 2022, 15(4):103707.
[3] SHARMA P, AHMAD HAJAM Y, KUMAR R, et al.Complementary and alternative medicine for the treatment of diabetes and associated complications:A review on therapeutic role of polyphenols[J].Phytomedicine Plus, 2022, 2(1):100188.
[4] VISVANATHAN R, WILLIAMSON G.Effect of citrus fruit and juice consumption on risk of developing type 2 diabetes:Evidence on polyphenols from epidemiological and intervention studies[J].Trends in Food Science &Technology, 2021, 115:133-146.
[5] WESTFALL S, LOMIS N, PRAKASH S.A polyphenol-rich prebiotic in combination with a novel probiotic formulation alleviates markers of obesity and diabetes in Drosophila[J].Journal of Functional Foods, 2018, 48:374-386.
[6] MALEKI M, KHELGHATI N, ALEMI F, et al.Stabilization of telomere by the antioxidant property of polyphenols:Anti-aging potential[J].Life Sciences, 2020, 259:118341.
[7] BAI X Y, YANG Z M, SHEN W J, et al.Polyphenol treatment delays the browning of litchi pericarps and promotes the total antioxidant capacity of litchi fruit[J].Scientia Horticulturae, 2022, 291:110563.
[8] PINTO D, DE LA LUZ C DIZ-GURREA M, GARCIA J, et al.From soil to cosmetic industry:Validation of a new cosmetic ingredient extracted from chestnut shells[J].Sustainable Materials and Technologies, 2021, 29:e00309.
DIZ-GURREA M, GARCIA J, et al.From soil to cosmetic industry:Validation of a new cosmetic ingredient extracted from chestnut shells[J].Sustainable Materials and Technologies, 2021, 29:e00309.
[9] YUAN Y, XIANG J L, ZHENG B L, et al.Diversity of phenolics including hydroxycinnamic acid amide derivatives, phenolic acids contribute to antioxidant properties of proso millet[J].LWT, 2022, 154:112611.
[10] HERRERA-BALANDRANO D D, CHAI Z, BETA T, et al.Blueberry anthocyanins:An updated review on approaches to enhancing their bioavailability[J].Trends in Food Science &Technology, 2021, 118:808-821.
[11] FERREIRA L M B, DOS SANTOS A M, BONI F I, et al.Design of chitosan-based particle systems:A review of the physicochemical foundations for tailored properties[J].Carbohydrate Polymers, 2020, 250:116968.
[12] WEISSPFLOG J, VEHLOW D, MÜLLER M, et al.Characterization of chitosan with different degree of deacetylation and equal viscosity in dissolved and solid state-Insights by various complimentary methods[J].International Journal of Biological Macromolecules, 2021, 171:242-261.
[13] RIAZ A, LAGNIKA C, ABDIN M, et al.Preparation and characterization of chitosan/gelatin-based active food packaging films containing apple peel nanoparticles[J].Journal of Polymers and the Environment, 2020, 28(2):411-420.
[14] MALEKI G, WOLTERING E J, MOZAFARI M R.Applications of chitosan-based carrier as an encapsulating agent in food industry[J].Trends in Food Science &Technology, 2022, 120:88-99.
[15] PATEL M, PATEL N V, PATEL T B.Design and development of rilpivirine nanoparticle containing chitosan using ionic gelation method for HIV infections[J].International Journal of Pharmacy and Pharmaceutical Sciences, 2020:113-118.
[16] 蒋悦颖. 多酚-壳聚糖微粒的制备及性能研究[D].天津:河北工业大学, 2017.
JIANG Y Y.Preparation and properties of polyphenols-chitosan microparticles[D].Tianjin:Hebei University of Technology, 2017.
[17] 杜洁, 李伟, 戴伟杰, 等.桉叶提取物贮藏稳定性探究[J].桉树科技, 2021, 38(2):48-52.
DU J, LI W, DAI W J, et al.Study on storage stability of Eucalyptus leaf extract[J].Eucalypt Science &Technology, 2021, 38(2):48-52.
[18] WEI Q, LI J, ZHAN Y S, et al.Enhancement of glucose homeostasis through the PI3K/Akt signaling pathway by dietary with Agaricus blazei Murrill in STZ-induced diabetic rats[J].Food Science &Nutrition, 2020, 8(2):1 104-1 114.
[19] ZHU X A, OUYANG W, LAN Y Q, et al.Anti-hyperglycemic and liver protective effects of flavonoids from Psidium guajava L.(guava) leaf in diabetic mice[J].Food Bioscience, 2020, 35:100574.
[20] ANANDHAKUMAR S, KRISHNAMOORTHY G, RAMKUMAR K M, et al.Preparation of collagen peptide functionalized chitosan nanoparticles by ionic gelation method:An effective carrier system for encapsulation and release of doxorubicin for cancer drug delivery[J].Materials Science and Engineering:C, 2017, 70:378-385.
[21] LIU S W, YU J C, FU M F, et al.Regulatory effects of hawthorn polyphenols on hyperglycemic, inflammatory, insulin resistance responses, and alleviation of aortic injury in type 2 diabetic rats[J].Food Research International, 2021, 142:110239.
[22] LIU Y L, ZHANG X N, ZHAN L H, et al.LC-Q-TOF-MS characterization of polyphenols from white bayberry fruit and its antidiabetic effect in KK-ay mice[J].ACS Omega, 2020, 5(28):17 839-17 849.
[23] SALMA B, JANHAVI P, MUTHAIAH S, et al.Ameliorative efficacy of the Cassia auriculata root against high-fat-diet + STZ-induced type-2 diabetes in C57BL/6 mice[J].ACS Omega, 2020, 6(1):492-504.
[24] ARISA W,PRANEE R,KANOGWAN S.Inhibitory effects of high molecular weight chitosan coating on ‘Hom Thong’ banana fruit softening[J].Food Packaging and Shelf Life, 2021, 29:100731.
[25] DING Z D, MO M M, ZHANG K, et al.Preparation, characterization and biological activity of proanthocyanidin-chitosan nanoparticles[J].International Journal of Biological Macromolecules, 2021, 188:43-51.