由牛乳引发的过敏反应,严重威胁人类的健康,也给牛乳加工产业的发展带来了较大的安全隐患[1-2]。β-乳球蛋白(β-lactoglobulin,β-Lg)被公认为是主要的乳清蛋白过敏原,82%的牛乳过敏患者对其过敏[3-4]。β-Lg分子质量为18.3 kDa左右,由162个氨基酸组成[4],分子表面具有多个过敏表位,大约有90%过敏患者的血清能够识别41~60、103~124和149~162等表位[2,5],如何有效破坏这些过敏表位,以消减β-Lg的致敏性是目前研究的热点和难点。
近年来,极端条件(高强度超声波、超高压等)、热处理、蛋白质修饰等方法被广泛用于处理牛乳过敏蛋白以降低其致敏性[6],而基于各种物理和化学技术来破坏过敏蛋白的过敏表位从而达到脱敏的目的是目前行之有效的脱敏技术。L-精氨酸(L-argnine, L-Arg)、L-赖氨酸(L-lysine,L-Lys)和L-组氨酸(L-histidine,L-His)等碱性氨基酸是蛋白质的基本单位,自身带有电荷,具有不同的结构和功能,与蛋白质相互作用能改善蛋白质的结构和功能特性[7],如添加碱性氨基酸可以改变肌球蛋白的微环境进而提高其溶解度和缓解热诱导聚集行为[8-9];L-Lys和L-His可使肌球蛋白的二级结构改变,从α-螺旋逐渐转变为β-折叠、β-转角和无规则卷曲[10]。采用超声波与L-Lys/L-Arg联合处理可促进肌球蛋白结构展开、提高肌球蛋白的溶解度和表面疏水性[11];CHEN等[12]研究发现,加入L-Arg和L-Lys会有效抑制猪排蛋白质在冷藏过程中的氧化。这些研究显示L-Arg、L-Lys和L-His能与蛋白质相互作用,改善其结构和功能特性,但L-Arg、L-Lys和L-His等外源性碱性氨基酸对牛乳过敏原蛋白质结构和致敏性的影响鲜有报道。
本研究以牛乳β-Lg为研究对象,在低盐环境中选用L-Arg、L-Lys、L-His单独或混合处理β-Lg,利用电泳、圆二色谱、光谱等方法分析处理前后β-Lg结构的变化;采用ABTS阳离子自由基清除能力检测处理前后β-Lg的抗氧化活性;运用酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)和KU812细胞实验研究碱性氨基酸对β-Lg致敏性的影响。
1 材料与方法
1.1 材料与试剂
β-Lg、抗β-Lg人血清、山羊抗人IgE-辣根过氧化物酶,美国Sigma公司。Rb a β-lactoglobulin,北京博奥森生物技术有限公司。山羊抗兔IgG-辣根过氧化物酶,赛国生物科技有限责任公司。8-苯胺基-1-萘磺(8-anilino-1-naphthalenesulfonic acid,ANS),上海麦克林生化科技有限公司。邻苯二甲醛(o-phthaldialdehyde,OPA),上海阿拉丁生化科技股份有限公司。L-Arg、L-Lys、L-His,北京索莱宝科技有限公司。其他所需试剂均为分析纯。牛乳过敏患者血清,美国Plasma Lab International公司。
过敏患者血清,所有血清样本在使用前于-88 ℃下保存。牛乳过敏患者信息如表1所示。
表1 牛乳过敏患者信息
Table 1 The information of milk allergic patients
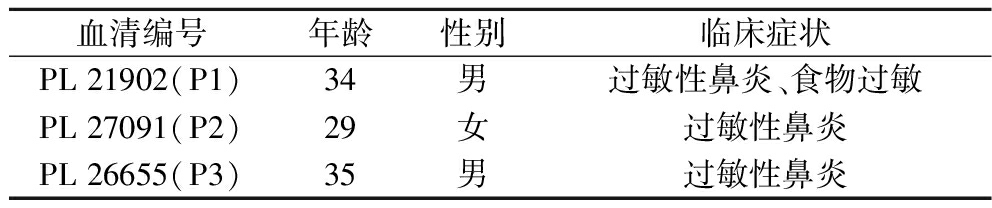
血清编号年龄性别临床症状PL 21902(P1)34男过敏性鼻炎、食物过敏PL 27091(P2)29女过敏性鼻炎PL 26655(P3)35男过敏性鼻炎
1.2 仪器与设备
U-2910型紫外可见分光光度计、F-4500荧光光谱仪,日本日立公司;Mini-Protean电泳仪,美国Bio-Rad公司;SMP 500-16295-OBVN 酶标仪,美国Molecular Devices公司;JASCO spectropolarimeter model J-1500圆二色谱仪,日本分光公司。
1.3 实验方法
1.3.1 样品制备
配制2.0 mg/mL的β-Lg 溶液(溶于0.1 mol/L NaCl溶液),分别加入0.6 mmol/L的L-Arg、L-Lys和L-His以及混合氨基酸(0.2 mmol/L L-Arg、0.2 mmol/L L-Lys和0.2 mmol/L L-His),混合充分搅拌均匀。各取25 mL溶液,置于90 ℃水浴加热30 min。加热结束后,测定溶液pH值。未处理、加入L-Arg、L-Lys、L-His、混合氨基酸的β-Lg分别命名为N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg。
1.3.2 聚丙烯酰氨凝胶电泳
参照LIU等[13]的方法,对N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg进行SDS-PAGE分析。
1.3.3 圆二色谱
设定圆二色谱仪的扫描波长范围190~260 nm,扫描速率50 nm/min,测定0.2 mg/mL N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg二级结构的变化。
1.3.4 紫外吸收强度
设定紫外可见分光光度计的扫描速度1 200 nm/min,扫描范围200~400 nm,测定1.0 mg/mL N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的紫外吸收强度。
1.3.5 内源荧光强度
设定荧光光谱仪的激发波长为280 nm,扫描速度为1 200 nm/min,测定1.0 mg/mL N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的内源荧光强度。
1.3.6 表面疏水性
参照 KATO等[14]的方法,采用ANS荧光探针法测定N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的表面疏水性。
1.3.7 ABTS阳离子自由基清除能力
参照ZHANG等[15]的方法并做适当调整,测定N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的ABTS阳离子自由基清除能力。取50 μL N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg样品溶液,加入150 μL ABTS阳离子自由基溶液,室温反应30 min后,734 nm处测定吸光值。ABTS阳离子自由基清除能力按公式(1)计算:
清除率![]()
(1)
式中:As,50 μL样品溶液和150 μL ABTS阳离子自由基溶液的吸光值;Ac,以蒸馏水代替样品的反应体系的吸光值。
1.3.8 IgE/IgG结合能力的测定
参照朱一丹等[16]的方法,稍作修改。采用ELISA法测定N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg与的IgE/IgG结合能力;牛乳过敏患者P1、P2和P3血清F77特异性IgE水平分别为16.4、4.38、11.6 kU/L。
1.3.9 KU812 细胞脱颗粒
参照APPEL等[17]的方法,适当修改。采用含有10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基,放置在37 ℃ 5% CO2培养箱中培养KU812细胞。将1×106个细胞接种于24孔板培养24 h,加入20 μL牛奶过敏患者血清,24 h后,分别加入50 μg N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg激发4 h。用PBS缓冲液代替样品处理的细胞为阴性对照。采用ELISA法分析组胺(histamine,HIS)和白介素-6(interleukin-6,IL-6)的释放情况,并按照生产商的说明进行分析。
1.4 数据分析
采用SPSS 24.0软件对实验数据进行单因素方差分析,数据采用Origin 2019软件作图,所有实验均重复3次。
2 结果与分析
2.1 十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
图1为N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的SDS-PAGE图。N-β-Lg存在2个条带,分别为单体和二聚体,N-β-Lg分子由162个氨基酸组成,分子质量为18.4 kDa,通常以二聚体形式存在[3]。与N-β-Lg相比,R-β-Lg和K-β-Lg的条带没有发生明显变化,说明L-Arg和L-Lys对β-Lg的分子质量无显著影响,而H-β-Lg和M-β-Lg的二聚体逐渐解聚,这可能是由于L-His含有带正电荷的咪唑基,与蛋白质上带电残基进行静电相互作用[7],破坏β-Lg分子内和分子间原有的交联键,导致其二聚体解离。

图1 N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的SDS-PAGE图
Fig.1 SDS-PAGE diagram of N-β-Lg,R-β-Lg,K-β-Lg,H-β-Lg, and M-β-Lg
2.2 二级结构
N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg二级结构含量的变化如表2所示。N-β-Lg的二级结构中α-螺旋占8.83%,β-折叠占35.19%,β-转角占22.35%,无规则卷曲占33.57%。与N-β-Lg相比,R-β-Lg、K-β-Lg和M-β-Lg的α-螺旋、β-折叠、β-转角和无规则卷曲含量均有变化,但无显著差异(P>0.05),而H-β-Lg的β-折叠含量显著增加(P<0.05),无规则卷曲含量明显减少(P<0.05)。L-Arg、L-Lys、L-His和混合碱性氨基酸处理后,能影响β-Lg的二级结构,其中L-His处理可使其二级结构发生显著变化(P<0.05),无规则卷曲结构向β-折叠转变。这是因为L-His在中性pH下带正电荷,可以与β-Lg分子上的带电残基结合,可能破坏蛋白分子间原有的离子键,咪唑环存在着亲核中心可能扰乱氢键,进而改变β-Lg的二级结构[18-19]。
表2 N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的二级结构
Table 2 Secondary structure content of N-β-Lg,R-β-Lg,K-β-Lg,H-β-Lg and M-β-Lg

样品α-螺旋/%β-折叠/%β-转角/%无规则卷曲/%N-β-Lg8.83±0.57a35.19±0.27b22.35±0.15a33.57±0.35abR-β-Lg8.88±3.41a37.35±0.88b22.69±5.73a31.07±4.32abK-β-Lg6.78±1.41a32.95±0.97b23.36±1.01a36.88±0.60aH-β-Lg8.68±4.54a46.39±6.41a22.91±2.40a21.96±5.37cM-β-Lg10.05±1.73a38.48±3.35b26.10±2.25a25.37±3.90bc
注:不同小写字母表示差异显著(P<0.05,n=3)(下同)。
2.3 紫外吸收强度
如图2所示,N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg在280 nm处均有最大吸收峰,相比于N-β-Lg,R-β-Lg、K-β-Lg和M-β-Lg的紫外吸收强度增大,说明L-Arg、L-Lys和混合碱性氨基酸使β-Lg分子上的色氨酸、酪氨酸等芳香族氨基酸残基暴露在表面,增加其紫外吸收强度,而H-β-Lg的紫外吸收强度呈相反的趋势,说明L-Arg、L-Lys和L-His能显著影响β-Lg的构象结构,影响顺序依次为L-His、L-Lys、L-Arg。这可能是因为碱性氨基酸可以作为阳离子表面活性剂,并与带相反电荷的蛋白质相互作用,引发蛋白质的展开和疏水区域的暴露[20]。
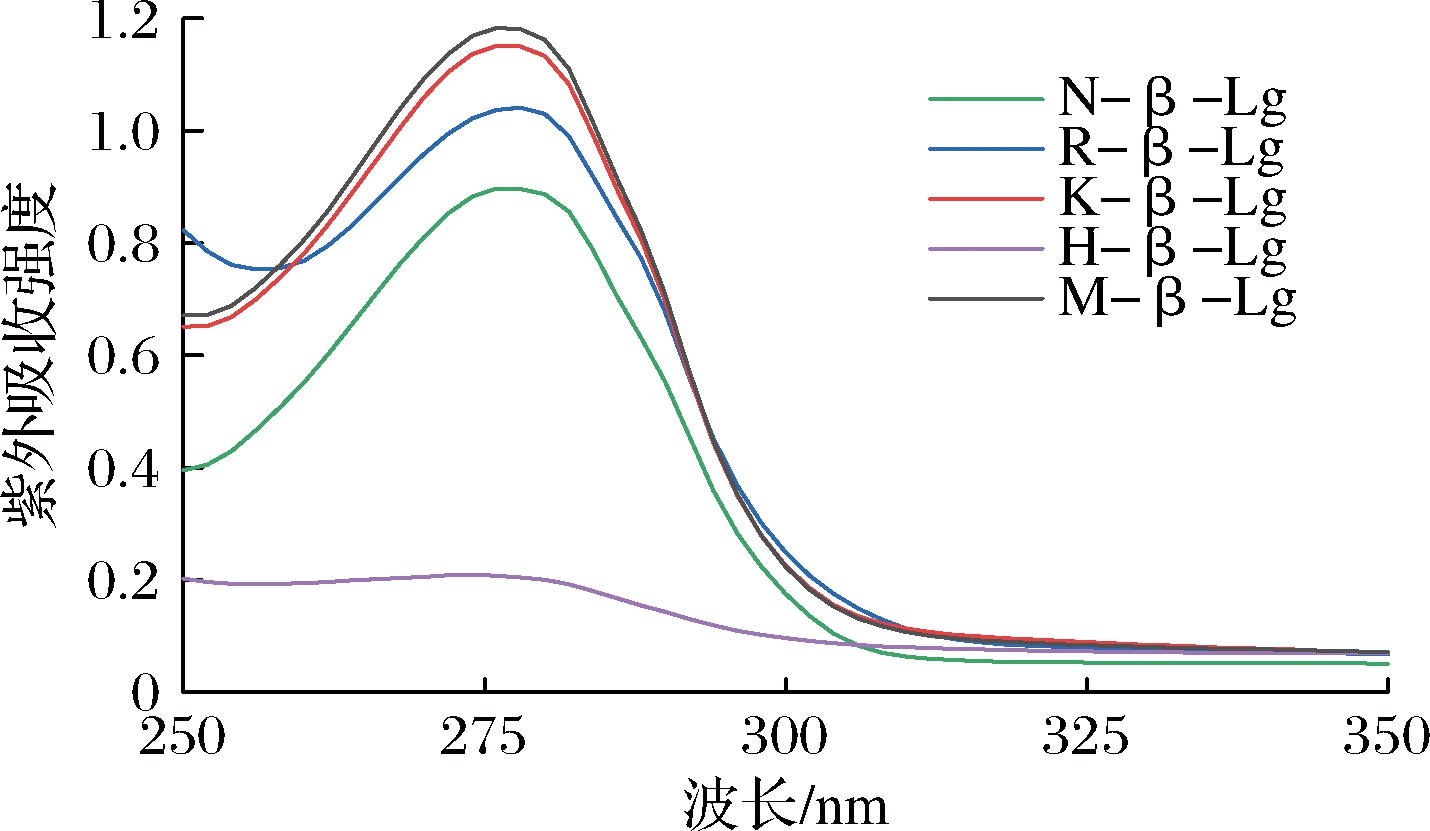
图2 N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的紫外-可见吸收光谱
Fig.2 UV-Vis absorption spectra of N-β-Lg,R-β-Lg,K-β-Lg,H-β-Lg, and M-β-Lg
2.4 内源荧光强度
由图3可知,相比于N-β-Lg的内源荧光强度,R-β-Lg、M-β-Lg和K-β-Lg的荧光强度逐渐升高,且发生红移,说明L-Arg、L-Lys和3种混合碱性氨基酸处理β-Lg后会使色氨酸残基暴露,引起内源荧光强度的增强[21],改变其三级结构。而H-β-Lg的荧光强度呈相反的趋势,可能是由于L-His中的带正电荷基团,与β-Lg分子上的带电基团相互作用,暴露在β-Lg表面的色氨酸被掩埋到分子内部,降低其H-β-Lg的荧光强度,这与紫外吸收强度的结果一致,说明L-Arg、L-Lys和L-His能显著地改变β-Lg的构象结构。

图3 N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的内源荧光强度
Fig.3 Fluorescence emission spectra of N-β-Lg,R-β-Lg,K-β-Lg,H-β-Lg, and M-β-Lg
2.5 表面疏水性
β-Lg中疏水基团的相互作用力可以维持其三级结构,表面疏水性(H0)可作为研究β-Lg三级结构变化的重要依据[22]。如图4所示,相比于N-β-Lg的H0,R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的H0均显著降低(P<0.05),说明β-Lg经过L-Arg、L-Lys、L-His和3种混合碱性氨基酸处理,一些疏水区域被碱性氨基酸基化覆盖或ANS会与L-Arg和L-Lys结合[10, 23],导致β-Lg的H0显著降低,顺序为R-β-Lg>K-β-Lg>H-β-Lg。该结果与紫外吸收强度的结果一致,表明碱性氨基酸能够显著改变β-Lg的三级结构。

图4 N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的表面疏水性
Fig.4 The surface hydrophobicity of N-β-Lg,R-β-Lg,K-β-Lg,H-β-Lg, and M-β-Lg
2.6 ABTS阳离子清除活性
N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的ABTS阳离子清除能力如图5所示。N-β-Lg的IC50为39.675 mg/mL,加入碱性氨基酸处理后,其IC50均减少,H-β-Lg、R-β-Lg、M-β-Lg和K-β-Lg的IC50分别为3.267、2.692、1.941、1.774 mg/mL。表明外源性碱性氨基酸的加入会增加β-Lg的抗氧化性能,这主要是由于碱性氨基酸与β-Lg相互作用,促使氨基酸上的带电荷基团与金属离子螯合形成复合物,增强β-Lg的抗氧化能力[9, 12]。

图5 N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的ABTS阳离子自由基清除能力
Fig.5 The ABTS radical cation ability of N-β-Lg,R-β-Lg,K-β-Lg,H-β-Lg, and M-β-Lg
2.7 IgE/IgG结合能力
以IgE/IgG结合能力为指标,采用ELISA法评估N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的致敏性,结果如图6所示。

a-IgE;b-IgG
图6 N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的IgE/IgG结合能力
Fig.6 IgE and IgG binding capacity of N-β-Lg,R-β-Lg,K-β-Lg,H-β-Lg and M-β-Lg
与N-β-Lg的IgE结合能力相比,碱性氨基酸处理均能降低β-Lg的IgE结合能力,这可能是碱性氨基酸通过自身所带电荷与β-Lg的带电残基相互作用[9],改变β-Lg的构象表位,降低其与IgE的结合能力。K-β-Lg、H-β-Lg的IgE/IgG结合能力呈现显著下降的趋势(P<0.05),其中H-β-Lg的降低程度最大,这可能是因为L-His能够使β-Lg解聚,改变其构象结构[24-25]。N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg的IgG结合能力(IC50值)分别为18.080、13.617、60.895、103.422、16.242 μg/mL,与IgE结合能力呈相同的趋势。结果表明,外源性碱性氨基酸能降低β-Lg的 IgE/IgG结合能力。
2.8 KU812细胞致敏性
嗜碱性粒细胞的脱颗粒率是决定过敏原免疫反应性的关键因素。经不同碱性氨基酸处理的β-Lg对KU812细胞的IL-6和HIS释放情况如图7所示。

a-IL-6;b-HIS
图7 N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg对KU812细胞释放IL-6和HIS能力的影响
Fig.7 Effects of N-β-Lg, R-β-Lg, K-β-Lg, H-β-Lg and M-β-Lg on release of IL-6 and HIS in KU812 cells
与对照组相比,N-β-Lg、R-β-Lg、K-β-Lg、H-β-Lg、M-β-Lg的IL-6和HIS含量均显著增加(P<0.05),说明β-Lg的加入能引起KU812过敏相关细胞因子的释放。与N-β-Lg 相比,R-β-Lg、K-β-Lg、H-β-Lg和M-β-Lg处理的KU812细胞的IL-6和HIS含量呈不同程度的降低,其中K-β-Lg和H-β-Lg的IL-6和HIS含量呈显著降低(P<0.05)。表明K-β-Lg和H-β-Lg能诱导嗜碱性粒细胞脱颗粒的程度较弱,减弱了效应细胞分泌IL-6和HIS的能力,这与IgE/IgG结合能力的结果一致。结果表明,碱性氨基酸处理的β-Lg能降低KU812细胞IL-6和HIS的分泌,降低其过敏反应。
3 结论
本研究选用L-Arg、L-Lys和L-His对β-Lg进行处理,结果表明L-Arg、L-Lys和L-His均能不同程度地增加其抗氧化性和降低其致敏性,反映在ABTS阳离子自由基清除能力的增加,IgE/IgG结合能力的降低以及KU812细胞中HIS和IL-6含量的减少。β-Lg的过敏表位是引起其过敏反应的结构基础,β-Lg致敏性的降低与其过敏表位的破坏有关,经不同物理和化学方法处理后,会引起β-Lg线性过敏表位或构象过敏表位的变化。L-Arg、L-Lys和L-His处理β-Lg后,改变其二级结构、紫外吸收、内源荧光强度和表面疏水性,这些结构的变化会破坏β-Lg的构象过敏表位,从而降低其致敏性。L-His处理的β-Lg具有最低的致敏性,主要是由于L-His能使β-Lg二聚体发生解聚,破坏其构象结构,显著降低其致敏性。综上所述,外源碱性氨基酸可能通过静电相互作用构成空间位阻,与蛋白质侧链某些基团形成氢键以及影响蛋白质疏水基团的分布的方式来破坏β-Lg的构象过敏表位,降低IgE/IgG的结合能力和KU812细胞的过敏反应,但致敏性的评价并不全面,需要更多的实验(如动物和临床实验等)来验证其效果。
[1] 罗永康, 沈小琴, 李朝慧.牛乳蛋白过敏原改性的研究[J].中国乳品工业, 2005, 33(10):4-8.
LUO Y K, SHEN X Q, LI Z H.Studies on modification of milk protein allergens[J].China Dairy Industry, 2005, 33(10):4-8.
[2] 陆玉琴. 牛乳β-乳球蛋白与植物多酚共价结合对蛋白致敏性影响的初步研究[D].深圳:深圳大学, 2019.
LU Y Q.Preliminary investigation of the allergenic capacity of β-lactoglobulin by covalent conjugation with plant polyphenols[D].Shenzhen:Shenzhen University, 2019.
[3] 蔡小虎, 李欣, 陈红兵, 等.牛乳中主要过敏原的分离纯化研究进展[J].食品科学, 2010, 31(23):429-433.
CAI X H, LI X, CHEN H B, et al.Research progress in isolation and purification of major allergens from bovine milk[J].Food Science, 2010, 31(23):429-433.
[4] YANG W H, TU Z C, WANG H, et al.The mechanism of reduced IgG/IgE-binding of β-lactoglobulin by pulsed electric field pretreatment combined with glycation revealed by ECD/FTICR-MS[J].Food &Function, 2018, 9(1):417-425.
[5] 宋伟, 段翠翠, 吕剑光, 等.酶解作用对牛乳β-lg抗原性影响的研究[J].食品工业科技, 2012, 33(2):393-395.
SONG W, DUAN C C, LV J G, et al.Enzymatic hydrolysis effects on milk β-lactoglobulin antigenicity[J].Science and Technology of Food Industry, 2012, 33(2):393-395.
[6] 杨晶晶, 赵树静, 刘甜甜, 等.降低牛乳中β-乳球蛋白致敏性方法的研究进展[J].中国油脂, 2021, 46(5):75-81.
YANG J J, ZHAO S J, LIU T T, et al.Progress in methods of reducing the allergenicity of β-lactoglobulin in cow’s milk[J].China Oils and Fats, 2021, 46(5):75-81.
[7] 曹云刚, 梁光灿, 张鑫, 等.碱性氨基酸调控肌原纤维蛋白加工性能及肉品品质研究进展[J/OL].食品科学, 2021:1-12.(2021-11-09).https://kns.cnki.net/kcms/detail/11.2206.TS.20211108.2048.010.html.
CAO Y G, LIANG G C, ZHANG X, et al.Regulation of functional properties of myofibrillar protein and quality of meat products by basic amino acid:A comprehensive review[J/OL].Food Science, 2021:1-12.(2021-11-09).https://kns.cnki.net/kcms/detail/11.2206.TS.20211108.2048.010.html.
[8] LI S Y, ZHENG Y D, XU P, et al.L-Lysine and L-arginine inhibit myosin aggregation and interact with acidic amino acid residues of myosin:The role in increasing myosin solubility[J].Food Chemistry, 2018, 242:22-28.
[9] ZHANG Y W, GUO X Y, PENG Z Q, et al.A review of recent progress in reducing NaCl content in meat and fish products using basic amino acids[J].Trends in Food Science &Technology, 2022, 119:215-226.
[10] GUO X Y, PENG Z Q, ZHANG Y W, et al.The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J].Food Chemistry, 2015, 170:212-217.
[11] 黄亚军. 超声与碱性氨基酸联合处理对乳化肠物理稳定性的影响及机理研究[D].合肥:合肥工业大学, 2020.
HUANG Y J.The study of the effects of the combined treatment of ultrasound and basic amino acids on the physical stability of emulsion sausage and its mechanism[D].Hefei:Hefei University of Technology, 2020.
[12] CHEN L, BAO P Q, WANG Y, et al.Improving quality attributes of refrigerated prepared pork chops by injecting L-arginine and L-lysine solution[J].LWT, 2022, 153:112423.
[13] LIU J, TU Z C, ZHANG L, et al.Influence of ultrasonication prior to glycation on the physicochemical properties of bovine serum albumin-galactose conjugates[J].Food Science and Technology Research, 2018, 24(1):35-44.
[14] KATO A, NAKAI S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochimica et Biophysica Acta (BBA) - Protein Structure, 1980, 624(1):13-20.
[15] ZHANG L, TU Z C, XIE X, et al.Antihyperglycemic, antioxidant activities of two Acer palmatum cultivars, and identification of phenolics profile by UPLC-QTOF-MS/MS:New natural sources of functional constituents[J].Industrial Crops and Products, 2016, 89:522-532.
[16] 朱一丹, 谢国锦, 高岭, 等.不同pH和离子强度条件下青鱼(Mylopharyngodon piceus)肌浆蛋白IgG/IgE结合能力的变化[J].食品与发酵工业, 2020, 46(14):34-39.
ZHU Y D, XIE G J, GAO L, et al.Effect of different pH and ion strength on IgG/IgE binding capacity of sarcoplasmic protein of black carp(Mylopharyngodon piceus)[J].Food and Fermentation Industries, 2020, 46(14):34-39.
[17] APPEL K, MUNOZ E, NAVARRETE C, et al.Immunomodulatory and inhibitory effect of immulina®, and immunloges® in the Ig-E mediated activation of RBL-2H3 cells.A new role in allergic inflammatory responses[J].Plants, 2018, 7(1):13.
[18] GAO R C, WANG Y M, MU J L, et al.Effect of L-histidine on the heat-induced aggregation of bighead carp (Aristichthys nobilis) myosin in low/high ionic strength solution[J].Food Hydrocolloids, 2018, 75:174-181.
[19] CHEN X, ZOU Y F, HAN M Y, et al.Solubilisation of myosin in a solution of low ionic strength L-histidine:Significance of the imidazole ring[J].Food Chemistry, 2016, 196:42-49.
[20] WANG Y S, ZHAO J, ZHANG W W, et al.Modification of heat-induced whey protein gels by basic amino acids[J].Food Hydrocolloids, 2020, 100:105397.
[21] HU H, WU J H, LI-CHAN E C Y, et al.Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J].Food Hydrocolloids, 2013, 30(2):647-655.
[22] 王俊杰. 有机农药分子与牛血清白蛋白相互作用研究[D].南昌:南昌大学, 2008.
WANG J J.Study on the interaction between organ-pesticide molecules and bovine serum albumin[D].Nanchang:Nanchang University, 2008.
[23] 马天怡, 张唯唯, 何振东, 等.碱性氨基酸改造食品蛋白质功能性研究进展[J].精细化工, 2021, 38(2):294-305.
MA T Y, ZHANG W W, HE Z D, et al.Recent advances on basic amino acids modifying functionalities of food proteins[J].Fine Chemicals, 2021, 38(2):294-305.
[24] BROERSEN K.Milk processing affects structure, bioavailability and immunogenicity of β-lactoglobulin[J].Foods, 2020, 9(7):874.
[25] RYTKÖNEN J, KARTTUNEN T, KARTTUNEN R.Effect of Heat Denaturation of Bovine Milk Beta-Lactoglobulin on Its Epithelial Transport and Allergenicity[M].Oulu:University of Oulu, 2006.