糖尿病是严重危害人类健康的慢性代谢疾病之一,2021年全球糖尿病患者已经高达5.36亿,且呈逐年上升的趋势,预测到2040年,全球糖尿病患者将高达6.42亿[1]。机体的长期高血糖会诱导血清和血红蛋白的糖基化,造成晚期糖基化终产物(advanced glycation end products, AGEs)的过度积累,促进活性自由基的形成。研究表明,AGEs是引起糖尿病肾病、视网膜病变、神经病变、心血管病等糖尿病并发症的主要因素之一,减少AGEs的生成量能有效降低糖尿病并发症的发病率[2]。而机体中氧自由基的积累会导致蛋白质、DNA等大分子的功能损伤,许多研究证明氧化应激和糖尿病并发症的发生密切相关[3]。α-葡萄糖苷酶抑制剂可通过降低α-葡萄糖苷酶的活性来减缓葡萄糖的吸收,从而降低餐后和空腹血糖水平,是治疗糖尿病的一线药物[4],但是目前常用的α-葡萄糖苷酶抑制剂如阿卡波糖等有腹胀、腹泻、心绞痛等副作用,甚至可导致肝毒[5]。因此,清除自由基、抑制α-葡萄糖苷酶的活性和AGEs的形成可作为天然植物资源中抗糖尿病活性成分筛选的评价指标,对寻找天然、高效和安全的抗糖尿病药物具有很重要的意义。
鱼腥草又名折耳根、岑草、紫蕺、猪鼻拱,属三白草科蕺菜属,是一种具有腥味的草本植物。药典记载,鱼腥草具有清热解毒、排脓促尿的作用,目前已知鱼腥草中的化学成分包括挥发油、生物碱、酚酸、黄酮类化合物等。药理研究表明,鱼腥草提取物可减少炎症因子的释放,减轻肺损伤,增强阴道、口腔、肠道的免疫屏障,降低病原菌感染[6]。SEKITA等[7]发现鱼腥草膏体乙醇提取物对金黄色葡萄球菌有抗菌作用,且对金黄色葡萄球菌脂磷壁酸诱导的人角质形成细胞产生IL-8和CCL20,具有剂量依赖性的抑制作用,无任何细胞毒性。JU等[8]研究发现鱼腥草水提物有很强的抗氧化活性,能缓解氧化应激引起的肌肉损伤等相关性疾病。HAN等[9]研究表明鱼腥草多糖HCA4S1能显著抑制肺癌细胞A549的增殖,具有显著的抗癌活性。但目前关于鱼腥草水提物中化学成分的研究相对较少,其对糖尿病及其并发症的预防和治疗作用也尚不明确。
本研究以鱼腥草为原料,先用沸水对其进行提取获得水提物,再分别采用乙酸乙酯和正丁醇对水提物进行萃取,再采用无水乙醇对水相进行醇沉处理,最后得到乙酸乙酯相、正丁醇相和乙醇相。采用紫外分光光度计法测定水提物及各组分中总酚、总黄酮、总糖和总蛋白含量,通过DPPH自由基和ABTS阳离子自由基清除能力、α-葡萄糖苷酶抑制能力和AGEs形成抑制能力实验评价其抗糖尿病应用潜力,并采用高效液相色谱-四极杆飞行时间串联质谱(high performance liquid chromatography-quadrupole time of flight tandem mass spectrometry, HPLC-QTOF-MS/MS)技术对其主要化学成分进行初步鉴定,旨在评估鱼腥草作为新型抗糖尿病药物的潜力,为其开发利用提供理论基础。
1 实验与材料
1.1 材料与试剂
鱼腥草,江西省宜春市万载;ABTS、DPPH、阿卡波糖、α-葡萄糖苷酶(>50 U/mg蛋白质)、对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,pNPG),美国Sigma公司;乙酸乙酯、正丁醇、乙醇、甲醇,西陇科学股份有限公司;没食子酸、槲皮素、NaHCO3、乙腈、甲酸等其他试剂,上海阿拉丁生化科技股份有限公司。其中乙腈和甲酸为色谱纯,其他所有使用的试剂均为分析纯。
1.2 仪器与设备
FA1104N电子分析天平,上海丙林电子科技有限公司;SynergyH1酶标分析仪,美国BioTek公司;F-7000荧光分光光度计,日本Hitachi公司;TGL-10C高速台式离心机,上海安亭科学仪器厂;EYELA旋转蒸发仪,日本EYELA公司;UPLC LC30系统,日本Shimadzu公司;Hybrid Quadrupole-TOF二级质谱仪、Shortcut to Peakview数据处理工作站,美国AB Sciex公司。
1.3 实验方法
1.3.1 活性成分的提取
鱼腥草用自来水冲洗干净后,烘干粉碎,按1∶15(g∶mL)的固液比分散在沸水中,室温提取1 h后过滤,留上清液,残渣在相同条件下再提取2次。将上清液合并,4 000 r/min离心10 min,浓缩冻干,得到水提物(crude extract by water,CE)。将CE溶于少量蒸馏水中,依次用乙酸乙酯和正丁醇对其进行萃取,得到乙酸乙酯相和正丁醇相,水相再用5倍体积乙醇于4 ℃下过夜醇沉,上清液即为乙醇相。将乙酸乙酯相(ethyl acetate fraction,EAF)、正丁醇相(n-bwtanol fraction,nBuF)和乙醇相(ethanol fraction,EF)浓缩至干,放在棕色瓶于-20 ℃下保存备用。
1.3.2 总酚含量的测定
参照TIAN等[10]的方法,采用Folin-Ciocalteau法测定样品的总酚含量。以没食子酸为标准品绘制标准曲线,根据标准曲线计算样品中的总酚含量,实验重复3次,结果用没食子酸当量(μg GAE/mg)表示。
1.3.3 总黄酮含量的测定
采用AlCl3·6H2O方法测定样品中总黄酮的含量[10]。以槲皮素为标准品绘制标准曲线,根据标准曲线计算不同样品中总黄酮含量,实验重复3次,结果用槲皮素当量(μg QUE/mg)表示。
1.3.4 总糖的含量测定
采用苯酚-硫酸法测定样品中总糖含量[11],根据标准曲线计算样品中总糖的浓度,结果以每克干物质中葡萄糖当量 (mg Glu/g)表示。
1.3.5 总蛋白含量的测定
采用双缩脲法测定样品中总蛋白的含量[12],将1.0 mL样品与4.0 mL Biurent试剂混合,室温反应30 min,记录其在540 nm处的吸光度。以牛血清白蛋白(bovine serum albumin, BSA)作为阳性对照,结果以提取物中牛血清白蛋白的当量(mg BSA/g)表示。
1.3.6 ABTS阳离子自由基清除能力和DPPH自由基清除能力
参照ZHANG等[13] 的方法,采用ABTS和DPPH 2种体外抗氧化模型分析鱼腥草不同组分的自由基清除能力。取50 μL适宜浓度的样品溶液于96孔酶标板,加入150 μL的ABTS阳离子自由基溶液充分混匀,室温避光反应6 min后测定体系在734 nm处吸光值;取50 μL适宜浓度的样品溶液于96孔酶标板,加入150 μL的DPPH自由基溶液充分混匀,避光反应30 min后测定体系在517 nm处吸光值,以槲皮素为阳性对照,结果用百分抑制率表示。清除50%的自由基所需要的样品质量浓度用IC50值表示(μg/mL),所有实验重复3次。
1.3.7 体外抗糖尿病活性分析
1.3.7.1 α-葡萄糖苷酶活性抑制能力
参照XIE等[14]的方法测定样品的α-葡萄糖苷酶活性抑制能力。取50 μL适宜浓度的样品溶液于96孔酶标板,加入50 μL 0.1 U/mL的α-葡萄糖苷酶充分混匀,室温反应6 min,再加入50 μL 5.0 mmol/L的pNPG溶液,37 ℃反应10 min后加入100 μL 0.2 mol/L的Na2CO3溶液终止反应,最后在405 nm测吸光值(Ai)。以不加酶和样品的反应体系为空白,不含酶的反应体系为样品空白(Aj),90%甲醇代替样品的体系为控制组(Acontrol),阿卡波糖为阳性对照。按公式(1)计算样品的α-葡萄糖苷酶抑制率,半抑制浓度(IC50值)。
酶抑制率![]()
(1)
1.3.7.2 抑制AGEs形成能力
采用BSA-MGO模型评价样品抑制AGEs形成的能力[15]。采用pH 7.4,0.2 mol/L的PBS配制20 mg/mL的BSA、60 mmol/L的MGO和氨基胍盐酸盐溶液,将BSA、MGO和样品溶液按照10∶10∶1的体积比混合,37 ℃避光反应3 d后用0.2 mol/L pH 7.4 PBS 10倍稀释,测定其在激发波长370 nm,发射波长为440 nm时的荧光强度(FIs),激发和发射的狭缝宽度均为2.5 nm,扫描速度为1 200 nm/min,电压为400 V。不含MGO的反应体系为样品空白(FIsb),不含样品的反应体系为控制组(FIc),不含MGO和样品的反应体系为空白组(FIb),按公式(2)计算AGEs形成抑制能力:
抑制能力![]()
(2)
1.3.8 化学成分的鉴定
采用UPLC LC30系统对鱼腥草茶中的化学成分进行分离,样品经0.22 μm尼龙膜过滤后进样(10 μL)分析。色谱分析条件为:Tnature C18色谱柱(4.0 mm×250 mm,5 μm);柱温24 ℃;流动相A:0.1%(体积分数)甲酸水;流动相B:乙腈;流速0.4 mL/min;检测波长全波长模式。梯度洗脱程序为:0 min,95% A;12 min,90% A;13 min,90% A;35 min,70% A;36~40 min,5% A。每次进样前,先用5%(体积分数)乙腈平衡色谱柱15 min。
采用Hybrid Quadrupole-TOF Tandem Mass Spectrometer采集化合物的质谱数据。质谱条件为:电喷雾离子源;负离子模式,离子范围:m/z 100~1 500;碰撞气He;辅助气体和屏蔽气体N2;气帘气压35.0 psi;辅助气和喷雾气压50.0 psi;裂解电压-80 V;喷雾电压-4.5 kV;离子源温度550.0 ℃;MS碰撞能-10 eV;MS/MS碰撞能(-30±15) eV。采用AB SCIEX Analyst® 1.6软件采集数据,采用Peak view®1.2软件分析质谱数据。
1.4 数据分析
所有实验均重复3次,实验数据均以平均值±标准偏差表示。采用SSPS 22.0软件对数据进行单因素方差分析(one-way analysis of variance,ANOVA),采用Tukey检验比较进行显著性分析(P<0.05),采用Pearson相关系数进行相关性分析,所有图形采用Origin 8.6绘制。
2 结果与分析
2.1 总酚、总黄酮、总糖和总蛋白含量
如表1所示,鱼腥草水提物乙酸乙酯相(EAF)具有最高的总酚和总黄酮含量,其值分别为440.3 mg GAE/g和103.57 mg QUE/g,正丁醇相(nBuF)次之。经过萃取之后,EAF、nBuF和EF中的总酚含量为水提物中的1.1~5.57倍;除乙醇相之外,其总黄酮含量增加了2.00~9.30倍。这主要是因为酚类和黄酮类化合物以中和低极性成分为主,尤其是黄酮类化合物,更易溶于乙酸乙酯等有机溶剂,在萃取过程中,水提物中大量的多糖和蛋白会保留在水相中,最后在乙醇沉淀过程中被除去。以上结果表明鱼腥草中富含多酚类化合物,通过萃取能有效富集鱼腥草中的酚类和黄酮类化合物,且乙酸乙酯对鱼腥草中多酚的富集效果最好。TIAN等[10]测定了鱼腥草茶萃取组分的总酚含量,EAF和nBuF组分的总酚含量分别为408.6和37.8 μg GAE/mg,其含量显著低于本研究。这是因为植物中的总酚和总黄酮含量与遗传差异、生长环境、采收时间以及提取方法等因素密切相关[6]。
表1 鱼腥草提取物中总酚、总黄酮、总糖和总蛋白含量
Table 1 Content of total phenolics, total flavonoids, polysaccharides and total proteins in H.cordata extracts
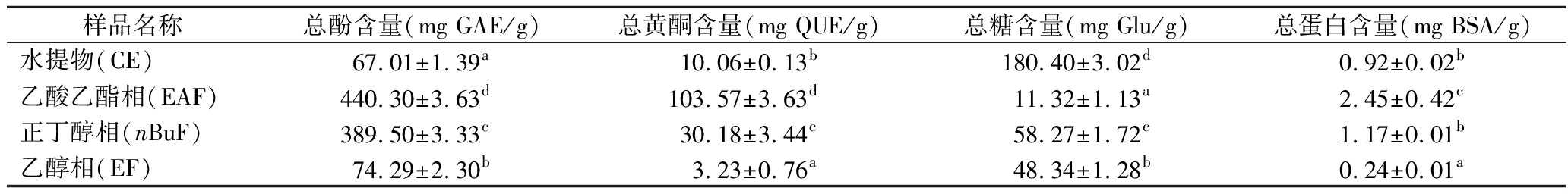
样品名称总酚含量(mg GAE/g)总黄酮含量(mg QUE/g)总糖含量(mg Glu/g)总蛋白含量(mg BSA/g)水提物(CE)67.01±1.39a10.06±0.13b180.40±3.02d0.92±0.02b乙酸乙酯相(EAF)440.30±3.63d103.57±3.63d11.32±1.13a2.45±0.42c正丁醇相(nBuF)389.50±3.33c30.18±3.44c58.27±1.72c1.17±0.01b乙醇相(EF)74.29±2.30b3.23±0.76a48.34±1.28b0.24±0.01a
注:同一列不同字母表示样品间存在显著性差异(P<0.05)(下同)。
如表1所示,CE的总糖含量最高,其值为180.40 mg Glu/g;EAF的总糖含量最低,其值为11.32 mg Glu/g。EAF的总蛋白含量最高,其值为2.45 mg BSA/g,分别是CE和nBuF的2.66和2.09倍。CE和nBuF之间的总蛋白含量不存在显著性差异(P>0.05)。以上结果表明,萃取能显著降低鱼腥草提取物的总糖含量,而对其蛋白含量的影响较小。因此,我们可通过萃取的方式除去鱼腥草中的糖类物质,提高其中多酚类活性成分的含量。
2.2 ABTS阳离子自由基清除能力
鱼腥草水提物及其萃取组分的ABTS阳离子自由基清除能力如图1-a所示,随着样品浓度的升高,其对ABTS阳离子自由基的清除能力不断增强,呈现明显的剂量效应。由表2可知,EAF(50.00 μg/mL)和nBuF(116.13 μg/mL)的IC50值最低,其活性分别为CE的4.19和1.81倍,但显著低于对照品槲皮素(IC50=10.44 μg/mL)的ABTS阳离子自由基清除能力(P<0.05)。上述结果表明EAF对ABTS阳离子自由基的清除能力最强,这可能是因为EAF含有最高的总酚含量。许多研究表明植物中的多酚和黄酮是优质的抗氧化剂,多酚含量与其抗氧化活性存在很高的相关性。例如,ZHANG等[13]发现藜蒿叶中没食子酸、原儿茶醛和奎宁酸等多酚是主要的抗氧化活性物质,XIE等[14]发现花青素、香兰素和鞣花酸等多酚是马尾松叶片中主要的抗氧化成分。

a-ABTS阳离子自由基清除能力;b-DPPH自由基清除能力
图1 鱼腥草提取物的ABTS阳离子自由基清除能力和DPPH自由基清除能力
Fig.1 The ABTS cationic radical and DPPH radical scavenging ability of H.cordata extracts
表2 鱼腥草水提物(CE)、乙酸乙酯相(EAF)、正丁醇相(nBuF)和乙醇相(EF)的抗氧化和抑制α-葡萄糖苷酶活性的IC50值
Table 2 The IC50 values of antioxidant activities and α-glucosidase inhibitory of crude extracts from H.cordata (CE), ethyl acetate fraction (EAF), n-butanol fraction (nBuF) and ethanol fraction (EF)
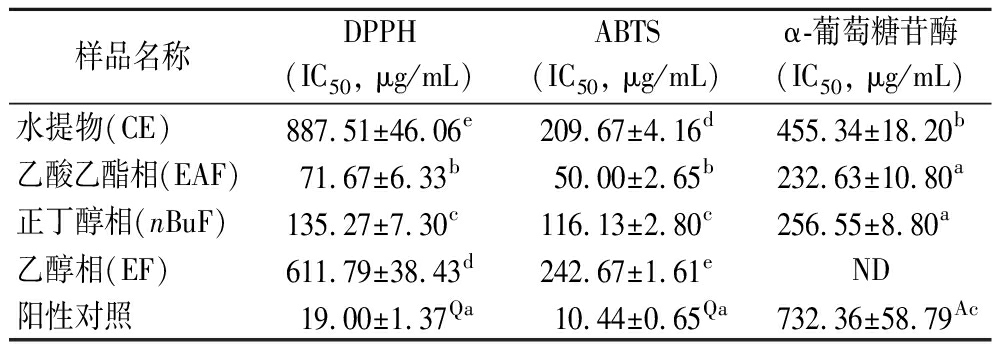
样品名称DPPH(IC50, μg/mL)ABTS(IC50, μg/mL)α-葡萄糖苷酶(IC50, μg/mL)水提物(CE)887.51±46.06e209.67±4.16d455.34±18.20b乙酸乙酯相(EAF)71.67±6.33b50.00±2.65b232.63±10.80a正丁醇相(nBuF)135.27±7.30c116.13±2.80c256.55±8.80a乙醇相(EF)611.79±38.43d242.67±1.61eND阳性对照19.00±1.37Qa10.44±0.65Qa732.36±58.79Ac
注:Q-槲皮素;A-阿卡波糖;ND-未检出。
2.3 DPPH自由基清除能力
鱼腥草水提物及其萃取组分的DPPH自由基清除能力如图1-b所示,鱼腥草样品的抗氧化活性与其浓度存在显著的剂量效应。由表2可知,鱼腥草水提物(CE)及其萃取组分EAF、nBuF和EF清除DPPH自由基的IC50值分别为887.51、71.67、135.27和611.79 μg/mL,EAF具有最高的DPPH自由基清除能力(P<0.05),这与ABTS阳离子自由基清除能力的结果一致。通过萃取能显著提高鱼腥草提取物的DPPH自由基清除能力,乙酸乙酯是富集鱼腥草中抗氧化剂的最佳溶剂。TIAN等[10]发现鱼腥草乙酸乙酯提取物有最强的DPPH自由基清除能力,其IC50值为41.3 μg/mL。ZHANG等[16]也报道掌叶槭乙酸乙酯提取物的DPPH自由基清除能力显著高于其水提物和正丁醇相萃取组分。皮尔森相关性分析表明,DPPH自由基清除能力与总酚含量、总黄酮含量和总糖含量的相关系数分别为0.930、0.826和0.339,表明多酚和黄酮是其主要的DPPH自由基清除剂,许多研究也发现,多酚与DPPH自由基清除能力高度相关[17-18]。
2.4 α-葡萄糖苷酶活性抑制作用
如图2-a和表2所示,EF的α-葡萄糖苷酶抑制活性很弱,其余样品对α-葡萄糖苷酶的抑制能力均呈现出显著的剂量效应。EAF和nBuF的α-葡萄糖苷酶抑制活性最强,其IC50值为232.63和256.55 μg/mL,且两者之间不存在显著性差异;CE次之,其IC50值为455.34 μg/mL。EAF、nBuF和CE的α-葡萄糖苷酶抑制活性分别是阿卡波糖的3.15、2.82和1.59倍。以上结果表明鱼腥草可作为AGIs(alpha-glucosidase inhibitors, AGIs)的天然优质来源。HSU等[19]研究鱼腥草叶水提物对糖尿病小鼠心脏和肾脏的抗糖和抗氧化作用,发现鱼腥草水提物能显著降低糖尿病小鼠的血糖、血尿素氮水平和肌酸磷酸激酶水平,抑制小鼠α-葡萄糖苷酶的活性可能是其降糖途径之一。鱼腥草样品的α-葡萄糖苷酶抑制能力与其总酚含量呈中度相关(r=0.621),而与其总黄酮含量的相关性较低(r=0.28),说明鱼腥草中的多酚是其中主要的AGIs。

a-α-葡萄糖苷酶活性抑制能力;b-AGEs抑制能力
图2 鱼腥草提取物的α-葡萄糖苷酶活性抑制能力和抑制AGEs形成能力
Fig.2 The α-glucosidase inhibition and anti-AGEs abilities of H.cordata extracts
注:不同小写字母代表差异显著(P<0.05)。
2.5 抑制AGEs形成能力
非酶糖基化反应晚期阶段会产生大量的AGEs,通过测定鱼腥草对AGEs形成的抑制能力评估其对糖尿病并发症的预防作用。由于鱼腥草CE的糖含量过高,可能会与蛋白发生糖基化作用,干扰实验结果,因此本文只评价了鱼腥草萃取组分对牛血清白蛋白糖基化过程中AGEs形成的抑制作用。结果如图2-b所示,当鱼腥草样品的质量浓度为2.0 mg/mL时,其AGEs形成的抑制率为37.50%~68.08%,显著高于阳性对照品阿卡波糖。在3个测试浓度下,鱼腥草CE萃取组分的AGEs形成抑制能力均强于阿卡波糖,且EAF的AGEs形成抑制能力最强,其次为nBuF,而EF最弱。LIU等[20]也发现褐藻提取物EAF萃取组分的抗糖基化能力最强。皮尔森相关性分析表明,鱼腥草萃取组分对AGEs形成的抑制能力与DPPH自由基清除能力(r=0.851)、ABTS阳离子自由基清除能力(r=0.839)和α-葡萄糖苷酶抑制能力(r=0.951)呈高度相关,与酚类物质含量呈中度相关,表明鱼腥草中的抗氧化剂和AGIs对其抗糖基化活性有很大的贡献。WANG等[5]研究表明多酚和黄酮是良好的糖基化抑制剂,其在捕获MgO和GO的过程中发挥着重要的作用,可与赖氨酸和精氨酸竞争抑制AGEs,减少AGEs的生成。YOON等[21]也发现槲皮素、芦丁、鱼腥草甲醇提取物对糖基化反应中AGEs的形成有显著的抑制作用,其活性为阿卡波糖的1.5~2.12倍。
2.6 活性成分分析
EAF和nBuF的多酚化合物含量最高且活性最强,因而采用HPLC-ESI-QTOF-MS/MS对其主要成分进行分析。EAF和nBuF的基峰色谱图见图3,通过将检测到的峰的保留时间、母离子、碎片离子等信息与文献和数据库中的信息对比,对化合物的结构进行初步鉴定。共从EAF和nBuF中鉴定出40个化合物,包括6个有机酸、12个酚酸、15个黄酮类化合物、4个脂肪酸和3个其他化合物,其中在EAF和nBuF中分别鉴定出17和23个化合物(表3)。

a-乙酸乙酯相;b-正丁醇相
图3 鱼腥草乙酸乙酯相和正丁醇相总离子流图
Fig.3 Total ion current chromatography of ethyl acetate fraction extract and n-butanol fraction from H.cordata
表3 鱼腥草提取物中主要化学成分鉴定质谱信息
Table 3 The mass information for identifying the major chemical constituents from H. cordata extracts

编号保留时间/min检测值m/z预测值m/z分子式二级质谱碎片化合物名称EAFnBuF有机酸23.84134.050 1134.021 0C4H6O5107.038 8苹果酸-+45.03191.075 9192.026 4C6H8O7117.041 5, 101.047 8柠檬酸-+55.42191.059 6191.055 0C7H11O6127.044 6, 109.034 4奎宁酸-+78.21117.022 0118.026 0C4H6O4100.925 9琥珀酸-+2735.95187.100 9187.096 4C9H15O4169.088 7, 143.109 2, 125.097 1壬二酸-+327.19117.021 8118.026 1C4H6O4100.925 9琥珀酸同系物+-酚酸13.56296.886 2296.052 6C13H12O8296.899 3, 128.963 7香豆酸-+34.81151.064 4152.046 8C8H8O3133.016 2, 108.021 5, 80.024 3香兰素-+814.90353.091 3353.086 7C16H17O9191.064 9, 179.042 8, 135.049 93-O-咖啡酰奎宁酸-+1118.76353.091 7354.094 5C16H18O9191.066 2, 173.054 1, 135.050 6反式3-咖啡酰奎宁酸-+1219.95353.092 3354.094 5C16H18O9191.065 4, 179.043 3, 173.053 7, 135.050 1反式3-咖啡酰奎宁酸同系物-+1522.37177.022 5178.026 0C9H6O4149.024 6, 133.036 2, 105.036 6二羟基香豆素-+1623.03179.037 9180.041 7C9H8O4135.049 7, 134.041 8咖啡酸-+1724.10337.097 1338.099 6C16H18O8173.052 6, 191.064 4, 163.045 5香豆酰奎尼酸-+3311.05153.020 9154.026 0C7H6O4135.051 3, 119.054 4原儿茶酸+-3414.51137.026 5138.031 1C7H6O3109.032 5, 108.024 5原儿茶醛+-3515.27177.020 2178.026 0C9H6O4149.031 7, 133.033 6, 121.031 1,105.038 4二羟基香豆素同系物+-3615.58179.036 4180.041 7C9H8O4135.050 8, 134.043 0咖啡酸同系物+-
续表3

编号保留时间/min检测值m/z预测值m/z分子式二级质谱碎片化合物名称EAFnBuF黄酮917.89595.174 2594.157 9C27H30O15463.117 4, 323.034 2, 301.051 7, 300.445, 271.041 1牡荆素2-葡萄糖苷同系物-+1018.38609.153 4610.152 8C27H30O16463.116 8, 462.109 0, 301.052 9, 299.035 9, 271.039 6芦丁-+1926.27609.153 9610.152 8C27H30O16301.052 9, 300.044 7, 271.038 7芦丁同系物-+2128.25463.093 9464.094 9C21H20O12301.054 5, 300.045 9, 271.040 7, 255.044 4, 151.010 1槲皮素-3-O-己糖苷同系物-+2430.77447.098 5448.100 0C21H20O11284.048 0, 285.054 8, 255.043 0, 227.045 5山柰酚-3-O-己糖苷-+2532.52447.098 5447.092 2C21H19O11301.054 3, 300.046 0, 271.046 0, 255.044 4, 151.010 1槲皮素-3-O-邻鼠李糖苷-+2936.70431.102 0432.105 1C21H20O10285.056 4, 284.048 3, 255.042 9, 227.045 9, 163.013 5山柰酚-3-O-邻鼠李糖苷-+3818.46463.088 9464.094 9C21H20O12301.054 6, 300.046 5, 271.041 0, 255.044 8, 151.010 4槲皮素-3-O-己糖苷同系物+-3920.05447.095 2464.094 9C21H20O12285.055 8, 284.048 4, 255.042 8, 227.045 5, 151.009 0山柰酚-3-O-己糖苷同系物+-4020.48433.078 9434.084 4C20H18O11301.052 8, 300.044 5, 271.039 4, 255.042 4, 179.006 6, 151.008 8槲皮素-3-O-戊糖苷+-4120.81447.095 2447.092 2C21H19O11301.055 7, 300.047 7, 271.042 3,255.045 7, 179.008 2, 151.011 1槲皮素-3-O-邻鼠李糖苷同系物+-4221.50447.095 3447.092 2C21H19O11301.053 4, 300.045 4, 271.040 2, 255.043 9, 179.006 6, 151.009 8槲皮素-3-O-邻鼠李糖苷同系物+-4841.24285.041 7286.068 3C12H14O8223.039 2, 185.070 6, 130.971 9, 108.024 3山柰酚+-脂肪酸4637.04327.218 4328.224 4C18H32O5229.155 6, 221.129 6, 183.147 5, 171.110 1, 167.150 9, 137.101 1, 127.117 2三羟基十八碳二烯酸+-4739.68329.234 7330.240 0C18H34O5299.037 7, 229.155 0, 211.144 1, 193.132 2, 183.147 3, 171.109 9, 139.117 8, 127.117 29,12,13-三羟基十八烯酸同系物+-4942.83309.208 4310.213 8C18H30O4211.165 6, 183.111 1, 171.110 2, 155.114 9, 139.117 3, 107.089 6羟基十八碳三烯酸+-5043.52329.234 0330.240 0C18H34O5311.237 5, 293.228 3, 211.144 2, 199.142 7, 181.130 8, 171.110 2, 155.114 2, 129.096 09,12,13-三羟基十八烯酸同系物+-其他化合物66.01282.088 9218.103 6C10H12N5O173.070 5, 130.973 6, 137.030 2鸟苷-+1320.45431.197 6432.199 0C20H32O10205.133 0,153.097 6,138.072 7未知-+1421.97281.142 9290.038 0C9H10N2O9171.126 1, 121.068 8, 113.087 2天冬酰胺戊糖苷-+1825.41610.425 4610.303 7C37H42N2O6564.452 9, 225.173 0莲心碱-+2027.70723.512 8724.512 0C41H72O10677.549 2未知-+2228.94413.149 5414.149 3C15H22N6O8790.642 3未知-+2329.37583.071 5584.116 0C28H24O14447.122 0, 301.052 7, 300.043 8, 271.040 7未知-+2634.33405.180 8404.131 3C17H24O11-未知-+2836.40493.234 3494.235 7C22H38O12447.253 0, 315.199 2, 161.051 9, 131.040 0未知-+3037.96493.234 7494.235 7C22H38O12447.250 3, 315.198 0, 161.051 7, 131.040 8未知-+
续表3

编号保留时间/min检测值m/z预测值m/z分子式二级质谱碎片化合物名称EAFnBuF3139.98421.212 7421.206 8C19H33O10277.181 9, 161.052 9, 159.036 6, 125.029 4未知-+3717.93723.505 8724.512 0C41H72O10677.498 1, 579.317 7, 509.807 7, 451.330 6, 338.244 4, 320.234 4, 275.333 6未知+-4431.45135.046 3135.044 0C8H7O2-未知+-
2.6.1 有机酸
有机酸裂解会脱去—CO2、—H2O、H2O-CO2和—H2OCO等基团,通过分析特征碎片离子,化合物2、4和27分别被鉴定为苹果酸、酒石酸和柠檬酸。化合物5、7和32含有特征离子碎片127.044 6、109.925 9和109.925 9,表示这些化合物脱去了羟基和羧基,因而其被鉴定为奎宁酸、琥珀酸及其同系物[22]。
2.6.2 酚酸化合物
通过与标准品进行对比,化合物1、3和33分别被鉴定为香豆酸、香兰素和原儿茶酸。化合物8、11和12具有相同的特征碎片191和135,表明其存在咖啡酰基和奎宁酸酰基,被初步鉴定为3-O-咖啡酰奎宁酸、Trans 3-咖啡酰奎宁酸及其同系物[23]。化合物15被鉴定为二羟基香豆素,其特征碎片离149.024 6、133.036 2和105.036 6分别表示其脱去1个CO、CO2和CO—CO2[18]。化合物16和36具有特征离子碎片135,表明其母离子在裂解过程中脱去1个CO2,被鉴定为咖啡酸同系物。化合物17被鉴定为香豆酰奎宁酸,碎片离子135表明其存在奎宁酸酰基。化合物34在裂解过程中产生了碎片离子108.025 9,通过与文献对比,其被鉴定为原儿茶醛[24]。化合物35和15具有相同的分子式和特征离子碎片,被初步推测为二羟基香豆素同系物。
2.6.3 黄酮类化合物
芹菜素、槲皮素、山奈酚苷元的特征离子碎片为269、301和285,其衍生物分子质量减少132、162和146分别表示脱去一个戊糖基、己糖基和鼠李糖基[25]。根据特征离子碎片,化合物45和48被鉴定为槲皮素和山奈酚。通过与标准品对比,化合物10被鉴定为芦丁,化合物19与其有相同的离子碎片和分子式,被鉴定为芦丁同系物。化合物9、21、25、38、40、41和42都含有特征碎片离子301,其分子质量相比于槲皮素增加了294、162、146、162、132、146和146 Da,表明其存在戊糖基己糖基、己糖基、鼠李糖基、己糖基、戊糖基、鼠李糖基和鼠李糖基。因此,化合物9、化合物21和38、化合物25、41和42、化合物40分别被鉴定为黄素蛋白异构体、槲皮素-3-O-己糖苷同系物、槲皮素-3-O-鼠李糖苷同系物和槲皮素-3-O-戊糖苷。化合物24和39均被鉴定为山奈酚-3-O-己糖苷同系物,其母离子碎片285.055 8表示其脱去一个己糖基。化合物29和43被鉴定为山奈酚-3-O-鼠李糖苷同系物,特征离子碎片285.056 3说明其存在鼠李糖基[26]。
2.6.4 脂肪酸
化合物46被鉴定为三羟基十八碳二烯酸,特征碎片离子229.155 6代表其脱去3个H2O和1个CO2[25]。化合物47和50的分子质量比化合物46高2 Da,表明其多了2个氢原子,因而被鉴定为9,12,13-三羟基十八烯酸同系物[25]。化合物49为十八碳三烯酸的氢过氧化物,特征碎片离子171.110 2表明其在裂解过程中失去了—C9H14O,被鉴定为羟基十八碳三烯酸。
2.6.5 其他化合物
通过与标准品对比,化合物18被初步鉴定为莲心碱。化合物6被鉴定为鸟苷,碎片离子137.030 2表示其在裂解过程中脱去了-ribose-N[27]。化合物14具有特征碎片离子113.087 2,表明其存在天冬氨酸酰基,被鉴定为天冬氨酸戊糖苷[13]。
3 结论
本论文对鱼腥草水提物及其萃取组分的总酚含量、总黄酮含量、总糖含量、总蛋白含量、抗氧化活性、α-葡萄糖苷酶抑制活性和AGEs形成抑制能力进行了测定,并对EAF和nBuF中的活性成分进行了质谱分析。研究发现,EAF的总酚含量[(440.3±3.63) mg GAE/g]、总黄酮含量[(103.57±3.63) mg QUE/g]和总蛋白含量[(2.45±0.42) mg BSA/g]最高,分别是CE的6.57、10.30和2.66倍;但其总糖含量最低[(11.32±1.13) mg QUE/g]。同时,EAF具有最强的抗氧化活性,其DPPH自由基和ABTS阳离子自由基清除能力的IC50值分别为(71.67±6.33)和(50.00±2.65) μg/mL,清除能力显著高于CE。EAF、nBuF和CE对α-葡萄糖苷酶的抑制能力是阿卡波糖的1.59~3.15倍,其中EAF的IC50值最低,为(232.63±3.63) μg/mL。EAF和nBuF对AGEs形成的抑制能力显著高于AG,表现出显著的抗糖基化作用。从EAF和nBuF中共鉴定出40个化合物,包括6个有机酸、12个酚酸、15个黄酮类化合物、4个脂肪酸和3个其他化合物,酚酸和黄酮是其中的主要活性成分。本研究可为鱼腥草作为多靶点糖尿病药物的开发提供借鉴,促进鱼腥草资源的高值化利用。
[1] KAMALRAJ R, NEELAKANDAN S, RANJITH KUMAR M, et al.Interpretable filter based convolutional neural network (IF-CNN) for glucose prediction and classification using PD-SS algorithm[J].Measurement, 2021, 183(9):109804.
[2] KHAN M, LIU H L, WANG J, et al.Inhibitory effect of phenolic compounds and plant extracts on the formation of advance glycation end products:A comprehensive review[J].Food Research International, 2020, 130:108933.
[3] SINGH R, DEVI S, GOLLEN R.Role of free radical in atherosclerosis, diabetes and dyslipidaemia:Larger-than-life[J].Diabetes/Metabolism Research and Reviews, 2015, 31(2):113-126.
[4] ALSSEMA M, RUIJGROK C, BLAAK E E, et al.Effects of alpha-glucosidase-inhibiting drugs on acute postprandial glucose and insulin responses:A systematic review and meta-analysis[J].Nutrition &Diabetes, 2021, 11(1):1-9.
[5] WANG Z C, WANG J, HU J X, et al.A comparative study of acarbose, vildagliptin and saxagliptin intended for better efficacy and safety on type 2 diabetes mellitus treatment[J].Life Sciences, 2021, 274:119069.
[6] WU Z, DENG X Y, HU Q C, et al.Houttuynia cordata Thunb:An ethnopharmacological review[J].Frontiers in Pharmacology, 2021, 12:714694.
[7] SEKITA Y, MURAKAMI K, YUMOTO H, et al.Anti-bacterial and anti-inflammatory effects of ethanol extract from Houttuynia cordata poultice[J].Bioscience, Biotechnology, and Biochemistry, 2016, 80(6):1 205-1 213.
[8] JU L L, ZHANG J X, WANG F J, et al.Chemical profiling of Houttuynia cordata Thunb.by UPLC-Q-TOF-MS and analysis of its antioxidant activity in C2C12 cells[J].Journal of Pharmaceutical and Biomedical Analysis, 2021, 204:114271.
[9] HAN K, JIN C, CHEN H J, et al.Structural characterization and anti-A549 lung cancer cells bioactivity of a polysaccharide from Houttuynia cordata[J].International Journal of Biological Macromolecules, 2018, 120:288-296.
[10] TIAN L M, SHI X L, YU L H, et al.Chemical composition and hepatoprotective effects of polyphenol-rich extract from Houttuynia cordata tea[J].Journal of Agricultural and Food Chemistry, 2012, 60(18):4 641-4 648.
[11] ZHANG W H, WU J, WENG L Y, et al.An improved phenol-sulfuric acid method for the determination of carbohydrates in the presence of persulfate[J].Carbohydrate Polymers, 2020, 227:115332.
[12] 程娟, 刘雯恩, 黄敏菊, 等.双缩脲法测定胶原贴敷料中Ⅰ型胶原蛋白含量[J].中国医疗器械信息, 2019, 25(11):18-20.
CHENG J, LIU W E, HUANG M J, et al.Determination of collagen type Ⅰ in collagen dressing by biuret method[J].China Medical Device Information, 2019, 25(11):18-20.
[13] ZHANG L, TU Z C, WANG H, et al.Metabolic profiling of antioxidants constituents in Artemisia selengensis leaves[J].Food Chemistry, 2015, 186:123-132.
[14] XIE X, TU Z C, ZHANG L, et al.Antioxidant activity, α-glucosidase inhibition, and phytochemical fingerprints of Anoectochilus roxburghii formula tea residues with HPLC-QTOF-MS/MS[J].Journal of Food Biochemistry, 2017, 41(6):e12402.
[15] ZHANG L, ZHU M F, TU Z C, et al.α-Glucosidase inhibition, anti-glycation and antioxidant activities of Liquidambar formosana Hance leaf, and identification of phytochemical profile[J].South African Journal of Botany, 2017, 113:239-247.
[16] ZHANG L, TU Z C, XIE X, et al.Antihyperglycemic, antioxidant activities of two Acer palmatum cultivars, and identification of phenolics profile by UPLC-QTOF-MS/MS:New natural sources of functional constituents[J].Industrial Crops and Products, 2016, 89:522-532.
[17] SUN Y, DENG Z Y, LIU R H, et al.A comprehensive profiling of free, conjugated and bound phenolics and lipophilic antioxidants in red and green lentil processing by-products[J].Food Chemistry, 2020, 325:126925.
[18] AMMAR S, DEL MAR CONTRERAS M, BELGUITH-HADRICH O, et al., et al.Assessment of the distribution of phenolic compounds and contribution to the antioxidant activity in Tunisian fig leaves, fruits, skins and pulps using mass spectrometry-based analysis[J].Food &Function, 2015, 6(12):3 663-3 677.
[19] HSU C C, YANG H T, HO J J, et al.Houttuynia cordata aqueous extract attenuated glycative and oxidative stress in heart and kidney of diabetic mice[J].European Journal of Nutrition, 2016, 55(2):845-854.
[20] LIU H Y, GU L W.Phlorotannins from brown algae (Fucus vesiculosus) inhibited the formation of advanced glycation endproducts by scavenging reactive carbonyls[J].Journal of Agricultural and Food Chemistry, 2012, 60(5):1 326-1 334.
[21] YOON S R, SHIM S M.Inhibitory effect of polyphenols in Houttuynia cordata on advanced glycation end-products (AGEs) by trapping methylglyoxal[J].LWT - Food Science and Technology, 2015, 61(1):158-163.
[22] WANG F Y, ZHANG Q Q, LU Z W, et al.Identification of chemical constituents in traditional Chinese medicine formula using HPLC coupled with linear ion trap-Orbitrap MS from high doses of medicinal materials to equivalent doses of formula:Study on Xiang-Sha-Liu-Jun-Zi-Jia-Jian Granules[J].Journal of Separation Science, 2016, 39(9):1 619-1 627.
[23] ZHENG G D, ZHOU P, YANG H, et al.Rapid resolution liquid chromatography-electrospray ionisation tandem mass spectrometry method for identification of chemical constituents in Citri Reticulatae Pericarpium[J].Food Chemistry, 2013, 136(2):604-611.
[24] 刘生生, 韩飞, 许卉, 等.丹酚酸B热解产物化学成分的分离与鉴定[J].中草药, 2011, 42(2):247-250.
LIU S S, HAN F, XU H, et al.Isolation and identification of chemical constituents from thermal decomposition extract of salvianolic acid B[J].Acupuncture Research, 2011, 42(2):247-250.
[25] LI Z, TU Z C, WANG H, et al.Ultrasound-assisted extraction optimization of α-glucosidase inhibitors from Ceratophyllum demersum L. and identification of phytochemical profiling by HPLC-QTOF-MS/MS[J].Molecules, 2020, 25(19):4507.
[26] 张露, 王红红, 杨斯涵, 等.基于UPLC-QTOF-MS/MS技术分析荷叶乙酸乙酯相中主要化学成分[J].食品科学, 2019, 40(22):229-235.
ZHANG L, WANG H H, YANG S H, et al.Characterization of chemical constituents in ethyl acetate fraction of lotus leaves by ultra-high performance liquid chromatography-quadrupole time-of-flight tandem mass spectrometry[J].Food Science, 2019, 40(22):229-235.
[27] LIU M H, TONG X, WANG J X, et al.Rapid separation and identification of multiple constituents in traditional Chinese medicine formula Shenqi Fuzheng Injection by ultra-fast liquid chromatography combined with quadrupole-time-of-flight mass spectrometry[J].Journal of Pharmaceutical and Biomedical Analysis, 2013, 74:141-155.