乳凝胶是指乳酪蛋白胶束在凝乳酶、酸或热诱导等因素作用下,形成胶联网状结构的过程。发酵乳是乳酸菌分解乳糖产生乳酸,酪蛋白在乳酸作用下,相互聚集形成网状结构的过程。当工艺和成分固定时,影响网状结构的酪蛋白微粒、脂肪球、乳清蛋白微粒以及体系温度均相对固定,此时只有乳酸菌及其代谢产物胞外多糖是可变的影响因素。开菲尔(Kefir)是由开菲尔粒发酵形成的一种具有酸性、低酒精含量特点的传统复合型发酵乳。1967年,LA RIVIERE首次发现Kefiran是一种黏性多糖,具有一定的弹性。Kefiran约含等量的D-葡萄糖和D-半乳糖,是一种黏合剂,起到固定微生物的作用,与各种微生物形成开菲尔粒结构的骨架,保护开菲尔粒免受外部微生物的危害。由于开菲尔胞外多糖有许多生物活性(如抗微生物、抗肿瘤、降血糖、免疫细胞平衡、保护肝损伤、伤口愈合等),具有潜在开发前景和应用价值,逐渐成为胞外多糖研究领域的热点之一。本研究以开菲尔发酵乳中Kefiran为研究对象,通过对开菲尔发酵乳及外源添加Kefiran的开菲尔发酵乳的粒径、Zeta电位、紫外/可见光谱、内源性荧光光谱、电镜扫描结果及流变学特性进行测定,研究Kefiran对发酵乳凝胶形成的影响。
1 材料与方法
1.1 材料与试剂
开菲尔粒(直径约为2~6 mm),采集自锡林郭勒盟牧民家庭。Kefiran,本实验室从开菲尔发酵乳中所提取的胞外多糖[1]。脱脂乳粉,丹麦Arla Foods乳品公司。
1.2 仪器与设备
TM400SEM扫描电镜,日立高新技术那珂事业所;FL970Plus荧光分光光度计,上海天美有限公司;DHR-2流变仪,美国TA Instruments公司;Nano-ZS90激光粒度仪,英国马尔文公司。
1.3 实验方法
1.3.1 样品的制备
原脱脂乳即为10%的脱脂乳;发酵乳为开菲尔粒接种量为50 g/L的发酵乳;外源添加Kefiran发酵乳为在发酵乳的基础上外源添加2%的Kefiran,放入28 ℃的恒温培养箱中培养24 h后取出。及时实验。
1.3.2 粒径测定
取1 mL样品,25 ℃下平衡2 min。将样品在通用分析模式下进行粒径测定。条件为:用蒸馏水分散,水的折射率为1.333,样品颗粒的折射率为1.520,波长为633 nm,每个样品测定3次,得到平均粒径。
1.3.3 Zeta电位测定
利用Nano-ZS90激光粒度仪测定不同样品溶液的Zeta电位。将样品稀释50倍,吸取1 mL稀释液于电位测定样品池中,测试温度为25 ℃。每组试验测定3次。
1.3.4 紫外/可见光谱扫描
将2 mL样品置于石英比色皿中用紫外分光光度计进行全波长扫描。条件为:温度25 ℃,扫描波长220~400 nm,采样间隔1 nm,每个样品进行3次平行试验。
1.3.5 内源性荧光光谱的测定
取2 mL样品置于专用比色皿中用荧光分光光度计进行测定。条件为:温度25 ℃,激发波长295 nm,扫描范围310~440 nm,扫描速率240 nm/min,采样间隔1 nm,每个样品进行3次平行试验。
1.3.6 扫描电镜
将导电胶带固定在样品盘的中间,取出少量冻干样品均匀的粘到胶带上,将固定好样品的样品盘放置在喷金仪中喷金15 min,选择合适的电压,用扫描电镜观察发酵乳结构变化。
1.3.7 流变学特性研究
参照之前实验方法,采用流变仪对样品的黏度及剪切特性进行测定[2]。
1.3.8 数据分析
本实验用Design-Expert 13分析软件进行响应面分析,所有数据通过SPSS 23统计软件进行方差分析,之后用Origin 2019b软件进行做图。
2 结果与分析
2.1 扫描电镜结果
图1显示不同冻干后样品通过扫描电镜观察到的微观结构。脱脂乳中蛋白呈现大小不一、表面光滑的球状结构(图1-a)。而经发酵后,发酵脱脂乳的微观结构为破碎且表面光滑的片状结构,说明发酵过程使蛋白质的有序结构被破坏。由于开菲尔多糖主要是在原料乳体系pH<5.2以后大量产生[1],在pH=5.2时,酪蛋白开始凝集,而内源性多糖随着乳凝胶的形成,由开菲尔粒中产多糖菌株缓慢代谢出来。此时多糖的位垒效应,也从无到有逐渐增大,使正在形成的、大的凝集体进一步加大,且联合过程受到一定程度的阻碍。同时,在分割小区内,增加了凝集体碰撞结合的几率。因此,在多糖逐步产生,渐渐形成“网络”的干扰下,酪蛋白絮凝体形成连续且细密的立体网状结构,表现为光滑致密的结构(图1-b)。外源胞外多糖的高度分枝结构促使构象紊乱,干扰有序的组装和网络的形成,当外源加入较大分子质量的多糖时,会导致酸乳凝胶形成的连续性变差,仅形成片状细密的松散结构(图1-c)。

a-脱脂乳;b-发酵脱脂乳;c-外源添加Kefiran发酵脱脂乳
图1 不同溶液的微观结构
Fig.1 The microstructure of various solutions
2.2 粒径测定
粒径及粒径的分布情况是反映聚合物在水溶液中相互作用的重要指标之一。不同样品溶液的粒径分布如图2所示。

图2 不同溶液的粒径分布
Fig.2 Particle size distribution of various solutions
原脱脂乳的粒径集中在0.03~1 μm,相对颗粒较小,一致性好。而Kefiran的粒径大部分集中在2~10 μm,少量集中在80~400 μm,颗粒较脱脂乳粉粒大,有很好的一致性。经发酵,缓慢释放的多糖参与酪蛋白的凝聚,由于壁垒作用,增大了分割区内酪蛋白的凝聚几率,单个酪蛋白相互结合成单体簇状物,粒径大部分集中于2~100 μm,粒径增大。随着多糖的逐步产生,“网络”干扰渐渐形成,酪蛋白絮凝体形成连续而且细密的立体网状结构,因此一致性优于脱脂乳。当外源添加Kefiran时,发酵脱脂乳粒径整体趋势变大。由于Kefir粒中菌群复杂,因此胞外多糖种类较多,分子大小不等,这从粒径分布也可以看出。分子较小的胞外多糖,形成较小的空间位垒。而与酪蛋白微球分子大小相近或更小的多糖,就不表现出空间位垒效应,此时,对乳凝胶形成的影响就非常有限,对酪蛋白凝聚作用的影响也就很小。粒径结果显示Kefiran粒径均远大于脱脂乳,因此对发酵乳粒径有一定影响,粒径集中于4~200 μm。
2.3 Zeta电位分析
Zeta电位用来测定样品的表面电荷密度以及带电性质,也可以用来反映乳清蛋白和多糖之间的静电作用程度,进一步反映溶液的稳定性[3]。由于在酸性条件下,大部分乳清蛋白发生变性沉淀,只有一小部分乳清蛋白可参与聚合反应[4]。由于乳清蛋白中主要成分为β-乳球蛋白,其等电点为5.2,为避免由于变性导致其与多糖聚合程度较低,故本实验选择发酵24 h时测定电位,此时发酵乳pH值为5.6左右,大于乳蛋白的等电点。有研究表明,当pH为3.0~4.0时,蛋白质溶液pH值小于等电点,蛋白质的氨基发生质子化现象[5-6],蛋白溶液所带电荷为正电荷。pH为5.0~9.0时,蛋白质溶液pH值大于等电点,蛋白溶液带负电荷[7]。由于本文中所考察的不同溶液pH大于等电点,因此,表面电荷均呈现负电荷,表现在Zeta电位上为负值(图3)。

图3 不同溶液的Zeta电位
Fig.3 Effects on the Zeta potential of various solutions
一般来说,电位的绝对值越大,分子间静电斥力越大,体系越稳定[8]。由于牛奶中酪蛋白以胶束形式存在,外层所披裹的κ-酪蛋白,对Zeta电位、空间位阻及酪蛋白胶粒均起到稳定作用,阻碍了胶粒之间的碰撞机率,减少了胶粒的凝聚。发酵过程中,伴随着体系pH值的降低,κ-酪蛋白层逐渐收缩、塌陷,酪蛋白胶粒表面的静负电荷减少,同时,静电斥力作用不断减小,出现互相聚集的趋势[9],这与粒径结果一致。外源添加Kefiran的发酵脱脂乳,显示出更低的Zeta电位绝对值。Zeta电位绝对值越低,吸引力越大,超过排斥力时,凝聚性增加,从而发生凝结或凝聚导致粒径变大,与粒径结果一致。当pH值超出蛋白等电点时,蛋白分子带负电荷,但并不表明,蛋白质分子上完全为负电荷。在蛋白分子的某个区域或者分子的某些片段仍带有正电荷。体系中可能存在的阴离子多糖,其阴离子基团与蛋白的正电荷区域就会发生静电吸引,而相互作用,此时,多糖屏蔽了部分蛋白表面电荷,从而降低了Zeta电位。
2.4 紫外/可见光谱扫描
为了进一步分析乳蛋白与多糖之间的相互作用,分别测定了不同样品溶液的紫外光谱图,如图4所示。紫外-可见吸收光谱在280 nm处可观察到特征吸收峰,吸收峰主要由芳香族氨基酸生色团(色氨酸吲哚环和酪氨酸苯环)的π-π*跃迁所致。从图4可以看出,不同样品溶液的最大吸收波长以及紫外吸收强度均发生了变化,可能是由于蛋白质肽链展开,含有共轭双键的酪氨酸、色氨酸等芳香族氨基酸暴露出来导致发生了变化[10]。在酸性体系中,发酵脱脂乳的最大吸收峰强度大于脱脂乳,可能是因为发酵过程使pH值降低,使得κ-酪蛋白保护层塌陷,导致酪蛋白中更多的共轭双键暴露出来,使吸收峰强度增加。外源添加Kefiran,在酸乳酪蛋白发生凝集之前,大分子的多糖即完成了对原料乳的空间分割作用,酪蛋白的有序性凝聚受到影响,从而形成细碎且不连续结构,导致肽链上氨基酸残基更多的暴露出来,使吸收峰强度增大。
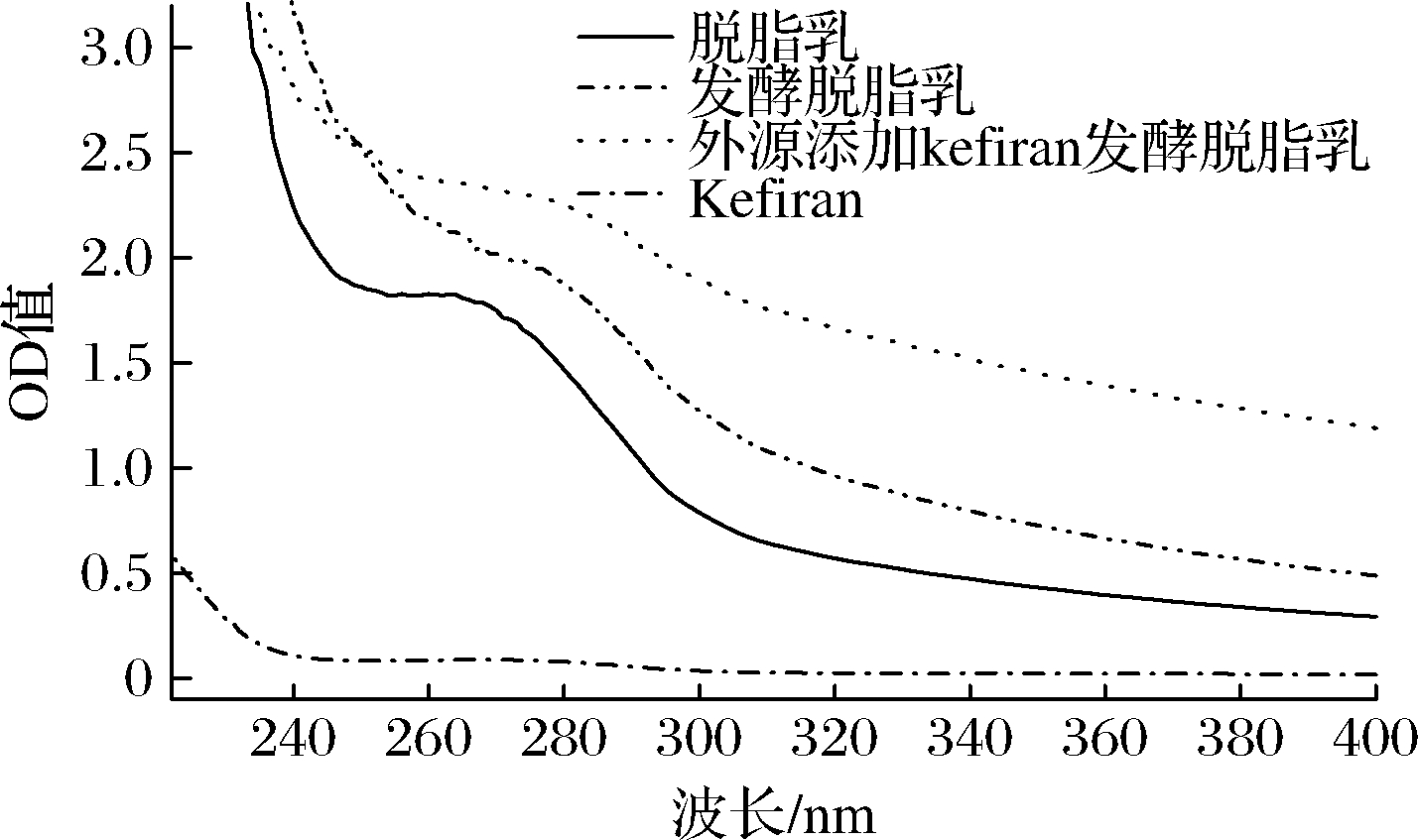
图4 不同溶液的紫外光谱图
Fig.4 Effects on ultraviolet spectra of various solutions
2.5 内源性荧光光谱的测定
蛋白质通常可作为荧光供体。荧光供体与荧光猝灭剂存在弱的分子间相互作用。这些作用力包括静电作用力、范德华力、疏水作用力和氢键等[11]。通过分析内源性蛋白质的荧光基团(如色氨酸残基等)的微环境变化,反应出蛋白质和多糖结合后三级结构和极性发生的变化[12]。由图5可知,在酸性体系中,相比脱脂乳,发酵脱脂乳和外源添加Kefiran的发酵乳的荧光强度依次降低,说明蛋白质色氨酸残基附近的疏水作用逐渐减弱,使荧光强度降低。由于发酵过程导致蛋白质发生聚集,芳香族氨基酸被非极性环境所包围[13],外源添加Kefiran后,由于提前形成了具有空间位垒的多糖网络结构,导致荧光基团内埋,荧光强度进一步降低。由于紫外吸收主要由于酪氨酸和色氨酸残基[7],因此这一结果与紫外光结果相反。

图5 不同溶液的内源性荧光光谱图
Fig.5 Effects on intrinsic fluorescence spectra of various solutions
2.6 流变学特性
2.6.1 剪切性质分析
图6显示了在剪切速率范围(10~1 000 s-1)内,不同样品溶液的黏度与剪切速率的关系。
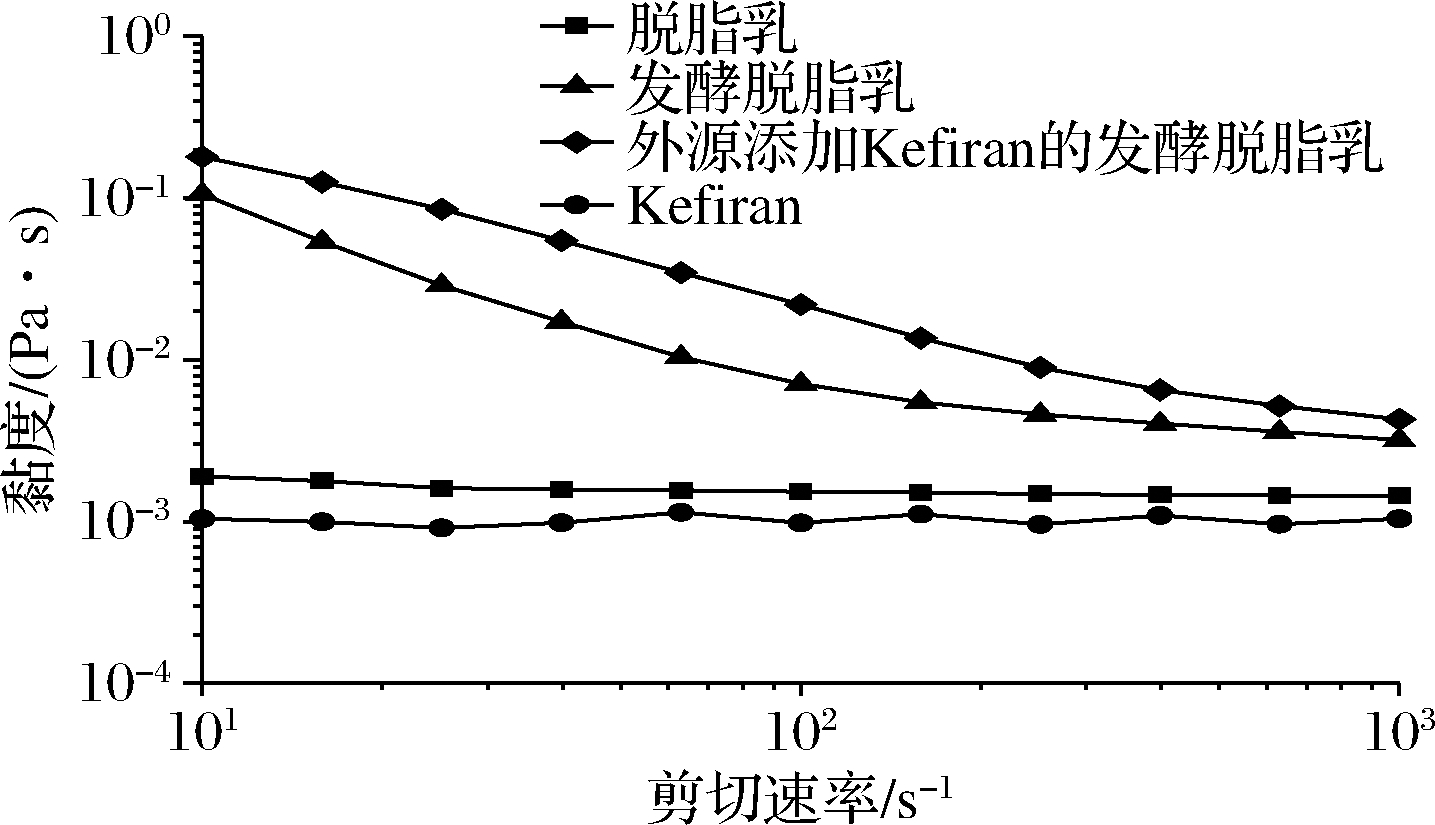
图6 不同溶液剪切速率与黏度的关系
Fig.6 Relationship between shear rate and viscosity of various solutions
在酸性体系中,可以观察到发酵脱脂乳的表观黏度显著高于脱脂乳,是由于发酵过程中Kefiran的产生导致发酵乳表观黏度的增加。据报道,胞外多糖的产生可以加强多糖和蛋白质之间的相互作用,使多糖分子部分相互联结,导致聚合程度增加[14]。外源添加Kefiran的发酵脱脂乳的表观黏度显著高于发酵脱脂乳,这是由于外源添加Kefiran使发酵乳流动阻力增大,导致所有剪切速率下的黏度值增高。开菲尔发酵乳与外源添加Kefiran发酵乳的表观黏度,随剪切速率的增大而下降,表现出明显的剪切稀化作用。VARDHANABHUTI[15]和 RUAS-MADIEDO等[16]认为,多糖链的取向效应,导致发生剪切稀化现象,即随着剪切速率增加,长而无序的大分子聚合物的流动方向越来越趋于一致,彼此间的交互作用逐渐减弱。KAZAZI等[17]的研究发现,乳酸菌胞外多糖可作为质地改良剂,明显提高乳制品黏度。还可通过乳蛋白质胶粒的相互作用,增强蛋白网络的刚性和稳定性。
由图7可知,发酵过程中,由于胞外多糖的代谢分泌,从而增加了发酵脱脂乳的表观黏度,因此,发酵脱脂乳的表观黏度高于脱脂乳。与发酵脱脂乳相比,外源添加Kefiran,明显增加了样品的表观黏度,这与实验室前期研究结果[2,18],也与KRISTO等[19]的结果相一致。并且发酵脱脂乳和外源添加Kefiran发酵脱脂乳的表观黏度的变化与它们的Zate电位和粒径的变化是一致的。酸乳凝胶形成的主体是原料乳中的酪蛋白。发酵过程中,Kefiran的分泌量在500~700 mg/L[1],因此,其自身黏度对体系总黏度的贡献很小。前期的研究中发现,Kefiran存在羧基和羟基,这是絮凝过程的首选基团[20],因此,引起酸乳凝胶微观结构的差异,与多糖分子大小和结构有很大关系,与含量没有直接关系,这与李全阳等[21]研究结果相一致。

图7 不同溶液表观黏度变化
Fig.7 Comparison of apparent viscosity of various solutions
2.6.2 动态力学分析
2.6.2.1 应变扫描
储能模量(G′)是衡量样品弹性的尺度,用于表示剪切过程中,存储在样品中的变形能量;损耗模量(G″)表示不可逆的衰减的剪切能部分,表示样品的黏性行为。可以观察到两个不同区域:G′和G″几乎恒定的是线性黏弹性区域,此范围内结构中的变形是可逆的;G″和G″发生变化的是非线性区域[17]。所有溶液在线性黏弹性区域都表现出G′>G″的弱黏弹性凝胶特征,这与PRASANNA的结果相一致[19,22]。从图8可以观察到,在线性黏弹性区域内,在酸性体系中,外源添加Kefiran发酵脱脂乳的G′、G″显著高于其他溶液。据报道,在线性黏弹性区域内强凝胶的应变值比弱凝胶高得多[23]。由此说明外源添加Kefiran可以显著增强发酵乳的凝胶强度。当剪切应力增大到某一定值时它开始减少,这一点被定义为该流体的屈服应力,表示对流体结构强度的量度,在许多技术应用和食品加工中被认为是一个重要参数[24]。外源添加Kefiran发酵脱脂乳的屈服应力明显高于其他溶液,说明外源添加Kefiran显著提高了发酵乳的机械强度。

图8 应变对不同溶液黏弹性的影响
Fig.8 Effect of strain on viscoelastic properties of various solutions
2.6.2.2 频率扫描
图9为测试了不同样品溶液不同振动频率时的黏弹性,可以进一步从微观结构运动的角度了解不同溶液体系的性能。随着剪切振荡频率的增加,不同溶液的储能模量(G′)和损耗模量(G″)都表现出不同程度的升高。在酸性体系中,发酵乳和外源添加Kefiran的发酵乳均可观察到主要的弹性行为(G′>G″),这意味着表现出更大的弹性而不是黏性,这与之前的一些结果一致[17,25]。

图9 频率对不同溶液黏弹性的影响
Fig.9 Effect of frequency on viscoelastic properties of various solutions
发酵乳具有弹性或固体状的特征可能是由于在发酵过程中多糖与酪蛋白和乳清蛋白之间的静电相互作用[21]。明显观察到外源添加Kefiran发酵脱脂乳的黏弹性显著高于发酵脱脂乳,可能是由于外源Kefiran在内源Kefiran与酪蛋白凝聚形成稳定的聚合网络过程中占据空间形成壁垒,使发酵乳体系发生改变,导致黏弹性的改变;也可能是Kefiran的加入会使酪蛋白在发酵过程中的聚集程度增高[26],导致更强的弹性结构,GORRET等[27]在P.acidi-propionici产多糖溶液的流变学性质研究中也得到了相类似的结果。
另一方面,脱脂乳溶液明显更依赖于频率,两个模量都具有高斜率。对于酸性体系,尤其是外源添Kefiran发酵脱脂乳的G′和G″对频率的依赖性小得多。这可能意味着外源添加Kefiran的发酵脱脂乳体系具有更高的稳定性,可能是由于外源添加的Kefiran与蛋白质之间的相互作用或者是Kefiran的增稠效果。
3 结论
高分子多糖的长链之间,也可相互作用,形成网络结构。且含有许多糖单位的多糖高分子长链,在介质中会有多种形态,并不断变化。因此,产胞外多糖乳酸菌在发酵过程中,多糖会与乳蛋白发生相互作用,赋予体系一定的物理特性及流变特性。通过对不同体系粒径、电位绝对值、扫描电镜、荧光光谱和流变特性的研究发现,外源添加Kefiran促进了发酵过程,使pH值接近酪蛋白等电点,此时蛋白质容易发生聚集,溶解性降低,造成溶液粒径增大,Zeta电位绝对值减小。而且,由于蛋白的聚集,导致荧光基团内埋,从而荧光强度降低。外源添加Kefiran可以在发酵过程中占据空间,形成的壁垒效应也可以增加酪蛋白的聚集程度,并且由于Kefiran本身的增稠作用,造成外源添加Kefiran发酵脱脂乳的微观结构为在片状结构表面形成了部分网络结构,使得发酵乳表观黏度增加,黏弹性显著增加,对频率的依赖性小,稳定性提高。
[1] 王纯玮, 白英.开菲尔胞外多糖理化性质及其抗氧化特性[J].食品与发酵工业, 2022, 48(21):104-110.
WANG C W, BAI Y.Physicochemical properties and antioxidant properties of Kefiran[J].Food and Fermentation Industries, 2022, 48(21):104-110.
[2] 白英, 刘乃齐.Lactobacillus casei HS4胞外多糖对发酵乳组织结构和流变特性的影响[J].食品科学, 2019, 40(12):145-152.
BAI Y, LIU N Q.Effect of exopolysaccharide produced by Lactobacillus casei HS4 on microstructure and rheological properties of fermented milk[J].Food Science, 2019, 40(12):145-152.
[3] 齐宝坤, 赵城彬, 江连洲, 等.不同热处理温度下大豆11S球蛋白Zeta电位、粒径和红外光谱分析[J].食品科学, 2018, 39(24):54-58.
QI B K, ZHAO C B, JIANG L Z, et al.Analysis of Zeta potential, particle size and infrared spectroscopy of 11S glycinin at different heat treatment temperatures[J].Food Science, 2018, 39(24):54-58.
[4] ZHANG S, VARDHANABHUTI B.Effect of initial protein concentration and pH on in vitro gastric digestion of heated whey proteins[J].Food Chemistry, 2014, 145:473-480.
[5] 段腊梅. 苹果梨渣多糖结构表征及其与乳清蛋白相互作用研究[D].锦州:渤海大学, 2021.
DUAN L M.Structural characterization of polysaccharides from ‘Pingguo’ pear residue and their interactions with whey protein[D].Jinzhou:Bohai University, 2021.
[6] WEINBRECK F, NIEUWENHUIJSE H, ROBIJN G W, et al.Complexation of whey proteins with carrageenan[J].Journal of Agricultural and Food Chemistry, 2004, 52(11):3 550-3 555.
[7] BOUZID H, RABILLER-BAUDRY M, PAUGAM L, et al.Impact of Zeta potential and size of caseins as precursors of fouling deposit on limiting and critical fluxes in spiral ultrafiltration of modified skim milks[J].Journal of Membrane Science, 2008, 314(1-2):67-75.
[8] 赖田甜, 赵华, 姚梦柯, 等.植物乳杆菌NMGL2胞外多糖对其生长特征及发酵乳加工特性的影响[J].中国酿造, 2022, 41(2):113-118.
LAI T T, ZHAO H, YAO M K, et al.Effect of the exopolysaccharide of Lactobacillus plantarum NMGL2 on its growth characteristics and processing characteristics of fermented milk[J].China Brewing, 2022, 41(2):113-118.
[9] 张立永, 贾树妍, 肖光辉, 等.应用Zeta电位研究液态奶的稳定机制[J].中国乳品工业, 2007, 35(12):38-41.
ZHANG L Y, JIA S Y, XIAO G H, et al.Research on the stability mechanism of liquid milk by Zeta potential[J].China Dairy Industry, 2007, 35(12):38-41.
[10] DEMCHENKO A P.Ultraviolet spectroscopy of proteins[M].Berlin:Spring-Verlag, 1986.
[11] 孙亚天, 程志先, 李果, 等.大豆分离蛋白与壳聚糖相互作用的光谱法研究[J].核农学报, 2018, 32(4):723-731.
SUN Y T, CHENG Z X, LI G, et al.Study on the interaction between soybean protein isolate and chitosan by spectroscopic methods[J].Journal of Nuclear Agricultural Sciences, 2018, 32(4):723-731.
[12] CHANG C, WANG T R, HU Q B, et al.Caseinate-zein-polysaccharide complex nanoparticles as potential oral delivery vehicles for curcumin:Effect of polysaccharide type and chemical cross-linking[J].Food Hydrocolloids, 2017, 72:254-262.
[13] ZHAN F C, YANG J C, LI J, et al.Characteristics of the interaction mechanism between tannic acid and sodium caseinate using multispectroscopic and thermodynamics methods[J].Food Hydrocolloids, 2018, 75:81-87.
[14] ADELI M, SAMAVATI V.Studies on the steady shear flow behavior and chemical properties of water-soluble polysaccharide from Ziziphus lotus fruit[J].International Journal of Biological Macromolecules, 2015, 72:580-587.
[15] VARDHANABHUTI B, IKEDA S.Isolation and characterization of hydrocolloids from monoi (Cissampelos pareira) leaves[J].Food Hydrocolloids, 2006, 20(6):885-891.
[16] RUAS-MADIEDO P, TUINIER R, KANNING M, et al.Role of exopolysaccharides produced by Lactococcus lactis subsp.cremoris on the viscosity of fermented milks[J].International Dairy Journal, 2002, 12(8):689-695.
[17] KAZAZI H, KHODAIYAN F, REZAEI K, et al.Rheology and microstructure of kefiran and whey protein mixed gels[J].Journal of Food Science and Technology, 2017, 54(5):1 168-1 174.
[18] 刘乃齐. 乳酸菌胞外多糖对发酵乳流变学特性的影响[D].呼和浩特:内蒙古农业大学, 2018.
LIU N Q.Effect of exopolysaccharides produced by Lactobacillus on rheological properties of fermented milk[D].Hohhot:Inner Mongolia Agricultural University, 2018.
[19] KRISTO E, MIAO Z T, CORREDIG M.The role of exopolysaccharide produced by Lactococcus lactis subsp.cremoris in structure formation and recovery of acid milk gels[J].International Dairy Journal, 2011, 21(9):656-662.
[20] WANG L, GU Y C, ZHENG X Y, et al.Analysis of physicochemical properties of exopolysaccharide from Leuconostoc mesenteroides strain XR1 and its application in fermented milk[J].LWT, 2021, 146:111449.
[21] 李全阳, 夏文水, 祝丽香, 等.一种乳酸菌多糖对酸乳凝胶的影响机理[J].高等学校化学学报, 2007, 28(5):868-871.
LI Q Y, XIA W S, ZHU L X, et al.Influence mechanism of a kind of exopolysaccharides on yogurt curd[J].Chemical Journal of Chinese Universities, 2007, 28(5):868-871.
[22] PRASANNA P H P, GRANDISON A S, CHARALAMPOPOULOS D.Microbiological, chemical and rheological properties of low fat set yoghurt produced with exopolysaccharide (EPS) producing Bifidobacterium strains[J].Food Research International, 2013, 51(1):15-22.
[23] TAN T C, FOO W T, LIONG M T, et al.Comparative assessment of dynamic oscillatory measurements on network development and mechanical spectra of gelatine or gellan in maize starch-egg white composite gels[J].Food Hydrocolloids, 2015, 45:93-101.
[24] HATAMI M, NEJATIAN M, MOHAMMADIFAR M A, et al.Milk protein-gum tragacanth mixed gels:Effect of heat-treatment sequence[J].Carbohydrate Polymers, 2014, 101:1 068-1 073.
[25] KRIVOROTOVA T, SEREIKAITE J, GLIBOWSKI P.Rheological and textural properties of yogurts enriched with Jerusalem artichoke flour[J].Czech Journal of Food Sciences, 2017, 35(5):432-439.
[26] XIONG W F, REN C, TIAN M, et al.Emulsion stability and dilatational viscoelasticity of ovalbumin/chitosan complexes at the oil-in-water interface[J].Food Chemistry, 2018, 252:181-188.
[27] GORRET N, RENARD C M G C, FAMELART M H, et al.Rheological characterization of the EPS produced by P.acidi-propionici on milk microfiltrate[J].Carbohydrate Polymers, 2003, 51(2):149-158.