根据世界肥胖联合会的数据,到2025年全球肥胖人口占比将达到1/3[1]。肥胖是由多种因素引起的能量摄入和消耗之间不平衡引起的脂质沉积,是全球性的健康问题。肥胖会增加罹患2型糖尿病、高血压、冠心病、中风、脂肪肝、痴呆和阻塞性睡眠呼吸暂停等疾病的风险,是隐藏的“健康杀手”,严重的甚至可导致死亡[2]。目前,肥胖的治疗方法主要有药物减肥(奥司利他、利鲁拉肽等)和手术减肥(Roux-en-Y胃旁路术、袖状胃切除术或可调节胃束带),但这些方法疗效有限或副作用严重,采用食疗等调整生活方式的方法控制超重和肥胖受到了广泛的关注。
松花粉是我国药食同源的花粉品种,富含酚类等活性物质。研究表明,松花粉具有保护肝脏、调节免疫、保护卵巢等功效[3-4]。马尾松花粉可显著控制小鼠的体重增长并改善体内脂质代谢水平,且酚类成分可能是控制肥胖的有效成分[5]。然而,前期研究发现,松花粉中的酚类活性成分大多以结合态形式存在[6],导致其无法充分地发挥功效。微生物发酵可以促进活性物质的释放及转化,如XIE等[7]采用发酵的方法提升了脱脂米糠不溶性膳食纤维中阿魏酸、p-香豆酸的含量,![]() 等[8]用乳酸菌发酵蜂花粉,提升了柚皮素(naringenin,NAR)、槲皮素、木犀草素和芦丁的含量。为了使松花粉中的活性成分充分释放出来从而更好地被吸收利用,目前多将细胞壁破碎使其内容物释放出来,但释放出来的以结合态存在的酚类等活性成分仍然难以被吸收利用。
等[8]用乳酸菌发酵蜂花粉,提升了柚皮素(naringenin,NAR)、槲皮素、木犀草素和芦丁的含量。为了使松花粉中的活性成分充分释放出来从而更好地被吸收利用,目前多将细胞壁破碎使其内容物释放出来,但释放出来的以结合态存在的酚类等活性成分仍然难以被吸收利用。
本文采用具有丰富酶系的食用真菌米根酶发酵松花粉,采用HPLC分析了发酵前后松花粉提取物中的酚类成分含量。采用3T3-L1细胞模型,研究了发酵前后的松花粉提取物对其分化因子:CCAAT/增强子结合蛋白α(enhancer binding proteins alpha,C/EBPα)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ),脂肪合成因子:脂肪酸合酶(fatty acid synthase,FAS),脂解因子:激素敏感性脂肪酶(hormone-sensitive lipase,HSL)、脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)以及脂肪酸氧化因子:过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor gamma alpha,PPARα)的影响规律,进一步探讨了其中的主要酚类成分柚皮素对上述因子的影响,并探讨了松花粉提取物降脂的可能机制。
1 材料与方法
1.1 材料与试剂
松花粉,烟台新时代健康产业有限公司;米根霉(Rhizopus oryzae,3010),中国工业微生物菌种保藏管理中心;3T3-L1细胞,中国科学院昆明细胞库;原儿茶酸、花旗松素、柚皮素等酚类物质标准品, 美国Sigma公司;DMEM高糖培养基,美国Gibco公司;胎牛血清(fatal bovine serun,FBS)、小牛血清(newborn calf serum,NBCS),乌拉圭Lonsera公司;牛胰岛素(insulin,INS)、地塞米松(Dexamethasone,DEX)、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX),上海源叶生物科技有限公司;PCR引物,生工生物工程(上海)股份有限公司;HRP标记兔抗小鼠一抗、HRP 标记山羊抗兔二抗,美国Proteintech公司。
1.2 设备与仪器
ZQZY-78AV恒温摇床,上海知楚生物科技有限公司;SCIENTZ-50F/A冷冻干燥机、SB5200超声波清洗机,宁波新芝生物科技有限公司;Trans-Blot Turbo半干转印系统、164-5050基础电源电泳仪、165-8003小型垂直电泳槽,美国伯乐公司;Line Gene 9600 Plus实时荧光定量PCR(quantitative real-time PCR,q-PCR)检测系统, 杭州博日科技股份有限公司;4600SF全自动化学发光系统, 上海天能科技有限公司。
1.3 实验方法
1.3.1 米根霉菌孢子悬液的制备
将4 ℃保藏的米根霉取出,28 ℃培养24 h,然后在麦芽浸粉肉汤(malt extract broth,MEB)平板划线培养4~7 d,待长满白色菌丝后,刮取孢子并重悬于100 mL无菌水,充分振荡并适度稀释至106个孢子/mL备用。
1.3.2 发酵工艺流程
按1∶20(g∶mL)的料液比配制松花粉液体培养基,即松花粉6.5 g,溶于130 mL去离子水(用磷酸氢二钠、柠檬酸缓冲液调节体系pH为6.6),85 ℃灭菌30 min,立即冷却至室温。从孢子悬液中以10%(体积分数)的接种量接种至灭菌好的松花粉液体培养基中,以30 ℃、180 r/min的方式摇瓶发酵4 d。
1.3.3 发酵前后松花粉提取物的制备
发酵松花粉样品(fermented pine pollen,FPP)的制备:发酵结束后(发酵工艺见1.3.1)以5 000 r/min,离心15 min,固液分离,取沉淀部分,用70%(体积分数)乙醇在45 ℃下超声搅拌3 h(料液比1∶20,g∶mL),重复提取3次,合并滤液,40 ℃旋蒸除去乙醇,冻干,得到提取物。
未发酵松花粉样品(unfermented pine pollen,NFPP)的制备:除未接菌外,其余操作同FPP样品制备保持一致。
1.3.4 松花粉提取物的物质组成及酚类物质的定性定量分析
根据GB/T 15672—2009 《食用菌中总糖含量的测定》、CHENG等[6]的总酚和总黄酮测定方法、GB 5009.5—2016 《食品中蛋白质的测定》、GB 5009.4—2016《食品中灰分的测定》,并进行适当修改,对发酵前后松花粉提取物的总糖、总酚、总黄酮、总蛋白以及灰分进行了测定。
采用HPLC-PDA分析松花粉发酵前后酚类物质的种类和含量。色谱柱:X-Bridge(250 mm×4.6 mm,5 μm),柱温35 ℃,进样量10 μL,检测波长200~600 nm;流动相:B相:0.1%甲酸,C相:乙腈,流速1.0 mL/min。洗脱方法:0~6.0 min,5%~25% C;6.0~15.0 min,25%~40% C;15.0~18.0 min,40%~70% C;18.0~20.0 min, 70%~100% C。
1.3.5 3T3-L1细胞诱导分化
将3T3-L1细胞以1×105个/孔的密度接种到6孔板,培养48 h,细胞达到接触抑制后,换用诱导培养基 Ⅰ(含0.5 mmol/L IBMX、1 μmol/L DEX、10 μg/mL INS和10% FBS)诱导分化2 d。换用诱导培养基Ⅱ[含10 μg/mL INS、10%FBS以及200、400 μg/mL的发酵前后松花粉提取物或100 μg/mL的绿原酸(chlorogenic acid, CGA)]继续诱导分化8 d。
1.3.6 CCK-8法测定细胞活力
将处于对数生长期的3T3-L1细胞以105个/mL的密度接种于96孔板中,置于37 ℃、5%CO2的培养箱培养24 h,更换含不同质量浓度的发酵前后松花粉(0、50、100、200、400、800 μg/mL)的DMEM培养基,继续培养48 h。每孔加入10 μL的CCK-8溶液,37 ℃反应1 h,测OD450值,细胞活力的计算如公式(1)所示:
细胞活力![]()
(1)
式中: A为450 nm的吸光值。
1.3.7 油红O染色及细胞脂质含量的测定
分化结束后,细胞用PBS洗涤2次,用4%的多聚甲醛固定10 min,PBS漂洗2次;加入改良油红O染液,染色30 min,吸取多余的染液后,PBS冲洗2次,在倒置显微镜下拍照。用100%(体积分数)异丙醇提取细胞脂质,测OD520值表征细胞脂质含量。
1.3.8 NFPP和FPP对3T3-L1细胞脂质代谢相关基因的q-PCR分析
取诱导分化完成的细胞,诱导分化过程同1.2,PBS洗去未贴壁细胞,吸去上清液,冰浴,加入500 μL的buffer RL试剂,裂解细胞,根据诺唯赞试剂盒说明书提取细胞mRNA,使用反转录试剂盒完成反转录,得到cDNA。引物合成由生工生物工程(上海)股份有限公司完成,引物序列如表1所示,测定PPARγ、FAS、C/EBPα、PPARα、HSL、ATGL和内参GAPDH的基因转录情况。
表1 q-PCR目的基因的基因序列
Table 1 The primer sequence of q-PCR target gene

基因类别序列PPARγF:5′-AGAACCTGCATCTCCACCTTAT-3′R:5′-CCACAGACTCGGCACTCAAT-3′FASF:5′-ACCCTGACCCAGAATACCAAG-3′R:5′-GTCAACAACCATAGGCGATTT-3′C/EBPαF:5′-GGCTCCTAATCCCTTGCTTTT-3′R:5′-CTCTGTCTCCTACCACATGGCT-3′PPARαF:5′-ACATTGTGTAATCCTGGTGGTG-3′R:5′-CTGGCTGTCCTGGAACTTGCTATG-3′HSLF:5′-CCAGCCTGAGGGCTTACTG-3′R:5′-CTCCATTGACATCTCG-3′ATGLF:5′-CAACGCCACTCACATCTACGG-3′R:5′-GGACACCTCAATAATGTTGGCAC-3′
1.3.9 Western blot分析
收集诱导分化结束的细胞,RIPA裂解液冰上裂解30 min。裂解液以12 000 r/min离心10 min,取上清液。BCA试剂盒进行蛋白定量后,制备电泳样品。电泳结束后,进行半干转。室温封闭聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)1 h。封闭结束,用TBST洗涤液洗涤2~3次,随后进行抗体孵育(一抗4 ℃过夜孵育,二抗室温孵育1.5 h)。TBST洗涤3次后,将PVDF膜进行化学发光显影。
1.3.10 统计学分析
所有实验数据采用Statistix 9软件进行统计学分析,结果均以平均值±标准偏差(standard deviation,SD)的形式表示,每个实验重复3次。数据差异的显著性采用t检验进行分析,当P<0.05,则差异显著,用大写字母表示显著性差异。
2 结果与分析
2.1 发酵前后松花粉的物质组成和含量
如表2所示,发酵后松花粉提取物的总糖、总蛋白、总酚以及总黄酮含量(P<0.05)都显著增加,由于蛋白和多糖等大分子组分难以进入3T3-L1细胞,且前人研究发现在3T3-L1细胞中起到降脂功效的多为酚类等小分子物质[9-10],因此以酚类物质为主要研究对象。采用HPLC对发酵前后松花粉提取物的酚类物质进行了定性和定量分析,结果同CHENG等[6]的研究大致相同,如图1和表3所示,经米根霉发酵后,松花粉中酚类的种类无变化,但含量发生了显著变化。与NFPP相比,米根霉发酵组(FPP)中的原儿茶酸、对香豆酸、花旗松素以及柚皮素的含量分别增加了176.30%、10.42%、88.43%和326.75%,儿茶素的含量降低了32.51%,酚类物质的总量从2 091.63 μg/g 增加到3 685.62 μg/g,其中柚皮素含量增加最为明显,从475.06 μg/g增加到了2 027.30 μg/g。WANG等[11]的研究表明,柚皮素以糖苷键和细胞壁中的纤维素结合,而微生物可通过产纤维素酶或葡萄糖苷酶等水解酶使和细胞壁结合的柚皮素释放出来。米根霉可产葡萄糖淀粉酶(可水解α-1,3、α-1,4和α-1,6葡萄糖苷键)、α-淀粉酶(1,4-α-D-葡聚糖水解酶)、蛋白酶等,故酚类物质尤其是柚皮素含量的增加可能是由于米根霉发酵过程中产生的酶使结合酚类物质部分游离出来。YEO等[12]通过米根霉发酵扁豆壳,使得存在于小扁豆壳中的不溶性结合酚类物质木犀草素、顺式阿魏酸和反式阿魏酸显著减少,并有效地转化为可溶性酚类物质。
表2 发酵前后松花粉提取物的物质组成
Table 2 Composition of NFPP and FPP

样品总糖/(mg·g-1)总酚/(mg GAE·g-1)总黄酮/(mg RE·g-1)总蛋白/[g·(100 g)-1]灰分/[g·(100 g)-1]NFPP98.47±2.55B7.57±0.10B5.22±0.11B7.85±0.08B2.05±0.07AFPP108.38±1.59A14.21±0.20A9.86±0.13A9.70±0.16A1.72±0.03B
注:结果以提取物质量计;总酚含量以等量没食子酸(gallic acid,GAE)表示,总黄酮含量以等量芦丁(rutin,RE)表示;不同大写字母表示差异显著(P<0.05)(下同)
表3 发酵前后松花粉的酚类组成和含量 单位:μg/g干基
Table 3 Qualitative and quantitative of polyphenols of NFPP and FPP

样品原儿茶酸儿茶素对香豆酸花旗松素柚皮素总含量NFPP162.38±1.55B1 160.80±20.72A162.31±0.66B131.08±0.22B475.06±4.15B2 091.63±27.29BFPP448.66±3.13A783.44±1.43B179.23±1.33A246.99±2.27A2 027.30±0.61A3 685.62±2.52A

图1-原儿茶酸;2-儿茶素;3-对香豆酸;4-花旗松素;5-柚皮素 a-NFPP;b-FPP;c-标品图
图1 发酵前后松花粉酚类物质的高效液相色谱图
Fig.1 HPLC chromatograms of polyphenols in NFPP and FPP
2.2 发酵前后松花粉提取物对3T3-L1细胞活力的影响
3T3-L1前脂肪细胞系经诱导分化可成为成熟的脂肪细胞,是研究脂肪生成的经典细胞系,在雷公藤三萜、甜菊苷脂代谢影响研究中已较好得到应用[13-14]。用CCK-8法研究了发酵前后松花粉提取物对3T3-L1细胞活力的影响,当用NFPP组和FPP处理3T3-L1细胞48 h时,NFPP组和FPP组的细胞活力在质量浓度为0~400 μg/mL时均接近100%,且与空白组无显著差异。因此,选择200 μg/mL和400 μg/mL 进行后续实验。
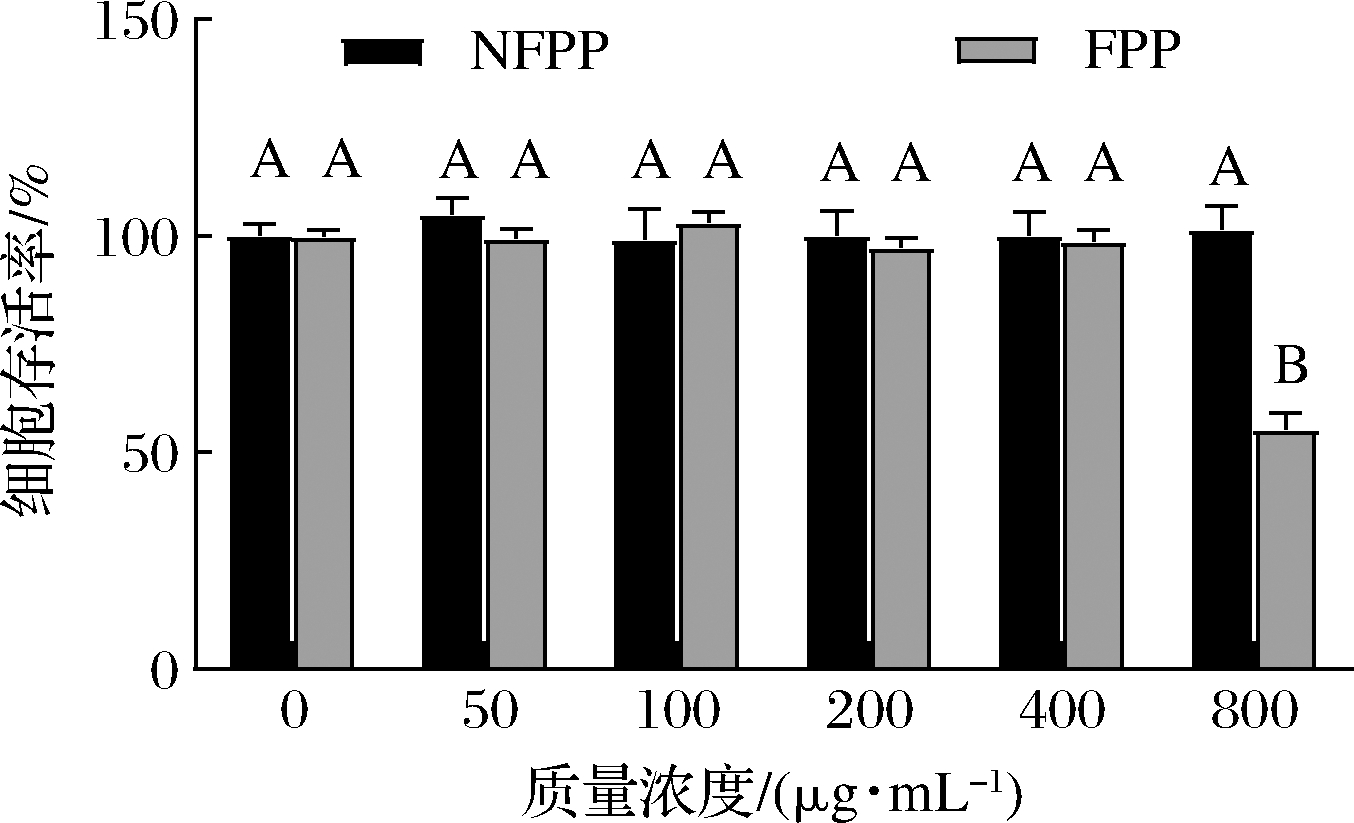
图2 NFPP和FPP对3T3-L1 细胞活力的影响
Fig.2 The effects of NFPP and FPP on 3T3-L1 cells viability 注:不同大写字母代表差异显著(P<0.05)(下同)
2.3 NFPP和FPP对 3T3-L1细胞脂质积累的抑制作用
前脂肪细胞诱导分化为成熟脂肪细胞的过程中会导致脂质积聚。因此,抑制分化有助于减少脂质的形成。油红O染色可直观显示出脂肪细胞的脂质积累程度。图3为3T3-L1细胞经NFPP和FPP处理的油红O染色图及脂质定量结果。在图3-a中,空白对照组脂质积累为100%,阳性对照组中(100 μg/mL的绿原酸处理3T3-L1细胞),脂肪细胞中有脂质积累,但脂质积累减少到了空白组的49.50%。与空白对照组相比,用发酵前后松花粉提取物处理的脂肪细胞中的脂滴数量减少,且FPP处理组的细胞脂滴数量少于NFPP组。如图3-b所示,与正常3T3-L1脂肪细胞(空白对照)相比,发酵前后松花粉提取物在不同质量浓度(200、400 μg/mL)下均可显著减少3T3-L1脂肪细胞中的脂质积累,呈现剂量依赖,且FPP组抑制3T3-L1细胞的脂质积累作用显著优于NFPP组(P<0.05),在400 μg/mL的作用浓度下,脂质积累仅为57.59%。与NFPP组相比,FPP组显示对3T3-L1脂肪细胞中脂质积累的良好抑制作用,可能通过抑制细胞分化、促进脂质分解等途径起效。
2.4 NFPP和FPP对脂质代谢相关基因表达的影响
为了探讨FPP抑制 3T3-L1成熟脂肪细胞脂质积累的可能机制,以100 μg/mL的绿原酸作为阳性对照,对3T3-L1细胞中脂代谢相关基因的mRNA表达水平进行了检测。C/EBPα、PPARγ是前脂肪细胞分化为成熟脂肪细胞的关键调控因子,通过调控细胞内糖代谢相关基因的表达,从而直接参与细胞分化[15]。如图4-a和图4-b所示,与NFPP组相比,低质量浓度的FPP组(200 μg/mL)可显著下调分化基因C/EBPα和PPARγ(P<0.05),且随着浓度的增加,基因的表达量逐渐减少,可以有效抑制3T3-L1细胞分化从而减少脂质积累。对于FAS,NFPP组和FPP组皆无明显影响。
HSL和ATGL是脂肪分解的限速酶,激活两者可促进TG分解[16]。PPARα可促进脂肪酸(甘油三酯分解得到)氧化成CO2和H2O [17]。如图4-d~图4-f所示,NFPP组、FPP组在200 μg/mL质量浓度下,HSL、ATGL和PPARα均显著增加(P<0.05),FPP组的基因表达量高于NFPP组,且在400 μg/mL的质量浓度下,FPP组的3个基因表达量分别为空白对照组的6.37、7.91、10.89倍。综上,FPP组能抑制C/EBPα和PPARγ的表达,促进ATGL、HSL和PPARα的表达,从而更好地抑制3T3-L1细胞分化,减少脂质积累。
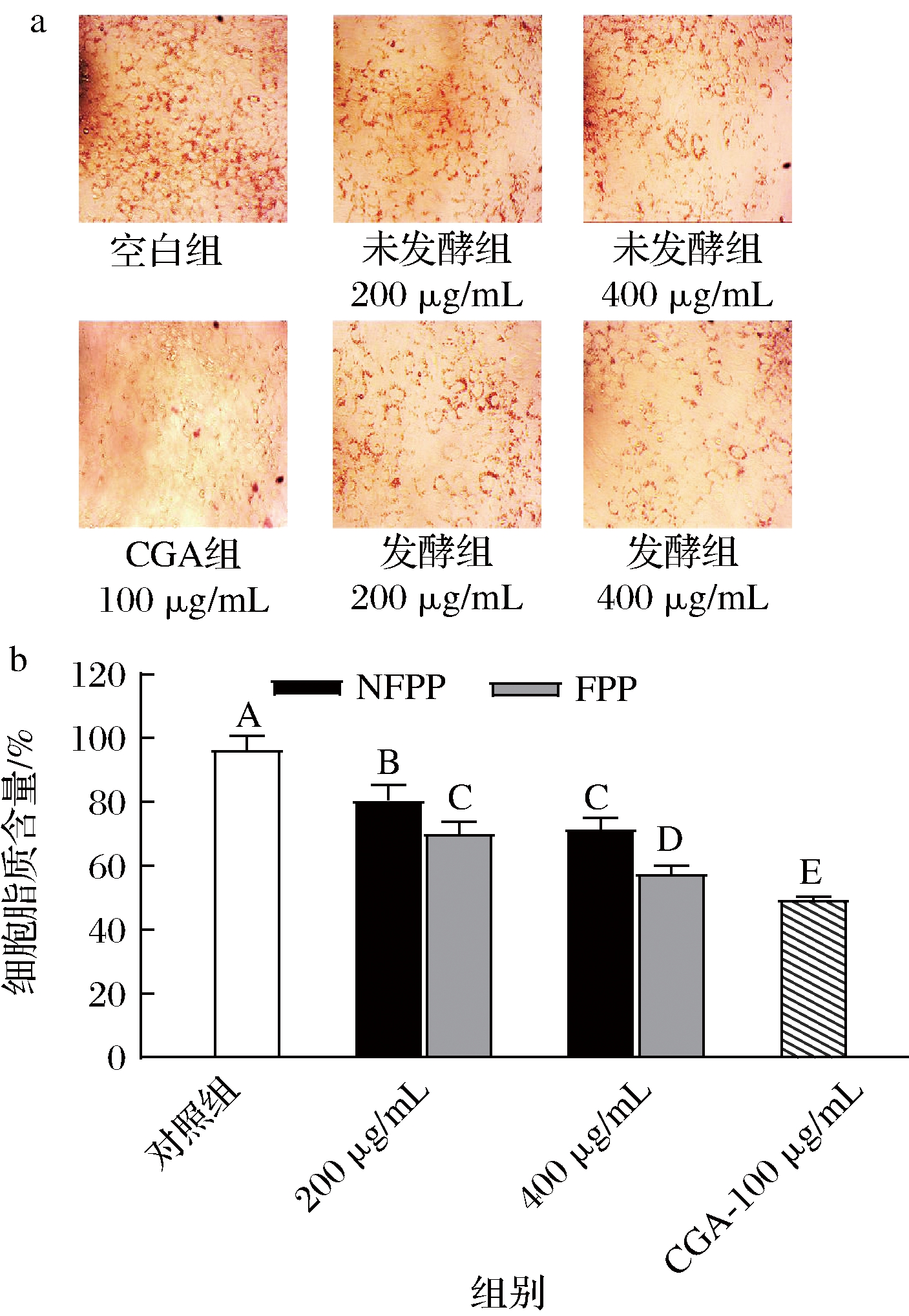
a-油红O染色图(200×);b-细胞脂质含量
图3 NFPP和FPP对 3T3-L1 细胞脂质积累的抑制作用
Fig.3 The Inhibitory effect of NFPP and FPP on the accumulation of lipids in 3T3-L1 cells

a-C/EBPα;b-PPARγ;c-FAS;d-HSL;e-ATGL;f-PPARα
图4 NFPP和FPP对3T3-L1细胞脂质代谢相关基因表达的影响
Fig.4 The effects of NFPP and FPP on mRNA expression of lipid metabolism-related genes in 3T3-L1 cells
2.5 NFPP和FPP对脂质代谢相关蛋白表达的影响
为进一步验证2.4所得的FPP组优于NFPP组的降脂效果,使用Western-blot分析检测CEBP/α、PPARγ、FAS以及PPARα、ATGL、HSL的蛋白表达量。结果如图5所示,趋势与2.4几乎一致,与NFPP组相比,FPP组能显著减少分化蛋白PPARγ、C/EBPα,增加PPARα、HSL和ATGL的蛋白表达量,且呈现一定的剂量依赖性。除FPP低质量浓度组(200 μg/mL),其余样品组对FAS几乎没有效果。通过2.4和2.5的结果,发现FPP可能通过增强对3T3-L1细胞的抑制分化作用和促进脂质分解、脂肪酸氧化的方式来达到良好的降脂效果。
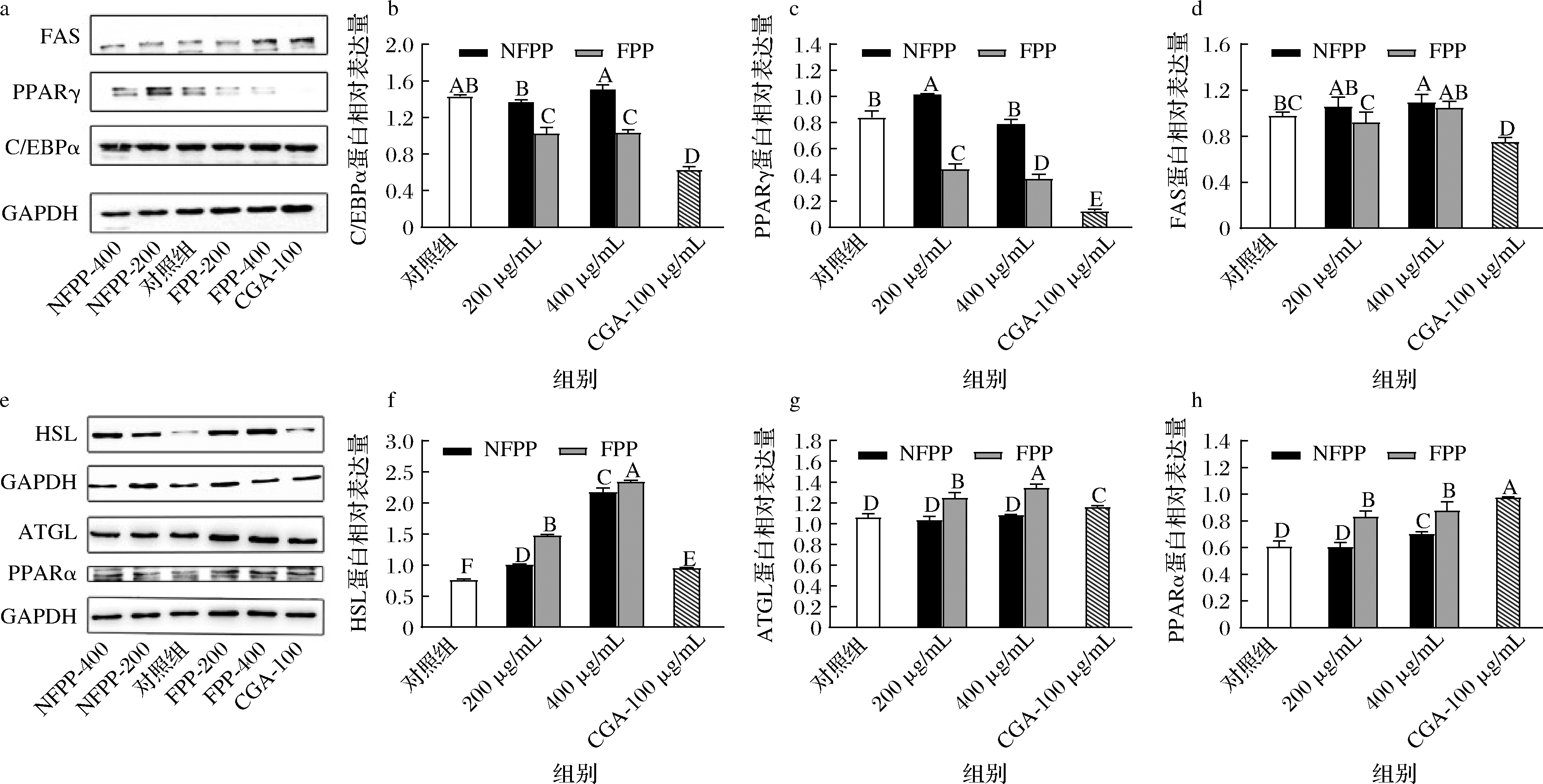
a-FAS、PPARγ和C/EBPα的Western-blot图;b-C/EBPα;c-PPARγ;d-FAS;e-PPARα、ATGL和HSL的Western-blot图; f-HSL;g-ATGL;h-PPARα
图5 NFPP和FPP对3T3-L1细胞脂质代谢相关蛋白表达的影响
Fig.5 The effects of NFPP and FPP on expression of lipid metabolism-related proteins in 3T3-L1 cells
2.6 NFPP和FPP对3T3-L1 细胞腺苷酸活化蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)磷酸化的影响
AMPK是一种调节脂质和葡萄糖代谢的代谢能量传感器,它通过增加细胞单磷酸腺苷(adenosine monophosphate,AMP)水平而被激活,并对细胞代谢产生影响。AMPK的激活可以抑制合成代谢反应,激活分解代谢反应,减少葡萄糖、脂肪酸、胆固醇和甘油三酯的合成和贮存,是预防肥胖的重要信号通路[18]。为了探究FPP降脂效果增强的机制,使用Western blot分析检测AMPKα、AMPKβ1以及乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)的磷酸化水平。如图6所示,用不同质量浓度的FPP(200、400 μg/mL)处理的3T3-L1细胞,AMPKα、AMPKβ1和ACC的磷酸化程度均高于NFPP,说明FPP可能能更好地激活AMPK信号通路,可能是由于FPP组的总酚含量高于NFPP组。有研究发现,发酵增加的原儿茶酸、花旗松素、对香豆酸和柚皮素均可通过激活AMPK信号通路发挥降脂作用[19-21]。
2.7 探究FPP组呈现良好降脂效果的可能原因
根据2.1对NFPP和FPP组的酚类定性定量结果可知,FPP组酚类物质含量显著高于NFPP组(P<0.05),其中柚皮素增幅最大(326.75%)。因此推测,FPP组降脂效果优于NFPP组的可能原因主要是由于柚皮素等酚类物质的增加,故选取1.5 μmol/L、3.0 μmol/L(FPP组400 μg/mL质量浓度下的柚皮素含量)对PPARγ、C/EBPα、ATGL、HSL和PPARα这几个变化最明显的蛋白进行Western blot分析。
结果表示,柚皮素可抑制C/EBPα、PPARγ蛋白在细胞分化时期的表达,PPARγ在3.0 μmol/L的浓度下起效。如图7-d、图7-e所示,1.5 μmol/L的柚皮素即可促进PPARα、ATGL的表达并呈现剂量依赖性。MOSQUEDA-SOLIS等[22]发现柚皮素对3T3-L1前脂肪细胞的抗成脂作用较强,在1.0 μmol/L时可有效减少甘油三酯的含量[(24.8±5.0)%]。BURKE等[23]发现与对照组(仅接受高脂肪饮食)相比,含有柚皮素的实验性饮食降低了血脂、促进脂解和脂肪酸动员基因Pnpla2 (ATGL) 的表达。此外ZHANG等[24]探究柚皮素对高脂饮食C57BL/6 J小鼠的降脂效果,发现柚皮素可以增强PPARα、ATGL表达,和本文研究结果相符。HSL蛋白在柚皮素的两个剂量浓度下,和空白对照组相比均无显著差异,说明FPP组促进HSL蛋白增加的原因可能是其他酚类物质产生的作用。综上,柚皮素处理细胞后,影响脂肪生成以及脂肪分解代谢相关蛋白的表达,从而防止脂质积累,上述蛋白的表达趋势和FPP组的结果一致,侧面印证了主要是由于柚皮素等酚类增加导致的功能活性提高的猜测。

a-Western-blot图;b-相对AMPKα表达量;c-相对AMPKβ1表达量;d-相对ACC表达量
图6 Western-blot检测不同质量浓度(200、400 μg/mL)的NFPP和FPP对3T3-L1细胞AMPK通路的影响及相对灰度分析图
Fig.6 Western-blot detection of the expression of AMPK signaling pathway in 3T3-L1 cells treated with (200, 400 μg/mL) of NFPP and FPP and their relative grayscale analysis

a-Western-blot图;b-C/EBPα;c-PPARγ;d-HSL;e-ATGL;f-PPARα
图7 柚皮素(1.5、3.0 μmol/L)对3T3-L1细胞脂质代谢相关蛋白表达的影响
Fig.7 The effects of naringenin (1.5, 3.0 μmol/L) on expression of lipid metabolism-related proteins in 3T3-L1 cells
3 结论
本研究用米根霉发酵松花粉,增加了多酚含量的释放。与NFPP相比,FPP可减少3T3-L1细胞的脂质积累,并可能通过增强对3T3-L1细胞的抑制分化作用和促进脂质分解、脂肪酸氧化并激活AMPK通路的方式起效。进一步探究了FPP具有更优降脂功效的原因可能是由于发酵导致的柚皮素等酚类物质释放后其含量大幅升高(柚皮素减少蛋白PPARγ、C/EBPα,增加PPARα和ATGL的表达)。该研究结果将为增强松花粉降脂功效提供一定的理论依据和指导,并促进松花粉的深加工。
[1] XU Y, MISHRA S.Obesity-linked cancers:Current knowledge, challenges and limitations in mechanistic studies and rodent models[J].Cancers, 2018, 10(12):523.
[2] CHOOI Y C, DING C, MAGKOS F.The epidemiology of obesity[J].Metabolism, 2019, 92(3):6-10.
[3] 何毓婕, 曲涛, 王桐, 等.松花粉对环磷酰胺致卵巢早衰大鼠的卵巢保护作用[J].天然产物研究与开发, 2022, 34(6):1 005-1 013.
HE Y J, QU T, WANG T, et al.Protective effect of pine pollen on ovaries of rats with premature ovarian failure induced by cyclophosphamide[J].Natural Product Research and Development, 2022, 34(6):1 005-1 013.
[4] GENG Y, XING L, SUN M M, et al.Immunomodulatory effects of sulfated polysaccharides of pine pollen on mouse macrophages[J].International Journal of Biological Macromolecules, 2016, 91:846-855.
[5] SONG X A, WANG Y L, GUAN R, et al.Effects of pine pollen wall on gut microbiota and biomarkers in mice with dyslipidemia[J].Phytotherapy Research, 2021, 35(4):2 057-2 073.
[6] CHENG Y, QUAN W, QU T, et al.Effects of (60) Co-irradiation and superfine grinding wall disruption pretreatment on phenolic compounds in pine (Pinus yunnanensis) pollen and its antioxidant and α-glucosidase-inhibiting activities[J].Food Chemistry, 2021, 345:128808.
[7] XIE J Y, LIU S A, DONG R H, et al.Bound polyphenols from insoluble dietary fiber of defatted rice bran by solid-state fermentation with Trichoderma viride:Profile, activity, and release mechanism[J].Journal of Agricultural and Food Chemistry, 2021, 69(17):5 026-5 039.
[8] ![]() V,
V, ![]() K, et al.The impact of fermentation on bee pollen polyphenolic compounds composition[J].Antioxidants, 2022, 11(4):645.
K, et al.The impact of fermentation on bee pollen polyphenolic compounds composition[J].Antioxidants, 2022, 11(4):645.
[9] LES F, C SEDAS G, VALERO M S, et al.Rock tea (Jasonia glutinosa (L.) DC.) polyphenolic extract inhibits triglyceride accumulation in 3T3-L1 adipocyte-like cells and obesity related enzymes in vitro[J].Food &Function, 2020, 11(10):8 931-8 938.
SEDAS G, VALERO M S, et al.Rock tea (Jasonia glutinosa (L.) DC.) polyphenolic extract inhibits triglyceride accumulation in 3T3-L1 adipocyte-like cells and obesity related enzymes in vitro[J].Food &Function, 2020, 11(10):8 931-8 938.
[10] RODRIGUEZ LANZI C, PERDICARO D, BOTTINI R, et al.Grape pomace extract, rich in polyphenols, stimulate the emergence of brown-like cells in white adipose tissue in spontaneously hypertensive rats and in 3T3-L1 adipocytes[J].Free Radical Biology and Medicine, 2017, 108:S83.
[11] WANG Z Y, LI S Y, GE S H, et al.Review of distribution, extraction methods, and health benefits of bound phenolics in food plants[J].Journal of Agricultural and Food Chemistry, 2020, 68(11):3 330-3 343.
[12] YEO J, TSAO R, SUN Y, et al.Liberation of insoluble-bound phenolics from lentil hull matrices as affected by Rhizopus oryzae fermentation:Alteration in phenolic profiles and their inhibitory capacities against low-density lipoprotein (LDL) and DNA oxidation[J].Food Chemistry, 2021, 363:130275.
[13] CHOI S K, PARK S, JANG S, et al.Cascade regulation of PPARγ2 and C/EBPα signaling pathways by celastrol impairs adipocyte differentiation and stimulates lipolysis in 3T3-L1 adipocytes[J].Metabolism, 2016, 65(5):646-654.
[14] PARK M, BAEK H, HAN J Y, et al.Stevioside enhances the anti-adipogenic effect and β-oxidation by activating AMPK in 3T3-L1 cells and epididymal adipose tissues of db/db mice[J].Cells, 2022, 11(7):1076.
[15] MOSETI D, REGASSA A, KIM W K.Molecular regulation of adipogenesis and potential anti-adipogenic bioactive molecules[J].International Journal of Molecular Sciences, 2016, 17(1):124.
[16] ZHANG X A, ZHANG C C, YANG H, et al.An epistatic interaction between Pnpla2 and lipe reveals new pathways of adipose tissue lipolysis[J].Cells, 2019, 8(5):395.
[17] YE R, SCHERER P E.Tissue-specific functions of PPARα overexpression in liver, adipose, and pancreatic β Cells[J].Diabetes, 2019, 68(S1):180.
[18] CANBOLAT E, CAKIROGLU F P.The importance of AMPK in obesity and chronic diseases and the relationship of AMPK with nutrition:A literature review[J].Critical Reviews in Food Science and Nutrition, 2023, 63(14):449-456.
[19] HAN L, YANG Q, LI J, et al.Protocatechuic acid-ameliorated endothelial oxidative stress through regulating acetylation level via CD36/AMPK pathway[J].Journal of Agricultural and Food Chemistry, 2019, 67(25):7 060-7 072.
[20] KANG S W, KANG S I, SHIN H S, et al.Sasa quelpaertensis Nakai extract and its constituent p-coumaric acid inhibit adipogenesis in 3T3-L1 cells through activation of the AMPK pathway[J].Food and Chemical Toxicology, 2013, 59:380-385.
[21] YANG Y, WU Y, ZOU J, et al.Naringenin attenuates non-alcoholic fatty liver disease by enhancing energy expenditure and regulating autophagy via AMPK[J].Frontiers in Pharmacology, 2021, 12:687095.
[22] ![]() A, LASA A, G
A, LASA A, G MEZ-ZORITA S, et al.Screening of potential anti-adipogenic effects of phenolic compounds showing different chemical structure in 3T3-L1 preadipocytes[J].Food &Function, 2017, 8(10):3 576-3 586.
MEZ-ZORITA S, et al.Screening of potential anti-adipogenic effects of phenolic compounds showing different chemical structure in 3T3-L1 preadipocytes[J].Food &Function, 2017, 8(10):3 576-3 586.
[23] BURKE A C, TELFORD D E, EDWARDS J Y, et al.Naringenin supplementation to a chow diet enhances energy expenditure and fatty acid oxidation, and reduces adiposity in lean, pair-fed ldlr-/- mice[J].Molecular Nutrition &Food Research, 2019, 63(6):1800833.
[24] ZHANG S, LI J J, SHI X Y, et al.Naringenin activates beige adipocyte browning in high fat diet-fed C57BL/6 mice by shaping the gut microbiota[J].Food &Function, 2022, 13(19):9 918-9 930.