印楝(Azadirachta indica)为楝科楝属常绿乔木,原产于印度、孟加拉、泰国、尼泊尔和巴基斯坦,适宜生长在热带和亚热带地区,具有喜温耐旱的特性[1-2]。印楝在印度作为药用植物已有4 000多年的历史,其种子、枝叶和树皮长期以来广泛用于医药、农药及日化产品等领域。印度人民用印楝树枝清洁牙齿、将印楝叶作为补品食用,并将印楝叶放置在橱柜、粮仓和书本中,用以避免蚊虫[3]。印楝在传统上也被广泛应用于印度阿育吠陀医学体系,用于治疗不治之症,因此印楝在印度被视为“神树”和“乡村药房”[4]。目前已知的印楝药用价值包括抗过敏、抗炎、抗真菌、退热、利尿、杀虫等,且研究表明其对人类、动物、鸟类、益虫和蚯蚓无害,已被美国环境保护署批准用于食品[5]。因其出色的药用价值,印楝被联合国宣布为“21世纪之树”[2]。
印楝树中分离提取出包括印楝素、沙拉宁、楝素、缬氨酸和其他衍生物等200多种化合物,其中印楝鲜叶中含有的化合物超过50%[6]。印楝鲜叶约含有60%的水分、23%的碳水化合物、7.7%~18.73%的总灰分、7%以上的矿物质、7%的蛋白质、0.89%~3.96%的钙和0.10%~0.30%的磷。印楝叶富含脂肪酸和氨基酸,还含有印楝素、抗坏血酸、槲皮素、黄酮、多酚、水杨酸等多种有效成分[7]。
印楝叶及其提取物具有广泛的药理活性,如:抗氧化[6]、诱导肿瘤细胞的凋亡[8-9]、抗突变、抗病毒、抗菌[10]、抗高血糖和抗高血压[11-12]、抗炎解热[13]、抗溃疡[14]、免疫调节[15-16]和保护心脏肝脏[17-18]等。此外,印度部落用印楝叶治疗寄生虫[19]、致病线虫[20]和皮肤病(如骆驼疥癣感染[19]、真菌感染和小反刍动物出血[21]等),并用作天然洗发水和眼部清洁剂。在印度乌塔拉坎德,印楝叶提取物被用来辨认蛇是否具有毒性[22]。泰米尔纳德邦西印度群岛的帕利亚尔人用印楝叶制成的汤剂治疗发烧[23]。此外,印楝叶可用来制备杀虫剂[24]。
萜类化合物、生物碱、黄酮类化合物和苷类化合物是印楝叶中主要的活性成分,它们具有抗氧化和抗炎等作用,其中的印楝素、柠檬苦素、黄柏酮等柠檬苦素类化合物具有显著抗癌活性和高自由基清除活性[25]。印楝叶的药理活性,特别是显著的抗氧化活性使其可作为保健品来增强人体抵抗力,但由于印楝叶具有强烈苦味,目前尚未将其开发为饮品。本文旨在研究降低印楝叶苦味的加工工艺,并建立印楝叶苦味特征物质检测方法,探究不同加工工艺对印楝叶苦味物质的去除效果。进一步利用印楝叶为主要原料,优化筛选拼配茶、果和甜味剂种类,在改善印楝叶苦味的同时保留印楝叶的药理活性,制备一种值得开发利用的新式功能茶饮品。
1 材料与方法
1.1 材料与试剂
印楝叶鲜叶、蔗糖、阿斯巴甜、三氯蔗糖、枸杞、山楂、金银花、三七、茉莉花干、玫瑰花干、绞股蓝、甘草、青钱柳茶、苦荞麦、蒲公英根、珍稀白茶、野生绿茶、瑞草园绿茶、黄山毛峰、四海绿茶、崂山绿茶、白河春燕、润思六安瓜片、信阳毛尖、生态茶红茶、SAN-CHA TEA、金骏眉、十八岁红茶、大吉岭红碎茶、四海红美人、三融速溶绿茶、三融速溶茉莉花茶、三融速溶红茶、三融速溶普洱、茉莉花茶、铁观音、黄大茶、福鼎老白茶、甜叶菊、冻干芒果果干、冻干白桃果干、冻干黄桃果干、冻干草莓果干、冻干金桔果干、尼龙抽线茶包、纯棉纱布抽线茶包、无纺布抽线茶包、滤纸抽线茶包、玉米纤维抽线茶包。
标准品:印楝素1(Nimbin)98%、印楝素2(Azadirachtin)98%、诺米林(Nomilm)98%、黄柏酮(Obacunone)98%、葛杜宁(Gedunin)98%、柠檬苦素(Limonin)98%、印苦楝内酯(Nimbolide)98%、苦楝萜酮内酯(Kulactone)98%,北京世纪奥科生物技术有限公司;甲醇(分析纯),德国CNW公司。
1.2 仪器与设备
ME104/02电子天平,梅特勒-托利多仪器(上海)有限公司;DHG-9202 3A电热恒温干燥箱,上海三发科学仪器有限公司;DK-8D电热恒温水槽,上海一恒科技有限公司;SHB-ⅢA循环水式多用真空泵,临海市永昊真空设备有限公司;IKA A11研磨机,北京优尼康生物科技有限公司;TYXH-I漩涡振荡器,上海汗诺仪器有限公司;THZ-82A水浴恒温振荡器,江苏金坛市环宇科学仪器厂;UV-7502PC紫外-可见分光光度计,上海欣茂仪器有限公司;TRIPLE QUAD 5500三重四级杆串联液相-质谱仪,配备电喷雾电离源(Turbo Ionspray, Applied Biosystems公司)及Analyst 1.5.1 Software工作站,AB SCIEX公司。
1.3 实验方法
1.3.1 印楝叶拼配茶制作
首先确定印楝叶干茶的加工工艺并制作印楝叶茶,以其为主原料与辅助原料进行拼配并进行感官审评,确定合适的拼配比例后进行拼配茶的制作。
1.3.1.1 印楝叶加工工艺的选择
本研究尝试不同的加工工艺,流程如下:
将印楝叶鲜叶放在室内自然晾干→用80 ℃电热鼓风干燥箱将印楝叶鲜叶烘干→在炒茶锅中将印楝叶鲜叶炒干→将印楝叶鲜叶轻发酵烘干→将印楝叶鲜叶进行不同时间(10、20、30、40、50、60、120 s)蒸青后置于80 ℃电热鼓风干燥箱烘干→将印楝叶鲜叶焯水10、20、30、40、50、60、120、240、360 s后置于80 ℃电热鼓风干燥箱烘干
各取以上加工工艺制作的印楝叶茶0.5 g,用200 mL沸水冲泡3 min,进行感官审评。
1.3.1.2 甜味剂选择
加工后的印楝叶苦味降低明显,但仍不能被普通消费者接受,而甜味剂可以在一定程度上掩盖苦味感知强度。蔗糖、冰糖、阿斯巴甜和三氯蔗糖是食品加工中常用的甜味剂,查阅相关文献以及参考GB 2760—2014《食品安全国家标准 食品添加剂使用标准》,明确阿斯巴甜在茶饮料中的最大使用量为0.6 g/kg,三氯蔗糖的甜度是蔗糖的600~800倍,饮料中的最大使用量为0.25 g/kg。根据以上资料设计了不同甜味剂的添加量:蔗糖1、2、4、6、8、10、20、30 g,冰糖1、2、4、6、8、10、20、30 g,阿斯巴甜0.02、0.04、0.06、0.08、0.10、0.12 g,三氯蔗糖0.01、0.02、0.03、0.04、0.05 g。称取0.5 g焯水4 min烘干的印楝叶,用200 mL沸水冲泡3 min后取茶汤,分别加入以上不同量的甜味剂,通过感官审评,进行苦味和甜味评分,选择合适的甜味剂。
1.3.1.3 花草果茶拼配
花草果茶具有独特的风味,常用于拼配茶包。本文选用了一些常用且具有独特风味的花草果茶,包括六大茶类、绞股蓝、甘草、三七、荞麦、蒲公英根、青钱柳茶、金银花、玫瑰花、茉莉花、枸杞、山楂以及各种果干,包括芒果、白桃、黄桃、草莓和金桔进行拼配。各称取以上花草果茶0.5 g,并与0.5 g焯水4 min烘干后的印楝叶混合,用200 mL沸水冲泡3 min,通过单因素和正交优化配方,对拼配茶进行感官审评,选择合适的花草茶。
根据甜味剂和花草茶的单因素试验结果,对筛选出来的合适配方进行正交实验并进行感官审评,再次筛选适合的配方。
1.3.2 茶包袋选择
茶包袋的材质和孔径对于水溶性物质的浸出速率有一定的影响,因此影响花草茶口感。实验选取了5种不同材质的茶包袋:尼龙抽线茶包袋、纯棉纱布抽线茶包袋、无纺布抽线茶包袋、滤纸抽线茶包袋、玉米纤维抽线茶包袋。将优化好的印楝叶拼配茶装入不同材质茶包袋,用200 mL沸水冲泡3 min,进行感官审评。
1.3.3 感官审评方法
由5名具有评茶师职业资格的专业人员组成感官分析小组,对苦味评分用0~10分打分,分值越高苦味越重。苦味评分以印楝叶鲜叶0.5 g,200 mL沸水冲泡3 min为10分;苦丁茶0.5 g,200 mL沸水冲泡3 min为5分;水为0分,两者苦味类型相同。
1.3.4 印楝叶苦味物质测定
1.3.4.1 标准溶液配制
分别准确称量5 mg印楝素1、印楝素2、诺米林、黄柏酮、葛杜宁、柠檬苦素、印苦楝内酯和苦楝萜酮内酯标准品于10 mL容量瓶中,将其溶解在甲醇中并定容于10 mL容量瓶,配成500 μg/mL的标准储备液。采用V(甲醇)∶V(水)=1∶19将标准储备液稀释配制成不同质量浓度(0.001、0.005、0.01、0.05、0.1、0.5、5、10、50 μg/mL)的混合标准工作液,现配现用。所有的标准溶液在4 ℃下贮存。
1.3.4.2 印楝叶茶提取液制备
分别称取烘干和焯水4 min烘干的1.000 g磨碎试样(过1.0 mm孔径筛)于离心管中,分别加入10 mL 70%(体积分数)乙醇涡旋2 min,70 ℃水浴加热45 min,冷却后5 000 r/min离心10 min, 取上清液过0.22 μm滤膜稀释,置于-20 ℃冰箱待用。
1.3.4.3 色谱条件
色谱柱:Waters Acquity-BCH C18(100 mm×2.1 mm,1.7 μm),流速:0.3 mL/min,柱温:40 ℃,二极管阵列检测器(PDA)检测波长:280 nm;进样量:5 μL,流动相:0.1%(体积分数)甲酸-水(A)、甲醇(B)。梯度洗脱条件为0~5 min,5%B;5~10 min,5%B;10~20 min,55%B;20~25 min,55%B;25~30 min,85%B;30~35 min,95%B。
1.3.4.4 质谱条件
离子源:电喷雾离子源;质谱扫描方式:正负离子模式;检测方式:分别在正负离子模式下多反应监测模式测定;电喷雾电压:5 500 V;离子源温度:300 ℃;干燥气流速:11 L/min;干燥气温度:300 ℃;雾化器的压力:15 psi;监测印楝叶的碎片离子作为定量和确认离子。使用针泵进样对6种标准品的质谱分析参数进行了优化,相关参数见表1。
表1 印楝叶苦味物质的母离子、子离子碎片和质谱条件
Table 1 Parent ions, daughter ion fragments, and mass spectrometry conditions of neonicotinoid pesticide metabolites
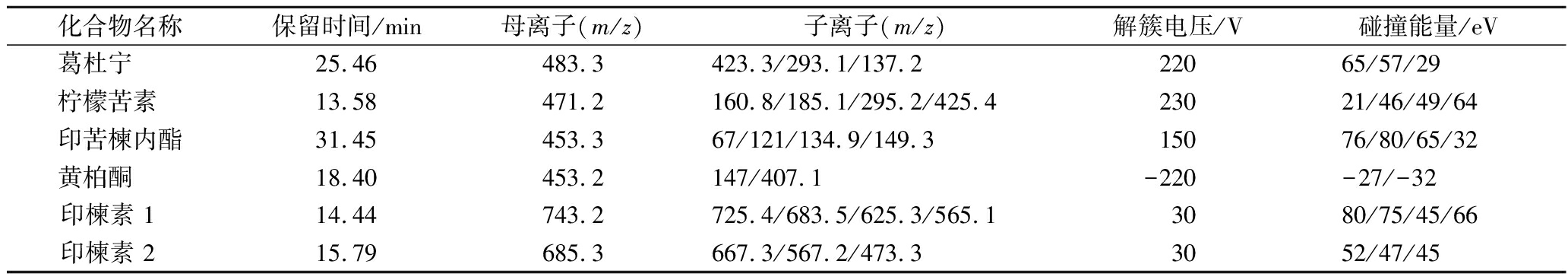
化合物名称保留时间/min母离子(m/z)子离子(m/z)解簇电压/V碰撞能量/eV葛杜宁 25.46483.3423.3/293.1/137.222065/57/29柠檬苦素 13.58471.2160.8/185.1/295.2/425.423021/46/49/64印苦楝内酯31.45453.367/121/134.9/149.315076/80/65/32黄柏酮 18.40453.2147/407.1-220-27/-32印楝素 1 14.44743.2725.4/683.5/625.3/565.13080/75/45/66印楝素 2 15.79685.3667.3/567.2/473.33052/47/45
1.3.5 印楝叶抗氧化活性测定
1.3.5.1 印楝叶提取液制备
分别称取烘干和焯水4 min烘干的磨碎印楝叶1.0 g,以1∶50(料液比,g∶mL)沸水提取45 min,其间每隔15 min 摇瓶1次,提取后趁热抽滤,滤液冷后用去离子水定容至200 mL后备用。
1.3.5.2 DPPH溶液的配制
DPPH用70%乙醇溶液溶解并定容于100 mL容量瓶中,制成1.5 mmol/L DPPH溶液,于4 ℃避光冷藏保存。
1.3.5.3 抗氧化活性测定
取一定量5.0×10-5 mol/L的DPPH乙醇溶液与不同体积的去离子水混合后,在紫外可见分光光度计上进行光谱扫描,确定最大吸收波长。取6 mL 5.0×10-5 mol/L的DPPH乙醇溶液与相同体积的印楝叶茶提取液于试管中混匀后,于517 nm测定其吸光值的变化,DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A0为未加样品的空白对照吸光值;A1为加入样品反应后的吸光值。
2 结果与分析
2.1 印楝叶拼配配方
2.1.1 加工工艺比较
印楝叶鲜叶苦味、辣味浓厚持久,辣味占主导,苦味评分为10分。模仿茶叶加工工艺,利用比较自然晾干、烘干和炒干印楝叶加工工艺进行优化选择。首先比较了不同干燥工艺对印楝叶苦味物质的影响,自然干燥和烘干工艺对印楝叶苦味没有改善作用,苦味评分也均为10分,而炒干工艺能小幅降低印楝叶的苦味,其苦味评分为9分。
蒸青工艺是绿茶加工工艺的一种,水的蒸腾作用或会影响苦味物质的含量,从而对印楝叶的苦味有所改善,因此本文采用蒸青工艺对印楝叶进行加工。结果表明,蒸青工艺对印楝叶苦味稍有改善作用,但不同蒸青处理时间对苦味改善无显著差异,蒸青后干燥的所得的印楝叶茶苦味评分均为8分,但含水量稍有差异,蒸青50 s的鲜叶更易做形,因此后续加工工艺中均选择了蒸青工艺,时间选用50 s。
发酵工艺是红茶加工中的关键工艺,通过发酵工艺可以使多酚发生氧化,降低茶叶的苦涩味。因此模拟红茶发酵工艺加工印楝叶茶,比较印楝叶风味的变化情况。结果表明,经发酵烘干的样品苦味没有显著降低,评分为8分,并且有不愉快的瓜果发酵味。
进一步的,揉捻工艺可为茶叶做形,因此本文比较炒干和揉捻炒干工艺对印楝叶滋味的影响,实验结果表明,蒸青炒干和蒸青揉捻炒干工艺对印楝叶苦味改善作用不大,苦味评分为8分,与蒸青烘干的评分一致,并且炒干和揉捻炒干的工艺较烘干更为复杂,因此后续采用烘干作为干燥工艺。
焯水是食品加工中常用的去除苦味的工艺,然而焯水工艺也会导致内含成分降低。本文比较了不同焯水时间工艺对印楝叶茶的苦味影响,发现焯水印楝叶的评分为9~6分,随着焯水时间延长,苦味降低,焯水工艺可以有效降低印楝叶的苦涩味。采用GB/T 8305—2013《茶 水浸出物测定》方法测定焯水后样品的水浸出物。结果表明,直接烘干和焯水10、20、30、40、50、60、120、240、360 s后烘干样品的水浸出物含量分别为46.07%、41.23%、41.54%、41.13%、37.25%、40.14%、40.34%、37.49%、34.83%、23.20%。焯水4、6 min后均能明显降低印楝叶茶的苦涩味,结合苦味评分和水浸出物含量,确定焯水时间为4 min。
焯水后的印楝叶汤水中含有大量水溶性苦味物质,有部分滞留在叶片上,进一步在焯水后增加了过水工艺(用少量水冲洗焯水后叶片),制备所得的印楝叶茶苦味评分依然为6分,表明过水工艺对于苦味改善不明显,因此选用焯水4 min后烘干为最佳加工工艺。
2.1.2 甜味剂比较
印楝叶添加不同剂量蔗糖的苦味评分为6~4分,蔗糖添加量达到8 g时,评分降低到4分,入口感受不到苦味,但后苦依旧明显持久,且甜味苦味不融合。冰糖的审评结果同蔗糖相似,冰糖添加量达到8 g时,评分降到4分,后苦味依然存在,但甜苦融合度较好;添加阿斯巴甜后,评分为7~5分,甜味不自然,依旧无法改善后苦浓厚持久以及甜苦不融合的问题;添加三氯蔗糖的评分为6~5分,三氯蔗糖甜度过高,较不自然,也无法改善后苦以及甜苦不融合的问题。
综合上述审评结果,冰糖风味较好,甜味自然协调,颗粒大小适宜放入茶包中,因此选用冰糖作为后续的拼配材料。为改善单独添加冰糖需要量大,且不能完全遮蔽印楝叶苦涩味的问题,需要筛选更多的添加物来改善口感。
2.1.3 花草茶比较
单因素实验结果表明,枸杞、山楂、金银花、三七、玫瑰花干和茉莉花干对苦味的改善不明显,苦味评分均为6分,但添加茉莉花干后茶汤有茉莉花的香气,令人愉悦。绞股蓝、甘草、荞麦和蒲公英根对于苦味有一些改善,苦味评分为5分,但绞股蓝带有中草药味,荞麦和蒲公英根带有炒制香,相比之下,甘草、荞麦和蒲公英根更为合适。青钱柳茶虽然有药香,但对于苦味的改善较为明显,评分4分,并能较好融合。因此花草茶中选用茉莉花干、荞麦、蒲公英根和青钱柳茶作为后续的拼配材料。
2.1.4 茶叶比较
选取的9种拼配用的绿茶中,白河春燕、六安瓜片和信阳毛尖的降苦味效果较好,苦味评分为5分,选择的7种拼配红茶中,大吉岭红碎茶和四海红美人的降苦味效果较好,苦味评分为5分,其他茶类中福鼎老白茶的降苦味效果较好,评分为4分。结合所有茶类的审评结果,福鼎老白茶对印楝叶苦味改善效果最好,可能是由于福鼎白茶的氨基酸含量较高[26],而氨基酸对于苦味有较好的抑制作用,因此选取福鼎老白茶作为后续的拼配首选茶叶品种。
2.1.5 冻干果干选择
选用了芒果、白桃、黄桃、草莓和金桔果干作为拼配果茶原料。审评结果表明,芒果、白桃、黄桃和草莓干果对于苦涩味的改善效果不明显,苦味评分为6分,且果味不融合。金桔的酸味在一定程度上可以改善印楝叶的苦味,评分为5分,橘子清香与印楝叶的清香也较为融合,因此选用金桔干作为后续的拼配果干。
2.1.6 拼配配方的确定
根据上述花草茶和茶叶单因素试验结果,选取福鼎老白茶、茉莉花干和甘草进行正交试验,审评结果如表2所示。配方1~4对印楝叶的苦味效果改善不明显,后续实验中选用金桔果干和福鼎老白茶,由于金桔酸味较强,因此添加冰糖来改善其口味对以上材料进行正交试验,制备拼配配方5~8,根据苦味评分,配方8对于印楝叶的苦味改善作用优于其他3个配方。后续对配方8的比例进行调整,又设计了8种配比,分别为配方9~16。综合酸味和苦味评分结果,配方16的滋味较好,但是仍然带有苦味。
根据单因素试验结果,荞麦和蒲公英根也具有较好的改善苦味作用,因此选取上述的配方16进行进一步改良,形成配方17~20。审评结果如表2所示,4个配方苦味改善不明显,虽然金桔果干对于印楝叶的苦涩味有一定的掩盖作用,但其酸味明显,无法为大众所接受,因此后续配方不采用金桔。
花草茶试验中,青钱柳茶具有较重的药味,但对于印楝叶的苦涩味具有较好的遮蔽作用,因此尝试用青钱柳茶替换金桔,并添加荞麦和蒲公英根,制备配方21~24。结果如表2所示。荞麦和蒲公英根都对苦涩味有一定的改善作用,但荞麦有其特殊的苦味,因此最终选用配方23,即印楝叶∶福鼎老白茶∶青钱柳茶∶冰糖∶蒲公英根质量比为0.6∶0.8∶0.8∶0.4∶0.4作为最终的拼配配方,最终配方的苦味评分为3分。
2.2 茶包袋的确定
茶包袋的材质和孔径对于水溶性物质的浸出均有一定的影响,因此选取了几款茶包袋,装上最佳配方印楝叶茶制备印楝叶茶包,进行感官审评。尼龙抽线茶包、纯棉纱布抽线茶包和无纺布抽线茶包的苦味较为明显,评分为2分。滤纸抽线茶包和玉米纤维抽线茶包泡出来的茶汤色绿黄透亮,清香,微微带苦味,基本可忽略,评分为1分,因此最终选用滤纸抽线茶包袋和玉米纤维抽线茶包袋作为包装。
表2 不同印楝叶拼配配方审评结果
Table 2 Evaluation results of different neem leaf blending formulas
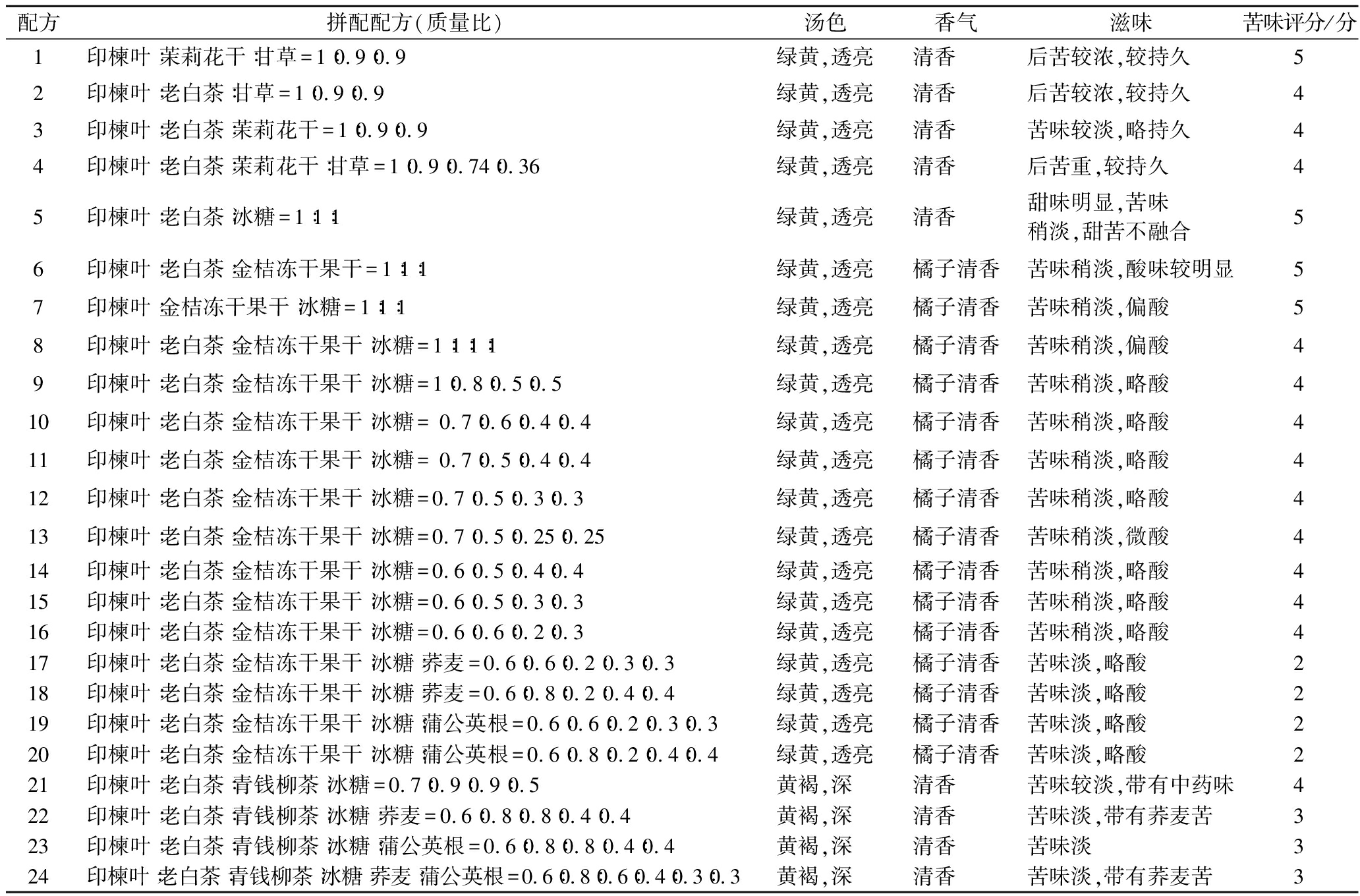
配方拼配配方(质量比)汤色香气滋味苦味评分/分1印楝叶∶茉莉花干∶甘草=1∶0.9∶0.9绿黄,透亮清香 后苦较浓,较持久52印楝叶∶老白茶∶甘草=1∶0.9∶0.9绿黄,透亮清香 后苦较浓,较持久43印楝叶∶老白茶∶茉莉花干=1∶0.9∶0.9绿黄,透亮清香 苦味较淡,略持久44印楝叶∶老白茶∶茉莉花干∶甘草=1∶0.9∶0.74∶0.36绿黄,透亮清香 后苦重,较持久45印楝叶∶老白茶∶冰糖=1∶1∶1绿黄,透亮清香 甜味明显,苦味稍淡,甜苦不融合56印楝叶∶老白茶∶金桔冻干果干=1∶1∶1绿黄,透亮橘子清香苦味稍淡,酸味较明显57印楝叶∶金桔冻干果干∶冰糖=1∶1∶1绿黄,透亮橘子清香苦味稍淡,偏酸58印楝叶∶老白茶∶金桔冻干果干∶冰糖=1∶1∶1∶1绿黄,透亮橘子清香苦味稍淡,偏酸49印楝叶∶老白茶∶金桔冻干果干∶冰糖=1∶0.8∶0.5∶0.5绿黄,透亮橘子清香苦味稍淡,略酸410印楝叶∶老白茶∶金桔冻干果干∶冰糖= 0.7∶0.6∶0.4∶0.4绿黄,透亮橘子清香苦味稍淡,略酸411印楝叶∶老白茶∶金桔冻干果干∶冰糖= 0.7∶0.5∶0.4∶0.4绿黄,透亮橘子清香苦味稍淡,略酸412印楝叶∶老白茶∶金桔冻干果干∶冰糖=0.7∶0.5∶0.3∶0.3绿黄,透亮橘子清香苦味稍淡,略酸413印楝叶∶老白茶∶金桔冻干果干∶冰糖=0.7∶0.5∶0.25∶0.25绿黄,透亮橘子清香苦味稍淡,微酸414印楝叶∶老白茶∶金桔冻干果干∶冰糖=0.6∶0.5∶0.4∶0.4绿黄,透亮橘子清香苦味稍淡,略酸415印楝叶∶老白茶∶金桔冻干果干∶冰糖=0.6∶0.5∶0.3∶0.3绿黄,透亮橘子清香苦味稍淡,略酸416印楝叶∶老白茶∶金桔冻干果干∶冰糖=0.6∶0.6∶0.2∶0.3绿黄,透亮橘子清香苦味稍淡,略酸417印楝叶∶老白茶∶金桔冻干果干∶冰糖∶荞麦=0.6∶0.6∶0.2∶0.3∶0.3绿黄,透亮橘子清香苦味淡,略酸218印楝叶∶老白茶∶金桔冻干果干∶冰糖∶荞麦=0.6∶0.8∶0.2∶0.4∶0.4绿黄,透亮橘子清香苦味淡,略酸219印楝叶∶老白茶∶金桔冻干果干∶冰糖∶蒲公英根=0.6∶0.6∶0.2∶0.3∶0.3绿黄,透亮橘子清香苦味淡,略酸220印楝叶∶老白茶∶金桔冻干果干∶冰糖∶蒲公英根=0.6∶0.8∶0.2∶0.4∶0.4绿黄,透亮橘子清香苦味淡,略酸221印楝叶∶老白茶∶青钱柳茶∶冰糖=0.7∶0.9∶0.9∶0.5黄褐,深 清香 苦味较淡,带有中药味422印楝叶∶老白茶∶青钱柳茶∶冰糖∶荞麦=0.6∶0.8∶0.8∶0.4∶0.4黄褐,深 清香 苦味淡,带有荞麦苦323印楝叶∶老白茶∶青钱柳茶∶冰糖∶蒲公英根=0.6∶0.8∶0.8∶0.4∶0.4黄褐,深 清香 苦味淡324印楝叶∶老白茶∶青钱柳茶∶冰糖∶荞麦∶蒲公英根=0.6∶0.8∶0.6∶0.4∶0.3∶0.3黄褐,深 清香 苦味淡,带有荞麦苦3
2.3 两种加工方式印楝叶苦味物质含量比较
2.3.1 标准曲线的制作
优化了印楝叶中苦味物质的液相色谱流动相、质谱条件,配制混合标准溶液进行分析,利用外标法定量。以10倍信噪比对应的加标水平为定量限,通过测定6个浓度梯度标准溶液,以标准品的浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制线性回归方程,结果如表3所示。优化后的液相质谱条件对印楝叶的6种苦味物质的相关系数0.99,可用于后续样品中苦味物质含量分析。
表3 六种印楝叶内含成分标准曲线
Table 3 Standard curves of six components in neem leaves

化合物名称标准曲线相关系数线性范围/(ng·mL-1)定量限/(ng mL-1)葛杜宁 y=418.4x-2 217.60.997 21~5008柠檬苦素 y=466.4x+1 880.60.995 01~5001印苦楝内酯y=7 198.9x+1 880.60.990 61~50010黄柏酮 y=70.0x+207.40.999 91~50010印楝素1 y=1 106.1x+499.00.999 51~5001印楝素2 y=3 461.8x+927.40.999 91~5001

a-葛杜宁;b-柠檬苦素;c-印苦楝内酯;d-黄柏酮;e-印楝素1;f-印楝素2
图1 质量浓度为500 ng/mL的各标准品的多反应监测离子流图
Fig.1 Multiple reaction monitoring ion flow diagram of each standard at 500 ng/mL
2.3.2 两种加工方式印楝叶苦味物质含量对比
前述2.1实验结果表明选用焯水4 min烘干的印楝叶作为印楝叶拼配茶包原料,此工艺对印楝叶的苦味具有较大的改善作用。为研究印楝叶苦味降低的原因,本文测定了主要内含苦味物质的含量。由于烘干印楝叶的苦强度与印楝叶鲜叶含量基本相同,因此选用烘干印楝叶作为苦味物质含量对照样。选取70%乙醇作为提取印楝叶苦味物质的溶剂,测定结果如表4所示。
柠檬苦素类化合物是一种高度氧化的四降三萜类的植物次生代谢产物,广泛存在于楝科和芸香科植物[27]。据文献报道,柠檬苦素在水溶液中的苦味阈值约为1×10-6 mol/L,是主要的苦味来源之一[28]。柠檬苦素、印苦楝内酯、黄柏酮和印楝素为主要的柠檬苦素类化合物。实验结果表明,与烘干叶相比,焯水4 min烘干的印楝叶中6种苦味物质含量均有所下降。焯水4 min烘干的印楝叶中柠檬苦素的去除率高达50.73%,印楝素1、印楝素2、黄柏酮和印苦楝内酯的去除率分别为38.94%、36.51%、15.95%和14.9%。表明焯水可以有效降低印楝叶中柠檬苦素类化合物的含量,这可能是焯水工艺加工的印楝叶茶苦味降低的主要原因。
表4 焯水工艺对印楝叶中苦味物质的去除率
Table 4 Removal rate of bitter substances in Azedarach leaves by blanching process
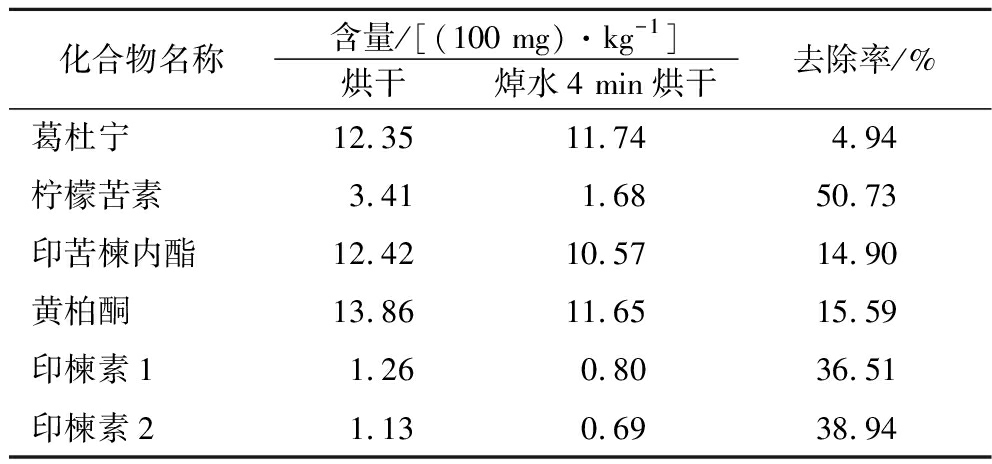
化合物名称含量/[(100 mg)·kg-1]烘干焯水4 min烘干去除率/%葛杜宁12.3511.744.94柠檬苦素3.411.6850.73印苦楝内酯12.4210.5714.90黄柏酮13.8611.6515.59印楝素11.260.8036.51印楝素21.130.6938.94
2.4 两种加工方式印楝叶抗氧化活性对比
焯水工艺可以显著减少印楝叶中的苦味物质含量,然而柠檬苦素及其类似物也是印楝叶中抗氧化活性物质,为探究焯水是否显著降低印楝叶抗氧化活性,本研究通过DPPH自由基清除实验比较焯水工艺对印楝叶的抗氧化活性的影响。结果表明,直接烘干的印楝叶自由基清除率为92.7%,焯水4 min后烘干印楝叶自由基清除率为89.4%,仅降低了3.3%。因此焯水工艺在显著降低印楝叶苦味的同时可以保持其抗氧化活性。
3 结论与讨论
本文通过比较优化印楝叶茶的加工工艺,选择花草茶、茶叶、冻干果干种类,并优选甜味剂和茶包袋材料。以焯水4 min后烘干的印楝叶为主要原料,与福鼎老白茶、青钱柳茶、冰糖和蒲公英根复配得到的印楝叶茶包为:印楝叶0.6 g,福鼎老白茶0.8 g,青钱柳茶0.8 g,冰糖0.4 g,蒲公英根0.4 g,用滤纸抽线茶包和玉米纤维抽线茶包作为茶包袋。此工艺制备的印楝叶茶包的茶汤清透明亮,呈浅黄绿色,滋味清新,大大改善了印楝叶原有苦味,可被普通消费者接受。
建立了印楝叶中主要苦味特征物质的液质联用检测方法,分析了焯水工艺对印楝叶中苦味物质的含量的影响,结果表明,印楝叶的柠檬苦素类化合物均具有较高去除率,尤其柠檬苦素的去除率达到50%以上,证明焯水工艺是降低印楝叶苦味物质的有效方法。
印楝叶具有高保健功效,其中含有50多种化合物,萜类化合物、生物碱、黄酮类化合物等是印楝叶中主要的活性成分,具有较强的抗氧化和抗炎等作用。实验对焯水烘干后印楝叶的抗氧化活性进行测定,发现其自由基清除率仅降低3.3%,说明焯水工艺在去除印楝叶苦味物质的同时,较大程度地保留印楝叶的抗氧化性能。
本文研制出可去除或遮蔽印楝叶苦味,并同时保留其保健功能成分的印楝叶拼配茶包,并建立印楝叶苦味特征物质的液质联用检测方法,制备了市场上未见的印楝叶茶新产品,具有一定的开发前景,也为今后相关研究提供了思路和技术支持。
[1] GUPTA S C, PRASAD S, TYAGI A K, et al.Neem (Azadirachta indica):An Indian traditional panacea with modern molecular basis[J].Phytomedicine, 2017, 34:14-20.
[2] HOSSAIN M A, AL-TOUBI W A S, WELI A M, et al.Identification and characterization of chemical compounds in different crude extracts from leaves of Omani neem[J].Journal of Taibah University for Science, 2013, 7(4):181-188.
[3] TAGGAR G K, SINGH R, CHHUNEJA P K, et al.Insecticidal potential of home-made neem extract against pod sucking bug, Clavigralla gibbosa (Spinola) in pigeonpea[J].International Journal of Tropical Insect Science, 2022, 42(2):1 913-1 924.
[4] ADIGWE O P, IBRAHIM J A, ADAMU A, et al.Chemometric analysis of volatile compounds of Niprineem oil and other brands of neem seed oils sold in Nigeria[J].Journal of Biophysical Chemistry, 2022, 13(1):1-12.
[5] UJAH I I, NSUDE C A, ANI O N, et al.Phytochemicals of neem plant (Azadirachta indica) explains its use in traditional medicine and pest control[J].GSC Biological and Pharmaceutical Sciences, 2021, 14(2):165-171.
[6] ANUP CHANDRA N M, THAKUR A.Neem and its derivatives—A tropical trove[J].International Journal of Current Microbiology and Applied Sciences, 2021, 10(2):3 228-3 235.
[7] KHAN I H, JAVAID A.Identification of biologically important compounds in neem leaves through GC-MS analysis[J].Jordan Journal of Pharmaceutical Sciences, 2021, 14(3):359-366.
[8] BHUNIYA A, GUHA I, GANGULY N, et al.NLGP attenuates murine melanoma and carcinoma metastasis by modulating cytotoxic CD8+ T cells[J].Frontiers in Oncology, 2020, 10:201.
[9] LI H, LI Z, XU Y M, et al.Epigallocatechin-3-gallate induces apoptosis, inhibits proliferation and decreases invasion of glioma cell[J].Neuroscience Bulletin, 2014, 30(1):67-73.
[10] NGOH DOOH J P, MBOU TADZO P R M, DEURNAYE P, et al.Effect of aqueous neem extract on development of Pestalotia heterocornis agent of Pestalotia leaf blight of cashew in far North Cameroon[J].European Journal of Agriculture and Food Sciences, 2021, 3(3):1-6.
[11] YARMOHAMMADI F, MEHRI S, NAJAFI N, et al.The protective effect of Azadirachta indica (neem) against metabolic syndrome:A review[J].Iranian Journal of Basic Medical Science, 2021, 24(3):280-292.
[12] SETH M, KHAN H, JANA S.Antimicrobial activity study of Ag-ZnO nanoflowers synthesised from neem extract and application in cotton textiles[J].International Journal of Nanotechnology, 2021, 18(5/6/7/8):531-544.
[13] NURMALA S, MOERFIAH M, PURNAMA R T.Anti-inflammatory activity of the gel containing a combination of neem leaf extract and shallot extract[J].Pharmacology and Clinical Pharmacy Research, 2020, 5(1):33.
[14] JALALUDDIN M, RAJASEKARAN U, PAUL S, et al.Comparative evaluation of neem mouthwash on plaque and gingivitis:A double-blind crossover study[J].The Journal of Contemporary Dental Practice, 2017, 18(7):567-571.
[15] DUARTE J P, REDAELLI L R, SILVA C E, et al.Effect of Azadirachta indica (Sapindales:Meliaceae) oil on the immune system of Spodoptera frugiperda (Lepidoptera:Noctuidae) immatures[J].Journal of Insect Science, 2020, 20(3):17.
[16] NARKHEDE A N, JAGTAP S D, KASOTE D M, et al.Comparative immunomodulation potential of Tinospora cordifolia (Willd.) Miers ex Hook.F., Tinospora sinensis (Lour.) Merrill and Tinospora cordifolia growing on Azadirachta indica A.Juss[J].Indian Journal of Experimental Biology, 2014, 52(8):808-813.
[17] ASHWANI K,RENU G,SANJAY B.Protective effect of Azadirachta indica A.Juss against doxorubicin-induced cardiac toxicity in tumour bearing mice[J].Indian Journal of Experimental Biology, 2014, 52(4):323-331.
[18] KOUL A, MOHAN V, BHARATI S.Azadirachta indica mitigates DMBA-induced hepatotoxicity:A biochemical and radiometric study[J].Indian Journal of Biochemistry &Biophysics, 2014, 51(1):37-45.
[19] VERMA S, POOJA, SINGH S K,et al.A review on response of neem seed and leaf extract on crop protection and production[J].International Journal of Plant &Soil Science, 2021:22-27.
[20] BAURI R K, TIGGA M N, KULLU S S.A review on use of medicinal plants to control parasites[J].Indian Journal of Natural Products and Resources, 2015, 6:268-277.
[21] RAUTRAY A K, SAHOO R, SARDAR K K, et al.Ethnoveterinary practices for small ruminants followed by rural folks in southern Odisha[J].Indian Journal of Traditional Knowledge, 2015, 14(2):319-324.
[22] KALA C P.Herbal treatment for snakebites in Uttarakhand state of India[J].Indian Journal of Natural Products Resources, 2015, 6(1):56-61.
[23] BOSE M J, ARON S, MEHALINGAM P.An ethnobotanical study of medicinal plants used by the Paliyars aboriginal community in Virudhunagar district, Tamil Nadu, India[J].Indian Journal of Traditional Knowledge, 2014, 13(3):613-618.
[24] TAK P S, PANNU P P S, KAUR J.Effect of foliar application of fungicides, neem extract and butter milk on yellow rust, plant growth and yield parameters of wheat[J].Agricultural Research Journal, 2021, 58(2):232-239.
[25] YADAV D K, BHARITKAR Y P, CHATTERJEE K, et al.Importance of neem leaf:An insight into its role in combating diseases[J].Indian Journal of Experimental Biology, 2016, 54(11):708-718.
[26] 段红星, 孙围围.福鼎白茶与景谷白茶内含成分与感官品质研究[J].云南农业大学学报(自然科学), 2016, 31(6):1 091-1 096.
DUAN H X, SUN W W.Research on the components and sensory quality of Fuding and Jinggu white tea[J].Journal of Yunnan Agricultural University (Natural Science), 2016, 31(6):1 091-1 096.
[27] 曲栋, 张群, 申丽, 等.印度红树植物Xylocarpus moluccensis的柠檬苦素[J].天然产物研究与开发, 2021, 33(1):57-64.
QU D, ZHANG Q, SHEN L, et al.Limonoids from Indian mangrove, Xylocarpus moluccensis[J].Natural Product Research and Development, 2021, 33(1):57-64.
[28] 吴今人, 耿平, 胡田叶, 等.柑橘不同部位中柠檬苦素的分布及含量分析[J].湖北农业科学, 2015, 54(4):882-885.
WU J R, GENG P, HU T Y, et al.Distribution and content of the limonin in different tissues of citrus[J].Hubei Agricultural Sciences, 2015, 54(4):882-885.