β-葡聚糖酶是能水解谷物中葡聚糖的酶类总称,主要包括β-(1,3-1,4)-葡聚糖酶,内切和外切β-1,3-葡聚糖酶,内切和外切β-1,4-葡聚糖酶。啤酒酿造中,β-葡聚糖酶可解决大麦中葡聚糖引起的麦汁和啤酒过滤速度慢等问题[1]。大麦型饲料中添加β-葡聚糖酶能够消除其胚乳细胞壁中的抗营养因子,提高营养物质利用率[2],影响动物肠道结构及微生物区系,增强机体免疫力[3]。
目前β-葡聚糖酶工业生产中一直存在酶活力低、成本高、热稳定性差等问题,选育出稳定遗传高β-葡聚糖酶活力且酶热稳定性良好的菌株是国内外学者的研究热点[4]。通过在毕赤酵母中高效表达拟青霉(Paecilomyces sp.)FLH30的β-葡聚糖酶基因PsBg16A,酶活力在5 L发酵罐中可达61 754 U/mL,此为已报道产β-葡聚糖酶活力最高的菌株[5]。常压室温等离子体(atmospheric and room temperature plasma,ARTP)技术诱变节杆菌(Arthrobacter)KQ11获得突变株4-13,其β-葡聚糖酶活力为6.27 U/mL,是原始菌株的1.5倍[6]。里氏木霉(Trichoderma reesei)GIMCC 3.498产β-葡聚糖酶活力为78.83 U/mL,为已报道的里氏木霉高产β-葡聚糖酶菌株[7]。里氏木霉具有菌株安全无毒、酶系丰富、胞外酶易分离纯化等优点,常作为葡聚糖酶工业化生产的重要菌株[8]。
本研究以里氏木霉CICC 2626为出发菌株,采用操作简单、不污染环境、突变率高的ARTP诱变技术,结合刚果红-β-葡聚糖透明圈初筛及酶活力测定复筛,获得高产β-葡聚糖酶且遗传稳定的菌株后,对其进行固态产酶发酵、酶学性质及体外模拟消化研究,为后期应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
里氏木霉(Trichoderma reesei),中国工业微生物菌种保藏管理中心,菌种保藏编号:CICC 2626。
1.1.2 培养基
马铃薯葡萄糖(potato dextrose agar, PDA)培养基。
液体产酶培养基(g/L):葡聚糖5.0,(NH4)2SO4 3.5,K2HPO4 1.0,KCl 0.5,MgSO4·7H2O 0.5。
初筛培养基:基于液态产酶培养基加入20 g/L琼脂。
种子培养基(g/L):葡萄糖20.0,蛋白胨20.0,酵母粉10.0。
限量培养液(g/L):葡萄糖1.0,(NH4)2SO4 0.5。
固态产酶培养基:玉米芯15.0 g,麸皮15.0 g,(NH4)2SO4 0.75 g,K2HPO4 0.5 g,料水比1∶0.8(g∶mL)。
1.1.3 实验试剂
乙酸-乙酸钠缓冲溶液(pH=5.5)、3,5-二硝基水杨酸溶液、刚果红溶液(10.0 mg/mL)、β-葡聚糖(10.0 mg/mL)、脱氧胆酸钠等(均为国产分析纯),上海源叶生物科技有限公司;大麦粉、麸皮等,新疆天康饲料有限公司。
1.1.4 仪器与设备
ARTP-IIS ARTP诱变育种仪,无锡源清天木生物科技有限公司;DK-8D三孔电热恒温水槽,上海齐欣科学仪器有限公司;Fresco17离心机,Thermo Fisher Scientific公司;SpectraMaxM5e酶标仪器,上海美谷分子仪器有限公司;ANKOM Daisy Ⅱ体外模拟培养箱,青岛圣吉仪器系统有限公司;G506003-0001电动组织研磨器,生工生物工程(上海)股份有限公司;SNB-2数字式黏度计,上海尼润智能科技有限公司。
1.2 实验方法
1.2.1 β-葡聚糖酶活定性及定量测定
里氏木霉CICC 2626接种于初筛培养基,28 ℃培养3 d,刚果红染色,以菌体直径与其透明圈直径的比值表征菌株对葡聚糖的水解能力。
β-葡聚糖酶活力定义:在50 ℃,pH值为5.5的条件下,每分钟酶解10 mg/mL β-葡聚糖产生1 μmoL葡萄糖所需要的酶量为1个酶活力单位。液态产酶发酵液、固态发酵料的酶活力按农业行业标准NY/T 911—2020《饲料添加剂β-葡聚糖酶活力的测定 分光光度法》进行测定。
1.2.2 ARTP诱变选育
制备里氏木霉CICC 2626萌动孢子[9],孢子处于萌动而尚未生长状态。吸取10 μL萌动孢子悬浮液,均匀涂布到无菌金属载片上,以99.99%高纯氦气为工作气体,设定气流量为10 SLM,功率为100 W,工作距离(即为载片与气流端口的距离)2 mm,处理时间为0、30、60、120、180、240、300、360 s。将处理后的载片用灼烧后的镊子迅速移至盛有990 μL无菌水的1.5 mL离心管中,混匀后稀释涂布PDA平板,记录不同处理时间下的菌落数,绘制致死率曲线[10]。致死率计算如公式(1)所示:
致死率![]()
(1)
式中:A,处理时间为0 s,菌液涂布平板的菌落数;B,不同处理时间下,菌液涂布平板的菌落数。
初筛:选取适宜的处理时间,挑选生长快且菌落大的菌株,打孔接种在初筛培养基上,28 ℃培养3 d,刚果红染色,挑选透明圈与菌体比值大的菌株。
复筛:测定初筛所获菌株的酶活力。28 ℃培养3 d,测定发酵液β-葡聚糖酶活力,选取高酶活力的菌株进行后续实验。
1.2.3 突变菌株遗传稳定性检测
将复筛得到的高产β-葡聚糖酶突变株,传7代,并测定酶活力,确定其遗传稳定性。
1.2.4 生长曲线测定
将出发菌株CICC 2626和突变株ARTP-9接种于斜面培养基,28 ℃培养至充分产孢后用无菌水冲洗,调整孢子浓度为106 CFU /mL,以2%接种到种子培养基,于28 ℃、180 r/min培养,每间隔4 h采用干重法测定其生物量,绘制生长曲线。
1.2.5 粗酶液制备
突变株ARTP-9固态发酵酶制剂经硫酸铵分级沉淀、透析获得粗酶液[11]。
1.2.6 β-葡聚糖酶酶学性质研究
1.2.6.1 粗酶液最适温度及热稳定性
以10 mg/mL的β-葡聚糖为底物,分别于30、40、50、60、70 ℃酶解10 min后测定酶活力。以测得酶活力最高为100%,计算各温度相对酶活力。稳定性:粗酶液用pH值为5.5的乙酸缓冲液适当稀释,酶活力测定前在30、40、50、60、70、80 ℃进行保温,于0、1、5、10、30 min各时间点进行取样,在最适温度下进行酶解,以酶液未经保温后测定的酶活力为100%,测定不同温度不同保温时间下剩余酶活力。
1.2.6.2 粗酶液最适pH值及pH稳定性
分别配制0.1 mol/L pH值为2.0、2.5、3.0的磷酸氢二钠-柠檬酸缓冲液、0.1 mol/L pH值为3.5、4.0、4.5、5.0、5.5、6.0的乙酸缓冲液、0.1 mol/L pH值为6.5、7.0、7.5、8.0的Tris-HCl缓冲液,用以上缓冲液适当稀释酶液,在最适温度下测定其酶活力,以测得最高酶活力为100%,考察不同pH对酶活力的影响。稳定性:不同pH缓冲液稀释粗酶液后,于最适温度放置1 h,以未处理酶液测定的酶活力为100%,测定剩余酶活力。
1.2.6.3 金属离子对酶活力影响
向粗酶液中加入ZnSO4、CaCl2、FeCl3、FeCl2、MgSO4、MnSO4、CuSO4,使其金属离子终浓度为1、5、10 mmol/L,在最适温度和最适pH条件下,以不加金属离子粗酶液测定的酶活力为100%,测定相对酶活力。
1.2.6.4 酶动力学参数测定
在酶最适催化条件下,以1.0~10.0 mg/mL β-葡聚糖溶液为底物,测定反应速度V[12]。根据双倒数作图法(Lineweaver-Burk法)将米氏方程改写为公式(2),计算最大反应速度Vmax及米氏常数Km。
(2)
式中:V表示反应速度,μmol/(mg·min);Vmax表示最大反应速度,μmol/(mg·min);Km表示米氏常数,mg/mL;[S]表示反应底物质量浓度,mg/mL。
1.2.7 β-葡聚糖酶体外模拟消化方法
将出发菌株与突变菌株分别接种在固态产酶培养基上,28 ℃培养4 d,38 ℃低温烘干粉碎后测定酶活力[13],作为酶制剂备用。以大麦粉为底物,体外模拟消化实验分为胃期和肠期两个阶段,实验方法参照文献[14]。胃期、肠期模拟过程中分别隔1、3 h记录消化液中黏度与还原糖生成量。黏度测定:采用SNB-2数字式黏度计直接读数。DNS法测定消化产物中还原糖的生成量[15]。体外干物质消化率(in vitro dry matter digestibility,IVDMD)计算方法如公式(3)所示:
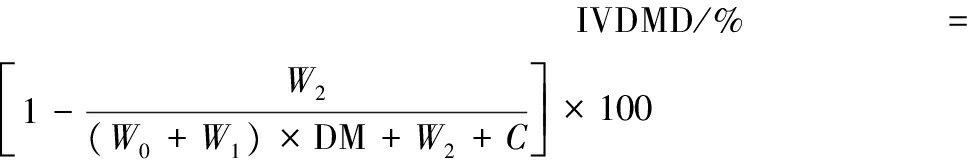
(3)
式中:DM表示样本干物质含量,%;W0表示大麦粉质量,g;W1表示酶制剂质量,g;W2表示滤袋质量,g;W3表示滤袋及残渣干重,g;C表示滤袋校正因子,即空白滤袋消化后袋重与原来的比值。
2 结果与分析
2.1 ARTP诱变选育
在处理时间为120 s时,菌株CICC 2626致死率达到86.96%(图1)。当致死率为85%~95%时,获得正向突变的概率较高,因此选择处理时间120 s进行后续实验。
根据刚果红水解透明圈直径(h)与菌落直径(c)的比值(表1),初筛获得11株突变株;摇管复筛后,突变菌株ARTP-3酶活力为45.69 U/mL,较出发菌株提高61.22%。
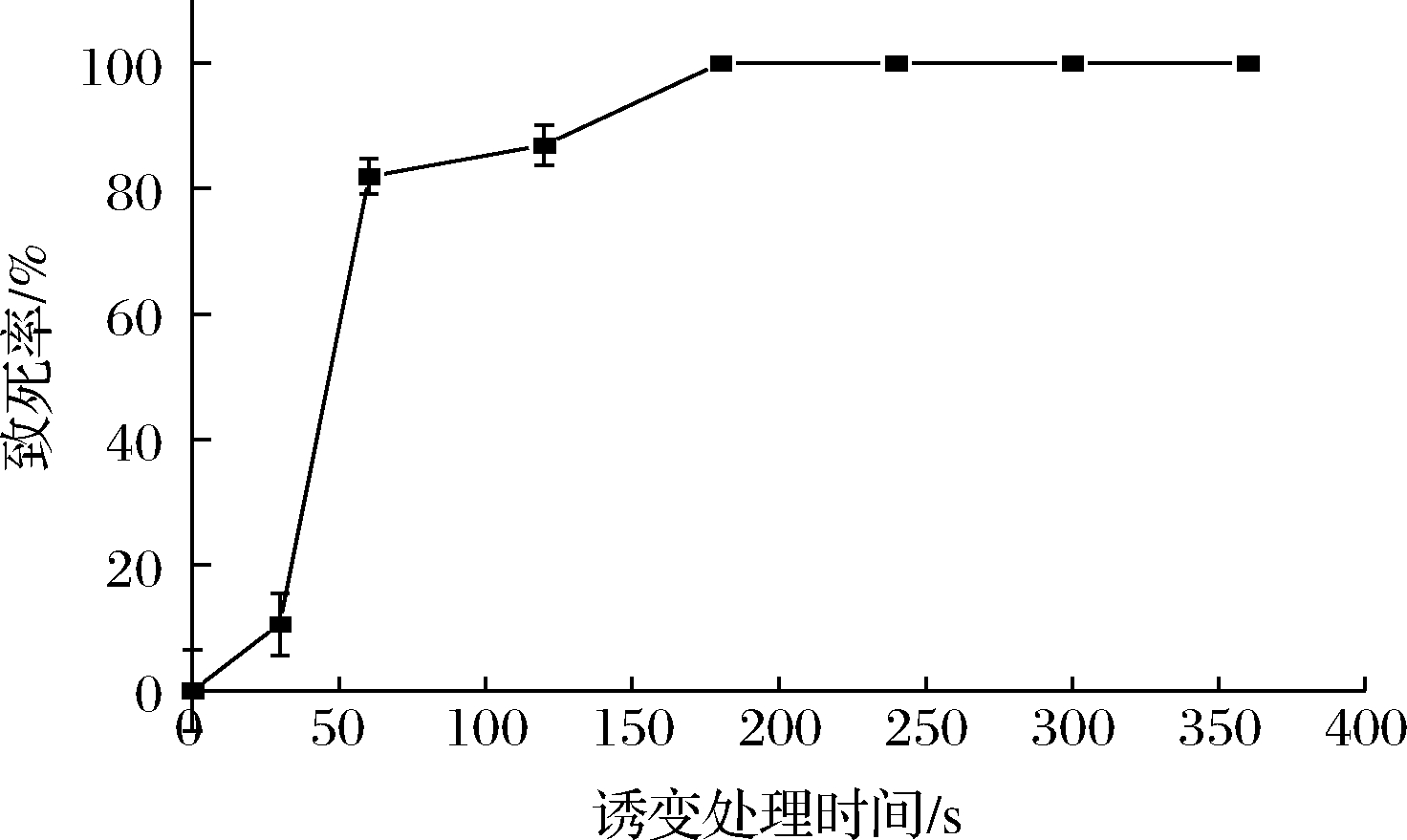
图1 里氏木霉CICC 2626 ARTP致死率曲线
Fig.1 ARTP fatality curve of T.reesei CICC 2626
表1 菌株CICC 2626诱变选育结果
Table 1 The mutation result of strain CICC 2626
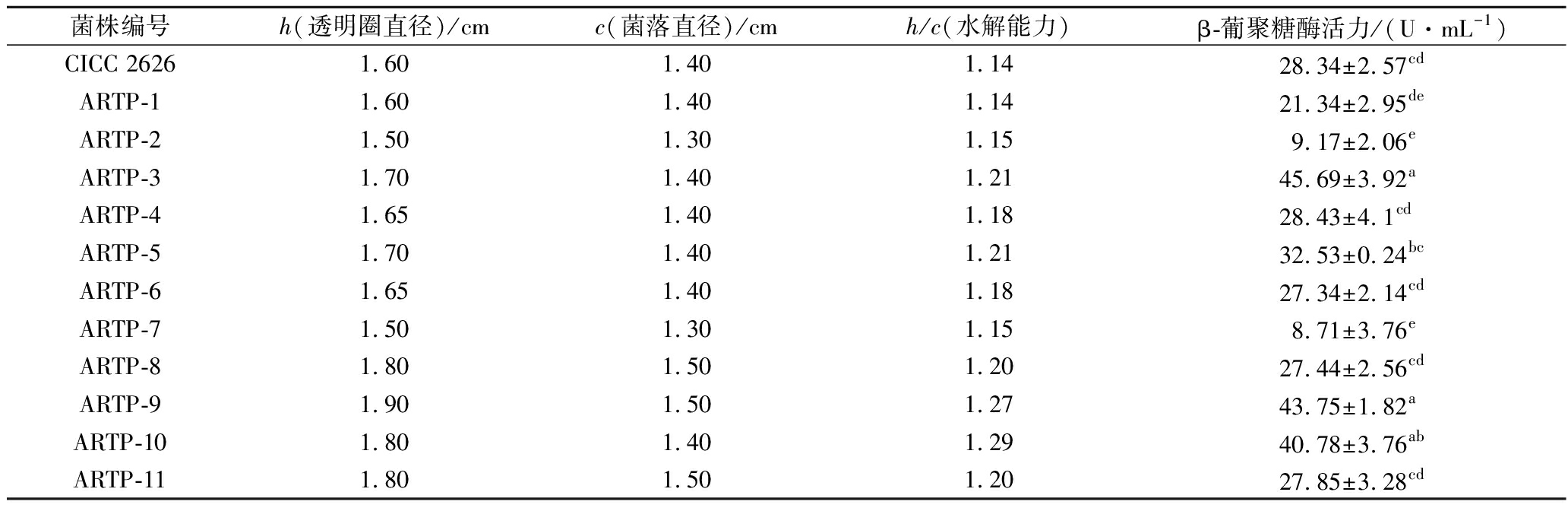
菌株编号h(透明圈直径)/cmc(菌落直径)/cmh/c(水解能力)β-葡聚糖酶活力/(U·mL-1)CICC 26261.60 1.40 1.14 28.34±2.57cdARTP-11.60 1.40 1.14 21.34±2.95deARTP-21.50 1.30 1.15 9.17±2.06eARTP-31.70 1.40 1.21 45.69±3.92aARTP-41.65 1.40 1.18 28.43±4.1cdARTP-51.70 1.40 1.21 32.53±0.24bcARTP-61.65 1.40 1.18 27.34±2.14cdARTP-71.50 1.30 1.15 8.71±3.76eARTP-81.80 1.50 1.20 27.44±2.56cdARTP-91.90 1.50 1.27 43.75±1.82aARTP-101.80 1.40 1.29 40.78±3.76abARTP-111.80 1.50 1.20 27.85±3.28cd
注:不同小写字母表示差异显著(下同)(P<0.05)
2.2 突变菌株的遗传稳定性和生长特性
对出发菌株及复筛所获酶活力较高的4株菌进行遗传稳定性实验(表2)。结果表明,虽然突变株ARTP-3在复筛时表现出最佳的酶活力,但在传代过程中,酶活力均低于原始菌株水平,可能与菌株保存活化方式有关。突变株ARTP-5、ARTP-10第1~4代传代过程中有较稳定的增加趋势,ARTP-5第2、4代酶活出现小高峰,第3代下降,差异显著(P<0.05)可能与诱变后细胞修复使基因发生改变,随传代次数的增加逐渐显现有关,但其高酶活力能遗传不稳定,当这2株菌传至5~7代时,酶活力均逐渐下降接近于原始菌株水平,这可能与丝状真菌随传代次数增加导致菌株退化,部分优良性状丢失有关。突变株ARTP-9在连续7次传代过程中,酶活力差异不显著(P>0.05),遗传稳定性好,β-葡聚糖酶活力同原始菌株CICC 2626相比显著提高(P<0.05)。因此,选其作为后续实验菌株。
表2 突变菌株产β-葡聚糖酶的遗传稳定性 单位:U/mL
Table 2 Genetic stability of β-glucanase-producing mutant strains
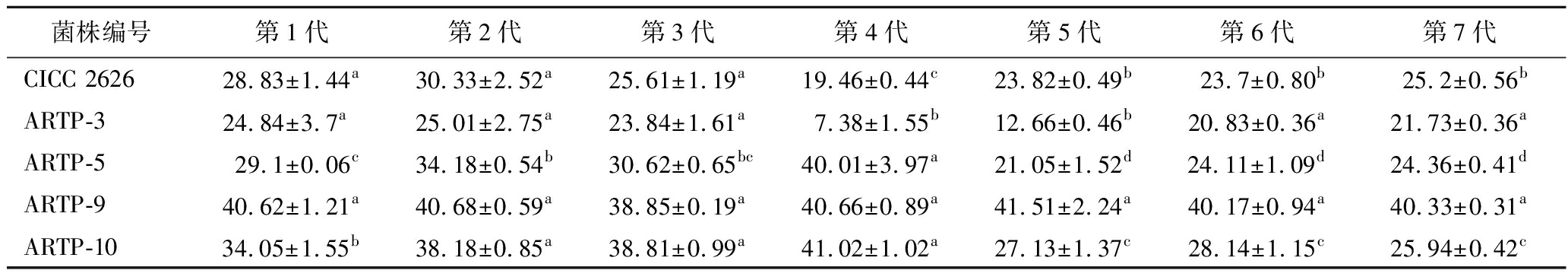
菌株编号第1代第2代第3代第4代第5代第6代第7代CICC 262628.83±1.44a30.33±2.52a25.61±1.19a19.46±0.44c23.82±0.49b 23.7±0.80b 25.2±0.56bARTP-324.84±3.7a 25.01±2.75a23.84±1.61a7.38±1.55b12.66±0.46b20.83±0.36a21.73±0.36aARTP-5 29.1±0.06c34.18±0.54b30.62±0.65bc40.01±3.97a21.05±1.52d24.11±1.09d24.36±0.41dARTP-940.62±1.21a40.68±0.59a38.85±0.19a40.66±0.89a41.51±2.24a40.17±0.94a40.33±0.31aARTP-1034.05±1.55b38.18±0.85a38.81±0.99a41.02±1.02a27.13±1.37c28.14±1.15c25.94±0.42c
注:不同小写字母表示各诱变菌株在不同传代次数之间存在显著性差异(P<0.05)
ARTP-9培养28 h后,生物量达到3.62 g/L,比出发菌株高2.26倍;44 h时,达到平稳期,其生物量达到10.81 g/L,比出发菌株高4.0%(P<0.05)(图2)。
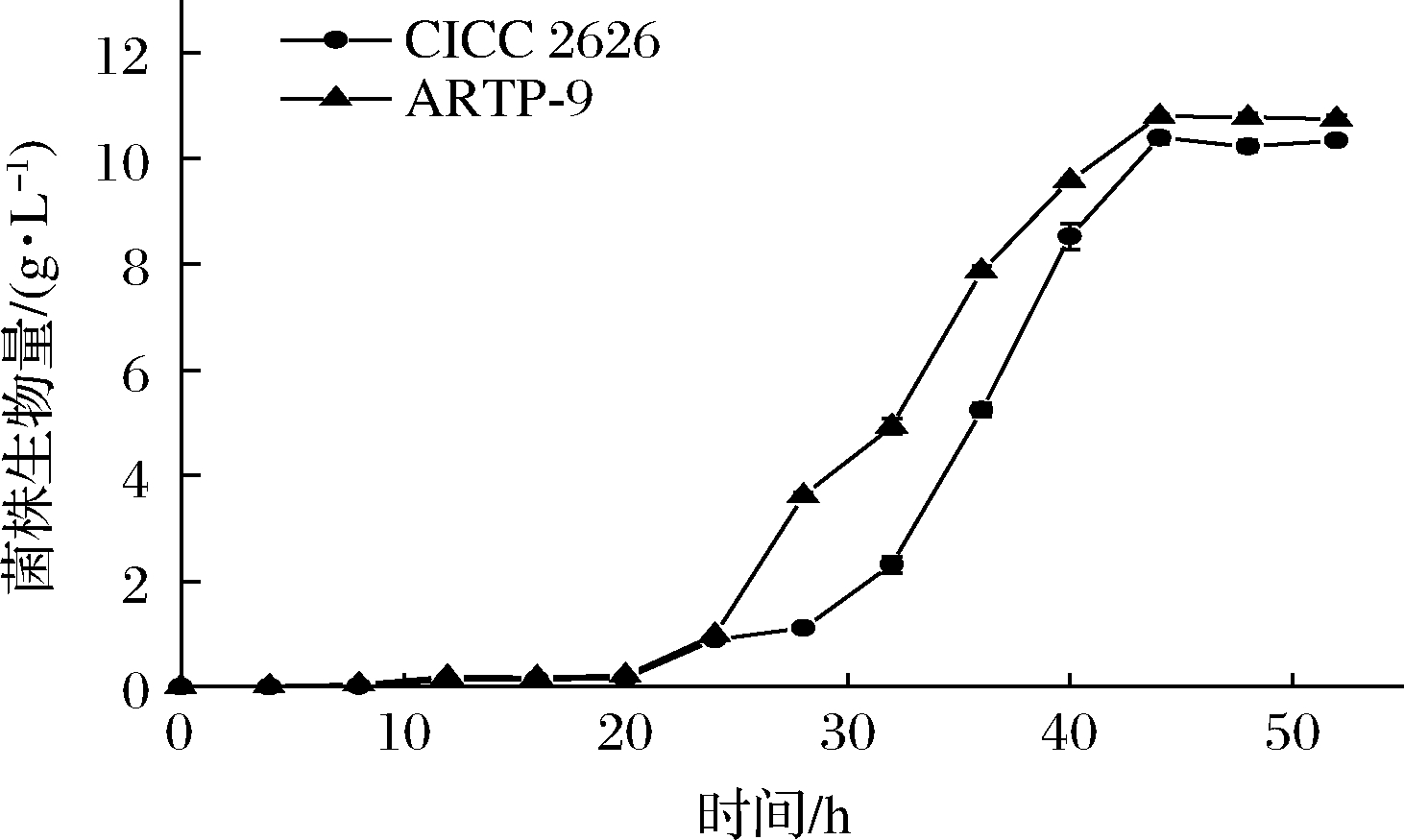
图2 菌株CICC 2626与突变菌株ARTP-9生长曲线
Fig.2 The growth curves of strain CICC 2626 and mutant ARTP-9
2.3 突变株ARTP-9 β-葡聚糖酶酶学性质研究
2.3.1 最适反应温度及热稳定性
突变株ARTP-9所产β-葡聚糖酶的最适反应温度为50 ℃(图3-a)。在50~60 ℃,酶活力较高(相对酶活力>75%),温度高于60 ℃,随着温度上升和保温时间延长,相对酶活力降低(图3-b)。
2.3.2 最适反应pH及pH稳定性
粗酶液最适pH值为6.0(图4-a)。在pH值2.5~6.5 有较高稳定性,50 ℃保温1 h后,相对酶活力均在70%以上(图4-b),说明该酶适宜在偏酸性条件下催化反应进行。
2.3.3 金属离子对β-葡聚糖酶活力的影响
5.0 mmol/L Fe2+、Mg2+对β-葡聚糖酶激活作用最强;Fe3+、Mn2+、Zn2+、Cu2+对β-葡聚糖酶起抑制作用,其中Fe3+的抑制作用最强(表3)。低浓度Ca2+对酶活性无影响,当其离子浓度达到10.0 mmol/L时酶活力下降到原来的82.47%。
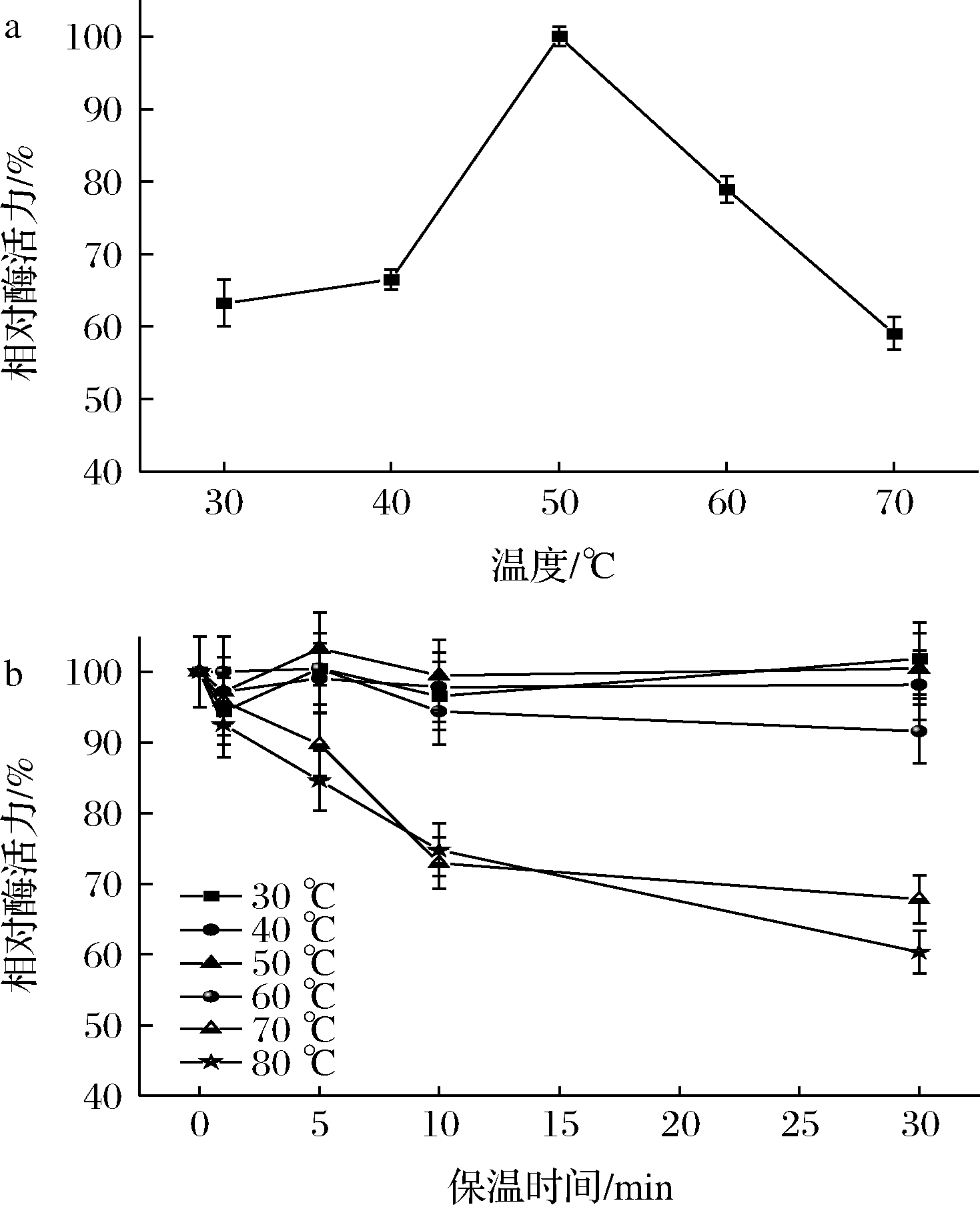
a-酶的最适温度;b-酶的热稳定性
图3 温度对β-葡聚糖酶活力及其稳定性的影响
Fig.3 Effects of temperature on the activity and stability of β-glucanase
2.3.4 β-葡聚糖酶动力学参数
酶的动力学参数是评估酶与底物亲和能力的重要指标。根据Lineweaver-Burk双倒数图(图5),得到回归方程y=0.165 4x+0.104 3(R2=0.990 4),通过截距计算出Km值为1.59 mg/mL,Vmax值为6.99 μmol/(mg·min)。
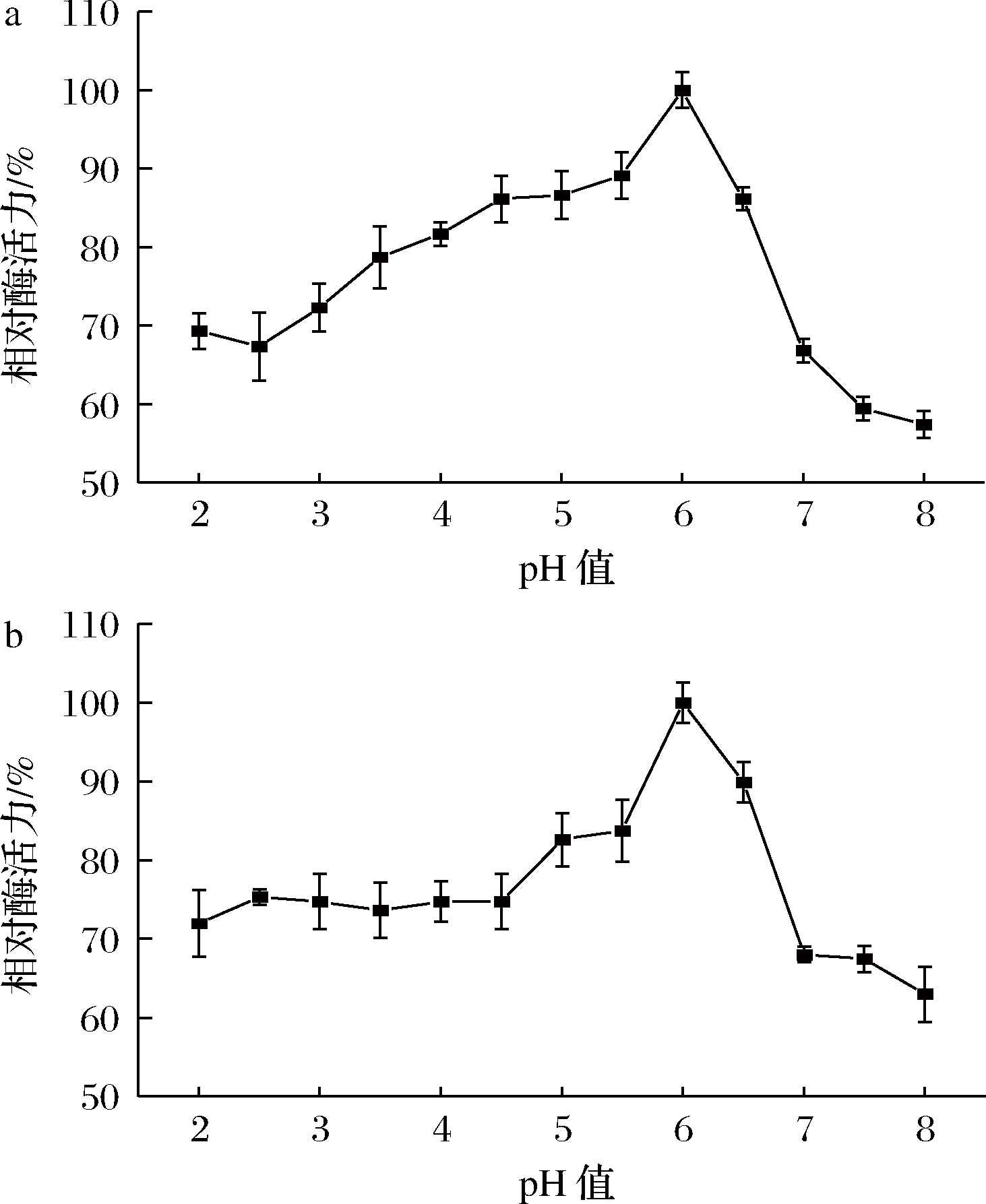
a-酶的最适pH值;b-酶的pH稳定性
图4 pH对β-葡聚糖酶活力及其稳定性的影响
Fig.4 Effects of pH on the activity and stability of β-glucanase
表3 金属离子对突变株ARTP-9 β-葡聚糖酶活力的影响 单位:%
Table 3 Effects of metal ions on the activity of β-glucanase produced by mutant ARTP-9
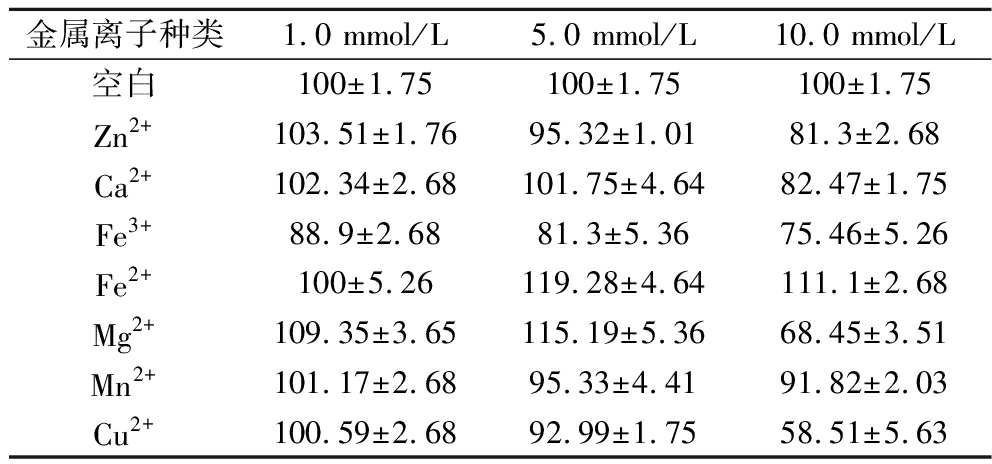
金属离子种类1.0 mmol/L5.0 mmol/L10.0 mmol/L空白100±1.75100±1.75100±1.75Zn2+103.51±1.7695.32±1.0181.3±2.68Ca2+102.34±2.68101.75±4.6482.47±1.75Fe3+88.9±2.6881.3±5.3675.46±5.26Fe2+100±5.26119.28±4.64111.1±2.68Mg2+109.35±3.65115.19±5.3668.45±3.51Mn2+101.17±2.6895.33±4.4191.82±2.03Cu2+100.59±2.6892.99±1.7558.51±5.63
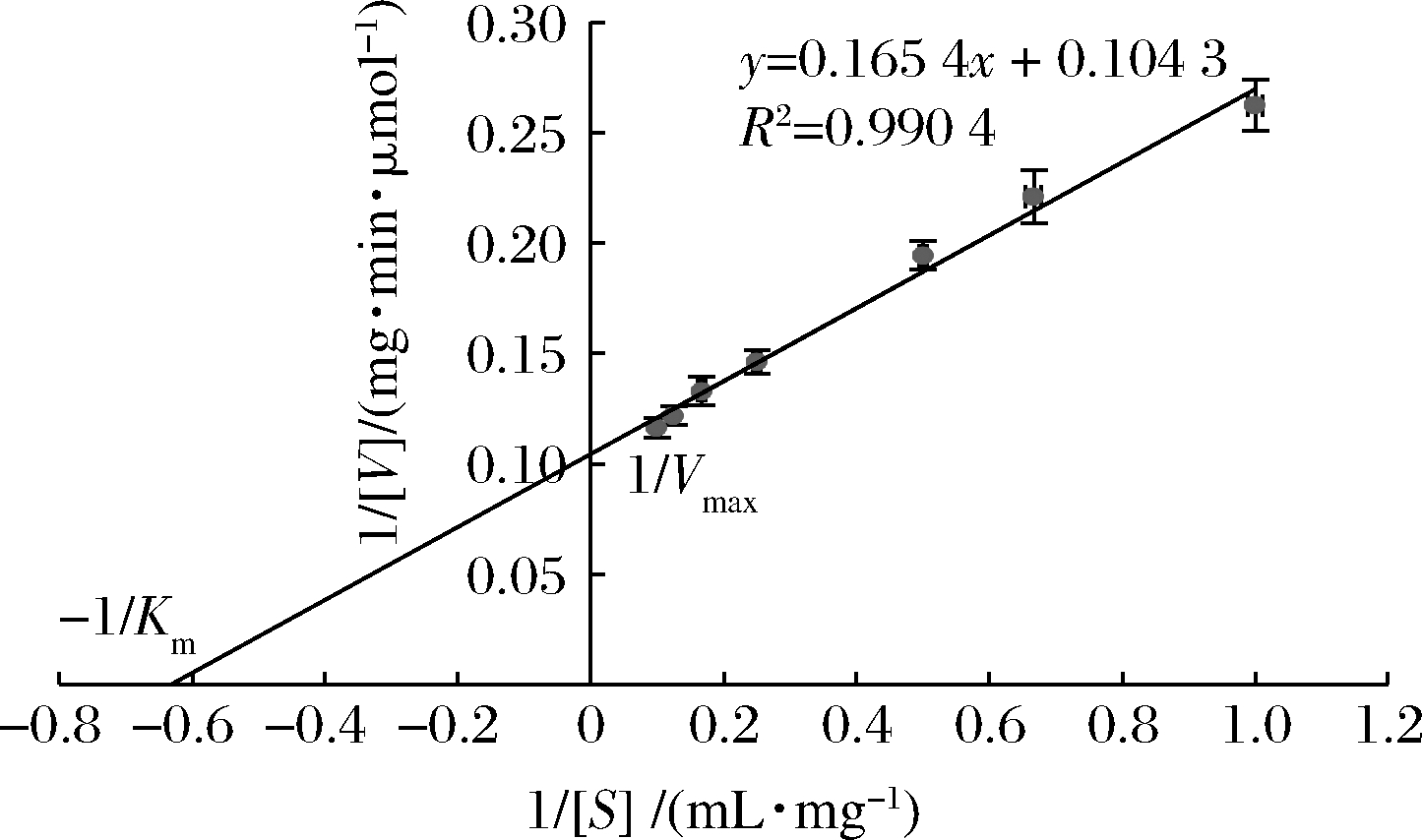
图5 Lineweaver-Burk双倒数图
Fig.5 Lineweaver-Burk curve
2.4 β-葡聚糖酶体外模拟消化
出发株与突变株固态发酵烘干后测定其β-葡聚糖酶活力分别为34.55、39.47 U/g,2株菌固态产酶差异较小的原因可能与培养基类型由液态转变为固态有关。体外模拟消化实验表明,随消化时间延长,大麦粉β-葡聚糖分解,还原糖增加,黏度下降,抗营养作用降低。在胃期消化4 h时,ARTP-9酶处理的黏度最低,较空白下降23.89%,还原糖最高,为7.47 mg/mL(图6)。肠期消化21 h时,ARTP-9酶处理黏度最低,较空白下降29.31%,还原糖最高,为0.70 mg/mL(图7)。

a-黏度组;b-还原糖组
图6 胃期模拟消化阶段黏度及还原糖变化
Fig.6 The change of viscosity and reducing sugar in simulated gastric digestion

a-黏度组;b-还原糖组
图7 肠期模拟消化阶段黏度及还原糖变化
Fig.7 The change of viscosity and reducing sugar in simulated intestinal digestion
肠期模拟消化12~15 h,ARTP-9菌株的β-葡聚糖酶对大麦粉消化率较空白和出发菌株大幅提高且差异显著(P<0.05);18~24 h,差异极显著(P<0.01)(表4)。
表4 不同菌株β-葡聚糖酶对大麦粉体外消化率的影响 单位:%
Table 4 Effects of β-glucanase from different strains on digestibility of barley powder in vitro
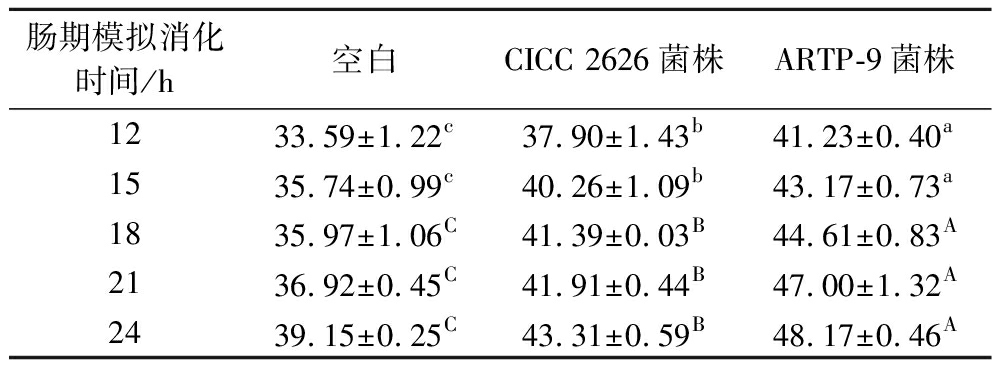
肠期模拟消化时间/h空白CICC 2626菌株ARTP-9菌株1233.59±1.22c37.90±1.43b41.23±0.40a1535.74±0.99c40.26±1.09b43.17±0.73a1835.97±1.06C41.39±0.03B44.61±0.83A2136.92±0.45C41.91±0.44B47.00±1.32A2439.15±0.25C43.31±0.59B48.17±0.46A
注:不同大写字母表示差异极显著(P<0.01)
3 讨论
本研究利用ARTP诱变里氏木霉CICC 2626选育出1株β-葡聚糖酶活力为43.75 U/mL,较出发菌株提高54.38%且遗传稳定的突变株ARTP-9。对突变株所产β-葡聚糖酶的酶学性质进行测定,最适反应温度及pH分别为50 ℃和6.0,在pH 2.5~6.5都有较好的稳定性,耐受温度为40~80 ℃,热稳定性良好。Fe2+、Mg2+等金属离子利于酶促反应的进行,Fe3+等抑制作用明显。以β-葡聚糖为底物,该酶催化反应的米氏常数Km值为1.59 mg/mL,Vmax值为6.99 μmol/(mg·min)。体外模拟消化实验结果表明,尽管两菌株固态发酵产酶差异较小,但突变株仍表现出较原始菌株更好的降黏效果,更高的还原糖生成量及体外消化率,胃期4 h黏度最低至2.23 mPa·s,肠期21 h还原糖最高达0.70 mg/mL,均比出发菌株及空白组高,24 h体外干物质消化率达到48.17%,高于出发菌株,较空白组显著提高了9.02%。诱变处理可能造成突变菌株其他碳水化合物酶活力的改变[16],例如纤维素酶,也可以使体外模拟消化过程中的黏度降低、还原糖生成量增高。
突变株所产β-葡聚糖酶的最适pH及酸碱耐受范围与来源于毕赤酵母表达系统的β-葡聚糖酶NFAmy16A-Pichia相似[17]。酶反应的最适温度与ARTP复合乙基甲基砜诱变球毛壳菌(Chaetomium globosum)获得的β-葡聚糖酶相似,但耐受温度范围更广[18]。不同真菌来源的β-葡聚糖酶Km值不同,一般介于1.11~13.38 mg/mL[19]。ARTP-9突变株产的β-葡 聚糖酶Vmax值为6.99 μmol/(mg·min),Km值为1.59 mg/mL。采用相同底物β-葡聚糖,大肠杆菌表达的来源于沙质微泡菌的β-葡聚糖酶(MaGlu16A),Vmax值为83.60 μmol/(mg·min),Km值为3.80 mg/mL[20],虽然里氏木霉来源的β-葡聚糖酶催化效率没有沙质微泡菌来源的高,但Km值更小,其底物亲和性更高。
β-葡聚糖酶能够打破β-葡聚糖特殊的支链结构,使大麦饲用粮中的非淀粉多糖转化为可消化吸收的还原糖[21],提高饲料养分利用率,降低食糜黏度及抗营养作用,减少禽类后肠发酵。SMULIKOWSKA[22]研究了酶制剂对于黑麦水提物体外消化和鸡消化道黏度的影响,其中含有β-葡聚糖酶的复合酶制剂降黏效果最好,体内外黏度分别降低77%及44%。本研究中利用ARTP-9酶制剂进行大麦粉体外模拟消化,消化液黏度下降23.89%,可能原因是菌株产酶种类没有复合酶制剂的酶系丰富。
4 结论
本文采用ARTP诱变处理获得4株β-葡聚糖酶活显著提高的里氏木霉突变株,其中ARTP-9突变株遗传稳定,其所产β-葡聚糖酶热稳定性高,酸稳定性好,提高了大麦粉体外消化率,减轻了抗营养作用,为获得β-葡聚糖酶工业生产新菌株提供了新方法。
[1] KUPETZ M, PROCOPIO S, SACHER B, et al.Critical review of the methods of β-glucan analysis and its significance in the beer filtration process[J].European Food Research and Technology, 2015, 241(6):725-736.
[2] AL-QAHTANI M, AHIWE E U, ABDALLH M E, et al.Endogenous enzyme activities and tibia bone development of broiler chickens fed wheat-based diets supplemented with xylanase, β-glucanase and phytase[J].Animal Bioscience, 2021, 34(6):1 049-1 060.
[3] HEIDARY VINCHE M, KHANAHMADI M, AHMAD ATAEI S A, et al. Investigation of the effects of fermented wheat bran extract containing beta-glucanase on beta-glucan of cereals used in animal feed[J].Cereal Chemistry, 2021, 98(3):651-659.
[4] 韩冰, 王施岚, 德青美朵, 等.一种黑曲霉高耐热β-葡聚糖酶基因的克隆、表达及重组酶性质分析[J].食品与发酵工业, 2018, 44(11):55-62.
HAN B, WANG S L, DE Q M D, et al.Gene cloning, expression and characterization analysis of a highly thermal stable β-glucanase gene from Aspergillus niger[J].Food and Fermentation Industries, 2018, 44(11):55-62.
[5] HUA C W, YI H X, JIAO L X.Cloning and expression of the endo-1, 3 (4)- β-glucanase gene from Paecilomyces sp.FLH30 and characterization of the recombinant enzyme[J].Bioscience, Biotechnology, and Biochemistry, 2011, 75(9):1 807-1 812.
[6] WANG X B, LU M S, WANG S J, et al. The atmospheric and room-temperature plasma (ARTP) method on the dextranase activity and structure[J].International Journal of Biological Macromolecules, 2014, 70:284-291.
[7] LI J, ZHU L, ZHAN X B, et al.Purification and characterization of a new endo-β-1, 3-glucanase exhibiting a high specificity for curdlan for production of β-1, 3-glucan oligosaccharides[J].Food Science and Biotechnology, 2014, 23(3):799-806.
[8] TASIRNAFAS M, KARIMI K, JAFARABADI G A, et al.Extraction and purification of β-glucanase from bovine rumen fungus Trichoderma reesei and its effect on performance, carcass characteristics, microbial flora, plasma biochemical parameters, and immunity in a local broiler hybrid Golpayegan-Ross[J].Tropical Animal Health and Production, 2020, 52(4):1 833-1 843.
[9] 朱玉霞. 高产纤维分解酶木霉和黑曲霉诱变选育及发酵条件优化[D].呼和浩特:内蒙古农业大学, 2018.
ZHU Y X.Trichoderma and Aspergillus niger with high yield fiber decomposition enzyme by mutagenesis and the optimization of fermentation process[D].Hohhot:Inner Mongolia Agricultural University, 2018.
[10] 董弦弦, 吴晓江, 张钰龙, 等.常压室温等离子体诱变选育产单宁酶炭黑曲霉及发酵参数优化[J].食品与发酵工业, 2021, 47(15):15-21.
DONG X X, WU X J, ZHANG Y L, et al. Breeding of tannase-producing Aspergillus carbonarius using ARTP mutagenesis and fermentation optimization[J].Food and Fermentation Industries, 2021, 47(15):15-21.
[11] DE G G, LAVANDERA I.Biocatalysis for Practitioners[M].Wiley, New York, 2021, 19-22.
[12] 孙军涛, 王洪新, 吕文平, 等.1, 3-1, 4-β-葡聚糖酶基因克隆表达及其耐热性研究进展[J].食品与发酵工业, 2010, 36(6):107-111;117.
SUN J T, WANG H X, LYU W P, et al. Development on 1, 3-1, 4-β-glucanases gene cloning, expression and thermostability[J].Food and Fermentation Industries, 2010, 36(6):107-111;117.
[13] 肖冬光, 丁友, 王德培, 等.里氏木霉纤维素酶在酒精生产中应用的研究[J].酿酒, 1997,24(3):12-16.
XIAO D G, DING Y, WANG D P, et al.Studies on the application of cellulase of Trichoderma reesi in alcohol production[J].Liquor Making, 1997,24(3):12-16.
[14] 刘雨田, 赵峰, 张宏福, 等.仿生消化系统模拟鸡饲料消化的适宜水解时间的研究[J].动物营养学报, 2010, 22(5):1 422-1 427.
LIU Y T, ZHAO F, ZHANG H F, et al. The optimum hydrolysis time for simulative digestion stages in a bionic digestion system designed for poultry[J].Chinese Journal of Animal Nutrition, 2010, 22(5):1 422-1 427.
[15] 沈佳琳. 黑果枸杞多糖的提取纯化、抗氧化活性及体外模拟消化和发酵研究[D].南京:南京农业大学, 2017.
SHEN J L.Isolation, purification, antioxidant bioactivity, stimulated digestion and fermentation of polysaccharides from Lycium ruthenicum Murr[D].Nanjing:Nanjing Agricultural University, 2017.
[16] ZOU Z S, ZHAO Y Y, ZHANG T Z, et al.Efficient isolation and characterization of a cellulase hyperproducing mutant strain of Trichoderma reesei[J].Journal of Microbiology and Biotechnology, 2018, 28(9):1 473-1 481.
[17] 汪凌旭, 易卓林, 罗惠波, 等.来源于不同表达菌株的β-葡聚糖酶酶学性质比较[J].应用与环境生物学报, 2022,28(5):1 312-1 317.
WANG L X, YI Z L, LUO H B, et al. Comparison of enzymatic properties of β-glucanase from different expression strains[J].Chinese Journal of Applied and Environmental Biology, 2022,28(5):1 312-1 317.
[18] YANG L, ZHOU N D, TIAN Y P.Characterization and application of dextranase produced by Chaetomium globosum mutant through combined application of atmospheric and room temperature plasma and ethyl methyl sulfone[J].Process Biochemistry, 2019, 85:116-124.
[19] 夏许寒, 朱成林, 李诚.β-1, 3-1, 4-葡聚糖酶研究进展[J].食品科学, 2016, 37(19):289-295.
XIA X H, ZHU C L, LI C.Advances in research on β-1,3-1,4-glucanase[J].Food Science, 2016, 37(19):289-295.
[20] 马俊文, 江正强, 李晨霞, 等.沙质微泡菌β-1, 3(4)-葡聚糖酶的克隆表达及酶学性质[J].微生物学通报, 2020, 47(7):2 028-2 039.
MA J W, JIANG Z Q, LI C X, et al. Cloning, expression and characterization of an β-1, 3(4)-glucanase from Microbulbifer arenaceous[J].Microbiology China, 2020, 47(7):2 028-2 039.
[21] 刘胜利, 刘示杰, 王述柏, 等.基于体外仿生消化法筛选适用于肉鸡玉米-豆粕-杂粕型饲粮的非淀粉多糖复合酶[J].动物营养学报, 2020, 32(3):1 362-1 381.
LIU S L, LIU S J, WANG S B, et al.Optimization of non-starch polysaccharide complex enzymes added to corn-soybean meal-miscellaneous meal diet for broilers by extracorporeal bionic digestion method[J].Chinese Journal of Animal Nutrition, 2020, 32(3):1 362-1 381.
[22] SMULIKOWSKA S.A simple in vitro test for evaluation of the usefulness of industrial enzymes as additives to broiler diet based on rye[J].Journal of Animal and Feed Sciences, 1992, 1(1):65-70.