致病菌盛行以及抗生素耐药给人类健康造成巨大挑战,开发安全高效且具有成本效益的抗菌剂已经成为趋势[1]。近年来,人们对多种抗菌材料——天然、有机以及无机物质,都进行了深入研究[2-5]。纳米技术的发展使得抗菌剂开发有了突破性进展。金属纳米材料,如Ag、ZnO、Zn、TiO2、Cu,表现出优异的抗菌性能,引起人们极大关注,被认为是极具应用前景的抗菌剂,有望发展为具有潜力的广谱抗菌剂,从而替代传统抗生素以解决耐药性问题[4-5]。
近年来,合金纳米复合材料因其优异的理化性能及多重功能而广受人们关注,其理化性质因其组成不同而不同,合理设计可以实现功能多样性[6-7]。氧化锌以及银纳米材料经证实可抑制多种细菌生长[8-9],且具有一定的协同作用,通过合理设计,可以合成具有优异抑菌活性的ZnO/Ag纳米复合材料[7]。目前,制备合金纳米材料的方法多样,以植物中活性成分作为还原剂绿色合成纳米材料的方法,因其合成绿色安全、简单快捷以及成本低等优点成为了近年来的研究热点[5,10]。
根据报道,以儿茶素为还原剂,成功合成了儿茶素-ZnO纳米复合材料以及儿茶素-Ag纳米复合材料,并证实所合纳米复合材料具有广谱抗菌性,表明儿茶素是金属纳米材料绿色合成的潜在还原剂[11-12]。儿茶素为多酚类化合物,具有一定的抑菌、抗氧化、抗炎、抗病毒、抗癌等作用[13]。以儿茶素为还原剂以及稳定剂,水热合成ZnO/Ag纳米复合制剂,有望实现儿茶素自身抗菌性协同合金纳米制剂抗菌性,从而提高纳米制剂的抗菌性能。而关于儿茶素功能化ZnO/Ag纳米复合材料的绿色合成,目前未有深入研究。本研究以植物活性成分儿茶素作为绿色还原剂和稳定剂,通过多次预实验优化合成方案,最终成功制备了亲水性儿茶素功能化ZnO/Ag纳米复合材料,并对所得纳米复合材料进行抑菌性能研究。
1 材料与方法
1.1 材料与设备
儿茶素,纯度≥98%,生工生物工程(上海)股份有限公司;ZnCl2,纯度≥98%,上海恒远生物科技有限公司;AgNO3,优级纯,科欧密化学试剂公司;NH3·H2O、CH3COOH,分析纯,天津富宇化工公司;营养琼脂、营养肉汤,青岛海博生物;注射用青霉素钠,哈药集团;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、白色念珠菌(Candida albicans),黑龙江省农科院应用微生物学研究所;斑马鱼,山东一溪月生物科技有限公司;超纯水,电阻率>18 MΩ·cm,实验室自制。
UV-5500紫外-可见分光光度计,上海元析仪器有限公司;IR Affinity-1傅里叶变换红外光谱仪,日本岛津公司;JEM-2100透射电子显微镜,日本电子公司;PHI5700ESCA X光电子能谱仪,System美国物理电子公司;PHG-9145A电热恒温鼓风干燥箱,上海一恒科学仪器有限公司。
1.2 儿茶素-ZnO/Ag纳米复合材料的制备
称取0.232 0 g儿茶素,250 mL超纯水定容,配制得3.2 mmol/L儿茶素水溶液;称取2.500 0 g ZnCl2,50 mL超纯水定容,配制得0.367 mol/L ZnCl2水溶液;称取2.500 0 g AgNO3,50 mL超纯水定容,配制得0.294 mol/L AgNO3水溶液。取40 mL上述儿茶素水溶液,加入0.175 mL上述氯化锌溶液和0.225 mL 上述硝酸银溶液,使得反应体系中氯化锌与硝酸银的摩尔比为1∶1,混匀,30 min后测得反应溶液pH值为6.15。利用氨水/冰醋酸将反应溶液pH值调至8.00,而后将上述溶液转移至50 mL的高压反应釜中,并在140 ℃下保持4 h。待温度达到室温后收集反应溶液,将其高速离心,弃去上清液,所得固体50 ℃下干燥12 h,即得儿茶素-ZnO/Ag纳米复合材料。
1.3 表征方法
紫外-可见分光光谱仪(ultraviolet-visible spectroscopy,UV-vis):将所制备的儿茶素-ZnO/Ag胶体溶液移至石英比色皿中,以进行UV-vis吸收光谱测定,波长范围为200~800 nm。透射电子显微镜(transmission electron microscope,TEM):将5 μL儿茶素-ZnO/Ag胶体测试液滴在碳膜铜网上,室温风干以进行TEM成像,工作电压200 kV。能谱仪(energy dispersive spectroscopy,EDS):协同TEM测试,通过EDS同步分析纳米复合材料的元素组成。X射线光电子能谱仪(X-ray photoelectron spectroscopy,XPS):样品的表面元素由XPS分析,X射线(Mg Kα)能量为1 253.6 eV。傅里叶红外光谱仪(Fourier transform infrared spectroscopy,FTIR):采用溴化钾压片法对儿茶素和儿茶素-ZnO/Ag纳米复合材料进行FTIR测试,波数范围为4 000~400 cm-1。
1.4 抑菌性能研究
选取革兰氏阳性细菌——大肠杆菌,革兰氏阴性菌——金黄色葡萄球菌及真菌——白色念珠菌,分别进行抑菌圈,最低抑菌浓度(minimum inhibitory concentration,MIC)/最低杀菌浓度(minimum bactericidal concentration,MBC)测定,以及抑菌率测定实验以探究儿茶素-ZnO/Ag纳米复合材料抑菌性能,抑菌实验均在无菌台上操作。
称取0.027 6 g儿茶素-ZnO/Ag纳米复合材料,100 mL超纯水定容,即得质量浓度为276 μg/mL的儿茶素-ZnO/Ag胶体溶液,为样品。质量浓度为100 μg/mL的青霉素溶液,质量浓度为7 350 μg/mL的儿茶素溶液,以及相同质量浓度(276 μg/mL)的AgNO3、ZnCl2溶液为对照组。分别滴加15 μL测试液于直径为6 mm圆形滤纸片上,自然晾干。取200 μL 稀释至106 CFU/mL对数期菌悬液加至营养琼脂平板,均匀涂抹,而后将自然晾干的滤纸片用镊子依次放至平板中,最后密封。将大肠杆菌与金黄色葡萄球菌置于37 ℃恒温振荡培养箱中培养24 h,白色念珠菌置于28 ℃恒温振荡培养箱中培养24 h。培养结束后,观察滤纸片周边菌落的生长状况,并拍照记录。
将儿茶素-ZnO/Ag胶体溶液和对照组中的青霉素以及儿茶素溶液进行稀释,采用两倍稀释法测定MIC及MBC。分别移取100 μL稀释后的样品或对照组于96孔板中,而后滴加100 μL菌悬液,培养的温度与时间同上述抑菌圈实验。无菌落生长的最低浓度即MIC。取10 μL上述不同浓度的悬浮液,在琼脂板上再进行接种,培养24 h,琼脂板上菌落小于5个 的最低浓度确定为MBC。
在MIC以及MBC测定的基础上进行抑菌率测定。将样品稀释至2 MIC,各菌液稀释至106 CFU/mL,两者各取100 μL进行混合。同时,以100 μL超纯水与100 μL营养培养液的混合溶液作为空白对照,100 μL细菌或真菌悬浮液与100 μL氯化钠溶液的混合溶液作为阳性对照。培养条件与抑菌圈实验相同,采用酶标仪测定635 nm波长处的光密度值(OD值)以计算抑制率,如公式(1)所示:
抑菌率![]()
(1)
式中:At,测试液OD值;A0,空白对照OD值;Acon,阳性对照OD值。
斑马鱼由于成本低,易于饲养且繁殖率高,通常被用作纳米材料安全性评估的体内模型[14]。以斑马鱼为模型动物,儿茶素-ZnO/Ag胶体溶液为测试液,进行生物相容性评估。所用斑马鱼自购买,使用充分曝气且沉淀过滤处理的自来水进行饲养,温度维持在21~23 ℃,每日喂食2次。以低MBC以及高MBC为目标浓度,使用上述自来水配制儿茶素-ZnO/Ag胶体溶液作为暴露溶液,备用。相同规格的试验箱内分别注入3 L空白对照溶液以及暴露溶液,标记为空白组,MBC处理组1(低MBC)以及MBC处理组2(高MBC)。将30尾同一批次斑马鱼随机分配引入上述试验箱中,进行为期1周的观察,并拍摄记录。
2 结果与分析
2.1 表征结果
2.1.1 UV-vis分析
紫外-可见吸收光谱是金属纳米材料结构表征最广泛使用的技术之一。金属纳米材料光学吸收光谱主要由表面等离子体共振决定,随着粒径的增大,表面等离子体共振波长会向更长的波长移动[15]。已有报道,球形ZnO纳米材料(70~75 nm)的UV-vis吸收光谱典型吸收带为380 nm[16],银纳米颗粒(~12 nm)在405 nm波长处显示尖峰吸收[17]。图1描述了所合儿茶素-ZnO/Ag纳米复合材料的UV-vis吸收光谱,并以儿茶素-ZnO以及儿茶素-Ag纳米粒子作为对照。儿茶素-ZnO/Ag纳米复合材料光学吸收光谱同儿茶素-ZnO纳米粒子相似,在350~430 nm波长处显示出宽吸收峰,相较于儿茶素-Ag纳米粒子在420 nm波长处显示尖峰吸收,其最大吸收峰出现在390 nm波长处,发生了蓝移。这种蓝移可能是由于ZnO/Ag纳米复合材料中电子空穴交换相互作用所导致,表明Ag纳米粒子与ZnO纳米粒子之间存在强大的界面电子相互作用。同时,儿茶素-ZnO/Ag纳米复合材料,由于银纳米粒子的引入,其390 nm处的吸收强度有所增强,表明银纳米颗粒沉积在ZnO纳米材料的表面,增强了其光学吸收[6,18]。
2.1.2 TEM及EDS分析
所制备儿茶素-ZnO/Ag纳米复合材料的形貌采用JEM-2100型透射电子显微镜进行分析。如图2所示,合成的纳米复合材料以棒状以及球状颗粒为主,且被儿茶素覆盖。分析图2-c、图2-d,可以看到球状纳米粒子大多分散点缀在棒状纳米粒子表面,未发生聚集,分析图2-a、图2-b,可以看到球状纳米粒子点缀在棒状纳米粒子表面,组成纳米复合材料,且呈现分散状态。以上结果表明,球状纳米粒子与棒状纳米颗粒之间存在较强的相互作用,形成ZnO-Ag键,同时体系中引入了儿茶素作为稳定剂,故合成的纳米复合材料均匀分散。

图1 儿茶素-ZnO/Ag、儿茶素-Ag以及儿茶素-ZnO纳米 复合材料的UV-vis光谱
Fig.1 UV-vis spectra of catechin-ZnO/Ag, catechin-Ag and catechin-ZnO nanocomposites

a-200 nm;b-100 nm;c, d-50 nm
图2 儿茶素-ZnO/Ag纳米复合材料TEM图
Fig.2 TEM images of catechin-ZnO/Ag nanocomposites
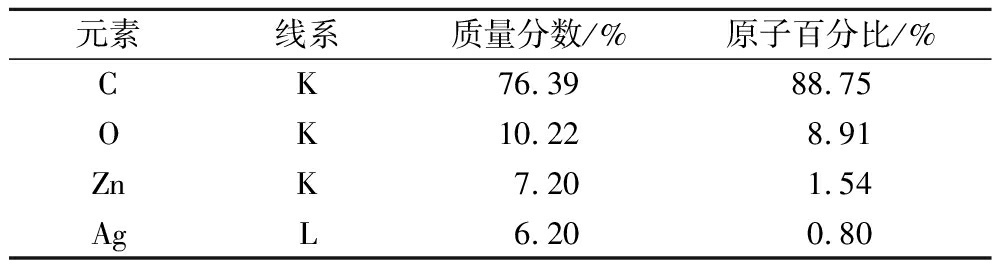
通过EDS分析进一步证实纳米复合材料的化学元素组成,其中图3为儿茶素-ZnO/Ag纳米复合材料的EDS谱图,显示其化学元素组成,表1则显示纳米复合材料元素含量情况。图1中的C、O元素归因于儿茶素的存在,值得注意的是,表1显示的C质量分数相对丰富,这是由于测试时采用碳膜铜网制作样品。表1显示Zn与Ag的质量分数别为7.20%与6.20%,以及图3中Zn、O、Ag元素的存在充分证实了纳米复合材料中ZnO和Ag纳米粒子的存在。
2.1.3 XPS分析
为阐明纳米复合材料的化学组成以及结合能下的价态,利用XPS分析进行表征,图4为Zn 2p以及Ag 3d的XPS图谱。如图4-a所示,1 046.1 eV与1 021.9 eV特征峰归因于ZnO的Zn 2p1/2和Zn 2p3/2,与报道值相一致[18]。如图4-b所示,Ag 3d5/2峰出现在366.9 eV结合能处,Ag 3d3/2峰出现在373.2 eV结合能处,3d双峰的分裂为6.0 eV,表明存在金属银[19]。与Ag 3d5/2(368.6 eV)和Ag 3d3/2(374.1 eV)标准值不同的较低结合能,这是由于电子从Ag纳米粒子转移到ZnO纳米材料表面,证实了Ag纳米粒子在ZnO纳米材料上功能化[18]。

图3 儿茶素-ZnO/Ag纳米复合材料EDS谱图
Fig.3 EDS spectrum of catechin-ZnO/Ag nanocomposites
表1 能谱仪测得的儿茶素-ZnO/Ag纳米复合材料元素含量
Table 1 Element content of catechin-ZnO/Ag nanocomposites measured by EDS
元素线系质量分数/%原子百分比/%CK76.3988.75OK10.228.91ZnK7.201.54AgL6.200.80
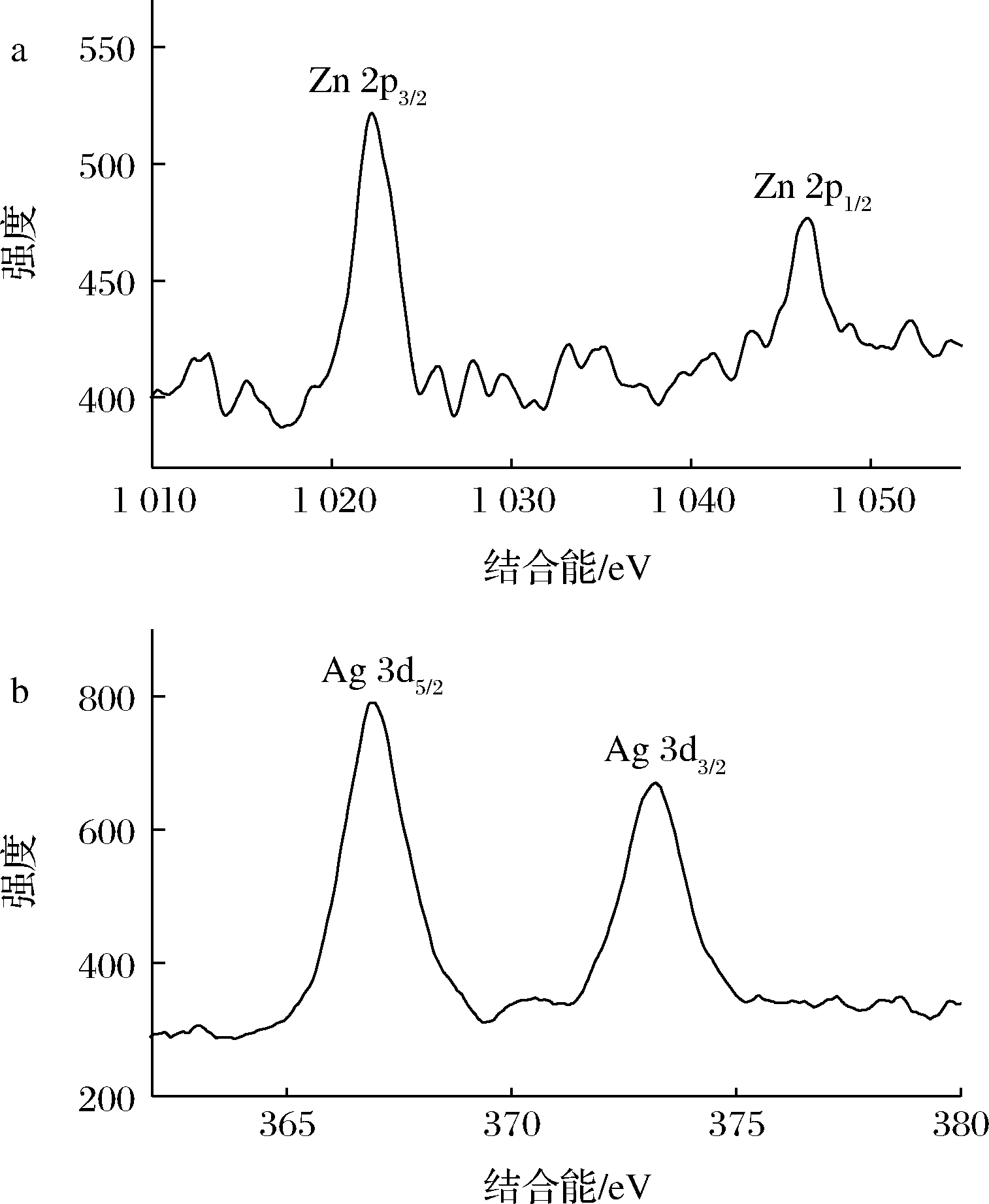
a-Zn 2p;b-Ag 3d
图4 儿茶素-ZnO/Ag纳米复合材料XPS谱图
Fig.4 XPS spectrum of catechin-ZnO/Ag nanocomposites
2.1.4 FTIR分析
图5为儿茶素-ZnO/Ag纳米复合材料的FTIR谱图,以纯儿茶素作为对照,两者FTIR谱图相似。分析纯儿茶素FTIR谱图,由于儿茶素羟基之间形成氢键,其在3 350 cm-1处产生了一个很宽的吸收带。值得注意的是,儿茶素-ZnO/Ag纳米复合材料存在相似的氢键特征吸收峰,相对而言,其位置发生红移,表明儿茶素与ZnO/Ag纳米复合材料表面发生了强烈的相互作用。此外,1 625 cm-1和1 465 cm-1处吸收峰归因于儿茶素苯环C![]() C键及烷烃C—H键的伸缩振动,1 518 cm-1处的吸收带由C—O伸缩振动引起[20]。FTIR分析结果证实了儿茶素结合于ZnO/Ag纳米复合材料表面,氢键区域的移位效应表明儿茶素的—OH与ZnO/Ag纳米复合材料表面存在相互作用。儿茶素是复合纳米材料的重要组成部分之一,羟基的引入使得复合纳米材料具有亲水性,溶于水可形成稳定胶体。
C键及烷烃C—H键的伸缩振动,1 518 cm-1处的吸收带由C—O伸缩振动引起[20]。FTIR分析结果证实了儿茶素结合于ZnO/Ag纳米复合材料表面,氢键区域的移位效应表明儿茶素的—OH与ZnO/Ag纳米复合材料表面存在相互作用。儿茶素是复合纳米材料的重要组成部分之一,羟基的引入使得复合纳米材料具有亲水性,溶于水可形成稳定胶体。
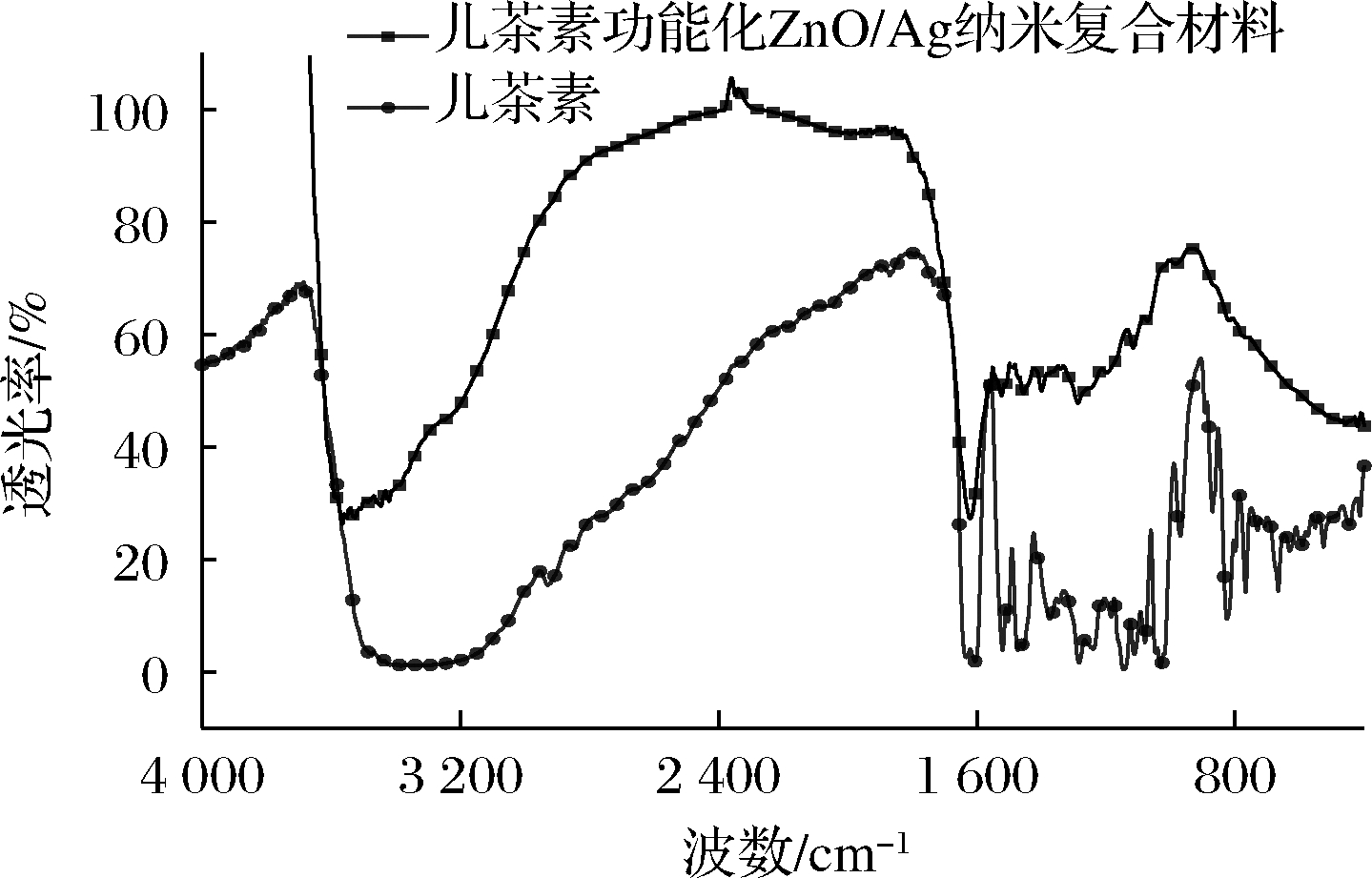
图5 儿茶素-ZnO/Ag纳米复合材料FTIR谱图
Fig.5 FTIR spectrum of catechin-ZnO/Ag nanocomposites
2.2 抑菌性能探究
图6是儿茶素-ZnO/Ag纳米复合材料抑菌圈实验结果,其中ZnCl2、AgNO3、儿茶素和青霉素溶液为对照。儿茶素-ZnO/Ag纳米复合材料对两种细菌以及白色念珠菌表现出了极强的杀菌作用,表明其具有广谱抑菌性能。对比同质量浓度ZnCl2溶液、AgNO3溶液,其抑菌效果更佳。ZnCl2以及AgNO3易于变质,且直接应用可能会对人体健康造成不可逆转的不良影响[21],而儿茶素-ZnO/Ag纳米复合材料具有长期稳定性以及生物相容性,更适用于生物抗菌应用[11,22]。

a-大肠杆菌;b-金黄色葡萄球菌;c-白色念珠菌
图6 抑菌圈
Fig.6 Bacteriostatic circle
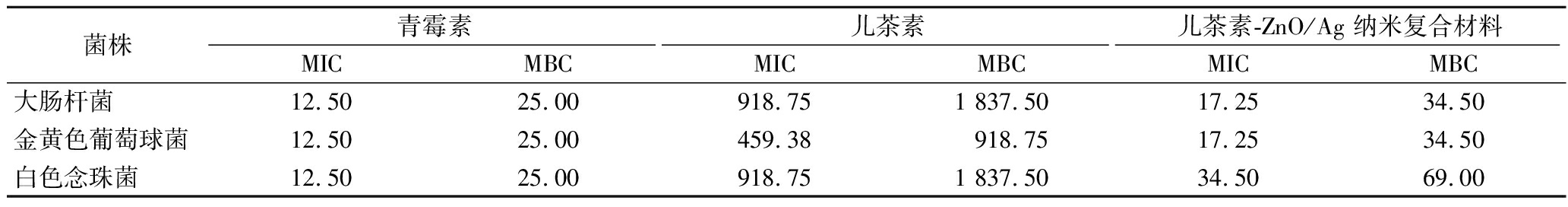
表2所示为儿茶素-ZnO/Ag纳米复合材料的MIC/MBC测定实验结果,青霉素及儿茶素为对照。在MIC的基础上进一步探索了儿茶素-ZnO/Ag纳米复合材料对大肠杆菌、金黄色葡萄球菌以及白色念珠菌的抑制率,结果如图7所示。实验结果表明,儿茶素-ZnO/Ag纳米复合材料对大肠杆菌及金黄色葡萄球菌的MIC为17.25 μg/mL,明显低于儿茶素,也略低于儿茶素-ZnO纳米复合材料(29.8 μg/mL)以及儿茶素-Ag纳米复合材料(19.63 μg/mL)[11-12]。其对白色念珠菌的MIC为34.50 μg/mL,明显低于儿茶素,略高于儿茶素-ZnO纳米复合材料以及儿茶素-Ag纳米复合材料。以上结果表明儿茶素-ZnO/Ag纳米复合材料协同儿茶素与合金纳米材料的抗菌性能,实现高效抗菌。且MIC条件下,其对3种微生物的抑制率明显都达到85%以上。值得注意的是,抑菌圈,MIC/MBC以及抑菌率测试结果都表明所合儿茶素-ZnO/Ag纳米复合材料针对细菌的抗菌效果明显强于真菌。抑菌性能研究结果表明儿茶素-ZnO/Ag纳米复合材料对细菌以及真菌都有明显抑制作用,有望开发为新型抑菌制剂。
表2 儿茶素-ZnO/Ag纳米复合材料MIC及MBC 单位:μg/mL
Table 2 MIC and MBC of catechin-ZnO/Ag nanocomposites
菌株青霉素儿茶素儿茶素-ZnO/Ag 纳米复合材料MICMBCMICMBCMICMBC大肠杆菌12.5025.00918.751 837.5017.2534.50金黄色葡萄球菌12.5025.00459.38918.7517.2534.50白色念珠菌12.5025.00918.751 837.5034.5069.00

图7 儿茶素-ZnO/Ag纳米复合材料抑菌率
Fig.7 Bacteriostatic rate of catechin-ZnO/Ag nanocomposites
为进一步评估儿茶素-ZnO/Ag纳米复合材料的生物相容性,以斑马鱼为模型动物,进行安全性评估。空白,MBC处理组1(低MBC 34.5 μg/mL)以及MBC处理组2(高MBC 69 μg/mL)各放入10尾斑马鱼,如图8-a所示。1周后,MBC处理组的斑马鱼依旧保持

a-第1天;b-第7天
图8 儿茶素-ZnO/Ag纳米复合材料安全性评价
Fig.8 Safety evaluation of catechin-ZnO/Ag nanocomposites
活跃状态,没有出现死亡情况,如图8-b所示。结果表明MBC水平的儿茶素-ZnO/Ag纳米复合材料无毒,生物相容性好。因此,高抗菌活性的儿茶素-ZnO/Ag纳米复合材料有望应用于包装材料,化妆品和生物医学应用。
3 结论与讨论
本研究开发了一种用以合成亲水性儿茶素功能化ZnO/Ag纳米复合材料的绿色合成方法,该方法简捷方便,且可批量生产。以儿茶素作为还原剂和稳定剂,要求ZnCl2和AgNO3摩尔比为1∶1,反应体系pH为8.0,密封于140 ℃反应温度下保持4 h,即可制备儿茶素-ZnO/Ag纳米复合材料。合成的儿茶素-ZnO/Ag纳米复合材料通过透射电镜图谱观察发现,是由球形的Ag纳米粒子点缀在ZnO纳米棒表面组成的纳米复合材料。FTIR谱图证实了儿茶素存在于纳米复合材料表面中,使得纳米复合材料具有亲水性。抑菌实验表明了合成的儿茶素-ZnO/Ag纳米复合材料对大肠杆菌、白色念珠菌和金黄色葡萄球菌明显的抑制作用,具有广谱抗菌性能。因此,儿茶素-ZnO/Ag纳米复合材料由于其生产便捷性以及广谱抗菌性能,有望成为新型高效抗菌剂,应用于生物医学领域中,以解决细菌感染问题。
[1] BEHZADNIA S, DAVOUDI A, REZAI M S, et al.Nosocomial infections in pediatric population and antibiotic resistance of the causative organisms in north of Iran[J].Iranian Red Crescent Medical Journal, 2014, 16(2):e14562.
[2] AMIN D H, ABOLMAATY A.Efficacy assessment of various natural and organic antimicrobials against Escherichia coli O157:H7, Salmonella enteritidis and Listeria monocytogenes[J].Bulletin of the National Research Centre, 2020, 44(1):172.
[3] CHEN R R, HAN Z H, HUANG Z L, et al.Antibacterial activity, cytotoxicity and mechanical behavior of nano-enhanced denture base resin with different kinds of inorganic antibacterial agents[J].Dental Materials Journal, 2017, 36(6):693-699.
[4] ALAVI M, KARIMI N, VALADBEIGI T.Antibacterial, antibiofilm, antiquorum sensing, antimotility, and antioxidant activities of green fabricated Ag, Cu, TiO2, ZnO, and Fe3O4 NPs via Protoparmeliopsis muralis lichen aqueous extract against multi-drug-resistant bacteria[J].ACS Biomaterials Science &Engineering, 2019, 5(9):4 228-4 243.
[5] ADEYEMI D K, ADELUOLA A O, AKINBILE M J, et al.Green synthesis of Ag, Zn and Cu nanoparticles from aqueous extract of Spondias mombin leaves and evaluation of their antibacterial activity[J].African Journal of Clinical and Experimental Microbiology, 2020, 21(2):106-113.
[6] LUNGU M V, VASILE E, LUCACI M, et al.Investigation of optical, structural, morphological and antimicrobial properties of carboxymethyl cellulose capped Ag-ZnO nanocomposites prepared by chemical and mechanical methods[J].Materials Characterization, 2016, 120:69-81.
[7] RAJITH KUMAR C R, BETAGERI V S, NAGARAJU G, et al.Synthesis of core/shell (ZnO/Ag) nanoparticles using Calotropis gigantea and their applications in photocatalytic and antibacterial studies[J].Journal of Inorganic and Organometallic Polymers and Materials, 2020, 30(9):3 410-3 417.
[8] ZHENG K Y, SETYAWATI M I, LEONG D T, et al.Antimicrobial silver nanomaterials[J].Coordination Chemistry Reviews, 2018, 357:1-17.
[9] MIRZAEI H, DARROUDI M.Zinc oxide nanoparticles:Biological synthesis and biomedical applications[J].Ceramics International, 2017, 43(1):907-914.
[10] AHMAD W, KALRA D.Green synthesis, characterization and anti microbial activities of ZnO nanoparticles using Euphorbia hirta leaf extract[J].Journal of King Saud University-Science, 2020, 32:2 358-2 364.
[11] ZHAO B H, DENG S X, LI J C, et al.Green synthesis, characterization and antibacterial study on the catechin-functionalized ZnO nanoclusters[J].Materials Research Express, 2021, 8(2):025006.
[12] 邢雅艳, 史宇哲, 邓世贤, 等.儿茶素-银纳米复合材料的制备及其应用[J].应用化学, 2020, 37(9):1 062-1 068.
XING Y Y, SHI Y Z, DENG S X, et al.Preparation and application of catechin-silver nanocomposites[J].Chinese Journal of Applied Chemistry, 2020, 37(9):1 062-1 068.
[13] BAE J, KIM N, SHIN Y, et al.Activity of catechins and their applications[J].Biomedical Dermatology, 2020, 4(1):8.
[14] PENSADO-L PEZ A, FERN
PEZ A, FERN NDEZ-REY J, REIMUNDE P, et al.Zebrafish models for the safety and therapeutic testing of nanoparticles with a focus on macrophages[J].Nanomaterials, 2021, 11(7):1784.
NDEZ-REY J, REIMUNDE P, et al.Zebrafish models for the safety and therapeutic testing of nanoparticles with a focus on macrophages[J].Nanomaterials, 2021, 11(7):1784.
[15] PAL S, TAK Y K, SONG J M.Does the antibacterial activity of silver nanoparticles depend on the shape of the nanoparticle? A study of the Gram-negative bacterium Escherichia coli[J].Applied and Environmental Microbiology, 2007, 73(6):1 712-1 720.
[16] SHARMILA G, THIRUMARIMURUGAN M, MUTHUKUMARAN C.Green synthesis of ZnO nanoparticles using Tecoma castanifolia leaf extract:Characterization and evaluation of its antioxidant, bactericidal and anticancer activities[J].Microchemical Journal, 2019, 145:578-587.
[17] SONDI I, SALOPEK-SONDI B.Silver nanoparticles as antimicrobial agent:A case study on E.coli as a model for Gram-negative bacteria[J].Journal of Colloid and Interface Science, 2004, 275(1):177-182.
[18] LIU H R, LIU H, YANG J E, et al.Microwave-assisted one-pot synthesis of Ag decorated flower-like ZnO composites photocatalysts for dye degradation and NO removal[J].Ceramics International, 2019, 45(16):20 133-20 140.
[19] DENG Q, TANG H B, LIU G, et al.The fabrication and photocatalytic performances of flower-like Ag nanoparticles/ZnO nanosheets-assembled microspheres[J].Applied Surface Science, 2015, 331:50-57.
[20] XIA J, WANG D, LIANG P, et al.Vibrational (FT-IR, Raman) analysis of tea catechins based on both theoretical calculations and experiments[J].Biophysical Chemistry, 2020, 256:106282.
[21] TOMASZ D, KRYSTYNA S, RAFA C, et al.The proapoptotic influence of AgNO3 on human keratinocytes and fibroblasts in vitro, the impact for burned patient management[J].Acta Poloniae Pharmaceutica, 2008, 65(5):515-519.
C, et al.The proapoptotic influence of AgNO3 on human keratinocytes and fibroblasts in vitro, the impact for burned patient management[J].Acta Poloniae Pharmaceutica, 2008, 65(5):515-519.
[22] ALI NAWAZ RANJHA M M, SHAFIQUE B, REHMAN A, et al.Biocompatible nanomaterials in food science, technology, and nutrient drug delivery:Recent developments and applications[J].Frontiers in Nutrition, 2022, 8:778155.