食源性肽具有多种多样的生物活性和功能附属,如抗氧化[1]、降血压[2]、降血糖[3]、抗菌[4]、免疫调节[4]等。此外,与化学合成物质相比,食源性肽安全无毒,更易被人体吸收。目前,将生物活性肽应用到保健食品和药物中成为一种趋势。然而,多肽进入体内后会被消化道上的酶降解,胃肠道中严酷的酸碱环境同样会导致其活性丧失。因此,有必要利用一些材料对多肽进行包封,达到保护其活性的目的。
针对多肽利用度低已经设计出多种递送体系,如脂质体[5]、乳液[6]、聚合物[7]、无机纳米颗粒[8]等。聚合物递送载体与其他递送载体相比具有独特的优势。首先,通过调整工艺参数可以减小聚合物的粒径,使其更容易穿过小肠上皮细胞。其次,根据聚合物的物理性质(表面电荷、疏水性)能够针对性地设计出适合不同多肽的递送体系。在聚合物中,壳聚糖因具有无毒、生物相容性好、可生物降解等特点,被认为是理想的多肽载体。NASRI等[9]制备的虾虎鱼蛋白水解产物壳聚糖纳米颗粒的粒径为4.81 μm,包封率为44%。HOSSEINI等[10]利用离子凝胶法制备的鱼纯化蛋白抗氧化肽壳聚糖纳米颗粒大致呈球形,与游离肽相比,包封后的肽具有更高的热稳定性。离子凝胶是通过在酸性条件下发生质子化的壳聚糖氨基与多价阴离子交联制备载体粒子的方法。三聚磷酸钠因其性能稳定、过程简单可控、无毒副作用,是应用最广泛的一种交联剂[11]。
本研究以壳聚糖为壁材,三聚磷酸钠做为交联剂,通过离子凝胶法制备包封鳙鱼肽的壳聚糖纳米颗粒,通过单因素试验筛选出最佳制备条件,以期提高鳙鱼肽在胃肠道中的稳定性,为鳙鱼肽在食药工业中的应用提供一定的参考。
1 材料与方法
1.1 材料与试剂
鳙鱼肽(分子质量<5 kDa),实验室自制;壳聚糖(脱乙酰度≥85%),上海麦克林生化科技有限公司;三聚磷酸钠(分析纯),南京化学试剂有限公司;胃蛋白酶、胰蛋白酶,上海源叶生物科技有限公司。
1.2 仪器与设备
UH5300紫外可见分光光度计,日本日立公司;85-2A 磁力搅拌器,上海沪析实业有限公司;GL-21M高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;Nicolet iS50傅里叶变换红外光谱仪,美国热电公司;Mastersizer 2000,英国Malvern公司;Talos L120C扫描电镜,美国赛默飞世尔科技公司;SDTA851e热重分析仪,瑞士梅特勒-托利多公司;SHJ-6A磁力搅拌水浴锅,常州金坛良友仪器有限公司。
1.3 实验方法
1.3.1 鳙鱼肽标准曲线的绘制
配制1 mg/mL的鳙鱼肽原液。分别量取0.2、0.4、0.6、0.8、1.0 mL原液于10 mL容量瓶中,并定容至相应刻度,得到不同浓度的标准溶液,用紫外可见分光光度计在220 nm处测定吸光度。所得标准方程为Y=0.008 8X-0.011 6,R2=0.999 2。其中Y为吸光度,X为鳙鱼肽浓度。
1.3.2 鳙鱼肽壳聚糖纳米颗粒的制备
参考DU等[12]制备蛋清肽壳聚糖纳米粒子的方法并稍作修改。将壳聚糖溶于质量分数为1%的冰醋酸中,搅拌过夜得到壳聚糖溶液。用浓度为1 mol/L的NaOH将壳聚糖溶液的pH调整为4,并匀速滴加浓度为2 mg/mL的鳙鱼肽,使壳聚糖与肽的质量比为1∶1。然后在磁力搅拌下以壳聚糖与三聚磷酸钠质量比为5∶1匀速滴加质量浓度为0.8 mg/mL的三聚磷酸钠溶液,并调整前后pH值使其保持一致,室温下继续磁力搅拌30 min获得鳙鱼肽壳聚糖纳米颗粒悬浮液。
1.3.3 鳙鱼肽壳聚糖纳米颗粒粒径、多分散性指数(polydispersity index,PDI)和Zeta电位的测定
通过基于动态光散射的方法对鳙鱼肽壳聚糖纳米颗粒进行表征。测量前将鳙鱼肽壳聚糖纳米颗粒悬浮液用去离子水稀释10倍,取0.8 mL样品于25 ℃下测量电位。取未稀释的悬浮液1 mL测量粒径和PDI。
1.3.4 包封率的测定
将不同条件下制备的鳙鱼肽壳聚糖纳米颗粒悬浮液注入超滤离心管(10 kDa)中,然后在4 ℃、4 000 r/min下离心20 min,未包埋的鳙鱼肽会被超滤离心至滤液中。将滤液适当稀释,然后在220 nm处测吸光度,并通过标准曲线计算未被包埋的鳙鱼肽的含量。包封率根据公式(1)计算:
包封率![]()
(1)
式中:M为添加的鳙鱼肽总量,mg;m为通过标准曲线计算所得的质量,mg。
1.3.5 壳聚糖分子质量对鳙鱼肽纳米颗粒的影响
选取分子质量分别为30、50、100、150、300 kDa的壳聚糖在1.3.2的基础上制备鳙鱼肽壳聚糖纳米颗粒。按照1.3.3的方法测量粒径、电位和PDI。
1.3.6 鳙鱼肽壳聚糖纳米颗粒制备工艺单因素试验
1.3.6.1 壳聚糖溶液pH值选择
配制1 mg/mL的壳聚糖溶液,用1 mol/L的NaOH 调整pH值分别为2、3、4、5、6,按照壳聚糖与鳙鱼肽质量比1∶1添加多肽,壳聚糖与三聚磷酸钠质量比5∶1添加0.8 mg/mL的三聚磷酸钠,通过包埋率、粒径、电位和PDI等指标考察壳聚糖溶液pH值对鳙鱼肽壳聚糖纳米颗粒的影响。
1.3.6.2 壳聚糖浓度的选择
分别配制0.2、0.5、1.0、1.5、2.0 mg/mL的壳聚糖溶液,采取上述实验获得的最佳壳聚糖浓度和pH值,按照壳聚糖与鳙鱼肽质量比1∶1添加多肽,壳聚糖与三聚磷酸钠质量比5∶1添加0.8 mg/mL的三聚磷酸钠,通过包埋率、粒径、电位和PDI等指标考察壳聚糖浓度对鳙鱼肽壳聚糖纳米颗粒的影响。
1.3.6.3 壳聚糖与三聚磷酸酸钠质量比的选择
采取上述实验获得的最佳壳聚糖浓度和pH值,设置壳聚糖与三聚磷酸钠质量比分别为7∶1、6∶1、5∶1、4∶1、3∶1,通过包埋率、粒径、电位和PDI等指标考察壳聚糖与三聚磷酸钠质量比对鳙鱼肽壳聚糖纳米颗粒的影响。
1.3.7 鳙鱼肽壳聚糖纳米颗粒的体外性质
1.3.7.1 傅里叶红外光谱分析
采用压片法,将壳聚糖、纯肽、空纳米颗粒和包封鳙鱼肽的纳米颗粒与KBr按照一定比例混合,压片后置于红外光谱仪样品仓内进行扫描采集,扫描波数范围4 000~600 cm-1。
1.3.7.2 透射电子显微镜(transmission electron microscope,TEM)分析
将鳙鱼肽壳聚糖纳米颗粒悬浮液与去离子水以体积比1∶19混合,取混合后的悬浮液滴加到铜网上进行TEM观察。
1.3.7.3 热重分析(thermogravimetric analysis,TGA)
取鳙鱼肽、空载纳米颗粒和负载纳米颗粒5~10 mg置于TGA炉中,在升温速率10 ℃/min、升温范围25~650 ℃、23 mL/min的条件下进行测量。
1.3.7.4 体外模拟消化
参考栾晓旭等[13]的方法进行模拟消化,将鳙鱼肽和负载鳙鱼肽的壳聚糖纳米颗粒分别投入含有胃蛋白酶的溶液中,调整pH值为2,37 ℃下磁力搅拌2 h。随后调整pH值为7.5,加入胰蛋白酶酶解2 h。分别取胃蛋白酶和胰蛋白酶消化后的样品于220 nm出测吸光度,通过标准曲线和公式(2)计算保留率:
保留率![]()
(2)
1.4 数据分析
所有处理均一式三份进行分析,使用SPSS程序进行方差分析确定各组之间的显著性差异,并使用Origin 2018 软件进行绘图。
2 结果与分析
2.1 壳聚糖分子质量的选择
不同分子质量壳聚糖对鳙鱼肽壳聚糖纳米颗粒粒径、PDI和电位的影响如表1所示。由表1可知,随着壳聚糖分子质量的增加,体系的Zeta电位数值也随之变大,可能是由于不同分子质量的壳聚糖脱乙酰度不均一所导致。除分子质量为30 kDa的壳聚糖外,其余分子质量壳聚糖体系的Zeta电位值均大于+30,表明该体系是一个稳定的系统[14]。粒径随分子质量的变化呈现波动趋势,50 kDa和100 kDa时粒径较小,且无显著性差异。研究表明粒径越小的纳米颗粒越容易穿过小肠上皮细胞被人体吸收[15]。PDI是衡量颗粒均匀性的指标,范围从0~1, PDI的值越接近零,体系越均一[16]。其中分子质量为50 kDa的壳聚糖制备的纳米颗粒PDI最小,因此体系最均一。综合Zeta电位、PDI和粒径3个指标,在后续的单因素试验中采用分子质量为50 kDa的壳聚糖作为实验条件。
表1 壳聚糖分子质量对纳米颗粒粒径、PDI、Zeta电位的影响
Table 1 Effects of chitosan molecular weight on nanoparticle size, PDI, and Zeta potential
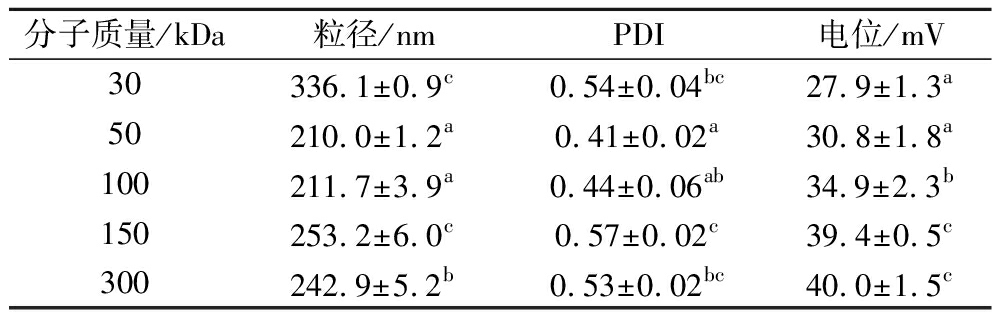
分子质量/kDa粒径/nmPDI电位/mV30336.1±0.9c0.54±0.04bc27.9±1.3a50210.0±1.2a0.41±0.02a30.8±1.8a100211.7±3.9a0.44±0.06ab34.9±2.3b150253.2±6.0c0.57±0.02c39.4±0.5c300242.9±5.2b0.53±0.02bc40.0±1.5c
注:表中相同小写字母表示无显著性差异(P>0.05)(下同)
2.2 鳙鱼肽壳聚糖纳米颗粒制备工艺单因素优化
2.2.1 壳聚糖溶液pH值对纳米颗粒的影响
酸性条件下壳聚糖上的氨基去质子化带正电,与带负电的磷酸基团交联形成纳米颗粒。因此体系的pH值对纳米颗粒的形成具有重要的影响。由表2可知,包封率随pH值的增加呈现先上升后下降的趋势,pH值为4时包封率最高。随着pH值的变大,氨基的电离受限制,因此Zeta电位值也随之下降。粒径呈现先降低后上升的趋势,这与钱浩[17]的实验结果类似。当体系pH值增加到6时粒径急剧增加,结合实验过程中有乳白色沉淀推断pH值为6时体系带的正电荷最多,三聚磷酸钠和抗氧肽通过竞争性结合将剩余带正电的壳聚糖包裹其中,使去质子化的壳聚糖从颗粒上剥离下来,在重力作用下发生絮凝和沉淀[18]。另外pH值为4时粒径最小,因此在后续的实验中选取壳聚糖溶液的pH值为4作为实验条件。
表2 壳聚糖溶液pH值对纳米颗粒粒径、PDI、Zeta电位和包封率的影响
Table 2 Effects of pH of chitosan solution on nanoparticle size, PDI, Zeta potential, and encapsulation efficiency

pH粒径/nmPDI电位/mV包封率/%2227.3±14.5ab0.66±0.11c38.3±1.0d40.6±6.2a3197.4±2.1a0.446±0.01b 28.8±2.6bc40.8±3.9a4212.0±1.2a 0.41±0.03ab30.8±1.8c48.8±3.0a5283.2±5.9b0.29±0.04a26.9±0.4b39.3±2.0a61 774.3±62.5c 0.40±0.03ab18.6±0.3a34.5±5.3a
2.2.2 壳聚糖浓度对纳米颗粒的影响
由表3可知,鳙鱼肽壳聚糖纳米颗粒的包封率呈现先上升后下降的趋势,当壳聚糖质量浓度为0.5 mg/mL时包封率最高,此时体系内带正电的氨基与带负电的磷酸基团相互作用最强,因此包封率最大。随着壳聚糖浓度的增加,电离出的氨基数量也随之增多,这点从Zeta电位的数值变化可以看出。但浓度过高时,溶液黏度变大,导致粒径增大,同时也会阻碍抗氧化肽在壳聚糖分子周围运动,导致包封率下降。当壳聚糖质量浓度为0.5 mg/mL时,PDI值为0.43,说明此时体系均一稳定。所以采用0.5 mg/mL的壳聚糖作为下面实验的条件。
2.2.3 壳聚糖与三聚磷酸钠质量比对纳米颗粒的影响
由表4可知,包封率随壳聚糖与三聚磷酸钠质量比的降低呈现先上升后降低的趋势,当两者质量比为6∶1时包封率最大,此时体系所存在的氨基与磷酸基团能够完全交联,因此对抗氧化肽的包封率最高。随着壳聚糖与三聚磷酸钠质量比的降低,体系内壳聚糖质量减少,带正电的氨基基团不足以与磷酸基团完全交联,导致包封率降低。粒径与Zeta电位分别呈现上升和下降趋势,这与GAN等[19]的研究结果类似。当壳聚糖与三聚磷酸钠质量比为6∶1时,Zeta电位值大于+30,该体系稳定,PDI值为0.293~0.411,表明粒径大小得到了很好的控制,均一性较好。
表3壳聚糖浓度纳米颗粒粒径、PDI、Zeta电位和包封率的影响
Table 3 Effects of chitosan concentration on nanoparticle size, PDI, Zeta potential, and encapsulation efficiency

质量浓度/(mg·mL-1)粒径/nmPDI电位/mV包封率/%0.2206.2±1.95a0.358±0.01ab14.1±1.6a39.9±1.29a0.5206.3±1.6a0.431±0.01c30.6±2.7b62.6±0.1c1.0212.0±1.2b0.411±0.03bc30.8±1.8b48.8±3.0b1.5312.8±3.2c0.298±0.03a40.8±1.3c45.5±3.5ab2.0346.1.2±1.4d0.400±0.02bc42.4±0.7c45.7±0.3ab
表4 壳聚糖与三聚磷酸钠质量比对纳米颗粒粒径、PDI、Zeta电位和包封率的影响
Table 4 Effects of the mass ratio of chitosan and sodium tripolyphosphate on the particle size, PDI, Zeta potential, and encapsulation efficiency of nanoparticles

质量比粒径/nmPDI电位/mV包封率/%7∶1196.9±0.87a0.397±0.007b42.2±0.7c65.3±1.2a6∶1201.4±6.7a0.315±0.03a37.3±1.2b79.6±1.1b5∶1212.0±1.2b0.411±0.03b30.8±1.8a70.1±4.8a4∶1231.0±4.9c0.293±0.003a29.8±1.8a67.3±2.6a3∶1235.1±3.6c0.309±0.003a28.2±0.9a66.6±1.2a
2.3 傅里叶红外光谱分析
游离肽、壳聚糖、空纳米颗粒和包封多肽纳米颗粒的红外图谱如图1所示。3 300~3 450 cm-1的吸收峰归因于壳聚糖中羟基、氨基和酰胺基的拉伸振动。通过观察壳聚糖与负载多肽的纳米颗粒红外图谱可知,壳聚糖在3 453 cm-1处的吸收峰转移到空纳米颗粒中更低的波数中(3 365 cm-1),且峰型略有变窄,表明氢键减少,说明壳聚糖与三聚磷酸钠发生了离子交联[20]。同时壳聚糖中酰胺Ⅰ带(1 667 cm-1)和酰胺Ⅱ带(1 596 cm-1)在空纳米颗粒中分别消失和变弱,这也是由于壳聚糖中的氨基基团和三聚磷酸钠中的磷酸基团产生了离子交联的缘故。此外,在780~540 cm-1也观察到壳聚糖与三聚磷酸钠之间的相互作用,该范围表示基团对称反应的模型[21]。在空纳米颗粒中3 365 cm-1处的O—H拉伸在负载多肽的纳米颗粒中移动到更低波数中(3 291 cm-1),可归因于鳙鱼肽的负电荷与壳聚糖正电荷之间的静电作用,这与NASRI等[9]的研究结果类似。1 078 cm-1处的峰同时出现在鳙鱼肽和负载鳙鱼肽纳米颗粒的红外图谱中,进一步说明了鳙鱼肽被包封在了壳聚糖纳米颗粒中。
2.4 表面微观结构分析
最佳制备条件下的粒径分布和表面形态如图2所示。粒径分布曲线显示单峰分布,一个峰值代表主要粒径,由图2-a可知,包封鳙鱼肽的壳聚糖纳米颗粒的粒径在210 nm左右。由图2-b可知,该纳米颗粒呈圆形,大小较为均一,这与ZHAO等[22]负载鱼源肽所观察到的形态类似。分布较散可能与稀释倍数过高有关。粒径大小与粒径分布图中显示的相一致,ZHANG等[23]在制备茶多酚-Zn复合物装载的α-和β-壳聚糖纳米粒子时得出与此相同的结论。

a-鳙鱼肽;b-壳聚糖;c-空载壳聚纳米颗粒; d-负载鳙鱼肽壳聚糖纳米颗粒
图1 鳙鱼肽、壳聚糖、空载壳聚纳米颗粒、负载鳙鱼肽壳 聚糖纳米颗粒傅里叶红外光谱图
Fig.1 Fourier transform infrared spectra of bighead carp peptide, chitosan, unloaded chitosan nanoparticles, and bighead carp peptide-loaded chitosan nanoparticles
2.5 热稳定性分析
热重分析广泛用于评价微胶囊的热稳定性。如图3-a所示,样品的质量损失随温度的升高而降低,650 ℃时肽和空载纳米颗粒的剩余质量分别为27.8%和34.5%。与游离肽相比,壳聚糖与三聚磷酸钠的离子交联提高了鳙鱼肽的热稳定性,650 ℃时剩余质量为43%。鳙鱼肽的降解曲线主要分为2个阶段,第一次失重发生在75~100 ℃,与水分的蒸发有关,220~480 ℃质量的损失可归因于多肽的分解。

a-最佳条件下粒径分布曲线;b-鳙鱼肽壳聚糖纳米颗粒TEM图
图2 鳙鱼肽壳聚糖纳米颗粒粒径分布曲线和TEM图
Fig.2 Particle size distribution curve and TEM image of bighead carp peptide-chitosan nanoparticles

a-质量损失图;b-质量变化速率图
图3 鳙鱼肽、空载纳米颗粒和负载纳米颗粒质量损失图和 质量损失变化速率图
Fig.3 Mass loss and change rate of mass loss of bighead carp peptides, unloaded nanoparticles, and loaded nanoparticles
质量变化速率图显示空载纳米颗粒在254 ℃处的失重峰与壳聚糖和三聚磷酸钠的分解有关,NASRI等[9]包封虾虎鱼蛋白水解产物时得出与此相同的结论。负载纳米颗粒在254 ℃处同样具有失重峰,再次证明了鳙鱼肽被包封在壳聚糖纳米颗粒中,以及高温对其保护作用。
2.6 消化前后多肽保留率分析
如图4所示,鳙鱼肽经过模拟肠胃消化后会被降解,经胃肠道酶消化后保留率分别降低10.3%和23.5%,这与曹振海等[24]的报道一致。而经壳聚糖纳米颗粒包封后,鳙鱼肽在模拟胃肠消化后保留率有所提高。说明壳聚糖纳米颗粒包封后阻止了胃肠道中的酶的降解,对鳙鱼肽起到了一定的保护作用。
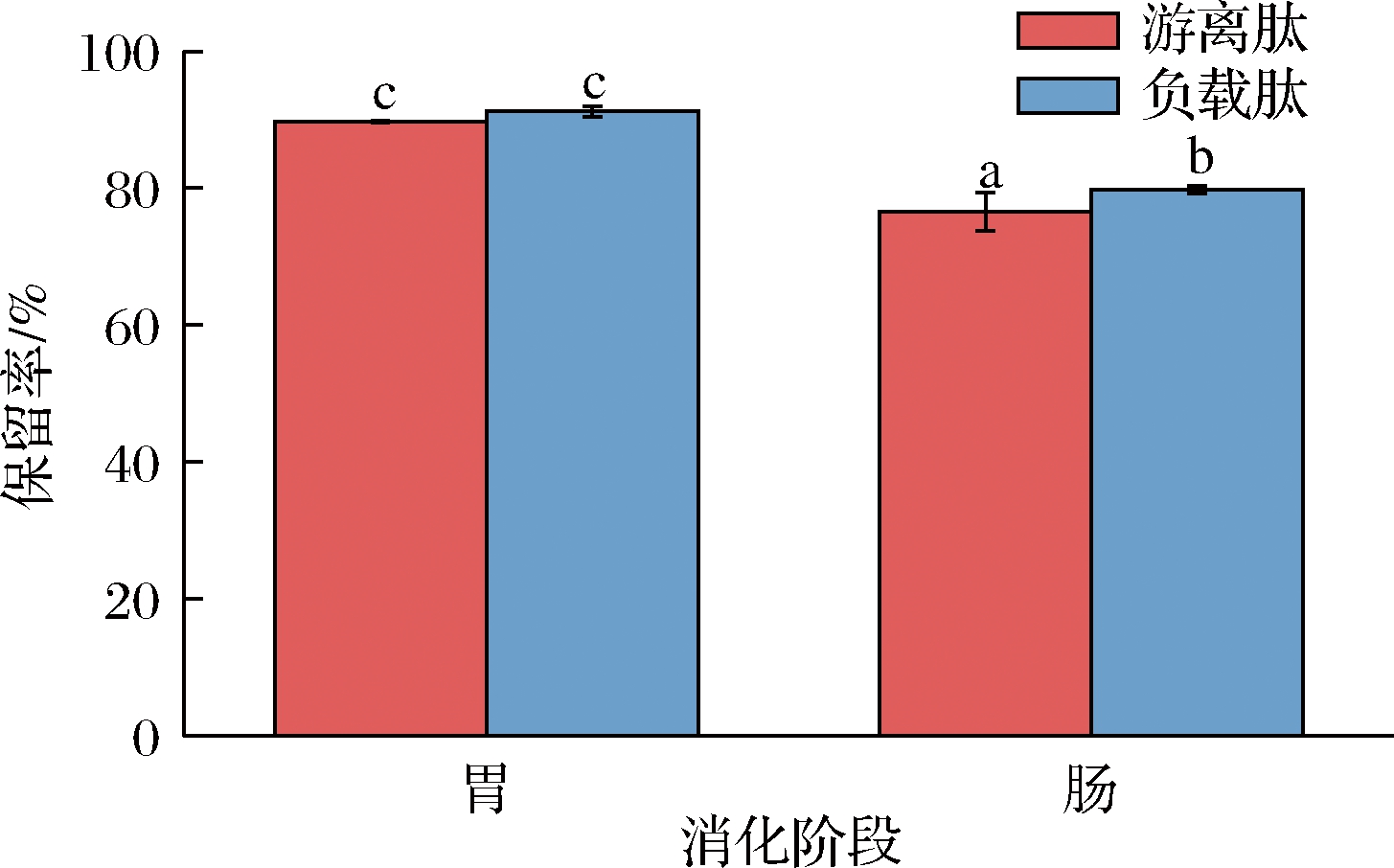
图4 壳聚糖纳米颗粒包埋前后鳙鱼肽模拟体外消化结果
Fig.4 Simulated in vitro digestion results of bighead carp peptides before and after chitosan nanoparticles encapsulation
3 结论
本研究通过单因素试验筛选出鳙鱼肽壳聚糖纳米颗粒的最佳制备条件,最佳制备条件为:壳聚糖分子质量为50 kDa,壳聚糖溶液pH值为4,壳聚糖溶液质量浓度为0.5 mg/mL,壳聚糖与三聚磷酸钠质量比为6∶1。最佳条件下包封率为79.6%,粒径为212 nm,PDI和Zeta电位值表明最佳制备条件下体系均一稳定;TEM图显示该纳米颗粒呈圆形;包封后提高了鳙鱼肽的热稳定性以及在胃肠道中的稳定性。
[1] LI G S, ZHAN J Q, HU L P, et al.Identification of novel antioxidant peptide from porcine plasma hydrolysate and its effect in in vitro digestion/HepG2 cells model[J].Journal of Food Biochemistry, 2022, 46(4):e13853.
[2] SHI C Y, LI T T, HUANG J C, et al.Effect of processing conditions and simulated gastrointestinal digestion on the activity of angiotensin I-converting enzyme (ACE) inhibitory peptide derived from duck meat hydrolysate[J].CyTA-Journal of Food, 2019, 17(1):393-399.
[3] WANG B B, YU Z, YOKOYAMA W, et al.Collagen peptides with DPP-IV inhibitory activity from sheep skin and their stability to in vitro gastrointestinal digestion[J].Food Bioscience, 2021, 42:101161.
[4] SONG W G, KONG X Z, HUA Y F, et al.Antioxidant and antibacterial activity and in vitro digestion stability of cottonseed protein hydrolysates[J].LWT, 2020, 118(10):108724.
[5] REZAEI N, MEHRNEJAD F, VAEZI Z, et al.Encapsulation of an endostatin peptide in liposomes:Stability, release, and cytotoxicity study[J].Colloids and Surfaces B:Biointerfaces, 2020, 185:110552.
[6] GIROUX H J, ROBITAILLE G, BRITTEN M, et al.Controlled release of casein-derived peptides in the gastrointestinal environment by encapsulation in water-in-oil-in-water double emulsions[J].LWT-Food Science and Technology, 2016, 69:225-232.
[7] DÖLEN Y, GILEADI U, CHEN J L, et al.PLGA nanoparticles co-encapsulating NY-ESO-1 peptides and IMM60 induce robust CD8 and CD4 T cell and B cell responses[J].Frontiers in Immunology, 2021, 12:641703.
[8] BEITZINGER B, GERBL F, VOMHOF T, et al.Delivery by dendritic mesoporous silica nanoparticles enhances the antimicrobial activity of a napsin-derived peptide against intracellular Mycobacterium tuberculosis[J].Advanced Healthcare Materials, 2021, 10(14):2100453.
[9] NASRI R, HAMDI M, TOUIR S, et al.Development of delivery system based on marine chitosan:Encapsulationand release kinetic study of antioxidant peptides from chitosan microparticle[J].International Journal of Biological Macromolecules, 2021, 167:1 445-1 451.
[10] HOSSEINI S F, SOLEIMANI M R, NIKKHAH M.Chitosan/sodium tripolyphosphate nanoparticles as efficient vehicles for antioxidant peptidic fraction from common kilka[J].International Journal of Biological Macromolecules, 2018, 111:730-737.
[11] PAN C L, QIAN J Q, ZHAO C Y, et al.Study on the relationship between crosslinking degree and properties of TPP crosslinked chitosan nanoparticles[J].Carbohydrate Polymers, 2020, 241:116349.
[12] DU Z Y, LIU J B, ZHANG T, et al.A study on the preparation of chitosan-tripolyphosphate nanoparticles and its entrapment mechanism for egg white derived peptides[J].Food Chemistry, 2019, 286:530-536.
[13] 栾晓旭, 冯美琴, 孙健.发酵香肠源抗氧化肽的稳定性[J].食品科学, 2020, 41(16):1-7.
LUAN X X, FENG M Q, SUN J.Stability of antioxidant peptides extracted from fermented sausages[J].Food Science, 2020, 41(16):1-7.
[14] ANANDHAKUMAR S, KRISHNAMOORTHY G, RAMKUMAR K M, et al.Preparation of collagen peptide functionalized chitosan nanoparticles by ionic gelation method:An effective carrier system for encapsulation and release of doxorubicin for cancer drug delivery[J].Materials Science and Engineering, 2017, 70:378-385.
[15] 郝晓丽, 吉日木图, 何静.利用纳米载体口服递送生物活性肽的研究进展[J].食品科学, 2021, 42(11):341-348.
HAO X L, JIRIMUTU, HE J.Recent progress of nanocarriers for the oral delivery of bioactive peptides[J].Food Science, 2021, 42(11):341-348.
[16] SINGH J, MCCARTHY O J, SINGH H.Physico-chemical and morphological characteristics of New Zealand Taewa (Maori potato) starches[J].Carbohydrate Polymers, 2006, 64(4):569-581.
[17] 钱浩. 基于壳聚糖包埋的植酸酶纳米粒制备、特性及体外消化研究[D].杨凌:西北农林科技大学, 2021.
QIAN H.Preparation, characterization and in vitro digestion of phytase nanoparticles embedded in chitosan[D].Yangling:Northwest A &F University, 2021.
[18] 杜志阳. 壳聚糖自组装递送体系的构建及其对活性物质的缓控效用[D].长春:吉林大学, 2020.
DU Z Y.Construction of chitosan self-assembly delivery system and its slow-control effect on active substances[D].Changchun:Jilin University,2020.
[19] GAN Q, WANG T, COCHRANE C, et al.Modulation of surface charge, particle size and morphological properties of chitosan-TPP nanoparticles intended for gene delivery[J].Colloids and Surfaces B:Biointerfaces, 2005, 44(2-3):65-73.
[20] 张洪才. 壳聚糖纳米粒子的制备和功效评价及其在生物活性物质载体中的应用[D].上海:上海交通大学, 2015.
ZHANG H C.Preparation and efficacy evaluation of chitosan nanoparticles and their application in carriers of bioactive substances[D].Shanghai:Shanghai Jiao Tong University, 2015.
[21] KIILLL C P, DA SILVA BARUD H, SANTAGNELI S H, et al.Synthesis and factorial design applied to a novel chitosan/sodium polyphosphate nanoparticles via ionotropic gelation as an RGD delivery system[J].Carbohydrate Polymers, 2017, 157:1 695-1 702.
[22] ZHAO Y H, DU W W, WU H H, et al.Chitosan/sodium tripolyphosphate nanoparticles as efficient vehicles for enhancing the cellular uptake of fish-derived peptide[J].Journal of Food Biochemistry, 2019, 43(2):e12730.
[23] ZHANG H C, ZHAO Y Y.Preparation, characterization and evaluation of tea polyphenol-Zn complex loaded β-chitosan nanoparticles[J].Food Hydrocolloids, 2015, 48:260-273.
[24] 曹振海, 乐彩虹, 陶宁萍, 等.体外模拟消化对暗纹东方鲀鱼皮胶原蛋白肽结构特征及抗氧化活性的影响[J].食品与发酵工业, 2021, 47(23):61-69.
CAO Z H, LE C H, TAO N P, et al.Effects of structural characteristics and antioxidant activity of collagen bioactive peptides from Takifugu obscurus skin during simulated gastrointestinal digestion[J].Food and Fermentation Industries, 2021, 47(23):61-69.