2017年的统计调查显示,全球患高血压的人数达到9.72亿,而且中国老年高血压患病率高达49.1%[1]。高血压是导致心脑血管疾病的主要因素,最常见的严重慢性健康问题包括心肌梗死、动脉硬化、中风和终末期肾脏疾病等,全球约有15%~20%的人因患高血压导致一系列疾病或死亡[2]。因此,高血压已逐渐成为突出的社会健康问题,治疗和预防高血压是当今社会最重要的课题之一。
血管紧张素转换酶(angiotensin-I-converting enzyme,ACE)抑制肽是目前临床用于降血压的主要药物之一,其原理是通过对ACE酶活性的抑制作用,阻断肾素血管紧张素系统,从而达到降压效果[3]。虽然合成的ACE抑制剂是有效的降压药,但它们可能会产生不良的副作用,如咳嗽、过敏反应、味觉障碍、肾脏损害、血管神经性水肿和皮疹等[4]。因此,有必要从藻类、鱼类等高蛋白质的食品中摄入天然无毒的ACE抑制肽,这些天然的ACE抑制剂比合成的更具有安全、环保的特点。
浒苔俗称青海苔、苔条等,为近海滩涂常见的天然野生绿藻,其生长能力非常强,产量巨大[5-6]。我国东海海域浒苔资源丰富,仅青岛海域每年天然产量就约为100万t[5]。浒苔营养丰富、味道鲜美且具有较高的药用价值,开发应用潜力巨大。目前浒苔的开发利用大多加工为食品、动物饲料和肥料,深加工产品较少,其功能成分尚未得到充分利用。段训威等[6]采用木瓜蛋白酶酶解浒苔蛋白制备抗肺癌活性多肽。还有研究表明,采用碱性蛋白酶对浒苔酶解后,可得到具有ACE抑制活性的酶解产物[7]。以浒苔为原料制备活性肽,具有较大的开发潜力,目前对浒苔活性肽的研究较少,鲜有得到具有较高活性的ACE抑制肽。
有研究表明,功能性肽在胃肠消化过程中受pH、温度和消化酶等的影响,其结构发生改变导致功能活性减弱[8]。而摄入食源性蛋白质通过消化过程产生的短肽具有较强的抗消化降解能力,同时也具有较强的吸收能力。本文以浒苔为原料,采用模拟肠胃液消化条件对其进行水解,以体外ACE抑制率为指标,并采用超滤、凝胶色谱、离子色谱和反向色谱对浒苔模拟肠胃消化水解液进行分离纯化和筛选,以期获得纯度较高的ACE抑制肽,并采用高效液相-四级杆飞行时间串联质谱(high performance liquid phase-four-pole time-of-flight tandem mass spectrometry,HPLC-Q-TOF-MS)对ACE抑制肽的氨基酸序列进行分析鉴定,研究结果为浒苔高值化利用提供科学依据。
1 材料与方法
1.1 材料与试剂
浒苔;胃蛋白酶(EC 232-629-3)、胰蛋白酶(EC 232-468-9),美国sigma公司;乙腈、三氟乙酸(色谱级),Fisher科学公司(美国)。其他试剂均为分析级试剂,国药化学试剂公司(中国上海)。
1.2 仪器与设备
AKTA-prime蛋白质纯化仪,美国GE公司;FDU-1100型真空冷冻干燥机,东京理化器械株式会社;台式高速大容量冷冻离心机,艾德本中国有限公司;全波长扫描式多功能酶标仪,VarioskanR Flash;XW-80A旋锅混合器,上海医大仪器有限公司;ZY-1000切向流超滤系统,上海紫裕生物科技有限公司;Sephadex G-15(精),瑞典法玛西亚公司;UV-2550紫外可见分光光度计,上海旦鼎国际贸易有限公司;LC-20AD高效液相色谱仪,日本岛津公司;高效液相凝胶色谱柱Protein-PAK60(WAT085250),美国waters公司;1200型快速分离液相色谱系统、6520四极杆飞行时间串联质谱仪(quadrupole tandem mass spectrometry,Q-TOF),美国Agilent公司。
1.3 实验方法
1.3.1 浒苔模拟肠胃液消化水解液的制备
采用HERN NDEZ-LEDESMA等[9]的体外模拟胃肠道消化方法,部分有所改进。通过模拟胃肠道消化环境的方式对浒苔进行酶解,模拟胃消化:用1 mol/L 的HCl调节上述匀浆pH 2.0,按m(酶)∶m(底物)=1∶50 的比例加入胃蛋白酶2 g,搅拌混匀,于37 ℃下水解120 min。模拟肠道消化:模拟胃消化120 min后,用1 mol/L的NaOH调节消化液pH 7.5,m(酶)∶m(底物)=1∶25加入胰酶4 g,搅拌混匀,于37 ℃下水解280 min,消化结束后,于80 ℃的水浴中加热20 min,获得浒苔模拟肠胃液消化水解液。然后用无机陶瓷膜微滤处理所得水解液,再使用超滤膜进行全回流式超滤分离,分别收集不同相对分子质量组分的酶解液,放置于4 ℃备用。
NDEZ-LEDESMA等[9]的体外模拟胃肠道消化方法,部分有所改进。通过模拟胃肠道消化环境的方式对浒苔进行酶解,模拟胃消化:用1 mol/L 的HCl调节上述匀浆pH 2.0,按m(酶)∶m(底物)=1∶50 的比例加入胃蛋白酶2 g,搅拌混匀,于37 ℃下水解120 min。模拟肠道消化:模拟胃消化120 min后,用1 mol/L的NaOH调节消化液pH 7.5,m(酶)∶m(底物)=1∶25加入胰酶4 g,搅拌混匀,于37 ℃下水解280 min,消化结束后,于80 ℃的水浴中加热20 min,获得浒苔模拟肠胃液消化水解液。然后用无机陶瓷膜微滤处理所得水解液,再使用超滤膜进行全回流式超滤分离,分别收集不同相对分子质量组分的酶解液,放置于4 ℃备用。
1.3.2 浒苔模拟肠胃液消化水解液中对ACE的抑制活性测定
采用紫外分光光度计测定浒苔消化水解液对ACE的抑制活性[10]。ACE抑制活性用抑制率表示,计算如公式(1)所示:
ACE抑制率![]()
(1)
式中:A是添加抑制剂的样品管的吸光度;B是添加缓冲液的样品管的吸光度;C是反应前灭酶的样品管的吸光度。
1.3.3 Sephadex G-25凝胶层析分离
采用l.6 cm×40 cm层析柱,以过膜(孔径为0.22 um)超纯水作为洗脱液,调整上样质量浓度至15 mg/mL,检测波长为280 nm,收集各个峰值范围的洗脱液,并进一步纯化。
1.3.4 Capto Q强阴离子交换分离纯化
采用强阴离子交换填料Capto Q通过梯度洗脱对Sephadex G-25凝胶分离组分进一步分离纯化。设定样品质量浓度为2 mg/mL,进样量为10 mL,缓冲液为0.05 mol/mL Tris-HCl溶液(pH 9.5),洗脱液为0.5 mol/mL NaCl溶液,流速为0.5 mL/min,穿透峰洗脱5 CV,梯度洗脱20 CV,检测波长为220 nm。待上样结束后用平衡液继续流洗,去除与层析柱未结合或结合不紧密的蛋白质和肽,洗脱过程中逐步提高洗脱液的比例,收集各个峰值范围的洗脱液,并进行进一步纯化。
1.3.5 Sephadex G-15凝胶层析分离
对Capto Q阴离子交换分离组分进一步纯化。将上样质量浓度调整为10 mg/mL,上样量为2 mL,流速为0.5 mL/min,洗脱液为过膜超纯水,选择1.6 cm×70 cm型的Sephadex G-15凝胶层析柱,在220 nm检测波长下分离纯化,收集各个峰值范围的洗脱液,并进一步纯化分析。
1.3.6 反向高效液相色谱(reversed phase high-performance liquid chromatography,RP-HPLC)分离
将酶解液经Sephadex G-15分离获得的活性最强组分利用RP-HPLC分离纯化,收集各洗脱峰,经旋转蒸发浓缩后,冷冻干燥得到各分离组分,测定其ACE抑制活性。色谱条件:色谱柱C18(150 mm×2.0 mm,3 μm)柱;检测波长220 nm;柱温40 ℃;流速0.5 mL/min,进样量10 μL;流动相A:水(含0.1%的三氟乙酸);B:乙腈(含0.1%的三氟乙酸),C:蒸馏水,D:纯乙腈。梯度洗脱条件:0~10 min,95% C(线性梯度);10~30 min,65%~95% C(线性梯度)[11]。
1.3.7 浒苔模拟肠胃液消化水解液中ACE抑制肽的氨基酸序列测定
将经过1.3.6中纯化的ACE抑制肽溶于去离子水中,采用高效液相-四级杆飞行时间串联质谱对其进行氨基酸序列鉴定。操作条件:进样量为120 μL,流速为0.15 mL/min;正离子模式,毛细管电压为3.5 kV,锥孔电压65 V,二级质谱电压源25 kV[12]。
1.3.8 IC50值的测定
根据BALTI法测定半数抑制浓度值(half inhibition concentration value,IC50)[13]。当抑制率为50%时,抑制肽的浓度即为IC50,其数值由Origin 8.0统计软件计算。
1.3.9 数据处理
实验数据采用平均值±标准偏差(mean±SD)表示,所有实验进行3次重复,通过SPSS 16.0软件进行统计分析,使用JMP 10.0、Origin 8.0、Excel 2013及Peaks 7.0进行数据处理。
2 结果与分析
2.1 浒苔不同阶段消化产物的水解度和ACE抑制活性
图1为浒苔不同阶段模拟胃肠道消化水解动力学以及不同水解度的ACE抑制活性。如图1所示,浒苔的水解度随时间的延长逐渐增大直至210 min,随后又趋于平缓。浒苔进入胃环境初始阶段并未发生明显水解,直至60~90 min时,水解度从(7.85±0.45)%快速上升至(15.11±0.34)%。而后直至120 min水解度未发生较大变化。肠消化初始阶段浒苔的水解度从原来的(15.54±1.05)%快速上升至210 min的(42.43±1.02)%,随后趋于平缓仅有少量增长。直到400 min消化结束时水解度为(45.52±0.89)%。浒苔在胃肠消化的同时其ACE抑制活性也有较大改变。浒苔ACE抑制率初始10 min时仅为(36.44±0.89)%,经过胃消化后,其抑制率为(60.26±1.86)%。其主要的ACE抑制率上升阶段为胃消化60~90 min阶段。在肠消化仅在初始阶段浒苔ACE抑制率有少量上升[(68.29±1.84)%],随后下降至(56.27±1.06)%,最后趋于平稳有少量降低,直至400 min时ACE抑制率为(53.89±0.88)%。主要的原因可能是浒苔在胃消化60~90 min阶段被胃蛋白酶大量的分解成具有ACE抑制活性的多肽,且这些多肽对胃蛋白酶具有一定的耐受性。而在肠消化阶段ACE抑制率仅有少量增长的原因可能是浒苔对胰酶的耐受性较高,仅有少量的多肽生成。因不同的酶具有不同的酶切位点,胃消化阶段生成具有ACE抑制活性的多肽对胰酶的耐受性较差,导致部分多肽的肽键被破坏,肽序列发生变化,消化产物总的ACE抑制率下降[14]。在肠道内具有较强胰酶耐受性的多肽,可以在机体内发挥ACE抑制活性对高血压等疾病发挥具有缓解和治疗的作用[15]。
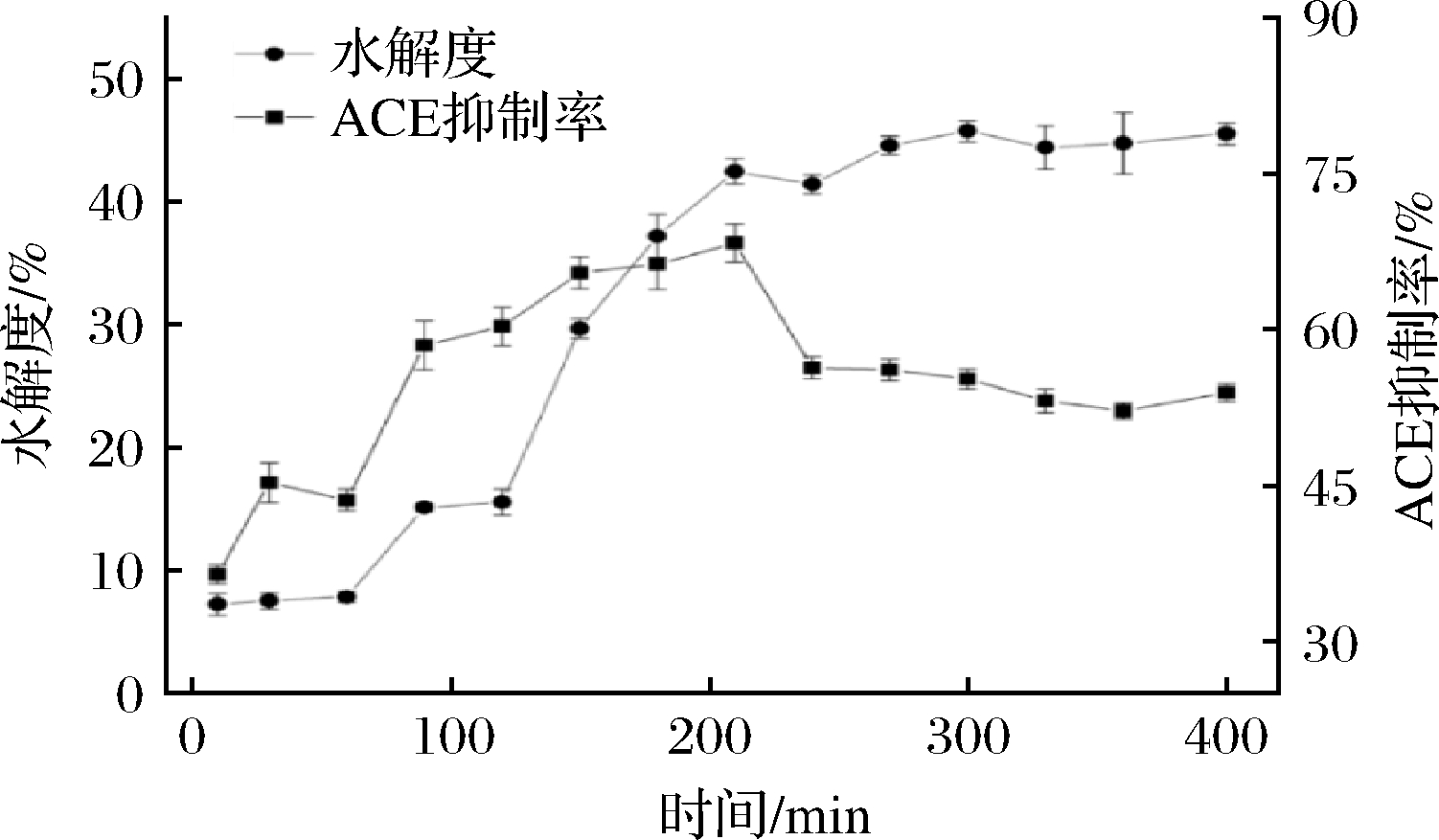
图1 浒苔模拟肠胃液消化过程中水解度及 ACE抑制活性的变化
Fig.1 Changes in hydrolysis and ACE inhibition activity during simulated gastrointestinal fluid digestion in Enteromorpha clathrata
2.2 浒苔模拟消化产物的超滤分离
浒苔经过胃肠消化后消化产物为相对分子质量几万至几百的肽与氨基酸混合物[16]。膜分离技术利用被分离物质的分子质量的不同对多肽成分进行分离,具有能耗低和操作简单等优点。因此,本研究利用截留分子质量的超滤分离技术对浒苔消化产物中具有ACE抑制活性的粗肽进行分离,得到不同分子质量范围肽组分H1、H2、H3和H4,并对消化产物(digestion product,SGDP)和各组分ACE抑制率的IC50值进行测定,结果如图2所示。粗肽ACE抑制活性的大小为H4>SGDP>H3>H1>H2。即组分H4的活性最高,IC50值为(1.34±0.08) mg/mL,与SGDP的ACE抑制活性相比,H4的IC50值下降了14.01%。GUO等[17]利用模拟胃肠道消化从蛋白质含量较高的海产品星形虫消化液中分离纯化出3种具有ACE抑制活性的肽(RYDF,YASGR和GNGSGYVSR),并对其ACE抑制率进行研究。结果表明3种肽具有较强的ACE抑制率,其IC50值分别为235、184、29 μmol/L。
有研究表明,肽的活性与其相对分子质量密切相关,其具有较强功能活性的肽主要集中在3 000 u以下[18]。本研究对活性最高的组分H4进行分子质量分布测定,结果如表1所示。分子质量<3 000 u的组分占59.95%,其中3 000~2 000 u的组分含量最高,占27.36%。LAFARGA等[19]利用木瓜蛋白酶将牛血水解并研究其水解产物的ACE抑制活性,结果表明肽的ACE抑制活性通常由短链氨基酸序列组成,而高分子质量的肽可能会造成总的ACE抑制活性下降。同时低分子质量肽可不经消化被人体直接吸收,比蛋白质和单一氨基酸更易吸收,吸收利用率几乎可达到100%[14]。

图2 浒苔模拟消化产物超滤组分的ACE抑制活性
Fig.2 ACE inhibitory activity of the ultrafiltration fraction of the simulated digestion products of Enteromorpha clathrata
表1 组分H4的分子质量分布
Table 1 Distribution of peptide molecular weight of fraction H4
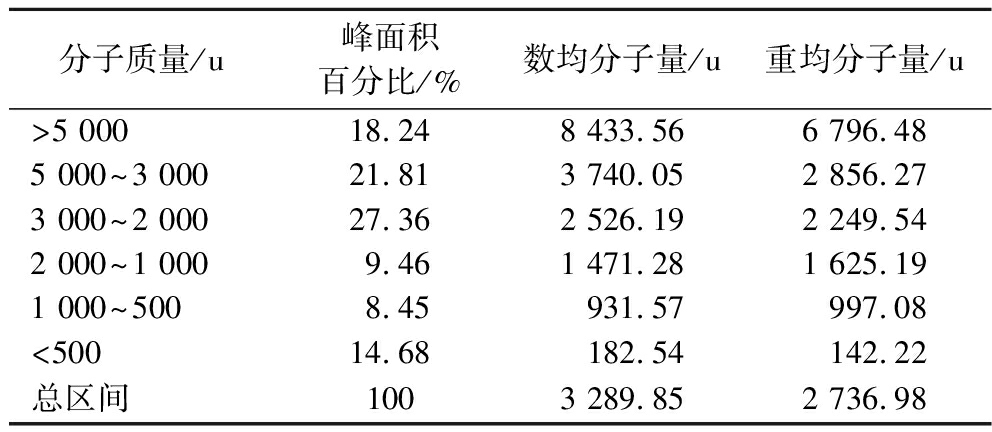
分子质量/u峰面积百分比/%数均分子量/u重均分子量/u>5 00018.248 433.566 796.485 000~3 00021.813 740.052 856.273 000~2 00027.362 526.192 249.542 000~1 0009.461 471.281 625.191 000~5008.45931.57997.08<50014.68182.54142.22总区间1003 289.852 736.98
2.3 Sephadex G-25凝胶层析分离
凝胶过滤层析主要用于不同分子质量大小蛋白质的分离及其分子质量的测定,具有操作简单和产品回收率高等特点[20]。因此将超滤后的组分H4利用Sephadex-25凝胶过滤层析色谱上进行分离并得到6个组分,分别为H4-1、H4-2、H4-3、H4-4、H4-5和H4-6,如图3所示。通过过滤层析将各组分收集并冷冻干燥后,测定其ACE抑制率的IC50,如图4所示。组分H4-3的ACE抑制活性最好,IC50为(0.52±0.07) mg/mL,活性高于其他组分。随后是H4-6组分ACE抑制活性的IC50为(0.65±0.06) mg/mL。因此,选择H4-3组分进行下一步分离纯化。
2.4 Capto Q离子交换层析分离
离子交换层析是利用流动相中的介质离子与固定相上的可交换离子间结合力大小的不同,实现分离的一种方法[20]。将H4-3组分利用Capto Q离子交换柱以梯度洗脱的方法进行分离纯化,结果如图5所示。根据电荷性质的不同H4-3组分被分为H4-3-1、H4-3-2、H4-3-3、H4-3-4、H4-3-5和H4-3-6,共6个组分。将各组分收集、冷冻干燥并测定其ACE抑制活性IC50,结果如图6所示。组分H4-3-4的ACE抑制活性最高,其IC50为(0.24±0.04) mg/mL,高于其他组分。其次为H4-3-5和H4-3-3组分ACE抑制率IC50分别为(0.32±0.03)、(0.36±0.05) mg/mL。因此我们选择H4-3-4组分进行下一步的分离纯化。
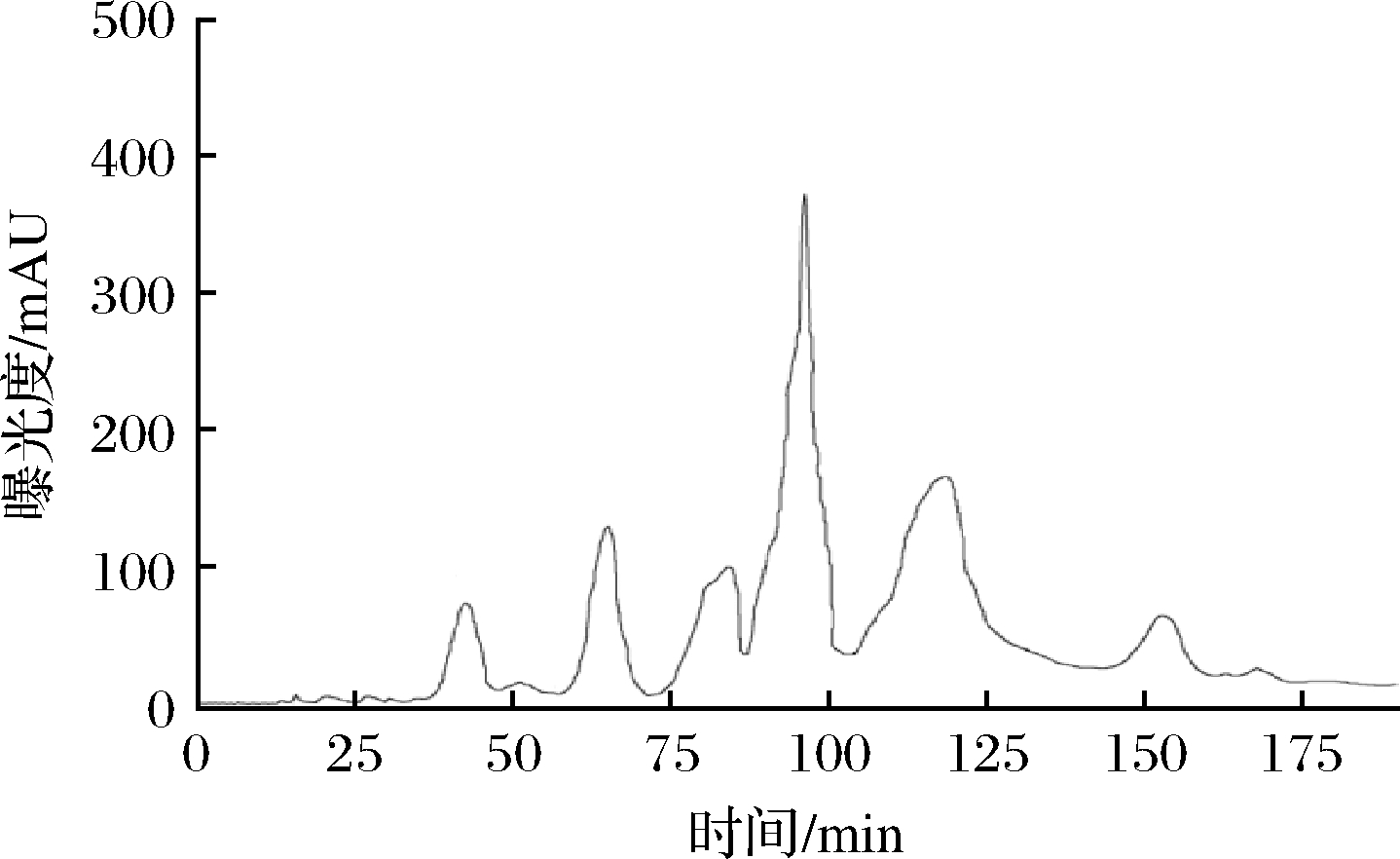
图3 组分H4的Sephadex G-25分离图谱
Fig.3 Separation profile of Sephadex G-25 for component H4
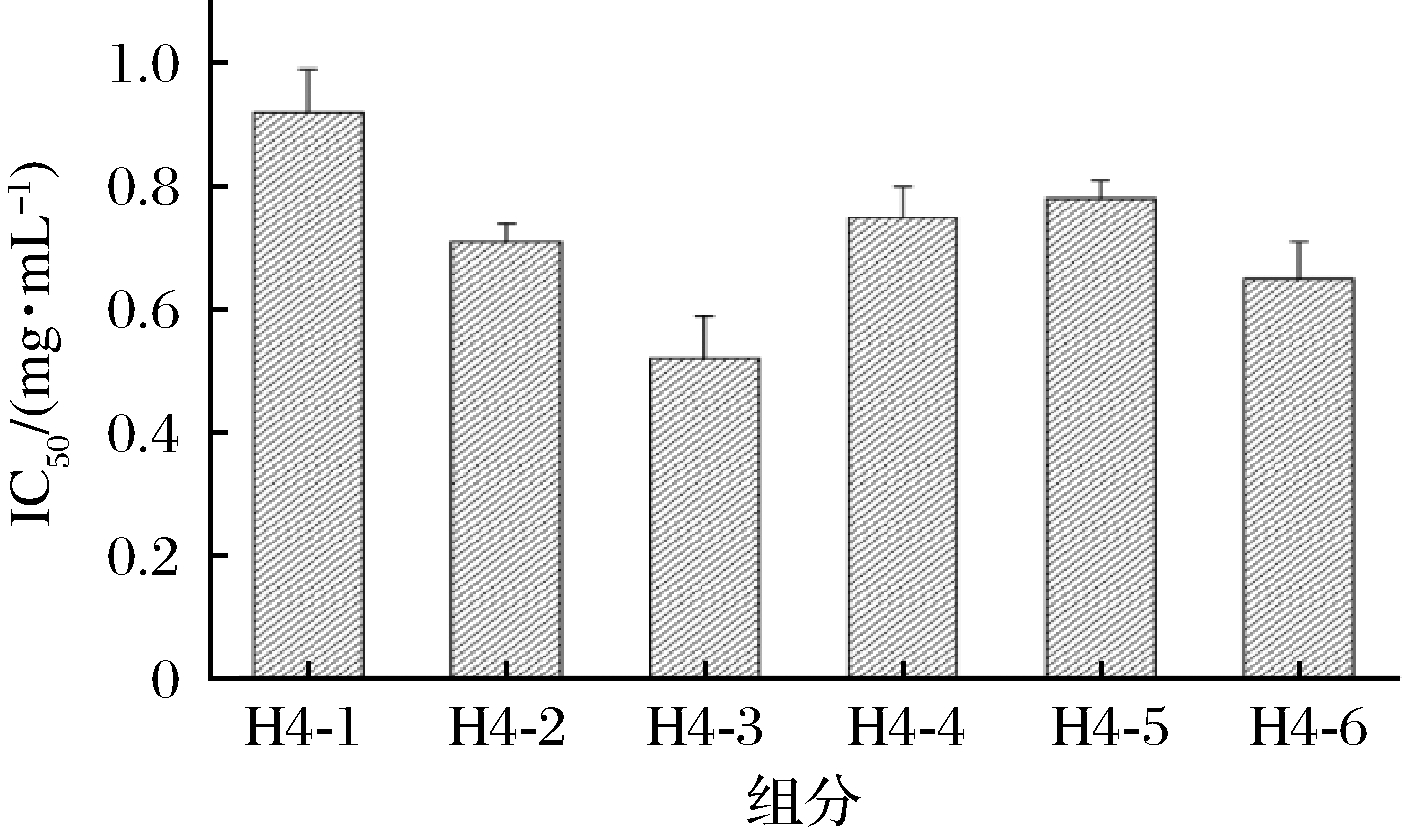
图4 Sephadex G-25分离组分的ACE抑制活性
Fig.4 ACE inhibitory activity of Sephadex G-25 isolate fraction
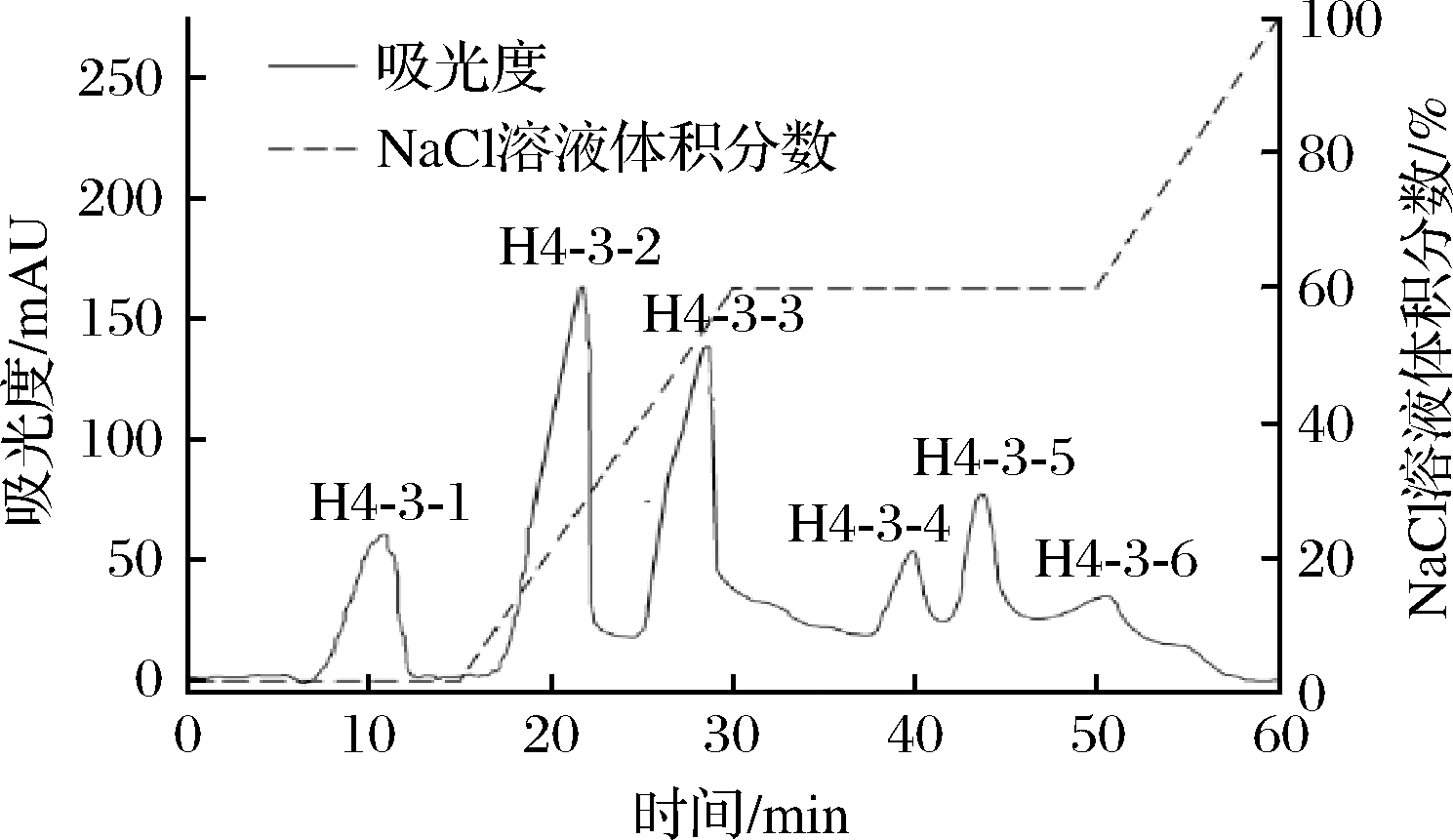
图5 组分H4-3的Capto Q离子交换层析分离图谱
Fig.5 Capto Q ion exchange chromatography separation profile of the component
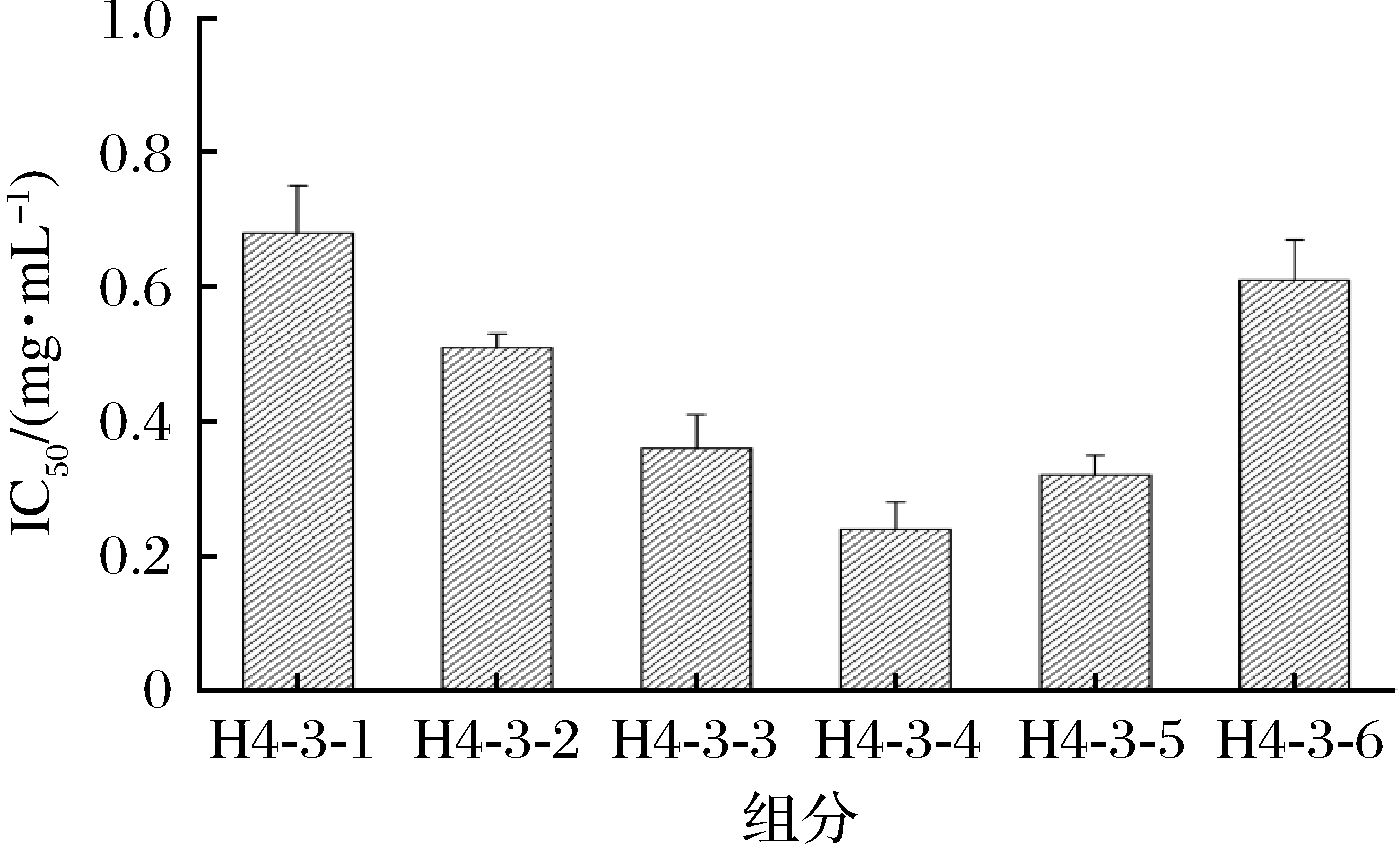
图6 Capto Q离子交换层析分离组分的ACE抑制活性
Fig.6 ACE inhibition activity of Capto Q ion exchange chromatography separated
2.5 Sephadex G-15凝胶层析分离
凝胶层析过程中蛋白质不与其他物质发生结合,减少层析过程中蛋白质的损失,还能基本保持蛋白质原有的活性不受破坏,其中Sephadex G-15适用于分子质量较小的肽分离[21]。因此利用Sephadex G-15进一步分离H4-3-4组分,得到H4-3-4-1、H4-3-4-2和H4-3-4-3,共3个组分,如图7所示。对3个组分ACE抑制活性的IC50进行测定,如图8所示。组分H4-3-4-2的IC50为(0.2±0.03) mg/mL,相较于组分H4-3-4-1和H4-3-4-1-3的IC50分别降低了44.44%和57.45%。因此选择H4-3-4-2进行下一步分离纯化。
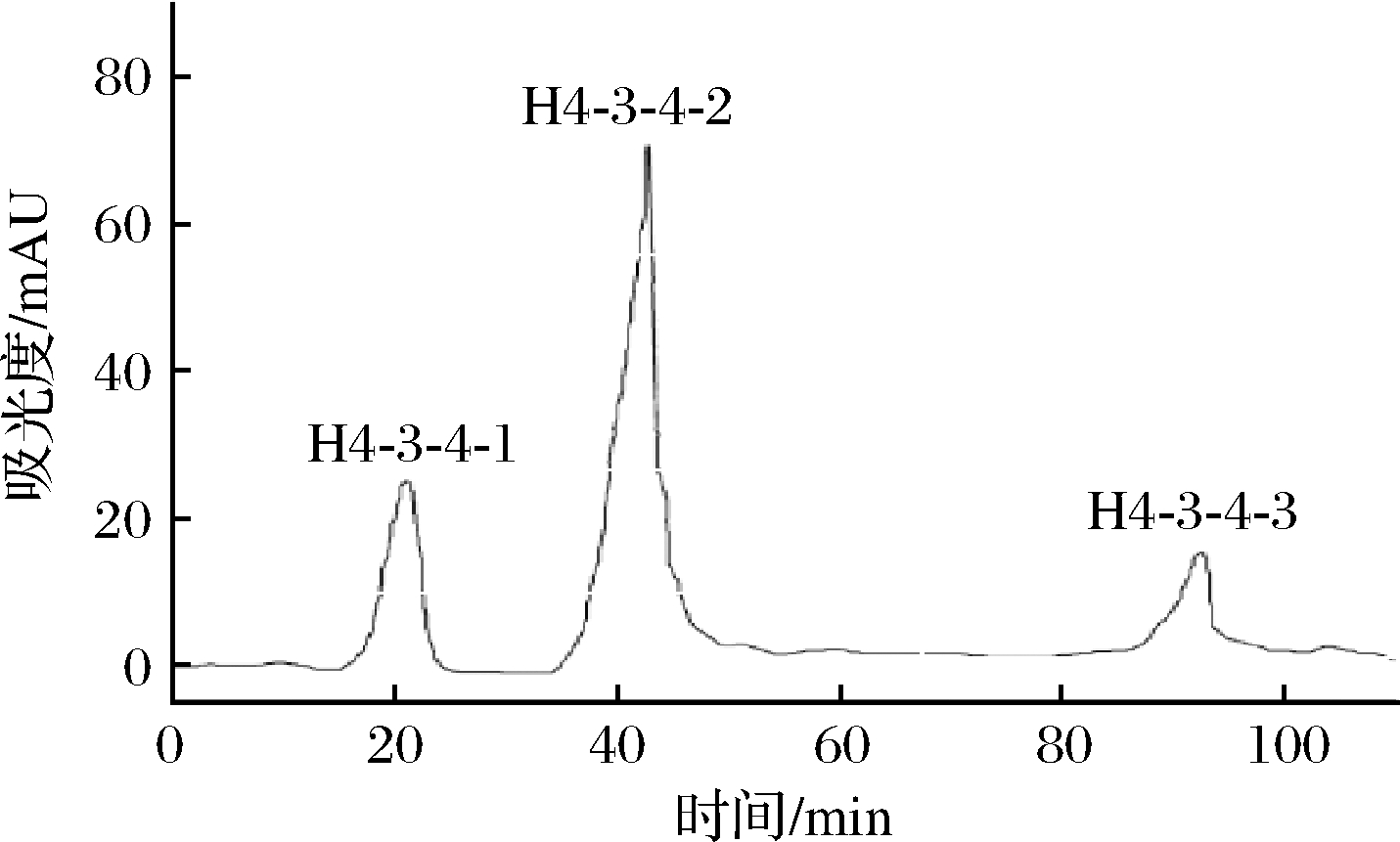
图7 组分H4-3-4的Sephadex G-15分离图谱
Fig.7 Separation profile of Sephadex G-15 for histone H4-3-4
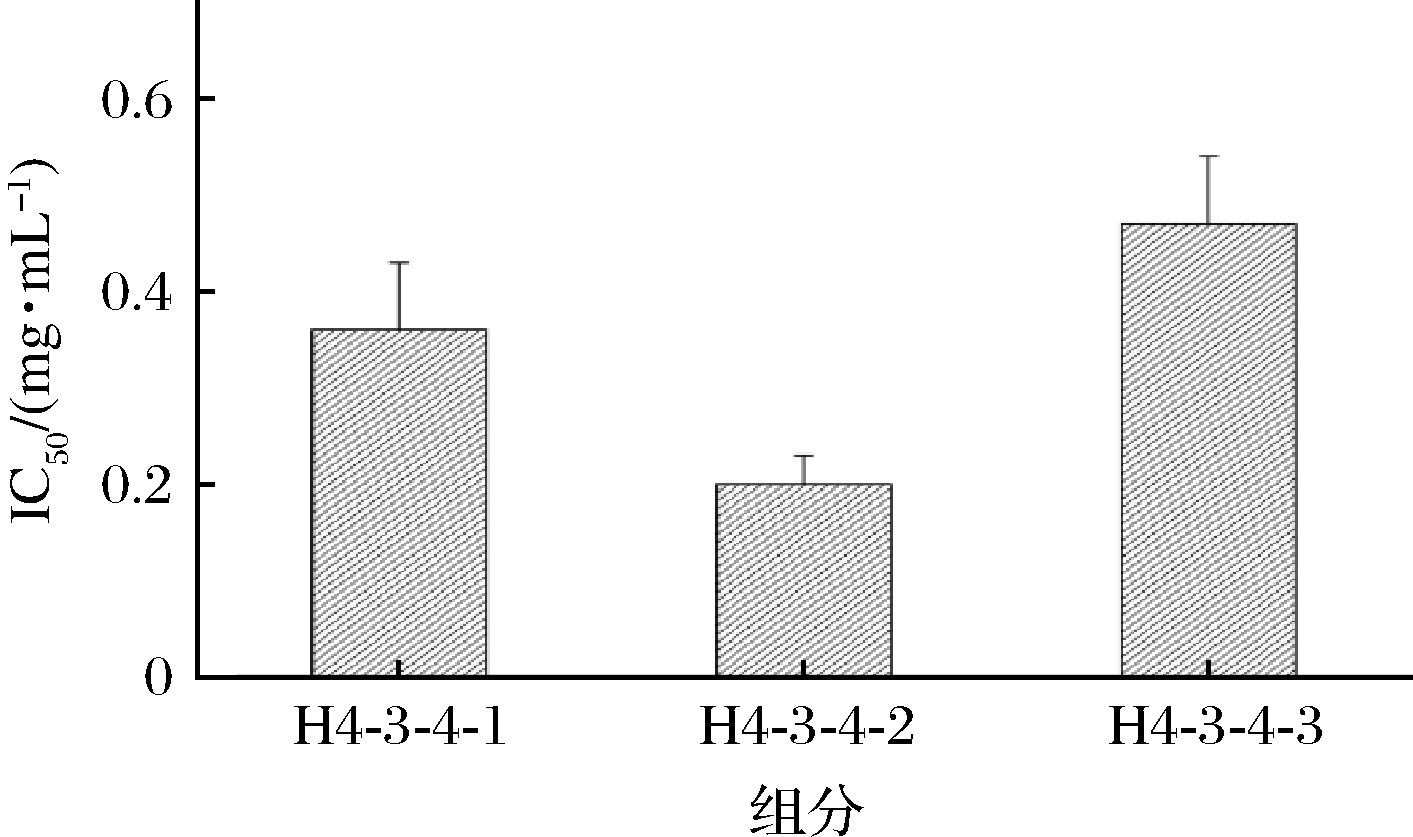
图8 Sephadex G-15分离组分的ACE抑制活性
Fig.8 ACE inhibitory activity of Sephadex G-15 isolate fractions
2.6 RP-HPLC分离
RP-HPLC具有分析速度快和分辨率高等优点,对于分子质量<5 kDa,尤其1 kDa以下的非极性小分子肽的分析纯化,具有很强的分辨力[22]。因此,本研究利用RP-HPLC对组分H4-3-4-2进行分离纯化并对分离出的2种肽的ACE抑制活性IC50进行测定,结果如图9和图10所示。组分H4-3-4-2并非单一组分,分离出2种组分为H4-3-4-2-1和H4-3-4-2-2。通过收集冷冻浓缩后测出H4-3-4-2-2组分的ACE抑制活性相对较高,其IC50为(0.12±0.01) mg/mL。对分离出来的2种组分进行RP-HPLC验证(图11),可知H4-3-4-2-2组分为单一纯品,而H4-3-4-2-1组分有比较多杂峰,不适合进行后续氨基酸序列解析[23]。
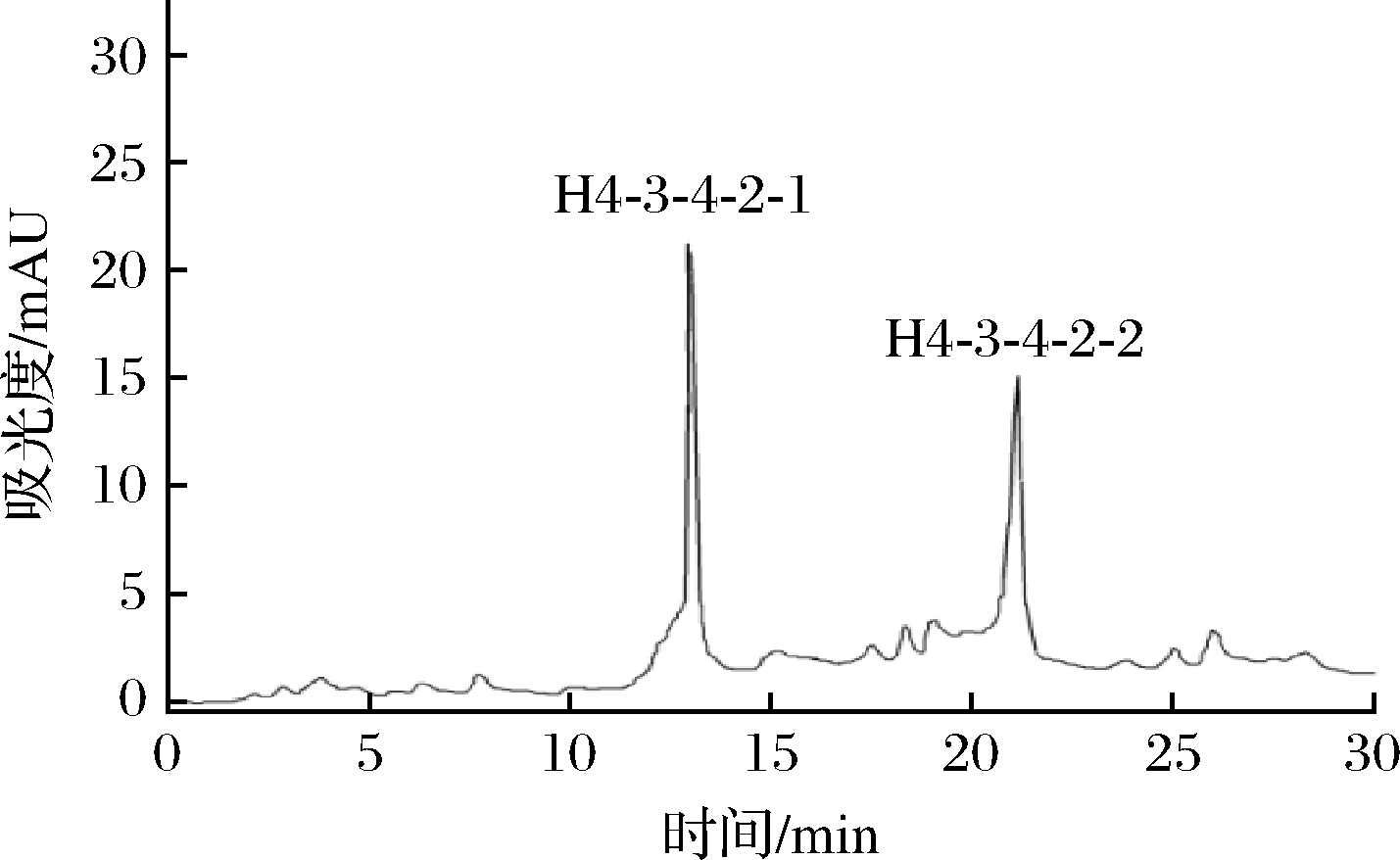
图9 组分H4-3-4-2的RP-HPLC分离图谱
Fig.9 RP-HPLC separation profile of the components H4-3-4-2
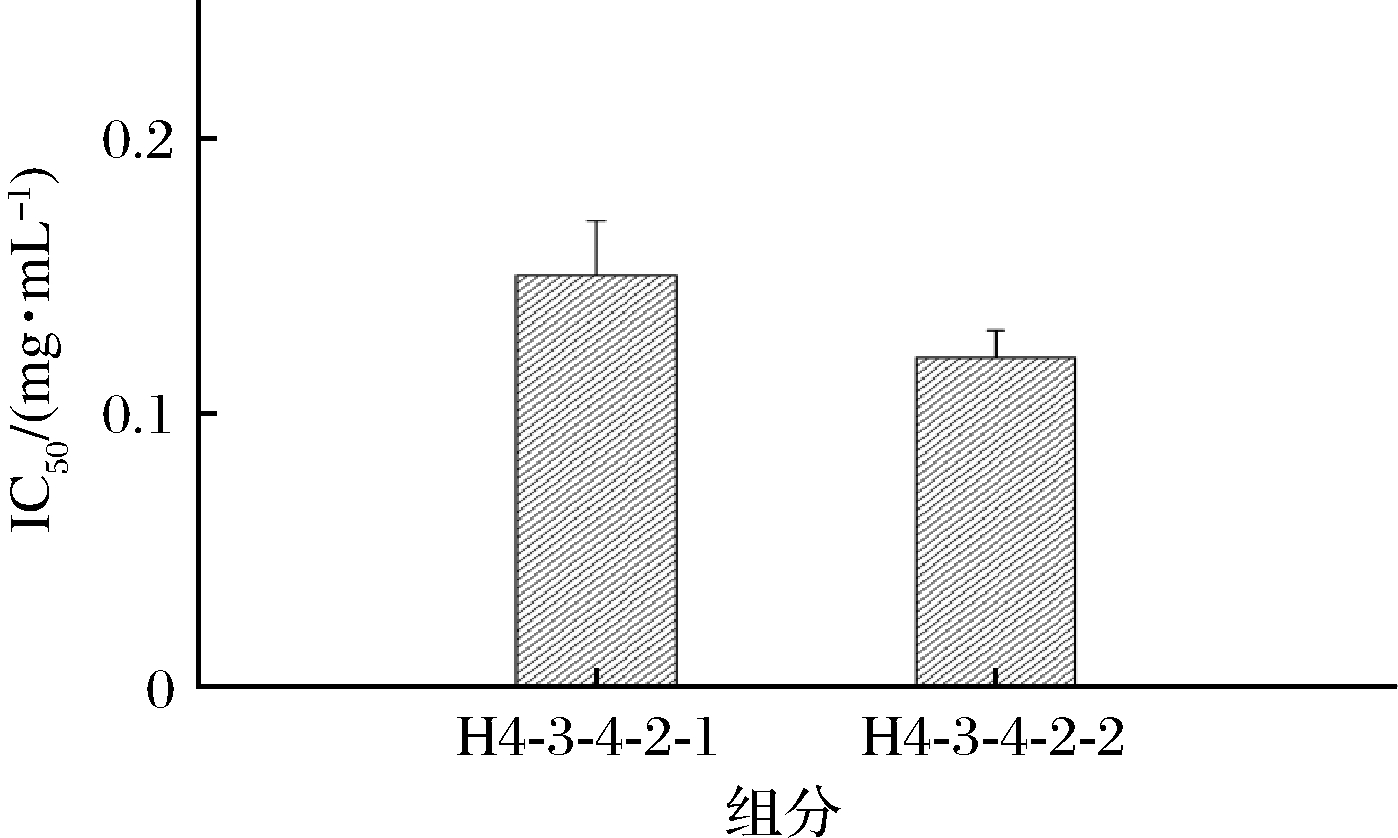
图10 RP-HPLC分离组分的ACE抑制活性
Fig.10 ACE inhibition activity of RP-HPLC separated fractions
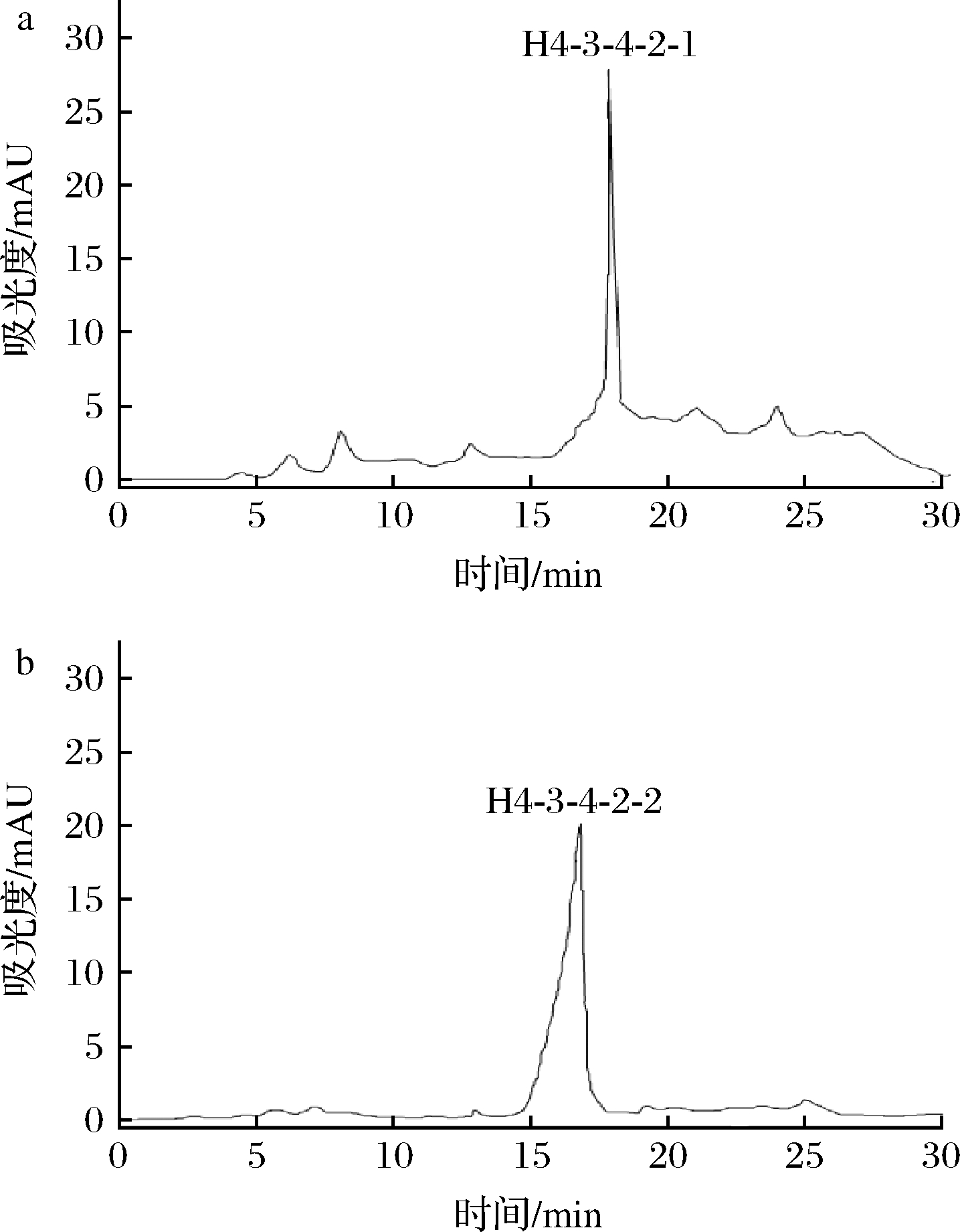
a-H4-3-4-2-1;b-H4-3-4-2-2
图11 H4-3-4-2-1和H4-3-4-2-2组分RP-HPLC图谱
Fig.11 RP-HPLC profiles of H4-3-4-2-1 and H4-3-4-2-2 fractions
2.7 浒苔模拟肠胃液消化水解液中ACE抑制肽的氨基酸序列
肽的活性不仅与分子质量相关,还与氨基酸组成和排列存在相关性[24]。因此本研究采用HPLC-Q-TOF-MS对组分H4-3-4-2-2的结构进行分析,将分析结果输入PEAKS 7.0软件进行在线从头测序及入库比来测定多肽的氨基酸序列。由图12可知,组分H4-3-4-2-2的一级质谱图中质荷比m/z最高的离子峰为348.1,为组分H4-3-4-2-2主要成分分子离子峰。将主要离子峰通过MS/MS二级质谱分析其氨基酸序列,如表2和图13所示。按Roepstorff和Fohlman提出的命名系统,在348.1离子片断二级电离离子片段中N端的103.5离子片段(b1=103.5)和C端的174.1离子片段(y1=74.1)和Leu-Tyr的离子片段信息吻合,因此推测组分H4-3-4-2-2(348.1)的氨基酸序列为Leu-Tyr。有研究表明,芳香族氨基酸Tyr、Trp和Phe等在肽链C端,脂肪族氨基酸Leu、Val和Ile在肽链N端有助于提高肽的ACE抑制活性[25],同时疏水性氨基酸对肽的ACE抑制活性也有积极作用[26]。ZHANG等[27]利用胃蛋白酶将胖头鱼肌肉蛋白进行水解,研究其水解物中具有ACE抑制活性的肽。从水解物中鉴定出的2种多肽Tyr-Asn-Leu-Lys-Glu-Arg-Tyr-Ala-Ala-Trp和Tyr-Asn-Arg-Leu-Pro-Glu-Leu具有较高的ACE抑制活性,IC50分别为(1.35±0.23)、(3.42±0.39) μmol/L。
表2 组分H4-3-4-2-2可能的几种序列及其b离子与 y离子的理论值
Table 2 Several possible sequences of the component H4-3-4-2-2 and their theoretical values for the b and y ions
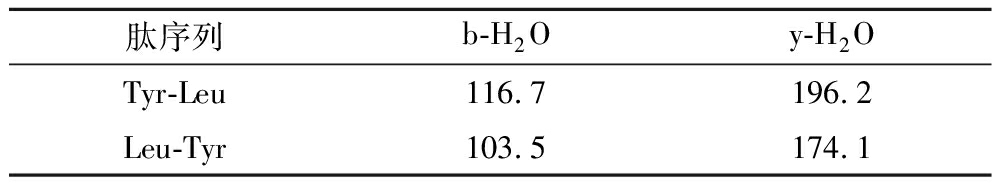
肽序列b-H2Oy-H2OTyr-Leu116.7196.2Leu-Tyr103.5174.1
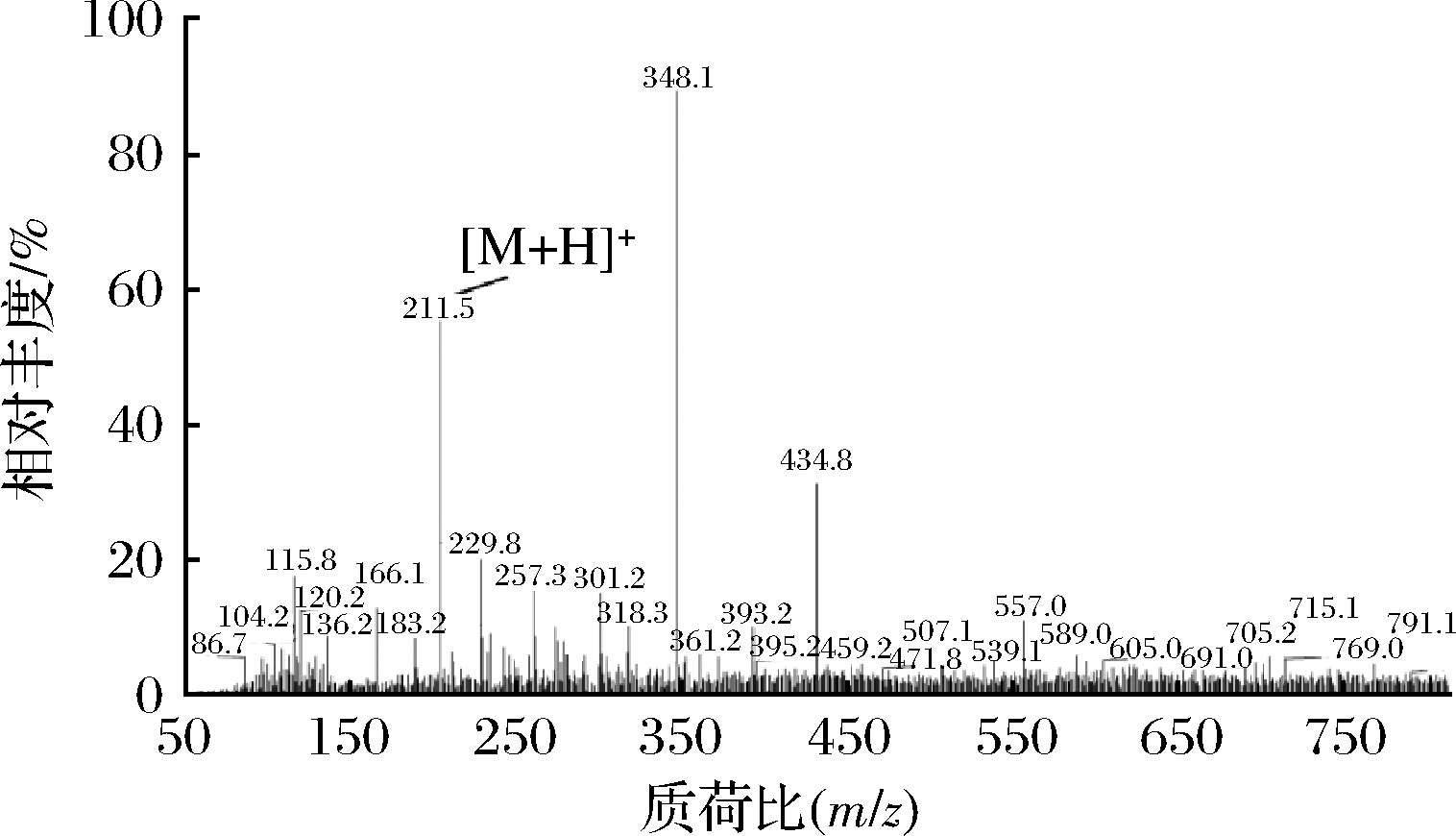
图12 组分H4-3-4-2-2的一级质谱图
Fig.12 Primary mass spectra of the components H4-3-4-2-2
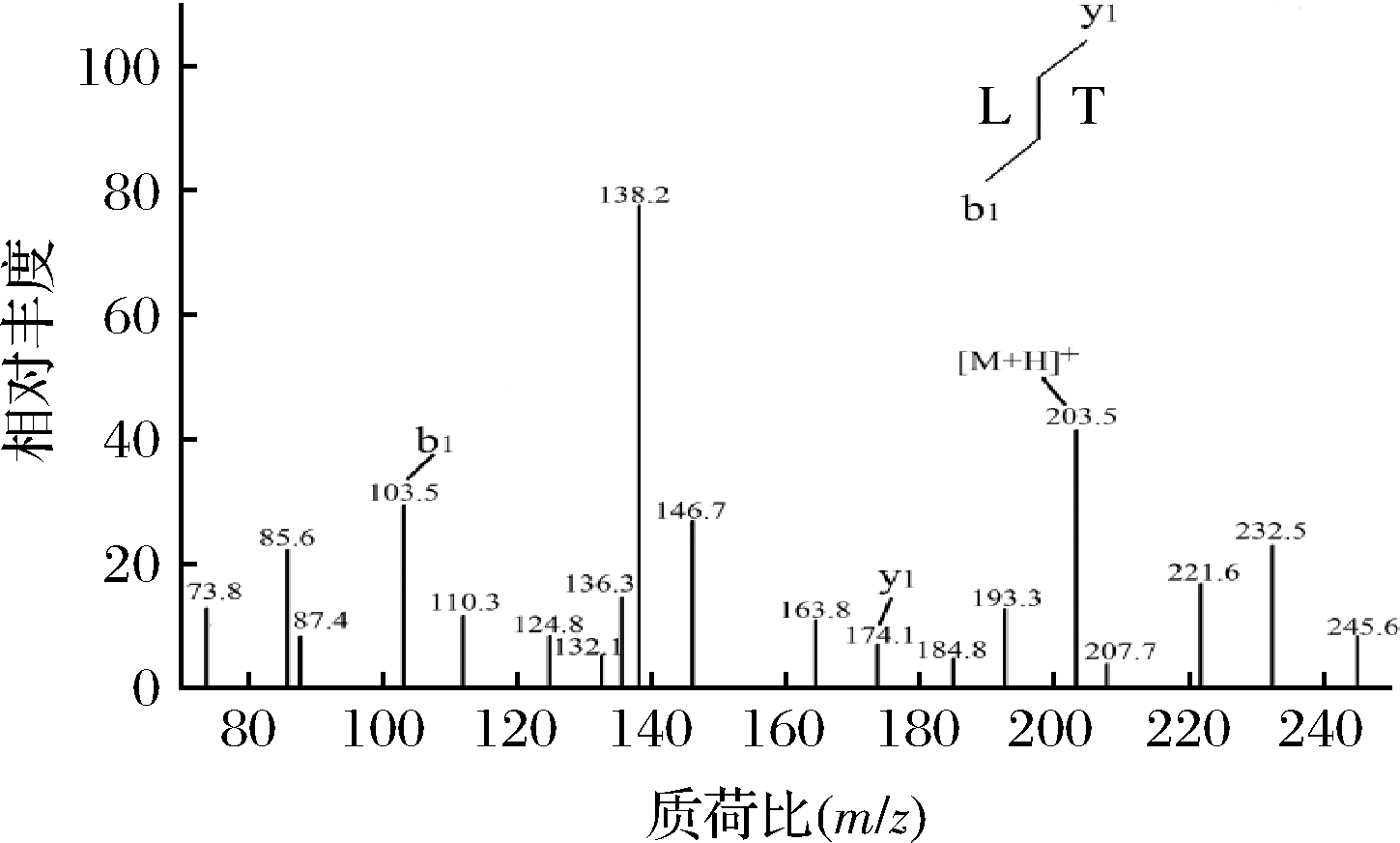
图13 组分H4-3-4-2-2的二级质谱图
Fig.13 Secondary mass spectra of the components H4-3-4-2-2
3 结论
通过体外模拟消化法利用胃蛋白酶和胰酶将浒苔进行水解。利用超滤、凝胶层析和离子交换层析等方法对浒苔消化产物进行了分离和纯化,获得了一个具有较强ACE抑制活性的肽段,其IC50为(0.12±0.01) mg/mL。然后利用HPLC-Q-TOF-MS对肽段进行结构表征,其分子质量和序列分别为348.1 Da和Leu-Tyr。
本实验研究结果为浒苔的开发利用提供依据。但实验仅系统研究了浒苔消化产物ACE抑制活性肽的分离纯化条件,以及利用质谱鉴定其序列。因此还需要通过人工合成相同序列的肽利用细胞实验和小鼠实验验证其体内ACE抑制活性和消化吸收性能,为进一步开发成功能性食品或药物提供基础数据。
[1] 牛瑞虹, 李丰, 姜静.老年高血压病诊断与治疗研究进展[J].人民军医, 2017, 60(5):507-511;514.
NIU R H, LI F, JIANG J. Research progress in diagnosis and treatment of hypertension in the elderly. People’s Military Surgeon, 2017, 60(5):507-511; 514.
[2] WANG J P, HU J N, CUI J Z, et al.Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effect of hydrolysate in spontaneously hypertensive rats[J].Food Chemistry, 2008, 111(2):302-308.
[3] JIMSHEENA V K, GOWDA L R.Angiotensin I-converting enzyme (ACE) inhibitory peptides derived from arachin by simulated gastric digestion[J].Food Chemistry, 2011, 125(2):561-569.
[4] 刘文颖, 林峰, 金振涛, 等.深海鲑鱼皮来源ACE抑制肽的分离及鉴定[J].现代食品科技, 2016, 32(6):170-176.
LIU W Y, LIN F, JIN Z T, et al.Separation and identification of ACE inhibitory peptides derived from deep-sea salmon skin[J].Modern Food Science and Technology, 2016, 32(6):170-176.
[5] SUN S, WANG F, LI C L, et al.Emerging challenges:Massive green algae blooms in the Yellow Sea[J].Nature Precedings, 2008. DOI: 10.1038/npre.2008.2266.1.
[6] 段训威, 肖桂清, 王礼兴, 等.酶解条浒苔蛋白制备抗肺癌活性多肽[J].生物技术通报, 2019, 35(8):246-252.
DUAN X W, XIAO G Q, WANG L X, et al.Preparation of anti-lung cancer peptides by enzymatic hydrolysis of protein from Enteromorpha clathrata[J].Biotechnology Bulletin, 2019, 35(8):246-252.
[7] PAN S K, WANG S J, JING L L, et al.Purification and characterisation of a novel angiotensin-I converting enzyme (ACE)-inhibitory peptide derived from the enzymatic hydrolysate of Enteromorpha clathrata protein[J].Food Chemistry, 2016, 211:423-430.
[8] CRISTEA E, GHENDOV-MOSANU A, PATRAS A, et al.The influence of temperature, storage conditions, pH, and ionic strength on the antioxidant activity and color parameters of rowan berry extracts[J].Molecules, 2021, 26(13):3786.
[9] HERN NDEZ-LEDESMA B, AMIGO L, RAMOS M, et al.Release of angiotensin converting enzyme-inhibitory peptides by simulated gastrointestinal digestion of infant formulas[J].International Dairy Journal, 2004, 14(10):889-898.
NDEZ-LEDESMA B, AMIGO L, RAMOS M, et al.Release of angiotensin converting enzyme-inhibitory peptides by simulated gastrointestinal digestion of infant formulas[J].International Dairy Journal, 2004, 14(10):889-898.
[10] BALTI R, BOUGATEF A, SILA A, et al.Nine novel angiotensin I-converting enzyme (ACE) inhibitory peptides from cuttlefish (Sepia officinalis) muscle protein hydrolysates and antihypertensive effect of the potent active peptide in spontaneously hypertensive rats[J].Food Chemistry, 2015, 170:519-525.
[11] 苗欣宇, 王祖浩, 王鹏, 等.红松仁清蛋白ACE抑制肽的分离纯化与结构鉴定[J].食品科学, 2017, 38(5):129-133.
MIAO X Y, WANG Z H, WANG P, et al.Isolation, purification and structural analysis of ACE inhibitory peptides derived from red pine (Pinus koraiensis Sieb.et Zucc.) nuts albumin[J].Food Science, 2017, 38(5):129-133.
[12] JIA J Q, WU Q Y, YAN H, et al.Purification and molecular docking study of a novel angiotensin-I converting enzyme (ACE) inhibitory peptide from alcalase hydrolysate of ultrasonic-pretreated silkworm pupa (Bombyx mori) protein[J].Process Biochemistry, 2015, 50(5):876-883.
[13] ASTAFIEVA A A, ENYENIHI A A, ROGOZHIN E A, et al.Novel proline-hydroxyproline glycopeptides from the dandelion (Taraxacum officinale Wigg.) flowers:de novo sequencing and biological activity[J].Plant Science, 2015, 238:323-329.
[14] 刘建华, 郑燕, 田颖刚, 等.泰和乌骨鸡肉模拟胃肠道消化液中ACE抑制肽的分离纯化及结构鉴定[J].南昌大学学报(理科版), 2011, 35(2):163-168;174.
LIU J H, ZHENG Y, TIAN Y G, et al.Isolation and identification of ACE-inhibitory peptide from simulated gastrointestinal digestion of Taihe black-bone silky fowl (Gallus gallus domesticus Brimsson) muscle[J].Journal of Nanchang University (Natural Science), 2011, 35(2):163-168;174.
[15] KIM H S, JE J G, RYU B, et al.Antioxidant and angiotensin-I converting enzyme inhibitory peptides from Hippocampus abdominalis[J].European Food Research and Technology, 2019, 245(2):479-487.
[16] 周存山, 秦晓佩, 余筱洁, 等.绿鳍马面鲀鱼皮蛋白抗氧化肽模拟胃肠消化制备[J].农业机械学报, 2015, 46(8):211-216.
ZHOU C S, QIN X P, YU X J, et al.Antioxidant activity and characteristics of simulated gastrointestinal digestion hydrolysate from filefish Navodon septentrionalis skin protein[J].Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(8):211-216.
[17] GUO M R, CHEN X J, WU Y L, et al.Angiotensin I-converting enzyme inhibitory peptides from Sipuncula (Phascolosoma esculenta):Purification, identification, molecular docking and antihypertensive effects on spontaneously hypertensive rats[J].Process Biochemistry, 2017, 63:84-95.
[18] ALEM N A, GIMÉNEZ B, PÉREZ-SANTIN, et al.Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J].Food Chemistry, 2011, 125(2):334-341.
N A, GIMÉNEZ B, PÉREZ-SANTIN, et al.Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J].Food Chemistry, 2011, 125(2):334-341.
[19] LAFARGA T, WILM M, WYNNE K, et al.Bioactive hydrolysates from bovine blood globulins:Generation, characterisation, and in silico prediction of toxicity and allergenicity[J].Journal of Functional Foods, 2016, 24:142-155.
[20] 刘曼丽. 模拟胃肠消化制备蚕蛹蛋白活性多肽及其生物活性研究[D].济南:山东师范大学, 2015.
LIU M L.Preparation of bioactive peptides from silkworm pupa protein by simulated gastrointestinal digestion and bioactivities study on the prepared peptides[D].Jinan:Shandong Normal University, 2015.
[21] 于晓辉. 红褐林蚁(Formica rufa Linnaeus)活性多肽蛋白质的研究[D].长春:东北师范大学, 2003.
YU X H.The studies on active polypeptides of Formica rufa Linnaeus[D].Changchun:Northeast Normal University, 2003.
[22] 李梅. 甘薯水溶性糖蛋白的分离及高效凝胶色谱测定方法研究[D].福州:福建农林大学, 2009.
LI M.Separation of water-soluble glycoprotein from sweet potato and determination by high-performance gel chromatography[D].Fuzhou:Fujian Agriculture and Forestry University, 2009.
[23] 任娇艳, 李宇娟, 张婷, 等.鲣鱼蛋白肽谱效关系研究[J].中国食品学报, 2020, 20(3):266-275.
REN J Y, LI Y J, ZHANG T, et al.Studies on the correction of spectrum and activities of protein hydrolysates of bonito[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(3):266-275.
[24] NIMALARATNE C, BANDARA N, WU J P.Purification and characterization of antioxidant peptides from enzymatically hydrolyzed chicken egg white[J].Food Chemistry, 2015, 188:467-472.
[25] LI Y W, LI B.Characterization of structure-antioxidant activity relationship of peptides in free radical systems using QSAR models:Key sequence positions and their amino acid properties[J].Journal of Theoretical Biology, 2013, 318:29-43.
[26] ZHOU P, YANG C, REN Y R, et al.What are the ideal properties for functional food peptides with antihypertensive effect? A computational peptidology approach[J].Food Chemistry, 2013, 141(3):2 967-2 973.
[27] ZHANG C, ZHANG Y Q, WANG Z Y, et al.Production and identification of antioxidant and angiotensin-converting enzyme inhibition and dipeptidyl peptidase IV inhibitory peptides from bighead carp (Hypophthalmichthys nobilis) muscle hydrolysate[J].Journal of Functional Foods, 2017, 35:224-235.