食物过敏是指某些特定食物蛋白质进入机体后刺激免疫系统的超常反应[1],可引发各类疾病及症状,主要的临床症状有哮喘、荨麻疹、腹泻、呕吐、发热等,严重时还会伴随虚脱、休克等,严重影响着过敏人群的正常生活[2-3]。鱼类是联合国粮农组织所报告的八大类常见过敏食品之一。金鲳鱼(Trachinotus ovatus)鱼肉细嫩、味道鲜美、无肌间小刺,深受消费者喜爱,近年来随着金鲳鱼产业的快速发展,其致敏问题也引起关注。
鱼类的主要过敏原是小清蛋白(parvalbumin,PV),在鱼及鱼类产品引起的过敏反应中占70%以上。PV蛋白分子质量在10~15 kDa,具有典型的螺旋-环-螺旋结构,属于EF手性蛋白家族,Ca2+、Mg2+ 在此区域内以离子键方式相结合[4]。PV蛋白与金属离子结合,功能区域被保护,表面呈疏水性,表现为耐高温、耐酶解[5-6]。本研究以金鲳鱼PV蛋白为研究对象,对其进行分离纯化,并研究其结构和性质,为鱼类过敏原的研究与金鲳鱼PV蛋白致敏性的消减研究提供理论基础。
1 材料与方法
1.1 材料与试剂
金鲳鱼,湛江东风市场;蛋白Marker(2610)、鼠抗小清蛋白单克隆抗体(PARV-19),Sigma公司;DEAE Sepharose FF、Sephacryl S-200 HR,北京酷来博科技有限公司(Coolaber);辣根过氧化酶标记的山羊抗鼠免疫球蛋白E(immunoglobulins,IgE),DAKO公司;胃蛋白酶(3 000 U/g)、胰蛋白酶(250 U/mg),北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
3-30 ks台式高速冷冻离心机,Sigma公司;DYCZ-24DN迷你双垂直电泳槽、DYY-6C电泳仪,北京市六一仪器厂;Chirascan V100圆二色性光谱仪,英国应用光物理公司;RF-5301PC荧光光谱仪、UV-2550紫外分光光度计,日本岛津公司;AKTAprime plus蛋白纯化系统、电转仪、化学发光系统,上海天能科技有限公司;Q Exactive Plus液质联用系统、毛细管高效液相色谱仪,赛默飞(上海)有限公司;涡旋仪、脱色摇床,美国Scliogex公司。
1.3 实验方法
1.3.1 金鲳鱼蛋白粗提液制备
将新鲜金鲳鱼,去头、皮、红肉部分,肌肉部分洗净,-35 ℃保存备用。将解冻鱼肉搅碎后于4倍体积的Tris-HCl(20 mmol/L,pH 7.0)缓冲液中捣碎,4 ℃磁力搅拌12 h,10 000 r/min离心15 min(4 ℃),取上清液,热处理10 min后迅速冷却过滤,所得滤液-20 ℃保存备用。
1.3.2 金鲳鱼PV蛋白分离纯化
将上述滤液上样于DEAE-Sepharose离子交换柱。用20 mmol/L Tris-HCl(pH 7.0)平衡,压力0.3 MPa,流速1 mL/min。缓冲液洗脱未吸附部分,用0.5 mol/L NaCl梯度洗脱,流速0.5 mL/min,压力0.3 MPa,收集洗脱蛋白,通过紫外分光光度计(A280nm)和SDS-PAGE监测。收集目的蛋白部分进行Sephacryl S-200凝胶过滤,用20 mmol/L Tris-HCl(pH 7.0),压力0.15 MPa,流速0.8 mL/min平衡后用相同缓冲液洗脱,得到纯化PV蛋白[7]。
1.3.3 蛋白浓度测定
以牛血清白蛋白标准品作为标准蛋白,在96孔板中分别加入20 μL质量浓度 0、0.125、0.25、0.5、0.75、1、1.5 mg/mL标准品和20 μL样品,加入200 μL G250染色液,595 nm下测最大光度值,绘制标准曲线,计算样品蛋白质含量。
1.3.4 SDS-PAGE分析
将纯化PV蛋白稀释至1 mg/mL,采用15%预制胶进行SDS-PAGE实验。将10 μL蛋白上样缓冲液(5×)与40 μL蛋白样品混合,沸水浴6 min。Marker上样6 μL,蛋白样品15 μL。电泳条件为电压120 V,电流 50 mA。电泳结束后进行考马斯亮蓝染色,用脱色液处理至蛋白质条带清晰结束。
1.3.5 质谱鉴定
1.3.5.1 样品处理
将SDS-PAGE中金鲳鱼PV蛋白区域胶条切下,对其进行脱色、洗涤、干燥处理,加入适量的胰蛋白酶,添加50 mmol/L NH4HCO3溶液以完全覆盖胶块,37 ℃孵育过夜。加入抽提液[V(60%乙腈,体积分数)∶V(5%甲酸,体积分数)=1∶1],超声波振荡10 min,离心取上清液,重复此过程2次,合并抽提液,离心浓缩仪抽干。使用C18小柱除盐,冻存于-20 ℃等待上机检测。
1.3.5.2 质谱检测与鉴定
采用Q Exactive Plus液质联用系统对肽段样品进行质谱检测和分析。肽段样品经上样缓冲液溶解,自动进样后结合至C18捕获柱(3 μm, 120 Å, 100 μm×20 mm);分析柱为2 μm, 120 Å, 75 μm×150 mm;流动相A∶V(二甲基亚砜)∶V(甲酸)∶V(水)=3∶0.1∶97;流动相B∶V(二甲基亚砜)∶V(甲酸)∶V(乙腈)=3∶0.1∶97;流速为300 nL/min。采集质谱数据通过ProteinPilot (V4.5)进行检索,对蛋白进行鉴定。
1.3.6蛋白免疫印迹分析
蛋白样按照1.3.4 中进行SDS-PAGE,采用湿法转移至预先活化好的PVDF膜,用Western封闭液室温封闭2 h,TBST洗膜5次,5 min/次,与稀释3 000倍鼠抗小清蛋白单克隆抗体在4 ℃冰箱中摇晃孵育过夜,TBST洗膜5次,5 min/次,与稀释5 000倍的HRP标记山羊抗鼠IgE抗体室温下孵育2 h,TBST洗膜5次,5 min/次。加入ECL试剂显色,采用天能5200化学发光仪拍照并分析结果[8]。
1.3.7 PV蛋白结构分析
1.3.7.1 PV蛋白二级结构分析
将样品质量浓度稀释至0.1 mg/mL,采用圆二色谱法分析PV蛋白的二级结构构成。扫描波长范围设置为190~260 nm,扫描速率为50 nm/min,带宽为1 nm,响应时间为2 s,以Tris-HCl作为空白对照。
1.3.7.2 PV蛋白紫外扫描
将样品质量浓度稀释至0.1 mg/mL,采用紫外可见分光光度计测定PV蛋白的紫外吸收峰值。扫描波长范围为210~260 nm,扫描速率为2 nm/s,带宽为5 nm,以Tris-HCl作为空白对照。
1.3.7.3 PV蛋白内源荧光分析
将样品质量浓度稀释至0.1 mg/mL,采用荧光光谱仪测定PV蛋白的内源荧光值。激发波长为290 nm,发射波长为300~450 nm,狭缝宽度为10 nm。
1.3.8 PV蛋白稳定性分析
1.3.8.1 PV蛋白热稳定性分析
将纯化后的PV蛋白在100 ℃下分别加热0、5、10、30、60、120、240 min,对各组样品进行SDS-PAGE分析及蛋白免疫印迹分析。
1.3.8.2 PV蛋白pH稳定性分析
将纯化后的PV蛋白与不同pH的缓冲液按比例混合,将样品在4 ℃静置4 h,所用缓冲液为50 mmol/L Gly-HCl,pH 2.0、pH 3.0;50 mmol/L乙酸钠-乙酸,pH 4.0、pH 5.0;50 mmol/L PBS,pH 6.0、pH 7.0;50 mmol/L Tris-HCl,pH 8.0、pH 9.0;50 mmol/L Na2CO3-H2CO3,pH 10.0。对各组样品进行SDS-PAGE分析及蛋白免疫印迹分析。
1.3.8.3 PV蛋白消化稳定性
(1)模拟胃消化
模拟胃液参照美国药典方法。将模拟胃液37 ℃孵育30 min,与纯化的PV蛋白混合。胃蛋白酶与底物的质量比为1∶100,反应体系在37 ℃下进行,分别在反应0、1、3、5、10、15、30、60 min后取样,加入适量的Na2CO3终止反应。对照反应组中未添加胃蛋白酶。对各组样品进行SDS-PAGE分析及蛋白免疫印迹分析。
(2)模拟肠消化
模拟肠液参照美国药典方法。将模拟肠液37 ℃孵育30 min,与纯化的PV蛋白混合。胰蛋白酶与底物的质量比为1∶400。反应体系在37 ℃下进行,分别在反应0、5、10、15、30、60、120、180 min后取样,于95 ℃加热5 min 终止反应。对照反应组中未添加胰蛋白酶。对各组样品进行SDS-PAGE分析及蛋白免疫印迹分析。
1.4 数据分析
采用Origin 8.0软件进行作图,利用Image J进行电泳条带分析。
2 结果与分析
2.1 PV蛋白的分离纯化
目前蛋白纯化方法较为成熟,主要采用阴离子交换层析、凝胶过滤层析等纯化方法[9-10],联合方法提高蛋白纯度[11]。金鲳鱼鱼肉经Tris-HCl粗提、热处理、2次柱层析后结果见图1。由图1-a可知,金鲳鱼肌肉粗提蛋白成分复杂,其中10、35、60、75 kDa左右蛋白含量较高;经过热处理后,大分子(>60 kDa)蛋白消失,15~35 kDa蛋白发生明显降解,10 kDa蛋白与未处理组无显著变化。由于PV具有较高的耐热性[12],采用热处理方式可使得金鲳鱼部分热敏性蛋白变性沉淀,达到初步纯化目的,再经过离子交换层析(图1-c)与凝胶过滤层析对10 kDa蛋白组分进行进一步纯化(图1-d)。纯化的样品用PARV-19作为一抗进行免疫印迹分析,结果显示10 kDa蛋白组分有阳性反应(图1-b)。通过Image J软件进行分析,该提取方法得到的目标蛋白纯度达95%以上。
2.2 PV蛋白鉴定
将PV蛋白对应区域电泳胶条切下,提取酶解后进行Q Exactive Plus液质联用测定。与ProteinPilot (V4.5)库进行对比,结果显示,该蛋白与斑马鱼的PV蛋白相似度较高,其鉴定分数为215.42分,蛋白覆盖率为66.1%。斑马鱼的PV蛋白的Protein IDs为Q 804V8,Gene names为pvalb 4,分子质量为11.711 kDa,目的蛋白的分子质量和等电点与SDS-PAGE上的迁移规律一致,分析其为金鲳鱼PV蛋白。

a-PV 蛋白纯化SDS-PAGE图(M-Marker;1-Tris-HCl 粗提蛋白;2-热 处理后蛋白;3-PV纯化蛋白);b-PV蛋白免疫印迹分析(M-Marker; 1-PV蛋白);c-PV蛋白纯化离子交换层析洗脱曲线; d-PV蛋白纯化Sephacryl S-200凝胶过滤洗脱曲线
图1 PV蛋白纯化图
Fig.1 The purification results of PV
2.3 PV蛋白原料特性分析
2.3.1 PV蛋白结构分析
天然的PV蛋白二级结构是由α-螺旋和不规则卷曲组成的[13]。如图2-a所示,PV蛋白在192 nm处有一个正峰,在208 nm、225 nm 处有负峰,说明金鲳鱼PV蛋白是典型的α-螺旋结构。这与报道的青鱼PV蛋白[13]、三文鱼PV蛋白[14]和鲢鱼PV蛋白[15]相似。α-螺旋结构具有一定的刚性,对于一些蛋白质的整体构象起着支撑作用,这使得PV蛋白具有较稳定的性质[16]。
蛋白质产生紫外吸收光谱主要由于色氨酸和酪氨酸残基侧链可吸收紫外光。如图2-b所示,PV蛋白在248 nm处有特征吸收峰,这与三文鱼PV蛋白的紫外特征吸收峰相似,这是由PV蛋白的氨基酸组成所决定的[14]。PV蛋白中所含芳香族氨基酸,如苯丙氨酸、酪氨酸和色氨酸残基产生荧光这些残基对蛋白质三级结构的变化非常敏感,通过测定荧光光谱的变化可以间接地反映蛋白质局部三级结构的改变,即内源性荧光。如图2-c所示,当激发波长为290 nm时,金鲳鱼PV蛋白在350 nm处有最大发射峰,此时的蛋白荧光光谱主要来自Trp残基,如果λmax>330 nm,Trp被定义为极性环境;如果λmax<330 nm,Trp被定义为非极性环境[16]。由图2-c可知,金鲳鱼PV蛋白存在于极性环境。
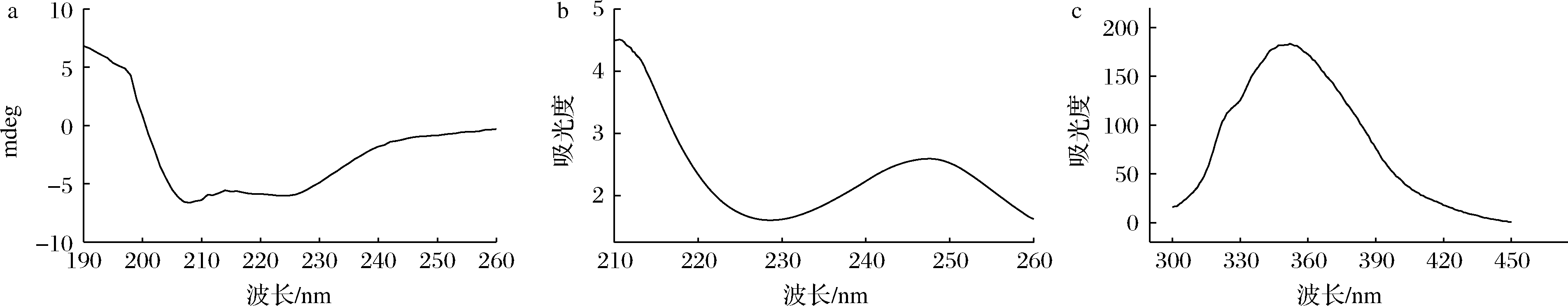
a-PV蛋白圆二色性光谱图;b-PV蛋白紫外可见光谱图;c-PV蛋白内源荧光谱图
图2 PV蛋白结构图谱
Fig.2 The structure of PV
2.3.2 PV蛋白稳定性分析
2.3.2.1 PV蛋白热稳定性分析
热稳定性是食物过敏原的主要特征之一[17]。SDS-PAGE结果显示,随着加热时间的延长,PV蛋白条带未发生变化,未发生降解或聚合(图3-a)。随着加热时间的延长,PV蛋白与IgE结合能力逐渐降低,但下降趋势缓慢(图3-b)。PV蛋白加热至60 min时其免疫活性下降,加热至120 min时其结合能力并未完全消失,而加热至240 min时反应活性完全丧失,这说明金鲳鱼PV蛋白的结构改变与加热时间相关。在日常膳食及产品加工过程中,鱼肉热处理时间通常不超过30 min[18-19]。因此,金鲳鱼PV蛋白热稳定性较好。

a-PV 蛋白热稳定性SDS-PAGE图;b-PV 蛋白热稳定性免疫印迹分析 M-Marker;1-0 min;2-5 min;3-10 min;4-30 min;5-60 min; 6-120 min;7-240 min
图3 PV蛋白热稳定性图
Fig.3 The thermal stability of PV
2.3.2.2 PV蛋白pH稳定性分析
耐酸性是PV蛋白特点之一[20]。如图4-a所示,采用pH 2~10的缓冲液处理PV蛋白,其蛋白条带未发生明显变化。如图4-b所示,与其他pH缓冲体系相比,PV蛋白处于pH 2、3、10的缓冲体系中,PV蛋白的IgE结合能力有所降低;其在pH 2的缓冲液中,反应活性最低,但仍存在一定免疫活性;PV蛋白处于pH 4~9的缓冲体系中,其结合能力并未受到影响,这说明金鲳鱼PV蛋白在弱酸性和碱性环境中较为稳定,这与鲢鱼的pH稳定性具有相似性[21]。
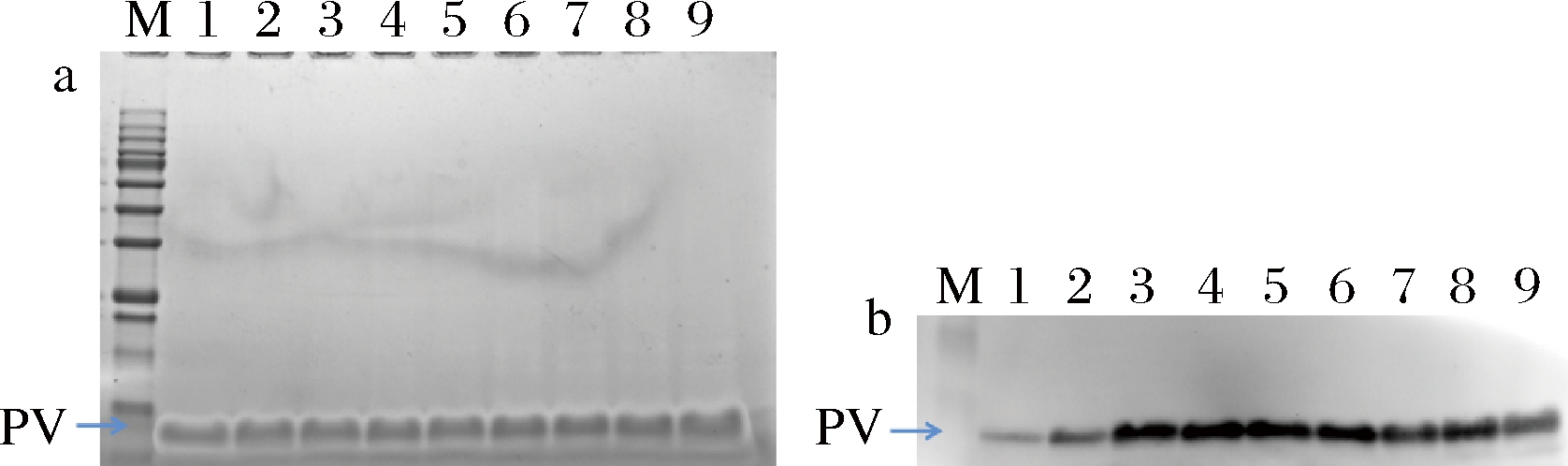
a-PV蛋白pH稳定性SDS-PAGE图;b-PV蛋白pH稳定性免疫印迹分析 M-Marker;1-pH 2;2-pH 3;3-pH 4;4-pH 5;5-pH 6;6-pH 7; 7-pH 8;8-pH 9;9-pH 10
图4 PV蛋白pH稳定性图
Fig.4 The pH stability of PV
2.3.2.3 PV蛋白消化稳定性分析
食物过敏原经口腔进入人体后消化吸收,最终诱发过敏反应是一个复杂的生化过程。通过体外模拟消化可以评价过敏蛋白的在人体消化过程中的稳定性。通常认为,当一个蛋白的IgE结合位点处的氨基酸能够在消化过程中具有耐受性,这种蛋白才具有过敏原性。这是因为过敏蛋白只有经过肠消化道黏膜吸收后才能诱发人体发生免疫反应。
(1)PV蛋白胃模拟消化
如图5-a所示,PV蛋白在胃蛋白酶的作用下,消化1 min时PV蛋白发生了降解,随着消化时间的延长PV蛋白降解加剧;消化时间达60 min时,PV蛋白条带完全降解。如图5-b所示,PV蛋白在胃消化酶的作用下与IgE结合能力逐渐降低。消化60 min时,其反应活性消失。食物基质十分复杂,除了含有致敏成分外,还有很多非致敏组分,如膳食中脂肪可能作为助剂诱发炎症和Th2偏向型免疫响应,并可能降低蛋白质的消化率,增加肠道屏障的通透性[22]。PV蛋白在胃消化酶的作用下变成更小的蛋白或肽段,但仍保留一定的致敏性[23]。

a-PV蛋白胃消化稳定性SDS-PAGE图;b-PV 蛋白胃消化稳定性 免疫印迹分析 M-Marker;1-0 min;2-1 min;3-3 min;4-5 min;5-10 min; 6-15 min;7-30 min;8-60 min;c-control
图5 PV蛋白胃消化稳定性图
Fig.5 The SGF digestion stability of PV
(2)PV蛋白肠模拟消化
如图6-a所示,消化时间达180 min时,PV蛋白保持稳定,电泳条带无变化,表明胰蛋白酶对PV蛋白未产生降解作用。如图6-b所示,PV蛋白在胰蛋白酶的作用下,金鲳鱼PV蛋白与IgE的结合能力未产生影响。PV蛋白对胰蛋白酶有一定抗性,与鲤鱼、鲢鱼、小黄鱼和鳕鱼[21,24]的PV蛋白对胰蛋白酶具有相似抗性,而膳食蛋白的不完全消化会导致肠道内的免疫反应[25]。

a-PV 蛋白肠消化稳定性SDS-PAGE图;b-PV蛋白肠消化稳定性 免疫印迹分析 M-marker;1-0 min;2-1 min;3-5 min;4-15 min;5-30 min; 6-60 min;7-120 min;8-180 min;c-control
图6 PV蛋白肠消化稳定性图
Fig.6 The SIF digestion stability of PV
3 结论
金鲳鱼鱼肉经Tris-HCl粗提、热处理、联合2次柱层析纯化后,可得到纯度为95%的PV蛋白。经SDS-PAGE分析PV蛋白分子质量约10 kDa,对其进行免疫印迹分析,显示10 kDa处有阳性反应。该蛋白经过质谱鉴定后,其与斑马鱼的PV蛋白(Q 804V8)相似度较高,蛋白覆盖率为66.1%。金鲳鱼PV蛋白为典型的α-螺旋结构;在248 nm处有紫外特征吸收峰;在350 nm处有内源荧光最大发射峰。PV蛋白具备较好的热稳定,耐弱酸和碱,胃蛋白酶可分解金鲳鱼PV蛋白,而胰蛋白酶作用较小。金鲳鱼PV蛋白稳定性较好,经胃、肠消化后,仍存在一定的免疫活性。本文通过对金鲳鱼PV蛋白的分离纯化、并对结构与性质进行分析,为金鲳鱼PV蛋白的致敏性消减提供了理论依据。随着食品加工技术与过敏原消敏技术的快速发展,针对金鲳鱼PV蛋白等耐热性强的水产过敏原,如何在控制食品安全的同时最大程度保持该类食品原有的品质,可采用一些非热加工手段,例如超声处理、等离子体处理,或者是联合处理等降低过敏原致敏性。
[1] 傅玲琳, 王彦波.食物过敏:从致敏机理到控制策略[J].食品科学, 2021, 42(19):1-19.
FU L L,WANG Y B.Food allergy:From sensitization mechanism to control strategy[J].Food Science, 2021, 42(19):1-19.
[2] LIANG J, TAYLOR S L, BAUMERT J, et al.Effects of thermal treatment on the immunoreactivity and quantification of parvalbumin from Southern hemisphere fish species with two anti-parvalbumin antibodies[J].Food Control, 2021, 121:107675.
[3] GALAND C, LEYVA-CASTILLO J M, YOON J, et al.IL-33 promotes food anaphylaxis in epicutaneously sensitized mice by targeting mast cells[J].Journal of Allergy and Clinical Immunology, 2016, 138(5):1 356-1 366.
[4] HEIZMANN C W.Ca2+-Binding Proteins of the EF-Hand Superfamily:Diagnostic and Prognostic Biomarkers and Novel Therapeutic Targets[M].Calcium-Binding Proteins of the EF-Hand Superfamily.New York:Humana Press, 2019:157-186.
[5] SWOBODA I, BALIC N, KLUG C, et al.A general strategy for the generation of hypoallergenic molecules for the immunotherapy of fish allergy[J].The Journal of Allergy and Clinical Immunology, 2013, 132(4):979-981.
[6] SAPTARSHI S R, SHARP M F, KAMATH S D, et al.Antibody reactivity to the major fish allergen parvalbumin is determined by isoforms and impact of thermal processing[J].Food Chemistry, 2014, 148: 321-328.
[7] 魏帅, 刘媛, 刘蒙娜, 等.凡纳滨对虾多酚氧化酶的纯化鉴定与生物信息学分析[J].广东海洋大学学报, 2020, 40(4):100-108.
WEI S, LIU Y, LIU M N, et al.Purification and identification of PPO from Litopenaeus vannamei and its bioinformatics analysis[J].Journal of Guangdong Ocean University, 2020, 40(4):100-108.
[8] ZHANG Z Y, LI X M, XIAO H, et al.Insight into the allergenicity of shrimp tropomyosin glycated by functional oligosaccharides containing advanced glycation end products[J].Food Chemistry, 2020, 302:125348.
[9] 林娜, 马德蓉, 刘志东, 等.南极磷虾主要过敏原的分离纯化及性质研究[J].水产学报, 2022, 46(3):445-456.
LIN N,MA D R,LIU Z D,et al.Isolation,purification and properties of Antarctic krill(Euphausia superba) major allergens[J]Journal of Fisheries of China,2022,46(3):445-456.
[10] 邵虎明, 肖有明, 谢彦海, 等.鲤鱼小清蛋白多克隆抗体的制备及免疫交叉反应的研究[J].食品科技, 2019, 44(7):50-55.
SHAO H M, XIAO Y M, XIE Y H, et al.Polyclonal antibody preparation and immunological cross-reactivity of carp parvalbumin[J].Food Science and Technology, 2019, 44(7):50-55.
[11] YANG R Q, CHEN Y L, CHEN F, et al.Purification, characterization, and crystal structure of parvalbumins, the major allergens in Mustelus griseus[J].Journal of Agricultural and Food Chemistry, 2018, 66(30):8 150-8 159.
[12] LIU G M, WANG N, CAI Q F, et al.Purification and characterization of parvalbumins from silver carp (Hypophthalmichthy molitrix)[J].Journal of the Science of Food and Agriculture, 2010, 90(6):1 034-1 040.
[13] 朱一丹. 鱼糜发酵过程中致敏蛋白的变化及原因剖析[D].无锡:江南大学, 2020.
ZHU Y D.Changes and causes of allergenic proteins in surimi fermentation[D].Wuxi:Jiangnan University, 2020.
[14] 马涛, 王一侠, 刘艳, 等.超声处理对三文鱼小清蛋白构象及致敏活性的影响[J].食品工业, 2017, 38(3):160-163.
MA T, WANG Y X, LIU Y, et al.Effect of ultrasonic treatment on the antigenicity and conformation of salmon parvalbumin[J].The Food Industry, 2017, 38(3):160-163.
[15] 杨汝晴. 鱼类小清蛋白分离纯化、性质分析及磷酸化改性[D].厦门:集美大学, 2018.
YANG R Q.Isolation, purification, property analysis and phosphorylation modification of fish paralbumin[D]. Xiamen:Jimei University, 2018.
[16] 李弓中, 赵英, 王俊彤, 等.超声处理对蛋清蛋白结构性质及蛋清液起泡性的影响[J].食品科学, 2019, 40(9):68-75.
LI G Z, ZHAO Y, WANG J T, et al.Effect of ultrasonic treatment on protein structure and physicochemical and foaming properties of liquid egg white[J].Food Science, 2019, 40(9):68-75.
[17] RAHAMAN T, VASILJEVIC T, RAMCHANDRAN L.Effect of processing on conformational changes of food proteins related to allergenicity[J].Trends in Food Science and Technology, 2016, 49:24-34.
[18] 陈佳奇, 刘天毅, 贾逾泽, 等.水煮鱼微波烹饪过程中鱼肉水分及组织变化对嫩度的影响[J].食品与机械, 2020, 36(4):51-55.
CHEN J Q,LIU T Y,JIA Y Z,et al.Effects of moisture and tissue changes on tenderness of boiledfish during microwave cooking[J].Food and Machinery,2020,36(4):51-55.
[19] 盛利燚,刘书来,吕飞,等.热煮对丁香鱼肌肉特性及质构的影响[J].食品科学,2011,32(11):5-8.
SHENG L Y, LIU S L, LYU F, et al.Effect of hot boiling on muscle characteristics and textural property of young anchovy (Engraulis japonicus)[J].Food Science, 2011, 32(11):5-8.
[20] MOHSEN M,REZA F,KOBRA M, et al.Identification and characterization of main allergic proteins in cooked wolf herring fish[J].Iranian Journal of Allergy, Asthma, and Immunology, 2016, 15(5):363-371.
[21] 于滢. 几种淡水鱼过敏原小清蛋白的纯化鉴定及性质研究[D].杭州:中国计量学院, 2015.
YU Y.Purification, identification and properties of several freshwater fish allergen paralbumin[D].Hangzhou:China University of Metrology, 2015.
[22] L PEZ-FANDI
PEZ-FANDI O R.Role of dietary lipids in food allergy[J].Critical Reviews in Food Science and Nutrition, 2020, 60(11):1 797-1 814.
O R.Role of dietary lipids in food allergy[J].Critical Reviews in Food Science and Nutrition, 2020, 60(11):1 797-1 814.
[23] 陶淼, 梁提松, 肖朝耿, 等.体外模拟淡水鱼小清蛋白对胃肠消化的影响(英文)[J].农业生物技术学报, 2016, 24(12):1 908-1 914.
TAO M, LIANG T S, XIAO C G, et al.Effect of parvalbumins on gastrointestinal digestion in freshwater fish with in vitro simulation[J].Journal of Agricultural Biotechnology, 2016, 24(12):1 908-1 914.
[24] 张敏. 基于糖基化反应的低致敏鳕鱼小清蛋白制备及其结构研究[D].南昌:南昌大学, 2020.
ZHANG M.Preparation and structure of hypoallergenic cod paralbumin based on glycosylation reaction[D].Nanchang:Nanchang University, 2020.
[25] DUPONT D, MANDALARI G, MOLLE D, et al.Comparative resistance of food proteins to adult and infant in vitro digestion models[J].Molecular Nutrition Food Research, 2010, 54(6): 767-780.