糖激酶是一类将高能供体分子(如ATP)中的磷酸基团转移到特定靶位点的酶,参与糖磷酸化过程。果糖激酶(fructokinase,FruK)是机体糖代谢的关键酶之一,催化果糖生成果糖6-磷酸(fructose 6-phosphate,F6P),进入糖酵解途径和氧化戊糖途径。葡萄糖代谢由葡萄糖激酶催化葡萄糖生成葡萄糖6-磷酸,然后由磷酸葡萄糖异构酶催化葡萄糖6-磷酸形成果糖6-磷酸,进入糖酵解途径。相比于葡萄糖代谢,果糖激酶催化果糖直接生产F6P,省去异构酶的参与。此外,FruK可作为植物的己糖感受器,通过糖信号感受进行植物生长的调控。已有研究表明,磷酸化的果糖可以为相关组织库的建立提供重要的科学依据[1-2]。己糖激酶(hexokinase,HXK)和FruK都能催化果糖进行磷酸化,但FruK对果糖的亲和力远远高于HXK[3],这表明FruK在果糖代谢中发挥十分重要的作用。因此,研究果糖激酶具有十分重要的科学意义和应用价值。
近年来,FruK已在苹果[4]、枸杞[5]、小麦[6]、水稻[7]和杨梅[8]等植物中被相继发现并成功克隆。PUAL等[9]从霍乱弧菌O395菌中克隆得到一个果糖激酶,通过异源重组表达和纯化获得纯度较高的重组果糖激酶,并利用X-Ray射线衍射得到其晶体结构。PEREZ-CENCI等[10]报道了蓝细菌中的果糖激酶,并发现其催化产物果糖6-磷酸是合成蔗糖的底物之一。目前,尚未发现纤维素堆囊菌中相关FruK基因克隆表达的报道。
糖激酶的产物是磷酸化的糖,不易被直接检测。目前常用的检测其活性的方法主要包括同位素标记法[11]、抗体法[12]、还原糖测定法[13]、偶联酶测定法[14]以及仪器直接测定法[15]等。DUAN等[16]研发出基于ADP的酶偶联方法(图1),该方法利用ADP合成直链淀粉,通过测定淀粉含量来检测激酶活力,该方法主要应用于鉴定糖激酶的底物特异性。该体系中,蔗糖合酶能够催化蔗糖和ADP反应,生成ADP-葡萄糖,然后在糖原合酶的催化下生成直链淀粉并再生ADP。向反应液中加入碘和碘化钾的混合溶液,若有淀粉生成,则会生成肉眼可见的淀粉-聚碘化物蓝色络合物,该络合物在光谱的红色区域具有强吸光度,因此可以通过测定络合物的吸光值来追踪激酶反应。值得注意的是,在该测定中ADP充当了催化剂。同时该方法操作简单,检测成本相对较低,且方便小批量检测。
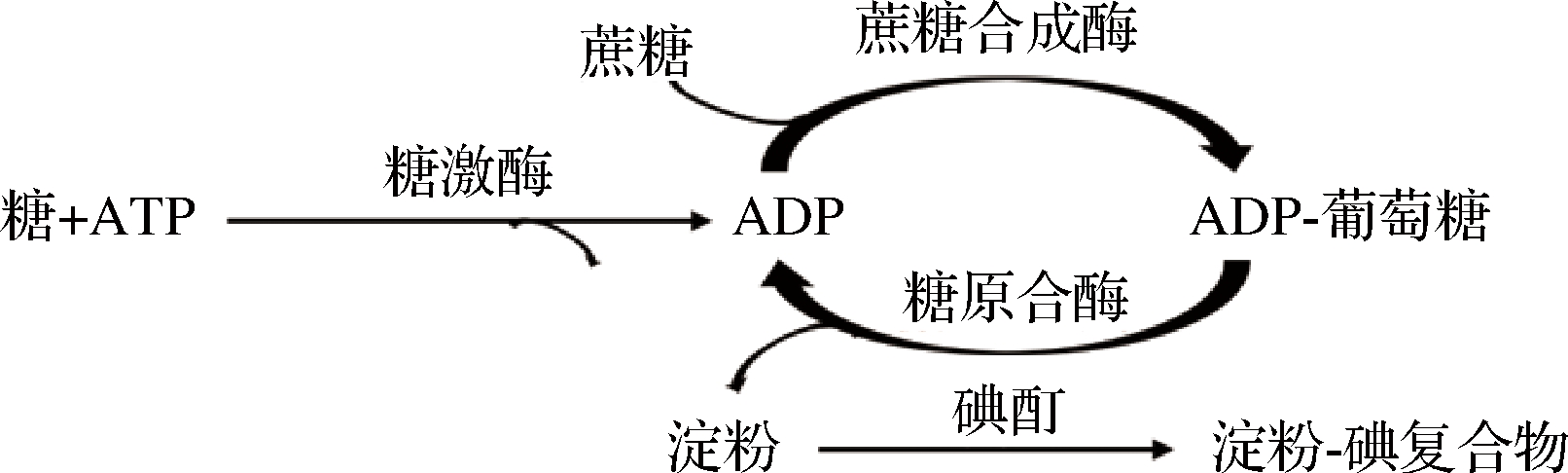
图1 ADP循环、产生淀粉的间接检测糖激酶活力的方法
Fig.1 The method to detect the activity of sugar kinase based on recycling of ADP and producing amylose indirectly
本研究以纤维素堆囊菌的果糖激酶基因为研究对象,通过NCBI数据库检索,拟对其编码的2个果糖激酶基因进行扩增,并异源表达于大肠杆菌,利用Nickel-NTA镍亲和色谱柱对重组果糖激酶进行纯化,探究其催化活性、酶学特性和底物特异性,为将来的进一步研究提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
纤维素堆囊菌和质粒pET30a(+)由本实验室保藏;大肠杆菌Escherichia coli DH5α、E.coli (DE3)感受态细胞,生工生物工程(上海)股份有限公司。
1.1.2 主要试剂
2×SuperStar Plus PCR Mix、细菌基因组DNA提取试剂盒、DNA纯化回收试剂盒,天根生物科技(北京)有限公司;限制性内切酶Nde I、Xho I和EcoR I,T4 DNA连接酶,北京全式金生物技术有限公司;Nickel-NTA亲和色谱柱,美国伯乐BIO-RAD公司;PCR引物的合成及测序均由通用生物有限公司完成;Goldview I型核酸染色剂和其他常规试剂,索莱宝生物科技有限公司。
1.2 仪器与设备
ZQZY-CT振荡培养箱,上海知楚仪器;PCR扩增仪,珠海黑马仪器有限公司;One Drop OD-2000分光光度计,南京五义科技有限公司;DYY-7C核酸电泳仪,北京市六一仪器厂;CT15RT高速冷冻离心机,上海天美生化仪器设备工程有限公司;Bio-Rad凝胶成像仪;LDZX-75KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;超声波细胞破碎仪,南京先欧仪器制造有限公司;恒温水浴锅,常州国华电器有限公司。
1.3 实验方法
1.3.1 基因组提取与果糖激酶基因的克隆
细菌(S.cellulosum)基因组DNA提取液(TES)的配制方法:50 mmol/L NaCl,50 mmol/L Tris-base,10% SDS,500 mmol/L EDTA和1% Triton-X100,pH为8.0,4 ℃冰箱保存备用。用1.5 mL Ep管分别取纤维素堆囊菌,12 000 r/min离心1 min,收集沉淀。将沉淀溶于500 μL的TES中,加入5 μL蛋白酶K。将混合液在55 ℃金属浴中反应3 h,90 ℃高温将蛋白酶K灭活,基因组提取完成,放入-20 ℃保存。
从NCBI网站检索获得纤维素堆囊菌基因组序列,筛选得到两条编码果糖激酶的基因,分别命名为SoCeFruK1852和SoCeFruK7579。利用Primer Premier 5软件设计引物如表1,其中下划线处是其对应的酶切位点,以Sorangium cellulosum基因组为模板进行PCR扩增。50 μL PCR反应体系:2×SuperStar Plus PCR Mix 25 μL,模板DNA 2 μL,F/R引物(10 μmol/L)各1 μL,ddH2O 21 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 1 min,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 6 min。PCR产物使用1%琼脂糖凝胶电泳分离,按DNA回收试剂盒说明书进行切胶回收。
表1 PCR扩增引物序列
Table 1 Primers for PCR amplification

基因名称引物名称酶切位点引物序列SoCeFruK18521852 FNde ICATATGTTGGACGTCATCTGTGCCGGCG1852 RXho ICTCGAGGCGCCGGCCGACCTTCGSoCeFruK75797579 FNde ICATATGGTGGTCTGCGTCGGTGAAGCGC7579 REcoR IGAATTCGAGCCGCGCTTCCGCCTCACC
1.3.2 表达载体的构建
回收的目的基因片段与pTG-19线性载体在T4连接酶作用下连接,得到重组质粒,利用热激法将重组质粒转化至DH5a感受态细胞;利用蓝白斑筛选原理,以M13通用引物,选取白色菌落为模板进行PCR鉴定阳性克隆子。按质粒提取试剂盒说明书提取阳性克隆菌中的重组质粒;限制性内切酶Nde I和Xho I或者EcoR I将重组质粒和表达载体pET-30a同时进行双酶切,将酶切后的目的基因片段和线性化载体在T4连接酶作用下连接,并将连接产物转化至DH5a感受态细胞,菌落PCR鉴定,将阳性克隆送样至测序公司测序。
1.3.3 重组蛋白的诱导表达和纯化
将含有果糖激酶基因的重组表达质粒转化到E.coli BL21(DE3)感受态细胞。取单菌落于5 mL含卡那霉素(50 μg/mL)的LB培养基中过夜培养;按照1%的接种比例将种子液接种到400 mL LB表达培养瓶中扩大培养,37 ℃培养至菌液浓度达到OD600值为0.5~0.8,加入IPTG至终浓度0.5 mmol/L,温度调至18 ℃,诱导表达20 h。
4 ℃、4 000 r/min离心收集菌体,去除培养基;用细胞裂解液(100 mmol/L NaCl,50 mmol/L Tris-HCl pH 8.0,1% Triton X-100,1 mmol/L PMSF)把菌体沉淀重悬,然后超声破碎细胞;10 000 r/min、4 ℃离心20 min收集上清液。使用Ni-NTA亲和层析柱纯化上清液中的目标蛋白,首先使用5倍柱体积的平衡缓冲液(50 mmol/L Tris/HCl pH 8.0,100 mmol/L NaCl)平衡镍柱;然后缓慢上样,上样结束后用10倍柱体积的结合缓冲液(50 mmol/L Tris/HCl pH 8.0,100 mmol/L NaCl,10 mmol/L咪唑)冲洗,去除非特异结合的蛋白,再用洗脱缓冲液(50 mmol/L Tris/HCl pH 8.0,100 mmol/L NaCl,500 mmol/L咪唑)洗脱重组蛋白,使用one drop蛋白浓度测定仪检测流出液,收集OD值大于0.5的流出液即为纯化后的重组酶。
使用PD10脱盐柱对纯化后的重组酶进行脱盐。柱子用去离子水平衡后,将2.5 mL样品加到柱子上端,样品全部进入柱体后,柱顶加入去离子水洗脱并开始收集,收集2.5 mL的流出液为脱盐蛋白峰。
使用SDS-PAGE检测诱导前后、上清液和纯化蛋白的重组蛋白;首先用80 V电压电泳浓缩胶,然后用100 V电压电泳分离胶至蓝色loading buffer跑出凝胶,电泳结束。使用Bradford法蛋白定量试剂盒测定重组蛋白含量,具体操作步骤参照试剂盒说明书进行。
1.3.4 酶活性和酶活力的测定
以果糖为底物,设置果糖激酶检测体系(表2),用加热灭活的酶作为阴性对照,反应体系置于37 ℃孵育6 h。反应结束后用等倍体积的氯仿萃取蛋白终止酶活性,离心取上清液;首先用薄层层析法(thin-layer chromatography,TLC)检测酶的活性,使用V(正丁醇)∶V(乙醇)∶V(水)=5∶3∶2的延展剂将样品分开,用DPA(4 g二苯胺,4 g苯胺,5 mL磷酸和50 mL丙酮)显色;然后利用多酶级联反应法验证其果糖激酶的催化产物是果糖6-磷酸,并计算其酶活力。
表2 果糖激酶的酶活性反应体系
Table 2 The reaction system of fructokinases

试剂体积/μLTris-HCl缓冲液(500 mmol/L,pH 7.5)7.5果糖 (20 mmol/L)7.5MgCl2 (20 mmol/L)3ATP (100 mmol/L)1.5新型果糖激酶5ddH2O5.5
利用多酶级联反应介导的酶标仪法进一步分析果糖激酶的酶活力[17]。果糖激酶催化的反应体系设置如表3,每个反应设置3个重复,下文中涉及到的酶促反应体系均为3个重复;反应结束后,酶标仪读取340 nm处的吸光值。以不同浓度的NADPH,绘制标准曲线。一个酶活力单位(1 U)定义为37 ℃条件下,果糖激酶每分钟水解产生1 μmol的酶量。根据读取的吸光度代入标准曲线换算出产物生成量,计算酶活力。
表3 多酶级联反应体系
Table 3 The reaction system of multi-enzyme system

试剂体积/μL表2反应混合液30葡萄糖-6-磷酸脱氢酶4葡萄糖-6-磷酸异构酶4Tris-HCl缓冲液(pH 7.5, 0.5 mol/L)15NADP+ (100 mmol/L)2EDTA (100 mmol/L)3去离子水2
1.3.5 重组果糖激酶的酶学特性研究
1.3.5.1 最适温度的测定
在pH 7.5的条件下,分别于16、25、30、37、42、50、60、70 ℃测定酶活力,反应体系和操作方法按照多酶级联反应的操作进行。以测得的最高酶活力为100%,计算不同温度下的相对酶活力,下文同。
1.3.5.2 最适pH的测定
在最适反应温度条件下,分别于pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、9.0缓冲液中测定酶活力。其中所用缓冲体系分别为磷酸氢二钠-柠檬酸溶液(pH 3.0~7.0)、Tris-HCl (pH 8.0~9.0),计算不同pH下的相对酶活力。
1.3.5.3 金属离子对果糖激酶活力的影响
在最适条件下,向反应体系中添加不同的金属离子(MnCl2、MgCl2、CaCl2、ZnCl2、CoCl2、FeCl3、CuCl2)和EDTA,终浓度均为2 mmol/L,然后测定酶活力,计算不同金属离子的相对酶活力。
1.3.5.4 化学试剂对果糖激酶活力的影响
在最适条件下,在反应体系中分别加入不同终浓度的Tween 20(0.5%、1%、2%,体积分数)、乙基苯基聚乙二醇 (octylphenoxypolyethoxyethanol, NP 40,0.1%,0.5%,1%,体积分数)、Triton X-100 (0.1%、0.2%、0.5%,体积分数)、尿素(0.1、0.5、1.0 mol/L)、SDS(1、5、10 g/L)、巯基乙醇(1、10、50 mmol/L)、咪唑(10、50、200 mmol/L),测定酶活力。以不添加化学试剂测定的酶活力为100%。
1.3.5.5 酶动力学常数
在最适条件下,以果糖为底物进行酶动力学检测,底物浓度分别配制成0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 mmol/L,测定酶活力。以不同浓度果糖的倒数为横坐标,不同浓度果糖下重组果糖激酶反应速率的倒数为纵坐标,基于米氏方程进行双倒数作图,计算出酶的Vmax和Km值。
1.3.5.6 底物特异性
为直观地观察果糖激酶的催化活性,采用DUAN等[16]的方法检测酶的底物特异性。不加酶的反应为阴性对照,含有ADP的反应为阳性对照,具体步骤如下:设置30 μL 50 mmol/L的Tris-HCl (pH 7.5)反应体系,其中2 mmol/L MgCl2,50 mmol/L蔗糖,10 μmol/L新型果糖激酶以及过量的蔗糖合酶和糖原合酶,反应体系在37 ℃过夜孵育;反应结束后,向反应液中加入2 μL碘酊,充分地混合均匀,观察混合液是否变蓝色;取20 μL加过碘酊的混合液,用酶标仪检测405 nm处的吸光值。
1.4 统计分析
采用Excel 2019和SPSS 21对试验数据进行统计分析,以Origin 8.0制图。
2 结果与分析
2.1 果糖激酶基因克隆、载体构建与序列分析
通过基因扩增,成功得到长度分别约为800 bp和900 bp的DNA片段,命名为SoCeFruK1852和SoCeFruK7579(图2)。经过目的基因富集、双酶切和连接,获得重组表达质粒pET30a-SoCeFruK1852和pET30a-SoCeFruK7579。测序结果显示克隆得到的基因序列与数据库序列一致,完整开放阅读框全长分别是834 bp和921 bp,编码278个和307个氨基酸残基,C-端带有便于纯化的组氨酸标签。
系统发育进化树显示SoCeFruK1852基因所编码蛋白序列与目前已知来自针状软骨菌Chondromyces apiculatus的糖激酶(EYF04789.1)和(WP_050434194.1)的保守性分别达到61.26%和56.23%、与玫瑰小囊粘杆菌Minicystis rosea的果糖激酶(APR81328.1)的保守性是56.55%、多角形科细菌Polyangiaceae bacterium (NUP07036.1)的保守性是53.11%,而与同菌属来源的糖激酶基因(CAN97109.1)和(WP_157907134.1)的同源性只有37.2%(图3)。
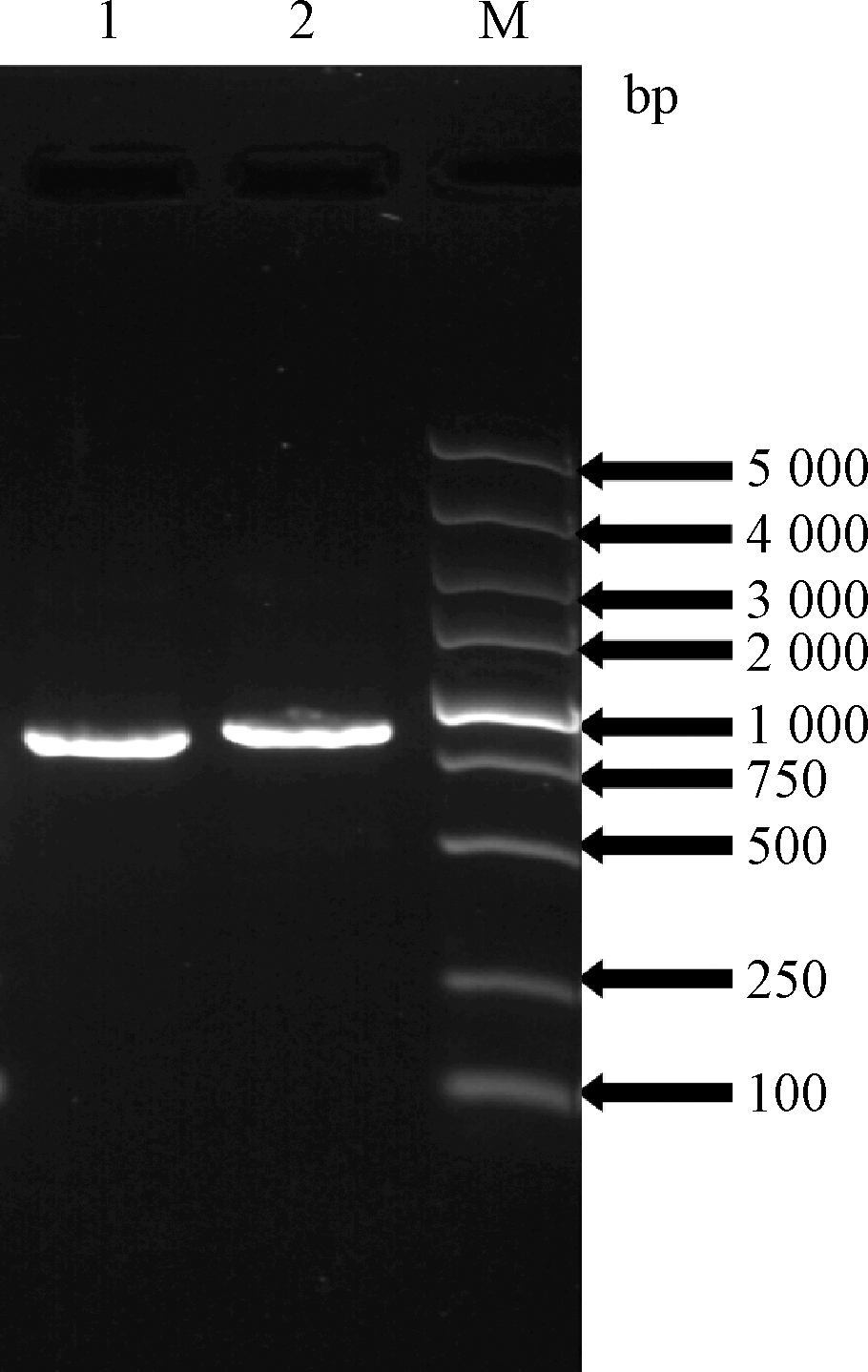
M-DNA标品;1-基因SoCeFruK1852;2-基因SoCeFruK7579
图2 PCR扩增产物电泳结果
Fig.2 Agarose gel electrophoresis of PCR products

图3 果糖激酶SoCeFruK1852进化树分析
Fig.3 The phylogenetic analysis of fructokinase SoCeFruK1852
S.cellulosum编码的果糖激酶SoCeFruK7579与来自泡沫多囊菌Polyangium spumosum的激酶(WP_170319666.1)同源性是43%,与烟色多囊菌Polyangium fumosum编码的激酶(WP_170229116.1)的同源性是38.89%,与真菌软骨霉状菌C.apiculatus编码的激酶(EYF04789.1)的同源性达到39.1%,与M.rosea编码的激酶(APR86074.1)的同源性是38%,如图4所示。因此,本研究发掘的2个果糖激酶与其他种属来源的糖激酶或果糖激酶有不同程度的相似性。

图4 果糖激酶SoCeFruK7579进化树分析
Fig.4 The phylogenetic analysis of fructokinase SoCeFruK7579
2.2 重组蛋白的表达和纯化
重组果糖激酶的SDS-PAGE电泳分析结果如图5所示。图5-a是重组SoCeFruK1852的SDS-PAGE结果,通过比较诱导前后菌体的蛋白组成,可以发现IPTG诱导后的菌体在分子质量30 kDa左右具有一条明显增强条带,且上清液和纯化组分都在相同位置有明显条带,其表观分子质量与理论分子质量(31.1 kDa)相吻合,表明经Ni-NTA纯化得到的重组SoCeFruK1852纯度较高。图5-b显示IPTG诱导后的重组SoCeFruK7579菌体在分子质量30 kDa附近同样具有一条明显增强条带,且上清液和纯化组分都在相同位置有明显的条带,其表观分子质量与理论分子质量(32.8 kDa)相吻合,Ni-NTA的纯化效率较高,SoCeFruK7579的纯度较高。Bradford法测定的蛋白质量浓度分别为2.04、1.8 mg/mL,以400 mL发酵液为例,2个重组蛋白的产量分别为20.4、18 mg。
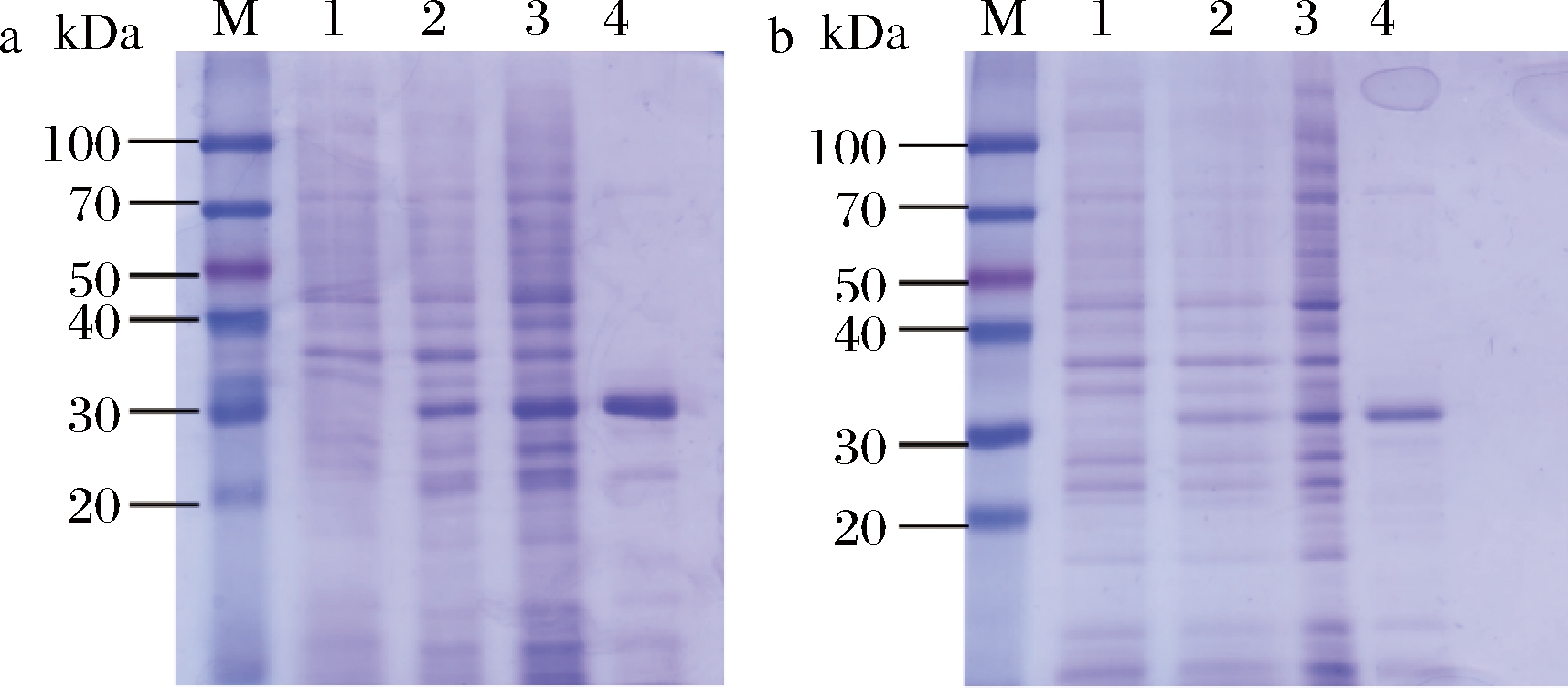
M-标记;1-诱导前细胞;2-IPTG诱导后的细胞;3-细胞裂解后的 上清液;4-镍柱纯化后的蛋白;a-SoCeFruK1852;b-SoCeFruK7579
图5 重组蛋白的SDS-PAGE
Fig.5 SDS-PAGE of recombinant fructokinases
2.3 重组果糖激酶活性及其比活力
本研究首先利用TLC检测2个重组果糖激酶的活性,检测结果见图6。由图6-a可知,2个重组果糖激酶均能催化果糖生成新的产物,且SoCeFruK1852的活性明显高于SoCeFruK7579。采用多酶级联反应介导的方法鉴定果糖激酶的产物是果糖-6-磷酸,该方法中的葡萄糖-6-磷酸只能由果糖-6磷酸转化生成。图6-b是2个重组果糖激酶的实时酶标仪检测结果,2个催化体系的吸光值随着时间的推移均在不断升高,而没有加酶的对照没有变化,说明重组两个果糖激酶均具有活性,与TLC检测结果一致,同时可以证明反应产物是果糖-6-磷酸,SoCeFruK1852和SoCeFruK7579的比活力分别为35.8、18.3 U/mg。SoCeFruK1852的活性更强,因此后续研究中仅以SoCeFruK1852为研究对象。

a-重组果糖激酶的TLC结果;b-重组果糖激酶酶标仪检测结果
图6 重组果糖激酶的活性检测
Fig.6 The activity detection of recombinant fructokinases
2.4 酶学性质研究
2.4.1 温度、pH和化学试剂对酶活力的影响
图7-a是最适温度的检测结果,重组SoCeFruK1852的最适温度为37 ℃,在25~42 ℃保持50%以上的酶活力,较低温度(16 ℃)时,相对酶活力也在40%左右。
如图7-b所示,重组SoCeFruK1852的最适反应pH为4.5,低pH范围内表现出较高的酶活力。随着pH的增加,酶活力增大,pH 4.5时活力最大,pH再增大,酶活力逐渐降低;pH 3.5~6.0,酶的活力均大于50%,说明重组SoCeFruK1852是一种嗜酸性酶,在碱性条件下几乎没有活性,该酶能够耐受偏酸性环境。
图7-c和7-d显示,重组SoCeFruK1852在不同化学试剂中酶活力差异明显。其中非金属离子型表面活性剂Triton X-100和咪唑对酶活力几乎没有影响,非金属离子表面活性剂NP40具有一定的激活作用。而Tween 20和SDS对SoCeFruK1852的酶活力具有较强的抑制作用,2%的Tween 20或者10 g/L 的SDS能够使酶的活力丢失近80%。因此,在使用SoCeFruK1852的过程中,应避免出现SDS或者Tween 20。
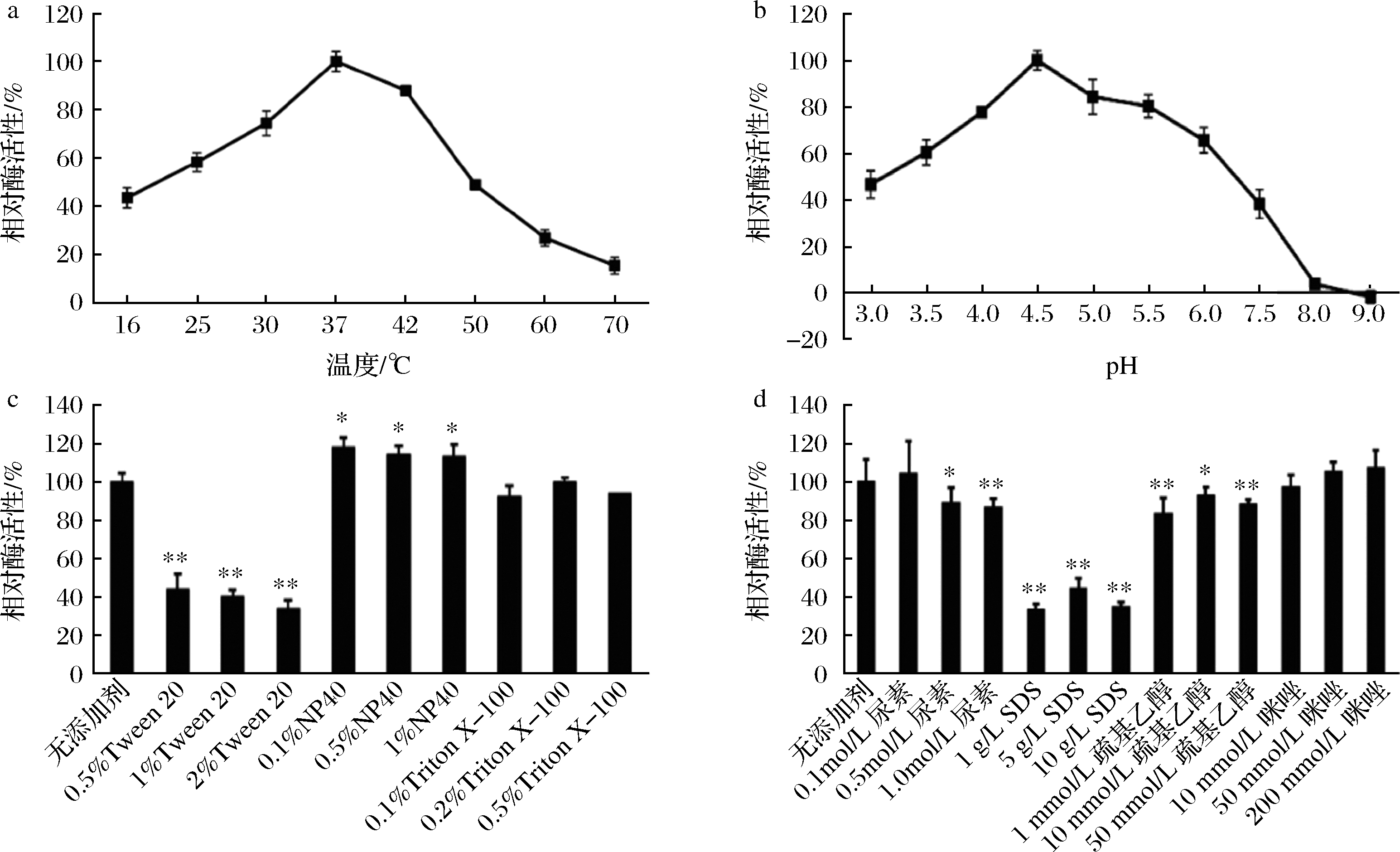
a-最适温度;b-最适pH;c、d-化学试剂对酶活力的影响
图7 重组SoCeFruK1852果糖激酶的酶学性质
Fig.7 Enzymatic properties of recombinant SoCeFruK1852
2.4.2 金属离子对酶活力的影响
不同金属离子对重组SoCeFruK1852酶活力的影响结果见表4。EDTA使得酶活力全部丢失,表明糖激酶是金属离子依赖性蛋白;体系中加入Mg2+和Mn2+对SoCeFruK1852具有显著的促进作用,其中Mg2+效果最明显,提高了1.69倍;Co2+、Fe3+、Zn2+对SoCeFruK1852均起抑制作用,显著降低了酶活力,分别是对照的10.32%、20.4%、30.23%;而Ca2+和Cu2+对重组酶活力的抑制作用较小。
表4 金属离子对重组果糖激酶活力的影响
Table 4 Effects of metal ions on the activity of recombinant fructokinase

金属离子(2 mmol/L)相对酶活力/%H2O 100±2.45EDTA 1.3±0.22MnCl2112.9±13.32FeCl320.4±2.30ZnCl230.23±1.49 CaCl284.32±8.90 CuCl269.03±10.89CoCl210.32±2.01 MgCl2169.32±10.24
2.4.3 酶动力学常数
以不同浓度的果糖作为底物探究重组SoCeFruK1852的酶动力学常数,结果如图8所示,采用Origin 8.0软件分析其Nonlinear Curve Fit (Michaelis Menten),米氏常数Km为0.54 mmol/L,计算得到Vmax为1.28 μmol/s,Kcat为10.21 s-1。

图8 米氏方程曲线
Fig.8 The curve of Michaelis equation
2.4.4 底物特异性
以不同的单糖作为底物分析重组SoCeFruK1852的底物特异性,结果如图9所示。通过碘遇淀粉变蓝的检测方法分析,SoCeFruK1852不仅对果糖具有催化活性,对D-塔格糖(D-tagatose, D-Tag)也显示出一定的活性,对D-葡萄糖(D-glucose, D-Glu)表现出微弱的活力;重组SoCeFruK1852不能催化D-半乳糖(D-galactose, D-Gal)、D-岩藻糖(D-fucose, D-Fuc)、D-核糖(D-ribose, D-Rib)、D-木糖(D-xylose, D-Xyl)和D-阿拉伯糖(D-arabinose, D-Ara),说明该酶的特异性相对较强。
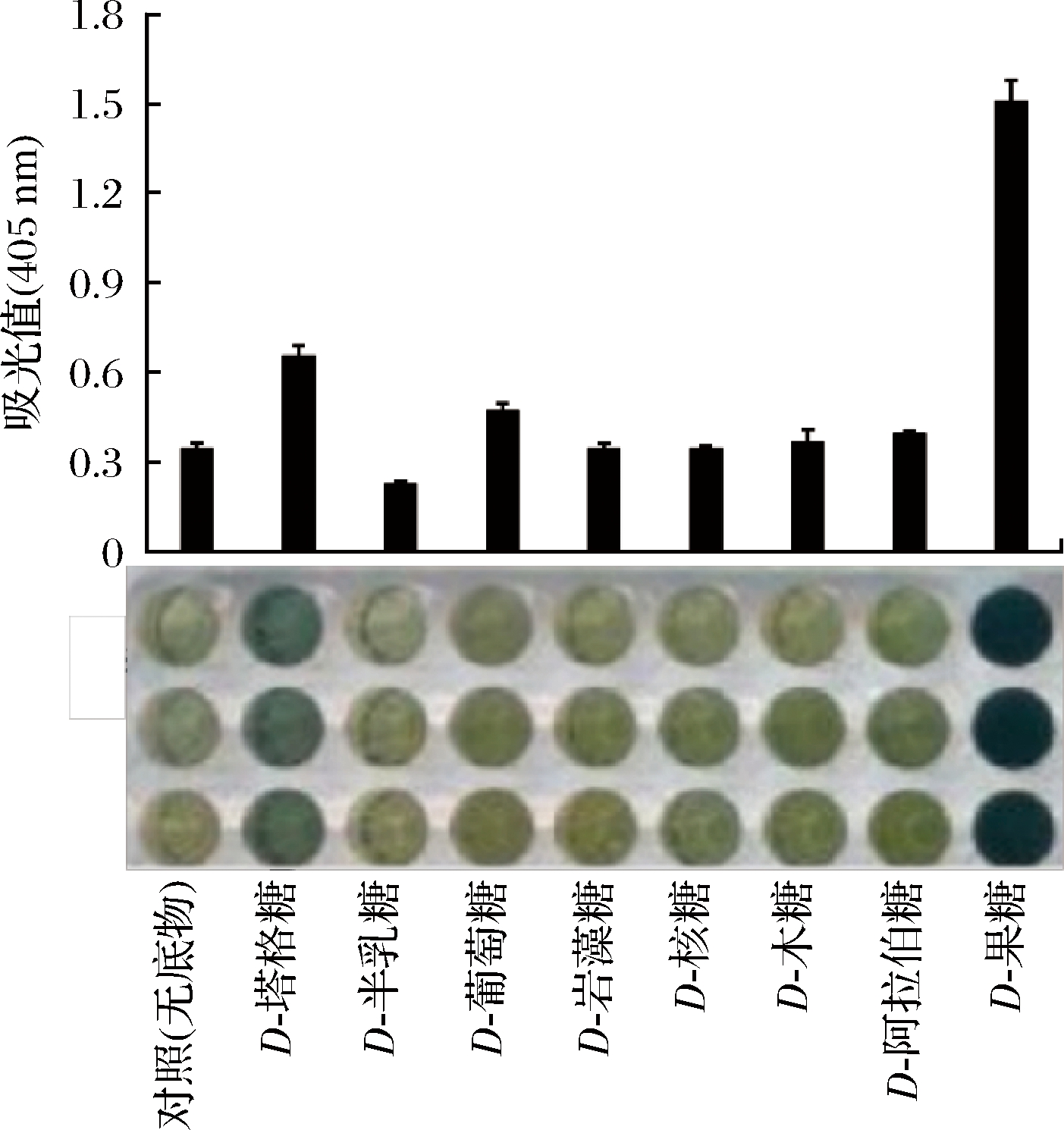
图9 重组SoCeFruK1852酶的底物特异性
Fig.9 Substrate specificity of recombinant SoCeFruK1852
3 讨论与结论
近年来,许多国内外学者已经从不同物种中克隆果糖激酶基因,少部分实现了目的基因的异源表达[9,18]。本研究首次从纤维素堆囊菌中成功获得2个编码果糖激酶的基因SoCeFruK1852和SoCeFruK7579,重组果糖激酶的分子质量相对较小,与长双歧杆菌Bifidobacterium longum A10C (32.4 kDa)来源的角蛋白酶分子质量相近[19]。400 mL标准发酵液中,重组SoCeFruK1852和SoCeFruK7579纯酶的产量分别为20.4、18 mg,产量与其他大肠杆菌表达的重组蛋白相当[20]。
重组SoCeFruK1852的酶活力显著高于SoCeFruK7579,因此本研究在后续研究中以SoCeFruK1852为研究对象。其最适反应温度为37 ℃,与其模板菌株纤维素堆囊菌的生长条件一致[21]。最适pH为4.5,与Methylomicrobium alcaliphilum 20Z来源的果糖激酶在碱性条件下(pH 9.0)活力最强不一致[22],这也说明酶的最适催化条件与其自身结构有关。该酶在酸性条件下表现出较高的酶活力,是一种嗜酸蛋白。表面活性剂Tween 20和SDS能够强烈抑制酶的活性,使酶的活力降低80%左右,这与许多重组酶的结果一致[23]。EDTA能够完全抑制酶的活性,Mg2+和Mn2+能够显著增强重组激酶的酶活力,说明SoCeFruK1852是金属离子依赖型蛋白。Co2+、Fe3+和Zn2+则显著抑制重组SoCeFruK1852的酶活力,酶活力分别保留了10.32%、20.4%和30.23%,可能是该类金属离子与酶发生反应,破坏了酶的空间结构,这与铜绿假单胞菌来源角蛋白酶的结果相似[24]。重组SoCeFruK1852对果糖的Km值为0.54 mmol/L,Kcat为10.21 s-1,RIGGS等[17]获得6个拟南芥源重组果糖激酶(FRK1~FRK6),且对果糖的Km值为0.46 mmol/L~0.98 mmol/L,Kcat为4.8~14.2 s-1,重组果糖激酶SoCeFruK1852具有相似的底物结合能力,催化效率也介于几个果糖激酶之间。但是SoCeFruK1852比嗜碱甲基霉来源果糖激酶的Km值(0.36 mmol/L)稍高[22],说明不同来源的果糖激酶的催化能力存在差异。重组SoCeFruK1852底物特异性较强,对果糖的催化活力最高,同时对塔格糖表现出一定的酶活力,对葡萄糖表现出微弱的活力,而对半乳糖等没有催化活性,这与MATT等[25]报道的果糖激酶能够催化果糖,而不能催化半乳糖的结果一致。
本研究首次实现了S.cellulosum果糖激酶基因SoCeFruK1852和SoCeFruK7579在大肠杆菌中的异源表达。重组果糖激酶分子质量大小分别为31.4 kDa和32.8 kDa,最适温度和pH分别为37 ℃和8.0,在温度16~42 ℃、pH 3.0~6.0具有较高的酶活力。该酶活力被EDTA、Co2+、Fe3+和Zn2+抑制,Mg2+和Mn2+能够显著增强酶活力,属于金属离子依赖型酶。因此,重组果糖激酶SoCeFruK1852良好的酶学特性使其在果糖-6-磷酸制备中具有潜在的价值。
[1] GRANOT D.Role of tomato hexose kinases[J].Functional Plant Biology,2007, 34(6):564-570.
[2] ROLLAND F,BAENA-GONZALEZ E,SHEEN J.Sugar sensing and signaling in plants:Conserved and novel mechanisms[J].Annual Review of Plant Biology, 2006, 57:675-709.
[3] GRANOT D, DAVID-SCHWARTZ R, KELLY G.Hexose kinases and their role in sugar-sensing and plant development[J].Frontiers in Plant Science, 2013, 4:44.
[4] 杨静静. 苹果果糖激酶基因MdFRK2在调控糖代谢中的功能研究[D].杨凌:西北农林科技大学, 2019.
YANG J J.Study on the function of apple fructokinase gene MdFRK2 in regulating glucose metabolism[D].Yangling:Northwest A&F University, 2019.
[5] 赵建华, 尹跃, 李浩霞, 等.枸杞果糖激酶基因LbFRK7的克隆及表达分析[J].西北植物学报, 2018, 38(5):816-822.
ZHAO J H, YIN Y, LI H X, et al.Cloning and expression analysis (LbFRK7) from wolfberry (Lycium barbarum)[J].Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(5):816-822.
[6] 张露凡, 宋普文, 毋柳柳, 等.小麦果糖激酶基因TaFRK与TaPFT的互作分析[J].麦类作物学报, 2021, 41(11):1 339-1 346.
ZHANG L F, SONG P W, WU L L, et al.Interaction analysis of fructokinase TaFRK and TaPFT genes in wheat[J].Journal of Triticase Crops, 2021, 41(11):1 339-1 346.
[7] HE L, ZHANG S, QIU Z N, et al.Fructokinase-like protein 1 interacts with TRXz to regulate chloroplast development in rice[J].Journal of Integrative Plant Biology, 2018, 60(2):94-111.
[8] 陈馨, 施丽愉, 邵佳蓉, 等.杨梅果糖激酶基因MrFRK2的克隆及在成熟期果实中的表达分析[J].园艺学报, 2016, 43(8):1 585-1 592.
CHEN X, SHI L Y, SHAO J R, et al.Molecular cloning and expression analysis of MrFRK2 in Chinese bayberry during fruit ripening[J]. Acta Horticulturae Sinica, 2016, 43(8):1 585-1 592.
[9] PAUL R, NATH S, SEN U.Cloning, expression, purification, crystallization and preliminary X-ray analysis of a fructokinase from Vibrio cholerae O395[J].Acta Crystallographica Section F:Structural Biology and Crystallization Communications, 2012, 68(12):1 564-1 567.
[10] PEREZ-CENCI M, SALERNO G L.Functional characterization of Synechococcus amylosucrase and fructokinase encoding genes discovers two novel actors on the stage of cyanobacterial sucrose metabolism[J].Plant Science, 2014, 224:95-102.
[11] LI X, CHEN G, LIU J J, et al.A rapid, accurate and sensitive method with the new stable isotopic tags based on microwave-assisted dispersive liquid-liquid microextraction and its application to the determination of hydroxyl UV filters in environmental water samples[J].Talanta, 2017, 167:242-252.
[12] ZEGZOUTI H, ZDANOVSKAIA M, HSIAO K, et al.ADP-glo:A Bioluminescent and homogeneous ADP monitoring assay for kinases[J].Assay and Drug Development Technologies, 2009, 7(6):560-572.
[13] LI C, NUMATA M, TAKEUCHI M, et al.A sensitive colorimetric and fluorescent probe based on a polythiophene derivative for the detection of ATP[J].Angewandte Chemie International Edition, 2005,44(39):6 371-6 374.
[14] HANSEN T, REICHSTEIN B, SCHMID R, et al.The first archaeal ATP-dependent glucokinase, from the hyperthermophilic crenarchaeon Aeropyrum pernix, represents a monomeric, extremely thermophilic ROK glucokinase with broad hexose specificity[J].Journal of Bacteriology, 2002, 184(21):5 955-5 965.
[15] KOGA S, YOSHIOKA I, SAKURABA H, et al.Biochemical characterization, cloning, and sequencing of ADP-dependent (AMP-forming) glucokinase from two hyperthermophilic archaea, Pyrococcus furiosus and Thermococcus litoralis[J].The Journal of Biochemistry, 2000, 128(6):1 079- 1 085.
[16] DUAN X C, CHEN H, LIU F F, et al.One assay for all:Exploring small molecule phosphorylation using amylose-polyiodide complexes[J].Analytical Chemistry, 2015, 87(19):9 546-9 550.
[17] RIGGS J W, CAVALES P C, CHAPIRO S M, et al.Identification and biochemical characterization of the fructokinase gene family in Arabidopsis thaliana[J].BMC Plant Biology, 2017, 17(1):1-18.
[18] 赵历强, 赵德蕊, 单春苗, 等.多花黄精果糖激酶和GDP-甘露糖焦磷酸化酶的基因克隆及酶结构性质[J].生物学杂志, 2021, 39(4):1-6.
ZHAO L Q, ZHAO D R, SHAN C M, et al. Cloning and characterization of fructokinase and GDP-mannose pyrophosphorylase genes in Polygonatum cyrtonema Hua[J].Journal of Biology, 2022, 39(4):1-6.
[19] CAESCU C I, VIDAL O, KRZEWINSKI F, et al. Bifidobacterium longum requires a fructokinase (frk;ATP:D-fructose 6-phosphotransferase, EC 2.7.1.4) for fructose catabolism[J].Journal of Bacteriology, 2004, 186(19):6 515-6 525.
[20] SONG H B, ZHAO G H, ZHANG M, et al.Optimization of the UDP-Xyl biocatalytic synthesis from Crassostrea gigas by orthogonal design method[J].Protein Expression and Purification, 2022, 190:106002.
[21] JULIEN B, SHAH S, ZIERMANN R, et al.Isolation and characterization of the epothilone biosynthetic gene cluster from Sorangium cellulosum[J].Gene, 2000, 249(1-2):153-160.
[22] BUT S Y, ROZOVA O N, KHMELENINA V N,et al.Properties of recombinant ATP-dependent fructokinase from the halotolerant methanotroph Methylomicrobium alcaliphilum 20Z[J].Biochemistry (Moscow), 2012, 77(4):372-377.
[23] LV Y M, LABORDA P, HUANG K, et al.Highly efficient and selective biocatalytic production of glucosamine from chitin[J].Green Chemistry, 2017, 19(2):527-535.
[24] HAN M H.Isolation and characterization of a keratinolytic protease from a feather-degrading bacterium Pseudomonas aeruginosa C11[J].African Journal of Microbiology Research, 2012, 6(9):2 211-2 221.
[25] MATT J, DUCH NE M.Molecular and biochemical characterization of Entamoeba histolytica fructokinase[J].Parasitology Research, 2015, 114:1 939-1 947.
NE M.Molecular and biochemical characterization of Entamoeba histolytica fructokinase[J].Parasitology Research, 2015, 114:1 939-1 947.