植物乳杆菌作为一种益生菌,具有调节人体肠道菌群平衡及缓解代谢性疾病等多重功能。果蔬及部分药食同源中药含有丰富的营养物质,是植物乳杆菌发酵的良好载体。采用植物乳杆菌发酵果蔬汁能够提高果蔬汁的营养成分和生物利用率,提升果蔬汁的感官品质,提高果蔬汁保藏性能等[1]。朱珺等[2]研究表明,植物乳杆菌发酵的果蔬汁可明显改善胃肠道内微生态环境,增强肠道蠕动能力。左映平等[3]发现接种富硒植物乳杆菌可使发酵后的复合果蔬汁具有最高的乳酸菌菌落总数和总酸、乳酸、总黄酮、总多酚含量。与自然发酵相比,接种发酵,尤其是接种富硒植物乳杆菌发酵,可提高复合果蔬汁的体外抗氧化活性。接种富硒植物乳杆菌的复合果蔬汁中硒含量可达20.97 μg/mL。马晓伟等[4]以紫心火龙果作为发酵原料,添加由产乳酸芽孢杆菌、鼠李糖乳杆菌、植物乳杆菌组成的复配发酵剂0.1 g/100 mL,30 ℃发酵后制得的火龙果饮料色泽自然透亮、澄清透明、具有清雅和谐的果香。赵珊等[5]以胡萝卜、木瓜为原料,选用植物乳杆菌DMDL9010发酵混合果蔬汁,采用最优工艺条件使开发的活菌型与灭菌型果蔬汁货架期分别可达28 d和3个月,大大延长了果蔬汁的保质期。
枸杞子本品为茄科植物宁夏枸杞的干燥成熟果实。夏、秋二季果实呈红色时采收,热风烘干,除去果梗,或晾至皮皱后,晒干,除去果梗。性甘,味平,归肝,肾经,滋补肝肾,益精明目[6]。现代药理研究表明,枸杞具有提高机体免疫功能、抗氧化、保肝、抗肿瘤、降血糖等多种功效[7]。枸杞籽作为枸杞的种子,属于植物的繁殖体,富含果肉中未含有的特殊成分且含有供发芽的充足营养,如何充分利用枸杞籽中的营养成分而不被废弃,这是研究枸杞资源中值得考究的一部分内容。目前关于枸杞发酵的研究多见于枸杞汁、枸杞果酒等,主要集中在工艺优化、功效成分等方面,如黄宁馨等[8]通过发酵枸杞果汁研究了发酵过程中品质及抗氧化活性的变化,刘知非等[9]采用响应面法对发酵枸杞汁进行了工艺优化,王丽萍等[10]通过浸泡枸杞后榨汁,进行了工艺优化和风味物质的分析。目前暂未发现发酵过程中相关短链脂肪酸含量变化的报道。
植物乳杆菌P9是一株具有优良胃肠液耐受性的益生乳酸菌。李常坤[11]发现该菌对有机磷农药具有良好的降解效果。张媛等[12]研究了植物乳杆菌P9与商业发酵剂复配发酵对发酵乳贮藏特性的影响,发现添加不同接种量的植物乳杆菌P9均可增加发酵乳硬度、稠度和内聚性,改善发酵乳质构,表明植物乳杆菌P9具有较好的发酵性能。本研究在确定了发酵工艺参数的基础上,研究了植物乳杆菌P9发酵枸杞浆过程中的pH、活菌数、总糖、葡萄糖、短链脂肪酸及抗氧化活性的变化,为植物乳杆菌P9发酵药食同源药材的开发应用提供数据支持和理论依据。
1 材料与方法
1.1 材料与试剂
宁夏枸杞干果,江西江中中药饮片有限公司;植物乳杆菌(Lactobacillus plantarum)P9冻干粉,江中药业股份有限公司;乳酸、乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸、2-甲基戊酸、甲基叔丁基醚(methyl tert-butyl ether,MTBE),均为色谱纯,上海安谱实验科技股份有限公司;无水葡萄糖标准品,中国食品药品检定研究院;苯酚、浓硫酸、1,10-菲罗啉、过氧化氢、DPPH、FeSO4·7H2O、NaCl、KCl、Na2HPO4、KH2PO4等均为分析纯。
1.2 仪器与设备
HM-928打浆机,广东黑马电器有限公司;LE438 pH计,梅特勒-托利多国际有限公司;ZQZY-85BN振荡培养箱,上海知楚仪器有限公司;SAFE-1500LC生物安全柜,上海力康科学仪器有限公司;LDZF-50L-III高压蒸汽灭菌锅,上海申安医疗器械厂;HH-4恒温数显水浴锅,常州国华电器有限公司;Agilent 1260型高效液相色谱仪、Agilent 7890-7000D气质联用仪,美国Agilent Technologies公司;Eppendorf 5424R离心机,德国Eppendorf公司;SA-402B型味觉感应系统(电子舌),日本Insent公司;UV-1800分光光度计,岛津株式会社。
1.3 实验方法
1.3.1 发酵工艺流程
挑除枸杞干果中的烂果、霉果,用自来水冲洗表面,去除杂质后按1∶6的料水比(g∶mL)加入纯水,浸泡30 min后,打浆,经沸水浴10 min灭菌,立即冷却至室温,接种植物乳杆菌P9冻干粉万分之一,37 ℃发酵64 h,在0、8、16、28、40、52、64 h分别取样测定pH值、活菌数及6种味觉值。同时在0、40 h分别测定总糖、葡萄糖、短链脂肪酸及羟自由基清除率、DPPH自由基清除率。
1.3.2 枸杞浆pH值和活菌数的测定
pH值:采用pH计测定;活菌数:采用平板稀释法,参考GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》。
1.3.3 电子舌滋味分析
采用电子舌分析不同发酵时间样品的味感变化。取30 g样品加等量超纯水进行稀释过滤至无明显渣籽,装入电子舌专用烧杯中。每秒采集1次数据,共采集120 s,清洗330 s。使用CTO、CAO、C00、AE1传感器分别对样品的咸味、酸味、苦味和涩味进行检测,每个样品重复测定4次;使用GL1传感器检测样品的甜味,每个样品重复测定5次,均选取最后3次的稳定数据纳入分析。
1.3.4 总糖含量的测定
采用超纯水将发酵0、40 h的枸杞浆样品稀释1 000倍,取稀释液0.2 mL于具塞试管中,参考GB/T 15672—2009《食用菌中总糖含量的测定》[13]中的步骤,在490 nm处测定吸光值,计算总糖含量,以葡萄糖为标准品,制作总糖标准曲线y=0.009 1x+0.015 9(g/L,R2=0.999)。
1.3.5 葡萄糖含量的测定
参照游佳欣等[14]的方法,测试样品在10 000 r/min离心5 min,稀释至相应倍数,上清液经0.22 μm的滤膜过滤。采用Agilent 1260型高效液相色谱仪进行测定,色谱条件:色谱柱Bio-Rad HPX-87H(300 mm×7.8 mm),Bio-Rad MG Cartridges(30 mm×4.6 mm),流动相0.005 mol/L硫酸,流速0.6 mL/min,柱温55 ℃,检测器为示差折光检测器(refractive index, RI)。进样量为10 μL。
1.3.6 短链脂肪酸(short chain fatty acids,SCFAs)含量的测定
样品的前处理方法参考BIANCHI等[15]、ZHAO等[16]的研究,将样品涡旋混匀1 min;取样本50 μL加入到对应的1.5 mL离心管中,加入100 μL 0.5%(体积分数)磷酸溶液,涡旋3 min;加入150 μL含内标的MTBE溶剂,涡旋3 min,冰浴下超声5 min;之后在12 000 r/min、4 ℃条件下离心10 min;离心后吸取上层清液90 μL到有玻璃内衬管的进样瓶中,进行GC-MS/MS分析。
参照文献[16-17]中的检测方法,色谱质谱条件如下:进样量2 μL;分流模式1∶1,载气为He,色谱柱DB-FFAP(30 m×0.25 mm×0.25 μm),柱流速1.2 mL/min,柱箱升温程序:90 ℃保持1 min,以25 ℃/min升至100 ℃,然后以20 ℃/min升至150 ℃并保持0.6 min,以25 ℃/min升温至200 ℃,保持0.5 min,运行3 min。前进样口温度200 ℃,传输线温度230 ℃,离子源温度230 ℃,四级杆温度150 ℃。
数据处理:将检测到的所有样本的积分峰面积比值代入标准曲线线性方程进行计算,进一步计算后,最终得到实际样本中该物质的含量数据。样品中SCFAs含量(μg/mL)的计算如公式(1)所示:
SCFAs含量=c×V/1 000/V0
(1)
式中:c为样本中积分峰面积比值代入标准曲线得到的质量浓度,μg/mL;V为样品提取过程中加入提取液的体积,μL;V0为量取的样本量,mL。
1.3.7 抗氧化活性的测定
1.3.7.1 DPPH自由基清除率的测定
参考ISLAM等[18]的方法略有修改。发酵前后的样品分别稀释10倍,过滤取滤液。取样品滤液与 DPPH(0.2 mmol/L,无水乙醇配制)按体积比1∶1混合,作为样品组。用等体积的无水乙醇取代DPPH作为样品对照组,用等体积的磷酸缓冲盐溶液代替样品溶液作为对照组,并以等体积的磷酸缓冲盐溶液和无水乙醇的混合液作为空白调零。DPPH自由基清除率的计算如公式(2)所示:
DPPH自由基清除率/%=
(2)
式中:A517(样品)、A517(样品对照)和A517(对照)分别为样品组、样品对聚照组和对照组在517 nm处的吸光值。
1.3.7.2 羟自由基清除率的测定
参考张书文[19]的方法略作修改。发酵前后的样品分别稀释20倍,过滤取滤液;清除羟自由基能力的计算如公式(3)所示:
羟自由基清除率![]()
(3)
式中:A536(样品)、A536(对照)及A536(空白)分别为样品组、对照组及空白组在536 nm处测得的吸光值。
1.4 数据处理与分析
使用Excel 2019、Origin 8.5对实验数据分析作图,实验结果采用“平均值±标准差”表示,显著性差异分析采用SPSS 20.0的单因素方差分析(ANOVA)进行分析,P<0.05则认为存在显著性差异。
2 结果与分析
2.1 枸杞浆在乳酸发酵过程中的活菌数与pH的变化
活菌数和pH值是评价乳酸菌在枸杞果汁中生长情况和发酵力的重要指标,结果见图1。由图1可知,在发酵16 h时,乳酸菌在枸杞浆中大量生长繁殖,同时pH值由4.95降至3.87。随着发酵时间的延长,体系中营养物质不断消耗及代谢产物的积累,28 h后枸杞浆中活菌数显著降低(P<0.05)。在40 h时,pH基本趋于稳定,初步确定为发酵终点。

图1 枸杞浆发酵过程中pH与活菌数的变化
Fig.1 Changes of pH and viable count of Lycium barbarum pulp during fermentation
2.2 枸杞浆在乳酸发酵过程中的滋味变化
电子舌作为一种新兴的仿生设备,避免了生理味觉和嗅觉的主观影响和缺陷,能够客观地反映食品的滋味和风味。酸味响应值的升高和甜味响应值的降低可以分别间接地反映出发酵过程中有机酸的生成与糖类的消耗。由图2可知,不同发酵时间的样品,味觉值均有不同程度的变化,随着发酵时间的延长,酸味响应值增大,甜味与鲜味响应值降低,这与乳酸发酵消耗了枸杞中的糖类物质并产生大量的有机酸有关。苦味、咸味等响应值略有降低(涩味响应值均在0以下,未在判断范围内)。PCA结果如图3所示,PC1的贡献率为53.59%,PC2的贡献率为45.35%,主要综合了咸味、苦味、鲜味、酸味、甜味,其中咸味、苦味、鲜味、甜味在PC1、PC2上呈正向分布,酸味则呈负向分布,两者的方差贡献率之和达到98.94%,说明PC1和PC2可以很好地反应样品几乎全部的信息。不同发酵时间段之间均存在一定的距离,随着发酵时间延长,发酵液中的咸味、苦味、鲜味、甜味逐渐降低,而酸味逐渐突出。其中0 h与8 h距离最大,随后依次缩短,40、52、64 h之间距离相差最小,即发酵产生的滋味变化小,为降低能耗,结合样品口感、活菌数变化等,确定40 h为发酵终点。
2.3 枸杞浆在乳酸菌发酵前后总糖、葡萄糖的变化
枸杞浆经植物乳杆菌P9发酵40 h,总糖与葡萄糖的变化如图4所示,总糖含量由86.18 g/L降至72.42 g/L,下降了16.75%;葡萄糖含量由40.36 g/L降至29.62 g/L,下降了26.61%。本研究中的枸杞干果经过浸泡、打浆、灭菌、发酵,未添加其他糖类物质,因此植物乳杆菌P9发酵枸杞浆进行的糖类代谢均是利用枸杞果肉与枸杞籽中的碳水化合物。植物乳杆菌P9进行糖类代谢是一个复杂的过程,乳酸菌与植物多糖之间可能存在着双向关系,乳酸菌会以多糖为益生元促进菌体生长,也可能会分泌酶类物质促进多糖的溶出或通过转化多糖为单糖后又重新合成了其自身的胞外多糖成分。所以发酵过程中总糖与葡萄糖的消耗尚不能完全反映植物乳杆菌P9的糖类代谢过程,可能存在葡萄糖的消耗,同时有枸杞多糖的分解[20]、溶出[21]等。
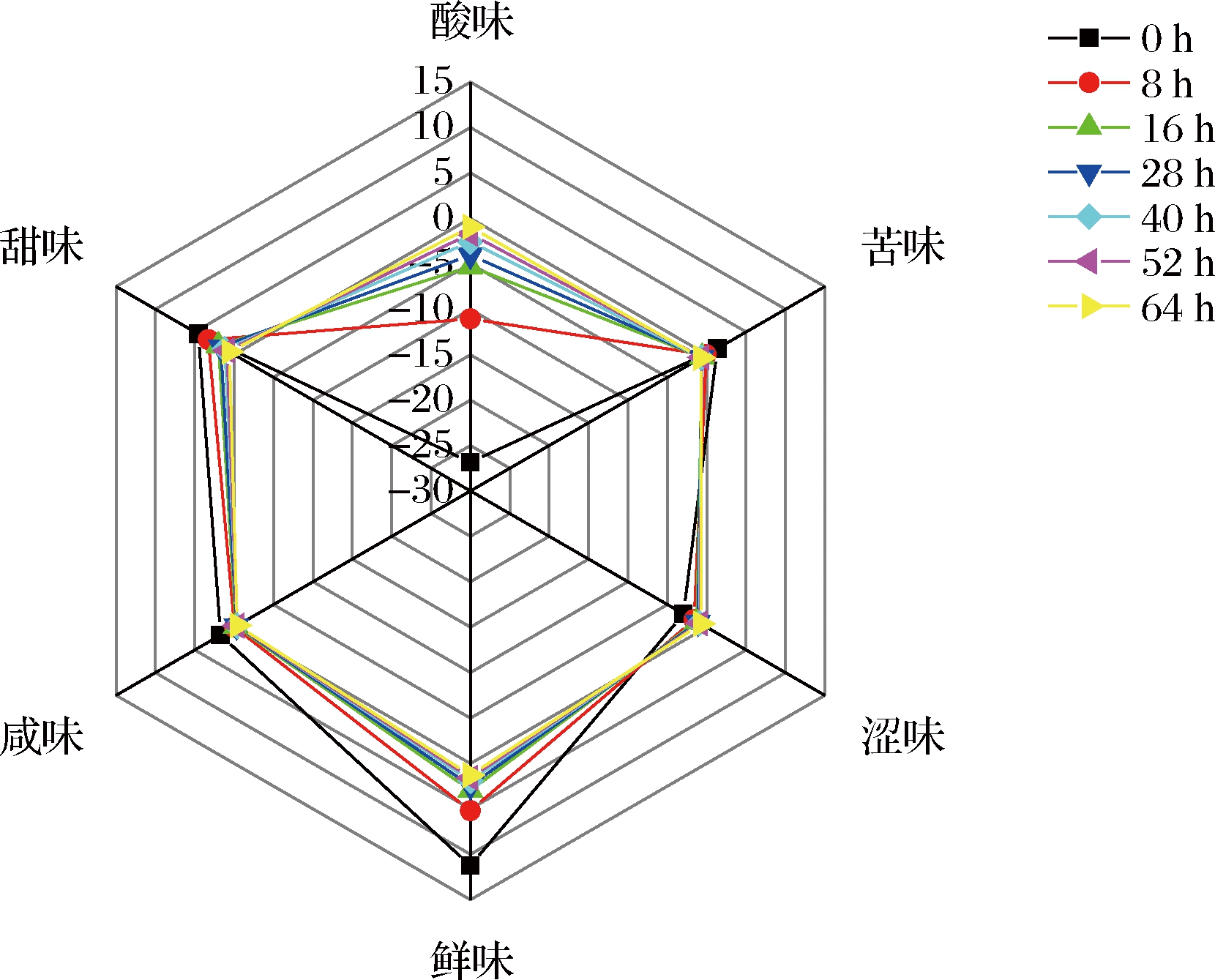
图2 枸杞浆发酵过程中滋味的变化雷达分析图
Fig.2 Radar analysis of taste changes in Lycium barbarum pulp during fermentation

A-因子载荷图;B-因子得分图
图3 不同发酵时间主成分分析结果
Fig.3 Principal component analysis results of different fermentation time
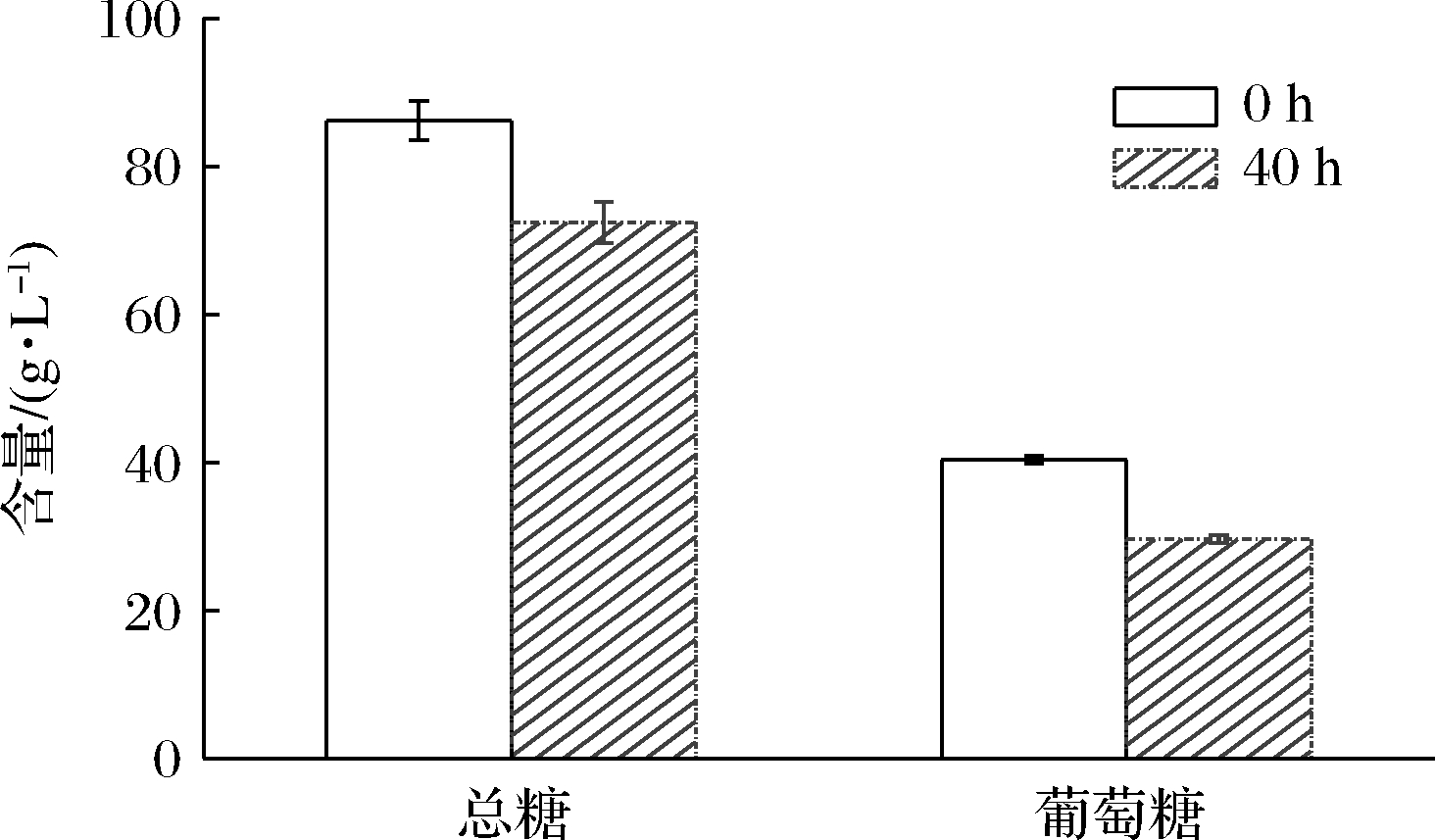
图4 发酵前后总糖与葡萄糖的变化
Fig.4 Changes of total sugar and glucose before and after fermentation
2.4 枸杞浆在乳酸发酵前后的SCFAs的变化
采用GC-MS方法,建立了7种SCFAs的标准方程,测定了其含量。研究结果表明枸杞浆在发酵40 h后,SCFAs含量均有不同程度的增加。其中乙酸含量最多,由(31.50±0.85) mg/L增加到(116.00±4.24) mg/L,其次是丙酸、丁酸、己酸、异戊酸、异丁酸、戊酸,该6种SCFAs含量变化见图5。发酵过程非常复杂,SCFAs的产生受到多种因素影响[22],主要有益生菌种类及数量、发酵基质等。本研究中植物乳杆菌发酵枸杞浆产生的SCFAs,主要以乙酸、丙酸、丁酸为主,作为有机酸的一部分,不仅可以增加枸杞果浆的酸度还可以丰富果浆的风味。此外,还可大大提升枸杞浆对肠道健康有益作用,如为肠道有益菌提供主要能量,保护肠黏膜屏障,调节肠道微生物稳态[23]。
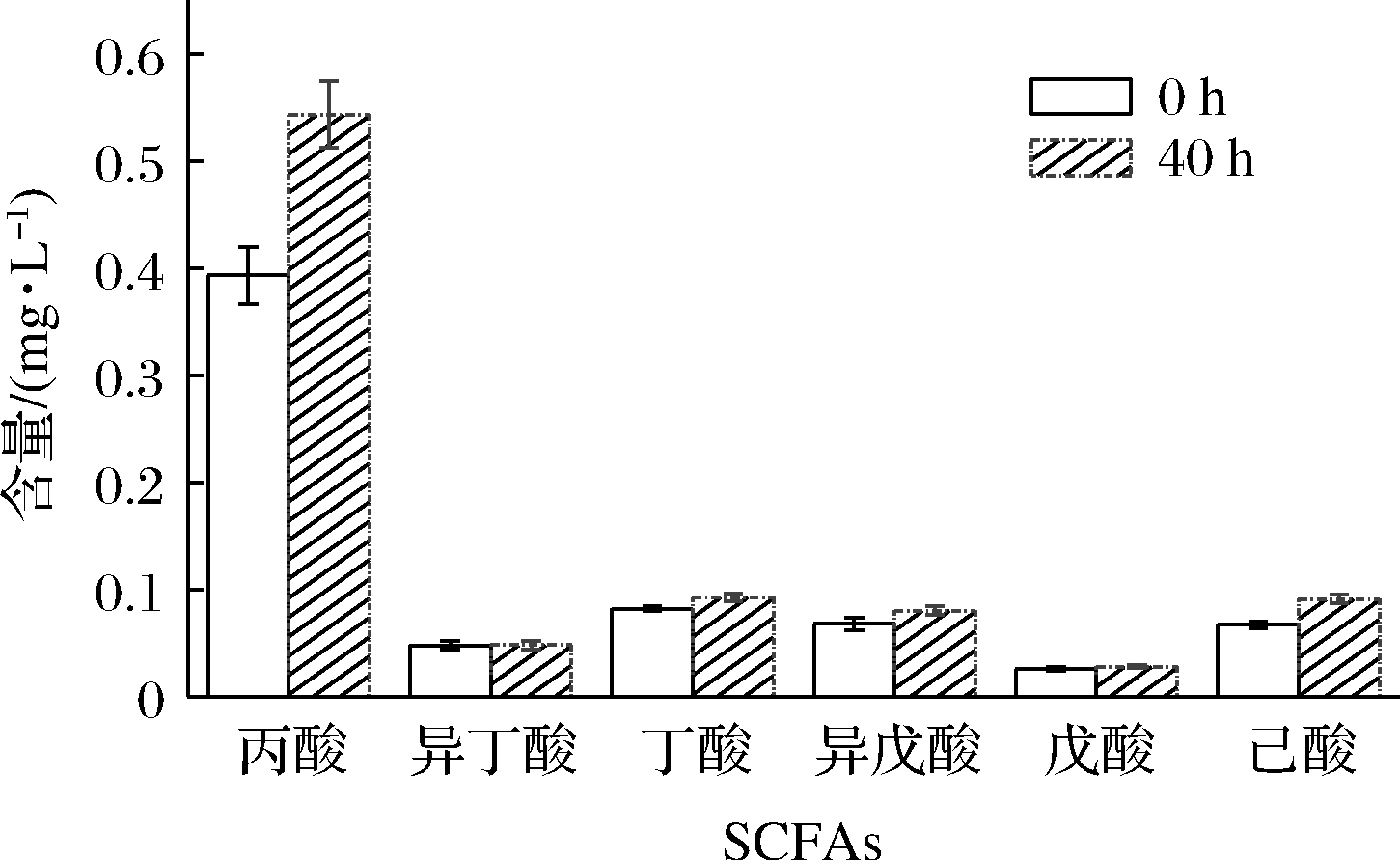
图5 枸杞浆发酵前后6种短链脂肪酸的变化
Fig.5 Changes of six SCFAs in Lycium barbarum pulp before and after fermentation
2.5 枸杞浆在乳酸菌发酵前后抗氧化活性的变化
利用羟自由基清除率、DPPH自由基清除率对发酵前后的枸杞浆抗氧化活性进行评价,结果如图6所示,植物乳杆菌P9发酵可以显著提高枸杞浆的抗氧化活性。其中,枸杞浆发酵40 h后羟自由基清除率由23.95%提高到30.89%,DPPH自由基清除率由65.92%提高到82.61%。枸杞果浆经植物乳杆菌发酵可显著提升其抗氧化活性,这与QI等[24]的结果研究一致。周旋等[25]探究了枸杞提取液主要活性成分含量与体外抗氧化活性指标之间的关系,结果表明,枸杞多糖含量与清除小鼠血清羟自由基能力呈显著的正相关关系,与抑制肝组织生成丙二醛能力呈极显著正相关关系。

图6 枸杞浆发酵前后抗氧化活性的变化
Fig.6 Changes of antioxidant activity of Lycium barbarum pulp before and after fermentation
3 结论
本文研究了植物乳杆菌P9发酵枸杞浆,并对其营养成分、风味物质和抗氧化活性进行了系统评价。研究结果表明,植物乳杆菌P9发酵可显著降低枸杞浆pH、总糖和葡萄糖含量;发酵过程中产生的SCFAs显著提升,尤其以乙酸提升最为明显,这不仅可以增加枸杞果浆的酸度还可以丰富果浆的风味,进而提升枸杞果浆对肠道健康有益作用;电子舌结果表明枸杞果浆经发酵后,其咸味、苦味、鲜味、甜味逐渐降低,而酸味逐渐突出,对其风味改善明显;抗氧化活性结果表明枸杞浆发酵后羟自由基清除率和DPPH自由基清除率显著提升。因此,可认为植物乳杆菌P9发酵对枸杞浆的品质提升明显,未来可采用其他乳酸菌与植物乳杆菌P9对枸杞浆进行复合发酵,并优化口感与风味。
[1] 全琦, 刘伟, 左梦楠, 等.乳酸菌发酵果蔬汁的风味研究进展[J].食品与发酵工业, 2022, 48(1):315-323.
QUAN Q, LIU W, ZUO M N, et al.Advances in the flavor of fruit and vegetable juices fermented by lactic acid bacteria[J].Food and Fermentation Industries, 2022, 48(1):315-323.
[2] 朱珺, 钱永清, 孙盛, 等.一株具有益生特性的植物乳杆菌及其在发酵果蔬汁中的应用[J].食品与发酵工业, 2019, 45(20):197-201.
ZHU J, QIAN Y Q, SUN S, et al.A probiotic Lactobacillus plantarum for vegetable and fruit juice fermentation[J].Food and Fermentation Industries, 2019, 45(20):197-201.
[3] 左映平, 孙国勇, 张玲.富硒乳酸菌对复合果蔬汁品质的影响[J].食品研究与开发, 2021, 42(14):36-42.
ZUO Y P, SUN G Y, ZHANG L.Quality of compound fruit and vegetable juice fermented by seleniumenriched lactic acid bacteria[J].Food Research and Development, 2021, 42(14):36-42.
[4] 马晓伟, 林小晖, 杜冰.益生菌发酵火龙果饮料的工艺研究[J].饮料工业, 2017, 20(3):48-52.
MA X W, LIN X H, DU B.Research and produce of pitaya fermented beverage with Lactobacillus[J].The Beverage Industry, 2017, 20(3):48-52.
[5] 赵珊, 李清兰, 黄燕燕, 等.胡萝卜木瓜混合发酵果蔬汁的制备及其抗氧化性能研究[J].食品科技, 2019, 44(1):146-153.
ZHAO S, LI Q L, HUANG Y Y, et al.Development and oxidation resistance of mixed fermented fruit-vegetable juice of carrot and papaya[J].Food Science and Technology, 2019, 44(1):146-153.
[6] 国家药典委员会. 中华人民共和国药典-四部:2020年版[M].北京:中国医药科技出版社, 2020.
National Pharmacopoeia Commission.Pharmacopoeia of the People′s Republic of China[M].Beijing:China Medical Science and Technology Press, 2020.
[7] 蒋兰, 杨毅, 江荣高.枸杞的药理作用及其加工现状[J].食品工业科技, 2018, 39(14):330-334.
JIANG L, YANG Y, JIANG R G.Pharmacological action of Chinese wolfberry and its comprehensive processing utilization[J].Science and Technology of Food Industry, 2018, 39(14):330-334.
[8] 黄宁馨, 鲁群, 丁士勇, 等.复合乳酸菌发酵过程中枸杞果汁品质及抗氧化活性变化[J].华中农业大学学报, 2021, 40(6):186-194.
HUANG N X, LU Q, DING S Y, et al.Changes in quality and antioxidant activity of Goji juice during fermentation of compound lactic acid bacteria[J].Journal of Huazhong Agricultural University, 2021, 40(6):186-194.
[9] 刘知非, 周婷, 胡晓磊, 等.响应面法优化复合益生菌发酵枸杞汁的工艺研究[J].中国酿造, 2021, 40(4):95-99.
LIU Z F, ZHOU T, HU X L, et al.Optimization of fermentation technology of Lycium barbarum juice with compound probiotics by response surface methodology[J].China Brewing, 2021, 40(4):95-99.
[10] 王丽萍,颉向红,米江,等.枸杞饮料乳酸发酵工艺优化及其风味物质分析[J].河南农业大学学报, 2020, 54(1):140-149.
WANG L P, XIE X H, MI J, et al.Optimization of lactic acid fermentation and analysis of flavor substances of Goji berry beverage[J].Journal of Henan Agricultural University, 2020, 54(1):140-149.
[11] 李常坤. 对三种有机磷农药具有降解活性Lactobacillus plantarum的筛选及其缓解大鼠甲拌磷中毒研究[D].呼和浩特:内蒙古农业大学, 2019.
LI C K.Screening of Lactobacillus plantarum with degradation activity for three organophosphorus pesticides and its mitigation of phorate poisoning in rats[D].Hohhot:Inner Mongolia Agricultural University, 2019.
[12] 张媛, 潘潇, 刘文君, 等.植物乳杆菌P9接种量对凝固型发酵乳贮藏特性的影响[J].中国乳品工业, 2022, 50(2):21-24.
ZHANG Y, PAN X, LIU W J, et al.Effect of Lactobacillus plantarum P9 inoculation amount on the storage characteristics of coagulated fermented milk[J].China Dairy Industry, 2022, 50(2):21-24.
[13] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.食用菌中总糖含量的测定:GB/T 15672—2009[S].北京:中国标准出版社, 2009.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, Standardization Administration of China Determination of total sugar content in edible fungi: GB/T 15672—2009[S].Beijing:China Standard Press, 2009.
[14] 游佳欣, 应文俊, 杨倩倩, 等.杨木酶水解液培养枯草芽孢杆菌试验[J].林业工程学报, 2021, 6(4):94-100.
YOU J X, YING W J, YANG Q Q, et al.The production of Bacillus subtilis by fermentation from enzymatic hydrolysate of poplar[J].Journal of Forestry Engineering, 2021, 6(4):94-100.
[15] BIANCHI F, DALL′AATA M, DEL RIO D, et al.Development of a headspace solid-phase microextraction gas chromatography-mass spectrometric method for the determination of short-chain fatty acids from intestinal fermentation[J].Food Chemistry, 2011, 129(1):200-205.
[16] ZHAO G, NYMAN M, JÖNSSON J A.Rapid determination of short-chain fatty acids in colonic contents and faeces of humans and rats by acidified water-extraction and direct-injection gas chromatography[J].Biomedical Chromatography: BMC, 2006, 20(8):674-682.
[17] ZHAO R S, CHU L L, WANG Y, et al.Application of packed-fiber solid-phase extraction coupled with GC-MS for the determination of short-chain fatty acids in children′s urine[J].Clinica Chimica Acta, 2017, 468:120-125.
[18] ISLAM F, QUADERY T M, CHOWDHURY S R, et al.Antioxidant and cytotoxic activities of Mussaenda macrophylla[J].Bangladesh Pharm.J, 2012, 15:69-71.
[19] 张书文. 抗氧化乳酸菌的筛选及其特性研究[D].呼和浩特:内蒙古农业大学, 2009.
ZHANG S W.Screening and characterization of antioxidant lactic acid bacteria[D].Hohhot:Inner Mongolia Agricultural University, 2009.
[20] 孙慧峰, 朱钧溢, 国立东, 等.乳酸菌生物转化药食同源植物活性成分研究进展[J].食品工业科技, 2022, 43(7):474-481.
SUN H F, ZHU J Y, GUO L D, et al.Research progress on biotransformation of lactic acid bacteria on active ingredients from homologous plants of medicine and food[J].Science and Technology of Food Industry, 2022, 43(7):474-481.
[21] 邱皓璞, 李卓航, 潘洁尘, 等.不同发酵菌种对白及多糖提取率及发育毒性的影响[J].中国野生植物资源, 2021, 40(12):26-30.
QIU H P, LI Z H, PAN J C, et al.Effects of different fermentation strains on extraction rate and reproductive toxicity of Bletilla striata polysaccharide[J].Chinese Wild Plant Resources,2021,40(12):26-30.
[22] 刘松珍, 张雁, 张名位, 等.肠道短链脂肪酸产生机制及生理功能的研究进展[J].广东农业科学, 2013, 40(11):99-103.
LIU S Z, ZHANG Y, ZHANG M W, et al.Research progress on producing mechanism and physiological functions of intestinal short chain fatty acids[J].Guangdong Agricultural Sciences, 2013, 40(11):99-103.
[23] 平易, 魏艳玲, 陈东风, 等.肠道短链脂肪酸与肠黏膜屏障[J].胃肠病学和肝病学杂志, 2022, 31(5):508-512.
PING Y, WEI Y L, CHEN D F, et al.Intestinal short-chain fatty acids and intestinal mucosal barrier[J].Chinese Journal of Gastroenterology and Hepatology, 2022, 31(5):508-512.
[24] QI J, HUANG H, WANG J, et al.Insights into the improvement of bioactive phytochemicals, antioxidant activities and flavor profiles in Chinese wolfberry juice by select lactic acid bacteria[J].Food Bioscience, 2021, 43:101264.
[25] 周旋, 梁晓婕, 王亚军, 等.枸杞提取液主要成分含量与体外抗氧化活性的相关性[J].食品工业, 2020, 41(5):211-214.
ZHOU X, LIANG X J, WANG Y J, et al.Correlation of main components content of wolfberry extract and antioxidant activity in vitro[J].The Food Industry, 2020, 41(5):211-214.