葡萄属葡萄科(Vitaceae)葡萄属(Vitis L)木质藤本植物,是全球广泛种植的商业果树;采后葡萄果实组织娇嫩且存在果蒂断面,易发生由灰葡萄孢(Botrytis cinerea)侵染导致的灰霉病并形成大面积腐烂[1]。传统的硫磺熏蒸或化学杀菌剂(如波尔多液)表面喷淋处理虽然能够有效控制葡萄采后灰霉病的发展,但也造成严重的环境污染并增加病原菌耐药性[2]。使用绿色诱导剂来激活防御反应被认为是高效的果实病害控制策略,水杨酸、苯丙噻唑硫代乙酸甲酯(benzothiadiazoles,BTH)、2,6-二氯异烟酸和茉莉酸及其甲酯衍生物等激发子均可有效激活果实对病原微生物的抗性,抑制采后腐烂的发生[3]。此外,β-氨基丁酸(β-aminobutyric acid, BABA)为小分子非蛋白氨基酸,可诱导烟草[4]和拟南芥[5]等模式作物中病程相关(pathogenesis-related, PR)蛋白的合成,提高植株抗病性。敏化(priming)反应即植物不表现任何可检测的生理生化反应,而仅在受到病原菌攻击时才表现出已被激活和放大的防卫反应的过程,即防御准备就绪的状态;priming抗性不是直接上调防卫信号传递级联反应,而是使植物进入防御状态,是植物低成本高效率的防御策略[6]。先期研究也表明,BABA处理可提升水蜜桃[7-8]等果实抗病性,从而抑制病原真菌侵染;而且,低浓度BABA(10 mmol/L BABA)在诱导草莓果实priming反应的同时,也维持了果实中较高的可溶性糖含量,显示出BABA诱导的果实抗病性在平衡底物消耗方面的优点[9]。但BABA诱导的采后果实抗病性与糖代谢的关联机制仍不清晰。
山梨醇是植物光合作用同化物的主要运输形式,在果实卸载后也广泛参与库器官中糖元的转化和积累[10]。在果实品质形成过程中,山梨醇可经山梨醇脱氢酶和山梨醇氧化酶的催化从而转化为葡萄糖和果糖,从而直接影响果实的风味[11-12]。此外,山梨醇能诱导苹果叶片中核苷酸结合位点-亮氨酸富集重复型(nucleotide-binding site-leucine-rich repeat, NBS-LRR)抗病基因的表达,启动果实效应子介导的免疫反应(effector-triggered immunity, ETI)[13]。先期对葡萄悬浮细胞的研究表明,BABA可激活葡萄悬浮细胞的系统获得性抗性(systemic acquired resistance,SAR),降低细胞对B.cinerea的敏感性,并同时提高细胞中可溶性糖和花色苷含量[14]。因此,在前期研究的基础上,本研究以采后“巨峰”葡萄果实为试材,确定BABA诱导的采后葡萄果实抗病性反应的具体模式,并从山梨醇代谢和转录调控的角度阐释BABA维持果实可溶性糖积累的机理,以期为浆果类果实采后保鲜提供新思路。
1 材料与方法
1.1 材料与试剂
达到商业成熟度的“巨峰”葡萄果实(Vitis vinifera Cv ‘Kyoho’)于2021年7月摘自四川省遂宁市船山区仁里镇有机葡萄种植基地,采后2 h内运回实验室。将有病虫害、机械伤以及未成熟的葡萄果实剔除,然后仔细剪下果穗上果粒,挑选大小一致且转色均匀的果实平摊于实验台以散去田间热。同日测定葡萄果实品质指标,其中果实直径范围(1.98±0.15) cm、可滴定酸(0.79±0.07)%、可溶性固形物含量为(14.8±1.38)%、pH值为3.24±0.17、硬度为(5.33±0.36) N。
灰葡萄孢(B.cinerea Pers.:Fr)B05.10菌株分离自发生灰霉病的葡萄果实,经分离纯化、测序鉴定和继代培养后,将成熟菌丝体转入PDA培养基上培养10 d,随后用无菌水冲洗出成熟孢子,取得孢子悬浮母液,随后用生理盐水将悬浮液中孢子浓度稀释为1×105个/mL,现配现用。
β-氨基丁酸(纯度≥95 %),上海麦克林科技有限公司;山梨醇含量测定试剂盒、NAD+型山梨醇脱氢酶(NAD+-SDH)酶活性反应试剂盒,苏州科铭科技有限公司;6-磷酸山梨醇脱氢酶(sorbitol-6-phosphate dehydrogenase,S6PDH)、山梨醇氧化酶(sorbitol oxidase,SOX)、NADP+型山梨醇脱氢酶(NADP+-SDH)酶活性反应试剂盒,苏州格锐思科技有限公司;植物可溶性糖检测试剂盒,北京生工有限公司;RNAprep Pure试剂盒、PrimeScriptTM RT reagent试剂盒、SYBR qPCR master mix试剂盒,日本宝日医公司;DH5α、Y1HGold感受态细胞,北京金沙生物技术有限公司;BamHI、BbsI、SacI、SmaI和SalI限制性内切酶,FastPure质粒提取试剂盒,双荧光素酶试剂盒(DL101-01),南京诺唯赞生物科技有限公司;金担子素A(AbA)、卡那霉素、SD/-Ura及SD/-Leu培养基等,北京索莱宝生物科技有限公司。
1.2 仪器与设备
Epoch型全波长酶标仪,美国伯腾公司;ABI QuantStudio7 型实时荧光定量PCR仪,美国赛默飞公司;ChemiDocTM MP凝胶成像系统,美国伯乐公司;EZ4D双目立体显微镜,德国莱卡公司;PAL-1型手持数显折光仪,日本爱拓公司;GloMax96微孔板发光检测仪,美国普洛麦格公司;LC-20A高效液相色谱仪,日本岛津公司。
1.3 实验处理
前期研究已证实,10 mmol/L的BABA处理可有效降低葡萄果实采后腐烂的发生并维持果实品质,故将以此为BABA处理浓度[14]。供试葡萄果实经75%(体积分数)乙醇进行表面消毒,随后在果实赤道部位对称穿刺2个孔(直径1.5 mm、深度1.5 mm)并随机分为4组分别按如下处理:(1)对照组,在葡萄果实各穿刺点注入10 μL无菌水;(2)BABA处理组,在果实各穿刺点注入10 μL的10 mmol/LBABA溶液;(3)B.cinerea接种组,在果实各穿刺点接种10 μL浓度为1.0×105个/mL的B.cinerea孢子悬浮液;(4)BABA+B.cinerea接种组,先注入10 μL的10 mmol/L BABA溶液于果实穿刺部位,于20 ℃静置6 h后再接种10 μL的1.0×105个/mL B.cinerea孢子悬浮液。处理完成后的全部果实于20 ℃下静置2 h(取样零点),再用无菌聚乙烯塑料盒分装(每盒10~12颗果实),最后于(20±1) ℃、80%~90%相对湿度环境中贮藏5 d。贮藏期间每日测定葡萄果实发病率和病斑直径,并同时用无菌手术刀切取健康果肉组织于液氮速冻再转入-80 ℃超低温冰箱中保存,以用于其余生化和分子指标的测定。各处理用果约200颗,重复3次,整个实验重复2次。
1.4 测定指标及方法
1.4.1 果实发病率及病斑直径
当葡萄果实穿刺点部位的灰霉病病疽直径超过1.5 mm时,即记为发病果实,计算病果数量与总果实数量的比例得出发病率。用游标卡尺直接测量病果病斑直径。
1.4.2 果实品质指标
用PAL-1型手持数显折光仪直接测定葡萄果实中可溶性固形物(total soluble solids,TSS)含量,酸碱滴定法测定(以酒石酸计)可滴定酸(titratable acid,TA)含量;采用Folin-Ciocalteu法[15]的测定果实中总酚含量,结果以mg/kg FW表示;根据SHE等[16]的方法进行测定果实中DPPH自由基清除率和总还原力,结果分别以DPPH自由基清除百分率和700 nm处吸光值表示。
1.4.3 基因表达量测定
根据WANG等[17]的方法提取葡萄果实总RNA,称取5 g果肉在液氮的保护下充分研磨后使用RNA prep Pure试剂盒进行提取,随后使用Prime ScriptTM RT reagent试剂盒逆转录为cDNA第一链,置于-80 ℃保存备用。选择葡萄果实的VvNPR1(LOC100250996)、VvPR1(LOC100258414)、VvPR2(AJ277900.1)、VvPR5(LOC100254811)、VvWRKY40(LOC100253480)这5个抗病相关基因,其特异性引物用Primer Premier 5.0软件设计得到(表1),以管家基因Vv18S rRNA(AF321266.1)为内参进行SYBR Green实时荧光定量PCR(quantitative real-time polymerase chain reaction, qRT-PCR)。qRT-PCR反应程序为:(1)95 ℃预变性30 s;(2)95 ℃变性10 s、60 ℃ 退火30 s,40个循环;(3)在95 ℃ 15 s、60 ℃ 60 s和95 ℃ 15 s条件下进行溶解曲线分析。各基因的表达水平根据阈值周期(Ct值)采用2-ΔΔCt法定量,并将对照组果实转录本设为1以量化各基因相对表达水平。
表1 实时荧光定量PCR特异性引物序列
Table 1 Sequences of specific primers used for qRT-PCR
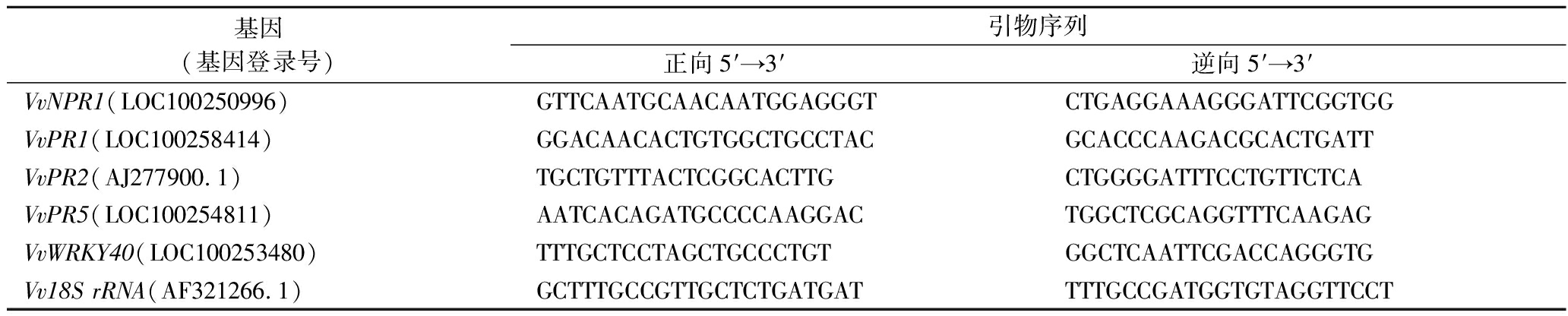
基因(基因登录号)引物序列正向5′→3′逆向5′→3′VvNPR1(LOC100250996)GTTCAATGCAACAATGGAGGGTCTGAGGAAAGGGATTCGGTGGVvPR1(LOC100258414)GGACAACACTGTGGCTGCCTACGCACCCAAGACGCACTGATTVvPR2(AJ277900.1)TGCTGTTTACTCGGCACTTGCTGGGGATTTCCTGTTCTCAVvPR5(LOC100254811)AATCACAGATGCCCCAAGGACTGGCTCGCAGGTTTCAAGAGVvWRKY40(LOC100253480)TTTGCTCCTAGCTGCCCTGTGGCTCAATTCGACCAGGGTGVv18S rRNA(AF321266.1)GCTTTGCCGTTGCTCTGATGATTTTGCCGATGGTGTAGGTTCCT
1.4.4 植保素含量的测定
称取2 g果实冻样,加入10 mL预冷的甲醇冰浴匀浆后过夜,随后4 ℃下以10 000×g离心15 min,冷冻干燥后用10 mL 100%冰乙腈溶解后经纤维膜(孔径为0.45 μm)过滤后得到相关提取液。葡萄果实中植保素单体(白藜芦醇和白藜芦醇脱氢二聚体)含量参考WANG等[18]的HPLC方法进行测定,使用reverse Nova-Pak C18色谱分析柱进行组分分离;流动相由20 mmol/L醋酸铵溶液(A相)和纯乙腈(B相)组成,梯度洗脱;柱温42 ℃。
1.4.5 山梨醇代谢相关酶活性测定
葡萄果实中S6PDH、NAD+-SDH、NADP+-SDH和SOX活性均采用特定酶活性反应试剂盒进行测定。将酶促反应液1 min内氧化1 nmol NADPH记作1个S6PDH酶活力单位,以反应液中1 min内生成1 nmol NADH记为1个NAD+-SDH酶活力单位,以1 min内生成1 nmol NADPH记为1个NADP+-SDH酶活力单位,以1 min内产生1 μg葡萄糖作为1个SOX酶活力单位[12],以上酶活性结果均以U/mg蛋白表示。
1.4.6 可溶性糖和山梨醇含量测定
葡萄果实中可溶性糖含量参考WANG等[18]方法进行提取,略有调整。称取5 g果实冻样,加入20 mL 80%乙醇充分研磨,匀浆液经以8 000×g离心10 min(4 ℃),取上清液于40 ℃下经旋转蒸发去除乙醇,残留物用10 mL蒸馏水溶解后使用特定试剂盒测定可溶性糖和山梨醇含量。根据反应液中4-氨基安替比林偶联酚化合物在波长505 nm处的吸光值测定葡萄糖含量,在480 nm处测定果糖与间苯二酚反应物的吸光值得出果糖含量;由于蔗糖在酸性环境中可水解为果糖,故以果糖和间苯二酚反应物的在480 nm处的吸光值间接测定蔗糖含量;山梨醇含量根据蓝色氢氧化铜反应络合物在波长655 nm处吸光值定量测定[19]。
1.4.7 生物信息学分析
拟南芥(Arabidopsis thaliana)AtWRKY18、烟草(Nicotiana tabacum)NtWRKY4和水稻(Oryza sativa)OsWRKY45等模式植物的转录因子可调控植株可溶性糖积累或应答生物胁迫[20],同时先期也鉴定出桃果实(Prunus persica)PpWRKY40也参与了果实中可溶性糖的积累[21]。为了筛选出葡萄中与糖代谢相关的WRKY转录因子,本研究从在线网站NCBI下载了46条桃(Prunus persica)及47条葡萄(Vitis vinifera)WRKY蛋白序列,使用ClustalW软件对上述蛋白序列进行比对,再以MEGA 5.0软件中的邻接法(Neigbor-joining method)构建系统进化树,自举值(Bootstrap)设置为1 000,使用在线工具iTOL(https://itol.embl.de/)构图。
1.4.8 酵母单杂交(Y1H)实验
参考Matchmaker® gold Y1H体系(Clontech)进行酵母单杂交实验。首先对VvSS1/VvSS2/VvSPS1/VvSPS3基因启动子序列中的CArG box [CC(A/T)6GG]进行筛选,选择W-box及相邻约50 bp核苷酸,设计并合成3个重复序列,经SacI和SalI酶切对应位点后连接到pAbAi载体上并经BbsI线性化。随后将VvSS1-AbAi、VvSS2-AbAi、VvSPS1-AbAi、VvSPS3-AbAi和p53-AbAi转化Y1H Gold酵母感受态细胞,经PCR鉴定阳性单克隆重组酵母菌Y1HGold [VvSS1-AbAi]、Y1HGold [VvSS2-AbAi]、Y1HGold [VvSPS1-AbAi]和Y1HGold [VvSPS3-AbAi]。根据先前方法[12],将pGADT7-VvWRKY40重组质粒和pGADT7质粒转化到新鲜制备的Y1HGold [VvSS1/2-AbAi]或Y1HGold [VvSPS1-AbAi]酵母感受态中,再将酵母重组液涂布于AbA抗性浓度的缺陷培养基SD/-Leu/AbA上(220 μg/L),以Y1HGold [p53-AbAi]+p53及Y1HGold [VvSS1/VvSS2/VvSPS1/VvSPS3-AbAi]+pGADT7为阳性及阴性对照,29 ℃培养3 d后观察酵母生长情况。
1.4.9 双荧光素酶报告(dual-luciferase reporter,DLR)实验
将VvWRKY40的CDS片段引入pGreenII 62-SK载体构建DLR实验的effector(35S∶∶VvWRKY40),并将VvSS1、VvSS2、VvSPS1和VvSPS3基因启动子融合到pGreenII 0800-LUC载体作为reporters(ProVvSS1/VvSS2/VvSPS1/VvSPS3∶∶LUC)(表2)。将验证好的effector和reporters构建体分别转化根瘤农杆菌GV3101,再按1∶100体积比挑取验证好的农杆菌菌落加至含Kan和Rif的YEB液体培养基中,在28 ℃、220 r/min条件下扩大培养至OD600为0.8~1.0,离心(8 000×g、5 min)后收集菌体沉淀。通过MgCl2-吗啉乙磺酸-乙酰丁香酮侵染液重悬菌体沉淀至OD600为0.3,于28 ℃静置避光3 h,随后按reporter∶effector为1∶10的比例混匀后侵染烟草叶背,侵染60 h后使用双荧光素酶试剂盒检测LUC和REN的发光强度。
表2 Y1H和DLR实验所用基因的特异性引物序列
Table 2 Sequences of specific primers used for Y1H and DLR

基因登录号引物名称寡核苷酸引物载体LOC100253480VvWRKY40-SmaI-FVvWRKY40-BamHI-RGGCCAGTGAATTCCACCCGGGATGCCTATGGATAGTTCTAATTGGATGCAGCTCGAGCTCGATGGATCCTCACCATTTTTCAGTTTGATTATGGpGADT7/Y1HLOC100253480VvWRKY40-HindⅢ-FVvWRKY40-BamHI-RGTCGACGGTATCGATAAGCTTATGCCTATGGATAGTTCTAATTGGATGCGCTCTAGAACTAGTGGATCCTCACCATTTTTCAGTTTGATTATGGpGreenII 62-SKLOC100249279VvSS1-HindⅢ-FVvSS1-BamHI-RGTCGACGGTATCGATAAGCTTTTTAATATTTTTTTAAATACTTTAATTTAATTTAATATTCGCTCTAGAACTAGTGGATCCGTCTCCTCTCTGGGTTCTTACCTAATPGreenⅡ0800-LucLOC109123468VvSS2-HindⅢ-FVvSS2-BamHI-RGTCGACGGTATCGATAAGCTTTTAATTTAAATAATATATAAATTA-AATATTTATGATATTATTGCGCTCTAGAACTAGTGGATCCGGCCCACTCTACAACCAACGPGreenⅡ0800-LucLOC100244135VvSPS1-HindⅢ-FVvSPS1-BamHI-RGTCGACGGTATCGATAAGCTTGTTCAAGATACCCTTAATCGGTTGCCGCTCTAGAACTAGTGGATCCTTTTCTAGAGAGAGAATGTGGAAATTGPGreenⅡ0800-LucLOC100262385VvSPS3-HindⅢ-FVvSPS3-BamHI-RGTCGACGGTATCGATAAGCTTAAAAATAAATTATTGAAAAAAAAAATGTTAACGCTCTAGAACTAGTGGATCCTCCGATATCCAAATTCCAAGAAAPGreenⅡ0800-Luc
1.5 数据分析
除发病率和病斑直径以及DLR试验中每个reporter重复测定6次外,其余各项指标均重复测定3次。采用Fisher 最低显著性差异法(LSD)进行显著性检验(显著水平为P=0.05)。
2 结果与分析
2.1 BABA处理和B.cinerea接种对采后葡萄果实灰霉病和品质的影响
如图1所示,葡萄果实在20 ℃贮藏过程中,单一BABA处理显著(P<0.05)抑制了果实病害的发生。果实经病原菌B.cinerea接种后即发生严重灰霉病,而经BABA处理后再接种B.cinerea果实的发病率和病斑直径显著(P<0.05)低于单一病原菌接种组水平,其发病率和病斑直径在贮藏第5天时较单一B.cinerea接种组分别下降了35.19%和28.45%。
在贮藏5 d后,经BABA+B.cinerea接种的葡萄果实中TSS、TA和总酚含量以及DPPH自由基清除率和总还原力均显著(P<0.05)高于单一B.cinerea接种组水平;单一BABA处理也有效维持了葡萄果实中各项品质指标(表3)。这些数据显示BABA处理可有效抑制葡萄果实采后灰霉病的发生并维持果实综合品质。
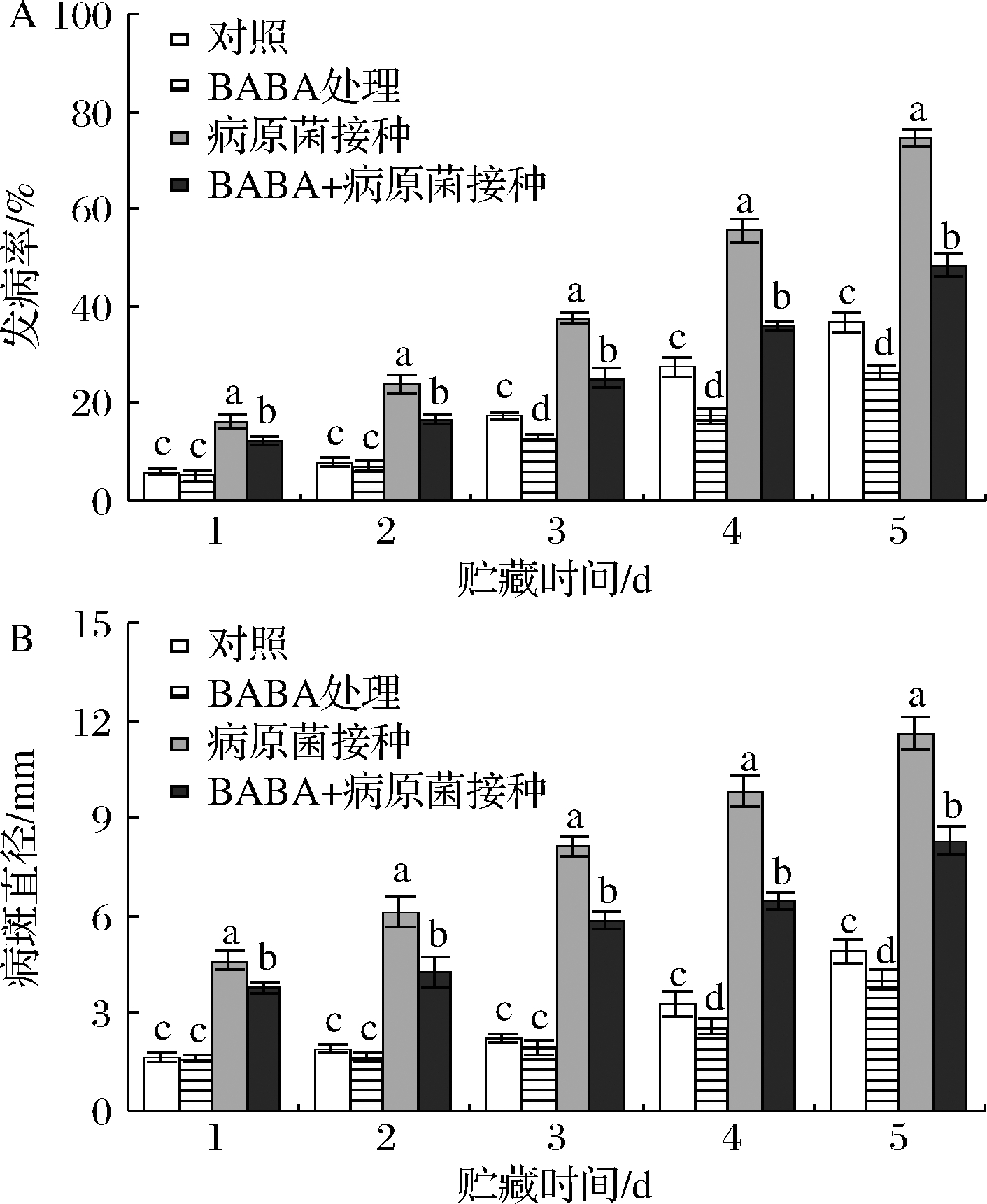
A-发病率;B-病斑直径
图1 BABA处理和B.cinerea接种对采后葡萄果实 发病率和病斑直径的影响
Fig.1 Effects of BABA elicitation and B.cinerea inoculation on disease incidence and lesion diameter in harvested grapes 注:不同小写字母说明各指标数值具有显著差异(P<0.05)(下同)
2.2 BABA处理和B.cinerea接种对葡萄果实PR和WRKY基因表达量的影响
单一BABA处理或接种病原菌B.cinerea均可诱导葡萄果实在贮藏期间抗病相关基因(VvNPR1、VvPR1、VvPR2、VvPR5)和VvWRKY40的表达,经BABA处理再接种B.cinerea的果实中VvNPR1、VvPR1、VvPR2、VvPR5和VvWRKY40等基因表达丰度在整个贮藏期间均保持较高水平,其表达量持续显著(P<0.05)高于单一BABA或B.cinerea处理组水平(图2)。
2.3 BABA处理和B.cinerea接种对葡萄果实植保素含量的影响
如图3所示,对照组葡萄果实中植保素(白藜芦醇及其脱氢二聚体)含量在20 ℃贮藏期间未出现明显变化。单一BABA或B.cinerea接种处理均可诱导葡萄果实中植保素合成,而BABA+B.cinerea接种处理较单一BABA或B.cinerea接种处理组更为显著(P<0.05)诱导了白藜芦醇和白藜芦醇脱氢二聚体的合成,经复合处理的葡萄果实中2种植保素单体含量在整个贮藏期间均维持在最高水平。
表3 BABA处理和B.cinerea接种处理对葡萄果实在20 ℃贮藏5 d后品质的影响
Table 3 Effects of BABA treatment and B.cinerea inoculation on qualities of grapes after the storage at 20 ℃ for 5 days
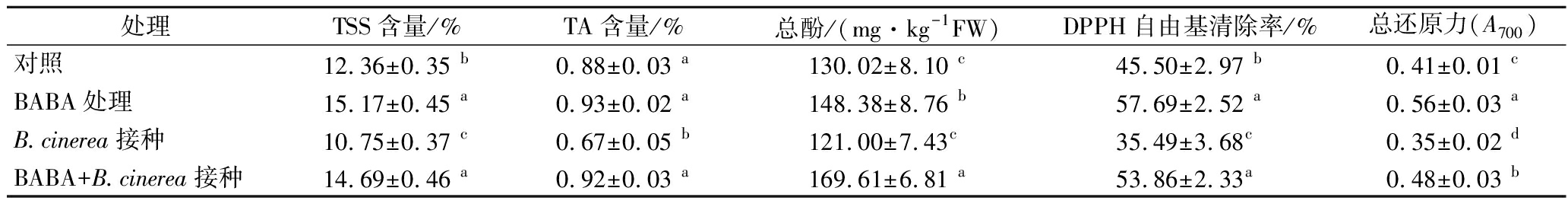
处理TSS含量/%TA含量/%总酚/(mg·kg-1FW)DPPH自由基清除率/%总还原力(A700)对照12.36±0.35 b 0.88±0.03 a130.02±8.10 c45.50±2.97 b0.41±0.01 cBABA处理15.17±0.45 a0.93±0.02 a148.38±8.76 b57.69±2.52 a0.56±0.03 aB.cinerea接种10.75±0.37 c0.67±0.05 b121.00±7.43c35.49±3.68c0.35±0.02 dBABA+B.cinerea接种14.69±0.46 a0.92±0.03 a169.61±6.81 a53.86±2.33a0.48±0.03 b
注:不同小写字母说明各指标数值具有显著差异(P<0.05)(下同)

A-VvNPR1;B-VvPR1;C-VvPR2;D-VvPR5;E-VvWRKY40
图2 BABA处理和B.cinerea接种对葡萄果实中VvNPR1、VvPR1、VvPR2、VvPR5和VvWRKY40基因表达的影响
Fig.2 Effect of BABA elicitation and B.cinerea inoculation on gene expressions of VvNPR1, VvPR1, VvPR2, VvPR5, and VvWRKY40 in harvested grapes

A-白藜芦醇;B-白藜芦醇脱氢二聚体
图3 BABA处理和B.cinerea接种对葡萄果实中 白藜芦醇和白藜芦醇脱氢二聚体含量的影响
Fig.3 Effects of BABA elicitation and B.cinerea inoculation on contents of trans-resveratrol and ε-viniferin in harvested grapes
2.4 BABA处理和B.cinerea接种对采后葡萄果实山梨醇代谢相关酶活性的影响
如图4-A~图4-C所示,对照果实中NAD+-SDH活性随贮藏时间的延长而缓慢下降,而S6PDH和NADP+-SDH活性基本保持稳定。BABA处理或B.cinerea接种均可有效提高NAD+-SDH、S6PDH和NADP+-SDH的活性,但BABA+B.cinerea接种组较单一B.cinerea接种更为显著(P<0.05)的诱导了这3种酶活性的上升。同时,对照果实中SOX活性在整个贮藏期间呈缓慢上升趋势,BABA处理可显著(P<0.05)促进SOX活性上升,BABA复合B.cinerea接种组的SOX活性在整个贮藏过程中则均显著(P<0.05)高于单一BABA处理或仅B.cinerea接种组水平(图4-D)。
2.5 BABA处理和B.cinerea接种对采后葡萄果实可溶性糖以及山梨醇含量的影响
对照葡萄果实中葡萄糖含量随贮藏时间的延长而逐渐上升,而果糖和蔗糖含量则基本保持稳定。与对照果实相比,单一BABA处理可显著促进(P<0.05)3种可溶性糖含量的上升;经BABA+ B.cinerea接种处理果实中可溶性糖含量也显著高于(P<0.05)单一病原菌接种果实(图5-A~图5-C)。同时,在整个贮藏期间,葡萄果实中山梨醇含量逐渐下降,经单一BABA处理或BABA+B.cinerea接种处理果实中山梨醇含量在整个贮藏期间分别显著(P<0.05)低于对照或仅病原菌接种水平(图5-D)。
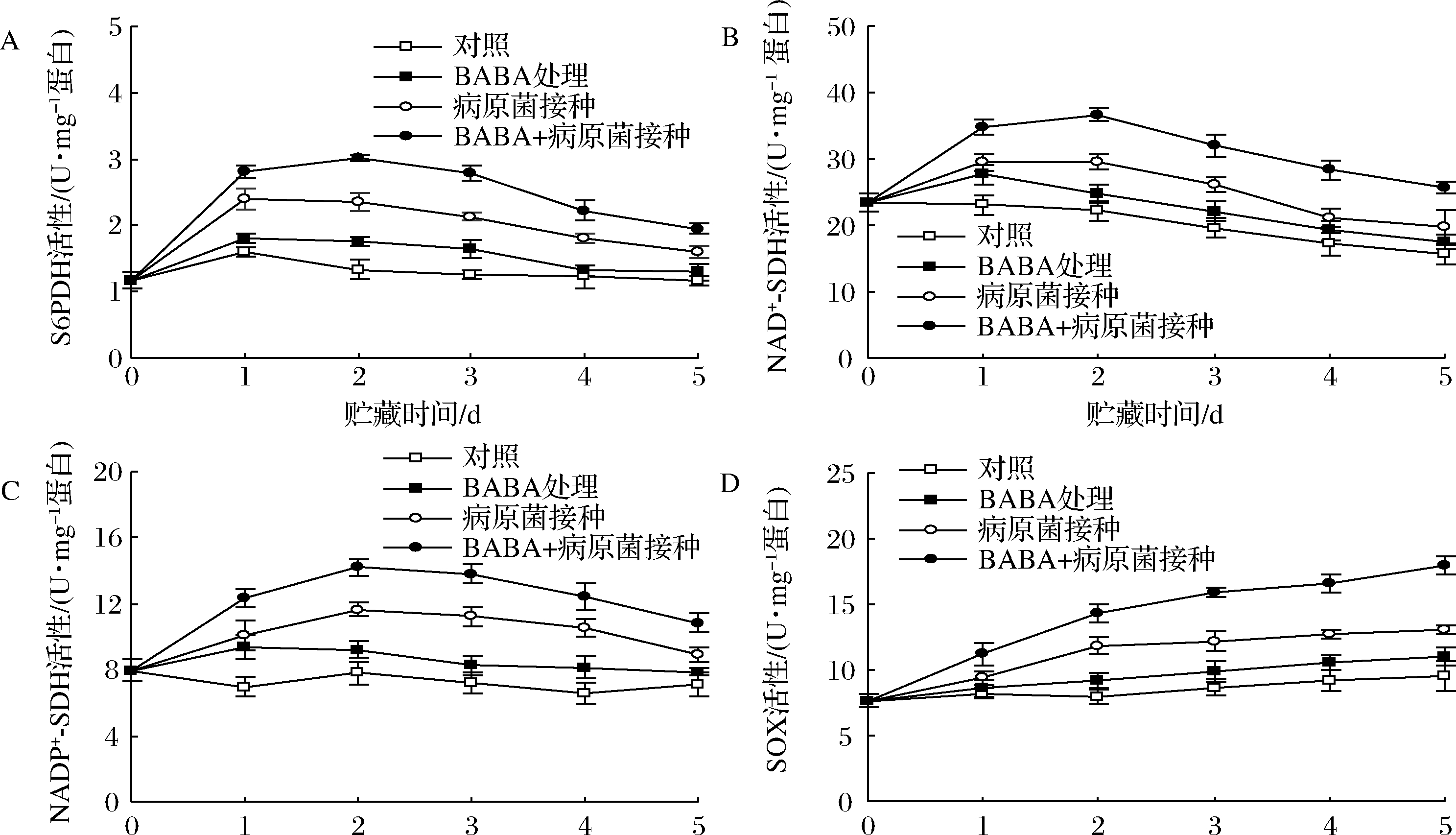
A-S6PDH;B-NAD+-SDH;C-NADP+-SDH;D-SOX
图4 BABA处理和B.cinerea接种对采后葡萄果实S6PDH、NAD+-SDH、NADP+-SDH和SOX活性的影响
Fig.4 Effects of BABA elicitation and B.cinerea inoculation on activities of S6PDH, NAD+-SDH, NADP+ -SDH, and SOX in harvested grapes
2.6 VvWRKYs的生物信息学分析
拟南芥AtWRKY18和桃PpWRKY40基因分别具有直接调控植株或果实中可溶性糖积累的功能。由图6-A进化树聚类结果可知,葡萄VvWRKY40、桃PpWRKY18/40以及拟南芥AtWRKY18则可归为同一亚族。这其中,VvWRKY40与AtWRKY18和PpWRKY40均有一定的亲缘关系,其同源性分别为46.86%和44.31%(图6-B),这暗示VvWRKY40基因在采后葡萄果实品质调控方面发挥重要作用。因此,在VvWRKY基因家族中选择VvWRKY40基因以研究其在葡萄果实可溶性糖积累中的调控作用。

A-葡萄糖;B-果糖;C-蔗糖;D-山梨醇
图5 BABA处理和B.cinerea接种对采后葡萄果实葡萄糖、果糖、蔗糖和山梨醇含量的影响
Fig.5 Effects of BABA elicitation and B.cinerea inoculation on contents of glucose, fructose, sucrose, and sorbitol in harvested grapes

A-WRKY基因家族进化关系和亚组分类;B-WRKY蛋白保守结构域分析
图6 葡萄与模式植物拟南芥和桃WRKY基因家族进化关系和亚组分类以及WRKY蛋白保守结构域分析
Fig.6 Phylogenetic relationship and subgroup classification of WRKY gene family and sequence analysis of the WRKY conserved domains in Vitis vinifera, Arabidopsis thaliana, and Prunus persica
2.7 葡萄VvWRKY40转录因子对糖代谢相关基因调控作用分析
从Y1H实验结果可知,VvWRKY40能直接结合VvSS1/VvSS2/VvSPS3启动子区域的W-box元件,且该结合可诱导酵母AbA抗性基因AUR1-C的表达,从而使共转化pGADT7-VvWRKY40+Y1HGold [VvSS1/VvSS2/VvSPS3-AbAi]的酵母可在含AbA的SD/-Leu平板上出现阳性菌落簇,而转入空pGADT7的酵母及共转化pGADT7-VvWRKY40+Y1HGold [VvSPS1-AbAi]的酵母则无法在含AbA的平板上生长(图7-A)。在DLR实验中,将含有effector 35S∶∶VvWRKY40和reporter ProVvSS1/VvSS2/VvSPS1/VvSPS3∶∶LUC的农杆菌按一定比例混匀后转染烟草叶片,检测到共转染35S∶∶VvWRKY40+ProVvSS1/VvSS2/VvSPS3∶∶LUC的烟草叶片的LUC/REN相对强度极显著高于共转染35S∶∶empty+ProVvSS1/VvSS2/VvSPS3∶∶LUC(对照)的烟叶,然而共转染35S∶∶VvWRKY40+ProVvSPS1∶∶LUC的烟叶的LUC/REN与对照组无统计学差异(图7-B)。

A-酵母单杂;B-双荧光素酶报告实验
图7 酵母单杂及双荧光素酶报告实验鉴定葡萄VvWRKY40蛋白对靶基因VvSS1、VvSS2、VvSPS1和VvSPS3的转录激活作用
Fig.7 The activation capacity of VvWRKY40 to the transcription of targeted genes VvSS1, VvSS2, VvSPS1, and VvSPS3 promoters is identified by Y1H and DLR assays
3 讨论
在展现防卫反应的过程中,植物正常的生命活动被迫调动至逆境响应层面,以满足细胞信号传导以及抗病相关物质和PR蛋白合成等抗逆反应对能量和底物的需要,因此有可能造成植物生长发育、制种率以及品质形成等适应度参数的下降[22]。Priming抗性是植物防卫反应的共通模式,其过程由先期敏化(primed state)和后期抗性表现(priming defence)两阶段组成;即激发子首先诱导植物处于敏化状态,但并不直接激活防卫反应,但当病原菌的侵染时,处于敏化状态的植物则迅速启动强烈的抗病性反应[23]。因此,priming抗性仅在病原菌侵染时得到表达,可避免植物在低病害胁迫时展现抗性而造成的不可逆损耗[24]。先期研究也证实,茉莉酸甲酯(methyl jasmonate,MeJA)[17]和BTH[18]诱导葡萄果实中的priming反应在激活抗病性的同时,也促进了果实中可溶性糖的积累并提高了抗氧化活性,因此在抗性反应和品质维持方面显示了良好的平衡性。BABA作为近年来被广泛研究的抗性激发子,已被证实可显著诱导多种模式植物或采后果实的priming抗性,从而赋予宿主在病原菌侵染时快速启动防卫反应的能力[25]。在本研究中,10 mmol/L BABA处理可诱导葡萄果实典型的priming抗性,即经BABA+B.cinerea接种处理的葡萄果实中PRs基因表达量和植保素含量显著高于单一BABA处理或B.cinerea接种果实,暗示经BABA处理的果实在遭受病原真菌侵染时才可表达强烈抗病性(图1~图3)。先期结果同样表明,低浓度的外源BABA处理(10~50 mmol/L)也可以诱导采后水蜜桃[7]和草莓[9]果实的priming抗性,从而有效抑制了采后草莓灰霉病和桃软腐病的发生。同时,由于PR1基因是由水杨酸介导的植物SAR反应中的重要标记基因,而病程相关非表达激发子(NPR1)则是SAR途径中感知SA传导并启动下游PR基因合成的关键调控蛋白[26]。本研究中BABA处理可诱导葡萄果实中VvNPR1和VvPR1基因的表达,显示BABA诱导的priming反应在抗性机制上是由SA介导的SAR反应。相类似的,BABA异构体γ-氨基丁酸(γ-aminobutyric acid,GABA)作为一种高渗透性小分子,同样具有诱导梨果实priming抗性的作用;并可通过谷氨酸脱羧或多胺降解途径大量合成,调节组织内多胺组成和脯氨酸含量,从而提高果实抗冷性[27]。
从品质角度来说,可溶性单糖或寡糖组成和含量是果实风味的决定性因素,同时也是合成色素、氨基酸、维生素和芳香物质等其他功能性物质的底物;在果实糖代谢网络中,6-磷酸葡萄糖(G6P)可在S6PDH的作用下被还原成6-磷酸山梨醇(S6P),S6P迅速降解成山梨醇,山梨醇则在NADP+-SDH和SOX的共同催化下生成葡萄糖或在NAD+-SDH的催化下生成果糖[28];同时,果糖可直接与尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG)在蔗糖合酶(sucrose synthase,SS)的催化下或以6-磷酸果糖(fructose-6-phosphate,F6P)的形式与UDPG在蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)的催化下合成蔗糖[18]。因此,山梨醇是果实糖代谢网络的中间节点,而S6PDH、NADP+-SDH、SOX和NAD+-SDH等山梨醇代谢酶类以及SS和SPS等蔗糖合成酶类是该网络中的关键调控酶类。另一方面,转录水平调控是植物各项代谢进程中的重要步骤,其通过靶基因上游的顺式调控元件来激活一系列功能性基因的表达[29]。WRKY转录因子是主要的植物转录因子家族,其蛋白结构在N端含有WRKYGQK保守序列且C端为锌指结构,能与靶基因启动子区域的W-box元件[(T)(T)TGAC(C/T)]特异结合从而调控靶基因的转录[20]。火龙果HpWRKY3被证实可直接结合蔗糖合成关键基因HpSuSy1和HpINV2中的W-box元件,从而提高HpSuSy1和HpINV2基因的表达并最终提高果实可溶性糖含量[30]。在本研究中,单一BABA或BABA+B.cinerea接种处理均可显著诱导葡萄果实山梨醇合成相关酶S6PDH以及转化相关酶NAD+-SDH、NADP+-SDH和SOX活性的上升,同时伴随着果实山梨醇含量的降低以及单糖(果糖和葡萄糖)含量的上升,这表明BABA处理可促使采后葡萄果实中山梨醇加速转化为葡萄糖和果糖(图4和图5-A~图5-C);同时,BABA处理也可以激活葡萄转录因子VvWRKY40基因的表达,而VvWRKY40能靶向蔗糖合成相关基因VvSS1/VvSS2/VvSPS3启动子区域的W-box元件并激活这3个基因的转录表达,从而促使葡萄果实中部分游离单糖在SS和SPS的催化下合成蔗糖(图6和图7)。此外,BABA处理也维持葡萄果实综合品质和抗氧化活性(表3)。因此,BABA可通过调控山梨醇代谢并提高VvWRKY40基因的表达丰度从而全面促进采后葡萄果实中可溶性糖含量的上升,最终维持果实风味和品质。
4 结论
(1)10 mmol/L BABA可诱导采后葡萄果实priming反应,从而在果实遭受病原菌B.cinerea侵染时快速启动SAR抗性。
(2)10 mmol/L BABA处理可通过提高采后葡萄果实山梨醇代谢酶类的活性从而将促使山梨醇转变为葡萄糖和果糖,并提升VvWRKY40基因表达水平从而激活蔗糖合成相关基因VvSS1/VvSS2/VvSPS3的转录,最终促进可溶性糖的积累。
(3)BABA诱导的采后葡萄果实priming反应在提高果实抗病性的同时亦可改善果实可溶性糖积累和综合品质,因此priming抗性反应在抗病性表达和品质维持两方面具有良好的平衡性。
[1] GUTIÉRREZ-GAMBOA G, ZHENG W, MART NEZ DE TODA F.Current viticultural techniques to mitigate the effects of global warming on grape and wine quality:A comprehensive review[J].Food Research International, 2021, 139:109946.
NEZ DE TODA F.Current viticultural techniques to mitigate the effects of global warming on grape and wine quality:A comprehensive review[J].Food Research International, 2021, 139:109946.
[2] YASSIN M, TON J, ROLFE S A, et al.The rise, fall and resurrection of chemical-induced resistance agents[J].Pest Management Science, 2021, 77(9):3 900-3 909.
[3] ROMANAZZI G, SANZANI S M, Bi Y, et al.Induced resistance to control postharvest decay of fruit and vegetables[J].Postharvest Biology and Technology, 2016, 122:82-94.
[4] LAZZARATO L, TREBBI G, PAGNUCCO C, et al.Exogenous spermidine, arsenic and β-aminobutyric acid modulate tobacco resistance to tobacco mosaic virus, and affect local and systemic glucosylsalicylic acid levels and arginine decarboxylase gene expression in tobacco leaves[J].Journal of Plant Physiology, 2009, 166(1):90-100.
[5] LUNA E, VAN HULTEN M, ZHANG Y H, et al.Plant perception of β-aminobutyric acid is mediated by an aspartyl-tRNA synthetase[J].Nature Chemical Biology, 2014, 10(6):450-456.
[6] AVRAMOVA Z.Defence-related priming and responses to recurring drought:Two manifestations of plant transcriptional memory mediated by the ABA and JA signalling pathways[J].Plant, Cell and Environment, 2019, 42(3):983-997.
[7] LI C H, WANG K T, HUANG Y X, et al.Activation of the BABA-induced priming defence through redox homeostasis and the modules of TGA1 and MAPKK5 in postharvest peach fruit[J].Molecular Plant Pathology, 2021, 22(12):1 624-1 640.
[8] 汪开拓, 廖云霞, 袁坤明, 等.β-氨基丁酸处理对桃果实采后灰霉病的影响及其诱导抗病模式研究[J].食品与发酵工业, 2016, 42(2):65-71.
WANG K T, LIAO Y X, YUAN K M, et al.Investigation on the effects of β-aminobutyric acid treatment on gray mold decay in harvested peaches and the mode of the induced disease resistance[J].Food and Fermentation Industries, 2016, 42(2):65-71.
[9] WANG K T, LIAO Y X, XIONG Q, et al.Induction of direct or priming resistance against Botrytis cinerea in strawberries by β-aminobutyric acid and their effects on sucrose metabolism[J].Journal of Agricultural and Food Chemistry, 2016, 64(29):5 855-5 865.
[10] YAMAKI S.Metabolism and accumulation of sugars translocated to fruit and their regulation[J].Journal of the Japanese Society for Horticultural Science, 2010, 79(1):1-15.
[11] WANG K, SHAO X F, GONG Y F, et al.The metabolism of soluble carbohydrates related to chilling injury in peach fruit exposed to cold stress[J].Postharvest Biology and Technology, 2013, 86:53-61.
[12] DESNOUES E, GIBON Y, BALDAZZI V, et al.Profiling sugar metabolism during fruit development in a peach progeny with different fructose-to-glucose ratios[J].BMC Plant Biology, 2014, 14:336.
[13] MENG D, LI C L, PARK H J, et al.Sorbitol modulates resistance to Alternaria alternata by regulating the expression of an NLR resistance gene in apple[J].The Plant Cell, 2018, 30(7):1 562-1 581.
[14] WANG K T, WU D Z, GUO D Q, et al.β-aminobutyric acid induces disease resistance against Botrytis cinerea in grape berries by a cellular priming mechanism[J].Acta Alimentaria, 2019, 48(2):177-186.
[15] SLINKARD K, SINGLETON V.Total phenol analysis:Automation and comparison with manual methods[J].American Journal of Enology and Viticulture, 1977, 28(1):49-55.
[16] SHE G M, XU C, LIU B, et al.Polyphenolic acids from mint (the aerial of Mentha haplocalyx Briq.) with DPPH radical scavenging activity[J].Journal of Food Science, 2010, 75(4):C359-C362.
[17] WANG K T, LIAO Y X, KAN J Q, et al.Response of direct or priming defense against Botrytis cinerea to methyl jasmonate treatment at different concentrations in grape berries[J].International Journal of Food Microbiology, 2015, 194:32-39.
[18] WANG K T, LIAO Y X, CAO S F, et al.Effects of benzothiadiazole on disease resistance and soluble sugar accumulation in grape berries and its possible cellular mechanisms involved[J].Postharvest Biology and Technology, 2015, 102:51-60.
[19] MORIGUCHI T, SANADA T, YAMAKI S.Seasonal fluctuations of some enzymes relating to sucrose and sorbitol metabolism in peach fruit[J].Journal of the American Society for Horticultural Science, 1990, 115(2):278-281.
[20] CHEN F, HU Y, VANNOZZI A, et al.The WRKY transcription factor family in model plants and crops[J].Critical Reviews in Plant Sciences, 2017, 36(5-6):311-335.
[21] LI C H, WANG K T, XU F, et al.Sucrose metabolism and sensory evaluation in peach as influenced by β-aminobutyric acid (BABA)-induced disease resistance and the transcriptional mechanism involved[J].Postharvest Biology and Technology, 2021, 174:111465.
[22] VOS I A, PIETERSE C M J, VAN WEES S C M.Costs and benefits of hormone-regulated plant defences[J].Plant Pathology, 2013: 62, 43-55.
[23] CONRATH U, BECKERS G J M, LANGENBACH C J G, et al.Priming for enhanced defense[J].Annual Review of Phytopathology, 2015, 53:97-119.
[24] MARTINEZ-MEDINA A, FLORS V, HEIL M, et al.Recognizing plant defense priming[J].Trends in Plant Science, 2016, 21(10):818-822.
[25] BACCELLI I, MAUCH-MANI B.Beta-aminobutyric acid priming of plant defense:The role of ABA and other hormones[J].Plant Molecular Biology, 2016, 91(6):703-711.
[26] ZAVALIEV R, MOHAN R, CHEN T Y, et al.Formation of NPR1 condensates promotes cell survival during the plant immune response[J].Cell, 2020, 182(5):1 093-1 108.
[27] SEIFIKALHOR M, ALINIAEIFARD S, HASSANI B, et al.Diverse role of γ-aminobutyric acid in dynamic plant cell responses[J].Plant Cell Reports, 2019, 38(8):847-867.
[28] LIU D F, NI J B, WU R Y, et al.High temperature alters sorbitol metabolism in Pyrus pyrifolia leaves and fruit flesh during late stages of fruit enlargement[J].Journal of the American Society for Horticultural Science, 2013, 138(6):443-451.
[29] NG D, ABEYSINGHE J, KAMALI M.Regulating the regulators:The control of transcription factors in plant defense signaling[J].International Journal of Molecular Sciences, 2018, 19(12):3 737.
[30] WEI W, CHENG M N, BA L J, et al.Pitaya HpWRKY3 is associated with fruit sugar accumulation by transcriptionally modulating sucrose metabolic genes HpINV2 and HpSuSy1[J].International Journal of Molecular Sciences, 2019, 20(8):1 890.