豆芽,也称芽苗菜,因其价格低廉、营养丰富,深受广大消费者喜爱[1-2],但是,近些年来,一些豆芽商贩为了牟取最大利润,在豆芽的生产过程中,违规添加植物生长调节剂、杀菌剂、抗生素等药物,以达到提升外观品相,延长保鲜时间,缩短生产周期,降低生产成本,增加产品产量等目的。已有相关报道指出,使用的植物生长调节剂主要有4-氯苯氧乙酸、6-苄基腺嘌呤、赤霉素等[3-5],抗生素主要有恩诺沙星、青霉素、土霉素、甲硝唑等[6-8],杀菌剂主要有福美双、百菌清、甲基硫菌灵、多菌灵、腐霉利、咪鲜胺等[9-11]。长期食用这些含有药物残留的豆芽会对人体健康带来风险,导致人体内分泌紊乱,影响肌体代谢平衡等[12-13]。因此,开展豆芽中各类添加药物的筛查,对于保证豆芽类蔬菜食用安全、促进豆芽产业健康发展都具有十分重要的意义。
目前,已发布的关于豆芽中药物残留的检测方法,主要集中在单个或者某一类别化合物的检测,覆盖面窄,而多类别药物的同时测定报道较少。刘春生等[14]建立了UPLC-MS/MS法测定豆芽中咪鲜胺、头孢氨苄、诺氟沙星、6-苄基腺嘌呤、赤霉素、2,4-二氧苯氧乙酸和4-氯苯氧乙酸残留的检测方法;程盛华等[15]建立了一种同时分析豆芽中10种植物生长调节剂和杀菌剂的分散固相萃取-UPLC-MS/MS的检测方法;孙晓冬等[16]使用UPLC-MS/MS结合快速高通量的前处理方法实现豆芽中51种抗生素类药物的快速筛查测定;黄燕红等[17]基于通过型固相萃取净化方法,建立UPLC-MS/MS法快速筛查豆芽中30种植物生长调节剂和喹诺酮类药物残留的方法;颜伟华等[18]建立了UPLC-MS/MS快速筛查豆芽中27种植物生长调节剂和抗生素类药物的方法。以上这些方法已不局限于单一类别药物的检测,但仍存在检测类别较少,覆盖面窄问题,不利于实现大批量样品中多组分药物的同时快速测定。因此,建立一种快速准确、灵敏可靠,可同时测定豆芽中植物生长调节剂、杀菌剂和抗生素等多类别药物的方法具有重要的实际应用价值。
本研究拟结合分散固相萃取(dispersive-solid-phase extraction,d-SPE)技术,建立超高效液相色谱-串联质谱法同时检测豆芽中磺胺类、杀菌剂类、四环素类、植物生长调节剂类、β-内酰胺类、氯霉素类、硝基咪唑类、大环内酯类、喹诺酮类9类共96种药物残留的方法,拓展了现有方法的检测范围,以期准确地评估豆芽中药物残留种类和含量水平,为豆芽中药物残留的风险监测提供技术参考。
1 材料与方法
1.1 材料与试剂
乙腈、甲醇、甲酸均为色谱纯,美国Sulpeco公司;甲酸、乙酸、乙腈、无水硫酸钠均为分析纯,天津市科密欧化学试剂有限公司;乙酸铵为优级纯、十八烷基硅烷(C18,粒度40~63 μm)吸附剂,上海安谱实验科技股份有限公司;陶瓷均质子,迪马科技有限公司;各药物标准品(纯度≥95%,100 μg/mL),天津阿尔塔科技有限公司。
萃取盐包(4 g Na2SO4、1 g NaCl),美国Agilent公司;萃取盐包(4 g MgSO4、1 g NaOAC),上海安谱实验科技股份有限公司;萃取盐包(4 g MgSO4、1 g NaCl、1 g柠檬酸钠、0.5 g柠檬酸氢二钠),美国Thermo Fisher公司;萃取盐包(6 g MgSO4、1.5 g NaOAC),月旭科技(上海)股份有限公司。
1.2 仪器与设备
Agilent1 290-6470超高效液相色谱仪-三重四级杆串联质谱仪,美国Agilent公司;L-500型高速离心机,长沙湘仪离心机仪器有限公司;N-EVAP 12型氮吹仪,美国Organomation公司;TG-16型高速离心机,四川蜀科仪器有限公司;B100250型多管旋涡混合器,浙江月旭材料科技有限公司;Milli-Q Intergra115实验室超纯水制备系统,美国Millipore公司。
1.3 实验方法
1.3.1 标准溶液的配制
准确移取磺胺类(A组)、杀菌剂类(B组)、植物生长调节剂类(D组)、氯霉素类(F组)、硝基咪唑类(G组)、大环内酯类(H组)和喹诺酮类(I组),分别用甲醇配制成10 μg/mL的标准储备液,-18 ℃下保存,有效期3个月;以V(乙腈)∶V(水)=1∶1为溶剂,分别将四环素类(C组)和β-内酰胺类(E组)药物配制成50 μg/mL的标准储备液,于-18 ℃下保存,有效期1个月。将各组标准储备液用V(乙腈)∶V(水)=1∶1溶液,稀释成所需浓度的混合标准中间溶液,临用前现配。
1.3.2 样品前处理
准确称取10 g(精确至0.01 g)均质后的样品于50 mL具塞离心管中,加入1颗陶瓷均质子和10 mL 1%甲酸乙腈溶液,2 500 r/min涡旋提取5 min,加入萃取盐包(4 g Na2SO4、1 g NaCl),立即涡旋混合1 min,静置10 min,以4 000 r/min离心5 min,使乙腈和水相分层。取5 mL乙腈层置于净化管(内含900 mg Na2SO4、150 mg C18)中,涡旋混合1 min,以4 000 r/min离心5 min,准确吸取2 mL上清液于15 mL离心管中,于45 ℃水浴中氮吹至近干,用V(乙腈)∶V(水)=1∶1溶剂定容至1 mL,涡旋30 s,然后转移至2 mL离心管中,以16 000 r/min离心2 min,移取上清液至样品瓶中,待仪器分析。
1.3.3 基质混合标准溶液的配制
实际样品检测时,选取阴性样品,按照1.3.2操作至“准确吸取2 mL上清液于15 mL离心管中”后,分别加入不同体积的混合标准中间溶液,依需要配制成适当浓度的基质混合标准工作溶液,然后按照1.3.2操作至“待仪器分析”。基质混合标准溶液应临用前新制。
1.3.4 色谱条件
色谱柱:Agilent Eclipse plus C18,2.1 mm×150 mm,2.7 μm;柱温:40 ℃;流速:0.3 mL/min;进样量:5 μL;流动相:A为5 mmol/L乙酸铵溶液(含0.1%体积分数甲酸),B为乙腈;梯度洗脱程序:0~0.5 min (5% B),0.5~2.0 min(5%~15% B),2.0~3.5 min(15%~20% B),3.5~6.0 min(20%~25% B),6.0~7.0 min(25%~30% B),7.0~11.0 min(30%~35% B),11.0~15.0 min(35%~95% B),15.0~21.0 min(95% B),21.0~21.5 min(95%~5% B),21.5~25.0 min(5% B)。
1.3.5 质谱条件
电喷雾离子源(electrospray ionization,ESI),动态多反应监测(dynamic multiple reaction monitoring,DMRM),正(负)离子同时扫描,干燥气、鞘气均为氮气,干燥气温度300 ℃,干燥气流速6 L/min,鞘气温度300 ℃,鞘气流速10 L/min,毛细管电压为4 000(+)和2 500(-),雾化器压力40 psi,喷嘴电压600 V,Delta EMV值为400(+)和800(-)。
1.4 数据统计及图表绘制
采用仪器配备的MassHunter workstation Software软件,进行数据采集,定性分析以及确定目标物的定量分析,导出的数据利用Origin 2021和Office excel 2019进行图表的绘制。
2 结果与分析
2.1 质谱条件的选择
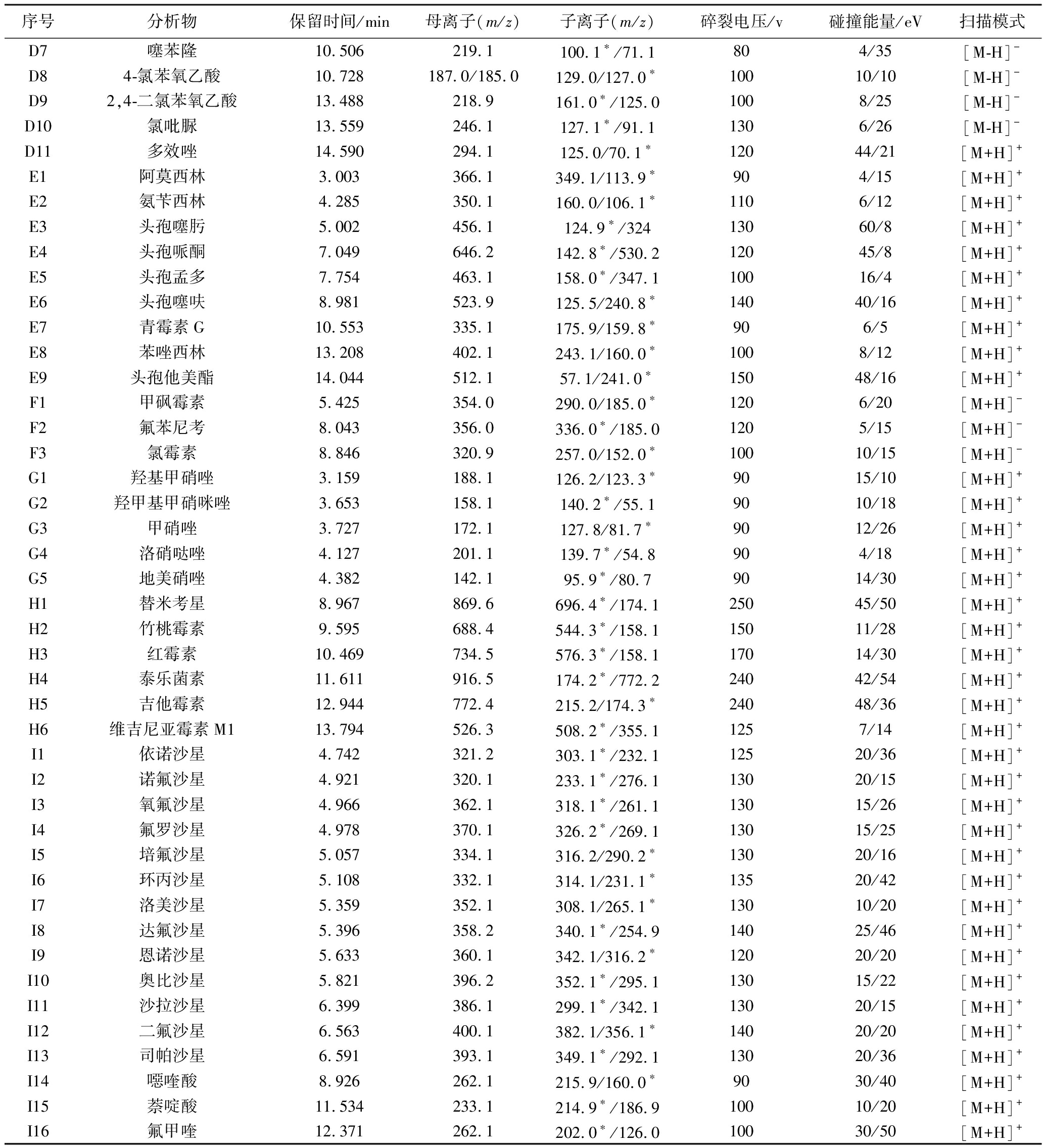
分别将各分析物配制成500 ng/mL质量浓度的混合标准溶液,在电喷雾离子源下,做正离子和负离子一级扫描分析,母离子均为[M+H]+或[M-H]-加合形式,其中6-苄基腺嘌呤、氯吡脲、噻苯隆、异戊烯腺嘌呤、吲哚乙酸、吲哚丁酸可同时生成[M+H]+和[M-H]-加合离子,根据化合物的性质和本研究流动相体系下的响应强度,采用负离子模式检测6-苄 基腺嘌呤、氯吡脲、噻苯隆、异戊烯腺嘌呤,采用正离子模式检测吲哚乙酸、吲哚丁酸;确定各分析物的母离子后,优化碎裂电压使母离子获得最佳响应,通过子离子扫描获得每个母离子的特异碎片离子,并优化碰撞能量,选择两个干扰较小、响应较高的碎片离子作为特征离子,用于定性和定量分析,各分析物的质谱优化参数见附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.032728),其中4-氯苯氧乙酸在负离子模式下,母离子为185.0,只获得了127.1碎片离子,未达到欧盟2002/657/EC决议中质谱检测必须不少于4个识别点的要求,4-氯苯氧乙酸有1个氯原子,氯元素存在35Cl与37Cl同位素,因此采用氯的同位素离子对187.0/129.0作为另一个定性离子对,可满足定性确证的要求;由于同时测定的化合物较多,为了保证每个色谱峰都能获得足够的数据点,采用DMRM模式进行扫描,与多反应监测(multiple reaction monitoring,MRM)相比较,显著改善了复杂样品的负载循环时间,提高了灵敏度和选择性。
2.2 色谱条件的优化
各目标化合物种类较多,性质差别较大,同时对96种化合物进行检测分析,这对色谱条件的选择有更高的要求。由于质谱分析采取正负离子模式同时扫描,在确定流动相体系时,既要关注各化合物在流动相条件下的峰形,也要兼顾正负离子电离化合物的响应情况。考虑到各化合物均溶于乙腈或乙腈水溶液,同时乙腈作为前处理提取溶剂,更具有兼容性,因此,选择使用乙腈作为有机相;考察水、0.1%甲酸水、5 mmol/L乙酸铵溶液、5 mmol/L乙酸铵溶液(含0.1%甲酸)作为水相,与乙腈搭配,对各化合物的分离效果。结果表明,以乙腈-水为流动相体系时,正离子化合物响应最低,峰形较差,乙腈-0.1%甲酸水体系提高了正离子化合物的离子化效率,响应明显提高,但抑制了负离子化合物的响应,乙腈-5 mmol/L乙酸铵流动相体系,促进了各化合物的保留,改善了峰形,对负离子化合物有较好的响应,但对部分正离子化合物离子响应没有明显的提升,采用乙腈-5 mmol/L 乙酸铵(含0.1%甲酸水)作为流动相体系,各化合物有良好的峰形,离子化效率较高,正负离子电离化合物都能够保证有足够的响应,可以满足定性定量的需要。本研究中的各化合物主要为弱极性或中等极性药物,可选择反相色谱柱进行分离,实验选择了Agilent Eclipse plus C18色谱柱为研究对象,主要考察了3种不同规格的Eclipse plus C18色谱柱(内径均为2.1 mm,粒径均为2.7 μm),柱长分别为50、100、150 mm,结果表明,Eclipse plus C18色谱柱可承受较高压力,各化合物峰形优异,柱长为150 mm的色谱柱对磺胺间甲氧嘧啶(A12)、磺胺对甲氧嘧啶(A13)、磺胺甲氧哒嗪(A14)3种同分异构体分离效果较好,图1为96种化合物在100 ng/mL质量浓度下的MRM图和总离子流图。
2.3 样品前处理条件选择与优化
2.3.1 提取溶剂的选择
本实验中涉及的药物种类较多,各类化合物的性质有一定的差异,乙腈作为d-SPE法中应用较多的提取溶剂,适合提取的化合物极性范围较广,对本实验中所测的大部分药物也有很好的溶解性,因此选取乙腈作为本研究的样品提取溶剂。根据文献报道[19-20],在加入乙腈提取前,先用水对样品进行分散,以及在乙腈中添加适量甲酸,可有效增加提取效率,本实验的研究对象为豆芽类蔬菜,含水率普遍大于90%[21],水量越多,对后续盐析和除水造成更大的困难,因此,本研究主要考察添加甲酸对各类化合物的提取效果。实验比较了在空白样品中添加50 μg/kg质量浓度水平下,4种提取剂:乙腈、0.2%甲酸乙腈、1%甲酸乙腈、2%甲酸乙腈,对提取效率的影响。结果如图2所示,四环素类、β-内酰胺类、喹诺酮类受提取溶剂的酸性影响较大,而其余类化合物在不同酸度的乙腈中提取平均回收率均在80%以上,无显著差异,四环素类、喹诺酮类化合物会与样品中的多价阳离子发生螯合,导致萃取效率较低,随着萃取溶剂酸度的增加,可大幅减少样品基质中金属离子与分析物的螯合,提高了这两类化合物的回收率,但对于β-内酰胺类药物,在酸性条件下不稳定易分解[22-23],提取效率随着酸度的增加而降低,因此,为了兼顾各类化合物的回收率,最终选择1%甲酸乙腈作为提取溶剂。
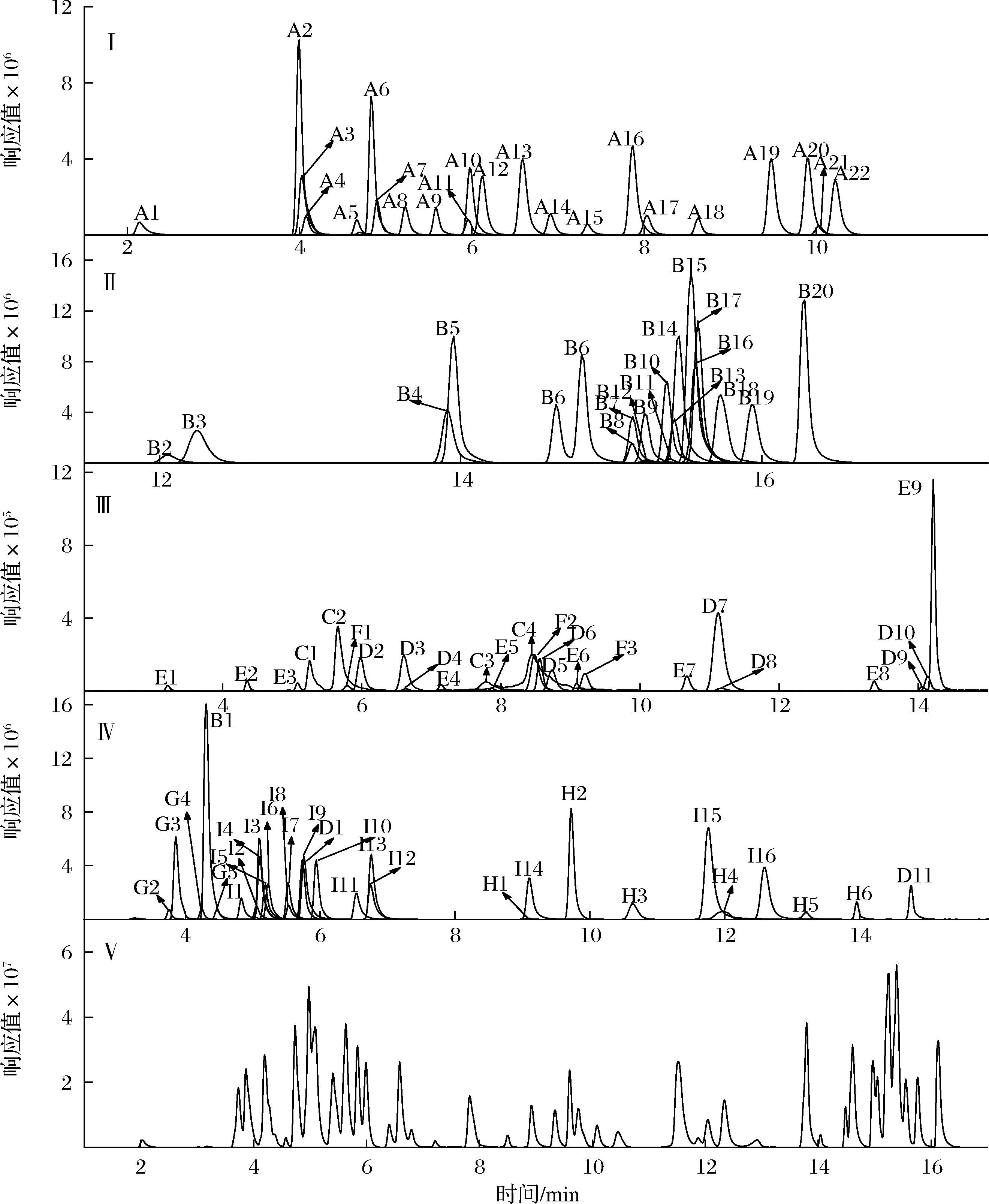
Ⅰ~Ⅳ-各化合物的MRM图,各化合物的标示序号与附表1一致;Ⅴ-各化合物的总离子流图
图1 96种化合物的MRM色谱图和总离子流图
Fig.1 Total ion chromatograms and MRM chromatograms of 96 compounds

图2 不同提取溶剂下的回收率(n=3)
Fig.2 Recoveries of various compounds with different extraction solvents(n=3)
2.3.2 分散固相萃取条件的优化
涉及到多类别药物残留的同时测定,d-SPE是较为理想的样品前处理方法,d-SPE法中用于除水和盐析的材料主要有无水硫酸镁、乙酸钠、无水硫酸钠、氯化钠、柠檬酸钠、柠檬酸氢二钠等,用于除去提取溶剂中共提干扰物的材料主要有十八烷基键合硅胶、乙二胺-N-丙基硅烷化硅胶、石墨化炭黑、NH2(键合氨丙基)、EMR(增强型脂质去除)、Z-sep(氧化锆涂层的二氧化硅)等。本实验考察了4种市售常见的萃取盐包对各类药物的提取效率,分别为:4 g无水硫酸钠+1 g氯化钠(兽药QuEChERS法)、4 g无水硫酸镁+1 g乙酸钠(BJS 201703)、4 g无水硫酸镁+1 g氯化钠+1 g柠檬酸钠+0.5 g柠檬酸氢二钠(GB 23200.113—2018)、4 g无水硫酸镁+1 g氯化钠(传统QuEChERS法),结果表明,使用4 g无水硫酸钠+1 g氯化钠组合,对1%甲酸乙腈的提取溶液进行盐析,各类化合物均能达到较好的回收率,其余3种组合对四环素类和部分β-内酰胺类药物回收率有较大的影响,可能是由于盐包中Mg2+与四环素类化合物形成配合物,以及无水硫酸镁除水时产生较高的热量。在净化材料的选择上,考虑到豆芽中不含有较多的色素,干扰不明显,不使用GCB作为净化材料,此外,根据已发表的文献[24-25],使用PSA净化时,对四环素类和大部分的植物生长调节剂有吸附作用,因此,本研究选择使用C18吸附剂作为净化材料,并在实验中比较了50 μg/kg添加水平下不同用量(50、100、150、200 mg)C18吸附剂的净化效果,结果表明,150 mg的C18用量可以使各类化合物均获得良好的回收效果,不会产生明显的吸附,如图3所示。

A-磺胺类;B-杀菌剂类;C-四环素类;D-生长调节剂类;E-β-内酰 胺类;F-氯霉素类;G-硝基咪唑类;H-大环内酯类;I-喹诺酮类
图3 C18吸附剂用量对回收率的影响(n=3)
Fig.3 The amount of C18 adsorbent dosage on recovery(n=3)
2.4 基质效应计算
本研究采用在空白基质提取液和纯溶剂中添加标液的方式评价基质效应(matrix effect,ME),计算如公式(1)所示:
(1)
式中:A和B分别为目标物在空白基质中和纯溶剂中的仪器响应值。
结果为正值表示基质增强效应,负值表示基质抑制效应,绝对值越大则代表受基质效应影响越明显。实验选取阴性黄豆芽为样品空白基质,在50 ng/mL的质量浓度水平下,计算各化合物的ME值,如附表2(https://doi.org/10.13995/j.cnki.11-1802/ts.032728)所示,56种化合物ME值在±20%内,基质效应不明显,属于弱基质效应;28种化合物ME值小于-20%,表现为基质抑制效应;12种化合物ME值大于20%,表现为基质增强效应。因此,为了最大程度降低由基质效应引起的定量分析偏差,本研究使用基质匹配的外标法进行校准。
2.5 方法的线性范围、检出限、回收率和精密度
以不含待测组分的阴性黄豆芽为空白样品,按照1.3.2前处理方法得到的空白基质液,依据各个化合物的响应情况,分别配制不同线性范围的基质匹配标准曲线,其中四环素类、β-内酰胺类和福美双的线性范围为20~2 000 ng/mL,其他各类化合物的线性范围为5~500 ng/mL,以各化合物的定量离子峰面积为纵坐标,对应组分的质量浓度(ng/mL)为横坐标绘制标准曲线。各目标物在相应的浓度范围内线性关系良好,相关系数(R2)均大于0.990。采用空白样品添加的方式,以各化合物定量离子色谱峰的信噪比(S/N)=3计算方法检出限,96种化合物的方法定量限在5~50 μg/kg,与目前已发布标准方法的指标如SN/T 3725—2013、BJS 201703、BJS 201909、GB 23200.110—2018相比,本方法定量限与其水平相当,满足实验需求。
为了验证方法的准确性,分别在阴性黄豆芽样品中添加96种化合物的标准溶液制成阳性样品,添加水平分别为10、50、200 μg/kg,每个添加水平做6平行实验,计算各个化合物的平均加标回收率和平均相对标准偏差。结果显示,各化合物在3个添加水平下平均加标回收率分别为75.8%~117.7%、64.3%~114.5%和64.3%~114.4%,平均相对标准偏差分别为2.3%~12.9%、1.2%~14.1%和2.4%~17.5%,表明本研究建立的方法准确度和精密度均满足GB/T 27404—2008检测方法确认的技术要求。各化合物的线性范围、相关系数、定量限、平均加标回收率和平均相对标准偏差详见附表2。
2.6 实际样品的测定
应用本方法对实验室收集和市场上自行购买的豆芽样品进行了筛查分析,共计102批次,检出33批次阳性样品,有8种药物检出,样品的测定结果见表1。依据农业农村部公告第250号、国家食品药品监督管理总局农业部国家卫生和计划生育委员会关于豆芽生产过程中禁止使用6-苄基腺嘌呤等物质的公告(2015年第11号)以及兽药注册使用范围不包含豆芽的规定要求,有4种禁止使用的药物检出,主要为恩诺沙星、诺氟沙星、6-苄基腺嘌呤、4-氯苯氧乙酸;此外,豆芽中还检出了多种植物生长调节剂,主要是2,4-二氯苯氧乙酸、吲哚乙酸、多效唑和氯吡脲,其中2,4-二氯苯氧乙酸、多效唑、氯吡脲在GB 2763—2021中有限量规定,但未对豆芽制定限量要求。
表1 实际样品的测定结果(n=2)
Table 1 Results of detection of actual samples(n=2)

检测项目含量范围/(μg·kg-1)检出率/%6-苄基腺嘌呤12.5~43.216.74-氯苯氧乙酸18.9~569 5.6氯吡脲 42.6~1 71711.12,4-二氯苯氧乙酸23.7~105 8.3吲哚乙酸 271~2 5606.9多效唑88.2~237 8.3恩诺沙星 504~1 0684.2诺氟沙星 116~4002.8
3 结论
本研究以豆芽作为研究对象,基于优化的分散固相萃取前处理方法,建立了超高效液相色谱-串联质谱法同时测定豆芽中植物生长调节剂类、抗生素类、杀菌剂类共96种药物残留的方法,经方法学验证,各项参数均满足GB/T 27404—2008检测方法确认的技术要求。该方法操作简单,准确可靠,检测范围广,基本覆盖了目前已报道的关于豆芽药物残留的检测指标,优势明显,能准确地评估豆芽中药物残留的种类和含量水平,为豆芽中药物残留的风险监控提供技术支持。
[1] 方良月, 肖潇, 傅亮.绿豆芽保鲜与细胞壁自溶机理分析[J].西北农业学报, 2019, 28(7):1 203-1 210.
FANG L Y, XIAO X, FU L.Analysis of green bean sprouts preservation and cell wall autolysis mechanism[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2019, 28(7):1 203-1 210.
[2] 张康逸, 宋范范, 周腾飞, 等.黄豆芽口服液制备工艺[J].食品与发酵工业, 2018, 44(5):182-186.
ZHANG K Y, SONG F F, ZHOU T F, et al.Preparation technology optimizing of soybean sprouts oral liquid[J].Food and Fermentation Industries, 2018, 44(5):182-186.
[3] WANG W, HE M, CHEN B B, et al.Simultaneous determination of acidic phytohormones in cucumbers and green bean sprouts by ion-pair stir bar sorptive extraction-high performance liquid chromatography[J].Talanta, 2017, 170:128-136.
[4] ZHANG H, WU X Q, YUAN Y N, et al.An ionic liquid functionalized graphene adsorbent with multiple adsorption mechanisms for pipette-tip solid-phase extraction of auxins in soybean sprouts[J].Food Chemistry, 2018, 265:290-297.
[5] 苏海雁, 吕敏, 薛亚馨, 等.超高效液相色谱-串联质谱法测定果蔬中28种植物生长调节剂残留量[J].食品安全质量检测学报, 2021, 12(14):5 664-5 673.
SU H Y, LYU M, XUE Y X, et al.Determination of 28 kinds of plant growth regulators residues in fruits and vegetables by ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety &Quality, 2021, 12(14):5 664-5 673.
[6] 韦航, 邹强, 李军法, 等.液相色谱-串联质谱测定豆芽中4种四环素类药物残留量研究[J].广州化工, 2019, 47(17):122-124;148.
WEI H, ZOU Q, LI J F, et al.Determination of four tetracycline antibiotics in bean sprouts by HPLC-MS/ MS[J].Guangzhou Chemical Industry, 2019, 47(17):122-124;148.
[7] 程志, 宿书芳, 魏莉莉, 等.通过式固相萃取净化-液相色谱-串联质谱法测定豆芽中10种喹诺酮类抗生素[J].分析试验室, 2020, 39(2):131-136.
CHENG Z, SU S F, WEI L L, et al.Simultaneous determination of ten quinolones in bean sprouts by solid phase extraction purification and ultra performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analysis Laboratory, 2020, 39(2):131-136.
[8] 吴少明. 超高效液相色谱-串联质谱法同时测定豆芽中18种抗菌剂的含量[J].食品安全质量检测学报, 2021, 12(23):9 027-9 034.
WU S M.Simultaneous determination of 18 kinds of antibacterial agents in bean sprouts by ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety &Quality, 2021, 12(23):9 027-9 034.
[9] 朱群英, 朱玉玲, 索莉莉, 等.在线固相萃取-高效液相色谱法同时测定豆芽中11种植物生长剂和杀菌剂[J].分析科学学报, 2018, 34(4):507-512.
ZHU Q Y, ZHU Y L, SUO L L, et al.Simultaneous determination of eleven plant growth regulators and fungicides in bean sprouts by online solid phase extraction-high performance liquid chromatography[J].Journal of Analytical Science, 2018, 34(4):507-512.
[10] KIM K G, PARK D W, KANG G R, et al.Simultaneous determination of plant growth regulator and pesticides in bean sprouts by liquid chromatography-tandem mass spectrometry[J].Food Chemistry, 2016, 208:239-244.
[11] SHI Z, CHEN D, CHEN T T, et al.In vivo analysis of two new fungicides in mung bean sprouts by solid phase microextraction-gas chromatography-mass spectrometry[J].Food Chemistry, 2019, 275:688-695.
[12] LU Z, DENG F F, HE R, et al.A pass-through solid-phase extraction clean-up method for the determination of 11 quinolone antibiotics in chicken meat and egg samples using ultra-performance liquid chromatography tandem mass spectrometry[J].Microchemical Journal, 2019, 151:104213.
[13] CAO S R, ZHOU X, XI C X, et al.Cleaning up vegetable samples using a modified “QuEChERS” procedure for the determination of 17 plant growth regulator residues by ultra high performance liquid chromatography-triple quadrupole linear ion trap mass spectrometry[J].Food Analytical Methods, 2016, 9(7):2 097-2 104.
[14] 刘春生, 罗海英, 冼燕萍, 等.超高效液相色谱-串联质谱法测定豆芽中7种药物残留[J].质谱学报, 2014, 35(4):302-310.
LIU C S, LUO H Y, XIAN Y P, et al.Determination of seven drug residues in bean sprouts by UPLC-MS/MS[J].Journal of Chinese Mass Spectrometry Society, 2014, 35(4):302-310.
[15] 程盛华, 杨春亮, 曾绍东, 等.分散固相萃取-超高效液相色谱-串联质谱法测定豆芽中10种植物生长剂和杀菌剂[J].食品工业科技, 2016, 37(12):53-59.
CHENG S H, YANG C L, ZENG S D, et al.Simultaneous determination of ten plant growth regulators and fungicides in bean sprouts using QuEChERS-UPLC-MS/MS[J].Science and Technology of Food Industry, 2016, 37(12):53-59.
[16] 孙晓冬, 郝杰, 毛婷, 等.超高效液相色谱-串联四级杆质谱快速筛查豆芽中51种抗生素类药物的残留[J].食品科学, 2017, 38(20):327-333.
SUN X D, HAO J, MAO T, et al.Rapid screening of 51 antibiotic residues in bean sprouts by UPLC-MS/MS[J].Food Science, 2017, 38(20):327-333.
[17] 黄燕红, 蒋湘, 盘正华, 等.豆芽中30种植物生长调节剂和喹诺酮类药物残留的快速筛查[J].食品工业科技, 2021, 42(23):287-295.
HUANG Y H, JIANG X, PAN Z H, et al.Rapid screening of 30 plant growth regulators and quinolone antibiotics in bean sprout samples[J].Science and Technology of Food Industry, 2021, 42(23):287-295.
[18] 颜伟华, 周莹, 郭浩炜, 等.UPLC-MS/MS快速筛查豆芽中27种植物生长调节剂和抗生素类药物[J].食品科学, 2021, 42(12):302-308.
YAN W H, ZHOU Y, GUO H W, et al.Rapid screening of 27 plant growth regulator and antibiotic residues in bean sprouts by ultra-high performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2021, 42(12):302-308.
[19] 郭添荣, 万渝平, 孙利, 等.通过式固相萃取结合超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速筛查畜禽肉中108种兽药残留[J].分析化学, 2022, 50(2):271-277.
GUO T R, WAN Y P, SUN L, et al.Rapid screening and confirmation of 108 kinds of veterinary drug residues in livestock and poultry meat by solid phase extraction purification and liquid chromatography coupled with quadrupole/orbitrap mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2022, 50(2):271-277.
[20] 郝杰, 姜洁, 毛婷, 等.QuEChERS-超高效液相色谱-串联质谱法同时测定蔬果中34种植物生长调节剂的残留量[J].食品科学, 2018, 39(8):267-275.
HAO J, JIANG J, MAO T, et al.Determination of 34 plant growth regulator residues in vegetables and fruits by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2018, 39(8):267-275.
[21] 杨月欣. 中国食物成分表(标准版 第6版 第一册)[M].北京:北京大学医学出版社, 2018:62.
YANG Y X.China Food Composition Tables (Standard Edition, 6th ed, Book 1).Beijing:Peking University Medical Press, 2018:62.
[22] 刘冬虹, 吴玉銮, 王斌, 等.分散固相萃取-超高效液相色谱-串联质谱测定肉制品中5类药物残留[J].现代食品科技, 2016, 32(10):290-296;258.
LIU D H, WU Y L, WANG B, et al.Analysis of five types of veterinary drug residues in meat products by dispersive solid phase extraction-UPLC-MS/MS[J].Modern Food Science &Technology, 2016, 32(10):290-296;258.
[23] 张泸文, 焦广睿, 王柯, 等.QuEChERS-高效液相色谱-串联质谱法同时测定果蔬中26种植物生长调节剂残留[J].食品安全质量检测学报, 2016, 7(7):2 677-2 689.
ZHANG L W, JIAO G R, WANG K, et al.Simultaneous determination of 26 kinds of plant growth regulator residues in fruits and vegetable by QuEChERS-high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety &Quality, 2016, 7(7):2 677-2 689.
[24] 莫迎, 吕敏, 张荣林, 等.改良QuEChERS结合超高效液相色谱四极杆/静电场轨道阱高分辨质谱法测定果蔬中15种植物生长调节剂残留[J].食品工业科技, 2020, 41(2):195-200;206.
MO Y, LYU M, ZHANG R L, et al.Determination of 15 plant growth regulators residues in fruits and vegetables by modified QuEChERS coupled with UPLC-Q-orbitrap HRMS[J].Science and Technology of Food Industry, 2020, 41(2):195-200;206.
[25] 贡松松, 张婧, 严凤, 等.超高效液相色谱-四极杆飞行时间质谱快速筛查与确证生鲜牛乳中80种抗生素和激素[J].分析测试学报, 2019, 38(1):22-30.
GONG S S, ZHANG J, YAN F, et al.Rapid screening and confirmation of 80 antibiotic and hormone residues in raw milk by ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry[J].Journal of Instrumental Analysis, 2019, 38(1):22-30.