冬凌草甲素为对映-贝壳杉烷型四环二萜类化合物,其能促进肿瘤细胞凋亡,对于白血病等肿瘤有一定疗效,抑制炎症小体活化,具有预防和治疗Ⅱ型糖尿病和痛风的潜力[1-2]。冬凌草甲素(Oridonin,ORI)也具有显著的抗菌活性和免疫调节作用,其对Staphylococcus aureus、Aeromonas hydrophila和Mycobacterium phlei等病原菌的生长有一定的抑制作用[3-5],能通过刺激淋巴细胞增殖和调节细胞因子分泌增强感染鸡白痢沙门氏菌肉鸡的免疫功能和抗病能力[6]。纠敏等[7]报道ORI和壳聚糖复合膜对冷鲜鸡肉进行保鲜可以有效抑制微生物的生长,延长其货架期[8]。胃蛋白酶是一种多肽水解酶,广泛应用于食品和医药领域[9]。当ORI被机体摄入后,经胃肠道消化吸收而发挥其功效,在此过程中,会与消化酶相互作用,活性发生变化。目前,关于ORI与胃蛋白酶(pepsin,PEP)互作机制的研究未见报道。因此,本文使用多光谱与分子对接模拟法研究ORI与PEP的相互作用机制,以期为其应用提供基础。
1 材料与方法
1.1 试剂与仪器
胃蛋白酶1∶3 000,来源于猪胃,生工生物工程(上海)股份有限公司;配成浓度2.5×10-4 mol/L的标准储备液(由含0.1 mol/L NaCl且pH 2.4的柠檬酸-磷酸盐缓冲液配制),4 ℃保存;ORI(纯度98%),上海源叶生物科技有限公司;配成浓度5×10-2 mol/L的储备液(甲醇为溶剂);其他试剂均为分析纯。
Cary eclipse荧光分光光度计,美国Aglient Cary eclipse公司;UV-2600紫外可见分光光度计,日本日立公司;VERTEX70傅里叶变换红外光谱仪,德国Bruker公司。
1.2 试验方法
1.2.1 ORI光谱学特性测定
采用紫外可见分光光度计测定ORI吸收光谱(200~800 nm);荧光光度计测定ORI荧光光谱。
1.2.2 不同温度下ORI-PEP体系荧光光谱测定
取6支比色管,分别加入1 mL PEP标准储备液与一定量ORI溶液,缓冲液定容至5 mL。终体系中PEP浓度为5×10-5 mol/L,ORI浓度分别为0、0.4×10-3、0.8×10-3、1.2×10-3、1.6×10-3、2.0×10-3 mol/L。摇匀后分别置于298、304、310 K下反应30 min。激发波长280 nm,狭缝宽度5 nm,压力700 V,扫描速度600 nm/min,检测发射波长300~500 nm的荧光光谱。
1.2.3 ORI-PEP体系同步荧光光谱测定
待测液配制和终体系中PEP与ORI浓度同1.2.2。摇匀后298 K下反应30 min。设置Δλ分别为15、60 nm,扫描发射波长200~500 nm的同步荧光光谱。
1.2.4 ORI-PEP体系三维荧光光谱测定
待测液配制和终体系中PEP浓度同1.2.2,ORI浓度分别为0、2.0×10-3 mol/L,摇匀后298 K下反应30 min。激发波长范围200~450 nm,发射波长间隔5 nm,压力700 V,扫描速度600 nm/min,狭缝宽度5 nm,扫描200~500 nm的发射光谱。
1.2.5 紫外可见吸收光谱测定
待测液配制和终体系中PEP与ORI浓度同1.2.2。摇匀后298 K下反应30 min,以相应浓度的ORI溶液作为空白参比,扫描200~500 nm的紫外可见吸收光谱。
1.2.6 傅里叶变换红外光谱法测定
待测液配制和终体系中PEP与ORI浓度同1.2.2。将ORI与PEP复合物真空冷冻干燥后,取少量样品与KBr研磨后压片,对其进行傅里叶变换红外光谱分析,扫描范围500~4 000 cm-1。
1.3 分子对接模拟
PEP晶体结构(PDB ID:4PEP)取自RCSB:PDB数据库(https://www.rcsb.org/),ORI分子构象(PubChem CID:5321010)从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取,利用软件Autodock和Pymol进行分子对接模拟。
2 结果与分析
2.1 ORI吸收光谱、荧光激发和发射光谱测定
由图1可知,ORI吸收光谱显示其在200~300 nm和300~400 nm各有一吸收峰值,238 nm处有最大紫外吸收峰,400~800 nm处无吸收。ORI在200~450 nm激发波长下三维荧光光谱没有明显的特征峰。

a-紫外光谱;b-荧光光谱
图1 ORI吸收光谱和荧光光谱特性
Fig.1 Absorption and fluorescence spectrum characteristics of ORI 注:ORI浓度为5.0×10-2 mol/L
2.2 ORI对PEP的荧光淬灭光谱分析
PEP含有的色氨酸、酪氨酸和苯丙氨酸使其具有内源性荧光[10]。图2分别为3种温度时,固定浓度的PEP随ORI浓度增大的荧光强度变化。由图2可知,激发波长280 nm下,PEP最大发射波长为345 nm,随着ORI浓度的增加,PEP最大荧光发射峰依次降低,这显示ORI对PEP的荧光强度产生了猝灭效应。

a-298 K;b-304 K;c-310 K
图2 不同温度下PEP与ORI相互作用的荧光光谱图
Fig.2 Fluorescence spectra of the interaction between PEP and ORI at different temperatures 注:PEP浓度为5×10-5 mol/L(图4~图6同);Ori浓度(1~6)分别为(0、0.4、0.8、1.2、1.6、2.0)×10-3 mol/L(图3、图4同);pH=2.4
2.3 ORI对PEP荧光猝灭类型的判断
使用Stern-Volmer方程计算Kq和KSV,如公式(1)所示:
F0/F=1+Kqτ0[Q]=1+KSV[Q]
(1)
式中:F0为未加入ORI时PEP的荧光强度;F为加入ORI的PEP荧光强度;Q为ORI的浓度;τ0为ORI不存在下PEP的平均荧光寿命(10-8s);Kq为双分子淬灭速率常数;KSV为动态淬灭常数[11]。
以F0/F为纵坐标,[Q]为横坐标作图,得回归方程。通过回归线斜率得KSV、Kq。由表1可知,在298、304、310 K下的Kq均大于最大动态猝灭速率常数2.0×1010 L/(mol·s),并且随着温度的升高,淬灭常数Ksv减小,表明ORI对PEP的荧光猝灭类型为静态猝灭。
2.4 ORI与PEP的结合常数和结合位点数
ORI和PEP的结合常数和结合位点数可通过静态猝灭双对数公式获得[12],如公式(2)所示:
lg[(F0-F)/F]=lgK+nlg[Q]
(2)
式中:F0、F和Q的含义同式(1),K和n分别为ORI与PEP的结合常数和结合位点数。
lg[(F0-F)/F]与lg[Q]呈线性相关。由线性方程的斜率和截距可计算3种温度下ORI与PEP的结合常数K和结合位点数n。由表1可知,3种温度下的结合位点数时n均接近1,显示ORI与PEP以1∶1形式结合形成复合物。3种温度下的结合常数K值均较大,说明两者结合能力较强。
2.5 ORI与PEP相互作用的热力学参数与作用力类型判断
ORI与PEP相互作用力可以通过体系内的热力学参数判断。当温度变化不大时,可使用Van′t Hoff方程计算[13]ΔH和ΔS,如公式(3)、公式(4)所示:
lnK=-ΔH/RT+ΔS/R
(3)
ΔG=-RTlnK=ΔH-TΔS
(4)
式中:R为气体常数[8.314 J/(mol·K)],T为实验温度,K为相应实验温度下ORI与PEP的结合常数(L/mol)。ΔH和ΔS值可分别由回归方程的斜率和截距计算,结果见表1。根据Ross理论[14],当ΔH<0和ΔS<0时,范德华力和氢键在结合过程中起主导作用。由表1可知,ΔG<0,表明ORI与PEP的作用是自发过程;ΔH<0且ΔS<0,表明ORI与PEP的作用力主要是氢键和范德华力。
表1 Stern-Volmer线性方程相关系数和热力学参数
Table 1 Correlation coefficient of Stern-Volmer linear equation and thermodynamic parameters

T/KKSV/(L·mol-1)Kq/(L·mol-1·S-1)K/(L·mol-1)nΔG/(kJ·mol-1)ΔH/(kJ·mol-1)ΔS/[J/(mol·K)-1]2986.775×1026.775×10101.514×1031.135-8.0443046.221×1026.221×10101.068×1031.077-7.315-44.286-121.6173105.199×1025.199×10100.306×1030.898-6.585
2.6 ORI对PEP构象的影响
2.6.1 紫外可见光谱分析
对于静态淬灭,小分子物质会使蛋白质的紫外吸收光谱发生红移或蓝移[15]。由图3可知,随着ORI浓度增大,PEP紫外吸收峰逐渐降低,且发生红移,证明两者发生相互作用,ORI与PEP之间发生了静态猝灭。ORI的加入使PEP最大吸收峰波长由276 nm红移至286 nm,说明ORI分子与PEP中氨基酸残基的碱基对π电子发生相互作用,且改变了所处的微环境,最终引起PEP构象发生改变[16]。
2.6.2 同步荧光光谱分析
同步荧光光谱中激发和发射的Δλ为15、60 nm时分别呈现酪氨酸和色氨酸残基的荧光光谱特性[17]。由图4可知,Δλ=15 nm时,随着ORI浓度的增加,PEP特征荧光吸收峰出现淬灭,但峰形基本保持不变;Δλ=60 nm时,PEP特征荧光吸收峰随着ORI浓度的提高亦出现猝灭,由278 nm红移至286 nm。这表明ORI的加入增加了PEP的色氨酸残基附近的微环境极性,使其疏水性减小[18]。由图4-a和图4-b可知色氨酸残基对PEP荧光猝灭的贡献高于酪氨酸残基,因此,ORI主要结合在色氨酸残基上使PEP的分子构象发生了变化。
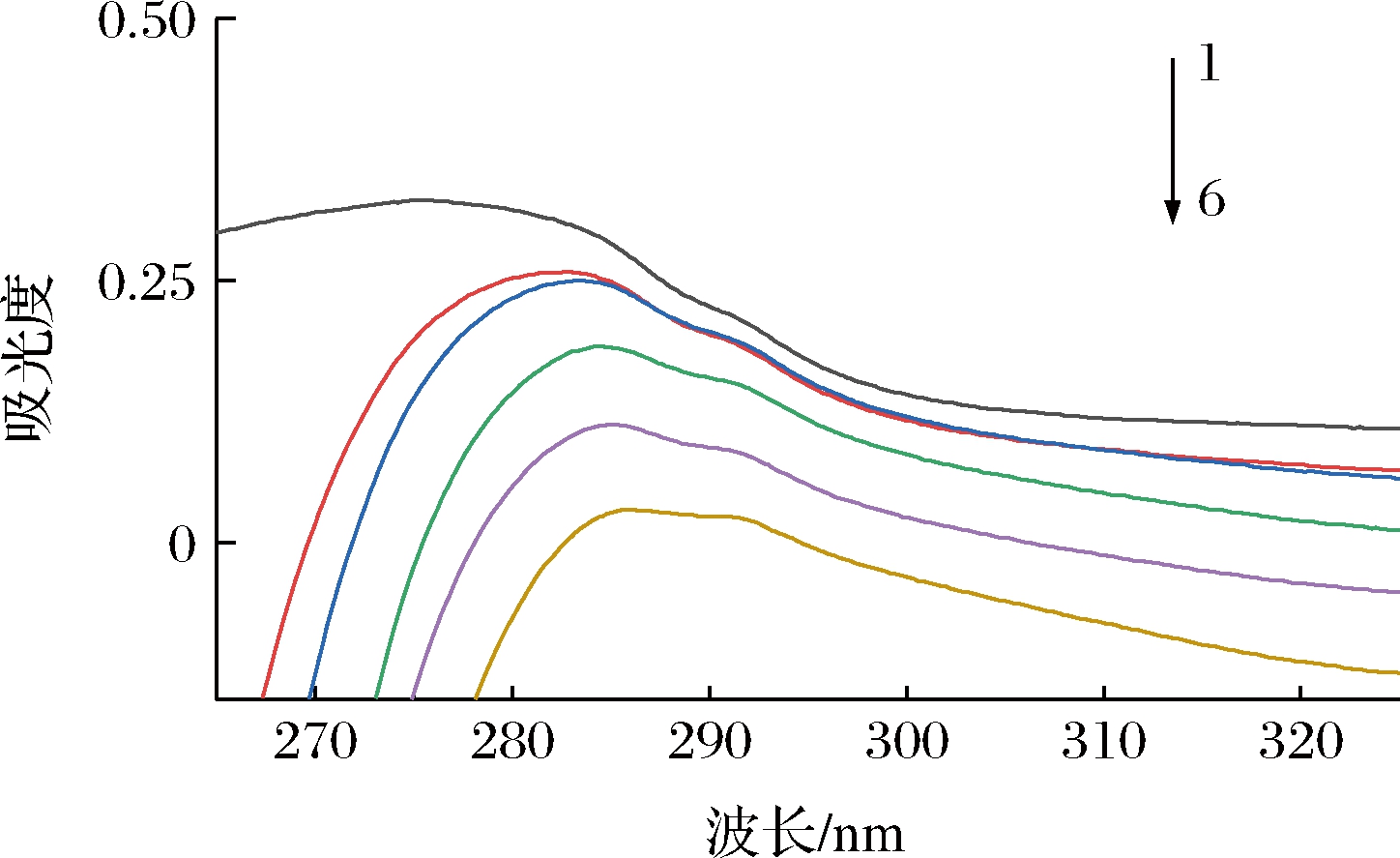
图3 ORI加入前后PEP的紫外吸收光谱图
Fig.3 UV absorption spectra of PEP before and after the addition of ORI 注:T=298 K
2.6.3 三维荧光光谱分析
加入ORI前后PEP的三维荧光光谱图见图5和图6。峰a是瑞利散射峰(λex=λem),峰1主要展现PEP中色氨酸或酪氨酸残基的荧光光谱特征,峰2与肽链骨架结构有关,其强度与蛋白二级结构相关[19]。由图5和图6可知,ORI和PEP复合物的荧光强度低于PEP,峰1的荧光强度由412.8减弱至335,发射波长从345 nm红移至353 nm(峰1),峰2则消失。荧光强度降低显示ORI对PEP产生了猝灭效应。红移现象则证明ORI使PEP周围的微环境的极性增大、亲水性增强和疏水性降低,且使其肽链结构发生变化。三维荧光光谱分析结果表明ORI改变了PEP的二级结构。
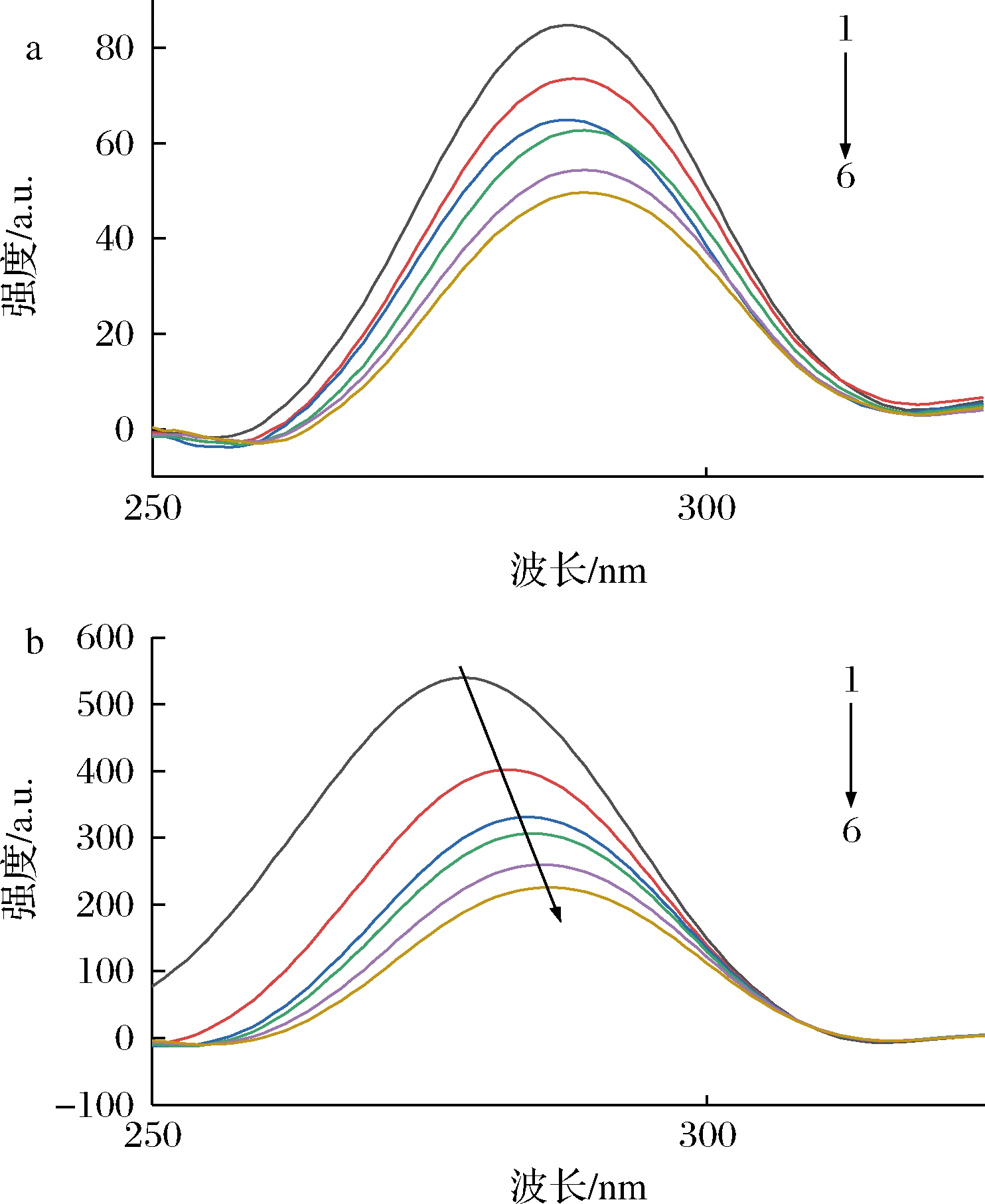
a-Δλ=15 nm;b-Δλ=60 nm
图4 ORI与PEP相互作用的同步荧光光谱
Fig.4 Synchronous fluorescence spectra of the interaction between ORI and PEP 注:T=298 K,pH=2.4(图5、图6同)
2.7 傅里叶变换红外光谱分析
傅里叶变换红外光谱可进一步研究蛋白质二级结构的变化,吸收光谱中的酰胺Ⅰ带和Ⅱ带以及C—N伸缩振动的峰移位表明小分子物质与蛋白质发生了相互作用[20]。由图7可知,相较于PEP,ORI的加入,C![]() O伸缩振动吸收峰的峰位发生了蓝移现象,由1 552.6 cm-1移动到1 546.9 cm-1,C—N键的伸缩振动和N—H键的弯曲振动耦合的峰位由1 325.1 cm-1移动到1 317.3 cm-1,吸收峰的大小也发生了变化,这表明ORI与PEP结构中的C
O伸缩振动吸收峰的峰位发生了蓝移现象,由1 552.6 cm-1移动到1 546.9 cm-1,C—N键的伸缩振动和N—H键的弯曲振动耦合的峰位由1 325.1 cm-1移动到1 317.3 cm-1,吸收峰的大小也发生了变化,这表明ORI与PEP结构中的C![]() O、C—N和N—H键发生了作用。3 500~3 200 cm-1的吸收峰是O—H的特征峰,ORI的加入,3 400.387 cm-1处的波峰红移至3 425.461 cm-1,且波峰变尖,表明ORI与PEP形成了新的氢键。
O、C—N和N—H键发生了作用。3 500~3 200 cm-1的吸收峰是O—H的特征峰,ORI的加入,3 400.387 cm-1处的波峰红移至3 425.461 cm-1,且波峰变尖,表明ORI与PEP形成了新的氢键。

a-三维荧光立体图;b-荧光强度等高线图
图5 PEP的三维荧光光谱
Fig.5 Three-dimensional fluorescence spectra of PEP

a-三维荧光立体图;b-荧光强度等高线图
图6 ORI与PEP相互作用的三维荧光光谱
Fig.6 Three-dimensional fluorescence spectra of the interaction between PEP and ORI 注:ORI浓度为2.0×10-3 mol/L
2.8 分子对接模拟
分子对接能直观地反映ORI与PEP的结合状态[21],结果见图8。由图8-a和图8-b可知,ORI分子进入到PEP的表面活性中心(2个催化活性氨基酸残基为Asp32和Asp215)凹槽处。图8-c为ORI附近的氨基酸残基2D/3D示意图,可进一步观察ORI与PEP相互作用的微环境。由图8-c可知,ORI与SER207、GLN211、TRP299、GLU297等氨基酸残基形成氢键,其键长分别为1.76、2.36、1.79、1.93、1.98及2.97 Å。此外,ORI与TRP299和ALA227之间还存在疏水作用力。分子对接模拟结果显示ORI主要通过氢键与疏水作用力与PEP结合,与热力学结果判断一致。
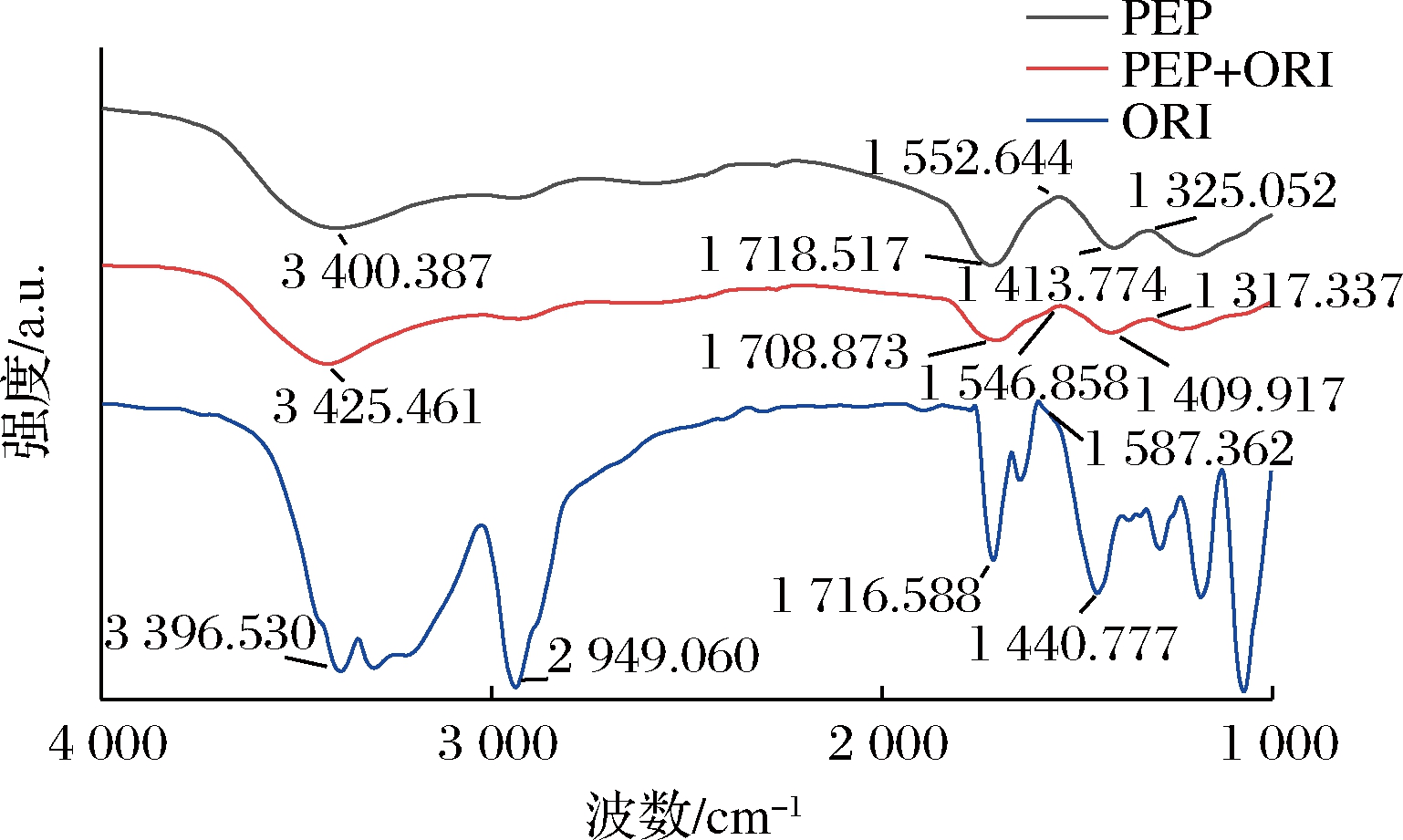
图7 PEP和ORI及其复合物的傅里叶变换红外光谱图
Fig.7 Fourier transform infrared spectrum of PEP, ORI and their compounds
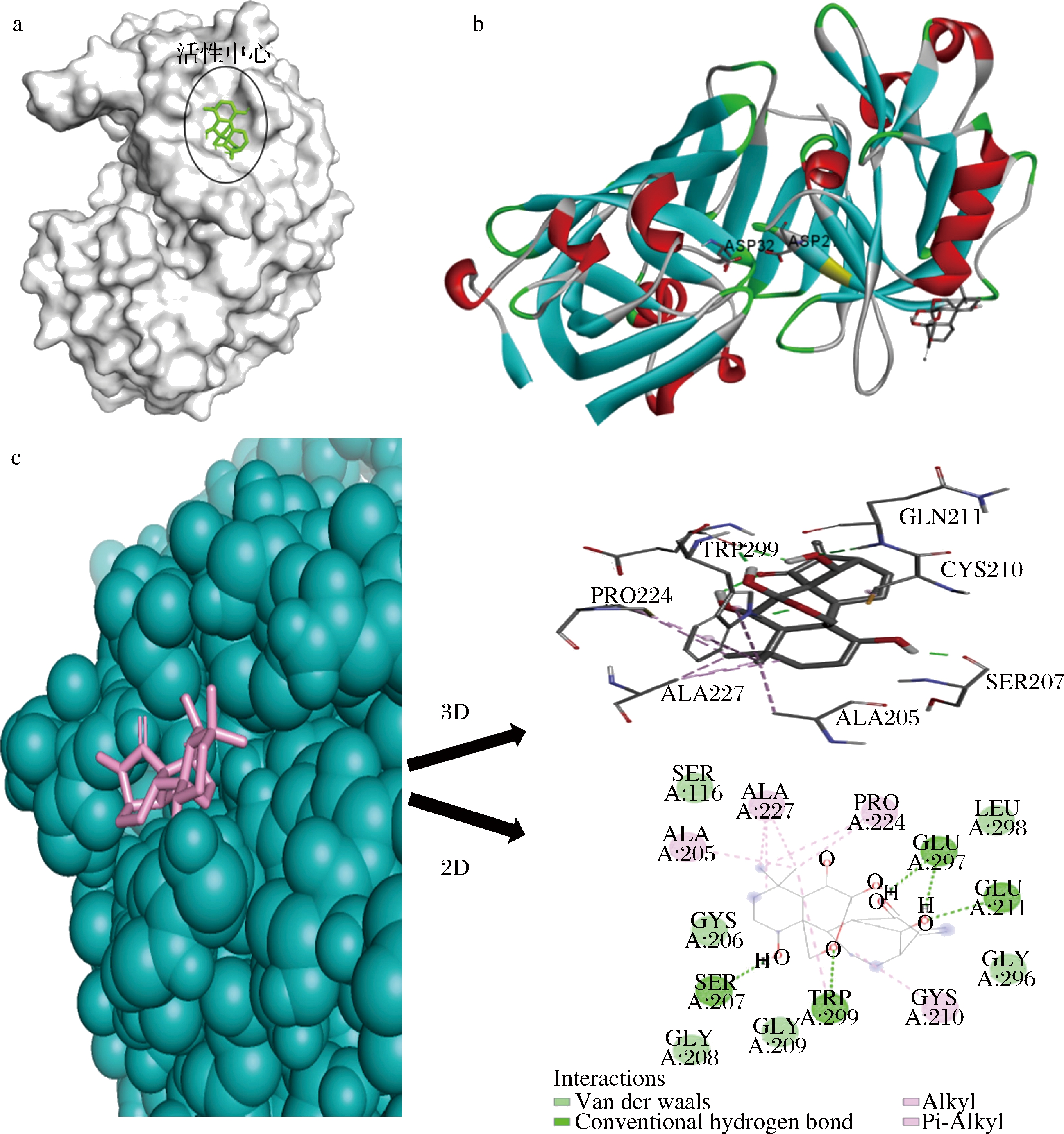
a-ORI与PEP的分子对接模拟图;b-ORI与PEP飘带状模型对接图;c-ORI与PEP的微环境示意2D和3D图
图8 ORI与PEP的分子对接模拟图
Fig.8 Molecular docking simulation diagram of ORI and PEP
3 结论
通过分析不同温度下PEP-ORI的荧光发射光谱,表明两者之间发生了相互作用,ORI对PEP荧光强度产生了猝灭效应,荧光猝灭类型为静态猝灭。静态猝灭双对数公式计算3种温度下的ORI与PEP结合常数和结合位点数,显示两者之间的结合较强且复合比为1∶1型。根据Van′t Hoff方程结合Ross理论推断出ORI与PEP的作用力主要是氢键和范德华力,二者的结合过程是自发反应。通过对紫外吸收光谱、同步荧光光谱和三维荧光光谱的分析,可知ORI使PEP中的色氨酸残基周围环境极性增强,疏水性减弱,导致PEP构象发生改变,同时进一步证明ORI与PEP之间发生荧光静态猝灭。傅里叶变换红外光谱分析表明ORI的加入会改变PEP的二级结构。分子对接模拟结果表明ORI对PEP残基的作用方式不仅具有氢键和范德华力,还存在疏水作用力,直观反映出ORI与PEP之间通过各种作用力稳定结合。这些结果阐明了在分子结构层面上ORI与PEP的作用机理,为其应用提供理论基础。
[1] LIAO M, DONG Q, CHEN R Q, et al.Oridonin inhibits DNMT3A R882 mutation-driven clonal hematopoiesis and leukemia by inducing apoptosis and necroptosis[J].Cell Death Discovery, 2021, 7:297.
[2] HE H B, JIANG H, CHEN Y, et al.Oridonin is a covalent NLRP3 inhibitor with strong anti-inflammasome activity[J].Nature Communications, 2018, 9:2550.
[3] LI D H, HU X, HAN T, et al.Synthesis, biological activity, and apoptotic properties of NO-donor/enmein-type ent-kauranoid hybrids[J].International Journal of Molecular Sciences, 2016, 17(6):747.
[4] YUAN Z W, OUYANG P, GU K X, et al.The antibacterial mechanism of oridonin against methicillin-resistant Staphylococcus aureus (MRSA)[J].Pharmaceutical Biology, 2019, 57(1):710-716.
[5] 缪玉佳, 陈杰豪, 梁天雨, 等.冬凌草甲素对嗜水气单胞菌体外抑菌效果及作用机制[J].水产学报, 2021, 45(11):1 899-1 908.
MIAO Y J, CHEN J H, LIANG T Y, et al.Antibacterial mechanism of oridonin against Aeromonas hydrophila in vitro[J].Journal of Fisheries of China, 2021, 45(11):1 899-1 908.
[6] WU Q J, ZHENG X C, WANG T, et al. Effects of oridonin on immune cells, Th1/Th2 balance and the expression of BLys in the spleens of broiler chickens challenged with Salmonella pullorum[J].Research in Veterinary Science, 2018, 119:262-267.
[7] 纠敏, 孟媛媛, 王倩, 等.冬凌草甲素/壳聚糖复合膜的性能和结构表征[J].食品发酵与工业, 2019, 45(24):119-123.
JIU M, MENG Y Y, WANG Q, et al.Properties and structural characterization of Oridonin/chitosan composite films[J].Food and Fermentation Industries, 2019, 45(24):119-123.
[8] 王倩, 纠敏, 孟媛媛, 等.冬凌草甲素/壳聚糖复合膜对冰鲜鸡胸肉的保鲜效果[J].食品与机械, 2021, 37(3):125-130.
WANG Q, JIU M, MENG Y Y, et al.Preservation effects of oridonin/chitosan composite film on chilled chicken breast meat[J].Food & Machinery, 2021, 37(3):125-130.
[9] METI M D, XU Y, XIE J F, et al.Multi-spectroscopic studies on the interaction between traditional Chinese herb, helicid with pepsin[J].Molecular Biology Reports, 2018, 45(6):1 637-1 646.
[10] KHALILI L, DEHGHAN G.A comparative spectroscopic, surface plasmon resonance, atomic force microscopy and molecular docking studies on the interaction of plant derived conferone with serum albumins[J].Journal of Luminescence, 2019, 211:193-202.
[11] SUO Z L, MA X L, MENG Z H, et al.Interaction between trelagliptin and pepsin through spectroscopy methods and molecular dynamics simulation[J].Spectroscopy Letters, 2018, 51(7):332-339.
[12] 王晓霞, 聂智华, 马力通, 等.多光谱法和分子对接模拟法研究美满霉素与牛血清白蛋白的相互作用[J].光谱学与光谱分析, 2020, 40(5):1 503-1 508.
WANG X X, NIE Z H, MA L T, et al.Study on the interaction between minocycline and bovine serum albumin by multi spectral method and molecular docking simulation[J].Spectroscopy and Spectral Analysis, 2020, 40(5):1 503-1 508.
[13] JAHANBAN-ESFAHLAN A, PANAHI-AZAR V.Interaction of glutathione with bovine serum albumin:Spectroscopy and molecular docking[J].Food Chemistry, 2016, 202:426-431.
[14] ROSS P D, SUBRAMANIAN S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry, 1981, 20(11):3 096-3 102.
[15] 王晓霞, 于洋洋, 马力通, 等.分子对接模拟法与多光谱法研究盐酸金霉素与胃蛋白酶的相互作用[J].光谱学与光谱分析, 2020, 40(8):2 518-2 524.
WANG X X, YU Y Y, MA L T, et al.Study on the interaction between chlortetracycline hydrochloride and pepsin by multispectral and molecular docking[J].Spectroscopy and Spectral Analysis, 2020, 40(8):2 518-2 524.
[16] 雷选, 王旭苹, 程镜蓉, 等.芦丁和阿魏酸与酪蛋白的相互作用研究[J].食品科学技术学报, 2020, 38(2):73-80.
LEI X, WANG X P, CHENG J R, et al.Study on interaction of rutin and ferulic acid with casein[J].Journal of Food Science and Technology, 2020, 38(2):73-80.
[17] TYAGI P, TYAGI M, AGRAWAL S, et al.Synthesis, characterization of 1,2,4-triazole Schiff base derived 3 d-metal complexes:Induces cytotoxicity in HepG2, MCF-7 cell line, BSA binding fluorescence and DFT study[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2017, 171:246-257.
[18] ZENG H J, YANG D, HU G Z, et al.Studies on the binding of pepsin with three pyrethroid insecticides by multi-spectroscopic approaches and molecular docking[J].Journal of Molecular Recognition, 2016, 29(10):476-484.
[19] 任国艳, 孙贺, 樊金玲, 等.荧光光谱法和分子对接模拟技术研究白藜芦醇与胃蛋白酶的相互作用[J].光谱学与光谱分析, 2019, 39(4):1 103-1 108.
REN G Y, SUN H, FAN J L, et al.Study on interaction between resveratrol and pepsin by fluorescence spectroscopy and molecular modeling[J].Spectroscopy and Spectral Analysis, 2019, 39(4):1 103-1 108.
[20] WEI J, XU D X, YANG J, et al.Analysis of the interaction mechanism of Anthocyanins (Aronia melanocarpa Elliot) with β-casein[J].Food Hydrocolloids, 2018, 84:276-281.
[21] WU Z B, SHEN L L, HAN Q G, et al.Mechanism and nature of inhibition of trypsin by Ligupurpuroside A, a Ku-Ding tea extract, studied by spectroscopic and docking methods[J].Food Biophysics, 2017, 12(1):78-87.