牦牛乳营养丰富,是青藏高原各族人民重要的食品和乳制品加工原料。其蛋白质、脂肪、乳糖、总固形物和矿物质的种类和含量均高于普通牛乳,并且容易被人体消化和吸收[1-2],但也因其丰富的营养极易滋生细菌而变质,从而使得牦牛乳在收集、运输、销售和加工等环节的贮藏环境及时间显得尤为重要。研究表明,风味能决定食品独特的感官价值,对食品新鲜度和营养价值的鉴定也有一定的影响。牛奶变质的主要原因是乳中微生物生长产生挥发性物质,导致气味和味道发生不良变化[3-4]。微生物生长可以通过基于单个活细胞的许多传统方法来确定。尽管这些传统的检测方法灵敏且价格低廉,但需要几天才能产生结果。并且近年来关于食品腐败检测的方法,如:聚合酶链式反应、DNA微阵列[5-6]和LC-MS[7]等,相对耗时,在样品制备过程中需要复杂的预处理步骤,以及需要昂贵的设备和高维护要求。
原料乳中微生物的醛、酮、醇、硫化物、苦味肽等代谢副产物会产生异味,对乳中这些重要的腐败指标的检测可以用来直观地确定其新鲜度和乳品是否已经变质[8-9]。气相色谱-离子迁移谱法(gas chromatography-ion mobility spectroscopy,GC-IMS)是一种简单、快速和灵敏的检测技术[10]。该技术将气相色谱法的出色分离能力与离子迁移谱法的快速响应和高灵敏度相结合[11]。此外,GC-IMS不需要样品预处理来识别液体或固体样品中的挥发性物质。因此,它已被成功应用于玉米[12]、植物油[13]、花生[14]和大米[15]等的质量评估上,而目前在乳及乳制品腐败变质检测方面的报道很少。本研究以新鲜牦牛乳为原料,探究牦牛乳在不同温度(-18、4、20 ℃)贮藏过程中(1、3、6 d)乳品质的变化规律,同时基于GC-IMS技术对牦牛乳的挥发性风味物质检测,揭示不同贮藏温度对牦牛乳品质及挥发性风味物质的影响,并对牦牛乳腐败的潜在挥发性物质进行筛选,以期为原料乳新鲜度的快速评估和贮藏过程中早期腐败预警提供参考。
1 材料与方法
1.1 材料与试剂
牦牛乳样品于2021年11月在甘肃省甘南藏族自治州夏河县牧场采集。
氢氧化钠,国药集团化学试剂有限公司;酚酞,天津市天新精细化工开发中心;邻苯二甲酸氢钾,天津市科密欧化学试剂有限公司;2-丁酮、2-戊酮、2-己酮、2-庚酮、2-辛酮、2-壬酮等均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
PHS-3C型pH计,上海仪电科学仪器股份有限公司;JQ-III-30型精其超纯水机,上海精其仪器有限公司;HH-2型恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;BCD-458 WDVMU1型冰箱,青岛海尔股份有限公司;MilkoScanTM FT120型乳成分测定仪,丹麦FOSS分析仪器公司;FlavourSpec®型气相离子迁移谱,德国 G.A.S 公司。
1.3 实验方法
1.3.1 样品采集及处理
用无菌采样瓶采集乳罐新鲜牦牛乳样品(体细胞数<2.0×105细胞/mL,菌落总数<1.0×105 CFU/mL),置于有冰袋的隔热采样箱,4 h 内运回实验室并无菌分装至250 mL无菌分装瓶进行-18 ℃冻藏、4 ℃冷藏和20 ℃室温贮藏。根据贮藏时间,即0、1、3、6 d进行相应的理化分析,每组样本做3个平行。
1.3.2 牦牛乳主要品质指标的检测
酸度测定参照国家标准GB 5009.239—2016《食品安全国家标准 食品酸度的测定》进行检测;pH 值测定参照国家标准GB 5009.237—2016《食品安全国家标准 食品pH值的测定》,采用PHS-3C型pH计测定;利用MilkoScanTM FT120型乳成分测定仪测定原料乳的各项常规营养成分的含量。
1.3.3 牦牛乳中挥发性物质的检测
牦牛乳中挥发性风味物质的分析参照李娟等[16]的方法并进行修改,采用GC-IMS测定。取无菌瓶中原料乳2 mL,置于20 mL顶空瓶中,60 ℃孵育20 min后进样500 μL,其中进样针温度85 ℃。将FS-SE-54-CB-1型色谱柱(15 m×0.53 mm,1 μm)保持在60 ℃,以N2(纯度≥99.999%)作为载气进行色谱分离。使用载气流量:0~2 min,5 mL/min;2~10 min,5~15 mL/min;10~20 min,15~100 mL/min;20~30 min,100 mL/min。整个分析过程总共需要30 min。
1.4 数据处理
采用Excel软件对数据进行初步处理,用 SPSS 软件进行方差分析,试验结果均以“平均数±标准差”表示;通过GC-IMS仪器自带分析软件LAV(Laboratory Analytical Viewer)、定性软件GC×IMS Library Search(内置NIST2014、IMS数据库)进行化合物的鉴定。运用LAV中插件Reporter进行样品GC-IMS谱图对比,用插件Gallery Plot进行GC-IMS指纹图谱的对比;通过SIMCA-P 14.1对牦牛乳在不同贮藏条件下的挥发性物质进行正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)。
2 结果与分析
2.1 牦牛乳贮藏过程中品质指标分析
2.1.1 牦牛乳贮藏过程中pH值和酸度测定
酸度是衡量牛乳化学性质和新鲜程度的重要指标之一,包括pH酸度和滴定酸度。酸度与口感和风味密不可分,这就使乳及乳制品在贮藏过程中酸度和pH的变化显得尤为重要[17]。新鲜牛乳的酸度一般为16~18 °T,牛乳存放时间过长,新鲜度下降之后,由于微生物的产酸作用,会使牛乳的滴定酸度升高。牦牛乳在不同贮藏温度过程中pH 值和酸度变化如图1所示。-18 ℃冻藏牦牛乳的pH 和酸度随着贮藏时间延长分别出现下降和升高的趋势,但与新鲜样品相比,无显著性差异(P>0.05);牦牛乳在4 ℃冷藏1 d的pH 和酸度与新鲜样品相比变化不显著(P>0.05),这可能与原料乳体系的抗菌肽的存在有关,如乳铁蛋白、溶菌酶、过氧化物等[18-19],抑制了乳中微生物的繁殖代谢,从而使微生物的产酸作用减缓。从冷藏3 d起,牦牛乳的酸度和pH的变化趋势较大,且差异性显著(P<0.05);牦牛乳在20 ℃室温贮藏1 d时,其pH和酸度与新鲜样品相比均有显著性差异(P<0.05),且在贮藏3 d时,有明显的乳清析出,感官较差,使人不能接受,所以对牦牛乳20 ℃室温贮藏3 d和6 d的pH、酸度和乳成分未进行分析。可见低温贮藏可有效降低乳品酸度的增长,保持低温可使乳品在短期内不至于过酸,从而确保乳品适宜的口感。
2.1.2 牦牛乳贮藏过程中蛋白质、脂肪和乳糖含量分析
牦牛乳在不同温度贮藏期间脂肪、蛋白质和乳糖变化如表1所示。新鲜牦牛乳的蛋白质、乳糖含量偏低,这是因为采样在高寒地区的冷季11月份,牦牛体内需能较多,对能源的消耗也大,且进入冷季后牧草枯黄,纤维素含量增加,营养成分降低,造成了牦牛乳除脂肪外的营养成分含量明显下降[20-21]。-18 ℃冻藏6 d期间牦牛乳的蛋白质和乳糖含量变化不显著(P>0.05),而脂肪含量在P<0.05的水平下变化显著,但与新鲜牦牛乳含量接近。但张超越等[22]和GARC A-LARA等[23]对人乳的研究表明,长期冻藏可造成人乳脂肪球膜粒径增大, 冰晶会刺破膜结构, 导致脂肪在脂肪酶的作用下被分解,同时也会影响婴儿对人乳脂质的消化吸收。而冻藏牦牛乳对人体消化吸收的影响需进一步研究。牦牛乳在4 ℃冷藏1 d时,脂肪、蛋白质、乳糖含量变化显著(P<0.05)。从冷藏3 d起,牦牛乳中的脂肪和蛋白质快速降低,且差异性显著(P<0.05)。产生这一变化的原因可能是嗜冷菌产生耐低温的脂肪酶和蛋白酶,能够分解原料乳中的脂肪和蛋白质,从而使得脂肪和蛋白质含量降低[24]。而在20 ℃室温贮藏1 d开始,各营养成分均发生了显著改变(P<0.05)。
A-LARA等[23]对人乳的研究表明,长期冻藏可造成人乳脂肪球膜粒径增大, 冰晶会刺破膜结构, 导致脂肪在脂肪酶的作用下被分解,同时也会影响婴儿对人乳脂质的消化吸收。而冻藏牦牛乳对人体消化吸收的影响需进一步研究。牦牛乳在4 ℃冷藏1 d时,脂肪、蛋白质、乳糖含量变化显著(P<0.05)。从冷藏3 d起,牦牛乳中的脂肪和蛋白质快速降低,且差异性显著(P<0.05)。产生这一变化的原因可能是嗜冷菌产生耐低温的脂肪酶和蛋白酶,能够分解原料乳中的脂肪和蛋白质,从而使得脂肪和蛋白质含量降低[24]。而在20 ℃室温贮藏1 d开始,各营养成分均发生了显著改变(P<0.05)。
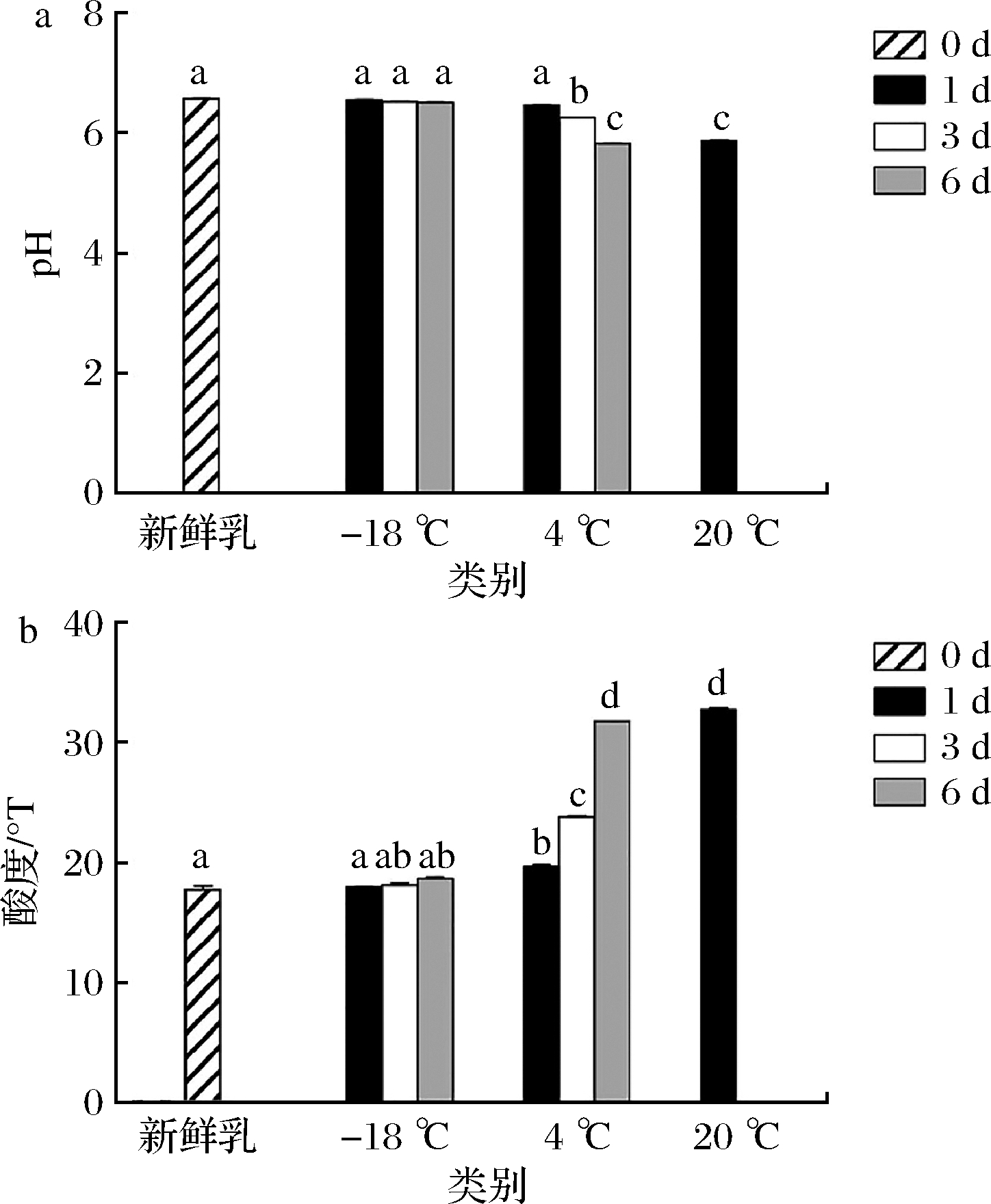
a-pH;b-酸度
图1 牦牛乳在不同温度贮藏期间pH、酸度变化
Fig.1 Changes of pH and acidity of yak milk during storage at different temperatures 注:不同小写字母表示存在显著性差异(P<0.05)
表1 牦牛乳在不同温度贮藏期间营养成分的变化
Table 1 Changes of nutritional components of yak milk during storage at different temperatures
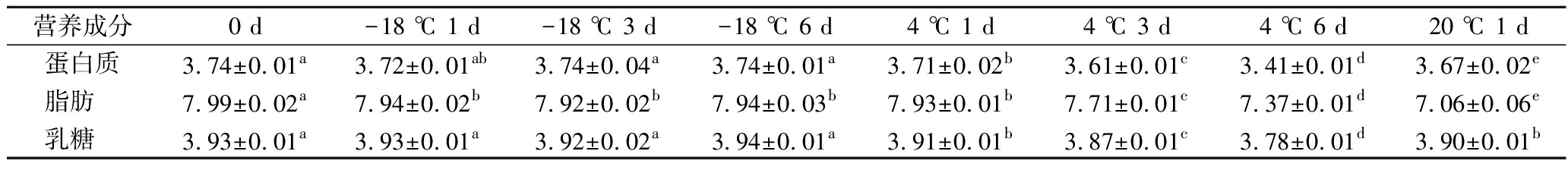
营养成分0 d-18 ℃ 1 d-18 ℃ 3 d-18 ℃ 6 d4 ℃ 1 d4 ℃ 3 d4 ℃ 6 d20 ℃ 1 d蛋白质3.74±0.01a3.72±0.01ab3.74±0.04a3.74±0.01a3.71±0.02b3.61±0.01c3.41±0.01d3.67±0.02e脂肪 7.99±0.02a7.94±0.02b7.92±0.02b7.94±0.03b7.93±0.01b7.71±0.01c7.37±0.01d7.06±0.06e乳糖 3.93±0.01a3.93±0.01a3.92±0.02a3.94±0.01a3.91±0.01b3.87±0.01c3.78±0.01d3.90±0.01b
注:同行数据后标有不同小写字母表示两者之间存在显著性差异(P<0.05)
2.2 牦牛乳贮藏过程中挥发性物质成分分析
采用GC-IMS对新鲜牦牛乳(0 d)和不同温度贮藏期间(1、3、6 d)的牦牛乳样品进行挥发性风味物质分析,通过归一化离子迁移时间和反应离子峰(RIP)的位置,获得了不同温度下贮藏的牦牛乳中挥发性组分的离子迁移光谱图(图2)。反应离子峰右侧的每个点表示特定的挥发性物质。每种挥发性物质的信号强度代表浓度水平,其浓度高低由颜色表示(白色表示浓度低;红色表示浓度高)。由图2可以看出, 随着贮藏时间的延长,-18 ℃贮藏和4 ℃贮藏早期和中期(1 d和3 d)的挥发性物质与新鲜牦牛乳样品差别不明显,大多数信号的迁移时间在4.0~6.0 s,而保留时间在25~75 s。与新鲜牦牛乳样品相比,在20 ℃贮藏期间和4 ℃贮藏后期(6 d)的样品在75~150 s的保留时间范围内发现了更多的挥发性物质。图3是以新鲜牦牛乳样品谱图为背景,扣除其谱图后得到不同贮藏条件下样品的谱图。白色、红色和蓝色背景表明挥发性物质浓度分别与参考浓度相似、更高或更低。对比图3可看出,新鲜牦牛乳样品谱图中挥发性物质较-18 ℃贮藏和4 ℃贮藏早期和中期样品不管是浓度还是种类均相似;20 ℃贮藏期间和4 ℃贮藏后期的样品较新鲜牦牛乳样品挥发性物质多一些,浓度也相对高,且牦牛乳原有风味物质明显减少或消失。
2.2.1 挥发性物质定性分析
根据挥发性物质保留时间和迁移时间,使用外标正酮C4~C9(2-丁酮、2-戊酮、2-己酮、2-庚酮、2-辛酮、2-壬酮)作为参考,牦牛乳在不同贮藏条件下共定性出46种挥发性物质(表2),其中主要包含:酮类16种、酯类13种、醇类4种、醛类7种以及其他化合物6种。由于化合物浓度不同,一些单一化合物可能产生多个信号或斑点(二聚体或三聚体)[25]。20 ℃贮藏过程中牦牛乳挥发性物质变化最明显,各类物质含量从1 d开始明显增长,导致其贮藏1 d开始就风味劣变。在4 ℃冷藏前期(1 d)各类物质变化不明显,而贮藏中后期(3 d和6 d)以酮类、酯类增长为主,醇类次之。同时随着冷藏时间的延长,醛类物质总体呈下降趋势,这可能是它们转变成伯醇或被氧化成相应的酸[26-27]。在冷藏中后期牦牛乳风味也出现劣变,这是由于微生物脂肪酶促进的脂类分解而导致的[22];在-18 ℃冻藏条件下各类挥发性物质含量增加放缓,但也有一定的波动,其原因可能是冻藏过程中冰晶刺破乳脂肪球膜导致脂肪在脂肪酶的作用下发生分解,从而造成挥发性物质含量的增加[23]。这也与张超越等[22]对人乳在低温贮藏下风味的变化表现出相似的结果,且温度越低越能抑制微生物的增殖,抑制脂肪酶的活性从而延缓脂肪分解。
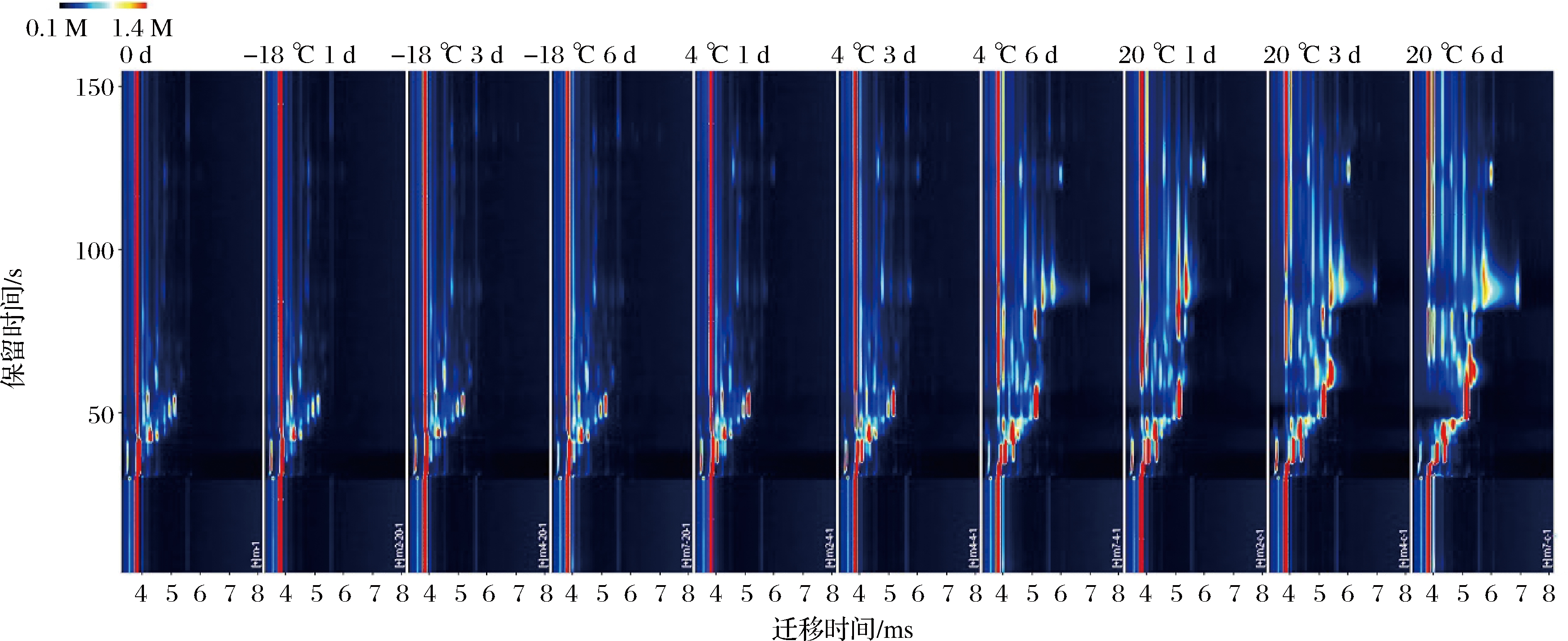
图2 牦牛乳在不同温度贮藏期间的气相色谱离子迁移谱图
Fig.2 GC-IMS spectra for the yak milk during storage at different temperatures
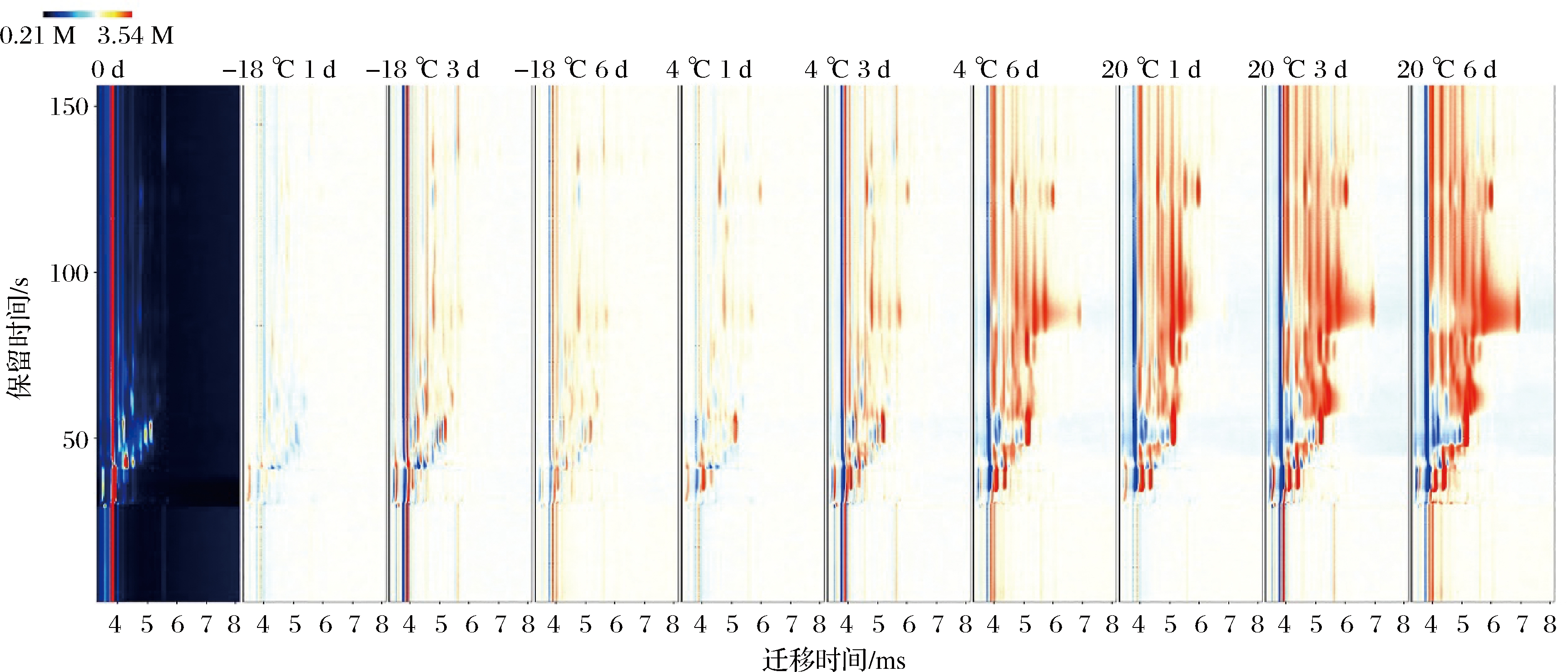
图3 牦牛乳在不同温度贮藏期间的气相色谱离子迁移谱差异图
Fig.3 GC-IMS difference image for the yak milk during storage at different temperatures
2.2.2 挥发性物质指纹谱图和聚类热图分析
为进一步比较牦牛乳在不同贮藏条件下挥发性物质的变化,选取GC-IMS二维图谱中各峰自动生成指纹图谱(图4),以识别牦牛乳在不同贮藏条件下腐败和变质的特征峰区域。行表示检测到的物质,列表示同一种挥发性物质在不同时间中的含量。单个点代表某一挥发性物质,色度代表该挥发性物质的含量水平,颜色越亮,含量越高。通过指纹图谱的分析,可以清楚地看出牦牛乳在不同贮藏条件下挥发性物质的变化差异,并对不同贮藏条件下各样品的特征挥发性物质进行了标记。如图4所示,a区域为新鲜牦牛乳中主要挥发性组分,其中包括乙酸乙酯、3-烃基-2-丁酮、2,3-丁二酮、2-丁酮、庚醛、正己醛等牦牛乳中常见的挥发性风味物质[28]。将-18 ℃贮藏的样品标记为b区域,可以看出在整个贮藏过程中与新鲜牦牛乳样品的挥发性风味物质非常相似。而在4 ℃贮藏中后期,可以看出牦牛乳中部分挥发性物质增加且出现了一些新的物质(c区域),比如2-丁酮、2,3-丁二酮、3-烃基-2-丁酮、2-戊酮、2-庚酮、吡啶、2-乙基-5-甲基吡嗪、丙烯酸乙酯、丁酸乙酯等,这些化合物有可能成为早期牦牛乳腐败变质的标志物。而在20 ℃贮藏的过程中,牦牛乳原有的风味物质减少或消失(d区域),且贮藏期间出现明显的异味。
表2 牦牛乳在不同温度贮藏期间挥发性物质的定性结果
Table 2 Qualitative analysis of volatile compounds in yak milk during storage at different temperatures
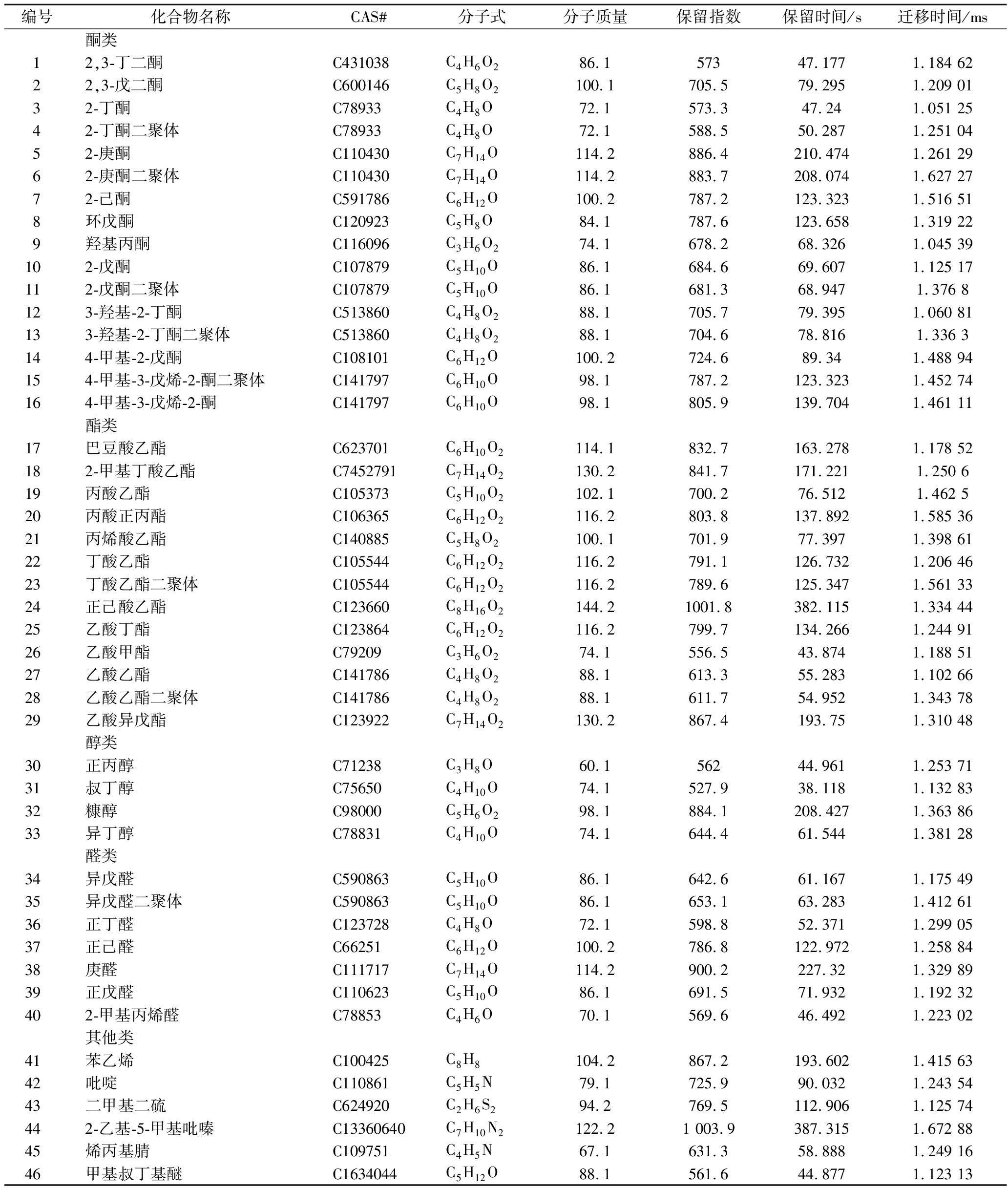
编号化合物名称CAS#分子式分子质量保留指数保留时间/s迁移时间/ms酮类12,3-丁二酮C431038C4H6O286.157347.1771.184 6222,3-戊二酮C600146C5H8O2100.1705.579.2951.209 0132-丁酮C78933C4H8O72.1573.347.241.051 2542-丁酮二聚体C78933C4H8O72.1588.550.2871.251 0452-庚酮C110430C7H14O114.2886.4210.4741.261 2962-庚酮二聚体C110430C7H14O114.2883.7208.0741.627 2772-己酮C591786C6H12O100.2787.2123.3231.516 518环戊酮C120923C5H8O84.1787.6123.6581.319 229羟基丙酮C116096C3H6O274.1678.268.3261.045 39102-戊酮C107879C5H10O86.1684.669.6071.125 17112-戊酮二聚体C107879C5H10O86.1681.368.9471.376 8123-羟基-2-丁酮C513860C4H8O288.1705.779.3951.060 81133-羟基-2-丁酮二聚体C513860C4H8O288.1704.678.8161.336 3144-甲基-2-戊酮C108101C6H12O100.2724.689.341.488 94154-甲基-3-戊烯-2-酮二聚体C141797C6H10O98.1787.2123.3231.452 74164-甲基-3-戊烯-2-酮C141797C6H10O98.1805.9139.7041.461 11酯类17巴豆酸乙酯C623701C6H10O2114.1832.7163.2781.178 52182-甲基丁酸乙酯C7452791C7H14O2130.2841.7171.2211.250 619丙酸乙酯C105373C5H10O2102.1700.276.5121.462 520丙酸正丙酯C106365C6H12O2116.2803.8137.8921.585 3621丙烯酸乙酯C140885C5H8O2100.1701.977.3971.398 6122丁酸乙酯C105544C6H12O2116.2791.1126.7321.206 4623丁酸乙酯二聚体C105544C6H12O2116.2789.6125.3471.561 3324正己酸乙酯C123660C8H16O2144.21001.8382.1151.334 4425乙酸丁酯C123864C6H12O2116.2799.7134.2661.244 9126乙酸甲酯C79209C3H6O274.1556.543.8741.188 5127乙酸乙酯C141786C4H8O288.1613.355.2831.102 6628乙酸乙酯二聚体C141786C4H8O288.1611.754.9521.343 7829乙酸异戊酯C123922C7H14O2130.2867.4193.751.310 48醇类30正丙醇C71238C3H8O60.156244.9611.253 7131叔丁醇C75650C4H10O74.1527.938.1181.132 8332糠醇C98000C5H6O298.1884.1208.4271.363 8633异丁醇C78831C4H10O74.1644.461.5441.381 28醛类34异戊醛 C590863C5H10O86.1642.661.1671.175 4935异戊醛二聚体C590863C5H10O86.1653.163.2831.412 6136正丁醛C123728C4H8O72.1598.852.3711.299 0537正己醛C66251C6H12O100.2786.8122.9721.258 8438庚醛C111717C7H14O114.2900.2227.321.329 8939正戊醛C110623C5H10O86.1691.571.9321.192 32402-甲基丙烯醛C78853C4H6O70.1569.646.4921.223 02其他类41苯乙烯C100425C8H8104.2867.2193.6021.415 6342吡啶C110861C5H5N79.1725.990.0321.243 5443二甲基二硫C624920C2H6S294.2769.5112.9061.125 74442-乙基-5-甲基吡嗪C13360640C7H10N2122.21 003.9387.3151.672 8845烯丙基腈C109751C4H5N67.1631.358.8881.249 1646甲基叔丁基醚C1634044C5H12O88.1561.644.8771.123 13
采用不同贮藏条件下牦牛乳中挥发性物质进行聚类热图分析,可以更好地了解在贮藏期间不同化合物之间的差异和相似之处(图5)。根据热图,在垂直方向上将牦牛乳样品根据贮藏条件的不同分为A和B两组,其中A组又分为A1和A2两组,可以看出-18 ℃贮藏的样品与新鲜牦牛乳的风味相似性更高,而牦牛乳样品在B组时已出现腐败变质、风味劣变。同时牦牛乳在不同温度贮藏期间挥发性物质也存在明显差异,A组中3-羟基-2-丁酮二聚体、叔丁醇、丁酸乙酯、4-甲基-2-戊酮和乙酸乙酯二聚体等含量相对较低,然而,这些化合物主要存在于B组,且随着贮藏时间的延长而增加。这些结果表明,牦牛乳中的挥发性物质在不同的贮藏时间会发生变化,并受贮藏温度的影响较大。
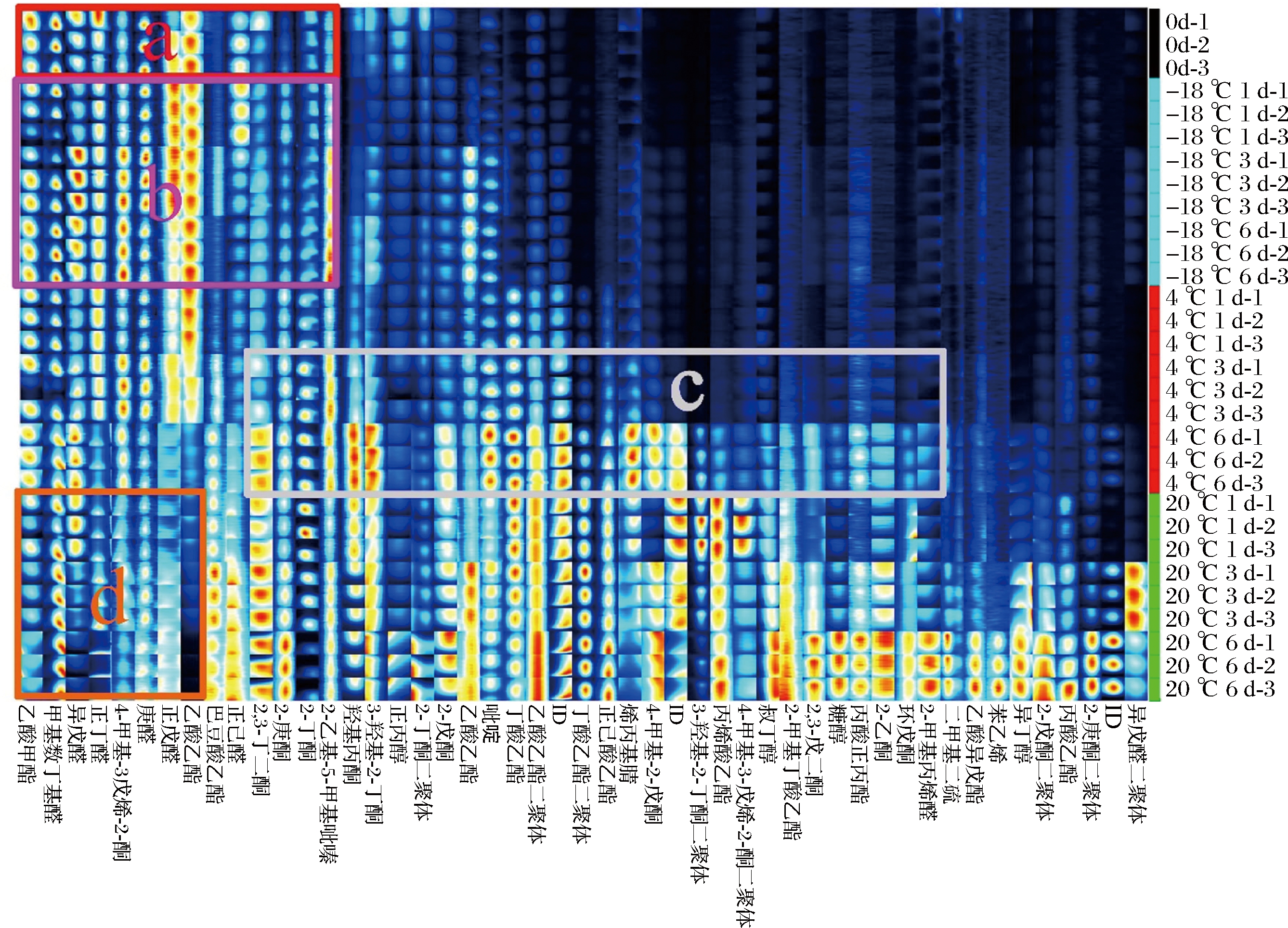
图4 牦牛乳在不同温度贮藏期间气相离子迁移谱图中挥发性物质的指纹图
Fig.4 Gallery Plot of volatile compound peaks selected from the GC-IMS spectra of the yak milk during storage at different temperatures 注:ID表示未定性挥发性物质(下同)

图5 牦牛乳在不同温度贮藏期间挥发性物质的聚类热图
Fig.5 Heat map of volatile compounds in yak milk during storage at different temperatures
2.2.3 基于主成分分析(principal component analysis,PCA)和OPLS-DA对牦牛乳腐败标志物的筛选
通过Dynamic PCA插件对牦牛乳在不同贮藏条件下的挥发性物质进行PCA。如图6所示,基于挥发性物质含量的差异,PCA可以将-18、4、20 ℃不同组样品进行有效区分(累计方差贡献率为82%)。-18 ℃贮藏1、3、6 d的样品和新鲜牦牛乳表现出相似的风味;其次是4 ℃贮藏1 d和3 d的样品;而在4 ℃贮藏6 d和20 ℃贮藏1、3、6 d的样品与新鲜牦牛乳样品距离较大,表明与其存在较大差异。该结果说明牦牛乳在贮藏过程中温度越低、时间越短,其原有的风味物质保持的越好,且在4 ℃贮藏6 d和20 ℃贮藏1 d及以后风味出现明显劣变,使人不可接受,这与GC-IMS指纹图谱和聚类分析结果一致。
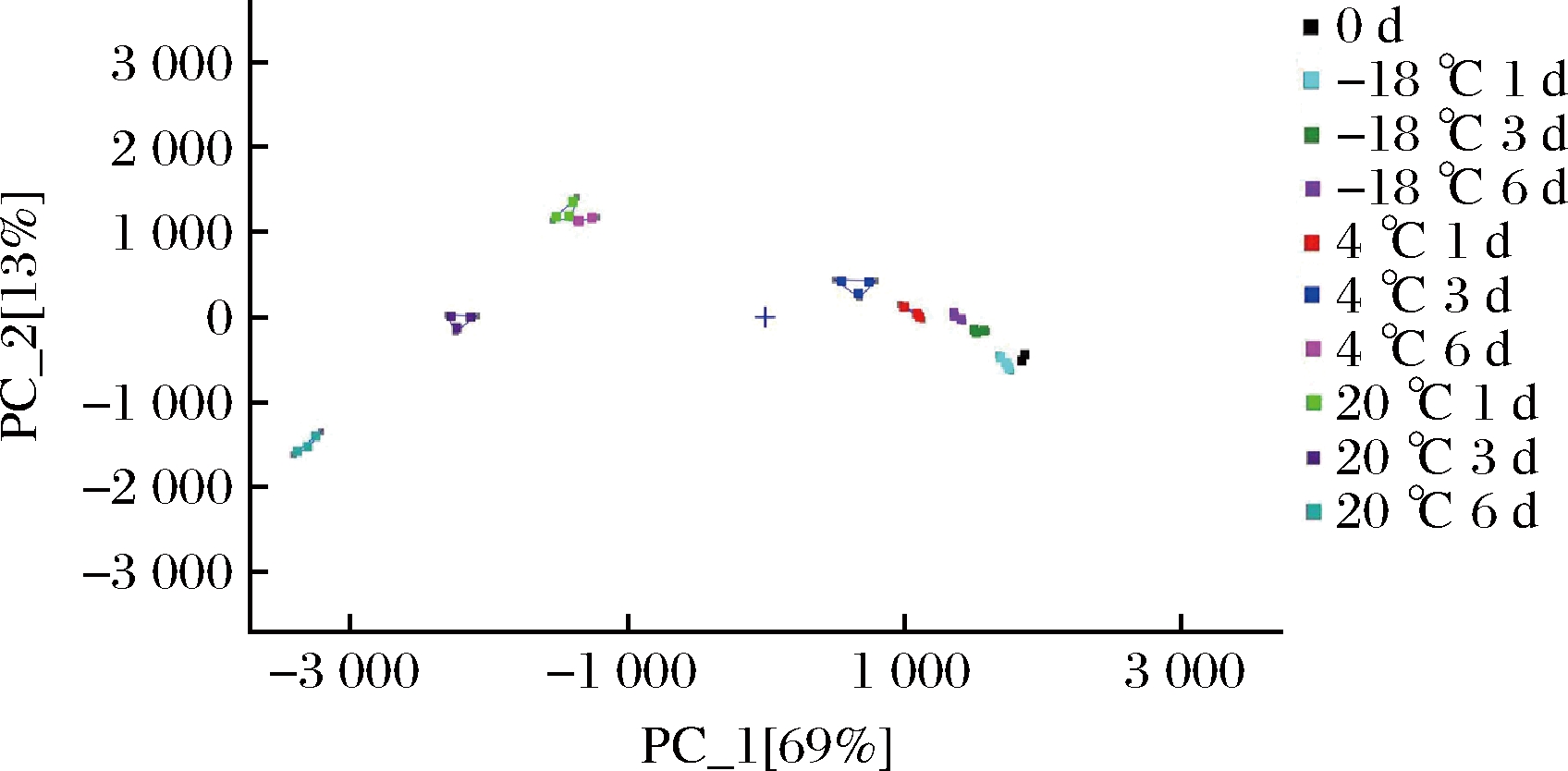
图6 牦牛乳在不同温度贮藏期间挥发性物质的PCA图
Fig.6 PCA plot of volatile compounds in yak milk during storage at different temperatures
图7-a为牦牛乳在不同贮藏条件下的挥发性物质的OPLS-DA得分图,与PCA显示出同样的趋势,且新鲜牦牛乳样品与-18 ℃样品点更为集中。因为-18 ℃冻藏样品和新鲜样品风味物质相近,室温20 ℃贮藏1 d开始已经出现腐败现象,所以选择4 ℃冷藏期间(1、3、6 d)的挥发性物质进行牦牛乳早期腐败标志物的筛选。对4 ℃冷藏期间OPLS-DA结果进行200次置信检验,图7-d为 OPLS-DA 的置信检验结果图,结果显示置信检验良好。通过筛选OPLS-DA结果中 VIP>1.0的变量作为潜在的牦牛乳早期腐败变质的标志物。通过筛选得到10种已定性的挥发性物质,且主要以酮类为主,分别为:2-丁酮、3-羟基-2-丁酮、4-甲基-2-戊酮、羟基丙酮、异戊醛、甲基叔丁基醚、乙酸乙酯、丁酸乙酯、叔丁醇和吡啶。而除了异戊醛、甲基叔丁基醚,其他8种物质均在牦牛乳指纹图谱腐败变质的区域c中被标记。M RQUEZ-SILLERO等[29]通过顶空-集束毛细管气相色谱-离子迁移谱监测超高温灭菌乳脂质氧化产生的挥发性不良风味用于评估贮存时间,发现己醛、2-丁酮、丙酮和二甲基硫醚4种脂质氧化产物在36 d的贮藏期间浓度不断增加,可用于其新鲜度的评判。同样在本实验室前期对荷斯坦奶牛乳和犏牛乳冷藏过程中挥发性物质分析,确定2-丁酮和吡啶为牛乳新鲜度检测的标记物。研究表明,酮类和醇类异味物质由亚油酸在脂肪氧化酶E2及裂解酶的作用下经过一系列氧化降解反应产生;醛类异味物质的产生主要源自亚麻酸,亚麻酸在脂肪氧化酶、裂解酶、氢化酶及异构酶的作用下可生成 C6及 C9的羰基化合物[30]。同时具有腐臭味和汗臭味物质的增加可归因于游离脂肪酸浓度的增加[31]。
RQUEZ-SILLERO等[29]通过顶空-集束毛细管气相色谱-离子迁移谱监测超高温灭菌乳脂质氧化产生的挥发性不良风味用于评估贮存时间,发现己醛、2-丁酮、丙酮和二甲基硫醚4种脂质氧化产物在36 d的贮藏期间浓度不断增加,可用于其新鲜度的评判。同样在本实验室前期对荷斯坦奶牛乳和犏牛乳冷藏过程中挥发性物质分析,确定2-丁酮和吡啶为牛乳新鲜度检测的标记物。研究表明,酮类和醇类异味物质由亚油酸在脂肪氧化酶E2及裂解酶的作用下经过一系列氧化降解反应产生;醛类异味物质的产生主要源自亚麻酸,亚麻酸在脂肪氧化酶、裂解酶、氢化酶及异构酶的作用下可生成 C6及 C9的羰基化合物[30]。同时具有腐臭味和汗臭味物质的增加可归因于游离脂肪酸浓度的增加[31]。
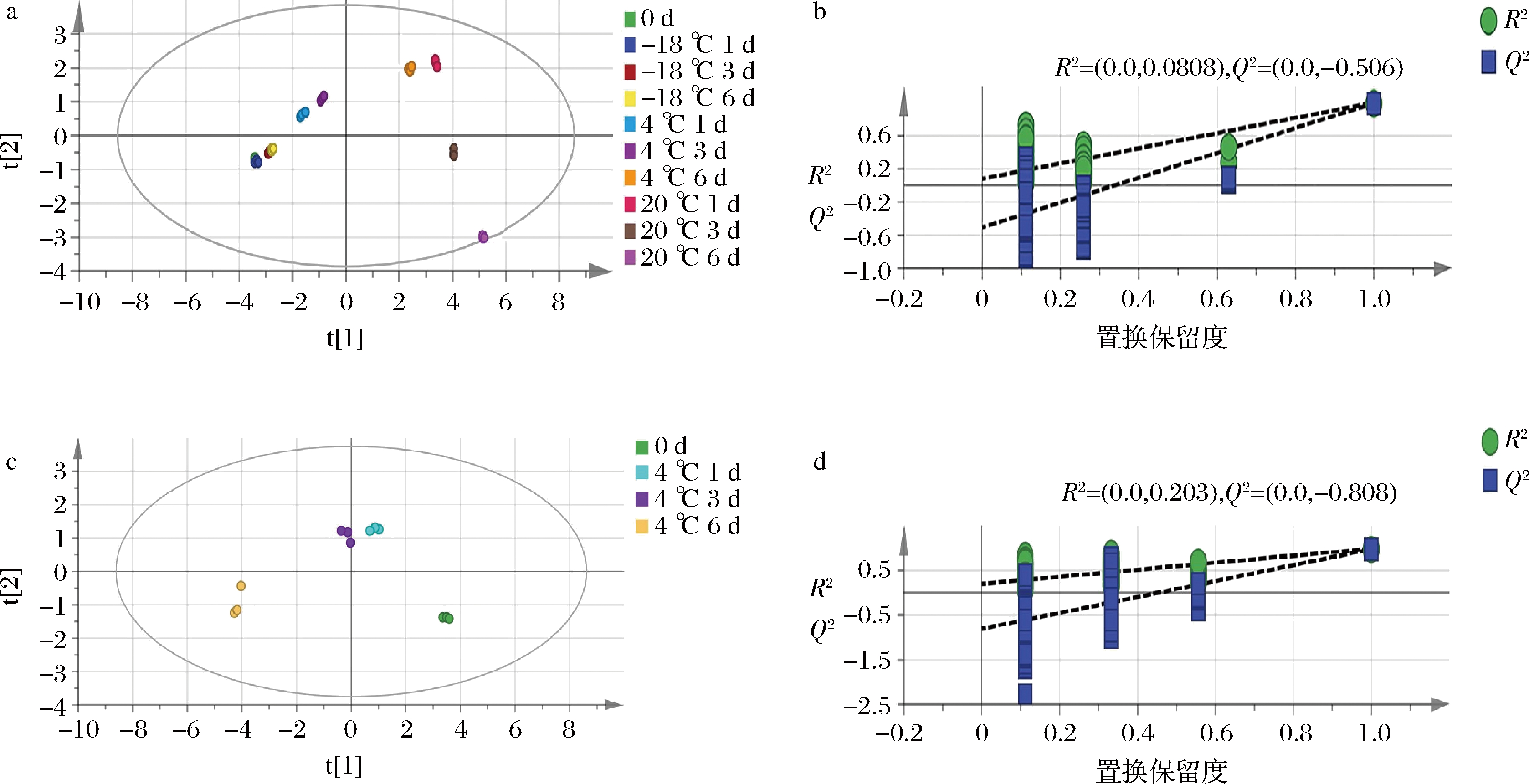
a-不同温度贮藏期间挥发性物质的OPLS-DA得分图;b-不同温度贮藏期间挥发性物质的置信检验结果; c-4 ℃贮藏期间挥发性物质的OPLS-DA得分图;d-4 ℃贮藏期间挥发性物质的置信检验结果
图7 牦牛乳在不同温度贮藏期间挥发性物质的OPLS-DA得分图和置信检验结果
Fig.7 OPLS-DA scores confidence analysis of volatile compounds in yak milk during storage at different temperatures
3 结论
对于乳及乳制品而言,贮藏温度及时间非常重要。通过对比新鲜牦牛乳在不同贮藏温度下的品质指标,发现-18 ℃冻藏的样品在pH、酸度、蛋白质、脂肪和乳糖方面的指标均优于4 ℃冷藏和20 ℃贮藏样品,且在4 ℃冷藏中后期和20 ℃贮藏1 d开始牦牛乳出现明显的腐败变质。在不同温度贮藏期间共定性出46种挥发性物质,主要包括酮类、酯类、醛类及醇类。通过主成分和聚类分析,发现-18 ℃冻藏样品与新鲜牦牛乳风味更相近,其次是4 ℃冷藏1 d和3 d的样品,而从4 ℃ 冷藏6 d和20 ℃贮藏1 d开始,风味明显劣变,使人不可接受。可见低温贮藏可以确保乳品具有适宜的口感和较高的营养价值。通过绘制GC-IMS指纹图谱,明析了牦牛乳在不同温度贮藏期间腐败和变质的特征峰区域。结合OPLS-DA筛选得到2-丁酮、3-羟基-2-丁酮、4-甲基-2-戊酮、羟基丙酮、异戊醛、甲基叔丁基醚、乙酸乙酯、丁酸乙酯、叔丁醇和吡啶10种物质与牦牛乳早期的腐败变质有关(VIP>1),它们可能作为牦牛乳新鲜度监测的标志物。然而,由于与风味物质形成有关的生物化学变化的复杂性,这些风味物质在原料乳冷藏期间的的具体变化机制还需结合代谢组学与宏基因组学进行进一步探索。
[1] FENG D, WANG J, JI X J, et al.HS-GC-IMS detection of volatile organic compounds in yak milk powder processed by different drying methods[J].LWT-Food Science and Technology, 2021, 141:110855.
[2] 王雅琼, 马晓玲, 包国媛.不同温度储藏条件下青藏高原某牧场牦牛牛乳中细菌的分离与鉴定[J].青海科技, 2022, 29(1):70-75.
WANG Y Q, MA X L, BAO G Y.Isolation and identification of bacteria from milk of yak in qinghai-tibet plateau under different storage temperature[J].Qinghai Science and Technology, 2022, 29(1):70-75.
[3] ZIYAINA M, RASCO B, COFFEY T, et al.Correlation of volatile compound concentrations with bacterial counts in whole pasteurised milk under various storage conditions[J].International Journal of Dairy Technology, 2019, 72(1):36-46.
[4] SALUSTIANO V C, ANDRADE N J, SOARES N F F, et al.Contamination of milk with Bacillus cereus by post-pasteurization surface exposure as evaluated by automated ribotyping[J].Food Control, 2009, 20(4):439-442.
[5] MANDAL P K, BISWAS A K, CHOI K, et al.Methods for rapid detection of foodborne pathogens:An overview[J].American Journal of Food Technology, 2011, 6(2):87-102.
[6] MOHANIA D, NAGPAL R, KUMAR M, et al.Molecular approaches for identification and characterization of lactic acid bacteria[J].Journal of Digestive Diseases, 2008, 9(4):190-198.
[7] LEE S, KIM G, MOON J.Performance improvement of the one-dot lateral flow immunoassay for aflatoxin B1 by using a smartphone-based reading system[J].Sensors, 2013, 13(4):5 109-5 116.
[8] ZIYAINA M, RASCO B, COFFEY T, et al.Colorimetric detection of volatile organic compounds for shelf-life monitoring of milk[J].Food Control, 2019, 100:220-226.
[9] 王媛媛, 剧柠, 苟萌, 等.宏基因组学探究原料乳冷藏过程菌群变化规律[J].农业工程学报, 2020, 36(22):333-340.
WANG Y Y, JU N, GOU M, et al.Metagenomics approach to explore the changes of bacterial community in raw milk during refrigerated storage[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(22):333-340.
[10] RODR GUEZ-MAECKER R, VYHMEISTER E, MEISEN S, et al.Identification of terpenes and essential oils by means of static headspace gas chromatography-ion mobility spectrometry[J].Analytical and Bioanalytical Chemistry, 2017, 409(28):6 595-6 603.
GUEZ-MAECKER R, VYHMEISTER E, MEISEN S, et al.Identification of terpenes and essential oils by means of static headspace gas chromatography-ion mobility spectrometry[J].Analytical and Bioanalytical Chemistry, 2017, 409(28):6 595-6 603.
[11] GERHARDT N, BIRKENMEIER M, SANDERS D, et al.Resolution-optimized headspace gas chromatography-ion mobility spectrometry (HS-GC-IMS) for non-targeted olive oil profiling[J].Analytical and Bioanalytical Chemistry, 2017, 409(16):3 933-3 942.
[12] LI H B, KANG X F, WANG S, et al.Early detection and monitoring for Aspergillus flavus contamination in maize kernels[J].Food Control, 2021, 121:107636.
[13] JURADO-CAMPOS N, GARC A-NICOL
A-NICOL S M, PASTOR-BELDA M, et al.Exploration of the potential of different analytical techniques to authenticate organic vs.conventional olives and olive oils from two varieties using untargeted fingerprinting approaches[J].Food Control, 2021, 124:107828.
S M, PASTOR-BELDA M, et al.Exploration of the potential of different analytical techniques to authenticate organic vs.conventional olives and olive oils from two varieties using untargeted fingerprinting approaches[J].Food Control, 2021, 124:107828.
[14] GU S, CHEN W, WANG Z H, et al.Rapid determination of potential aflatoxigenic fungi contamination on peanut kernels during storage by data fusion of HS-GC-IMS and fluorescence spectroscopy[J].Postharvest Biology and Technology, 2021, 171:111361.
[15] CHEN T, LIU C Y, MENG L L, et al.Early warning of rice mildew based on gas chromatography-ion mobility spectrometry technology and chemometrics[J].Journal of Food Measurement and Characterization, 2021, 15(2):1 939-1 948.
[16] 李娟, 任芳, 甄大卫, 等.气相色谱-离子迁移谱分析乳制品挥发性风味化合物[J].食品科学, 2021, 42(10): 235-240.
LI J, REN F, ZHEN D W, et al.Analysis of volatile flavor compounds dairy products by gas chromatography-ion mobility spectrometry[J].Food Science, 2021, 42(10): 235-240.
[17] 贾庆超, 孔欣欣.市售酸奶在贮藏过程中品质的变化[J].中国乳品工业, 2020, 48(6):26-30.
JIA Q C, KONG X X.Study on the quality changes of commercial yogurt during storage[J].China Dairy Industry, 2020, 48(6):26-30.
[18] ADDUCI F, ELSHAFIE H S, LABELLA C, et al.Abatement of the clostridial load in the teats of lactating cows with lysozyme derived from donkey milk[J].Journal of Dairy Science, 2019, 102(8): 6 750-6 755.
[19] LARA-AGUILAR S, ALCAINE S D.Lactose oxidase:A novel activator of the lactoperoxidase system in milk for improved shelf life[J].Journal of Dairy Science, 2019, 102(3):1 933-1 942.
[20] 马作霖, 甘伯中, 乔海军, 等.不同胎次及产奶月份甘南黑牦牛乳常规营养成分比较研究[J].甘肃农业大学学报, 2011, 46(6):6-10.
MA Z L, GAN B Z,QIAO H J, et al.The influence of different parities and lactation months on the nutrient contents of black yak milk from Gannan[J].Journal of Gansu Agricultural University, 2011, 46(6):6-10.
[21] 吴海玥, 金鑫燕.青海省泽库县高原型牦牛不同月份乳成分对比分析[J].青海畜牧兽医杂志, 2020, 50(2):52-56.
WU H Y, JIN X Y.Comparative analysis of milk composition with different months for Qinghai plateau yak[J].Chinese Qinghai Journal of Animal and Veterinary Sciences, 2020, 50(2):52-56.
[22] 张超越, 张雪颖, 胡锦华, 等.人乳脂肪球在低温储存下的结构变化及其对人乳风味的影响[J].食品与发酵工业, 2021, 47(17):111-118.
ZHANG C Y, ZHANG X Y, HU J H, et al.Structural changes of human milk fat globules duringlow temperature storage and its effect on flavor of human milk[J].Food and Fermentation Industries,2021,47(17):111-118.
[23] GARC A-LARA N R, ESCUDER-VIECO D, GARCíA-ALGAR O, et al.Effect of freezing time on macronutrients and energy content of breastmilk[J].Breastfeeding Medicine, 2012, 7(4):295-301.
A-LARA N R, ESCUDER-VIECO D, GARCíA-ALGAR O, et al.Effect of freezing time on macronutrients and energy content of breastmilk[J].Breastfeeding Medicine, 2012, 7(4):295-301.
[24] 胡婕. 原料乳冷藏过程中质量变化规律及其微生物群落演替研究[D].银川:宁夏大学, 2019.
Hu, J.Study on the quality changes and microbial community succession of raw milk during refrigeration[D].Yinchuan:Ningxia University, 2019.
[25] ARCE L, GALLEGOS J, GARRIDO-DELGADO R, et al.Ion mobility spectrometry a versatile analytical tool for metabolomics applications in food science[J].Current Metabolomics, 2015, 2(4):264-271.
[26] LE QUÉRÉ J L, SEPTIER C, DEMAIZI RES D, et al. Flavour Science[M]. Amsterdam: Elsevier, 1996:325-330.
RES D, et al. Flavour Science[M]. Amsterdam: Elsevier, 1996:325-330.
[27] IRIGOYEN A, ORTIGOSA M, JUANSARAS I, et al.Influence of an adjunct culture of Lactobacillus on the free amino acids and volatile compounds in a Roncal-type ewe′s-milk cheese[J].Food Chemistry, 2007, 100(1):71-80.
[28] 马瑞娟, 许英瑞, 薛元泰, 等.牦牛乳风味物质及影响因素研究进展[J].食品工业科技, 2020, 41(10):363-368.
MA R J, XU Y R, XUE Y T, et al.Research progress on flavor substancesand influencing factors of yak milk[J].Science and Technology of Food Industry,2020, 41(10):363-368.
[29] M RQUEZ-SILLERO I, C
RQUEZ-SILLERO I, C RDENAS S, SIELEMANN S, et al.On-line headspace-multicapillary column-ion mobility spectrometry hyphenation as a tool for the determination of off-flavours in foods[J].Journal of Chromatography A, 2014, 1 333:99-105.
RDENAS S, SIELEMANN S, et al.On-line headspace-multicapillary column-ion mobility spectrometry hyphenation as a tool for the determination of off-flavours in foods[J].Journal of Chromatography A, 2014, 1 333:99-105.
[30] 张丽娜, 瞿婧妍, 尹利昂, 等.不同冻藏条件对人乳脂质及挥发性风味物质的影响[J].食品科学,2022,43(4):135-143.
ZHANG L N, QU J Y, YIN L ANG, et al.Effects of different frozen storage on lipids and volatile compounds of human milk[J].Food Science,2022,43(4):135-143.
[31] HUNG H Y, HSU Y Y, SU P F, et al.Variations in the rancid-flavor compounds of human breastmilk under general frozen-storage conditions[J].BMC Pediatrics, 2018, 18(1):1-7.