酱香型白酒是中国蒸馏酒的基本香型之一,具有“酱香突出,幽雅细腻,酒体醇厚,回味悠久,空杯留香”的酒体风格,深受广大消费者的喜爱。酱香酒的传统酿造工艺以优质的糯高粱为原料,用小麦制成的高温大曲为糖化发酵剂,两次投料并高温堆积,采用条石筑的窖池发酵,经过一年的9次蒸煮、8次发酵、7次取酒,并长时间贮存后勾调而成[1]。
近年来,在对白酒中健康因子探寻过程中发现,白酒中的酚酸、吡嗪、酯、萜烯类等风味活性物质有益于人体健康。氨基酸作为高级醇类、酯类、吡嗪类等酱香风味物质的重要前体物质,对酱香型白酒风味及口感的形成起着非常重要的作用[2]。酿酒原料中的氨基酸被微生物分解成游离氨基酸,经多种方式脱氨形成酮酸,再进一步产生羰基化合物、高级醇等风味物质[3]。研究表明,氨基酸降解代谢途径是酱香型白酒酿造过程中合成高级醇的重要途径之一[4],白酒中的异丁醇来源于缬氨酸,而亮氨酸、苏氨酸、苯丙氨酸分别是形成异戊醇、1-丙醇、2-苯乙醇的前体氨基酸,精氨酸通过精氨酸脱亚氨基酶途径(arginine deiminase pathway, ADI途径)生成氨基甲酸乙酯,酱香白酒重要香气成分吡嗪类化合物的杂环氮原子来自α-氨基酸,此外,生物胺也与氨基酸含量有很大关系[5-7]。
目前,对于白酒氨基酸的研究多集中于产生机制、调节机制的研究,检测方法主要为氨基酸自动分析仪法和柱前衍生高效液相色谱法[8-10]。由于氨基酸具有高极性、低挥发性且不含有紫外及荧光吸收的特定生色基团,在对其进行检测分析时,为提高检测灵敏度,通常需要进行衍生化处理。上述两种分析方法均存在衍生物不稳定、反应条件繁琐、操作时间长等问题,不利于氨基酸的快速分析[11]。在其他食品及制药研究领域,学者采用毛细管电泳法[12]、离子色谱法[13]、液相色谱质谱法[14-18]等分析生物样本、中药材等物质中的氨基酸含量。其中,超高效液相色谱质谱法具有操作简便、定量准确、灵敏度高、特异性好、通量高的优势,样品无需衍生化即可直接上机检测[18]。
实验旨在开发一种分析速度快、灵敏度高、稳定性强的测定白酒制曲原料及大曲样品中氨基酸含量的方法,并初步探究白酒制曲过程中氨基酸变化规律,为酱香型白酒生产工艺改进和产品质量提升提供指导,也为酱香型白酒非挥发性风味物质形成机理的研究提供可以参考的检测技术。
1 材料与方法
1.1 材料与试剂
酱香型大曲、小麦样品由茅台镇某酱酒企业提供。
19种游离氨基酸标准品,纯度>98%,均为L型,包括天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、精氨酸(Arg)、甘氨酸(Gly)、苏氨酸(Thr)、脯氨酸(Pro)、丙氨酸(Ala)、缬氨酸(Val)、甲硫氨酸(Met)、胱氨酸(Cys-Cys)、异亮氨酸(Ile)、亮氨酸(Leu)、色氨酸(Trp)、组氨酸(His)、苯丙氨酸(Phe)、半胱氨酸(Cys)、酪氨酸(Tyr)、谷氨酰胺(Gln),上海吉至生化科技有限公司;乙腈、甲酸,质谱纯,德国Merck公司;甲酸铵,色谱纯,上海阿拉丁生化科技股份有限公司;水为瓶装纯净水,杭州娃哈哈集团有限公司。
1.2 仪器与设备
Qtrap 5500型超高效液相色谱质谱联用仪,配ESI离子源及Analyst软件,美国AB Sciex公司;XS105型电子天平,瑞士Mettle Rtoledo公司;Vortex Genie2型涡旋振荡器,美国Scientific Industries公司;Legend Micro 17型高速离心机,美国Thermo fisher公司;KQ-500DV型超声波清洗仪,昆山市超声仪器有限公司。
1.3 实验方法
1.3.1 标准溶液的配制
分别精密称取上述19种氨基酸对照品各10 mg(精确至0.1 mg),置于10 mL量瓶中,加入0.2%(体积分数)甲酸水溶液超声振荡溶解并定容,最终得到质量浓度为1.0 mg/mL的单一对照品储备液,于-20 ℃冰箱中保存。所需的系列浓度混合标准溶液均由储备液稀释得到。
1.3.2 样品的制备
精密称取样品0.5 g(精确至0.1 mg),加入20 mL 0.2%(体积分数)的甲酸水溶液,涡旋振荡10 min,超声提取30 min,然后取上清液于12 000 r/min离心10 min,吸取上清液1 mL经甲酸水溶液适当稀释后,置于进样小瓶中,即得到待测样品。
1.3.3 色谱质谱条件
1.3.3.1 色谱条件
色谱柱:BEH Amide(沃特世,2.1 mm×100 mm,1.7 μm);柱温40 ℃;流速0.3 mL/min;进样量2 μL;流动相A:0.2%甲酸水(含5 mmol/L甲酸铵)溶液,流动相B:95%乙腈(含0.2%甲酸水及5 mmol/L甲酸铵);梯度洗脱程序:0~2.0 min:80%~75% B,2.0~3.0 min:75%~55% B,3.01~5.0 min:55%~80% B,5.0~7.0 min:80%B。
1.3.3.2 质谱条件
离子源:电喷雾离子源(ESI);扫描方式:正离子扫描;检测方式:多反应监测(MRM)模式;离子化电压(electron energy,IS):5 500 V;雾化温度(TEM):550 ℃;气帘气(CUR):35 L/min;雾化器(Gas1):55 L/min;辅助加热气:55 L/min;碰撞气压力CAD:medium。
2 结果与分析
2.1 质谱条件优化
氨基酸带有氨基和羧基,具有两性化合物的性质,实验发现其在正离子模式下响应更强,因此实验采用正离子检测模式。将各氨基酸分别配成一定浓度的标准溶液,采用MS-only模式通过质谱针泵进样,首先进行Q1全扫,以各目标化合物准确的[M+H]+峰为母离子,在Product Ion模式下找到子离子,最后通过MRM模式进行二级质谱优化,得到优化后各化合物的Q1电压、碰撞电压以及Q3电压等参数。所得各氨基酸的质谱参数见表1。
2.2 色谱条件优化
结合相关文献[14-17]中的检测方法,实验探索了不同色谱条件下19种氨基酸的色谱峰分离情况及响应值,包括不同色谱柱(BEH Amide和HILIC)、不同流动相体系(乙腈、甲醇)以及在流动相中加入不同添加剂(甲酸、乙酸、甲酸铵)。实验结果表明,使用HILIC色谱柱检测19种氨基酸时,色谱峰集中在0.5~1.0 min出峰,分离效果较差,BEH Amide色谱柱的分离效果优于HILIC色谱柱,因此选用BEH Amide色谱柱开展后续实验。另外,采用添加0.2%甲酸水的乙腈体系时待测物的响应高于甲醇体系或无添加剂的体系,在流动相中加入5 mmol/L甲酸铵可改善亮氨酸和异亮氨酸的分离度,因此采用添加5 mmol/L甲酸铵的0.2%甲酸水溶液为A流动相,添加5 mmol/L甲酸铵及0.2%甲酸的95%(体积分数)乙腈为B流动相。在优化条件下检测的19种氨基酸的提取离子流图见图1。
表1 十九种氨基酸质谱参数优化结果
Table 1 Optimization of mass spectrometry parameters for 19 amino acids
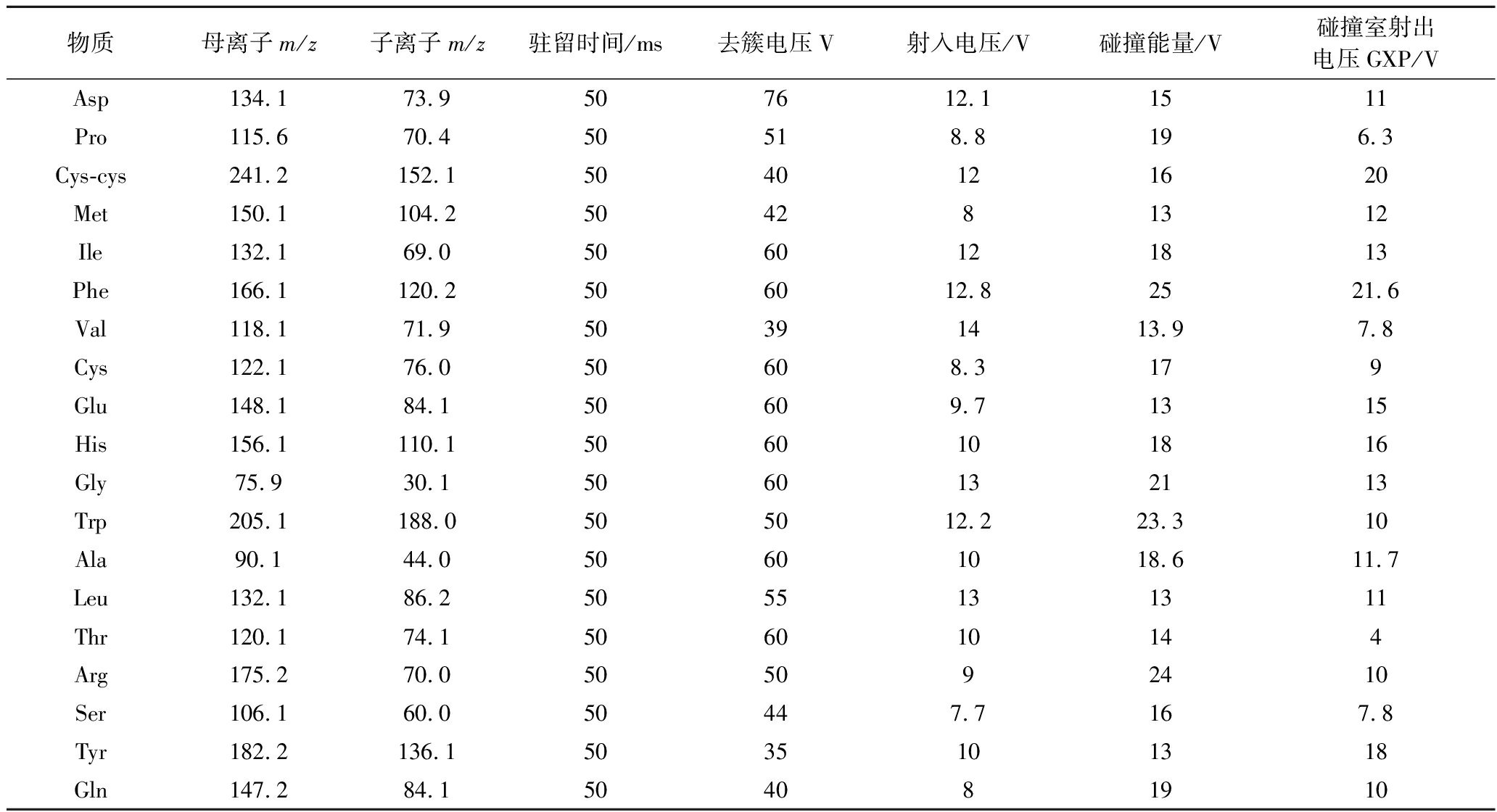
物质母离子m/z子离子m/z驻留时间/ms去簇电压V射入电压/V碰撞能量/V碰撞室射出电压GXP/VAsp134.173.9507612.11511Pro115.670.450518.8196.3Cys-cys241.2152.15040121620Met150.1104.2504281312Ile132.169.05060121813Phe166.1120.2506012.82521.6Val118.171.950391413.97.8Cys122.176.050608.3179Glu148.184.150609.71315His156.1110.15060101816Gly75.930.15060132113Trp205.1188.0505012.223.310Ala90.144.050601018.611.7Leu132.186.25055131311Thr120.174.1506010144Arg175.270.0505092410Ser106.160.050447.7167.8Tyr182.2136.15035101318Gln147.284.1504081910
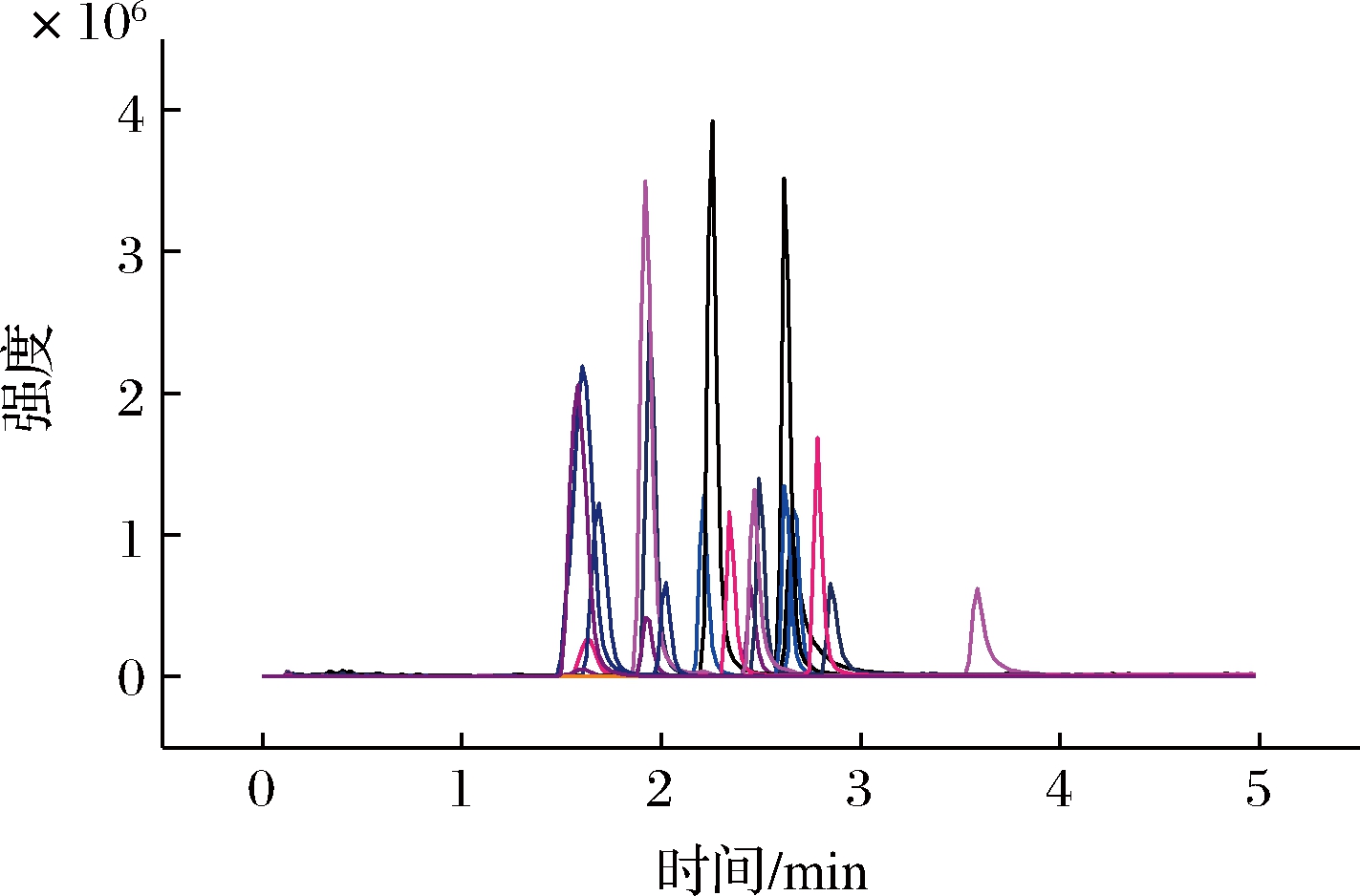
图1 十九种氨基酸提取离子流图
Fig.1 Extracted ion chromatography of 19 amino acids
2.3 方法学考察
2.3.1 线性、定量限、检出限
分别精密量取“1.3.1”中对照品储备液适量,稀释为不同质量浓度梯度的系列标准溶液,按“1.3.3”的方法测定,以质量浓度为横坐标,峰面积为纵坐标,建立线性回归方程。将信噪比S/N=3所对应的待测物的质量浓度定为检出限(limit of detection, LOD)。将信噪比S/N=10所对应的待测物的质量浓度定为定量限(limit of quantitation, LOQ)。方法的线性范围、回归方程、相关系数等结果见表2。结果表明,待测物浓度与响应之间线性关系良好,线性系数R2>0.998。
2.3.2 重复性、精密度
分别精密称取大曲样品6份,按照“1.3.2”的方法制备,按“1.3.3”方法进行测定,6份样品检测结果的相对标准偏差(relative standard deviation, RSD)即为方法的重复性。
短期精密度:精密移取线性范围项下的中间质量浓度混合对照品溶液,按“1.3.3”方法进行测定,重复进样6次并计算结果的RSD,即为短期精密度。
长期精密度:分别在0、4、8、16、24、48 h取同一样品溶液,按“1.3.3”方法进行测定,6次检测浓度的RSD值即为长期稳定性。
测定的平行样品中,19种氨基酸质量浓度的RSD为0.6%~6.5%,短期精密度RSD<3.4%,长期精密度的RSD<6.5%,表明方法的重复性和稳定性良好(表3)。
2.3.3 加标回收率
精密称取已知含量的样品9份,按其中各成分质量浓度的低、中、高水平(50%、80%、100%)分别加入19种氨基酸标准品溶液,按“1.3.2”的方法制备每一质量浓度的溶液各3份,按“1.3.3”的方法进行测定,计算3组不同质量浓度的加标回收率。样品中19种氨基酸的加标回收率计算结果如表4所示,回收率结果为80%~120%,即在可接受范围内。
表2 十九种游离氨基酸的线性关系、检出限及定量限
Table 2 The linear relationship,LOD, and LOQ of 19 amino acids

物质保留时间/min线性方程线性关系(R2)线性范围/(ng·mL-1)LOD/(ng·mL-1)LOQ/(ng·mL-1)Ala1.43y=1 410x+53 1000.999 2 5~500 2.78 5.56 Trp1.66y=8 300x+38 1000.999 8 10~1 0002.42 4.85 Leu1.71y=186 000x+501 0000.998 8 5~500 0.84 5.04 Ile1.72y=15 900x+101 0000.999 5 20~1 0002.27 11.34 Phe1.75y=59 200x+134 0000.999 0 5 5000.38 2.26 Met1.98y=18 400+86 4000.999 7 50~1 0004.42 22.12 Val1.98y=56 300x+140 0000.999 25~500 0.35 2.12 Tyr2.06y=13 700x+51 4000.999 4 10~1 0000.50 3.00 Pro2.22y=5 160x+103 0000.999 1 5~500 1.02 6.13 Cys2.36y=7 110x+21 0000.999 5 10~1 0002.81 5.62 Glu2.49y=13 500x+98 8000.999 5 20~1 0002.74 5.47 Gly2.49y=1 890x+44 2000.999 0 50~1 0005.86 29.32 Thr2.52y=16 900x+103 0000.999 6 5~500 0.44 2.62 Gln2.63y=7 800x+38 4000.999 7 20~1 0000.51 3.06 Asp2.65y=10 300x+187 0000.998 8 50~1 0004.61 23.04 Ser2.67y=16 900x+360 0000.999 1 20~1 0006.07 15.18 Arg2.86y=26 600x+82 0000.998 3 5~500 2.76 5.52 His2.91y=34 800x+392 0000.998 8 20~1 0004.26 21.32 Cys-Cys3.56y=3 470x+20 5000.999 5 10~1 0000.72 4.34
表3 方法的重复性和稳定性结果(n=6)
Table 3 The repeatability and instrument precision of the method (n=6)
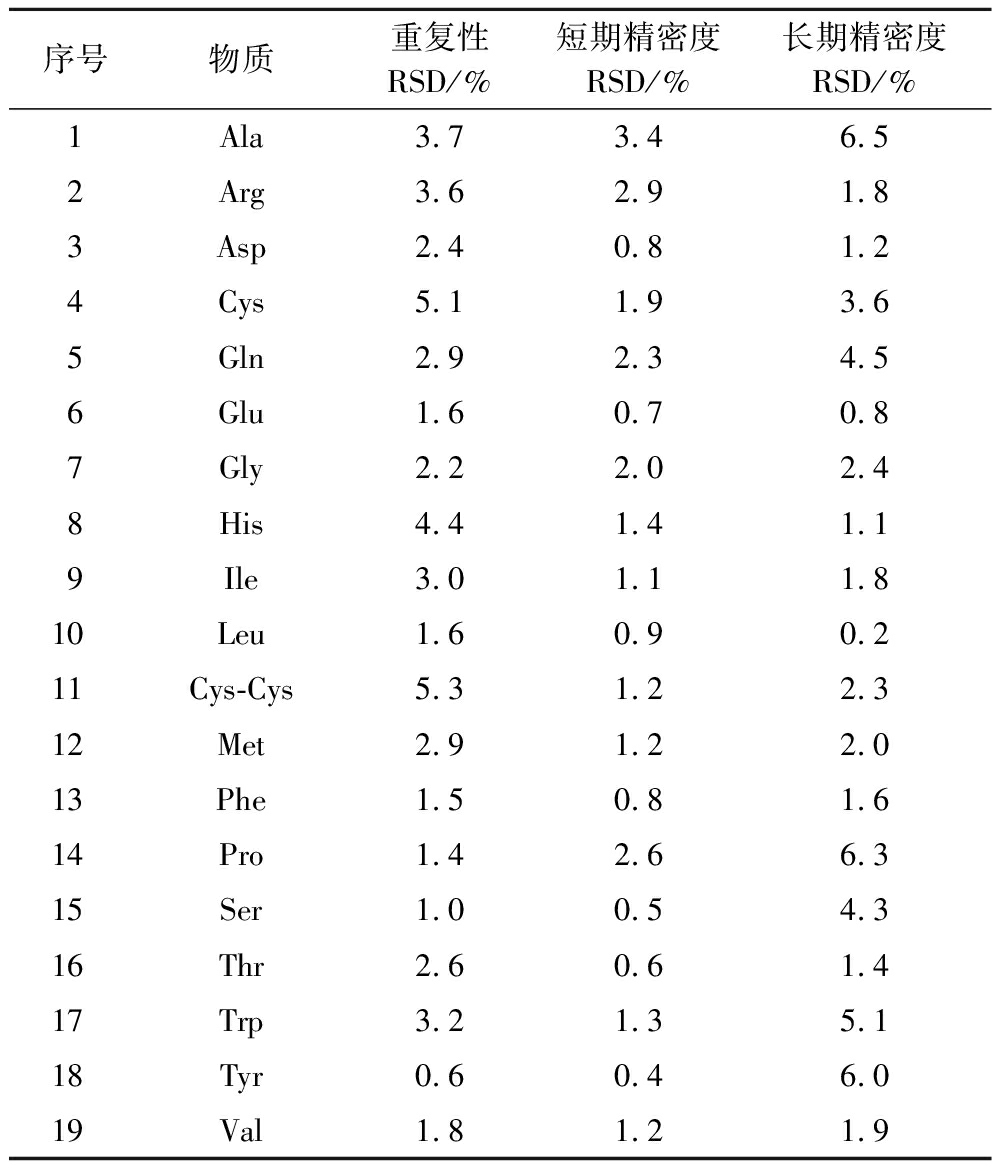
序号物质重复性RSD/%短期精密度RSD/%长期精密度RSD/%1Ala3.73.46.52Arg3.62.91.83Asp2.40.81.24Cys5.11.93.65Gln2.92.34.56Glu1.60.70.87Gly2.22.02.48His4.41.41.19Ile3.01.11.810Leu1.60.90.211Cys-Cys5.31.22.312Met2.91.22.013Phe1.50.81.614Pro1.42.66.315Ser1.00.54.316Thr2.60.61.417Trp3.21.35.118Tyr0.60.46.019Val1.81.21.9
2.3.4 样品检测
选取同一批次不同发酵阶段的酱香型大曲酿造原料,每批次取6个样品,测定其氨基酸的含量。检测结果如表5所示。
实验发现,在所检测的氨基酸中,有16种是所有样品的共有氨基酸,在出仓曲样中未检测到缬氨酸,部分大曲样品中未检测到胱氨酸和半胱氨酸。具体结果为小麦样品中色氨酸、天冬氨酸、谷氨酸、精氨酸、谷氨酰胺及缬氨酸的含量较多,分别占游离氨基酸总量的18.81%、16.62%、12.01%、8.81%、7.80%,胱氨酸和甲硫氨酸含量则较低,与文献报道一致[19-20];大曲样品中脯氨酸、异亮氨酸、谷氨酰胺、天冬氨酸、缬氨酸、谷氨酸、甘氨酸、丝氨酸的含量相对较高,实验结果与张巧玲等[8]通过柱前衍生高效液相色谱法测定的黄曲中氨基酸含量大体一致。
图2总结了影响酱香型白酒风味的关键氨基酸代谢途径[4,9-10,21],包括缬氨酸、苯丙氨酸、亮氨酸、精氨酸和甲硫氨酸。通过比较不同发酵时间的大曲样品,如图3所示,苯丙氨酸、精氨酸在大曲仓内发酵过程中含量大幅度增加,亮氨酸含量明显降低,而缬氨酸和甲硫氨酸均呈先增加后减小的趋势。在出仓曲样中未检测到缬氨酸,检测到较低质量浓度的甲硫氨酸。小麦样品中关键的5种氨基酸含量为0.08~0.88 mg/g,其中亮氨酸含量高于仓内发酵期的大曲样品。由此分析可知,大曲中的亮氨酸可能来源于原料小麦,其他氨基酸在后期仓内发酵过程中不断累积,这一过程也为后期酱香风味的形成提供了丰富的前体物质。
表4 方法的加标回收率结果
Table 4 The recovery rate of the method
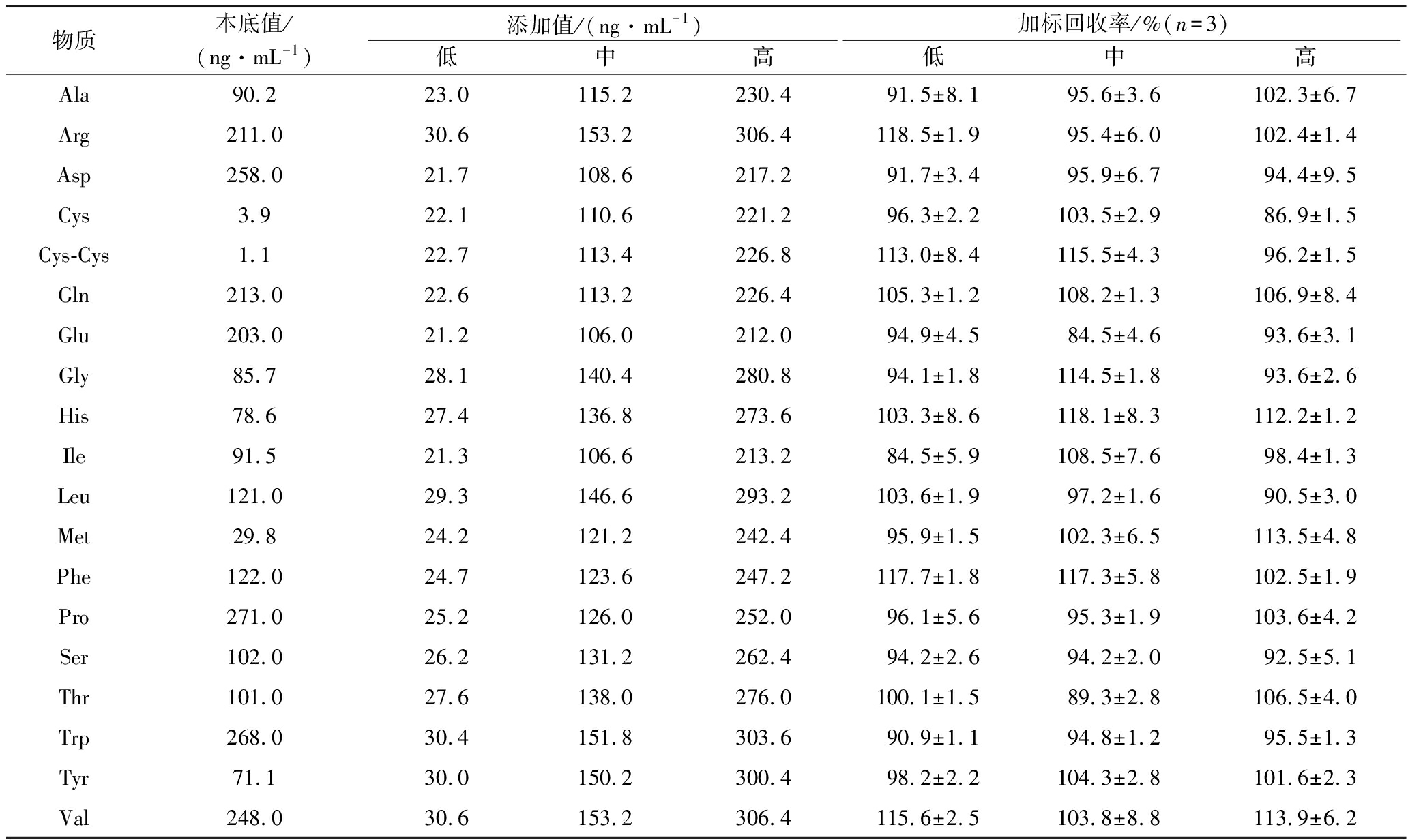
物质本底值/(ng·mL-1)添加值/(ng·mL-1)加标回收率/%(n=3)低中高低中高Ala90.223.0115.2230.491.5±8.195.6±3.6102.3±6.7Arg211.030.6153.2306.4118.5±1.995.4±6.0102.4±1.4Asp258.021.7108.6217.291.7±3.495.9±6.794.4±9.5Cys3.922.1110.6221.296.3±2.2103.5±2.986.9±1.5Cys-Cys1.122.7113.4226.8113.0±8.4115.5±4.396.2±1.5Gln213.022.6113.2226.4105.3±1.2108.2±1.3106.9±8.4Glu203.021.2106.0212.094.9±4.584.5±4.693.6±3.1Gly85.728.1140.4280.894.1±1.8114.5±1.893.6±2.6His78.627.4136.8273.6103.3±8.6118.1±8.3112.2±1.2Ile91.521.3106.6213.284.5±5.9108.5±7.698.4±1.3Leu121.029.3146.6293.2103.6±1.997.2±1.690.5±3.0Met29.824.2121.2242.495.9±1.5102.3±6.5113.5±4.8Phe122.024.7123.6247.2117.7±1.8117.3±5.8102.5±1.9Pro271.025.2126.0252.096.1±5.695.3±1.9103.6±4.2Ser102.026.2131.2262.494.2±2.694.2±2.092.5±5.1Thr101.027.6138.0276.0100.1±1.589.3±2.8106.5±4.0Trp268.030.4151.8303.690.9±1.194.8±1.295.5±1.3Tyr71.130.0150.2300.498.2±2.2104.3±2.8101.6±2.3Val248.030.6153.2306.4115.6±2.5103.8±8.8113.9±6.2
表5 酱香型大曲及其原料中19种氨基酸含量检测结果(n=6) 单位:mg/g
Table 5 Contents of 19 amino acids in Jiang-flavor Daqu starter and its raw material (n=6)

氨基酸名称小麦生曲一翻曲二翻曲出仓曲Ala0.26±0.110.41±0.041.36±0.121.72±0.321.93±0.41Trp1.88±0.541.05±0.121.33±0.320.79±0.130.67±0.24Leu0.32±0.020.53±0.040.20±0.040.23±0.060.25±0.05Ile0.20±0.020.52±0.123.48±0.603.29±0.823.38±0.88Phe0.28±0.030.53±0.071.36±0.211.22±0.351.31±0.36Met0.08±0.020.17±0.061.01±0.230.69±0.240.14±0.06Val0.57±0.111.21±0.192.51±0.172.93±0.24NDTyr0.25±0.020.55±0.121.75±0.131.69±0.191.66±0.18Pro0.54±0.101.40±0.225.30±0.564.89±0.734.99±0.86Cys0.01±0.01ND0.03±0.010.02±0.010.02±0.01Glu1.20±0.140.61±0.162.42±0.152.47±0.092.43±0.10Gly0.25±0.030.48±0.142.29±0.352.15±0.532.08±0.72Thr0.26±0.020.53±0.121.61±0.101.53±0.161.53±0.19Gln0.78±0.371.43±0.582.94±1.182.20±0.381.77±0.21Asp1.66±0.090.93±0.212.68±0.342.48±0.532.50±0.36Ser0.25±0.020.55±0.121.75±0.131.69±0.191.66±0.18Arg0.88±0.090.94±0.091.17±0.031.17±0.041.19±0.03His0.27±0.030.41±0.071.02±0.070.94±0.060.80±0.08Cys-Cys0.05±0.030.02±0.010.09±0.040.08±0.020.06±0.03
注:ND表示低于定量限

图2 酱香白酒风味形成中关键氨基酸代谢途径
Fig.2 Metabolic pathway of the key amino acids in the flavor formation of Jiang-flavor Baijiu

图3 不同发酵阶段样品中关键氨基酸含量的比较
Fig.3 Content comparison of key amino acids in samples of different fermentation stages
3 结论与讨论
本文通过对质谱、色谱条件的优化,建立了通过超高效液相色谱-质谱联用仪直接测定酱香型酒曲中19种游离氨基酸的方法,并对酱酒制曲过程中氨基酸的变化规律进行初步探究。样品经粉碎、超声提取、离心净化、定容及适当稀释后,可直接进样分析。结果表明,19种游离氨基酸在特定范围内线性关系良好(R2≥0.998 3),检出限0.3~6.1 ng/mL,定量限为2.1~29.3 ng/mL,加标回收率为84.5%~118.5%,方法重复性和仪器精密度RSD均低于6.5%(n=6)。食品中氨基酸的检测依据GB 5009.124—2016中酸解处理及氨基酸分析仪测定法,本文研发的方法避免了繁琐耗时、使用衍生化试剂的前处理步骤,精密度大大提升,且有效地缩短了分析时间,检测效率提升约14倍。该方法可用于监测白酒酿造工艺过程原辅料中游离氨基酸的含量,为酱香型白酒生产工艺优化、产品质量提升以及风味物质形成机制研究及调控提供一定的参考。
[1] 胡鹏刚, 邱树毅, 李继杰.酱香大曲酒生产工艺关键环节与其风格质量的关系[J].酿酒科技, 2010(8):36-39.
HU P G, QIU S Y, LI J J.Relations between key production techniques of Maotai-flavor Daqu and its quality and styles[J].Liquor-Making Science &Technology, 2010(8):36-39.
[2] 霍嘉颖, 黄明泉, 孙宝国, 等.中国白酒中功能因子研究进展[J].酿酒科技, 2017(9):17-23.
HUO J Y, HUANG M Q, SUN B G, et al.Research progress in functional factors in Baijiu[J].Liquor-Making Science &Technology, 2017(9):17-23.
[3] YIN H A, HE Y, DENG Y, et al.Application of Plackett-Burman experimental design for investigating the effect of wort amino acids on flavor-active compounds production during lager yeast fermentation[J].Journal of the Institute of Brewing, 2017, 123(3):300-311.
[4] 苟静瑜, 贾智勇, 闫宗科, 等.降低白酒中高级醇含量的研究进展[J].酿酒, 2016, 43(4):25-29.
GOU J Y, JIA Z Y, YAN Z K, et al.Research progress in decreasing the contents of higher alcohols in Baijiu (liquor)[J].Liquor Making, 2016, 43(4):25-29.
[5] 仇钰莹, 方芳, 周新虎, 等.酒醅中精氨酸利用菌株的分离筛选及其对浓香型白酒中瓜氨酸积累的影响[J].微生物学报, 2016, 56(10):1 638-1 646.
QIU Y Y, FANG F, ZHOU X H, et al.Characterization of arginine utilization strains from fermented grains and evaluation of their contribution to citrulline accumulation in Chinese Luzhou-flavor spirits[J].Acta Microbiologica Sinica, 2016, 56(10):1 638-1 646.
[6] FAN W L, SHEN H Y, XU Y.Quantification of volatile compounds in Chinese soy sauce aroma type liquor by stir bar sorptive extraction and gas chromatography-mass spectrometry [J].Journal of the Science of Food and Agriculture, 2011, 91(7):1 187-1 198.
[7] 温永柱, 范文来, 徐岩, 等.白酒中5种生物胺的HPLC定量分析[J].食品工业科技, 2013, 34(7):305-308.
WEN Y Z, FAN W L, XU Y, et al.Quantification for 5 selected biogenic amines in Chinese liquor by HPLC[J].Science and Technology of Food Industry, 2013, 34(7):305-308.
[8] 张巧玲, 吕锡斌, 秦兴, 等.酱香型白酒高温大曲游离氨基酸比较分析[J].中国酿造, 2019, 38(4):53-57.
ZHANG Q L, LV X B, QIN X, et al.Comparative analysis of free amino acids in high temperature Daqu of Moutai-flavor Baijiu[J].China Brewing, 2019, 38(4):53-57.
[9] 聂元皓, 徐岩, 吴群, 等.芳香族化合物前体物质酪氨酸和苯丙氨酸在白酒中的来源解析[J].食品与发酵工业, 2018, 44(10):1-6.
NIE Y H, XU Y, WU Q, et al.Analysis on source of tyrosine and phenylalanine as precursors of aromatic compounds in Baijiu (Chinese liquor)[J].Food and Fermentation Industries, 2018, 44(10):1-6.
[10] 柳习月, 朱琪, 杨帆, 等.蛋白组学揭示苯丙氨酸代谢对酱香大曲风味影响[J].食品科技, 2021, 46(8):1-6.
LIU X Y, ZHU Q, YANG F, et al.Proteomics reveals the effect of phenylalanine metabolism on the flavor of Daqu[J].Food Science and Technology, 2021, 46(8):1-6.
[11] 陈雪, 梁克红, 朱宏, 等.游离氨基酸检测方法及其应用[J].食品安全质量检测学报, 2021, 12(18):7 298-7 304.
CHEN X, LIANG K H, ZHU H, et al.Analysis method and application of free amino acids[J].Journal of Food Safety &Quality, 2021, 12(18):7 298-7 304.
[12] PIESTANSKY J, OLESOVA D, GALBA J, et al.Profiling of amino acids in urine samples of patients suffering from inflammatory bowel disease by capillary electrophoresis-mass spectrometry[J].Molecules, 2019, 24(18):3345.
[13] 孙洁, 李好转, 孙立臻, 等.芝麻香型白酒酒醅中游离氨基酸分析方法探讨[J].酿酒科技, 2014(4):93-95.
SUN J, LI H Z, SUN L Z, et al.Exploration on the analytical method of free amino acids in the fermented grains of sesame-flavor liquor[J].Liquor-Making Science &Technology, 2014(4):93-95.
[14] QIU X, REYNOLDS R, JOHANNINGSMEIER S, et al.Determination of free amino acids in five commercial sweetpotato cultivars by hydrophilic interaction liquid chromatography-mass spectrometry[J].Journal of Food Composition and Analysis,2020,92:103522.
[15] DESMONS A, THIOULOUSE E, HAUTEM J Y, et al.Direct liquid chromatography tandem mass spectrometry analysis of amino acids in human plasma[J].Journal of Chromatography A, 2020, 1 622:461135.
[16] 臧彬如, 周改莲, 单国顺, 等.超高效液相色谱串联三重四极杆质谱法测定梅花鹿茸中总游离氨基酸与游离氨基酸含量[J].医药导报, 2020, 39(11):1 520-1 527.
ZANG B R, ZHOU G L, SHAN G S, et al.Determination of total free amino acids and free amino acids in Sika Deer velvet antler by UPLC-QqQ-MS/MS[J]. Herald of Medicine, 2020, 39(11):1 520-1 527.
[17] VIOLI J P, BISHOP D P, PADULA M P, et al.Considerations for amino acid analysis by liquid chromatography-tandem mass spectrometry:A tutorial review[J].TrAC Trends in Analytical Chemistry, 2020, 131:116018.
[18] KRUMPOCHOVA P, BRUYNEEL B, MOLENAAR D, et al.Amino acid analysis using chromatography-mass spectrometry:An inter platform comparison study[J].Journal of Pharmaceutical and Biomedical Analysis, 2015, 114:398-407.
[19] 刘月, 丑建栋, 陈玥璋,等.小麦胚芽的营养功能成分及综合利用研究进展[J].食品工业科技, 2022, 43(12):457-467.
LIU Y, CHOU J D, CHEN Y Z, et al.Advances on nutritional functional components and comprehensive utilization of wheat germ [J].Science and Technology of Food Industry, 2022, 43(12):457-467.
[20] PEP P, GYÖRI Z. Amino acid compositions in wheat species with different genomes. Cereal Research Communications, 2007, 35(4):1 685-1 699.
P, GYÖRI Z. Amino acid compositions in wheat species with different genomes. Cereal Research Communications, 2007, 35(4):1 685-1 699.
[21] 谢佳. 杂醇、酸、酯组成及氨基酸对白酒醉度的调节作用[D].广州:华南理工大学, 2018.
XIE J.Effects of composition of fusel alcohols, acids and esters and amino acids on intoxicating degree of liquor[D].Guangzhou:South China University of Technology, 2018.