甲壳素作为一种天然高分子多糖,在自然界中的含量仅次于纤维素[1]。其来源极为广泛,如图1所示,主要存在于甲壳类水产动物、昆虫类的外壳中,真菌和藻类的细胞壁也存在着少量甲壳素[2]。水产工业中,甲壳类动物的废弃物常被用作甲壳素的主要生产原料,这些废弃物主要由蛋白质(15%~50%)、矿物质(30%~50%)和甲壳素(15%~30%)等构成,具有极高商业价值[1]。昆虫类外壳同样也是甲壳素的重要原料来源,例如蚕壳中的甲壳素含量高达74%[3]。

图1 甲壳素来源及结构
Fig.1 Source and structure of chitin
甲壳素是一种天然的生物聚合物,其主体结构是一种线性氨基多糖,主要由2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖通过β-(1→4)-糖苷键连接构成[4]。甲壳素具有独特的功能特性如生物相容性、可生物降解性和无毒副作用,使其在食品、医疗、农业、能源和环境等方面具有广阔的应用前景[5-6]。目前甲壳素的应用研究主要集中在其脱乙酰化产物壳聚糖上。由于壳聚糖具有良好的抗菌、抗氧化能力和优秀的透气性能,在医疗领域中常应用于防止伤口感染[7]和构建药物递送系统[8];在能源方面,改性的壳聚糖可作为一种对环境友好、经济效益高的电极材料,可应用于开发新型超级电容器[9]。此外,利用天然、改性壳聚糖或者壳聚糖复合物可对废水中的重金属离子进行吸附和回收[10]。
1 甲壳素提取技术
甲壳素的提取技术主要分为脱蛋白和脱钙2个步骤,部分追求高品质甲壳素的工艺中还会增加脱色步骤,但整个提取流程的关键仍是脱蛋白和脱钙[11]。目前工业上应用较多的提取技术以酸碱法为主,具有成本低廉、操作简单等优点,受到生产企业青睐。但是,酸碱法工艺所产生的大量废液会造成严重环境污染[12],有悖于绿色、健康和环保的发展趋势,并且酸碱还会破坏甲壳素结构,使其发生脱乙酰化和解聚反应,导致提取出的甲壳素出现品质不稳定等问题[13]。
为了弥补传统提取方法的缺陷,绿色提取甲壳素工艺研究正蓬勃发展,当前的研究热点(图2)主要集中在加入相关菌种或酶制剂以取代化学法中的酸碱试剂。生物法,因其具有工作条件温和以及耗能较低等特点,受到学者的广泛关注[14],目前利用菌种发酵和酶促催化提取甲壳素已有大量文献研究。同时,离子液体和低共熔溶剂等新型溶剂的出现也在甲壳素提取方面展示出巨大的应用潜力,这些新型溶剂的使用也有望成为甲壳素绿色提取工艺的关键一环。

图2 甲壳素提取技术
Fig.2 Chitin extraction tecnology
2 化学方法
2.1 传统方法
目前较成熟的化学工艺是使用盐酸溶解原料中的碳酸钙来完成脱钙流程,而强碱则用于去除原料中的蛋白质和其他有机化合物[11],最后利用高锰酸钾或过氧化氢进行脱色处理。脱钙和脱蛋白是甲壳素提取工艺中产生废液的主要环节,因而一些学者对替换强酸强碱的可行性进行有益探索,期望以此获得温和化学法的提取工艺,同时达到降低污染、减少废液废水产生的效果。
有研究者[15]利用磷酸作为甲壳素的溶解溶剂,辅以超声波,加速高分子质量甲壳素水解成低分子质量甲壳素的反应。通过向酸水解原料后的溶液体系中加水来沉淀出高分子质量甲壳素,然后再加入不同浓度的乙醇溶液进行差分沉淀,以得到较低分子质量的甲壳素;也有学者[11]利用谷氨酸和碳酸钙可生成水溶性谷氨酸钙的化学反应,替换原有脱钙过程中的盐酸,反应完全后加入磷酸氢铵,能释放出谷氨酸离子形成不溶性磷酸氢钙,再通过调节pH至3.2来实现谷氨酸的回收;HUAN等[16]将盐酸转化为蒸汽预处理甲壳素7 h,然后通过机械分离操作获得到甲壳素纳米晶体,因为所用盐酸不与样品直接接触,可以达到盐酸多次处理甲壳素的目的。
虽然,对化学提取法的改良研究能在一定程度上实现废液回收和降低环境污染,但仍然无法从根源上解决酸碱法所产生的污染问题和损伤甲壳素结构的弊端,所以学者们将目光转向寻求新型甲壳素提取方法的研究上。
2.2 新型方法
2.2.1 乙二胺四乙酸(ethylene diamine tetraacetie acid,EDTA)辅助法
EDTA辅助法是利用EDTA饱和溶液替代脱钙处理中的强酸,以此来提高脱钙的处理效率,主要原理是EDTA对钙离子有着特殊的络合机制[17]。EDTA溶液在安全性方面远胜于盐酸,虽然EDTA单次使用成本远高于传统的盐酸工艺,但容易回收和可重复使用特性降低了加工过程的整体成本。
杨丹等[18]以虾壳和虾蛄壳为原料,对比研究了EDTA法和酸碱法提取的甲壳素,结果表明在工作条件和甲壳素品质方面,EDTA法均优于酸碱法。有学者[17]在pH=4和pH=10 的条件下使用EDTA对虾壳进行脱钙处理,研究表明无论在哪种pH环境下,EDTA法提取的甲壳素钙含量均低于强酸法提取的甲壳素,且2种方法提取的甲壳素结构完全一致。另有研究者[19]利用EDTA辅以超声来处理虾壳,探究提取甲壳素的最佳条件,发现在超声频率60 kHz、功率180 W、超声时间45 min、处理温度30 ℃、EDTA质量分数18%、pH=13、料液比(g∶mL)1∶24的工作条件下,提取出的甲壳素灰分含量为0.13%、含氮量为3.51%,其品质也优于使用强酸提取的甲壳素。
EDTA辅助法会在一定程度上优化工作条件,提升甲壳素的提取品质,但实际上该方法仍未脱离化学法的整体框架,仍然是利用化学试剂完成脱钙和脱蛋白步骤,因此同样无法避免化学法缺点。即使EDTA辅助法具有可重复使用的特殊性能,但其本身对环境的破坏以及处理废液的高昂成本,都会导致其大规模应用受限。
2.2.2 离子液体
离子液体,又称为室温熔融盐,是一种在室温或在100 ℃以下呈液体形态的新型溶剂,这种溶剂主要由有机阳离子如铵、咪唑等、或按实际需求结合其他无机或有机的阴离子组合而成[20]。离子液体的性能取决于组合所用的离子,因此可理性设计不同的离子液体组合而实现不同功能。离子液体有着不易挥发、性质稳定、不易燃等特性,以及良好的溶解性能和稳定性,广泛应用于物质提取方面研究。有学者[21]探究了铵基离子液体体系:醋酸二异丙基乙基铵([DIPEA][Ac])、丙酸二异丙基乙基铵([DIPEA][P])和醋酸二甲基丁基铵([DMBA][Ac])对虾壳中甲壳素的提取能力。结果表明3种离子液体均能有效提取虾壳中的甲壳素,提取能力的排序为:[DMBA][Ac]>[DIPEA][Ac]>[DIPEA][P]。而且,提取出的甲壳素蛋白质含量均低于1.1%,元素分析结果也表明几乎没有钙离子的存在,这说明经过离子液体处理后钙离子基本上被完全去除。LI等[22]用1-乙基-3-甲基咪唑醋酸盐([Emim][OAc])代替盐酸对甲壳素进行预处理,发现离子液体会破坏甲壳素结构,使其暴露出更多的接触位点,增强了甲壳素酶的可及性,会明显提高单糖/低聚糖的转化效率。
离子液体虽然对甲壳素具有较强的溶解能力,但由于其本身所存在的毒性和不可降解性,当下在学术界中还存在着较大争议[5]。因此,使用离子液体提取甲壳素的多功效工业化应用还需要更多的研究支撑。
2.2.3 低共熔溶剂
低共熔溶剂(deep eutectic solvents,DES),又被称为类离子液体,有着与离子液体较为相近的特性,但所使用的原料绝大部分来源于天然产物。相较于离子液体,低共熔溶剂具有环境无害、原料成本低廉等优点,被认为是一种符合绿色化学的溶剂。同时,低共熔溶剂也具备熔点较低、性质稳定和溶解性能好等特点,而在结构上则与离子液体存在少许差别[23]。低共熔溶剂的合成需要选用一种氢键受体和其他的氢键供体相结合,目前DES的种类可分为4种:①有机或无机盐+金属氯化物;②有机或无机盐+金属氯化物+水合氯化物;③金属氯化物+路易斯酸;④无水金属氯化物+路易斯酸[24]。
当前,DES提取甲壳素的机理尚未明确,有研究指出氯化胆碱-乳酸体系中提取甲壳素机理可能分为以下两步过程:①当原料与DES开始接触时,DES体系中的游离H+与碳酸钙结合生成二氧化碳和可溶性钙盐;②无机盐脱除后暴露出了原料中的蛋白质和甲壳素,DES体系中大量的氢键会与蛋白质通过共价键结合,蛋白质与旧有的DES体系会形成新的多元DES体系,促使蛋白质不断溶解,最后沉淀出剩余不溶的甲壳素[25]。另有文献报道其他类似的DES体系对甲壳素也具有良好的溶解效果,MUKESH等[23]利用氯化胆碱与尿素和硫脲合成DES,结果表明甲壳素能有效溶解于该DES体系,并利用溶解后的甲壳素成功制备获得α-甲壳素纳米纤维。
季铵盐作为氢键供体的DES一般常用于提取甲壳素,SUN等[25]探究了季铵盐体系下,5种有机酸作为氢键供体的DES对虾壳中甲壳素的提取性能,结果表明提取出的甲壳素纯度基本一致。HONG等[26]在季铵盐体系下探究了4种有机酸对龙虾壳的甲壳素提取,发现4种DES提取的甲壳素具有不同的分子质量,纯度上也存在一定的差别,但整体物理化学性质保持一致。
低共熔溶剂在绿色提取甲壳素方面表现出巨大潜力,但其性能一般会受到氢键供体和受体的摩尔比、合成条件和提取工艺等因素影响,距离按照实际提取甲壳素需求,理性设计低共熔溶剂的目标仍有较大差距。同时,利用该法大规模提取甲壳素的应用研究也缺乏相关数据支撑,因此从实验室走向工业化应用还需进一步的深入探究。
3 生物方法
鉴于化学法提取甲壳素对环境污染严重、后续的废液处理工艺成本高昂等弊端,为改良甲壳素的提取工艺,学者们将目光投向了利用生物天然特性来替代提取工艺中可能会造成污染的化学试剂。现今,较为成熟的生物提取法是利用蛋白酶替代提取过程中脱蛋白和脱盐所使用的强酸强碱。近年来的研究主要聚焦于2种生物提取方法:(1)依赖引入特定的菌株在发酵中分泌的酶来完成提取;(2)通过额外添加酶制剂在一定条件下达到分解蛋白质和沉淀矿物质的效果。
3.1 发酵法
发酵法是通过接入特定的微生物菌株,利用菌株的发酵特性实现脱蛋白或脱盐的效果。菌株的发酵条件较为简单,且整体工艺成本低于化学提取法,后续也没有大量废弃物需要处理。针对实际提取需要,还能通过选用不同的菌种组合成混合菌剂来达到提高产率、改善甲壳素品质、提高脱乙酰化效率等目标,以方便后续加工处理,且具有化学法所欠缺的对环境友好、操作灵活的优点,因此发酵法受到广泛的关注和研究。
3.1.1 单菌发酵
单菌发酵提取工艺,通常采用可分泌蛋白水解酶的菌株,作为甲壳素提取脱蛋白工艺的核心。依据脱盐的方式不同可分为2种技术路线:(1)菌株发酵达成脱蛋白的效果后,辅以化学方法来对脱蛋白后的产物进行脱盐处理;(2)利用菌株发酵所需的酸性环境或是发酵过程中的产酸来降低整体pH,使得组分中的碳酸钙溶解,以达到与甲壳素分离的效果[27]。
如表1所示,GHORBEL-BELLAAJ等[27]利用铜绿假单胞菌A2(Pseudomonas aeruginosa A2)来提取虾壳中甲壳素,在最佳发酵条件下,蛋白质去除率约为89%,脱钙率约为96%,结果表明该菌株脱蛋白和脱钙效果较好,有望应用于工业化提取甲壳素。CAHYANINGTYAS等[28]从虾膏中分离出的蜡样芽胞杆菌HMRSC30(Bacillus cereus HMRSC30)能同时分泌蛋白酶和壳聚糖酶,其最佳产酶条件下甲壳素的脱蛋白率达到83%,脱钙率为40%,该菌表现出发酵制备甲壳素的巨大潜力。DAYAKAR等[29]选用嗜盐杆菌(Halobacterium salinarum)和多姆布氏盐球菌(Halococcus dombrowskii)分别对生、熟虾壳进行提取甲壳素研究,发现煮熟虾壳的脱蛋白效率最佳。TASER等[30]采用分离出的类芽孢杆菌BAT1(Paenibacillus jamilae BAT1)从虾壳中提取甲壳素,脱蛋白率和脱钙率分别为87.67%和41.95%,这也是首次将类芽孢杆菌应用于甲壳素提取研究的报道。DOAN等[31]分离出一株产碱性蛋白酶的类短芽孢杆菌TKU046(Brevibacillus parabrevis TKU046),该菌能利用虾头作为唯一碳/氮源,脱蛋白率高达95%,提取出的甲壳素结构品质与商用甲壳素基本一致。CASTRO等[32]采用从银鲑鱼中分离出的植物乳酸杆菌(Lactobacillus plantarum sp.47)进行发酵提取甲壳素,发酵后的产物经低浓度的酸和碱进一步纯化,脱蛋白率和脱钙率可达到95.3%和99.6%,发酵后的菌液经过简单操作能够回收蛋白质,也可用作饲料的原材料,实现多功效偶联应用。
现今,单一菌种发酵的提取效率与化学法相比还存在较大差距,产物的品质控制也存在一定问题。部分菌株在发酵过程还会改变、破坏α-甲壳素的晶型,降低甲壳素的脱乙酰化效率,提高了后续应用成本。此外,单菌发酵法,因菌株成长条件、发酵时间等因素限制,有着相对较高的技术要求,目前难以形成大规模生产,其漫长的提取过程也限制了发酵法的大规模实际应用。但单菌发酵同样具有化学法无法企及的优点,可以根据实际需求调节所使用的发酵菌种来达到不同提取目的。有学者探究了利用菌株生长发育所需的酸性条件来整合脱蛋白和脱钙过程的可行性,整合后的生产流程可一定程度上节约成本和减少时间。单菌发酵法相对温和的工作条件以及低廉、环保的试剂使用也是化学法难以达到的。随着对单菌发酵技术的不断深入研究,该项技术正逐渐从单纯的接入菌株产蛋白酶逐渐转向复合超声、微波等辅助技术耦合发酵使用,在提高产量的同时实现对甲壳素结构的改性以及为后续加工打下坚实基础。此外,筛选出具有酸性生长条件的高性能菌株来整合脱蛋白和脱钙过程也是该技术未来发展的方向之一。
表1 单菌发酵提取甲壳素文献研究
Table 1 Literature research on extraction of chitin by fermentation of single bacteria

微生物所用原料脱蛋白率/%脱钙率/%备注参考文献铜绿假单胞菌A2(Pseudomonas aeruginosa A2)虾壳89.0096.00—[27]蜡样芽孢杆菌HMRSC30(Bacillus cereus HMRSC30)虾壳83.0040.00—[28]嗜盐杆菌(Halobacterium salinarum)生虾壳熟虾壳89.3293.53—采用化学方法进行脱钙处理[29]多姆布氏盐球菌(Halococcus dombrowskii)生虾壳熟虾壳98.5498.99—采用化学方法进行脱钙处理[29]类芽孢杆菌BAT1(Paenibacillus jamilae BAT1)虾壳86.6741.95—[30]类短芽孢杆菌TKU046(Brevibacillus parabrevis TKU046)蟹壳、虾壳95.01—采用化学方法进行脱钙处理[31]植物乳酸杆菌sp.47(Lactobacillus plantarum sp.47)螃蟹固体废物95.3399.55发酵产物经0.4 mol/L NaOH与0.5 mol/L HCl纯化处理[32]枯草芽孢杆菌A26(Bacillus subtilis A26)蟹壳78.2063.90—[33]摩加夫芽胞杆菌A21(Bacillus mojavensis A21)蟹壳78.7066.50—[33]短小芽孢杆菌A1(Bacillus pumilus A1)蟹壳94.0080.00—[33]解淀粉芽孢杆菌An6(Bacillus amyloliquefaciens An6)蟹壳75.8071.50—[33]地衣芽孢杆菌NH1(Bacillus licheniformis NH1)蟹壳90.0083.00—[33]蜡样芽孢杆菌BG1(Bacillus cereus BG1)蟹壳80.9058.50—[33]
3.1.2 混菌发酵
混菌发酵,通常采用二步发酵法来从虾壳中提取甲壳素[34],其中脱蛋白过程和脱盐过程需接种生长条件存在较大差异的2种菌株。考虑到菌株之间对彼此的生长存在不同程度的干扰,因而在脱蛋白和脱盐工艺的切换过程中,需要进行重复灭菌、更换培养基等繁杂操作。同单菌发酵相比,混菌发酵在减轻环境污染和提高甲壳素品质方面具有天然优势,二步发酵法可以省去单菌发酵中的化学处理环节,避免高污染废液产生和强酸强碱对甲壳素结构的损害,使得产物整体结构较为稳定。
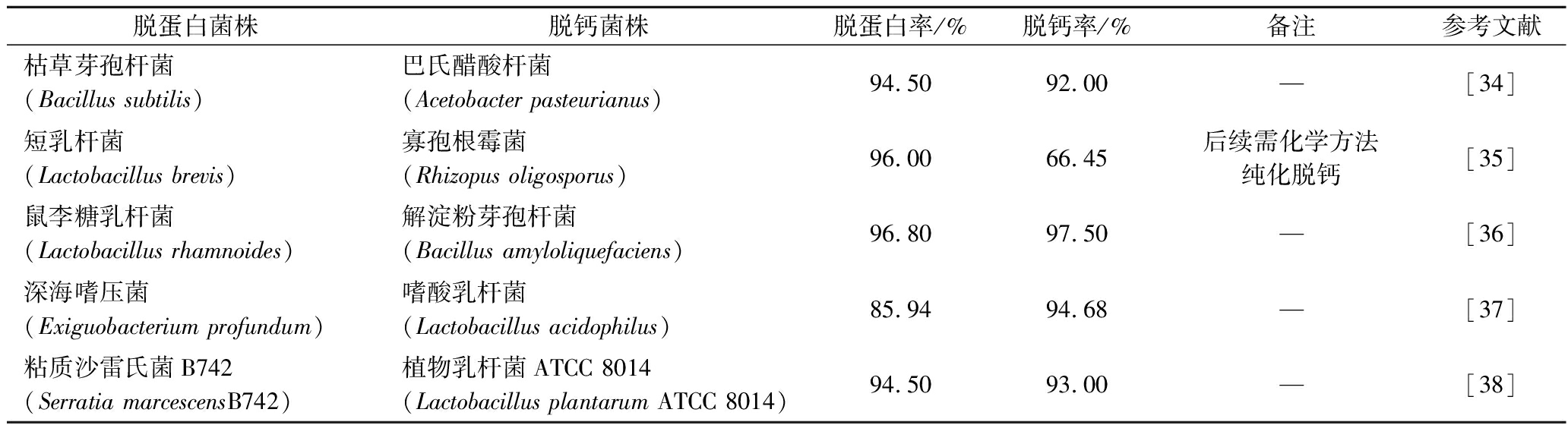
混菌发酵可以分为共同发酵法和连续二步发酵法。连续二步发酵法,是利用后一种菌株的特性对前一种菌株接种的培养基进行灭菌,并直接接种到同一个培养基上,免除了重复灭菌和更换培养基等情况(表2)。ZHANG等[34]将枯草芽孢杆菌(Bacillus subtilis)和巴氏醋酸杆菌(Acetobacter pasteurianus)共培养发酵,利用巴氏醋酸杆菌能够以乙醇作为碳源的特性,将脱蛋白过程中所使用的枯草芽孢杆菌杀灭,并直接接种到同一个培养基上继续进行脱盐处理,获得产物脱蛋白率94.5%,脱钙率92%,且甲壳素的聚合程度较低,方便了后续脱乙酰化的进行。ARANDAY-GARC A等[35]选用短乳杆菌(Lactobacillus brevis)和寡孢根霉菌(Rhizopus oligosporus)对凡纳滨对虾的虾头和胸部的废弃物进行混菌发酵以提取甲壳素,所得产物脱蛋白率96.0%,脱钙率66.45%,且从发酵废弃物中成功得到虾青素、蛋白质等高附加值产品。LIU等[36]选用鼠李糖乳杆菌(Lactobacillus rhamnoides)和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)进行连续二步发酵,该混菌发酵过程中,菌株间具有良好的协同性,仅需发酵过程中补充葡萄糖即可完成提取操作,产物的脱蛋白率和脱钙率分别高达96.8%和97.5%。XIE等[37]将深海嗜压菌(Exiguobacterium profundum)与嗜酸乳杆菌(Lactobacillus acidophilus)组合来进行连续二步发酵,脱蛋白率和脱钙率分别达到85.94%和94.68%,提取的甲壳素脱乙酰化程度较低,为后续进一步的改性提供更多选择,而且发酵液中含有大量蛋白质,可用于分离、生产出高价值的蛋白饲料。ZHANG等[38]选取粘质沙雷氏菌B742(Serratia marcescens B742)和植物乳杆菌ATCC 8014(Lactobacillus plantarum ATCC 8014)进行组合,经过连续二步发酵后脱蛋白率和脱钙率分别为94.5%和93.0%,提取出的甲壳素在理化和结构性质上与商业甲壳素基本一致。
A等[35]选用短乳杆菌(Lactobacillus brevis)和寡孢根霉菌(Rhizopus oligosporus)对凡纳滨对虾的虾头和胸部的废弃物进行混菌发酵以提取甲壳素,所得产物脱蛋白率96.0%,脱钙率66.45%,且从发酵废弃物中成功得到虾青素、蛋白质等高附加值产品。LIU等[36]选用鼠李糖乳杆菌(Lactobacillus rhamnoides)和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)进行连续二步发酵,该混菌发酵过程中,菌株间具有良好的协同性,仅需发酵过程中补充葡萄糖即可完成提取操作,产物的脱蛋白率和脱钙率分别高达96.8%和97.5%。XIE等[37]将深海嗜压菌(Exiguobacterium profundum)与嗜酸乳杆菌(Lactobacillus acidophilus)组合来进行连续二步发酵,脱蛋白率和脱钙率分别达到85.94%和94.68%,提取的甲壳素脱乙酰化程度较低,为后续进一步的改性提供更多选择,而且发酵液中含有大量蛋白质,可用于分离、生产出高价值的蛋白饲料。ZHANG等[38]选取粘质沙雷氏菌B742(Serratia marcescens B742)和植物乳杆菌ATCC 8014(Lactobacillus plantarum ATCC 8014)进行组合,经过连续二步发酵后脱蛋白率和脱钙率分别为94.5%和93.0%,提取出的甲壳素在理化和结构性质上与商业甲壳素基本一致。
近年关于混菌发酵的文献报道中,连续二步发酵法已经成为生物法绿色提取甲壳素的主流技术,二步连续发酵操作不仅降低了杂菌污染情况,而且也让混菌发酵操作变得更简单。但当前混菌发酵提取甲壳素研究仍处于实验室摇瓶环境,并不适用于实际的规模化生产应用[38]。因此,混菌发酵法未来的研究趋势是转向大型发酵集成装置的构建以及引入超声等物理辅助手段,以此提高发酵过程的稳定性和高效性,控制甲壳素的提取品质。
表2 混菌发酵提取甲壳素文献研究
Table 2 Literature research on the extraction of chitin by fermentation with mixed bacteria
脱蛋白菌株脱钙菌株脱蛋白率/%脱钙率/%备注参考文献枯草芽孢杆菌(Bacillus subtilis)巴氏醋酸杆菌(Acetobacter pasteurianus)94.5092.00—[34]短乳杆菌(Lactobacillus brevis)寡孢根霉菌(Rhizopus oligosporus)96.0066.45后续需化学方法纯化脱钙[35]鼠李糖乳杆菌(Lactobacillus rhamnoides)解淀粉芽孢杆菌(Bacillus amyloliquefaciens)96.8097.50—[36]深海嗜压菌(Exiguobacterium profundum)嗜酸乳杆菌(Lactobacillus acidophilus)85.9494.68—[37]粘质沙雷氏菌B742(Serratia marcescensB742)植物乳杆菌ATCC 8014(Lactobacillus plantarum ATCC 8014)94.5093.00—[38]
3.2 生物酶
不同于发酵法接种菌株产酶来提取甲壳素,生物酶法是通过直接添加纯化的蛋白酶来实现去除蛋白质的效果[39]。有研究表明,生物酶法提取的甲壳素分子量高于化学法提取的甲壳素,酶解产物中含有生物活性肽,这使得提取后剩余残渣的经济价值得到极大提升,可以被制成饲料或是用作肥料。目前的酶法工艺是通过加入蛋白酶的酶制剂来实现脱蛋白效果,常用的蛋白酶有碱性蛋白酶、胃蛋白酶、木瓜蛋白酶等。
3.2.1 碱性蛋白酶
蛋白酶的使用占全球总酶用量的60%,而碱性蛋白酶则占比25%以上[40],碱性蛋白酶在强碱环境和高温条件下仍能保持较高的活性和稳定性[41],由于具有来源广泛和工作环境要求简单等特性,使得其在工业处理方面具有天然的优势。
碱性蛋白酶应用于甲壳素脱蛋白工艺目前受到广泛关注。HAMMAMI等[42]从海水中分离出了一株产蛋白酶的芽孢杆菌,利用该菌制成的粗酶制剂在碱性和高温下能保持较高的活性,以虾类废弃物作为原料进行甲壳素提取时发现:该酶能一步实现脱蛋白和脱钙的效果,其中脱蛋白率可达76%,脱钙率约为95.17%。MHAMDI等[41]从一株新颖的小单孢菌属菌种S103中分离出了丝氨酸碱性蛋白酶,该蛋白酶在pH 5.0~12.0内性质都非常稳定,酶活最佳条件为pH 8.0和70 ℃,对甲醇、己烷、丙酮等有机溶剂仍能保持100%的原始活性;将该酶用于甲壳素提取中,蛋白去除率可达93%。CUI等[43]利用碱性蛋白酶和苹果酸对虾蛄壳进行甲壳素提取研究,结果表明该方法制得的甲壳素脱蛋白率和脱钙率分别为92.78%和94.11%,提取出的甲壳素具有良好多孔结构,结晶度和热稳定性均优于传统化学方法提取。碱性蛋白酶来源丰富、工作条件温和、性质稳定的特性使其在甲壳素提取领域中具有巨大的应用潜力。然而,目前该方法主要面临着甲壳素产率较低和大规模生产时品质难以保障等应用缺陷。如果能顺利解决这些难题,碱性蛋白酶将会为甲壳素的绿色加工提供一种新思路。
3.2.2 胃蛋白酶
胃蛋白酶是消化系统中主要的蛋白水解酶之一,同时也是目前主流的商用蛋白酶,它一般从猪的胃黏膜中分离制备,有研究表明从鱼类胃中提取也存在巨大的发展潜力[44],由于它的活性需要通过接触胃酸来激活,因此被认为是一种酸性蛋白酶[45]。
目前仅有少量研究将胃蛋白酶直接应用于甲壳素提取工艺中,例如武小芳等[46]在提取的过程中加入甲酸来激活胃蛋白酶,并整合脱蛋白和脱钙2个步骤,得到的甲壳素脱蛋白率和脱钙率分别为89%和96%。多数的文献研究都将其应用于提纯壳聚糖,LI等[47]将胃蛋白酶用四甲氧基硅烷和3-氨丙基三甲氧基硅烷固定化,然后应用于壳聚糖的纯化上,研究表明混合硅烷固定化蛋白酶后,脱蛋白效率高于传统化学方法,且壳聚糖只会发生轻微降解。
胃蛋白酶在提取甲壳素方面的研究虽然偏少,但它的酸性工作环境会为同时脱蛋白和脱钙提供可能。而固定化酶技术的应用能在一定程度上解决胃蛋白酶水解壳聚糖以及因酶的引入导致的蛋白质污染难题[47],并且固定化后酶的可回收性增强,则会极大降低生产成本。
3.2.3 木瓜蛋白酶
木瓜蛋白酶是一种提取自木瓜中的半胱氨酸蛋白酶,已经被证明能在较宽pH范围内保持较高活性[48-49]。并且,它是一种非专一性的酶,能作用于多种物质包括壳聚糖。木瓜蛋白酶获取途径相对简单且价格低廉,水解效率也比一般非专一性酶强[50],因此它在甲壳素的相关应用领域存在着极大潜力。
GARTNER等[51]以虾壳为原料利用木瓜蛋白酶提取甲壳素的研究,结果表明提取出的部分甲壳素结构遭到破坏,可能是木瓜蛋白酶的非专一性导致的。在对提取产物成分分析时发现,木瓜蛋白酶能够同时水解蛋白质和脱乙酰化甲壳素,因而会导致壳聚糖的生成。GOPALAKANNAN等[52]探究了木瓜蛋白酶提取甲壳素的最佳条件,研究表明经72 h酶处理提取的甲壳素脱蛋白率为73.1%,产物的脱乙酰化程度高于化学法提取的。虽然已有较多的文献研究证明木瓜蛋白酶会催化壳聚糖进行水解反应,但该酶在成本上远低于壳聚糖酶,且使用其进一步提纯获得的壳聚糖具有较高抗氧化和抗菌活性[53],因此有望应用于提高壳聚糖的附加价值,并发掘壳聚糖在食品保藏方面的发展潜力。
3.2.4 酶法技术发展趋势
目前纯酶的制造成本高昂,直接用于工业生产明显不符合实际需求,因此生物酶的工业生产应用需要进一步的改良。开发更多的生物酶来源是降低成本的一种办法,虾蟹的内脏消化系统中含有多种蛋白酶,即可作为生物酶的原料来源,又可将这些废弃物循环利用[39]。固定化酶技术的应用也能有效降低生产成本,通过重复使用来降低每次生产所需的酶量。此外,将酶蛋白制成微生物酶制剂也是一种降低成本的方法。
同时因为甲壳素本身结构的特殊性,造成酶的可及性较差,因此在提取工艺中添加超声、微波等辅助手段,会打开甲壳素结构中的酶作用位点也是目前的主要发展方向。V ZQUEZ等[54]结合酶专一性和化学试剂高效性开发出更高品质壳聚糖提取工艺,也具有发展成为高效、绿色加工处理甲壳素工艺的潜力。
ZQUEZ等[54]结合酶专一性和化学试剂高效性开发出更高品质壳聚糖提取工艺,也具有发展成为高效、绿色加工处理甲壳素工艺的潜力。
3.3 现代生物技术
基因工程、细胞固定化等现代生物技术的飞速发展也为甲壳素的提取提供了新的发展方向。基因工程可用于对生物合成甲壳素的相关基因信息进行解析,借此构筑基因工程菌或是细胞工厂来直接获取甲壳素。而细胞固定化则可以将细胞固定在各种载体上,载体的渗透性保证了底物的进入和产物的排出,同时将细胞截留在载体内[55]。如果将其与菌种发酵法相结合,有望通过固定化细胞,方便对甲壳素进行回收,为大规模生产提供一定的可行性。
对甲壳素合成酶基因片段的解析已有较多的文献报道,如HAR-DARD TTIR等[56]成功鉴别出鲑疮痂鱼虱上的甲壳素合成酶转录相关的基因片段,并详细探究了整个基因转录的过程。QIU等[57]找到了真菌的中关于甲壳素合成的Zn(II)2Cys6转录因子BbTpc1,BbTpc1突变后的真菌细胞壁会出现异常,这是因为甲壳素合成酶的基因转录被抑制,细胞壁的厚度和甲壳素合成都出现了减少的现象,研究的结果为调控真菌中甲壳素合成提供一定参考。HOU等[58]对小菜蛾进行RNA高通量测序分析,发现影响角质层蛋白、甲壳素合成酶等相关的基因,证明这些基因对昆虫变态过程中角质层的重建起重要作用,为研究再昆虫发育中特定基因的表达奠定了基础。经过不断深入研究积累,ZHANG等[59]利用毕赤酵母作为底盘细胞,通过对甲壳素合成关键酶的基因过表达,构筑出具备生物合成甲壳素途径的工程菌,虽然制备甲壳素的效率较低,但工程菌株的首次构建验证了利用基因工程手段生物合成甲壳素的可行性。
TTIR等[56]成功鉴别出鲑疮痂鱼虱上的甲壳素合成酶转录相关的基因片段,并详细探究了整个基因转录的过程。QIU等[57]找到了真菌的中关于甲壳素合成的Zn(II)2Cys6转录因子BbTpc1,BbTpc1突变后的真菌细胞壁会出现异常,这是因为甲壳素合成酶的基因转录被抑制,细胞壁的厚度和甲壳素合成都出现了减少的现象,研究的结果为调控真菌中甲壳素合成提供一定参考。HOU等[58]对小菜蛾进行RNA高通量测序分析,发现影响角质层蛋白、甲壳素合成酶等相关的基因,证明这些基因对昆虫变态过程中角质层的重建起重要作用,为研究再昆虫发育中特定基因的表达奠定了基础。经过不断深入研究积累,ZHANG等[59]利用毕赤酵母作为底盘细胞,通过对甲壳素合成关键酶的基因过表达,构筑出具备生物合成甲壳素途径的工程菌,虽然制备甲壳素的效率较低,但工程菌株的首次构建验证了利用基因工程手段生物合成甲壳素的可行性。
目前,对于不同物种中甲壳素合成相关的基因已有较多的解析研究,但鲜有关于构建合成甲壳素工程细菌的研究文献。这为未来利用基因工程修改昆虫类的脱皮或变态发育过程中的表皮,来获得大量的甲壳素提供了基础,同时也为构筑工程菌提供了所需的基因片段。而关于甲壳素提取或合成的细胞固定化研究也鲜有报道,但从该技术在其他方面的研究也可看出其未来用于甲壳素提取或合成的发展潜力。LAPPONI MAR A等[60]通过将微生物包埋在海藻酸钠中,获得了一种新型的生物催化剂,实现了抗肿瘤药物克拉曲滨的优化生产,所得催化剂可重复使用次数高达20次。SERVETAS等[61]在同一载体中构筑出两层复合的结构用于固定不同微生物,实现了酒精和乳酸的同时发酵生产,证明了利用复合催化剂实现多步工艺同时进行的可行性,从而有效降低生产成本。由此可以预测,细胞固定化可以与发酵法相结合,能够提高菌株的可重复利用性,方便功能菌株的回收。
A等[60]通过将微生物包埋在海藻酸钠中,获得了一种新型的生物催化剂,实现了抗肿瘤药物克拉曲滨的优化生产,所得催化剂可重复使用次数高达20次。SERVETAS等[61]在同一载体中构筑出两层复合的结构用于固定不同微生物,实现了酒精和乳酸的同时发酵生产,证明了利用复合催化剂实现多步工艺同时进行的可行性,从而有效降低生产成本。由此可以预测,细胞固定化可以与发酵法相结合,能够提高菌株的可重复利用性,方便功能菌株的回收。
4 结语与展望
甲壳素因其独特的性质和存在大量天然来源,受到了食品、医药和能源等行业的青睐。但目前甲壳素供给仍存在着受季节影响的缺陷,主要由原料虾、蟹提取出的甲壳素也会因品种差别导致产品品质波动。传统化学提取法会造成严重环境污染,提高了甲壳素的生产成本,制约了甲壳素大规模的应用。发酵法和生物酶作为一种绿色的提取工艺,具有对环境友好和节约能源的独特优势,但该技术目前面临着甲壳素品质不稳定、难以大规模生产等缺陷。为解决以上难题,可以从以下几方面入手:(1)通过筛选、优化出甲壳素提取的优势菌株,提高生产效率;(2)生物法与其他方法耦合使用,如化学法辅助提取,采用弱酸弱碱来增强生物法的脱钙效果;(3)可以利用产壳聚糖酶菌株,一步法实现提取和脱乙酰化,简化甲壳素从提取到应用的过程,提高整体效率;(4)通过构筑基因工程菌和细胞固定化等新型方法,通过现代生物技术来定向提高提取效率,也有望成为未来研究的方向。绿色提取甲壳素具有巨大发展前景,能够解决从实验室走向工业化的难题,将会释放出甲壳素广阔的应用价值,为实现甲壳素在能源、环境、食品和医药等领域的多功效应用奠定坚实基础。
[1] HAJJI S, GHORBEL-BELLAAJ O, YOUNES I, et al.Chitin extraction from crab shells by Bacillus bacteria.Biological activities of fermented crab supernatants[J].International Journal of Biological Macromolecules, 2015, 79:167-173.
[2] SARAVANA P S, HO T C, CHAE S-J, et al.Deep eutectic solvent-based extraction and fabrication of chitin films from crustacean waste[J].Carbohydrate Polymers, 2018, 195:622-630.
[3] BATTAMPARA P, NIMISHA SATHISH T, REDDY R, et al.Properties of chitin and chitosan extracted from silkworm pupae and egg shells[J].International Journal of Biological Macromolecules, 2020, 161:1 296-1 304.
[4] EL KNIDRI H E, BELAABED R, ADDAOU A, et al.Extraction, chemical modification and characterization of chitin and chitosan:A review[J].International Journal of Biological Macromolecules, 2018, 120:1 181-1 189.
[5] HUET G, HADAD C, GONZ LEZ-DOM
LEZ-DOM NGUEZ J M, et al.IL versus DES:Impact on chitin pretreatment to afford high quality and highly functionalizable chitosan[J].Carbohydrate Polymers, 2021, 269:118332.
NGUEZ J M, et al.IL versus DES:Impact on chitin pretreatment to afford high quality and highly functionalizable chitosan[J].Carbohydrate Polymers, 2021, 269:118332.
[6] SEDAGHAT F, YOUSEFZADI M, TOISERKANI H, et al.Chitin from Penaeus merguiensis via microbial fermentation processing and antioxidant activity[J].International Journal of Biological Macromolecules, 2016, 82:279-283.
[7] SUN C X, YUE P P, CHEN R L, et al.Chitin-glucan composite sponge hemostat with rapid shape-memory from Pleurotus eryngii for puncture wound[J].Carbohydrate Polymers, 2022, 291:119553.
[8] NAIR A, NAIR S C, BANERJI A, et al.Development and evaluation of plumbagin loaded chitin hydrogel for the treatment of skin cancer[J].Journal of Drug Delivery Science and Technology, 2021, 66:102804.
[9] VINODH R, SASIKUMAR Y, KIM H-J, et al.Chitin and chitosan based biopolymer derived electrode materials for supercapacitor applications:A critical review[J].Journal of Industrial and Engineering Chemistry, 2021, 104:155-171.
[10] WANG Z G, LI P Y, FANG Y, et al.One-step recovery of noble metal ions from oil/water emulsions by chitin nanofibrous membrane for further recycling utilization[J].Carbohydrate polymers, 2019, 223:115064.
[11] DING H P, LV L, WANG Z J, et al.Study on the “glutamic acid-enzymolysis” process for extracting chitin from crab shell waste and its by-product recovery[J].Applied Biochemistry and Biotechnology, 2020, 190(3):1 074-1 091.
[12] V ZQUEZ J A, RODR
ZQUEZ J A, RODR GUEZ-AMADO I, MONTEMAYOR M I, et al.Chondroitin sulfate, hyaluronic acid and chitin/chitosan production using marine waste sources:Characteristics, applications and eco-friendly processes:A review[J].Marine Drugs, 2013, 11(12):747-774.
GUEZ-AMADO I, MONTEMAYOR M I, et al.Chondroitin sulfate, hyaluronic acid and chitin/chitosan production using marine waste sources:Characteristics, applications and eco-friendly processes:A review[J].Marine Drugs, 2013, 11(12):747-774.
[13] MANNI L L, GHORBEL-BELLAAJ O, JELLOULI K, et al.Extraction and characterization of chitin, chitosan, and protein hydrolysates prepared from shrimp waste by treatment with crude protease from Bacillus cereus SV1[J].Applied Biochemistry and Biotechnology, 2010, 162(2):345-357.
[14] 纪蕾, 刘天红, 王颖, 等.鹰爪虾加工副产物制备甲壳素关键技术研究[J].食品与发酵科技, 2021, 57(5):64-71.
JI L,LIU T H,WANG Y,et al.Study of key technology on chitin preparation from processing wastes of Trachypenaeus curvirostris[J].Food and Fermentation Sciences &Technology, 2021, 57(5):64-71.
[15] ZHANG X, MAO Y M, BRIBER R M.Efficient production of oligomeric chitin with narrow distributions of degree of polymerization using sonication-assisted phosphoric acid hydrolysis[J].Carbohydrate Polymers, 2022, 276:118736.
[16] HUAN J J, SHEN J J, WANG B J, et al.High yield production of chitin nanocrystals via hydrochloric acid vapor pre-treatment[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2022, 641:128567.
[17] 何兰珍, 杨丹, 刘毅, 等.制备甲壳素过程中 EDTA 脱钙法的研究[J].食品与生物技术学报, 2008, 27(4):49-52.
HE L Z, YANG D, LIU Y, et al.Study on the preparation of chitin with EDTA decalcify method[J].Journal of Food Science and Biotechnology, 2008, 27(4):49-52.
[18] 杨丹, 何兰珍, 刘毅.从虾蛄壳制备甲壳素和壳聚糖的研究[J].食品科学, 2006, 27(12):437-439.
YANG D, HE L Z, LIU Y.Study on the preparation of chitin, chitosan from Squilla oratoria shell[J].Food Science, 2006, 27(12):437-439.
[19] 窦勇, 胡佩红, 顾鹏程.超声波辅助EDTA法提取淡水小龙虾壳中甲壳素的工艺研究[J].广东农业科学, 2014, 41(22):87-91.
DOU Y, HU P H, GU P C.Extracting chitin in freshwater crayfish shell with ultrasonic assisted EDTA method[J].Guangdong Agricultural Sciences, 2014, 41(22):87-91.
[20] KAUR G, KUMAR H, SINGLA M.Diverse applications of ionic liquids:A comprehensive review[J].Journal of Molecular Liquids, 2022,351:118556.
[21] TOLESA L D, GUPTA B S, LEE M J.Chitin and chitosan production from shrimp shells using ammonium-based ionic liquids[J].International Journal of Biological Macromolecules, 2019, 130:818-826.
[22] LI J, HUANG W C, GAO L, et al.Efficient enzymatic hydrolysis of ionic liquid pretreated chitin and its dissolution mechanism[J].Carbohydrate Polymers, 2019, 211:329-335.
[23] MUKESH C, MONDAL D, SHARMA M, et al.Choline chloride-thiourea, a deep eutectic solvent for the production of chitin nanofibers[J].Carbohydrate polymers, 2014, 103:466-471.
[24] GONTRANI L, PLECHKOVA N V, BONOMO M.In-depth physico-chemical and structural investigation of a dicarboxylic acid/choline chloride natural deep eutectic solvent (nades):A spotlight on the importance of a rigorous preparation procedure[J].ACS Sustainable Chemistry &Engineering, 2019, 7(14):12 536-12 543.
[25] SUN X Y, WEI Q F, YANG Y, et al.In-depth study on the extraction and mechanism of high-purity chitin based on NADESs method[J].Journal of Environmental Chemical Engineering, 2022, 10(1):106859.
[26] HONG S, YUAN Y, YANG Q R, et al.Versatile acid base sustainable solvent for fast extraction of various molecular weight chitin from lobster shell[J].Carbohydrate Polymers, 2018, 201:211-217.
[27] GHORBEL-BELLAAJ O, HMIDET N, JELLOULI K, et al.Shrimp waste fermentation with Pseudomonas aeruginosa A2:Optimization of chitin extraction conditions through Plackett-Burman and response surface methodology approaches[J].International Journal of Biological Macromolecules, 2011, 48(4):596-602.
[28] CAHYANINGTYAS H A A, SUYOTHA W, CHEIRSILP B, et al.Statistical optimization of halophilic chitosanase and protease production by Bacillus cereus HMRSC30 isolated from Terasi simultaneous with chitin extraction from shrimp shell waste[J].Biocatalysis and Agricultural Biotechnology, 2021, 31:101918.
[29] DAYAKAR B, MARTIN XAVIER K A, DAS O, et al.Application of extreme halophilic archaea as biocatalyst for chitin isolation from shrimp shell waste[J].Carbohydrate Polymer Technologies and Applications, 2021, 2:100093.
[30] TASER B, OZKAN H, ADIGUZEL A, et al.Preparation of chitosan from waste shrimp shells fermented with Paenibacillus jamilae BAT1[J].International Journal of Biological Macromolecules, 2021, 183:1 191-1 199.
[31] DOAN C T, TRAN T N, NGUYEN V B, et al.Chitin extraction from shrimp waste by liquid fermentation using an alkaline protease-producing strain, Brevibacillus parabrevis[J].International Journal of Biological Macromolecules, 2019, 131:706-715.
[32] CASTRO R, GUERRERO-LEGARRETA I, B RQUEZ R.Chitin extraction from Allopetrolisthes punctatus crab using lactic fermentation[J].Biotechnology Reports, 2018, 20:e00287.
RQUEZ R.Chitin extraction from Allopetrolisthes punctatus crab using lactic fermentation[J].Biotechnology Reports, 2018, 20:e00287.
[33] HAJJI S, GHORBEL-BELLAAJ O, YOUNES I, et al.Chitin extraction from crab shells by Bacillus bacteria.Biological activities of fermented crab supernatants[J].International Journal of Biological Macromolecules, 2015, 79:167-173.
[34] ZHANG Q, WANG L Y, LIU S G, et al.Establishment of successive co-fermentation by Bacillus subtilis and Acetobacter pasteurianus for extracting chitin from shrimp shells[J].Carbohydrate Polymers, 2021, 258:117720.
[35] ARANDAY-GARC A R, ROM
A R, ROM N GUERRERO A, IFUKU S, et al.Successive inoculation of Lactobacillus brevis and Rhizopus oligosporus on shrimp wastes for recovery of chitin and added-value products[J].Process Biochemistry, 2017, 58:17-24.
N GUERRERO A, IFUKU S, et al.Successive inoculation of Lactobacillus brevis and Rhizopus oligosporus on shrimp wastes for recovery of chitin and added-value products[J].Process Biochemistry, 2017, 58:17-24.
[36] LIU Y L, XING R E, YANG H Y, et al.Chitin extraction from shrimp (Litopenaeus vannamei) shells by successive two-step fermentation with Lactobacillus rhamnoides and Bacillus amyloliquefaciens[J].International Journal of Biological Macromolecules, 2020, 148:424-433.
[37] XIE J W, XIE W C, YU J, et al.Extraction of chitin from shrimp shell by successive two-step fermentation of Exiguobacterium profundum and Lactobacillus acidophilus[J].Frontiers in Microbiology, 2021, 12:677126.
[38] ZHANG H C, JIN Y F, DENG Y, et al.Production of chitin from shrimp shell powders using Serratia marcescens B742 and Lactobacillus plantarum ATCC 8014 successive two-step fermentation[J].Carbohydrate Research, 2012, 362:13-20.
[39] YOUNES I, HAJJI S, FRACHET V, et al.Chitin extraction from shrimp shell using enzymatic treatment.Antitumor, antioxidant and antimicrobial activities of chitosan[J].International Journal of Biological Macromolecules, 2014, 69:489-498.
[40] HAMDI M, HAMMAMI A, HAJJI S, et al.Chitin extraction from blue crab (Portunus segnis) and shrimp (Penaeus kerathurus) shells using digestive alkaline proteases from P.segnis viscera[J].International Journal of Biological Macromolecules, 2017, 101:455-463.
[41] MHAMDI S, KTARI N, HAJJI S, et al.Alkaline proteases from a newly isolated Micromonospora chaiyaphumensis S103:Characterization and application as a detergent additive and for chitin extraction from shrimp shell waste[J].International Journal of Biological Macromolecules, 2017, 94:415-422.
[42] HAMMAMI A, HAMDI M, ABDELHEDI O, et al.Surfactant- and oxidant-stable alkaline proteases from Bacillus invictae:Characterization and potential applications in chitin extraction and as a detergent additive[J].International Journal of Biological Macromolecules, 2017, 96:272-281.
[43] CUI D D, YANG J, LU B S, et al.Extraction and characterization of chitin from Oratosquilla oratoria shell waste and its application in Brassica campestris L.ssp[J].International Journal of Biological Macromolecules, 2022, 198:204-213.
[44] KUEPETHKAEW S, ZHANG Y, KISHIMURA H, et al.Enzymological characteristics of pepsinogens and pepsins purified from lizardfish (Saurida micropectoralis) stomach[J].Food Chemistry, 2022, 366:130532.
[45] SANTOS MATEUS P F, PORF RIO MARJORIE C P, JUNIOR EVALDO C, et al.Pepsin immobilization:Influence of carbon support functionalization[J].International Journal of Biological Macromolecules, 2022, 203:67-79.
RIO MARJORIE C P, JUNIOR EVALDO C, et al.Pepsin immobilization:Influence of carbon support functionalization[J].International Journal of Biological Macromolecules, 2022, 203:67-79.
[46] 武小芳, 刘燕, 刘建辉, 等.酸酶一步法对蟹壳脱矿物质和蛋白质作用的研究[J].河北农业大学学报, 2017, 40(5):72-77.
WU X F, LIU Y, LIU J H, et al.Demineralization and deproteinization of crab shell by acid-enzyme single-step method[J].Journal of Hebei Agricultural University, 2017, 40(5):72-77.
[47] LI B, ZHANG J L, DAI F T, et al.Purification of chitosan by using sol-gel immobilized pepsin deproteinization[J].Carbohydrate Polymers[J].Carbohydrate Polymers, 2012, 88(1):206-212.
[48] TACIAS-PASCACIO V G, CASTA EDA-VALBUENA D, MORELLON-STERLING R, et al.Bioactive peptides from fisheries residues:A review of use of papain in proteolysis reactions[J].International Journal of Biological Macromolecules, 2021, 184:415-428.
EDA-VALBUENA D, MORELLON-STERLING R, et al.Bioactive peptides from fisheries residues:A review of use of papain in proteolysis reactions[J].International Journal of Biological Macromolecules, 2021, 184:415-428.
[49] MARINA H, DZHIGANGIR F, VICTORIA K, et al.Novel biotechnological formulations of cysteine proteases, immobilized on chitosan.structure, stability and activity[J].International Journal of Biological Macromolecules, 2021, 180:161-176.
[50] 谭晶, 陈季旺, 夏文水, 等.木瓜蛋白酶对壳聚糖降解作用的研究[J].武汉工业学院学报, 2008,27(2):7-11.
TAN J, CHEN J W, XIA W S, et al.Studies on Hydrolysis of Chitosan by Papain[J].Journal of Wuhan Polytechnic University, 2008,27(2):7-11.
[51] GARTNER C, PEL EZ C A, L
EZ C A, L PEZ B L.Characterization of chitin and chitosan extracted from shrimp shells by two methods[J].e-Polymers, 2010, 10(1):69.
PEZ B L.Characterization of chitin and chitosan extracted from shrimp shells by two methods[J].e-Polymers, 2010, 10(1):69.
[52] GOPALAKANNAN A, JASMINE G I, SHANMUGAM S, et al.Application of proteolytic enzyme, papain for the production of chitin and chitosan from shrimp waste[J].Journal of the Marine Biological Association of India, 2000, 42:167-172.
[53] LAOKULDILOK T, POTIVAS T, KANHA N, et al.Physicochemical, antioxidant, and antimicrobial properties of chitooligosaccharides produced using three different enzyme treatments[J].Food Bioscience, 2017, 18:28-33.
[54] V ZQUEZ J A, NORIEGA D, RAMOS P, et al.Optimization of high purity chitin and chitosan production from Illex argentinus pens by a combination of enzymatic and chemical processes[J].Carbohydrate Polymers, 2017, 174:262-272.
ZQUEZ J A, NORIEGA D, RAMOS P, et al.Optimization of high purity chitin and chitosan production from Illex argentinus pens by a combination of enzymatic and chemical processes[J].Carbohydrate Polymers, 2017, 174:262-272.
[55] LAPPONI M J, MÉNDEZ M B, TRELLES J A, et al.Cell immobilization strategies for biotransformations[J].Current Opinion in Green and Sustainable Chemistry, 2022, 33:100565.
[56] HAR-DARD TTIR H M, MALE R E, NILSEN F, et al.Chitin synthesis and degradation in Lepeophtheirus salmonis:Molecular characterization and gene expression profile during synthesis of a new exoskeleton[J].Comparative Biochemistry and Physiology, Part A, 2019, 227:123-133.
TTIR H M, MALE R E, NILSEN F, et al.Chitin synthesis and degradation in Lepeophtheirus salmonis:Molecular characterization and gene expression profile during synthesis of a new exoskeleton[J].Comparative Biochemistry and Physiology, Part A, 2019, 227:123-133.
[57] QIU L, ZHANG J, SONG J Z, et al.Involvement of BbTpc1, an important Zn(II)2Cys6 transcriptional regulator, in chitin biosynthesis, fungal development and virulence of an insect mycopathogen[J].International Journal of Biological Macromolecules, 2021, 166:1 162-1 172.
[58] HOU Q L, CHEN E H.RNA-seq analysis of gene expression changes in cuticles during the larval-pupal metamorphosis of Plutella xylostella[J].Comparative biochemistry and physiology Part D, Genomics &proteomics, 2021, 39:100869..
[59] ZHANG X, ZHANG C Y, ZHOU M, et al.Enhanced bioproduction of chitin in engineered Pichia pastoris[J].Food Bioscience, 2022, 47:101606.
[60] LAPPONI MAR A J, BRITOS CLAUDIA N, RIVERO CINTIA W, et al.Biotransformation of cladribine using a stabilized biocatalyst in calcium alginate beads[J].Biotechnology Progress, 2020, 36(2):e2927.
A J, BRITOS CLAUDIA N, RIVERO CINTIA W, et al.Biotransformation of cladribine using a stabilized biocatalyst in calcium alginate beads[J].Biotechnology Progress, 2020, 36(2):e2927.
[61] SERVETAS I, BERBEGAL C, CAMACHO N, et al.Saccharomyces cerevisiae and Oenococcus oeni immobilized in different layers of a cellulose/starch gel composite for simultaneous alcoholic and malolactic wine fermentations[J].Process Biochemistry, 2013, 48(9):1 279-1 284.