胶原蛋白是肌腱、皮和骨骼等构成的主要结构蛋白,约占人和动物体内蛋白质总量的30%左右。胶原蛋白来源范围广,目前已在组织内鉴定出至少29种类型的胶原蛋白,不同体内组织中胶原蛋白的分布和含量存在差异[1]。不同类型的胶原蛋白具有相似的一级结构,其二级和三级结构存在差异。胶原蛋白一级结构含有规则的三肽重复结构Gly-X-Y,其中X和Y为亚氨基酸;多肽链经折叠、盘绕和卷曲构成胶原蛋白的二级结构,重复的肽段排序使得多肽链均为α多肽链;空间结构是由3条多肽链缠绕而成的右手三螺旋结构,其中Gly分布在螺旋的中心,其余氨基酸分布在两侧,螺旋结构进行交联聚合形成胶原纤维,胶原两端的非螺旋结构表现出不同的特性。独特的结构使其具有稳定的分子结构,使得胶原蛋白能够保持和支撑机体稳定[2]。胶原蛋白功能价值高,胶原蛋白含有其他蛋白中不具有的羟脯氨酸,因其独特的弱抗原性、生物相容性、生物降解性和无毒性被广泛用于生物医学、化妆品和食品工业中[3]。
胶原分子内各种次级键维持其高度有序的三螺旋结构,胶原在各种复杂因素的影响下,其自由氨基数、胶原分子半径、胶原聚合体缠绕程度等结构随之发生变化;流变特性作为胶原溶液重要性质之一,在胶原产品研发过程中会改变黏弹性、流动性和抗应变性能等理化特性,可在很大程度上反映产品品质和材料性能,胶原结构上的变化会导致流变性能的变化[4]。因此,系统总结影响胶原流变特性因素有助于研究者揭示产品品质与流变特性之间的规律,从而有目的性地调控产品品质,对于获得高稳定性产品具有十分重要的意义。
前人主要研究了单一影响因素对于胶原结构和流变性能的影响,并未系统总结内部和外部因素与其结构和流变性质的关系,对于胶原根据流变特性的应用领域并未全面阐述。本文主要综述了胶原的结构和流变性能,系统总结了不同作用因素对于胶原结构和流变特性的影响,充分挖掘胶原流变性能与应用方面的联系,对于指导生产胶原基材料具有一定的理论指导意义,本综述主要思路结构图如图1所示:
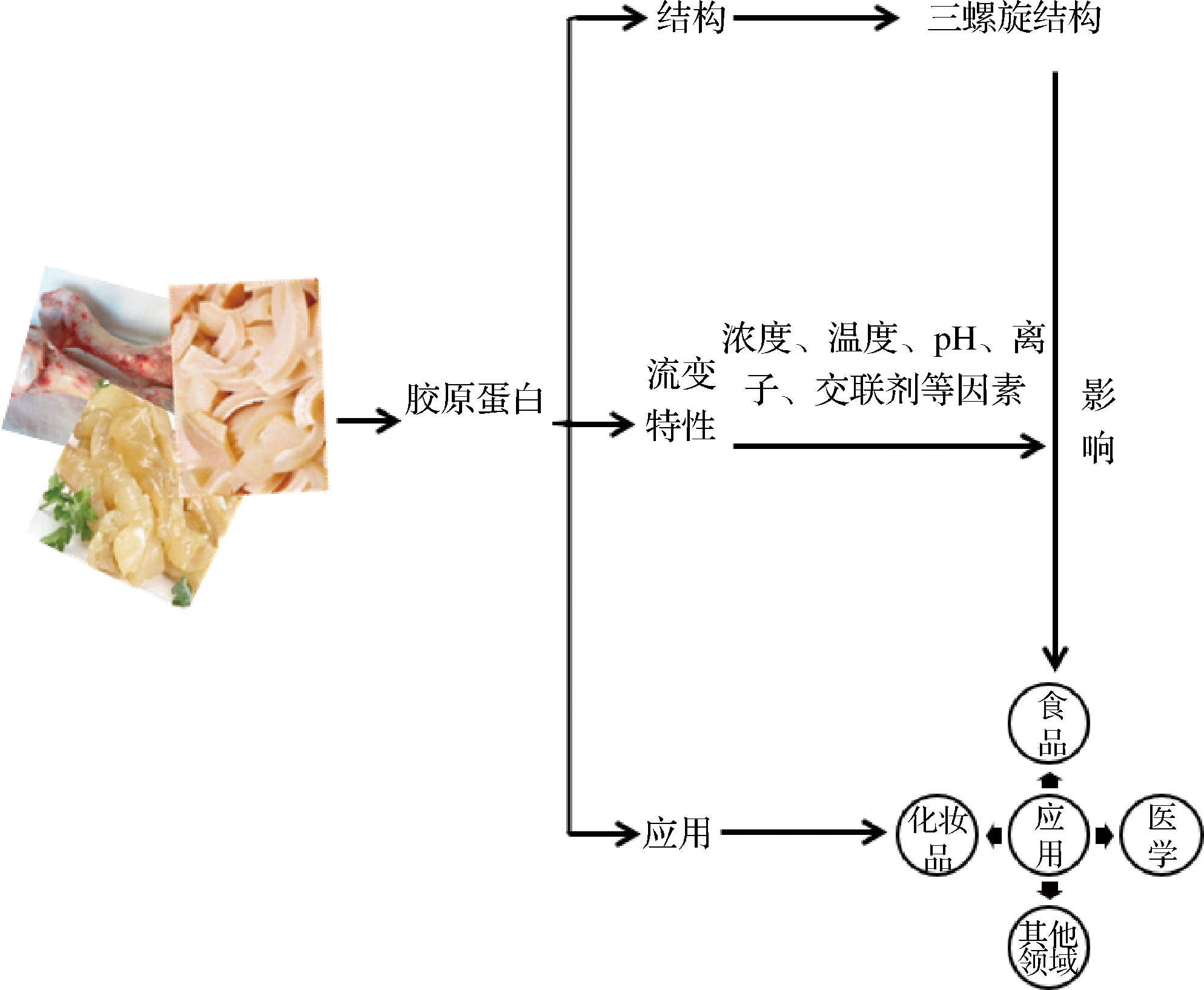
图1 文章思路结构图
Fig.1 The idea structure of the article
1 胶原蛋白的流变特性
流变学是属于力学范围的一种,主要研究物体受到外力作用而发生形变和产生流动变化规律,对于食品级产品加工过程中形变及流动问题的研究即为食品流变学,是表征物料流动特性的重要指标。如表1所示,根据测定方式和仪器的不同,主要可以分为五类。然而随着技术的发展和测定精度要求的不断提高,目前流变性能测定方式主要以锥板旋转式法为主,其从不同应力作用方式来看,主要分为动态测试、静态测试、蠕变测试和触变测试。动态频率测试中储能模量(G′)和损耗模量(G″)以及损耗因子(tan δ=G″/G′)反映蛋白网络结构致密程度及稳定性;静态流变反映材料在相对静止环境中,材料在剪切速率(γ)范围中的黏度变化;蠕变测试是将制备好的胶原溶液置于锥-板夹具中,记录施加和去除应力后样品的蠕变状况。触变测试与静态流变相似,其表示胶原在不同剪切速率下剪切应力的变化情况[5]。
胶原蛋白虽然具有稳定的三螺旋结构,但受到外界条件的影响而存在许多挑战,如水蒸气阻隔性能弱、机械强度差、流变性质不佳和易热变性等弊端,因此限制了纯胶原更广泛的应用范围。胶原流变特性与生物环境、胶原种类、分子结构等内部因素密切相关,除自身因素影响之外,温度、pH、料液浓度、离子强度等外界因素都决定着胶原的流变特性,此外,微波、超声波、超高压等新兴技术也会不同程度影响胶原流变特性[6]。本文主要总结影响胶原流变特性的诸多因素,并对添加不同外源物以改良其流变性质相关研究进展进行描述,以期达到更多胶原类材料产品研发和扩大胶原应用领域的目的。
表1 流变学特性检测方法
Table 1 Testing methods for rheological properties

检测方法操作方法测定类型优缺点适用范围毛细管测定法在压力作用下,根据流体的压力差或者自身质量,经过一定长度和半径的标准毛细管所需的时间,计算得出样品黏度。NF优点:操作简便,测量范围广缺点:精度不高,无法测定与时间的关系低黏度物质圆筒旋转式测定法将样品加入两个两个圆筒之间,其中一筒开始旋转,根据线速度和角速度等计算得出结果。NF、NNF优点:切变速率接近均一,容易校正缺点:对于黏度较高的聚合物不易装料聚合物溶液、乳液、悬浮液等锥板旋转式测定法将待测样液平板中央,移动平板至圆锥下部,圆锥进行转动,根据静止平板和旋转圆锥之间产生的切变得出样品黏度NF、NNF优点:切变速度相同,操作简便,需要样品量较少缺点:易受外界影响胶体和高分子溶液落球式测定法在特定温度下,含有样液的垂直玻璃管内使玻璃球或钢球自由落下,由球落下的速度和质量计算得出样品黏度。NF优点:高精确度,操作简便,不受外界影响缺点:需要样品量较多低黏度物质平行板旋转式测定法将样品置于平行板间,转动上板或下板,根据两板之间的高度、样品重量等参数计算得出样品黏度。NF、NNF优点:操作简便,可用于表征弹性的第一法向应力差缺点:精确度不高胶体和高分子溶液
注:NF指牛顿流体;NNF指非牛顿流体
2 胶原流变性质影响因素
2.1 内部因素对胶原流变性质影响
2.1.1 胶原蛋白浓度
流变性中G′、G″在一定范围内与胶原蛋白浓度的平方存在正相关的关系。随着胶原蛋白浓度的增加,动态频率测试中G′增加,表明样品内部结构变得更加紧密,因此高浓度胶原溶液更有利于提高黏弹性[7]。大量国内外学者都研究证实了这一观点,庄晓丽[8]通过频率扫描确定线性弹性区,并进行动态和稳态的流变测试,研究发现在胶原蛋白浓度0%至4.6%的范围内,分子链缠结随着质量浓度的增加而影响体系的运动,缠绕增强使得整个体系变得稳定。LI等[9]发现随着鱼鳔胶原浓度的增加,G″和G′同时增大,但是G′比G″的上升更快,因此溶液体系中弹性起主导作用。与之相似地,琚海燕等[10]考察0.5%、1.0%和1.5%添加量下的胶原纤维溶胀液的剪切应力与剪切速率之间的规律变化,研究发现,剪切应力随着剪切速率的增大而增大,曲线走势凸向剪切应力,但表面黏度与其呈现负相关,因此可得出胶原溶液存在剪切稀释现象。以胶原为基料进行加工利用时,若浓度较高可赋予胶原溶液近乎固体的黏弹性,因此可根据黏弹性需求调控胶原浓度。
2.1.2 胶原蛋白提取方式
胶原蛋白稳定的三螺旋结构使其具有较低的溶解性,作为纤维蛋白,在特定的条件下才能溶解。可利用多种方式提取得到不同类型的胶原蛋白,目前主要有酸法提取、碱法提取、酶法提取以及多种方式组合提取得到胶原蛋白,不同工艺提取的胶原蛋白流变特性存在着显著地差异。马帅[11]研究发现浓度对不同工艺提取的胶原溶液流变学特性存在显著性差异,相同剪切速率情况下,浓度对酶法提取胶原溶液流变学性能影响更明显。蔡路昀等[12]也有类似发现,其选择采用酸法和酶法从鲽鱼鱼骨制备出2种不同溶解性胶原蛋白,研究中发现不同的振荡频率影响着不同胶原溶液G′和G″,低振荡频率时两者差异性不明显,但当振荡频率为5.5~10 Hz时,弹性特征较突出且酶法提取得到的胶原溶液G′和G″增长速率更为明显。温慧芳等[13]采用碱法、盐法、酸法、热水法与酶法等方式对鮰鱼皮中胶原蛋白含量进行提取,并对5种类型胶原蛋白流变学特性进行比较,结果发现盐溶性胶原和碱法提取的胶原黏性模量和弹性模量交点相对较高,分别为1.78 rad/s和1.30 rad/s,其余3种蛋白交点出现在1.0 rad/s附近,原因可能与胶原分子运动以及分子内临近链中的N—H和C—O形成的氢键有关。胶原蛋白不同提取方式环境温度和程度不同,因此会影响胶原独特三螺旋结构,当胶原提取环境相对刺激时,导致胶原蛋白三螺旋空间结构被破坏,结果会使得胶原分子内流动性增加,表现出较高频率的交点[14]。
2.2 环境因素对胶原流变性质影响
2.2.1 温度对胶原流变性质的影响
温度的升高有利于分子间的运动,加剧了分子碰撞的频率,分子间相互作用增大了维持胶原结构的力,改变了胶原流变特性[15]。关于胶原蛋白流变特性与温度关系的研究,李剑瑛[16]主要探究了赤魟鱼胶原处于不同温度下弹性模量和黏性模量随频率变化规律,研究结果发现,当温度低于30 ℃时,变现为黏性特征,G′和G″的变化与温度之间呈现负相关关系,即G′和G″随着温度的升高而出现下降趋势;但是两者在温度高于30 ℃后随温度变化不明显,且频率高于1 Hz时,弹性模量出现了急剧下降。国外研究者也发现了类似现象,JU等[17]研究胶原溶液G′和G″与温度之间的关系,在温度小于45 ℃条件下,G′和G″随温度升高而出现下降,黏度从3.75 Pa·s下降至0.651 Pa·s,当温度大于45 ℃时,表现出无规律趋势。胶原蛋白在一定温度下能够维持天然的三螺旋结构,当处理条件达到变性温度时,非共价键的稳定性会被破坏,将会导致胶原分子结构杂乱无序,水分子排除,其系统网络结构被破坏,降低胶原在热变性过程中G′[18]。
2.2.2 pH对胶原流变性质的影响
pH作为胶原产品加工过程中重要的影响因素之一,这主要归因于在不同的pH的体系中,会使得胶原表面正负电荷的增减,电位差产生的作用力造成胶原纤维间各类次级键变化,将会导致蛋白结构处于聚集体和松散体之间转换,从而影响流变行为[19]。狄雯雯等[20]发现3 mg/mL的纯猪皮胶原在pH=7.2时体系黏度最大,强酸强碱都会造成黏度的下降,但是当pH调成11时,胶原分散体系黏度又有所升高,均表现为正触变性。其他研究者也有同样的发现,钟朝辉等[21]发现pH为3时,鱼鳞胶原黏度最大,pH在6~9时黏度处于最低状态,但是继续升高后黏度又开始上升。XU等[22]以胶原为材料制备薄膜时发现胶原纤维的溶胀程度与分散液的酸碱度有关,试验结果证明胶原纤维分散液在pH为3时溶胀度最高,研究中也发现在此条件下,分散液的假塑系数最小,因此其具有较强的假塑性;同时动态黏弹行为结果显示,由于pH=3时胶原纤维分子延展最大,胶原纤维间作用力最大,因此该条件下体系有最大的G′和G″。国外学者也有类似研究结论,LLOYD[23]研究结果显示在pH为2.2和11.8时,胶原分散液分别在酸性和碱性环境下溶胀度最大。胶原在不同pH的诱导条件下,会引起胶原的空间结构发生不同程度的相互缠绕,从而影响黏度升降,在胶原材料生产中根据实际需求进行调控pH以达到目的产物[24]。
2.2.3 离子对胶原流变性质的影响
胶原属于聚两性电解质,当溶液中加入离子时,离子会通过筛选带电基团来降低胶原分子之间的排斥力,从而胶原溶液的流变性质以及其他特性在一定程度上会受到影响。马建瑞[25]在研究银离子浓度对胶原溶液性质作用时发现,高浓度的银离子浓度有利于复合凝胶G′应变区范围缩小,从而会使得胶原凝胶力学强度增大,其中银离子浓度达到16 mg/mL时,力学强度达到最大,当浓度继续增加时,力学强度反而出现了下降趋势。李宇龙[26]主要研究了盐溶液对胶原溶液作用,研究结果证明,不同浓度氯化钠溶液的加入对于胶原溶液黏度影响显著,随着加入盐量的增加,胶原溶液的黏度反而是下降的,原因可能是因为氯化钠起着静电屏蔽作用。在一些哺乳动物基胶原形成纤维的过程中,磷酸根离子浓度与胶原之间的静电相互作用对于此过程影响效果显著,将通过改变静电斥力以调节这些分子的聚集,并且主要影响着胶原纤维过程中的滞后阶段[27]。相同条件下,离子种类的不同会对胶原溶液带来截然不同的状态,同时影响整个体系的流变状态[28]。通过离子对胶原溶液流变特性和理化特性规律的研究,在胶原类材料加工中可以通过改变离子的种类和添加量进一步控制产品质量,更有利于调控符合产品需求的流变性质。
2.2.4 交联剂对胶原流变性质的影响
胶原的在特殊环境下结构稳定性较差,限制了胶原蛋白在一些特殊领域的应用,因此通过交联方式来提升胶原材料的稳定性显得尤为必要[29]。在医学领域,宿丹丹[30]利用不同浓度、比例的胶原蛋白、聚乙二醇和聚多巴胺成功制备自愈合水凝胶,其中1 mg/mL的聚多巴胺溶液对于复合水凝胶表观黏度更为显著,该浓度也在不同聚合时间内表观黏度高于其他浓度,所以在一定的剪切速率范围条件下,自愈合水凝胶具有良好的剪切稀释性。另外,有学者探索了氧化纤维素交联改性胶原水凝胶流变特性,与未交联的水凝胶相比,两者G′和释放模量具有相同的增长趋势,但是改性后水凝胶趋势更加明显,随着培养时间的延长,引入氧化纤维素的胶原水凝胶具有良好的力学和流变特性,G′和G″约提高了10倍,同时相比较于戊二醛、甲醛等化学交联剂,氧化纤维素拥有良好的生物相容性和弱的细胞毒性[31]。通过监测黏弹行为的时间演变规律可以较好地调控胶原纤维流变性能。RAN等[32]研究证明磺化壳聚糖的加入有利于胶原的弹性和黏度,其二者持续增加直到平衡,同时磺化壳聚糖可以延长胶原溶液的凝胶化时间,凝胶化时间从12.48 min随着磺化壳聚糖加入量的增加延长至16.6 min,未来在组织工程中有良好的应用前景。交联剂在稳定胶原三螺旋结构发挥着重要的作用,通过交联剂,可以改善胶原的空间结构,使其具有更好的机械性能和流变性能,打破胶原在一些领域无法利用的局限性,更有利于胶原类产品的开发利用。
3 胶原蛋白的应用
近年来,人们较为重视动物副产物综合利用,且胶原蛋白提取新技术不断发展,胶原蛋白应用也越来越广泛。目前,充分利用胶原蛋白流变性质已成为学者研究的热点,众多学者在纯胶原蛋白的基础上,通过改变影响纯胶原蛋白的流变特性的因素条件,较大程度上增加了胶原蛋白的应用适应性。胶原蛋白作为一种绿色健康的天然生物材料,因其独特的三螺旋结构和理化特性,其被广泛应用在医学、化妆品、食品工业等其他领域。
3.1 胶原蛋白在医学领域的应用
作为具有免疫原性和高生物相容性的胶原蛋白可以凝胶、粉末、薄膜、纤维等状态存在,因此在生物医学领域可用于医用敷料、止血材料、骨支架、载药材料等方面,并能参与人体细胞内的迁移、分化和增殖,使得骨组织具有一定的力学强度和皮肤更易愈合[33]。YANG等[34]利用动物蛋白与黄芩和淀粉为主要原料,采用戊二醛进行交联,制得胶原蛋白烧伤愈合膜,结果表明,新制的愈合膜不仅具有细胞适应性,而且还具有良好的抗菌、消炎作用。新型愈合膜的使用可降低药物释放的速度,增加药效和减少伤口愈合时间。袁晓龙等[35]用1-乙基-3-(3-二甲基氨基丙基) 碳二亚胺/N-羟基丁二酰亚胺作为交联剂处理从太平洋鳕鱼鱼皮中提取的胶原蛋白,并以交联后的胶原蛋白制备出透明度高和空隙均匀的三维胶原支架,支架的应用并未改变组织细胞的活力。JANA等[36]利用瓜尔豆胶和鱼鳞胶原与头孢他啶药物发生非共价离子间相互作用,研究表明,发生交联后制得的膜能够抗金黄色葡萄球菌和铜绿假单胞菌生长活性,同时表现出优良的生物相容性。
除此之外,胶原蛋白及其复合材料在人造皮肤、人工血浆、修复周围神经缺损等生物材料方面的研究也相对较多[37]。
3.2 胶原蛋白在化妆品领域的应用
胶原蛋白存在保湿、修复、抗皱和美白等功效,作为一种常用的化妆品原料,因其具有低成本和无毒无害的优点,近些年得到很快的发展。张鸽[38]将碱性蛋白酶用于酶解东方鲀鱼皮并将产生的胶原蛋白肽进行体外刺激实验评价,从实验结果可以得出,当在皮肤表面涂抹1.5 g/mL胶原蛋白肽溶液后,Epi Skin皮肤模型中细胞平均相对成活率为93%,在进行羊角膜浑浊渗透试验时,加入相同浓度胶原蛋白肽后,通过评价反应得分为-0.187,2个实验测定的结果皆在无刺激评分范围内,因此说明胶原蛋白肽的加入对皮肤刺激性弱,可用作化妆品辅料。杨华等[39]通过向提取的皮胶原蛋白添加适量的纤维素衍生物、淀粉、保湿剂和交联剂等辅料研制出一种保湿面膜,结果表明,不仅具有较优的拉伸性和附着力,还具有良好的双重保湿功能。CHOR等[40]从牛蛙皮肤中提取Ⅰ型胶原蛋白,对其进行交联后形成胶原交联聚合物基质,通过与抗菌物质进行混合改变胶原基质的流变特性从而将其作为药用抗菌敷料应用于伤口处理和愈合。除此之外,目前市场众多知名品牌的化妆品厂商销售的面膜、眼霜、保湿霜、乳液等都含有胶原蛋白[41]。
3.3 胶原蛋白在食品工业上的应用
胶原蛋白作为体内不可缺少的蛋白质组成部分,当体内胶原蛋白含量不足时,机体的内分泌系统可能会发生紊乱,各个器官受到不同程度的影响。近些年的研究表明,通过添加酶和改变反应条件,酶解后产生的胶原蛋白肽流动性更佳,易被肠道直接吸收,可在短时间内更高效地补充蛋白质[42]。GOLDFARB等[43]通过改变胶原流变和机械性能制造出一种可以包埋多种调味成分的胶原蛋白膜,首先其在酸性条件下混合碎皮浆和纤维素形成凝胶,从而包埋调味成分,将混合物加入肉制品中明显提高了产品的风味和香气。董世荣等[44]发现将胶原蛋白肽加入凝固型酸奶中,可明显降低其硬度和胶着性,相比于空白组,肽的添加改变了酸奶的黏度。除此以外,胶原蛋白良好的功能性质使其在干酪、糖果、灌肠、发酵酸牛乳及面包中也被经常使用[45]。
3.4 胶原蛋白在其他领域的应用
除了将胶原蛋白应用于生物医药、化妆品等前沿和热门领域,其也常被用于传统行业。制酒过程中产生的不溶杂物严重影响产品品质,鱼胶中的明胶可与浑浊物吸附后过滤出去,还用于改善饮料长期存放过程中产生的浑浊沉淀[46]。在纺织品生产过程中使用的化学辅助剂虽具备多种提高纺织物的品质的作用,但是对于人体也有较大的伤害,使用胶原蛋白改性纤维来代替纺织工业所需的化学助剂,既能提高纺织物品质又对人体无害,可发挥两者的各自优势[47]。因胶原具有良好的可塑性常被用于3D打印,曾有研究者通过调控条件利用胶原与生物墨水结合打印出部分身体器官,试验中器官表现出良好的生物相容性[48]。近年来随着研究不断深入,胶原蛋白还被应用于多孔支架、包装材料及建筑陶瓷等领域[49]。
4 总结
我国是世界上畜禽和渔业生产加工贸易大国,加工生产过程中产生的皮、骨等副产物是优良的胶原来源。流变特性作为胶原的重要性质之一,目前国内研究主要集中在温度、pH和提取条件对胶原流变性质的影响,在外源添加物对流变性质影响方面探究较少。随着对于胶原流变性质研究的不断深入,未来可根据特定需求定向改变胶原性质,提高其稳定性和流变特性,胶原在生物医学、化妆品、食品工业等其他新兴领域将会有广阔的应用前景。
[1] HASHIM P, SOFBERI M M, BAKAR J, et al.Collagen in food and beverage industries[J].International Food Research Journal, 2015, 22(1):1-8.
[2] SHOULDERS M D, RAINES R T.Collagen structure and stability[J].Annual Review of Biochemistry, 2009,78(1):929-958.
[3] DING C C, ZHANG M, LI G Y.Rheological properties of collagen/hydroxypropyl methylcellulose (COL/HPMC) blended solutions[J].Journal of Applied Polymer Science, 2014, 131(7):2 540-2 540.
[4] M RCIO D P, GOISSIS G, VIRG
RCIO D P, GOISSIS G, VIRG NIA C A M, et al.Injectable gels of anionic collagen:Rhamsan composites for plastic correction:Preparation, characterization, and rheological properties[J].Journal of Biomedical Materials Research Part B Applied Biomaterials, 2010, 75(2):393-399.
NIA C A M, et al.Injectable gels of anionic collagen:Rhamsan composites for plastic correction:Preparation, characterization, and rheological properties[J].Journal of Biomedical Materials Research Part B Applied Biomaterials, 2010, 75(2):393-399.
[5] ZHONG Q, DAUBERT C R. Food Rheology[M]. New York: William Andrew Publishing 2007:391-414.
[6] NAN J, ZOU M, WANG H, et al. Effect of ultra-high pressure on molecular structure and properties of bullfrog skin collagen[J]. International Journal of Biological Macromolecules: Structure, Function and Interactions, 2018, 111:200-207.
[7] SAWYER W M, FERRY J D.Mechanical properties of substances of high molecular weight.VII.rigidities of polyvinyl acetate solutions in various solvents[J].Journal of the American Chemical Society, 1950, 72(11):5 030-5 034.
[8] 庄晓丽. 胶原蛋白分散体系流变性质研究[D].济南:齐鲁工业大学, 2017.
ZHUANG X L.Research on rheological properties of collagen dispersion system [D].Jinan:Qilu University of Technology, 2017.
[9] LI C H, DUAN L, TIAN Z H, et al.Rheological behavior of acylated pepsin-solubilized collagen solutions:Effects of concentration[J].Korea-Australia Rheology Journal, 2015, 27(4):287-295.
[10] 琚海燕, 刘萌, 但卫华, 等.胶原纤维溶胀液的流变特性研究[J].功能材料, 2014, 45(11):11 110-11 114.
JU H Y, LIU M, DAN W H, et al.Study on rheological properties of collagen fiber swelling solution[J].Functional Materials, 2014, 45(11):11 110-11 114.
[11] 马帅. 鲽鱼鱼皮胶原蛋白的提取及其理化和功能特性的研究[D].锦州:渤海大学, 2017.
MA S.Extraction of plaice skin collagen and its physicochemical and functional properties [D].Jinzhou:Bohai University, 2017.
[12] 蔡路昀, 史航, 曹爱玲,等.鲽鱼骨胶原蛋白的结构及流变学特性[J].中国食品学报, 2020, 20(3):66-73.
CAI L Y, SHI H, CAO A L, et al.Structure and rheological properties of plaice bone collagen[J].Chinese Journal of Food Science, 2020, 20(3):66-73.
[13] 温慧芳, 陈丽丽, 白春清, 等.基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J].食品科学,2016,37(1):74-81.
WEN H F, CHEN L L, BAI C Q, et al.Comparative study on physical and chemical properties of channel catfish skin collagen based on different extraction methods[J].Food Science, 2016, 37(1):74-81.
[14] WANG L, LIANG Q F, CHEN T T, et al.Characterization of collagen from the skin of Amur sturgeon[J].Food Hydrocolloids, 2014, 38:104-109.
[15] 马明思, 张宇昊, 马良, 等.兔皮胶原蛋白的微观结构及不同因素对其聚集特性的影响[J].食品与机械, 2017, 33(2):11-16.
MA M S, ZHANG Y H, MA L, et al.Microstructure of rabbit skin collagen and the effects of different factors on its aggregation properties[J].Food and Machinery, 2017, 33(2):11-16.
[16] 李剑瑛. 赤魟鱼鱼皮胶原及其衍生物的制备、理化性质及功能特性研究[D].厦门:集美大学,2019.
LI J Y.Preparation, physicochemical properties and functional properties of red stingray skin collagen and its derivatives [D].Xiamen:Jimei University, 2019.
[17] JU H Y, LIU M, DAN W H, et al.Dynamic rheological property of type i collagen fibrils[J].Journal of Mechanics in Medicine &Biology, 2013, 13(6):1340015.
[18] LAI G L, LI Y, LI G Y.Effect of concentration and temperature on the rheological behavior of collagen solution[J].International Journal of Biological Macromolecules, 2008, 42(3):285-291.
[19] TENNI R, SONAGGERE M, VIOLA M, et al.Self-aggregation of fibrillar collagens I and II involves lysine side chains[J].Micron, 2006, 37(7):640-647.
[20] 狄雯雯, 吴晓航, 李艳,等.pH对盐酸胍/Ⅰ型胶原分散体系触变性的影响[J].生物化工, 2019,5(1):66-69.
DI W W, WU X H, LI Y, et al.Effect of pH on thixotropy of guanidine hydrochloride/type I collagen dispersion system[J].Biochemical Engineering, 2019,5(1):66-69.
[21] 钟朝辉, 李春美, 窦宏亮, 等.草鱼鱼鳞酶溶性胶原蛋白粘度特性及变性温度研究[J].食品与发酵工业, 2006, 32(6):64-68.
ZHONG C H, LI C M, DOU H L, et al.Study on viscosity characteristics and denaturation temperature of enzymatic collagen from grass carp fish scales[J].Food and Fermentation Industry, 2006, 32(6):64-68.
[22] XU J, LIU F, WANG T, et al.Fabrication of films with tailored properties by regulating the swelling of collagen fiber through pH adjustment[J].Food Hydrocolloids, 2020, 108(1):106016.
[23] LLOYD K.A Histological and physico-chemical investigation of the swelling of a fibrous tissue[J].Proceedings of the Royal Society of London, 1924, 96(677):293-316.
[24] 徐金龙. 胶原纤维可食用膜的机械性能改善策略及相关机制[D].无锡:江南大学, 2021.
XU J L.Mechanical properties improvement strategies and related mechanisms of collagen fiber edible films[D].Wuxi:Jiangnan University, 2021.
[25] 马建瑞. 金属离子介导的胶原蛋白交联及其性质表征[D].兰州:兰州大学, 2020.
MA J R.Metal ion-mediated collagen cross-linking and its characterization [D].Lanzhou:Lanzhou University, 2020.
[26] 李宇龙. 盐对胶原溶液粘度行为的影响[D].济南:齐鲁工业大学, 2013.
LI Y L.The effect of salt on the viscosity behavior of collagen solution [D].Jinan:Qilu University of Technology, 2013.
[27] VARUN, GAUBA, JEFFREY, et al.Self-assembled heterotrimeric collagen triple helices directed through electrostatic interactions[J].Journal of the American Chemical Society, 2007, 129(28):8 921-8 921.
[28] HARRIS J R, SOLIAKOV A, LEWIS R J.In vitro fibrillogenesis of collagen type I in varying ionic and pH conditions[J].Micron, 2013, 49:60-68.
[29] LUCA S, NUNZIA G, LUCIA N M, et al.Marine collagen and its derivatives:Versatile and sustainable bio-resources for healthcare[J].Materials Science and Engineering C, 2020, 113(12):110963.
[30] 宿丹丹. 用于组织修复的胶原蛋白水凝胶材料的制备及其性能评价[D].无锡:江南大学, 2019.
SU D D.Preparation and performance evaluation of collagen hydrogel materials for tissue repair[D].Wuxi:Jiangnan University, 2019.
[31] CHEN S C, WU Y C, MI F L, et al.A novel pH-sensitive hydrogel composed of N,O-carboxymethyl chitosan and alginate cross-linked by genipin for protein drug delivery[J].Journal of Controlled Release Official Journal of the Controlled Release Society, 2004, 96(2):285-300.
[32] RAN Y Q, WEN S A, LEI M A, et al.Insight into the effect of sulfonated chitosan on the structure, rheology and fibrillogenesis of collagen[J].International Journal of Biological Macromolecules, 2021, 166:1 480-1 490.
[33] YING H Y, ZHOU J, WANG M Y, et al.In situ formed collagen-hyaluronic acid hydrogel as biomimetic dressing for promoting spontaneous wound healing[J].Materials Science &Engineering.C, Materials for Biological Applications, 2019, 101:487-498.
[34] YANG H, JIANG Y, DING S L, et al.Preparation of collagen burn-healing membranes[J].Journal of Chemical and Pharmaceutical Research, 2014, 6(5):1 035-1 039.
[35] 袁晓龙, 徐彬, 樊廷俊.三维鱼类胶原支架的制备及其生物相容性研究[J].山东大学学报(理学版), 2016, 51(1):36-42.
YUAN X L, XU B, FAN T J.Preparation and biocompatibility of three-dimensional fish collagen scaffolds[J].Journal of Shandong University (Science Edition), 2016,51(1):36-42.
[36] JANA P, MITRA T, GNANAMANI A, et al.Preparation of guar gum scaffold film grafted with ethylenediamine and fish scale collagen, cross-linked with ceftazidime for wound healing application[J].Carbohydrate Polymers, 2016, 153:573-581.
[37] HUANG K F, HSU W C, HSIAO J K, et al.Collagen glycosaminoglycan matrix implantation promotes angiogenesis following surgical brain trauma[J].BioMed Research International,2014,2014:672409.
[38] 张鸽. 河鲀鱼皮胶原蛋白肽提取及其化妆品功效研究[D].厦门:集美大学, 2018.
ZHANG G.Extraction of collagen peptides from puffer fish skin and its cosmetic efficacy [D].Xiamen:Jimei University, 2018.
[39] 杨华, 舒子斌, 薛兴福, 等. 胶原蛋白保湿面膜及其制备方法: 中国, CN100460516C[P]. 2009-02-11.
YANG H, SHU Z B, XUE X F, et al. Collagen moisturizing facial mask and its preparation method: China, CN100460516C[P]. 2009-02-11.
[40] TAY C Y , CIMENOGLU C , WANG J K , et al. Bullfrog skin-derived collagen, materials comprising thereof, and applications in wound healing: U.S.A, US2021324045A1[P]. 2021.
[41] 吴铭, 徐珍珍, 孙旸, 等.胶原蛋白在化妆品中的应用及研究进展[J].日用化学品科学, 2011,34(2):19-23.
WU M, XU Z Z, SUN Y, et al.Application and research progress of collagen in cosmetics[J].Science of Daily Chemicals, 2011, 34(2):19-23.
[42] 孟萌菲, 李博.口服胶原蛋白水解物对皮肤的修复作用[J].中国食物与营养, 2015, 21(1):58-61.
MENG M F, LI B.Restorative effect of oral collagen hydrolyzate on skin[J].China Food and Nutrition, 2015, 21(1):58-61.
[43] GOLDFARB E, MATHEWS D, HATCH S, et al. Methods for introducing flavoring substances into collagen shells: U.S.A, RU2769984C2[P]. 2022-04-12.
[44] 董世荣, 徐微, 李欣, 等.胶原蛋白肽对凝固型酸奶品质的影响[J].食品工业科技, 2020, 41(16):1-6.
DONG S R, XU W, LI X, et al.Effects of collagen peptides on the quality of solidified yogurt[J].Food Industry Science and Technology, 2020, 41(16):1-6.
[45] ELAM M L, JOHNSON S A, HOOSHMAND S R, et al.A calcium-collagen chelate dietary supplement attenuates bone loss in postmenopausal women with osteopenia:A randomized controlled trial[J].Journal of Medicinal Food, 2015, 18(3):324.
[46] 詹永献. 草鱼鱼鳔胶原蛋白理化性质及结构特点的研究[D].洛阳:河南科技大学, 2012.
ZHAN Y X.Study on the physicochemical properties and structural characteristics of collagen in grass carp swim bladder [D].Luoyang:Henan University of Science and Technology, 2012.
[47] 招汉. 胶原蛋白改性棉织物的研究[D].广州:华南理工大学,2011.
ZHAO H.Research on collagen-modified cotton fabrics[D].Guangzhou:South China University of Technology, 2011.
[48] YANG X C, LU Z H, WU H Y, et al.Collagen-alginate as bioink for three-dimensional (3D) cell printing based cartilage tissue engineering[J].Materials Science &Engineering C Materials for Biological Applications, 2018, 83:195-201.
[49] 海南大学. 一种交联复合胶原支架及其制备方法: 中国, CN202110007144.X[P]. 2021-05-14.
Hainan University. A cross-linked composite collagen scaffold and its preparation method: China, CN202110007144.X[P]. 2021-05-14.