在黄酒酿造过程中,麦曲是必不可少的糖化发酵剂、粗酶制剂和原料之一,用量约占原料米质量的16%~17%,具有“酒之骨”的美称,麦曲品质对黄酒的质量起着重要作用[1-2]。接种生麦曲属于典型的传统固态发酵体系,微生物群落的数量和结构能够响应代谢物和能量的分布并且在空间和时间上发生变化,被定义为空间异质性。发酵环境的温度、湿度等因素显著地影响麦曲微生物群落的多样性、品温和水分,从而影响麦曲的质量及黄酒的产率和品质[3-4]。从理化性质、环境参数、微生物群落等多方位评估麦曲是改善接种生麦曲质量、优化控制发酵的重要基础[5-6]。吴秋霞等[7]探讨了空间位置对大曲参数的影响,发现曲块的位置对酶活力、微生物量有较大影响,另外,温度和湿度对大曲的质量也有显著的影响。MA等[8]用响应面法探究接种生麦曲生产工艺与品质的相关性,提高了接种生麦曲的酶活力。微生物群落和环境指标是监测和控制生麦曲发酵过程的关键参数[9]。然而这些研究方法忽略了由于传质传热导致的空间异质性对微生物的影响,难以揭示接种生麦曲发酵过程中空间位置条件与微生物之间的关系。因此本研究以实验室模拟生产的接种生麦曲为对象,研究生产空间的异质性对麦曲微生物群落和理化性质的影响,解析发酵过程中的微生物群落与理化性质的相关性,改善麦曲质量,旨在为接种生麦曲的生产引入自动化、智能化技术及工艺的优化奠定理论基础。
1 材料与方法
1.1 材料与试剂
黄酒麦曲,江苏省某黄酒厂制曲车间;无水乙醇、乳酸、乙酸、无水葡萄糖等试剂,国药集团化学试剂有限公司;葡萄糖、蛋白胨、酵母膏、马铃薯琼脂培养基、孟加拉红培养基、细菌培养基、氢氧化钠、酒石酸钾钠、无水乙酸钠、冰乙酸、碘化钾、可溶性淀粉、硫酸铜,北京索莱宝生物科技有限公司。
1.2 仪器与设备
TGL-16M高速冷冻离心机,湘麓离心机仪器公司;SW-CJ-2FD型超净工作台,苏州净化设备有限公司;CX31生物显微镜,日本Olympus公司;85-2型数显恒温磁力搅拌器,上海双捷实验设备有限公司;PHS-25CW pH计,上海般特仪器制造有限公司;PX124ZH/E电子天平,奥豪斯仪器(常州)有限公司;DHG-9013A电热鼓风干燥箱;HWS-150B 恒温恒湿箱,黄骅菲斯福实验仪器有限公司;TU-1901紫外分光光度计,北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 接种生麦曲制作工艺及样品收集
实验室小规模制曲工艺[10]如图1所示,以小麦为原料,经过筛选、轧碎、拌料,采用固态发酵的方式,在适宜的气温和水分条件下,堆积于曲房内保温培养,期间翻曲1~2次,经5 d左右的固态发酵而成。
样品采集:样品信息及简写如表1所示,其中对照组(A)和实验组(B)的生产工艺并不相同,对照组采用传统控制工艺,实验组采用底部强制通风模式。分别从曲房所示不同位置的多层曲架的上、中、下层(3、2、1),每天(0、1、2、3、4、5 d)取发酵的曲,粉碎混合均匀后,5点取样300 g,一式两份,其中一份置于4 ℃用于理化检测和微生物监测。
空间变量分析:使用温度电极监测发酵过程中曲房空间、曲块中心的温度;通过在105 ℃下干燥麦曲粉末30 min,采用重量法测定麦曲的水分。
表1 取样表及样品名称
Table 1 Sampling point information and abbreviations
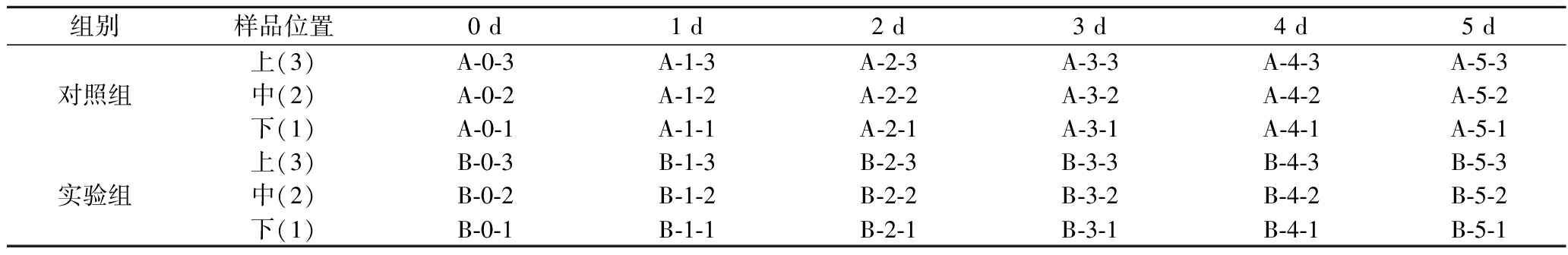
组别样品位置0 d1 d2 d3 d4 d5 d上(3)A-0-3A-1-3A-2-3A-3-3A-4-3A-5-3对照组中(2)A-0-2A-1-2A-2-2A-3-2A-4-2A-5-2下(1)A-0-1A-1-1A-2-1A-3-1A-4-1A-5-1上(3)B-0-3B-1-3B-2-3B-3-3B-4-3B-5-3实验组中(2)B-0-2B-1-2B-2-2B-3-2B-4-2B-5-2下(1)B-0-1B-1-1B-2-1B-3-1B-4-1B-5-1
1.3.2 理化指标分析检测
参照QB/T 4257—2011所述的方法和步骤测定温度、水分(moisture)、液化力(liquefaction activity, LA)、糖化力(saccharification activity, SA)。
1.3.3 微生物计数
采用稀释涂布平板法分别对霉菌、酵母、细菌进行计数。
1.4 模型建立
能量平衡的计算如公式(1)所示:
能量积累=传导引起的能量转移-对流引起的能量转移+微生物生长产生的热量
(1)
麦曲的发酵过程中的能量传递如图2所示,在本次研究当中遵从能量守恒的原则,通过进行一些假设来简化计算过程[11-12]。假设(1)发酵床顶部空间气体彼此处于平衡,并且在发酵过程中,床的导热率、密度、比热和空隙率没有显着变化;(2)假设微生物在整个发酵床中均匀生长,所产生的所有热量都是微生物活动的结果;(3)发酵过程中水分的变化并不显著,不影响微生物的反应;(4)恒温恒湿培养箱的侧壁是绝缘的,与外界没有热量交换。

图1 实验室规模制曲工艺
Fig.1 Laboratory small-scale wheat Qu making process

图2 发酵床能量传递模型
Fig.2 Energy transfer model
2 结果与分析
2.1 空间异质性对麦曲质量的影响
接种生麦曲发酵过程中温度、水分的变化情况如图3-a所示,生麦曲生产过程中因发酵产生的生物热逐层向上[11],导致上、中、下层曲块的品温差异显著。接种生麦曲发酵过程中的空间温度的分布差异是由传递不均而产生的,其中最大温度差为4 ℃,这是由于热空气的自然对流不能将代谢热量快速的传递给周围的空气,同时与微生物的种类和发酵系统的类型和规模有关。麦曲的含水量在上、中、下分布也有显著差异,水分含量呈现的趋势是下高上低。最底层的发酵床含水量在发酵过程中始终保持较高的水平,处于顶层的发酵床水分始终低于其他两个发酵床,发酵过程中水分差异也会导致麦曲的质量差异[13]。
如图3-b所示,生麦曲发酵过程中上、中、下层麦曲的细菌、霉菌、酵母数量分布呈现差异。温度作为驱动麦曲中微生物群落演替的主要因素[14],微生物数量的分布与曲房内不同空间位置各点的空间温度和发酵时间有关,因此发酵床所处的位置不同分布的数量也不同,细菌数目总量呈现中间高两边低的趋势,在中间发酵床的细菌总数最高,为(9.7±0.1) lg CFU/g;酵母含量则呈现由上到下依次增加的趋势,最底层发酵床的酵母菌数量为(8.2±0.2) lg CFU/g;霉菌计数呈现中间低两边高的趋势,最高为(9.1±0.2) lg CFU/g。
如图3-c所示,不同位置的酶活力差异显著。液化力、糖化力分别为0.51~8.89 g/(g·h)、559.10~1 099.80 mg/(g·h)。研究表明,可通过控制麦曲发酵空间的温、湿度而间接控制麦曲的品温和水分的变化[15],这有利于生麦曲的质量提升和稳定,从而增加麦曲中糖化酶、液化酶的积累。此外,处于中间位置发酵的麦曲液化力和糖化力高于其余位点。这种差异可能同时与麦曲发酵微空间的理化性质和微生物群落结构相关[16]。
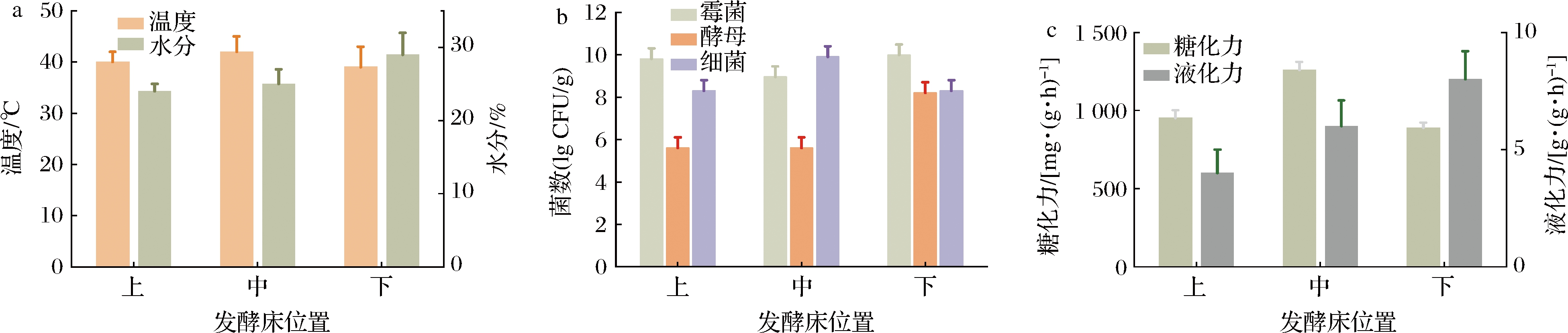
a-上、中、下层麦曲温度、水分; b-上、中、下层麦曲微生物数量; c-上、中、下层麦曲糖化力、液化力
图3 不同点位麦曲理化性质差异
Fig.3 Differences in physical and chemical parameters of wheat Qu between production areas
2.2 模拟、解析曲房空间异质性
2.2.1 温度分布差异
为了模拟接种生麦曲的发酵状态,我们使用 COMSOL Multiphysics软件来模拟麦曲发酵过程中的二维热和流体传输,忽略任何其他类型的传递[11]。虽然我们通过实验确定基质中微生物生长引起代谢热,但考虑到实际生产过程中有较大误差,品温是由于生物热与空间温度共同作用的结果,因此在这个模型中,通过设置一个随时间变化的热源(1~900 W/m3)来模拟接种生麦曲发酵过程中产生生物热的影响,解释曲块品温在发酵过程中不同空间位置产生的变化。最终温度模拟如图4所示,由温度分布可知,环境温度呈现梯度分布的规律,温度最高区域出现在中间。上下两部分温度较低,并向中间呈梯度升高。受传质传热以及自然对流换热的影响,上、中、下层环境温度在垂直方向由下往上呈缓慢下降趋势,麦曲存在随空间分布的温度梯度,环境条件和微生物相互作用对于微生物群的形成和代谢的差异有重要意义,温度在麦曲中分布不均可能导致麦曲的质量出现差异。

图1-发酵初期温度分布;2-发酵到达顶温时温度分布;3-发酵中期温度分布;4-发酵末期温度分布
图4 接种生麦曲发酵过程中温度分布差异
Fig.4 Difference of temperature distribution during fermentation of inoculated raw wheat Qu
2.2.2 速度分布差异
忽略麦曲发酵过程中的质量传递,使用模拟计算的方式来估计发酵过程中的气流。如图5所示,气流在上下发酵床之间产生了不均匀的死区,这可能导致室内3个发酵床发酵状态的差异。处于上方发酵床的水蒸发速率比中、下方发酵床更快,这是因为其表面上方的空气速度较高。随着发酵的进行,曲块温度逐渐增加,上层发酵床水分不断汽化而减少。可以看出,麦曲发酵过程中其理化指标和空间温湿度会发生不断的变化,同时由于曲块摆放方式及空间位置的不同,曲块间温湿度差异性较大[17],导致曲房各区域空间温湿度在空间分布不均,空间温湿度的变化也对曲块微生物生长及理化指标产生影响[18],两者间相互关联,故需对曲房空间温度和湿度进行监测及实时调控来稳定麦曲质量。
2.3 减少空间异质性对接种生麦曲质量的影响
由于发酵床的空间位置不同,它们的温度分布也会有所不同。在发酵过程中,对照组(A)按照传统工艺进行发酵,实验组(B)通过从培养箱底部强制通风的措施以控制环境因子,减少空间异质性。
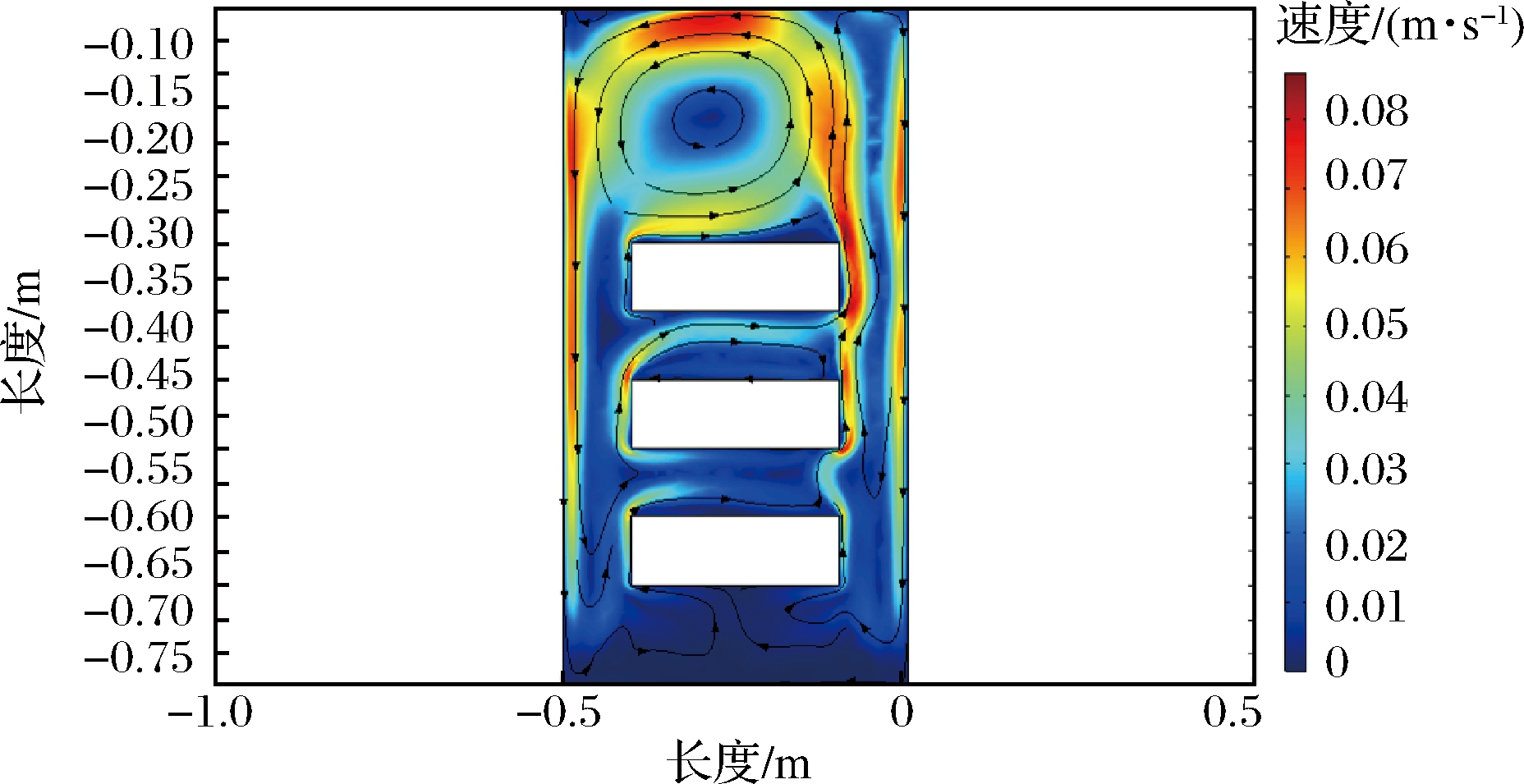
图5 接种生麦曲发酵过程中速度场的二维模拟
Fig.5 Two-dimensional simulation of temperature and velocity fields in the fermentation chamber
2.3.1 温度分布差异
如图6所示,接种生麦曲生产过程中,对照组和实验组的品温随时间的变化趋势基本相似,发酵24 h后,温度从27.7 ℃升高到了约49.5 ℃,达到峰值。温度达到峰值后,开始缓慢下降,直到发酵132 h结束。由图6可知,对照组和实验组在发酵初期时,由于曲块发酵与外界自然对流,导致不同曲层温度出现差异;随着发酵的进行不同曲层之间的差异进一步加大,这是由于发酵床传递差异而产生的发酵过程中典型的温度分布差异。对照组采用传统工艺控制,对照组内温度值平均相对误差为4.09%,最大相对误差为9.17%,这是由于热空气的自然对流不能将代谢热量快速的传递给周围空气而导致温度在曲层上下差异较大。实验组采用强制通风控制,平均误差为1.16%,最大相对误差4.36%;空间分布差异的大小不仅与发酵系统的规模和类型有关,同时也与微生物的生长相关[19]。其中温度有时出现较大偏差,是由于在发酵过程中人员开关恒温恒湿箱取样所致。

a-发酵1 d对照组和实验组温度;b-发酵2 d对照组和实验组温度;c-发酵3 d对照组和实验组温度; d-发酵4 d对照组和实验组温度;e-发酵5 d对照组和实验组温度
图6 对照组与实验组不同位置温度对比
Fig.6 Comparison of temperature at different positions between the control group and the experimental group
2.3.2 微生物数量分布差异
在本项研究当中,我们控制初始接种的微生物数量,使其均匀的分布在上、中、下3个不同的发酵床中。如图7所示,随着发酵的进行,微生物生长产生的能量代谢和传质传热的干扰导致微生物在曲堆中存在空间和时间的分布差异。其中图7-a及图7-b分别为对照组与实验组微生物数量百分比含量随时间的变化,对照组中霉菌的数量差异较大,最大为79%,发酵过程中实验组中霉菌数量差异及百分比变化较小,发酵床之间的最大差异为22%;对照组酵母数量最大差异在72 h时出现,为75%,实验组中酵母数量最大差异在96 h出现,为9%;此外,细菌在对照组中最大差异于120 h出现,为71%,实验组相对差异较小,最大差异14%。结果表明,实验组的微生物分布均匀、质量高,因此通过对温度分布的调节能够较好控制微生物数量的分布[14],稳定麦曲质量。
2.3.3 酶活力对比
本研究在解析曲房中不同空间位置酶活力的基础上,通过恒温恒湿箱模拟传统制曲工艺,接种实验室保藏的米曲霉苏-16制作实验组接种生麦曲,制作过程中每隔24 h取麦曲样品,测定了糖化酶活力、α-淀粉酶活力,并对核心酶活力与空间位置的关联性进行了分析。结果如图8所示,图8-a表示不同空间位置对照组和实验组糖化力、液化力的变化情况,液化力、糖化力分别为0.51~8.89 g/(g·h)、559.10~1 099.80 mg/(g·h),酶活力的分布呈现“中间高,两边低”的规律性,中间位置发酵床的酶活力最高, 在黄酒酿造过程中,麦曲的酶活力等基本指标是检验麦曲是否能够投入到实际生产中的重要步骤。有研究表明,可通过控制曲房的温、湿度而增加麦曲中酶的积累[20]。图8-b表明,由于发酵过程控制工艺的不同,对照组麦曲发酵过程中不同位置麦曲的酶活力出现较大差异。结果显示实验组的糖化酶活力高于对照组,糖化酶活力相比较对照组提高了10.2%,液化酶活力提高了54.1%;相比较与传统生麦曲糖化酶活力提高30.1%,液化酶活力提高106.8%。说明经过空间异质性控制的麦曲相对于较为传统的工艺制曲在两种酶系的活力上具有显著优势,这有利于提高原料的利用效率,并对黄酒的风味做出贡献。

a-对照组发酵过程中微生物数量变化;b-实验组发酵过程中微生物数量变化
图7 不同发酵位置微生物数量差异
Fig.7 Differences in the number of microorganisms in different fermentation positions
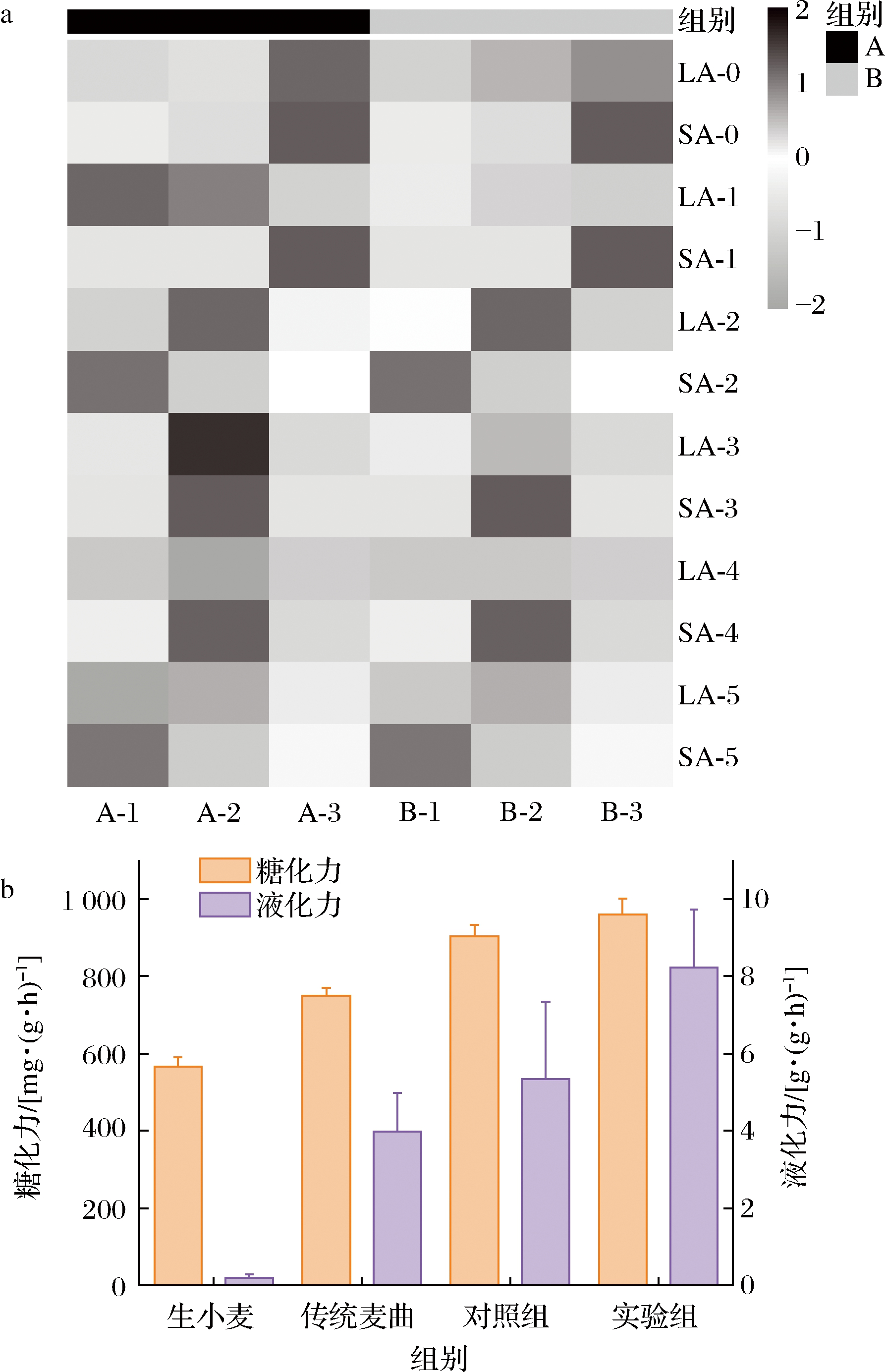
a-对照组和实验组理化参数差异;b-不同样品酶活力差异
图8 酶活力差异
Fig.8 Difference of enzyme activity 注:A为对照组,B为实验组,A-1为对照组发酵床1,B-1为实验组 发酵床1;LA-0为0 d液化酶活力,SA-0为0 d糖化酶活力
3 结论与讨论
在本次研究中,本文以江苏地区不同平面和空间位点的接种生麦曲为研究对象,探讨了接种生麦曲样品的主要理化参数、酶活力和微生物的差异,并通过计算模拟曲房的空间异质性,同时设置2组实验(对照组和实验组)来验证空间异质性对麦曲质量的影响。结果表明,随着接种生麦曲发酵的进行,对照组麦曲的品温出现明显分布差异现象,呈现为中间高两边低;生物量是表征微生物生长情况的重要指标,随着自然发酵的进行,不同曲层空间差异性增加,导致在同一时期不同位置微生物的分布响应空间因子的变化而呈现差异性,通过调节空间异质性分布可以调节微生物的分布。麦曲的品温和水分为其发酵过程中微生物的生长繁殖与生理代谢提供了条件。空间异质性正是通过影响微生物的生长和代谢来影响酶的分泌,在发酵前期,糖化力迅速提升,达到1 099.80 mg/(g·h)左右随后下降,在发酵中后期,糖化力又大幅上升,最后在992.52 mg/(g·h)左右趋于稳定;液化力在发酵第1~2天波动,最终稳定在8.10 g/(g·h)左右,导致酶活力在发酵过程中出现不同程度波动。我们研究模拟空间异质性对微生物分布的重要性,描述并分析麦曲发酵过程中温度在二维空间的分布,解析同一个曲房内的曲块出现质量差异的原因。这些结果表明空间异质性对麦曲的群落结构和酶活性均有显著影响,实际生产过程中可通过调节通风频率来调节空间异质性,提高麦曲的糖化力、液化力以及微生物数量,这为麦曲的智能化生产提供了科学依据。
[1] 杨国军. 黄酒酿造用麦曲生产及质量研究综述[J].酿酒, 2020, 47(4):28-32.
YANG G J.Review on the production and quality of maiju for Huangjiu brewing[J].Liquor Making, 2020, 47(4):28-32.
[2] 胡武瑶, 杨昳津, 窦慧, 等.不同麦曲酿造黄酒中挥发性风味物质的代谢差异[J].食品与发酵工业, 2020, 46(8):226-233.
HU W T, YANG Y J, DOU H, et al.Metabolic differences of volatile flavor compounds in Huangjiu fermented with different wheat Qu [J].Food and Fermentation Industries, 2020, 46(8):226-233.
[3] 唐鳗秋, 夏玙, 覃凤阳, 等. 四川黄酒麦曲发酵过程中理化特性及微生物多样性变化研究[J]. 食品与发酵工业, 2021, 47(24): 35-40.
TANG M Q, XIA Y, QIN F Y, et al. Physicochemical characteristics and microbial diversity in wheat Qu during the fermentation of Sichuan Huangjiu[J]. Food and Fermentation Industries, 2021, 47(24): 35-40.
[4] 陈伟峰, 刘雨星, 田润刚.黄酒酿造中的麦曲淀粉酶活力影响因素分析 [J].中国酒, 2022(8):60-67.
CHEN W F, LIU Y X, TIAN R G.Analysis of factors affecting the activity of wheat koji amylase in rice wine brewing[J].China Wine, 2022(8):60-67.
[5] MA S Y, LUO H B, ZHAO D, et al.Environmental factors and interactions among microorganisms drive microbial community succession during fermentation of Nongxiangxing daqu[J].Bioresource Technology, 2022, 345:126549.
[6] WANG L, HUANG Y G, HU X X, et al.The impact of environmental factors on the environmental bacterial diversity and composition in the Jiang-flavoured Baijiu production region[J].LWT, 2021, 149: 111784.
[7] 吴秋霞, 黄钧, 吴重德, 等.季节和制曲位置变化对大曲生产影响的研究[J].中国调味品, 2017, 42(4):42-46.
WU Q X, HUANG J, WU C D, et al.Study on the effect of season and koji-making location on Daqu production[J].China Condiment, 2017, 42(4):42-46.
[8] MA D L, LIU S P, LIU H P, et al.Developing an innovative raw wheat Qu inoculated with Saccharopolyspora and its application in Huangjiu[J].Journal of the Science of Food and Agriculture, 2022, 102(15):7 301-7 312.
[9] 黄海飞, 田建平, 王开铸, 等.曲房环境温湿度场的数值模拟及分布规律[J].现代食品科技, 2020, 36(9):148-155;40.
HUANG H F, TIAN J P, WANG K Z, et al.Numerical simulation and distribution of ambient temperature and humidity field in qu fang[J].Modern Food Science and Technology, 2020, 36(9):148-155;40.
[10] 陈细丹. 黄酒生麦曲的传统制作工艺[J].酿酒, 2011, 38(1):59-60.
CHEN X D.Students of traditiona Chinese rice wine production process wheat starter[J].Liquor Making, 2011, 38(1):59-60.
[11] JOU R Y, LO C T.Heat and mass transfer measurements for tray-fermented fungal products[J].International Journal of Thermophysics, 2011, 32(1-2):523-536.
[12] FINKLER A T J, WEBER M Z, FUCHS G A, et al.Estimation of heat and mass transfer coefficients in a pilot packed-bed solid-state fermentation bioreactor[J].Chemical Engineering Journal, 2021, 408:127246.
[13] JIN G Y, ZHU Y, RINZEMA A, et al.Water dynamics during solid-state fermentation by Aspergillus oryzae YH6[J].Bioresource Technology, 2019, 277:68-76.
[14] XIAO C, LU Z M, ZHANG X J, et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J].Applied and Environmental Microbiology, 2017, 83(23): e01550-17.
[15] BAN S B, CHEN L N, FU S X, et al.Modelling and predicting population of core fungi through processing parameters in spontaneous starter (Daqu) fermentation[J].International Journal of Food Microbiology, 2022, 363:109493.
[16] WANG H, HUANG Y G, HUANG Y L.Microbiome diversity and evolution in stacking fermentation during different rounds of Jiang-flavoured Baijiu brewing[J].LWT, 2021, 143:111119.
[17] NAGEL F J J I, TRAMPER J, BAKKER M S N, et al.Temperature control in a continuously mixed bioreactor for solid-state fermentation[J].Biotechnology and Bioengineering, 2001, 72(2):219-230.
[18] NAGEL F J J I, TRAMPER J, BAKKER M S N, et al.Model for on-line moisture-content control during solid-state fermentation[J].Biotechnology and Bioengineering, 2001, 72(2):231-243.
[19] GURUBEL K J, SANCHEZ A, CORONADO-MENDOZA A, et al.A Comparative study of temperature optimal control in a solid state fermentation process for edible mushroom growing[J].Chemical and Biochemical Engineering Quarterly, 2017, 31(1):101-114.
[20] 周书宇, 田建平, 高剑, 等.大曲发酵过程的环境温湿度均匀性调控系统研究[J/OL].食品与发酵工业,2023.DOI:10.13995/j.cnki.11-1802/ts.034132.
ZHOU S Y, TIAN J P, GAO J, et al.Study on regulating system of ambient temperature and humidity uniformity in Daqu fermentation process[J/OL].Food and Fermentation Industries, 2023. DOI:10.13995/j.cnki.11-1802/ts.034132.