四甲基吡嗪(tetramethylpyrazine,TTMP)是一种具有坚果和烘烤香气的活性风味化合物[1],对纳豆[2]、酱油[3]、陈醋[4]和白酒[5]等发酵食品有重要的香气贡献。其中,白酒中TTMP主要来源于枯草芽孢杆菌(Bacillus subtilis)的代谢[6],枯草芽孢杆菌利用发酵原料中的葡萄糖经糖酵解途径生产丙酮酸,丙酮酸在α-乙酰乳酸合成酶的作用下生成α-乙酰乳酸,再经α-乙酰乳酸脱羧酶的作用,α-乙酰乳酸脱羧形成乙偶姻(acetoin,ACT),最终,发酵体系中的ACT和主要由氨基酸转化来的氨通过非酶促反应生成TTMP[6-7]。然而,在其他发酵食品中,利用枯草芽孢杆菌合成的TTMP研究少见报道,尤其是影响其合成的重要基因,缺乏系统的研究。
枯草芽孢杆菌是发酵食品中主要的微生物[8-9],在发酵过程中可产生多种水解酶,如蛋白酶、纤维素和淀粉酶,有助于碳水化合物的液化和糖化[10],促进发酵食品中风味化合物的形成[8,11]。同时,枯草芽孢杆菌菌株代谢生成TTMP的能力对发酵食品品质的提高有重要作用[12]。因此,针对枯草芽孢杆菌中TTMP合成途径中的重要基因进行研究,对提高发酵食品中TTMP含量具有重要意义。
本研究基于课题组前期基础,通过优良风味豆豉发酵菌株BJ3-2[13],在37 ℃和45 ℃培养条件下,对其进行转录组分析靶向磷酸烯醇丙酮酸羧化激酶基因(pckA)[14]。在枯草芽孢杆菌的TTMP合成途径中,基因pckA主要负责将草酰乙酸催化生成磷酸烯醇式丙酮酸,在丙酮酸激酶的作用下生成丙酮酸[15],丙酮酸代谢生成TTMP[6],如图1所示。因此,为了探究PckA对枯草芽孢杆菌TTMP合成的影响,首先通过同源重组技术,构建pckA缺失菌株;然后,利用枯草芽孢杆菌BJ3-2及其pckA缺失菌株进行豆豉发酵;最后,通过感官评价和GC-MS检测分别对比pckA基因缺失前后发酵豆豉风味及TTMP含量的变化。系统研究枯草芽孢杆菌BJ3-2中pckA对TTMP合成和豆豉风味的影响,为提高豆豉品质提供新的理论基础。

图1 枯草芽孢杆菌中的四甲基吡嗪代谢途径
Fig.1 Metabolic pathway of TTMP in Bacillus subtilis
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
枯草芽孢杆菌BJ3-2为实验室保藏菌株[13];pHT01质粒[16],百奥迈科生物技术有限公司;大肠杆菌DH5α(Escherichia coli DH5α)和pUC18质粒,TaKaRa宝生物工程(大连)有限公司。
1.1.2 试剂与仪器
DNA限制性核酸内切酶(EcoR I、Sac I、BamH I、Pst I),TaKaRa宝生物工程(大连)有限公司;T4 DNA连接酶,New England Biolabs有限公司;StarScript Ⅱ第一链cDNA合成混合体系,GenStar公司;细菌RNA提取试剂盒、细菌DNA提取试剂盒、质粒提取试剂盒,OMEGA公司。
T100TMPCR仪、CFX96 Touch荧光定量PCR仪,美国Bio-Rad公司;BX53F-DP26生物显微镜,日本OLYMPUS;UV2100紫外可见分光光度计,尤尼柯仪器有限公司;HP6890/5975C气相-质谱联用仪,美国Agilent;pHS-3C酸度计,上海仪电科学仪器股份有限公司。
1.1.3 培养基与缓冲液
LB液体培养基:蛋白胨1 g,NaCl 1 g,酵母粉0.5 g,溶于100 mL蒸馏水,pH值调至7.0(LB固体培养基,添加琼脂粉1.5 g)。
10倍最低盐溶液:KH2PO4 6 g,K2HPO4 14 g,(NH4)2SO4 2 g、柠檬酸钠1 g溶于100 mL蒸馏水,高压灭菌后添加0.05 mL 1 mol/L MgSO4。
HS培养基:66.5 mL蒸馏水,2.5 mL 200 g/L葡萄糖,5 mL 100 g/L酵母粉,1 mL 20 g/L干酪素,10 mL 10×最低盐溶液,5 mL 1 g/L L-色氨酸,10 mL 80 g/L L-精氨酸和4 g/L L-组氨酸的混合液。
LS培养基:80 mL蒸馏水,2.5 mL 200 g/L葡萄糖,5 mL 20 g/L酵母粉,0.5 mL 20 g/L干酪素,10 mL 10倍最低盐溶液,0.5 mL 1 g/L L-色氨酸,0.05 mL 1 mol/L CaCl2,0.25 mL 1 mol/L MgCl2。
1.1.4 引物
本研究所用的引物见表1。
表1 本研究所用的引物
Table 1 Primers used in this study

基因/DNA片段扩增序列引物序列(5′-3′)扩增片段大小/bppckA上游同源臂片段HLarm-FCGGAATTCGATATCAGCAGACTGCTCATHLarm-RCCCGAGCTCATGAAACCTTCCTTTATCGT817catcat-FCCCGAGCTCATAGTGACTGGCGATGCTcat-RCGCGGATCCTTAAGTTATTGGTATGACTGGTTT1 083pckA下游同源臂片段HRarm-FCGCGGATCCAAAGCAAAAGCCAAGAGCAATHRarm-RAACTGCAGGGCAATCGAAATGGGAAGGCAT713pckA定位基因片段TEST-FTTGGTCTACACCCATTGCGTEST-RGGCGGCTGTTTTGATTGTAG3 034pckAPpckA-FAAACAGACGGCACTCATTCCPpckA-RACCTTTTTCACCGACATTGG18216S rRNA16S-qFACTCCTACGGGAGGCAGCAG16S-qRATTACCGCGGCTGCTGG123
注:下划线为酶切位点
1.2 实验方法
1.2.1 实时荧光定量PCR (real-time quantitative PCR,RT-qPCR)
提取置于37 ℃和45 ℃培养的BJ3-2菌体总RNA,使用StarScript Ⅱ第一链cDNA合成预混试剂反转录合成cDNA。以cDNA为模板,16S rRNA为内参基因,分别以16S-qF/16S-qR和PpckA-F/PpckA-R为引物进行16S rRNA和pckA片段扩增,条件为95 ℃, 2 min;95 ℃, 15 s, 55 ℃, 30 s, 72 ℃, 30 s(40个循环),采用2-(ΔΔCt)(Livak)法计算基因相对表达量。上述所用引物见表1。
1.2.2 pckA敲除菌株的构建
以枯草芽孢杆菌BJ3-2基因组DNA为模板,用引物HLarm-F/HLarm-R扩增pckA上游同源臂片段,将pckA上游同源臂片段和pUC18质粒使用EcoR I/Sac I进行双酶切处理,两个酶切获得的产物用T4 DNA连接酶连接,得到pUC18-HLarm质粒;以pHT01质粒为模板,用引物cat-F/cat-R进行PCR扩增获得cat片段后,以Sac I/BamH I酶对cat片段和pUC18-HLarm质粒进行酶切酶连,得到pUC18-HLarm-cat质粒;以枯草芽孢杆菌BJ3-2基因组DNA为模板,使用引物HRarm-F/HRarm-R扩增pckA下游同源臂片段,对pckA下游同源臂片段和pUC18-HLarm-cat质粒进行BamH I/Pst Ⅰ双酶切处理,对酶切产物进行酶接,并转化至E.coli DH5α感受态细胞中,获得敲除载体pUC18-HLarm-cat-HRarm(图2),对敲除载体进行质粒双酶切和测序验证。在20 mL LS培养基中接种200 μL于HS培养基37 ℃过夜培养的BJ3-2,30 ℃, 135 r/min培养2 h,吸取1 mL菌液加入10 μL 0.1 mol/L 乙二醇双(2-氨基乙基醚)四乙酸[glycol-bis-(2-aminoethylether)-N,N,N′,N′-tetraacetic acid,EGTA],室温静置5 min后,加入约1 μg验证正确的重组质粒DNA,37 ℃,200 r/min培养2 h,将转化产物涂布于5 μg/mL氯霉素LB抗性平板上[17],挑取平板上转化子,使用引物TEST-F/cat-R、cat-F/TEST-R和TEST-F/TEST-R对其进行PCR和测序验证,阳性敲除菌株命名为BJ3-2ΔpckA。上述所用引物见表1。

图2 敲除载体pUC18-HLarm-cat-HRarm构建流程
Fig.2 The construction procedure of konckout vector pUC18-HLarm-cat-HRarm
1.2.3 发酵豆豉
将BJ3-2和BJ3-2ΔpckA接种于5 mL LB液体培养基中,37 ℃,180 r/min过夜培养。室温浸泡12 h的大豆于121 ℃灭菌20 min。分别吸取BJ3-2和BJ3-2ΔpckA菌液(1%,mL∶g)接种至80 g大豆中,置于45 ℃发酵72 h。对发酵的豆豉进行10人小组的感官评价[14]。
1.2.4 菌株形态观察及生长曲线测定
将BJ3-2和BJ3-2ΔpckA菌株进行平板划线,37 ℃过夜培养后进行单菌落观察和显微镜观察。分别吸取1 mL过夜培养的BJ3-2和BJ3-2ΔpckA菌液,加入装有99 mL LB液体培养基的锥形瓶中,充分混匀后分装至20只试管中,于45 ℃、180 r/min培养40 h,培养期间每隔2 h测定两种菌液600 nm处吸光值。以未接种细菌的LB液体培养基作为对照,绘制生长曲线。
1.2.5 发酵豆豉pH测定
发酵豆豉样品前处理参照文献[14]方法,取10 g豆豉于50 mL超纯水中充分混匀,使用pH计对混合液进行测定,每24 h进行1次取样。
1.2.6 GC-MS检测
运用顶空固相微萃取装置联合GC-MS对发酵的豆豉进行挥发性风味物质检测[18]。称取混匀的豆豉样品3 g,置于50 mL采样瓶中,插入萃取头(2 cm-50/30 μm DVB/CAR/PDMS),在45 ℃顶空萃取55 min后移出萃取头,立即插入GC进样口(250 ℃)中,热解析5 min后进样。色谱柱为HP-5MS(60 m×0.25 mm×0.25 μm),柱温40 ℃(停留2 min),以3.5 ℃/min的升温至228 ℃,运行52 min,载气为高纯He(99.999%),气流量1.0 mL/min,不分流进样。离子源为EI源,质量范围29~500 amu。对总离子流图中的各质谱峰采用Nist普库检索,同时采用正构烷烃(C7~C30)计算保留指数鉴定。用峰面积归一化法测定了各化学成分的相对质量分数,相同条件下每个样品各进样3次。
2 结果与分析
2.1 转录水平变化
课题组前期采用BJ3-2在37 ℃和45 ℃分别进行豆豉发酵,发现两个温度下豆豉的风味存在明显差异,在45 ℃下酱香风味显著比37 ℃下更浓郁[14]。因此,分别进行了37 ℃和45 ℃条件培养BJ3-2菌体的转录组测序,经数据分析发现pckA的相对表达量在45 ℃比37 ℃下调了3.91倍(log2FC)[14]。同时,采用RT-qPCR检测分别置于37 ℃和45 ℃培养的BJ3-2菌株中pckA表达量,结果如图3所示,BJ3-2中pckA基因在45 ℃转录水平降低,与转录组测序趋势一致;相对表达量为37 ℃的0.83倍。由于,pckA位于枯草芽孢杆菌TTMP合成途径中,且其转录水平显著降低的菌株风味提升明显。因此,为进一步验证pckA对豆豉风味的影响,本研究将pckA敲除,验证BJ3-2在45 ℃发酵豆豉中TTMP含量。
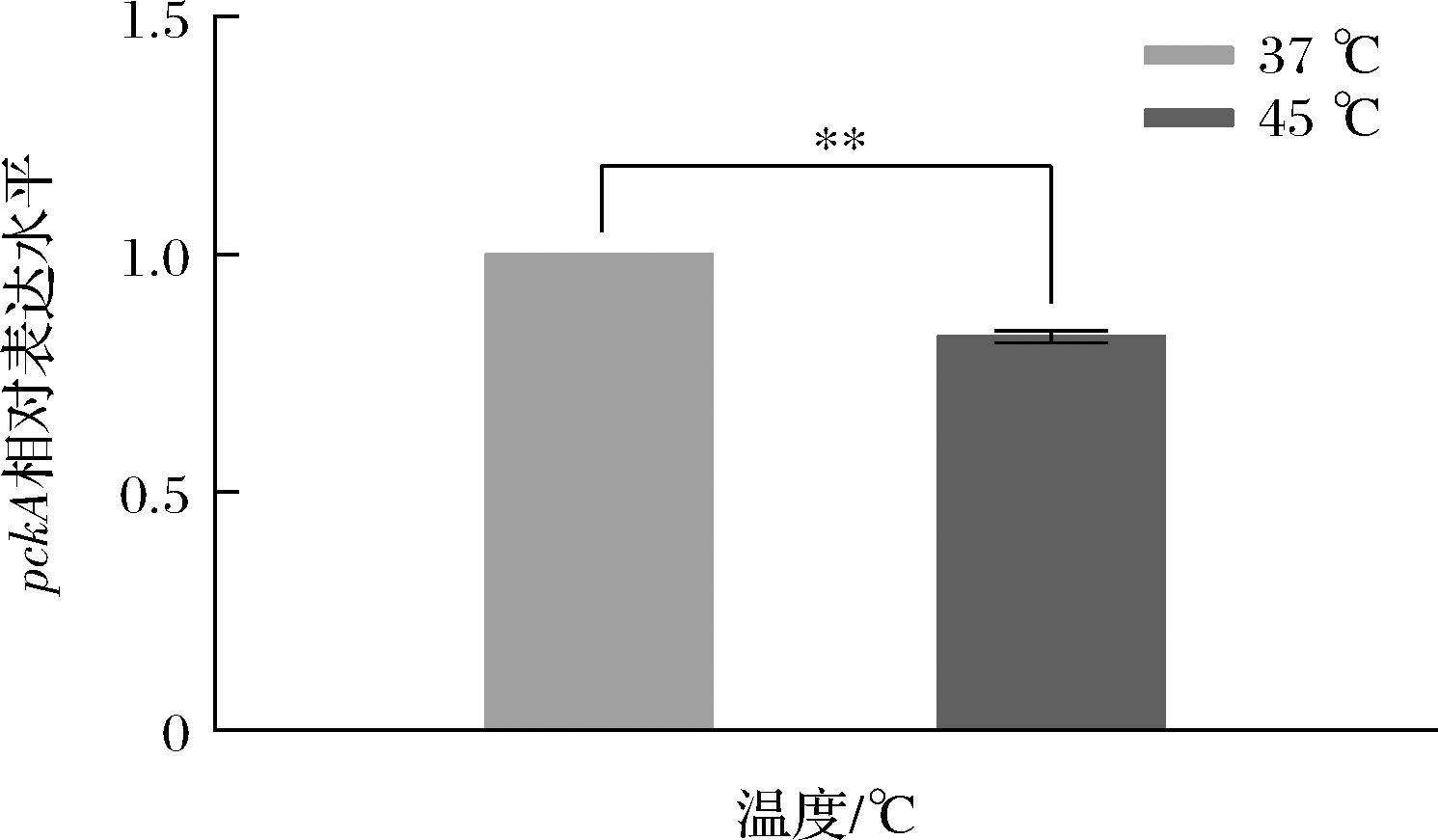
图3 BJ3-2中pckA的RT-qPCR分析
Fig.3 RT-qPCR analysis of pckA in BJ3-2 注:*和**分别表示P<0.05和P<0.01水平的差异显著性(下同)
2.2 pckA敲除菌株验证
对构建的重组质粒分别进行EcoR I/BamH I和BamH I/Pst I双酶切,获得与预期结果相符的3 399 bp/1 900 bp和4 586 bp/713 bp双条带(图4-a);同时测序结果也与预期一致,表明敲除载体构建成功。将敲除载体转化至BJ3-2后,对敲除菌株进行菌落PCR验证,引物TEST-F/cat-R、cat-F/TEST-R和TEST-F/TEST-R扩增出与预期相符的目的条带1 919、2 198、3 034 bp。挑取经菌落PCR验证为阳性交换的突变菌株使用氯霉素抗性平板进行划线传代培养(传至12代),在使用相同的引物对进行基因组DNA PCR验证,均获得相应的目的条带(图4-b),且测序结果表明,突变菌株中的pckA已成功被敲除载体上的cat替换,表明突变菌株BJ3-2ΔpckA构建成功。
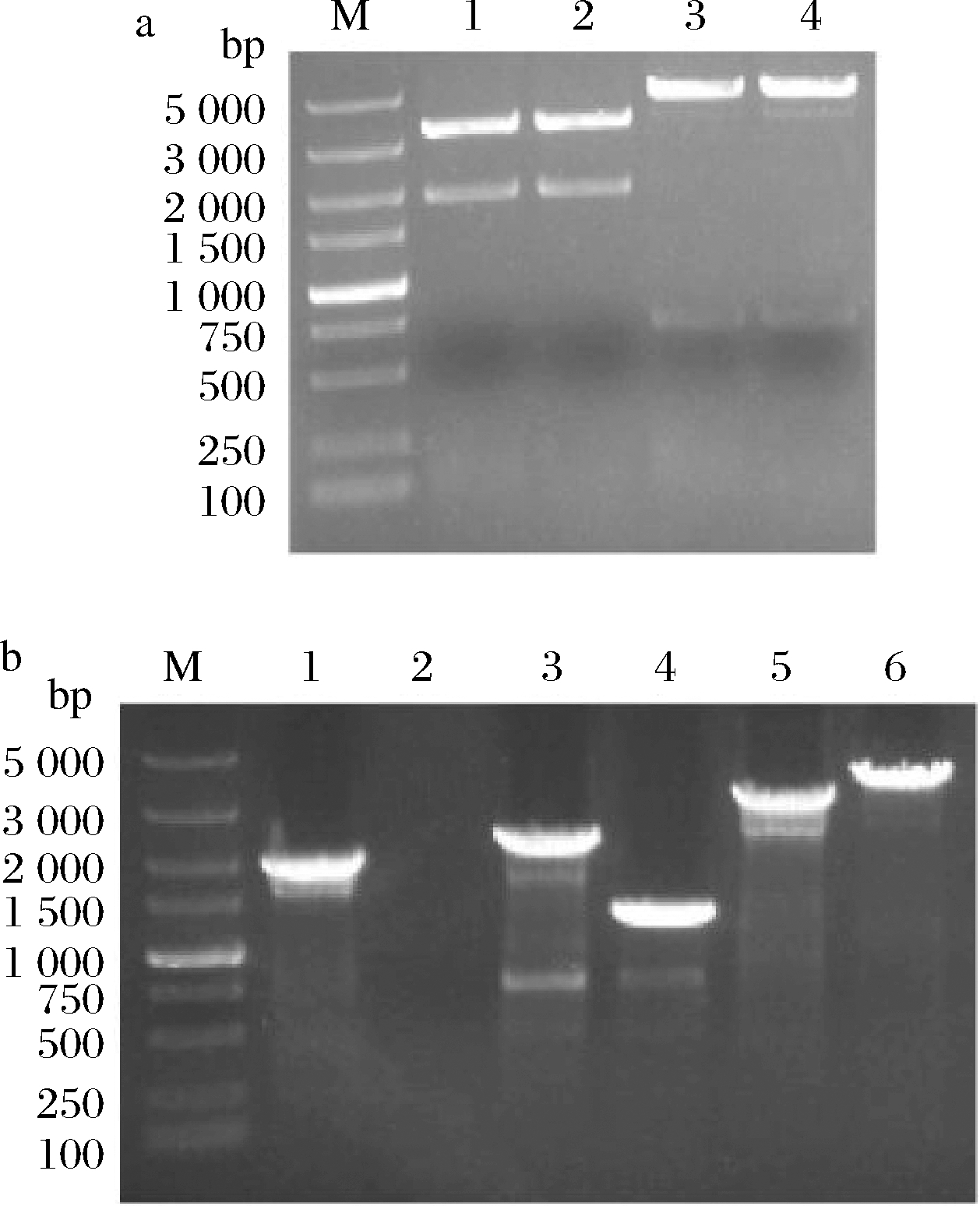
a-双酶切(M:DL5000 marker;1~2:EcoR I/BamH I;3~4:BamH I/Pst I) b-基因组DNA PCR验证(M:DL5000 marker;1~2:pckA上游定位 基因片段;3~4:pckA下游定位基因片段;5~6:pckA定位基因片段) 1、3、5:BJ3-2ΔpckA;2、4、6:BJ3-2
图4 DNA核酸电泳图
Fig.4 Agarose gel electrophoresis of DNA
2.3 发酵豆豉的感官评价
为研究pckA敲除前后菌株发酵豆豉风味变化,分别对45 ℃下BJ3-2和BJ3-2ΔpckA发酵豆豉的颜色、黏性和质地变化进行观察。如图5所示,相比于BJ3-2,BJ3-2ΔpckA发酵的豆豉颜色更深、豆豉间黏丝增加,质地变化不明显。
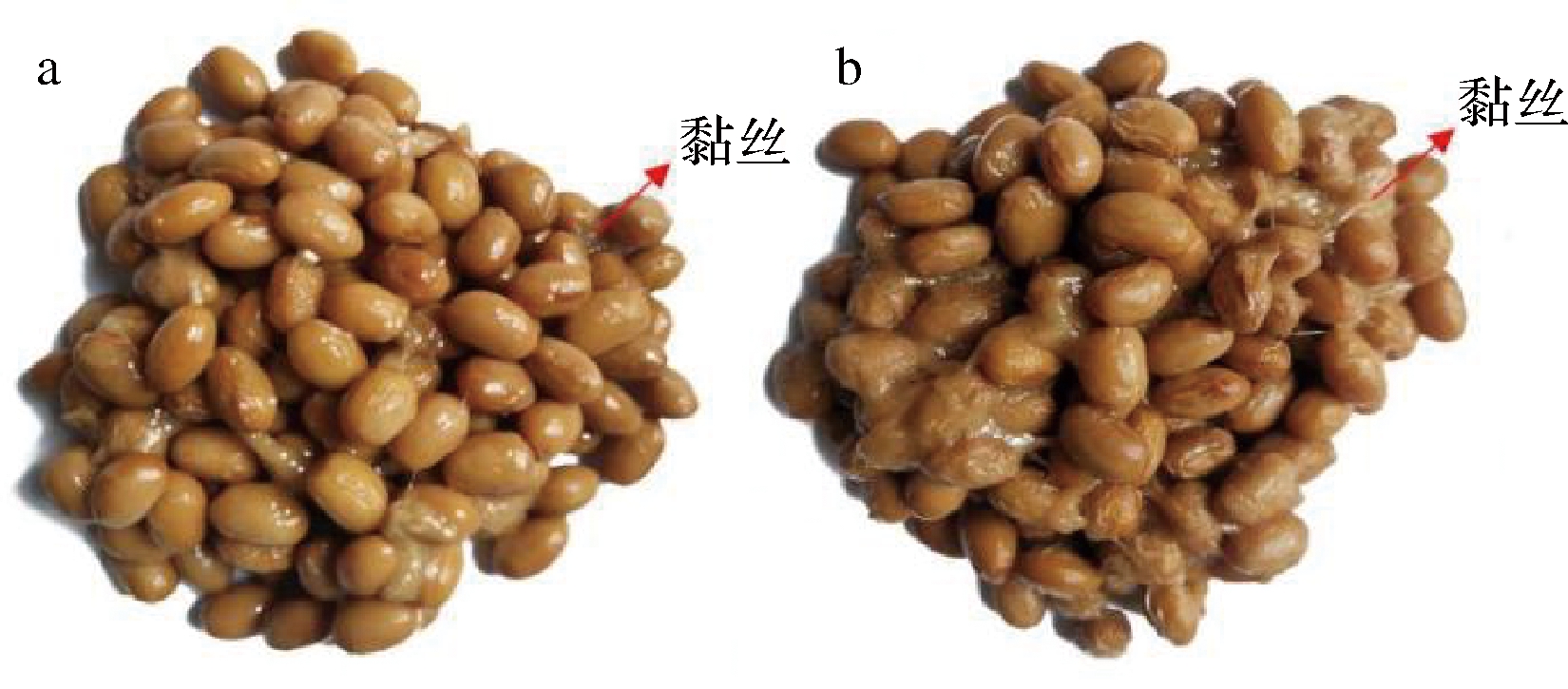
a-BJ3-2;b-BJ3-2ΔpckA
图5 发酵豆豉外观形态图
Fig.5 Appearance diagram of fermented Douchi
结合感官评价(表2),发现BJ3-2ΔpckA发酵的豆豉酱香更浓郁,氨味也有明显降低,表明敲除pckA有助于提高枯草芽孢杆菌BJ3-2发酵豆豉的风味。
2.4 敲除菌株生长特性
为研究敲除pckA对BJ-2生长能力的影响,对BJ3-2ΔpckA与BJ3-2进行菌落形态观察(图6)。结果显示,BJ3-2ΔpckA呈现革兰氏阳性短杆状,在平板上形状不规则、菌落中心呈同心环状隆起、不透明、表面干燥及菌体微黏稠等,所有特征均与BJ3-2一致,无显著差异。
表2 感官评价结果
Table 2 The results of sensory evaluation

参数分数BJ3-2BJ3-2ΔpckA评分标准颜色911棕褐色(8~15)、深黄褐色或淡黄褐色(5~7)、深棕色(1~4)黏性 713很黏(8~15)、中等(5~7)、不黏(1~4)质地1718中等硬度(15~20),略硬或略软(10~14),非常硬或非常柔软(1~9)氨味1722轻(16~25)、中(11~15)、重(1~10)酱香味1723浓郁(16~25),中等(11~15),轻(1~10)总分6787

a-BJ3-2革兰氏染色;b-BJ3-2ΔpckA革兰氏染色; c-BJ3-2平板菌落形态;d-BJ3-2ΔpckA平板菌落形态
图6 菌落形态
Fig.6 Colony morphology of Bacillus subtilis
此外,两株菌生长曲线测定(图7)结果显示,两株菌在同一时间的OD600值差异不显著(P>0.05),表明敲除pckA不会影响BJ3-2正常生长。由此可知BJ3-2ΔpckA与BJ3-2发酵豆豉风味变化,并不是由于敲除pckA影响菌株正常生长而导致的。
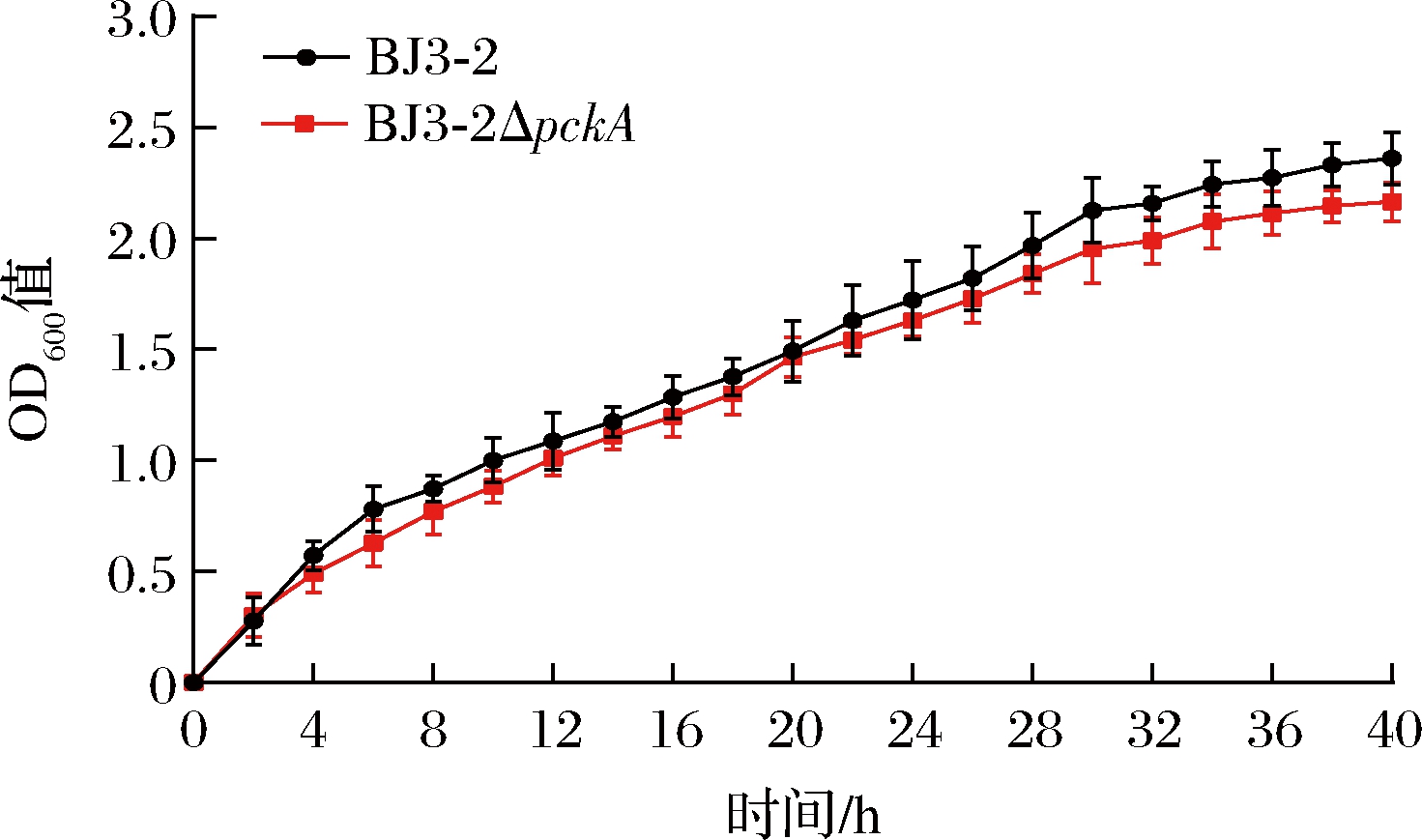
图7 生长曲线
Fig.7 Growth curve
2.5 发酵豆豉pH测定
BJ3-2和BJ3-2ΔpckA发酵豆豉的pH总体均随发酵时间增加不断升高,从24 h起pH每24 h增加5%~7%。如图8所示,BJ3-2ΔpckA发酵豆豉过程中pH一直高于BJ3-2,且均具有显著性差异。
2.6 GC-MS检测
基于前期对与TTMP合成相关的pckA进行分析,构建了pckA缺失菌株,发现pckA敲除前后菌株发酵的豆豉风味存在差异。因此,通过GC-MS对pckA敲除前后菌株发酵的豆豉中TTMP及前体物质ACT进行检测,检查结果显示,与BJ3-2对比,BJ3-2ΔpckA发酵的豆豉中ACT降低10.41%,而TTMP增加23.71%,表明敲除pckA有助于枯草芽孢杆菌合成TTMP(图9)。
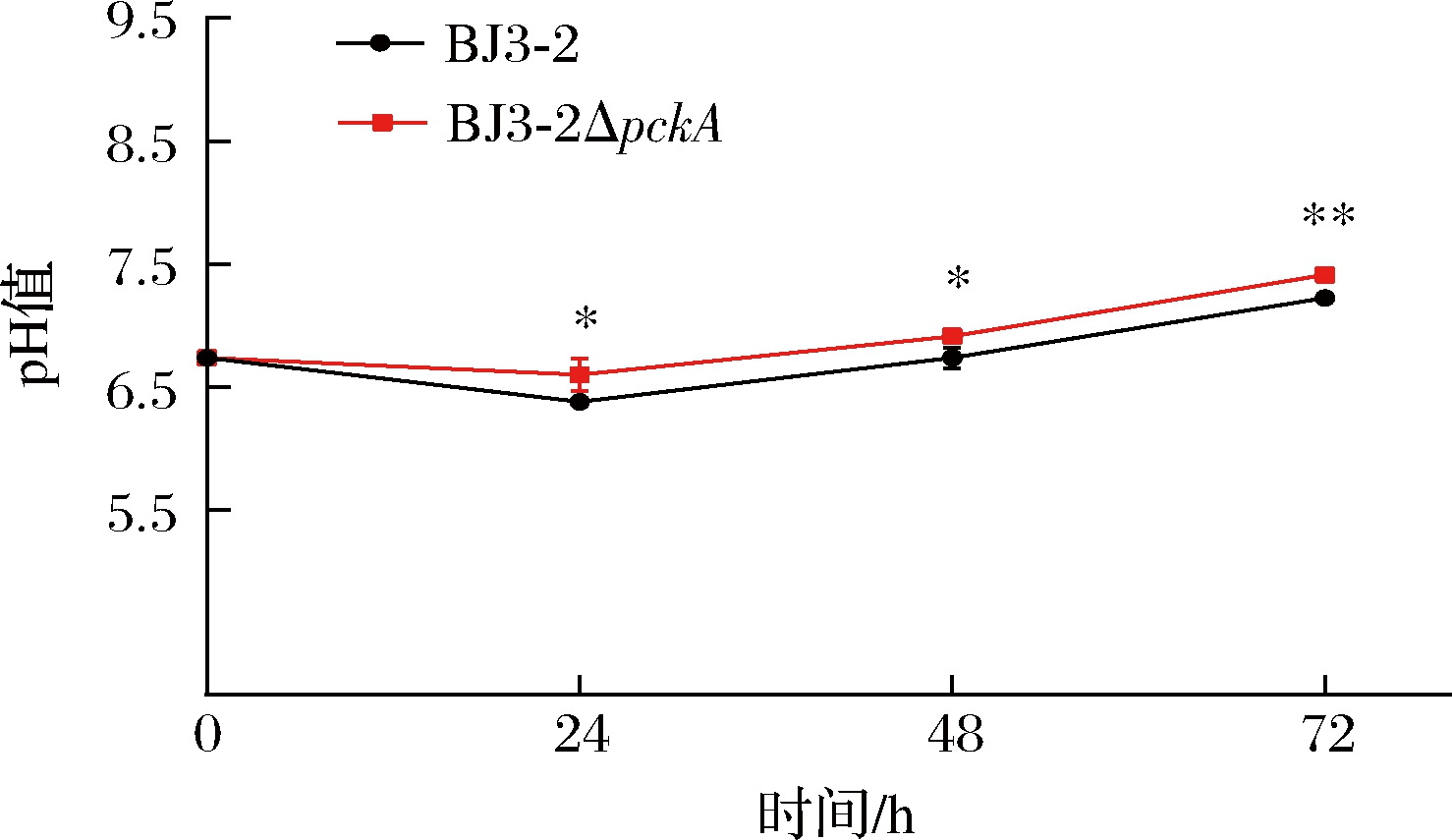
图8 发酵豆豉过程中pH值的变化
Fig.8 Changes of pH during fermentation of Douchi

图9 豆豉中ACT和TTMP相对含量
Fig.9 Relative content of ACT and TTMP in Douchi
3 结论与讨论
枯草芽孢杆菌发酵过程中TTMP的代谢能力影响发酵食品的风味品质,对TTMP代谢途径中关键基因的表达优化是提高TTMP合成的有效手段[19-20]。本研究以具有优良发酵风味的豆豉发酵菌株BJ3-2为出发菌株,靶向TTMP合成途径中的pckA,首次发现缺失pckA使BJ3-2ΔpckA发酵豆豉中ACT的含量降低10.41%,而TTMP含量增加23.71%,豆豉品质和风味显著提升。
在TTMP合成途径中,ACT作为TTMP前体,其与氨通过非酶促反应生成TTMP[6-7],因此,TTMP的含量受ACT和氨的影响。然而,ACT生物合成途径是枯草芽孢杆菌中的一种能量贮存过程[21],在菌株发酵后期,当胞内葡萄糖耗尽时,ACT将被利用于产能[22],可能造成BJ3-2ΔpckA发酵豆豉后期ACT的含量下降。其次,敲除pckA使细胞糖酵解途径中丙酮酸的生成受到影响,从而激活丙酮酸回补途径,例如丙氨酸等生糖氨基酸会通过脱氨基作用生成丙酮酸和氨,氨含量的增加有利于TTMP合成。最后,枯草芽孢杆菌TTMP的合成受pH的影响,当pH值为6.5~7.5 时,TTMP产量随着pH值的升高而提高[23]。菌株BJ3-2和BJ3-2ΔpckA发酵豆豉时,pH值在6~7.5呈上升的趋势,同时,BJ3-2ΔpckA的发酵pH显著高于BJ3-2。因此,BJ3-2ΔpckA的发酵条件更利于TTMP合成。
本研究中敲除pckA使豆豉中TTMP含量有一定程度的提升。然而,TTMP代谢途径中还有基因可以结合组学手段进行进一步的挖掘。同时,枯草芽孢杆菌TTMP的调控不仅受到代谢途径中相关代谢产物、相关酶的调控,还受到发酵环境因素的影响,对这些影响因素的进一步研究,将为枯草芽孢杆菌发酵产品品质的提升提供方向。
[1] XIAO Z J, HOU X Y, LYU X, et al.Accelerated green process of tetramethylpyrazine production from glucose and diammonium phosphate[J].Biotechnology for Biofuels, 2014, 7(1):1-8.
[2] LIU Y, SONG H L, LUO H Z.Correlation between the key aroma compounds and gDNA copies of Bacillus during fermentation and maturation of natto[J].Food Research International, 2018, 112:175-183.
[3] GAO L H, LIU T, AN X J, et al.Analysis of volatile flavor compounds influencing Chinese-type soy sauces using GC-MS combined with HS-SPME and discrimination with electronic nose[J].Journal of Food Science and Technology, 2017, 54(1):130-143.
[4] 王家东, 刘丹彤, 王馨宇, 等.山西老陈醋酿造过程四甲基吡嗪形成规律及稳定性研究[J].食品与发酵工业, 2022, 48(15):62-68.
WANG J D, LIU D T, WANG X Y, et al.The formation and stability of tetramethylpyrazine in the brewing process of Shanxi aged vinegar[J].Food and Fermentation Industries,2022, 48(15):62-68.
[5] FAN W L, XU Y, ZHANG Y H.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].Journal of Agricultural and Food Chemistry,2007, 55(24):9 956-9 962.
[6] 徐岩, 吴群, 范文来, 等.中国白酒中四甲基吡嗪的微生物产生途径的发现与证实[J].酿酒科技, 2011(7):37-40.
XU Y, WU Q, FAN W L, et al.The discovery &verification of the production pathway of tetramethylpyrazine (TTMP) in Chiese liquor[J].Liquor-Making Science &Technology, 2011(7):37-40.
[7] ZHU B F, XU Y.FAN W L.High-yield fermentative preparation of tetramethylpyrazine by Bacillus sp.using an endogenous precursor approach[J].Journal of Industrial Microbiology and Biotechnology, 2010, 37(2):179-186.
[8] ZHI Y, WU Q, DU H, et al.Biocontrol of geosmin-producing Streptomyces spp.by two Bacillus strains from Chinese liquor[J].International Journal of Food Microbiology, 2016, 231:1-9.
[9] KIMURA K, YOKOYAMA S.Trends in the application of Bacillus in fermented foods[J].Current Opinion in Biotechnology, 2019;56:36-42.
[10] LIANG H P, LI W F, LUO Q C, et al.Analysis of the bacterial community in aged and aging pit mud of Chinese Luzhou-flavour liquor by combined PCR-DGGE and quantitative PCR assay[J].Journal of the Science of Food and Agriculture, 2015, 95(13):2 729-2 735.
[11] RAMOS C L, DE ALMEIDA E G, FREIRE A L, et al.Diversity of bacteria and yeast in the naturally fermented cotton seed and rice beverage produced by Brazilian Amerindians[J].Food Microbiology, 2011, 28(7):1 380-1 386.
[12] K OSOWSKI G, MIKULSKI D, PIELECH-PRZYBYLSKA K.Pyrazines biosynthesis by Bacillus strains isolated from natto fermented soybean[J].Biomolecules, 2021, 11(11):1736.
OSOWSKI G, MIKULSKI D, PIELECH-PRZYBYLSKA K.Pyrazines biosynthesis by Bacillus strains isolated from natto fermented soybean[J].Biomolecules, 2021, 11(11):1736.
[13] 吴拥军. 一种枯草芽孢杆菌菌种及其用途:CN102199559A[P].2011-09-28.
WU Y J.A Bacillus subtilis strain and its use:CN102199559A[P].2011-09-28.
[14] LIU Z, WU Y, ZHANG L, et al.RocF affects the production of tetramethylpyrazine in fermented soybeans with Bacillus subtilis BJ3-2[J].BMC Biotechnology, 2022, 22(1):18.
[15] YU S, MENG S M, XIANG M X, et al.Phosphoenolpyruvate carboxykinase in cell metabolism:Roles and mechanisms beyond gluconeogenesis[J].Molecular Metabolism, 2021, 53:101257.
[16] 王希晖, 刘洪玲, 隋松森, 等.海藻糖合酶在枯草芽孢杆菌中的高效表达[J].食品与发酵工业, 2019, 45(7):29-36.
WANG X H, LIU H L, SUI S S, et al.Efficient expression of trehalose synthase in Bacillus subtilis WB800n[J].Food and Fermentation Industries, 2019, 45(7):29-36.
[17] 罗宁, 杨慧林, 沈徐凯, 等.转谷氨酰胺酶酶原在枯草芽孢杆菌WB800中的表达[J].现代食品科技, 2011, 27(7):734-737.
LUO N, YANG H L, SHEN X K, et al.Expression of pro-transglutaminase in Bacillus subtilis WB800[J].Modern Food Science and Technology, 2011, 27(7):734-737.
[18] 李雯, 谢和.枯草芽孢杆菌tdh基因对酱香风味的影响[J].食品与发酵工业, 2021, 47(24):116-123.
LI W, XIE H.Effect of tdh gene of Bacillus subtilis on Maotai-flavor[J].Food and Fermentation Industries, 2021, 47(24):116-123.
[19] CUI D Y, WEI Y N, LIN L C, et al.Increasing yield of 2,3,5,6-tetramethylpyrazine in Baijiu through Saccharomyces cerevisiae metabolic engineering[J].Frontiers in Microbiology, 2020, 11:596306.
[20] MENG W, WANG R M, XIAO D G.Metabolic engineering of Bacillus subtilis to enhance the production of tetramethylpyrazine[J].Biotechnology Letters, 2015, 37(12):2 475-2 480.
[21] MAYER D, SCHLENSOG V, BÖCK A.Identification of the transcriptional activator controlling the butanediol fermentation pathway in Klebsiella terrigena[J].Journal of Bacteriology, 1995, 177(18):5 261-5 269.
[22] GRUNDY F J, WATERS D A, TAKOVA T Y, et al.Identification of genes involved in utilization of acetate and acetoin in Bacillus subtilis[J].Molecular Microbiology, 1993, 10(2):259-271.
[23] 孟武, 王瑞明, 肖冬光.2,3-丁二醇调控四甲基吡嗪及乙偶姻合成菌产物产量的研究[J].食品与发酵工业, 2016, 42(1):21-25.
MENG W, WANG R M, XIAO D G.Effects of cultivation conditions on the yields of acetoin and TTMP[J].Food and Fermentation Industries, 2016, 42(1):21-25.