我国山楂种植历史悠久,种质资源丰富,是世界第三大山楂栽培中心,种植总面积达8.67万hm2,年产量150多万t,主要分布在北方地区[1]。山楂通常作为绿篱和观赏树,其果(一般也称为山楂)可生吃或做果酱果糕,干制后可入药,有健胃、消积化滞、舒气散瘀等功效[2]。山楂中含有黄酮类化合物、原花青素、有机酸和表儿茶素等多种功能性成分,目前已从山楂中成功分离出超过150余种化合物[3]。多糖是山楂中重要功能活性成分,其含量可达山楂干重的6.4%[4]。研究表明,山楂的品种、成熟度、贮藏时间、提取纯化方法等不同可引起山楂多糖组成结构及功能活性的差异。溶剂提取法(水提法、酸/碱提取法及酶解法等)或辅助溶剂提取法(超声、微波等)是常用的山楂多糖提取方法。通过比较热水浸提、超声辅助、酶法辅助及超声-酶法辅助提取方法对山楂多糖得率、组成结构及体外抗氧化活性的影响发现,不同提取方法对山楂多糖的单糖组成无显著影响,鼠李糖、木糖、葡萄糖和半乳糖为山楂多糖的主要单糖组分。超声-酶法辅助提取山楂多糖得率[(10.39±0.04)%]最高且体外抗氧化活性最强,而热水浸提法提取所得山楂多糖分子质量最大[5]。ZHU等[6]利用DEAE-52树脂对酶法提取山楂粗多糖进行分离并得到6个组分,其中中性糖组分主要由葡萄糖构成,而酸性糖组分主要由半乳糖醛酸构成。
山楂多糖功能活性已被科学证实。山楂多糖可显著降低高脂膳食诱导小鼠的肝脏质量,通过抑制高脂诱导的SREBF-1c活化,显著降低相关的mRNA和蛋白质表达水平,降低脂肪酸合成酶、乙酰辅酶A羧化酶和丙酮酸激酶活性,从而降低肝脏中甘油三酯和总脂水平[7-8]。山楂多糖可显著降低肿瘤坏死因子-α与白细胞介素-6水平,提高白细胞介素-10水平,从而抑制NF-κB信号通路,缓解高脂膳食引起的大鼠肝脏炎症[9]。此外,山楂多糖还具有抗糖基化[6]、抑制腐败微生物[10]等健康功效。研究发现,山楂多糖的健康功效与其益生活性密切相关。ZHANG等[11]和GUO等[12]采用沸水浸提与DEAE SepharoseTM Fast Flow离子交换层析从山楂中提取并纯化得到了2个多糖组分HAW-1与HAW-2,结构分析发现二者均为葡聚糖。体外纯种发酵表明,HAW-1与HAW-2具有益生活性,可显著促进多形拟杆菌(Bacteroides thetaiotamicron)、卵形类杆菌(Bacteroides ovatus)和长双歧杆菌(Bifidobacterium longμm)的增殖并代谢产生乙酸和丙酸。然而,山楂多糖作为益生元对肠道菌群结构及代谢调节作用研究缺乏,限制了山楂多糖作为功能性食品原料在食品开发中的应用。
本研究采用水提醇沉法制备山楂多糖,经色谱层析纯化获得单一多糖组分HFP-2并对其分子质量、单糖组成、结构特征进行分析,采用体外粪便菌群发酵分析了HFP-2的益生活性,对发酵过程中pH变化、短链脂肪酸生成、肠道微生物组成变化进行监测,研究发现有望为山楂多糖相关益生功能食品的开发提供理论参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
山里红山楂(Crataegus pinnatifida var.major),河北怡达食品集团有限公司;SephadexTM G-500、Q-sepharoseTM Fast Flow,美国Cytiva公司;大孔树脂AB-8、透析袋(截留分子质量为3 500 Da),上海源叶生物科技有限公司;苯酚,上海麦克林生化科技有限公司;优级纯菊粉,比利时Orafti公司;BCA蛋白定量检测试剂盒,北京百瑞极生物科技有限责任公司;蛋白胨、酵母浸粉,美国Thermo scientific公司;吐温-80,西陇化工股份有限公司;L-半胱氨酸盐酸盐,常州百瑞吉生物医药有限公司;高铁血红素,上海碧云天生物技术有限公司;维生素K1、D-半乳糖醛酸,D-(+)半乳糖、D-无水葡萄糖、L-(+)鼠李糖、L-阿拉伯糖,北京索莱宝科技有限公司;其他试剂如无说明则均为国产分析纯。
1.1.2 仪器与设备
HB10旋转蒸发仪,德国IKA公司;LGJ-10冷冻干燥机,北京四环科技有限公司;CBS-C自动收集器,上海沪西分析仪器厂;BT100-2 J蠕动泵,兰格恒流泵有限公司;MuLTLSKANFC多功能酶标仪,美国Thermo scientific公司;754紫外可见分光光度计,上海菁华科技仪器有限公司;HH-1数显恒温水浴锅,常州荣华仪器制造有限公司;3K15冷冻离心机,美国Sigma公司;PHS-3C pH计,成都世纪方舟有限公司;1200 Series高效液相色谱仪,美国安捷伦公司;LC-20AD高效液相色谱仪,日本岛津公司;SPECTRUM 100傅里叶红外光谱仪,美国PkinElme公司。
1.2 实验方法
1.2.1 山楂多糖的提取
新鲜山楂去核后冷冻干燥,经粉碎后过200目筛后保存备用。取山楂果粉20.0 g以1∶20(质量比)加入去离子水,90 ℃水浴浸提120 min(500 r/min),浸提液冷却至室温后离心10 min(4 ℃,5 000 r/min)并收集上清液。加入2倍体积无水乙醇对上清液中的山楂多糖进行醇沉,4 ℃静置过夜后离心10 min(4 ℃,2 000 r/min)并收集沉淀即为山楂多糖,经冷冻干燥后保存备用。
1.2.2 山楂多糖的分离纯化
1.2.2.1 大孔吸附树脂AB-8脱色
准确称取山楂多糖0.50 g并溶解于50 mmol/L NaCl溶液(5 mg/mL)。采用大孔吸附树脂AB-8色谱柱(3.2 cm×28 cm)对山楂多糖溶液进行脱色,洗脱液为50 mmol/L NaCl溶液,流速为1 mL/min,于490 nm苯酚硫酸法对洗脱液中多糖进行监测。洗脱液中未检测出多糖后停止收集,收集洗脱液并合并,采用旋转蒸发仪进行浓缩,4 ℃条件下去离子水透析72 h(截留分子质量为3 500 Da),冷冻干燥后获得山楂多糖CHFP组分并保存备用。
1.2.2.2 Q-sepharoseTM Fast Flow阴离子交换层析
准确称取山楂多糖CHFP组分0.30 g溶解于20 mmol/L Tris-HCl缓冲液中(pH=8.0,300 mL),同时采用20 mmol/L Tris-HCl缓冲液中(pH=8.0,200 mL)对Q-sepharoseTM Fast Flow离子层析柱(3.2 cm×28 cm)进行预平衡,将配制的山楂多糖溶液上样至阴离子交换层析柱后(流速2 mL/min),分别采用洗脱液A(Tris-HCl缓冲液,pH=8.0)和洗脱液B(含200 mmol/L NaCl的Tris-HCl缓冲液,pH=8.0)对山楂多糖中中性组分和酸性组分进行洗脱,洗脱流速为 2 mL/min。采用自动收集器收集洗脱液,每管收集4 min,于490 nm 苯酚硫酸法测定各管中多糖含量,洗脱液中未检测出多糖后停止收集。绘制洗脱曲线。根据洗脱曲线,对相应组分洗脱液进行合并并浓缩,4 ℃条件下去离子水透析72 h(截留分子质量为3 500 Da),冷冻干燥后获得山楂多糖HFP组分并保存备用。
1.2.2.3 SephadexTM G-500凝胶层析
采用SephadexTM G-500凝胶层析(1.6 cm×74 cm)对山楂多糖HFP组分进行进一步纯化。准备称取山楂多糖HFP组分0.10 g溶解于去离子水(10 mg/mL),上样量为5 mL,采用去离子水对凝胶层析柱进行洗脱。采用自动收集器对洗脱液进行收集,每管收集4 mL。采用苯酚硫酸法测定各管洗脱液中多糖含量,洗脱液中未检测出多糖后停止收集。绘制洗脱曲线。根据洗脱曲线对洗脱山楂多糖组分进行合并,浓缩后4 ℃条件下去离子水透析72 h(截留分子质量为3 500 Da),冷冻干燥后获得山楂多糖HFP-2组分并保存备用。
1.2.3 分子质量测定
采用高效液相色谱法对纯化前后山楂多糖(CHFP与HFP-2)的分子质量进行测定。配制1 mL 1.0 mg/mL纯化前后山楂多糖溶液,过0.22 μm滤膜后采用安捷伦1200液相色谱仪进行分析。色谱条件为:示差检测器,色谱柱Agilent PL aquagel-OH MIXED-H(8 μm,300 mm×7.5 mm),流动相为纯水,柱温30 ℃,流速1.0 mL/min,进样量10 μL。以葡聚糖为标准品建立保留时间(min)与分子质量对数lg Mw的标准曲线,计算CHFP与HFP-2平均分子质量。
1.2.4 化学组成分析
1.2.4.1 总糖含量分析
于490 nm下采用苯酚硫酸法[13],以CHFP与HFP-2中单糖组成及其含量配制0.1 mg/mL标准溶液,对纯化前后的山楂多糖样品中的总糖含量进行检测。
1.2.4.2 蛋白含量分析
于562 nm下采用BCA法[14],以牛血清蛋白作为标准蛋白,对纯化前后的山楂多糖样品中的蛋白质含量进行检测。
1.2.4.3 单糖组成分析
分别称取5.0 mg纯化前后山楂多糖(CHFP与HFP-2)置于5 mL棕色安培管中,加入3.0 mL 2 mol/L三氟乙酸,密封后于110 ℃条件下水解8 h,加入2 mL甲醇中止反应,采用旋转蒸发仪对反应体系进行旋蒸干燥,重复该过程3次后加入去离子水溶解山楂多糖水解产物并定容至3 mL。
吸取250 μL山楂多糖水解物溶液至5 mL离心管中,加入250 μL 0.6 mol/L NaOH及500 μL 0.4 mol/L 1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)-甲醇,70 ℃水浴反应1 h。反应液冷却至室温后加入500 μL 0.3 mol/L HCl中和,再加入1 mL氯仿涡旋1 min,萃取3次后保留水相离心10 min(3 000 r/min,4 ℃),合并上清液。上清液过0.22 μm滤膜后采用岛津LC-20AD液相色谱仪对其中的单糖组分进行分析。色谱条件:紫外检测器,Xtimate C18色谱柱(4.6 mm×200 mm,5 μm),流动相为0.05 mol/L磷酸二氢钾溶液(pH=6.70)∶乙腈=83∶17(体积比),柱温30 ℃,流速1.0 mL/min,进样量20 μL,在250 nm下检测。
1.2.5 傅里叶变换红外光谱分析
称取纯化前后的山楂多糖样品(CHFP与HFP-2)10 mg,利用带有衰减全反射(attenuated total reflection,ATR)组件的SPECTRUM 100型傅里叶红外光谱仪对山楂多糖中的官能团进行分析,波数为4 000~600 cm-1,测定频率设置为1 cm-1。
1.2.6 山楂多糖体外粪便发酵
选取3名健康志愿者(18~25岁),要求志愿者半年内未服用抗生素类药物、未补充益生元类产品且无肠道疾病史。采集志愿者的新鲜粪便样品,借助小玻璃珠将粪便样品分散于PBS缓冲液,纱布过滤后配制成质量浓度为0.1 g/mL的粪便匀浆。配制5 mL基础培养基[基础培养基配方(g/L):蛋白胨2.0、酵母浸粉2.0、NaCl 0.1、K2HPO4 0.04、KH2PO4 0.04、MgSO4· 7H2O 0.01、CaCl2·6H2O 0.01、NaHCO3 2.0、吐温-80 2 mL,高铁血红素0.02,维生素K1 2 mL,胆盐0.5,L-半胱氨酸盐酸盐0.5],加入250 mL厌氧瓶中,灭菌后分别添加5 mL过滤除菌的0.2 mg/mL HFP-2与菊粉(阳性对照)溶液,接入10 mL粪便匀浆并混合均匀后通入氮气,37 ℃水浴厌氧发酵48 h。空白组不添加任何碳源。
1.2.6.1 微生物基因组提取和测序分析
取5 mL发酵液离心后(1 000 r/min,15 min)沉淀采用OMEGA Soil DNA Kit(D5625 01)试剂盒提取总DNA。选用细菌16S rRNA基因高度可变的V3、V4区进行扩增,特异性引物分别为338F(5′-ACTCCTACGGGAGGCAGCA-3′),806R(5′-GGACTACHVGGGTWTCTAAT-3′)。扩增结束后采用2%琼脂糖凝胶电泳分离目的基因,切取目的片段后使用Axygen凝胶回收试剂盒回收目的基因。利用TruSeq Nano DNA LT Library Prep Kit(Illumina公司,美国)进行建库。对合格的文库,在Illumina NovaSeq上利用NovaSeq 6000 SP Reagent Kit(500个循环)进行2×250 bp的双端测序。测序数据使用QIIME2进行分析微生物群落多样性分析[15]。
1.2.6.2 发酵液pH测定
取5.0 mL各时间点发酵液至离心管,室温下测定发酵液pH。
1.2.6.3 短链脂肪酸分析
取0.5 mL各时间点发酵液至离心管,离心10 min(4 ℃,10 000 r/min),取200 μL上清液至4 mL 离心管中,加入50 μL浓HCl及2.5 mL无水乙醚涡旋后静置20 min,萃取完成后离心10 min(4 ℃,10 000 r/min),取上层有机相至离心管中,加入300 μL 1.0 mol/L NaOH涡旋后静置20 min,萃取结束后离心10 min(4 ℃,10 000 r/min),收集下层水相,加入50 μL浓HCl混匀,过0.22 μm滤膜后采用安捷伦1260液相色谱仪对短链脂肪酸组成及含量进行分析。色谱条件:紫外检测器,Agilent Hi-Plex色谱柱(4.6 mm×250 mm,8 μm),流动相为5 mmol/L硫酸溶液,柱温55 ℃,流速1.0 mL/min,进样量30 μL,在210 nm下检测。
1.3 数据处理与分析
所有实验均重复3次,结果表示为平均值±标准偏差,使用R3.6.0、Python3等数据处理软件对数据进行分析,采用多重比较法进行显著性分析(P<0.05表示差异显著),使用GraphPad Prism 8软件作图。
2 结果与分析
2.1 山楂多糖的提取与分离纯化
采用水提醇沉法对山楂中的多糖组分进行提取,山楂多糖得率为(5.61±1.23)%。GUO等[12]采用热水浸提法从山楂中提取富含葡萄糖的杂多糖得率为6.5%,而TRIPATHI等[10]LI等[16]从山楂中提取果胶类多糖的得率可达8.7%。山楂多糖经大孔树脂AB-8脱色后(记为CHFP)采用Q-sepharoseTM Fast Flow离子交换色谱进行纯化,洗脱曲线如图1-a所示。CHFP经20 mmol/L Tris-HCl缓冲溶液(pH=8.0)洗脱后无明显洗脱峰,而经含200 mmol/L NaCl的Tris-HCl缓冲溶液(pH=8.0)洗脱后出现洗脱峰(记为HFP),说明CHFP主要为酸性多糖,而不含中性多糖。对HFP进行收集浓缩后进一步通过SephadexTM G-500凝胶柱层析进行纯化,如图1-b洗脱曲线所示,经洗脱后共出现2个洗脱峰,分别记为HFP-1(22~45管)和HFP-2(50~90管),两组分分别占HFP的(15.24±1.25)%和(83.24±1.75)%。因HFP-1组分含量较低,后续收集HFP中主要组分HFP-2进行结构组成及益生活性研究。
2.2 山楂多糖组成及结构特征分析
以葡聚糖为标准品,采用HPLC法对CHFP及HFP-2的分子质量进行分析。如图2所示,CHFP与HFP-2的色谱保留时间分别为5.566、5.450 min,根据葡聚糖标准曲线(y=-1.338 9x+15.712,R2=0.996 4)计算可得,CHFP分子质量为1.82×105 kDa,而经SephadexTM G-500凝胶柱层析进行纯化后获得的HFP-2分子质量为2.60×105 kDa,LINARES-GARC A等[17]通过水提醇沉法得到山楂多糖HMPH的分子质量为502.3 kDa,显著小于CHFP与HFP-2分子质量。
A等[17]通过水提醇沉法得到山楂多糖HMPH的分子质量为502.3 kDa,显著小于CHFP与HFP-2分子质量。
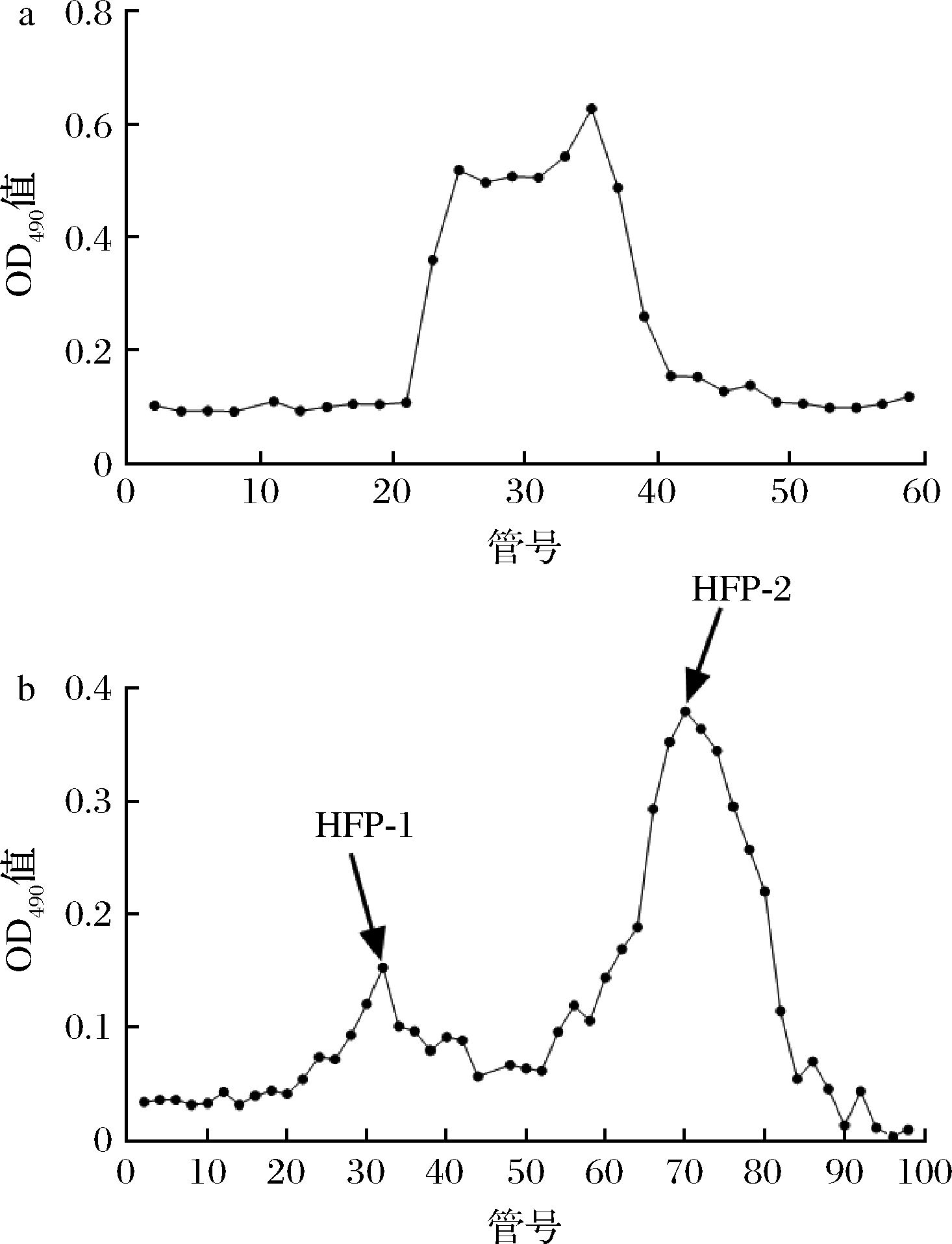
a-Q-sepharoseTM Fast Flow阴离子交换色谱; b-SephadexTMG-500凝胶柱层析
图1 纯化山楂多糖洗脱曲线
Fig.1 Purified hawthorn polysaccharide elution curve
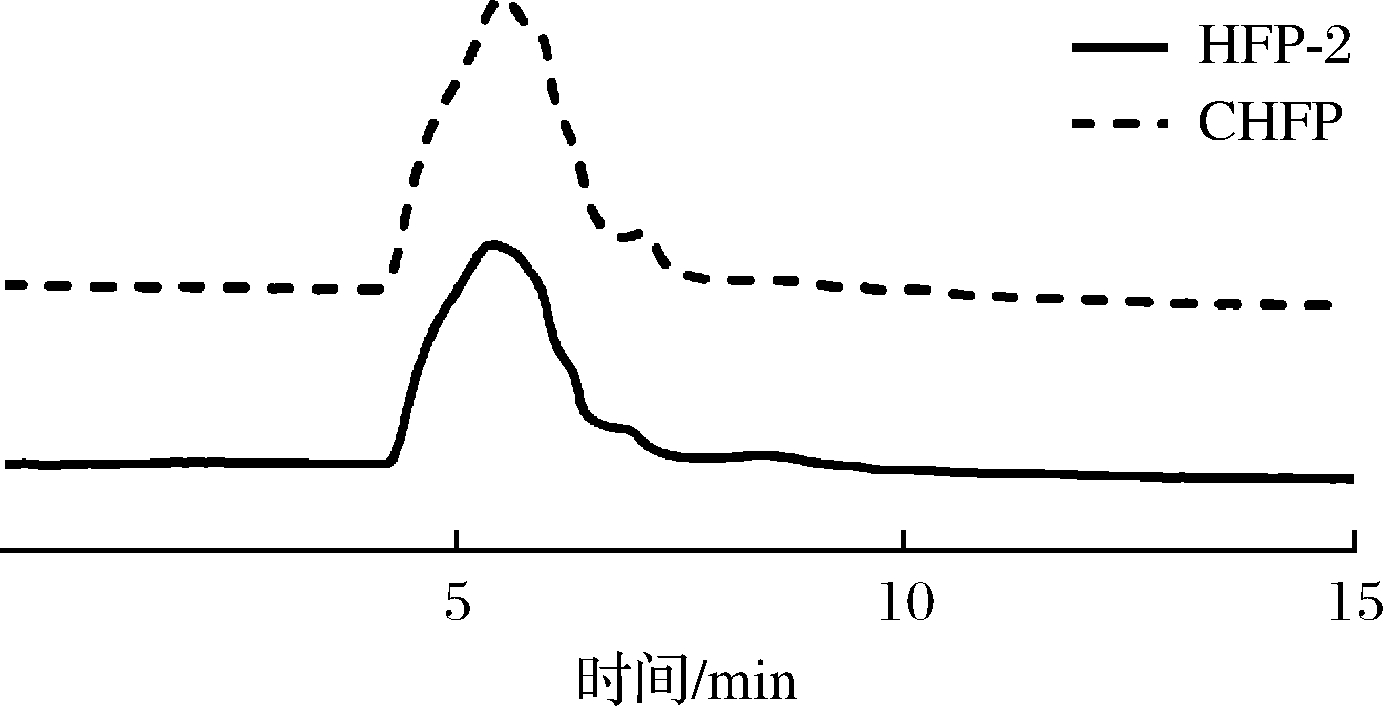
图2 高效液相色谱法分析CHFP与HFP-2的分子质量
Fig.2 Molecular weight analysis of CHFP and HFP-2 by HPLC
2.3 山楂多糖化学组成
如表1所示,未经阴离子层析纯化的组分CHFP总糖含量为(91.58±0.52)%,主要由半乳糖醛酸(44.60 mol%)、阿拉伯糖(26.15 mol%)、葡萄糖(13.02 mol%)和半乳糖(11.53 mol%)组成,此外还含有少量的鼠李糖(5.21 mol%)。HFP-2总糖含量为(93.84±0.58)%,其单糖组成与CHFP相同,HFP-2中的阿拉伯糖(28.11 mol%)、葡萄糖(15.02 mol%)和半乳糖(13.06 mol%)高于CHFP。CHFP与HFP-2中半乳糖醛酸为主要单糖组成,这一结果与商飞飞等[4]通过水提法并利用DEAE-52纤维素柱纯化得到的酸性山楂多糖单糖组成结果一致。BCA法分析结果显示,HFP与HFP-2中均含有少量的蛋白质,含量分别为(6.26±0.08)%和(5.41±0.05)%。
表1 CHFP与HFP-2的化学组成
Table 1 The chemical composition of HFP and HFP-2
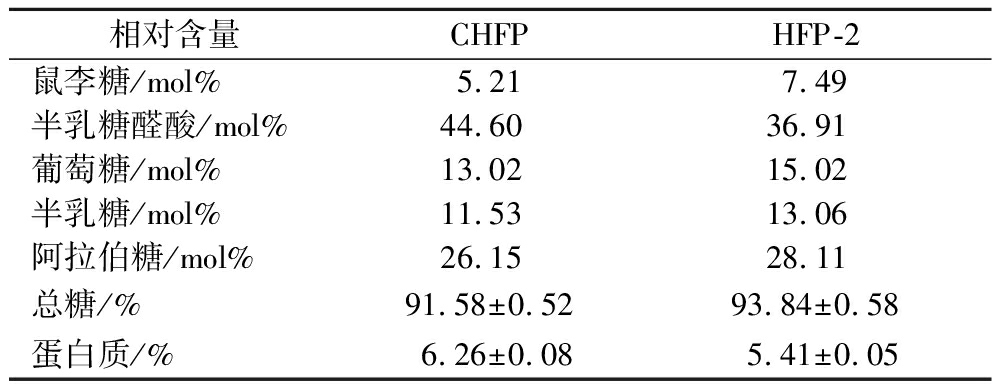
相对含量CHFPHFP-2鼠李糖/mol%5.217.49半乳糖醛酸/mol%44.6036.91葡萄糖/mol%13.0215.02半乳糖/mol%11.5313.06阿拉伯糖/mol%26.1528.11总糖/%91.58±0.5293.84±0.58蛋白质/%6.26±0.085.41±0.05
2.4 傅里叶变换红外光谱分析
采用傅里叶变换红外光谱分别对HFP与HFP-2结构中的官能团类型进行分析。如图3所示,CHFP与HFP-2的具有相似的傅里叶变换红外吸收特征,其中3 308 cm-1处强吸收峰是由由于O—H振动引起,表明2种组分均存在分子间/内氢键[18]。2 904 cm-1处的低强度峰为—CH、—CH2和—CH3中C—H的拉伸和弯曲振动[19]。CHFP与HFP-2含有吡喃糖环结构,吡喃糖环的C—H弯曲振动在1 334 cm-1处有吸收,而1 608 cm-1和1 422 cm-1处的峰分别为CHFP与HFP-2结构中糖醛酸的羧基的不对称和对称拉伸[20]。HFP与HFP-2在1 744 cm-1和1 238 cm-1处存在吸收峰,表明结构中存在酯化羧基(—COOR)及—O—CH3基团[19]。HFP与HFP-2组成中的高半乳糖醛酸含量引起1 020~1 082 cm-1区域的强吸收峰[21]。此外,1 200~1 900 cm-1处的吸收峰为果胶的特征指纹区域[22-23],结合山楂多糖的化学组成分析可以推断,山楂多糖CHFP和HFP-2组分为类似半乳糖醛酸为主链的果胶结构。

图3 CHFP与HFP-2傅里叶变换红外光谱图
Fig.3 FTIR of CHFP and HFP-2
2.5 山楂多糖体外粪便菌群发酵
2.5.1 发酵液pH及短链脂肪酸变化
肠道微生物可发酵利用膳食纤维并代谢生成短链脂肪酸,如乙酸、丙酸和丁酸等[24]。短链脂肪酸可降低结肠内pH值,从而具有抑制肠道有害菌如节杆菌和梭菌类的生长、提高钙离子和镁离子的生物利用率等多种生理功能[25-26]。此外,短链脂肪酸对肠道上皮细胞的代谢具有重要意义,丁酸作为肠道上皮细胞代谢的重要能量来源,能够影响其生长、分化与凋亡。有研究表明,丁酸可预防结肠癌的发生[27-28]。如表2所示,体外粪便菌群发酵HFP-2后,发酵液pH随发酵时间的延长逐渐降低,发酵48 h后,发酵液pH降低至4.45与阳性对照菊粉相当,显著低于空白组(pH=6.33)。发酵液中短链脂肪酸的累积是导致pH降低的重要原因,如表2所示,随着发酵时间的延长,HFP-2组发酵液中乙酸、丙酸、异丁酸、丁酸含量逐渐提高,发酵24 h后乙酸、丙酸、异丁酸含量分别为2.319 3×10-1、1.735 8×10-1、5.058×10-2 mg/mL,
表2 HFP-2体外粪便菌群发酵过程中发酵液pH及短链脂肪酸变化
Table 2 Changes of pH and short chain fatty acids (SCFAs) concentration in culture medium throughout in vitro fermentation of HFP-2 with human fecal microbiota
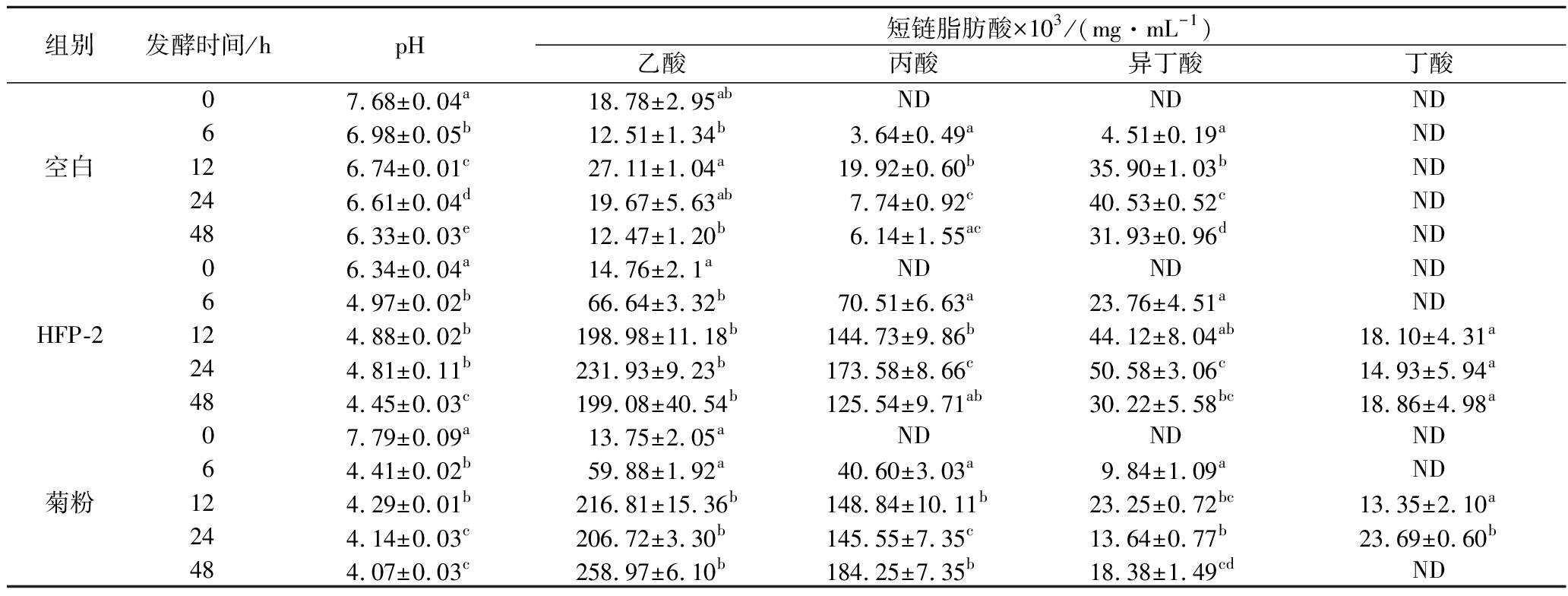
组别发酵时间/hpH短链脂肪酸×103/(mg·mL-1)乙酸丙酸异丁酸丁酸07.68±0.04a18.78±2.95abNDNDND66.98±0.05b12.51±1.34b3.64±0.49a4.51±0.19aND空白126.74±0.01c27.11±1.04a19.92±0.60b35.90±1.03bND246.61±0.04d19.67±5.63ab7.74±0.92c40.53±0.52cND486.33±0.03e12.47±1.20b6.14±1.55ac31.93±0.96dND06.34±0.04a14.76±2.1aNDNDND64.97±0.02b66.64±3.32b70.51±6.63a23.76±4.51aNDHFP-2124.88±0.02b198.98±11.18b144.73±9.86b44.12±8.04ab18.10±4.31a244.81±0.11b231.93±9.23b173.58±8.66c50.58±3.06c14.93±5.94a484.45±0.03c199.08±40.54b125.54±9.71ab30.22±5.58bc18.86±4.98a07.79±0.09a13.75±2.05aNDNDND64.41±0.02b59.88±1.92a40.60±3.03a9.84±1.09aND菊粉124.29±0.01b216.81±15.36b148.84±10.11b23.25±0.72bc13.35±2.10a244.14±0.03c206.72±3.30b145.55±7.35c13.64±0.77b23.69±0.60b484.07±0.03c258.97±6.10b184.25±7.35b18.38±1.49cdND
注:所有结果按照平均值±标准差表示,显著性差异分析使用法;ND表示未检出;上标字母表示组内是否存在差异,即相同标记字母的为差异不显著,不同标记字母的为差异显著(P<0.05)
显著高于菊粉组发酵液中相应短链脂肪酸含量(2.067 2×10-1、1.455 5×10-1和1.364×10-2 mg/mL),而HFP-2组发酵液中丁酸含量(1.493×10-2 mg/mL)低于菊粉组。
2.5.2 微生物群落结构及组成变化
β多样性反映了不同样本之间微生物丰富度的差异,选择weighted UniFrac距离结合主坐标分析(principal coordinates analysis, PCoA)来衡量β多样性[29],如图4-a所示,添加HFP-2发酵后发酵液菌群组成与菊粉组相比发生显著性变化(P<0.05)。α多样性反映了微生物群落的丰富度和多样性,Simpson指数与微生物多样性呈正相关[30]。如图4-b所示,添加HFP-2与菊粉在发酵12、24、48 h后,Simpson指数均低于空白组(P<0.05),这可能与优势菌群的竞争作用有关[31],但添加HFP-2发酵后Simpson指数逐渐增加。以上结果说明,HFP-2在发酵过程中不仅能够改变肠道微生物组成结构,还能够提高肠道微生物丰度。如图4-c所示,0 h时发酵液微生物主要为Firmicutes(91.94%)、Bacteroidetes(4.06%)、Actinobacteria(2.86%)、Proteobacteria(1.01%)门,添加HFP-2发酵12 h后Bacteroidetes(18.14%)、Proteobacteria(17.92%)门相对丰度显著提高(P<0.05),随着发酵时间的延长,Proteobacteria门相对丰度逐渐降低,但Bacteroidetes门相对丰度逐渐上升且始终高于菊粉组。如图4-d所示从属水平上,发酵之初Megamonas(31.24%)、Roseburia(14.62%)与Faecalibacterium(7.06%)为优势菌属,加入HFP-2发酵后上述3种菌属相对丰度均显著降低,Phascolarctobacterium、Bacteroides与Shigella成为优势菌属。相较于菊粉,HFP-2能够显著增加肠道Bacteroides(12 h:10.44%;24 h:14.51%;48 h:19.22%)与Phascolarctobacterium属(12 h:26.17%;24 h:22.85%;48 h:8.65%)相对丰度(P<0.05)。Phascolarctobacterium属广泛分布在我国30~60岁人群肠道中[32],能够分解琥珀酸盐产生丙酸[33],HOU等[34]通过碱提法从柑桔皮提取得到AK与HPAK 2种果胶,与本研究结果相同,AK与HPAK通过体外发酵能够显著提高Phascolarctobacterium属相对丰度且增加丙酸和丁酸的含量。Bacteroide属中许多菌种能够通过编码多种碳水化合物水解酶(如多聚半乳糖醛酸酶和果胶甲基酯酶)代谢复杂碳水化合物主要产生乙酸和丙酸[35],研究发现富含RG-Ⅰ型结构的果胶能够显著提高小鼠肠道中Bacteroides属微生物含量[36],这可能是HFP-2组在体外发酵24 h后发酵液中乙酸和丙酸含量显著高于菊粉组的原因。与空白对照组相比HFP-2能够显著增加Prevotella属(12 h:0.84%;24 h:2.00%;48 h:2.11%)相对丰度,Prevotella是健康人群肠道中的一种主要微生物,它能抵抗胆汁酸,编码多种酶水解复合碳水化合物,产生乙酸,调节餐后血糖,缓解肠道炎症[37]。
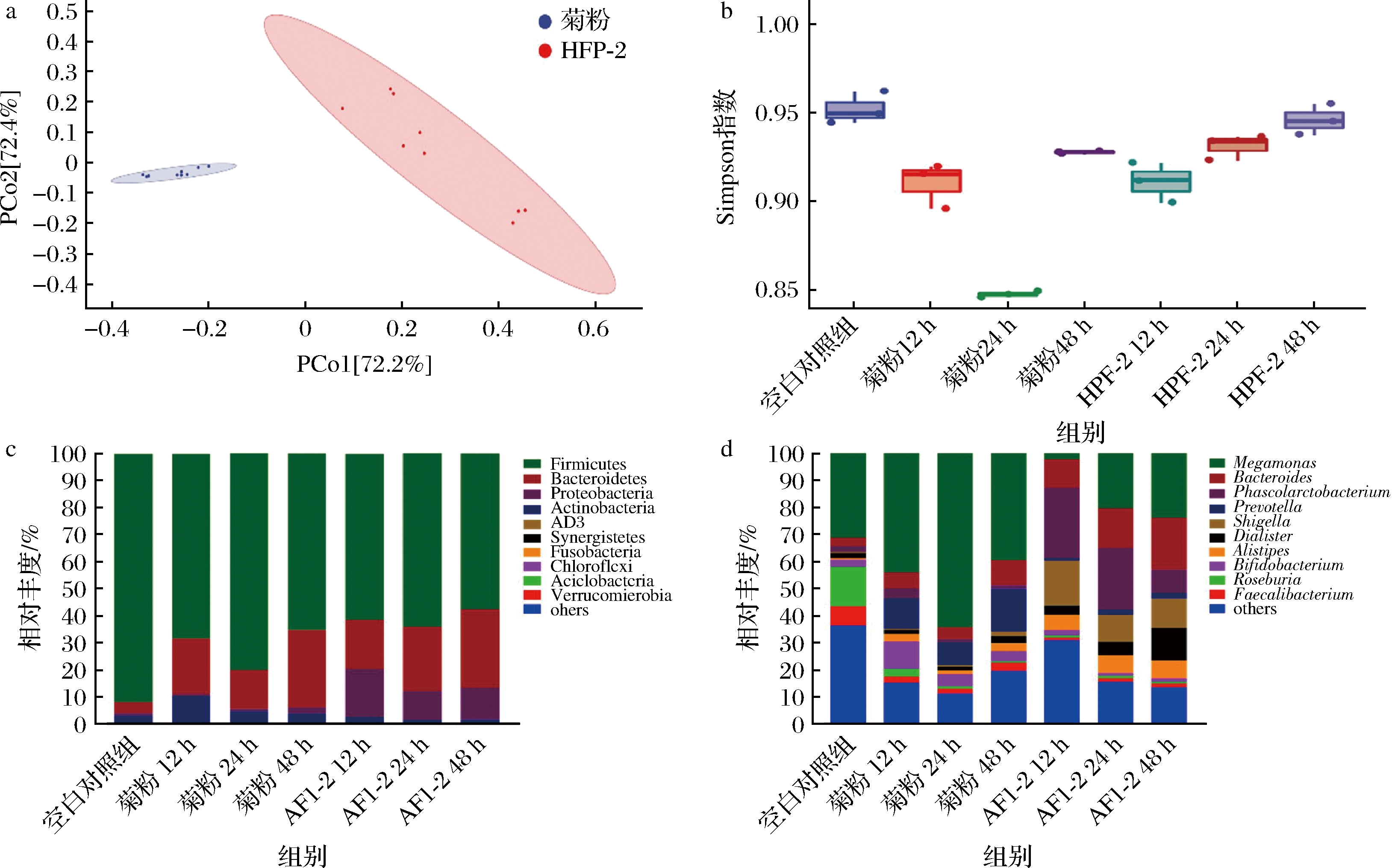
a-β多样性;b-α多样性;c-门水平;d-属水平
图4 HFP-2体外发酵过程中粪便菌群组成及结构变化
Fig.4 Changes in the composition and structure in culture medium throughout in vitro fermentation of HFP-2 with human fecal microbiota
3 结论
本研究从新鲜山楂中提取多糖,通过大孔吸附树脂脱色处理、Q-sepharoseTM Fast Flow阴离子交换层析以及SephadexTM G-500凝胶层析对山楂多糖进行纯化,得到均一多糖组分HFP-2。HFP-2分子质量为5.36×103 kDa,经单糖组成及傅里叶红外光谱分析发现,HFP-2可能是以半乳糖醛酸为主链的果胶。体外粪便菌群发酵实验表明,HFP-2具有益生活性,可以显著改变粪便菌群结构,提高菌群多样性及有益菌相对丰度,促进粪便菌群代谢产乙酸、丙酸、异丁酸及丁酸等短链脂肪酸。因此,山楂多糖可作为膳食纤维类益生元应用于功能食品。
[1] 魏树伟, 王少敏, 董冉, 等.山东省山楂产业现状、存在问题及对策[J].北方果树, 2021(4):53-54.
WEI S W, WANG S M, DONG R, et al.Present situation, problems and countermeasures of hawthorn industry in Shandong Province[J].Northern Fruits, 2021(4):53-54.
[2] 中国科学院中国植物志编辑委员会. 中国植物志[M].北京:科学出版社, 1974.
The Editorial Committee of Flora Reipublicae Popularis Sinicae of Chinese Academy of Sciences.Flora Reipublicae Popularis Sinicae[M].Beijing:Science Press, 1974.
[3] 楼陆军, 罗洁霞, 高云.山楂的化学成分和药理作用研究概述[J].中国药业, 2014, 23(3):92-94.
LOU L J, LUO J X, GAO Y.Overview of chemical compostions and pharmacological action of grataegus Pinnatifida bunge[J].China Pharmaceuticals, 2014, 23(3):92-94.
[4] 商飞飞, 祝儒刚, 张鑫雨, 等.山楂多糖的分离纯化及抗氧化和抗糖化活性研究[J].现代食品科技, 2019, 35(9):96-101;303.
SHANG F F, ZHU R G, ZHANG X Y, et al.Extraction, isolation and purification of haw polysaccharide and its antioxidant and antiglycation activities in vitro[J].Modern Food Science and Technology, 2019, 35(9):96-101;303.
[5] CHEN X, ZHANG H B, DU W Q, et al.Comparison of different extraction methods for polysaccharides from Crataegus pinnatifida Bunge[J].International Journal of Biological Macromolecules, 2020, 150:1 011-1 019.
[6] ZHU R G, HONG M L, ZHUANG C Y, et al.Pectin oligosaccharides from hawthorn (Crataegus pinnatifida Bunge.Var.major) inhibit the formation of advanced glycation end products in infant formula milk powder[J].Food &Function, 2019, 10(12):8 081-8 093.
[7] LI S H, HUANG Z, DONG Y P, et al.Haw pectin pentaglaracturonide inhibits fatty acid synthesis and improves insulin sensitivity in high-fat-fed mice[J].Journal of Functional Foods, 2017, 34:440-446.
[8] LI T, ZHU R, DONG Y, et al.Effects of pectin pentaoligosaccharide from Hawthorn (Crataegus pinnatifida Bunge.var.Major) on the activity and mRNA levels of enzymes involved in fatty acid oxidation in the liver of mice fed a high-fat diet[J].Journal of Agricultural and Food Chemistry, 2013, 61(31):7 599-7 605.
[9] LI T P, CHEN X J, HUANG Z, et al.Pectin oligosaccharide from hawthorn fruit ameliorates hepatic inflammation via NF-κB inactivation in high-fat diet fed mice[J].Journal of Functional Foods, 2019, 57:345-350.
[10] TRIPATHI S, MEHROTRA G K, DUTTA P K.Preparation and physicochemical evaluation of chitosan/poly(vinyl alcohol)/pectin ternary film for food-packaging applications[J].Carbohydrate Polymers, 2010, 79(3):711-716.
[11] ZHANG S H, ZHANG C Q, LI M X, et al.Structural elucidation of a glucan from Crataegus pinnatifida and its bioactivity on intestinal bacteria strains[J].International Journal of Biological Macromolecules, 2019, 128:435-443.
[12] GUO C L, ZHANG S H, WANG Y Q, et al.Isolation and structure characterization of a polysaccharide from Crataegus pinnatifida and its bioactivity on gut microbiota[J].International Journal of Biological Macromolecules, 2020, 154:82-91.
[13] 杨勇杰, 姜瑞芝, 陈英红, 等.苯酚硫酸法测定杂多糖含量的研究[J].中成药, 2005, 27(6):706-708.
YANG Y J, JIANG R Z, CHEN Y H, et al.Determination of sugars in heteropolysaccharide by phenol-sulfuric acid method[J].Chinese Traditional Patent Medicine, 2005, 27(6):706-708.
[14] SMITH P K, KROHN R I, HERMANSON G T, et al.Measurement of protein using bicinchoninic acid[J].Analytical Biochemistry, 1985, 150(1):76-85.
[15] BOLYEN E, RIDEOUT J R, DILLON M R, et al.Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J].Nature Biotechnology, 2019, 37(8):852-857.
[16] LI T P, LI S H, WANG N, et al.Physicochemical properties and partial structural features of haw pectin[J].European Food Research and Technology, 2008, 227(4):1 035-1 041.
[17] LINARES-GARC A J A, RAMOS-RAM
A J A, RAMOS-RAM REZ E G, SALAZAR-MONTOYA J A.Viscoelastic properties and textural characterisation of high methoxyl pectin of hawthorn (Crataegus pubescens) in a gelling system[J].International Journal of Food Science &Technology, 2015, 50(6):1 484-1 493.
REZ E G, SALAZAR-MONTOYA J A.Viscoelastic properties and textural characterisation of high methoxyl pectin of hawthorn (Crataegus pubescens) in a gelling system[J].International Journal of Food Science &Technology, 2015, 50(6):1 484-1 493.
[18] SU D L, LI P J, QUEK S Y, et al.Efficient extraction and characterization of pectin from orange peel by a combined surfactant and microwave assisted process[J].Food Chemistry, 2019, 286:1-7.
[19] YANG J S, MU T H, MA M M.Optimization of ultrasound-microwave assisted acid extraction of pectin from potato pulp by response surface methodology and its characterization[J].Food Chemistry, 2019, 289:351-359.
[20] WANDEE Y, UTTAPAP D, MISCHNICK P.Yield and structural composition of pomelo peel pectins extracted under acidic and alkaline conditions[J].Food Hydrocolloids, 2019, 87:237-244.
[21] BAUM A, DOMINIAK M, VIDAL-MELGOSA S, et al.Prediction of pectin yield and quality by FTIR and carbohydrate microarray analysis[J].Food and Bioprocess Technology, 2017, 10(1):143-154.
[22] WANG W J, MA X B, JIANG P, et al.Characterization of pectin from grapefruit peel:A comparison of ultrasound-assisted and conventional heating extractions[J].Food Hydrocolloids,2016,61:730-739.
[23] POLANCO-LUGO E, MART NEZ-CASTILLO J I, CUEVAS-BERNARDINO J C, et al.Citrus pectin obtained by ultrasound-assisted extraction:Physicochemical, structural, rheological and functional properties[J].CyTA-Journal of Food, 2019, 17(1):463-471.
NEZ-CASTILLO J I, CUEVAS-BERNARDINO J C, et al.Citrus pectin obtained by ultrasound-assisted extraction:Physicochemical, structural, rheological and functional properties[J].CyTA-Journal of Food, 2019, 17(1):463-471.
[24] HEINRITZ S, WEISS E, EKLUND M, et al.Impact of a high-fat or high-fiber diet on intestinal microbiota and metabolic markers in a pig model[J].Nutrients, 2016, 8(5):317.
[25] CLOETENS L, BROEKAERT W F, DELAEDT Y, et al.Tolerance of arabinoxylan-oligosaccharides and their prebiotic activity in healthy subjects:A randomised, placebo-controlled cross-over study[J].British Journal of Nutrition, 2010, 103(5):703-713.
[26] GULL N B, GULL
N B, GULL N P, TAVARIA F, et al.Structural features and assessment of prebiotic activity of refined arabinoxylooligosaccharides from wheat bran[J].Journal of Functional Foods, 2014, 6:438-449.
N P, TAVARIA F, et al.Structural features and assessment of prebiotic activity of refined arabinoxylooligosaccharides from wheat bran[J].Journal of Functional Foods, 2014, 6:438-449.
[27] PENG L, LI Z R, GREEN R S, et al.Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers[J].The Journal of Nutrition, 2009, 139(9):1 619-1 625.
[28] ELAMIN E E, MASCLEE A A, DEKKER J, et al.Short-chain fatty acids activate AMP-activated protein kinase and ameliorate ethanol-induced intestinal barrier dysfunction in Caco-2 cell monolayers[J].The Journal of Nutrition, 2013, 143(12):1 872-1 881.
[29] FENG Y, WANG L, KHAN A, et al.Fermented wheat bran by xylanase-producing Bacillus cereus boosts the intestinal microflora of broiler chickens[J].Poultry Science, 2020, 99(1):263-271.
[30] ZHANG Z S, WANG X M, HAN S W, et al.Effect of two seaweed polysaccharides on intestinal microbiota in mice evaluated by illumina PE250 sequencing[J].International Journal of Biological Macromolecules, 2018, 112:796-802.
[31] CHEN L G, XU W, CHEN D, et al.Digestibility of sulfated polysaccharide from the brown seaweed Ascophyllum nodosum and its effect on the human gut microbiota in vitro[J].International Journal of Biological Macromolecules, 2018, 112:1 055-1 061.
[32] WU F F, GUO X F, ZHANG J C, et al.Phascolarctobacterium faecium abundant colonization in human gastrointestinal tract[J].Experimental and Therapeutic Medicine, 2017, 14(4):3 122-3 126.
[33] OGATA Y, SUDA W, IKEYAMA N, et al.Complete genome sequence of Phascolarctobacterium faecium JCM 30894, a succinate-utilizing bacterium isolated from human feces[J].Microbiology Resource Announcements, 2019, 8(3):e01487-18.
[34] HOU Z Q, HU X X, LUAN L Q, et al.Prebiotic potential of RG-I pectic polysaccharides from Citrus subcompressa by novel extraction methods[J].Food Hydrocolloids, 2022, 124:107213.
[35] LARSBRINK J, ROGERS T E, HEMSWORTH G R, et al.A discrete genetic locus confers xyloglucan metabolism in select human gut Bacteroidetes[J].Nature, 2014, 506(7 489):498-502.
[36] MAO G Z, LI S, ORFILA C, et al.Depolymerized RG-I-enriched pectin from citrus segment membranes modulates gut microbiota, increases SCFA production, and promotes the growth of Bifidobacterium spp., Lactobacillus spp.and Faecalibaculum spp.[J].Food & Function, 2019, 10(12):7 828-7 843
[37] VANDEPUTTE D, KATHAGEN G, D’HOE K, et al.Quantitative microbiome profiling links gut community variation to microbial load[J].Nature, 2017, 551(7 681):507-511.