丙烯酰胺(acrylamide,ACR)是常见的工业化合物,是合成聚丙烯酰胺的原材料[1-2]。ACR有多种方式进入人体并造成毒害[3]。ACR有急性毒性和神经毒性等多种毒性,目前的研究显示,长期接触低浓度的ACR会对身体造成伤害[2,4],其的神经毒性已通过先前的细胞动物实验及流行病学研究被证明[3,5]。日常生活中ACR的产生通常发生在烹调食物过程中,高温下对淀粉含量高的食材进行加工时发生美拉德反应从而形成的一种食品有害物质[6]。由于生活方式的改变,我国人民食用烘焙食品和油炸食品的频率越来越高,导致膳食ACR暴露量不断增加,对人体的健康造成了一定的伤害[7]。
研究表明ACR毒性与氧化应激有关[4,8]。自由基过度生成引发机体内氧化与抗氧化系统失调导致氧化应激,严重的氧化应激会造成细胞功能丧失或凋亡[9]。氧化应激是机体活性氧(reactive oxygen species,ROS)的生成与抗氧化自由基不平衡导致[10]。ROS升高可引起脂质过氧化,生成丙二醛(malondialdehyde,MDA),从而加剧机体氧化[11],同时激活超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)等非酶类的抗氧化保护体系[12]。研究表明核因子E2相关因子2 (nuclear factor E2-related factor 2,Nrf2)通路参与 ACR引起的氧化损伤及细胞凋亡。PC12细胞加入ACR发现核Nrf2含量增多以及胞质Nrf2含量降低,降低程度与ACR浓度有关。同时发现Nrf2控制的血红素氧合酶1(heme oxygenase-1,HO-1)等抗氧化酶的数量增多[13-14]。许多体内外研究发现,c-Jun N-末端激酶(c-Jun N-terminal kinase,JNK)和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38)通路能够调控细胞凋亡。ACR能够提高p38、JNK的表达,诱导细胞凋亡[15-16]。综上所述,ACR的作用机制和氧化应激以及细胞凋亡密切相关。
黑果枸杞多酚(Lycium ruthenicum Murr.polyphenols,LRP)是黑果枸杞中的主要活性成分[17]。研究显示,LRP抗氧化效果好,具有良好的清除DPPH自由基的作用, 通过消除ROS、减少MDA和GSH含量来控制羧甲基赖氨酸诱导神经-2细胞的氧化应激[18]。补充黑果枸杞花色苷能抑制ROS的产生和肝脏炎症[19]。作为多酚的一种,LRP也具有改善线粒体功能的作用[20]。SH-SY5Y 细胞来源于人体神经母细胞瘤谱系。该细胞常用于神经退行性疾病发病机制探究和神经毒物的实验[21-22]。本文研究LRP对ACR诱导的氧化应激损伤的保护作用机制。使用LRP干预ACR诱导的SH-SY5Y细胞,探究LRP对SH-SY5Y细胞的保护作用,以阐明LRP对ACR诱导的神经毒性的保护作用机理。研究结果为降低膳食ACR诱发的神经性损伤奠定了理论基础,也有利于高附加值的黑果枸杞产品的研究和应用。
1 材料与方法
1.1 材料与试剂
SH-SY5Y细胞,上海中科院细胞库;黑枸杞多酚提取物粉末[0.1%(质量分数)LRP],西安青芷生物技术有限公司;丙烯酰胺(纯度>99 %),上海西格玛奥德里奇公司;JNK、p-JNK、p38、p-p38,Cell Signaling Technology公司;ROS、SOD、GSH试剂盒,南京建成生物工程研究所;MDA测定试剂盒、全蛋白提取试剂盒、BCA试剂盒,江苏凯基生物技术公司;SDS-PAGE凝胶配制试剂盒,上海雅酶生物医药科技有限公司;Nrf2 抗体,Proteintech中国公司;HO-1、谷氨酸半胱氨酸连接酶催化亚基(glutamate-cysteine ligase catalytic subunit,GCLC)、谷胺酸半胱氨酸连接酶(glutamate-cysteine ligase,GCLM)、β-actin,美国Abcam公司。
1.2 仪器与设备
LEICA DM750荧光学显微镜,德国莱卡公司;DHG-92400电热恒温鼓风干燥箱,上海琅玕公司;Multiskan GO全波长酶标仪、Sorvall ST 16R低温离心机,美国Thermo公司;HF90二氧化碳培养箱,Heal Force。
1.3 实验方法
1.3.1 SH-SY5Y细胞培养
培养基中加入15% FBS胎牛血清、1%青链霉素溶液和DMEM/F12,置于培养箱培养,48 h换1次溶液,细胞密度80%左右传代。
1.3.2 细胞活力测定
(1)6 000 μg/mL LRP溶液配制:将60 mg LRP粉末与DMEM/F12培养基于无菌管内稀释混匀,后用无菌0.22 μm过滤器过滤。100、250、500、1 000、1 500、2 000 μg/mL LRP溶液配制由0.2、0.5、1、2、3、4 mL的6 000 μg/mL LRP溶液加入完全培养基稀释至12 mL。
2.5 mmol/L ACR溶液配制:0.710 3 g ACR粉末与4 mL DMEM/F12培养基离心管稀释混匀,用无菌0.22 μm过滤器过滤后4 ℃保存。
(2)CCK-8法测细胞活力,以1.5×105/mL的细胞密度接种在96 孔板中。分为对照组,ACR组,100、250、500、1 000、1 500、2 000 μg/mL LRP预处理组,加ACR干预的LRP组。不同剂量LRP组加入(1)中相应浓度的LRP溶液。LRP组预处理24 h后ACR组和LRP组加2.5 mmol/L ACR干预12 h。干预结束后,96孔板各孔加10 μL CCK-8,放入培养箱培养3 h,在450 nm检测各孔的吸光度值(OD值),并设立空白和对照孔。计算如公式(1)所示:
细胞活力![]()
(1)
1.3.3 细胞转染
(1)对数生长期的细胞在6孔板上培养,至细胞密度为40%~60%。
(2)250 μL Opti-MEM稀释5 μL 50 nmol/L siRNA储存液以及5 μL 50 nmol/L LipofectamineTM 3000。
(3)转染复合物配制:混合(2)中稀释好的试剂后放置10 min。
(4)6孔板加入500 μL转染复合物和1 500 μL完全培养液,培养48 h。
1.3.4 ROS及GSH、MDA、SOD含量检测
(1)ROS含量测定:在SH-SY5Y单细胞悬液中加入浓度为10 μmol/L的活性氧荧光探针,37 ℃孵育30 min。使用PBS洗涤探针标记过的细胞悬液后,1 000×g离心细胞5~10 min,收集沉淀物,收集好细胞用PBS重悬。在最佳激发波长485 nm、最佳发射波长525 nm下检测细胞内ROS水平。测定结果以荧光强度/mg蛋白表示。
(2)GSH、MDA、SOD测定:采用相应试剂盒检测。预先按说明书调配试剂备用,现用现配。细胞按对应培养说明培养,PBS洗涤细胞,离心后收集沉淀物。使用裂解液裂解细胞,制备细胞匀浆。实验中各操作严格按照说明书操作实验。
1.3.5 Western blot检测
1.3.5.1 提取蛋白
(1)500~800×g离心细胞10 min。后用10 mL/150 mm培养板的冷PBS,离心5 min冲洗2次;
(2)将1 mL冷Lysis Buffer、10 μL磷酸酶抑制剂、1 μL蛋白酶抑制剂和5 μL 100 mmol/L吩嗪硫酸甲酯混匀,冰中保存;
(3)将洗涤后的细胞注入冷藏后的离心管,再加1 mL(2)中的混合液。置于4 ℃摇床上,剧烈振荡30 s,放置冰上4 min,重复5次;
(4)12 000×g,4 ℃离心5 min,上清液即为全蛋白提取物。样品保存于冰箱。
1.3.5.2 蛋白浓度测定
BCA蛋白测定试剂盒检测蛋白浓度。
(1)酶标板中加入定量蛋白标准溶液、去离子水和蛋白。把BCA试剂B和50倍的试剂A混合。板中每孔添加200 μL配好的试剂。酶标板在振荡器上振荡30 s,稳定后37 ℃放置30 min后在562 nm测定比色。以蛋白含量为横轴,吸光值为纵轴作曲线图。将蛋白检测样品稀释到20 μL,与10倍体积的BCA工作液混合均匀。混合液在37 ℃保温30 min。用标准曲线0号管为参照,562 nm测定比色。根据样品的吸光值在标准曲线上查出相应蛋白含量,实际蛋白浓度计算如公式(2)所示:
实际蛋白质量浓度/(μg·μL-1)=
![]() 样品稀释倍数
样品稀释倍数
(2)
(2)将每种试样的浓度配平,加入试样的缓冲液,混合均匀,100 ℃,5 min,煮沸,然后分装。
1.3.5.3 SDS-PAGE
按说明书配制分离胶和浓缩胶。混匀蛋白样品上样。每孔加入10 μL样品后进行SDS-PAGE。结束后,将分离的蛋白条带移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF膜)。之后使用5%的脱脂牛奶封闭2 h。PBST洗3次后4 ℃下孵育一抗过夜,后洗涤3次,室温下孵育二抗1 h,洗涤后显影曝光。Image J软件定量分析结果。
1.4 数据分析
利用SPSS 23.0统计软件进行统计处理。结果用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,多样本间多重比较使用t检验,P<0.05表示有显著性差异。
2 结果与分析
2.1 LRP对ACR诱导的细胞存活率的影响
课题组前期研究确定选取2.5 mmol/L的ACR进行干预[23]。使用对应浓度的LRP预处理的细胞使用ACR染毒后显示细胞生存率与LRP浓度呈显著相关性。LRP干预剂量≤1 500 μg/mL时,SH-SY5Y细胞的活性与LRP浓度成正比,随着LRP的质量浓度到达2 000 μg/mL时,活性下降。因此实验中选择500、1 000、1 500 μg/mL 3种浓度的LRP作为低、中、高剂量进行干预。
之前课题组的研究显示2.5 mmol/L的ACR诱导细胞12 h后,能明显抑制细胞的活性,并使细胞的活力降低50%左右[23]。图1为影响LRP对ACR诱导SH-SY5Y细胞活性的影响。研究发现与ACR组相比,250、1 000、1 500、2 000 μg/mL LRP预处理组细胞活力明显增高(P<0.05),其中1 500 μg/mL LRP处理效果最明显,显示LRP能够抑制ACR诱导引发的细胞毒性。

图1 LRP对ACR诱导 SH-SY5Y 细胞存活率的影响
Fig.1 Effect of LRP on the viability of SH-SY5Y cells induced by ACR 注:#表示与对照组相比,P<0.05;##表示与对照组相比,P<0.01; *表示与ACR组相比,P<0.05;**表示与ACR组相比, P<0.01(下同)
2.2 LRP对ACR诱导SH-SY5Y细胞ROS和氧化应激指标的影响
本文探讨了LRP的干预作用下,ACR诱导的细胞氧化水平的改变。细胞ROS水平变化见图2、图3。ACR诱导的细胞ROS含量较对照组显著增加(P<0.05)。图2、图3显示不同浓度的LRP预处理的细胞随着LRP浓度增高,荧光强度和ROS水平下降。同时ACR组和高剂量LRP组的ROS水平有显著差异(P<0.05)。显示LRP对 ACR诱导的SH-SY5Y细胞的ROS水平有抑制作用。
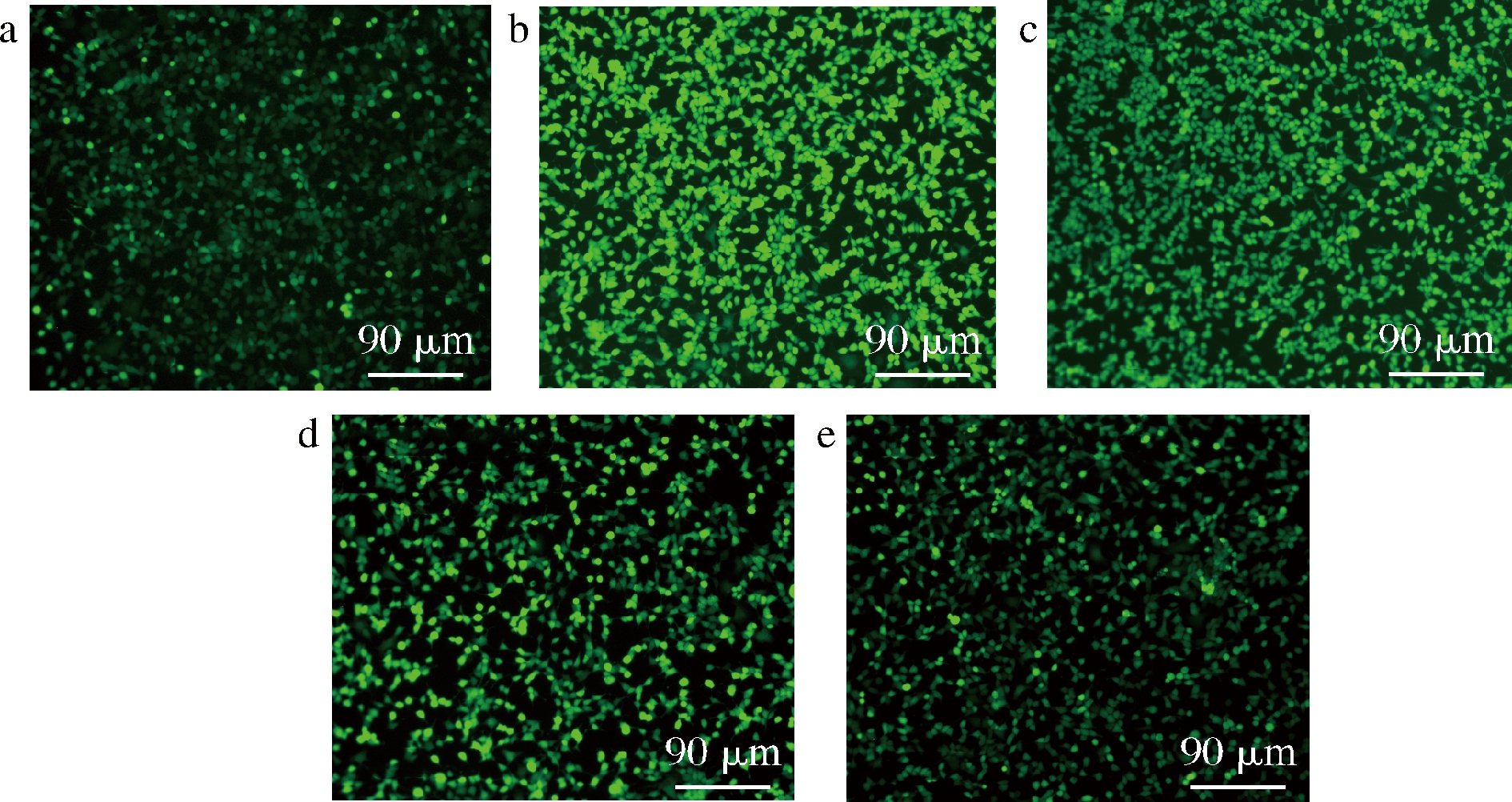
a-对照组;b-ACR组;c-500 μg/mL LRP+ACR组; d-1 000 μg/mL LRP+ACR组;e-1 500 μg/mL LRP+ACR组
图2 LRP对ACR诱导SH-SY5Y细胞ROS荧光强度的影响
Fig.2 Effect of LRP on the ROS fluorescence intensity of SH-SY5Y cells induced by ACR
如图4所示,与对照组相比,ACR组的SOD、GSH和MDA含量均有显著差异,且存在统计学意义(P<0.05)。
不同浓度的LRP处理组的GSH和SOD活性随LRP浓度的增加而升高,且与ACR组相比有统计学差异(P<0.05)。LRP预处理后, MDA含量明显减少。且ACR组与1 000、1 500 μg/mL的LRP组相比有显著差异(P<0.05)。

图3 LRP对ACR诱导SH-SY5Y细胞ROS的影响
Fig.3 Effect of LRP on ROS of SH-SY5Y cells induced by ACR

a-MDA;b-GSH;c-SOD
图4 LRP对ACR诱导SH-SY5Y细胞SOD、GSH和MDA的影响
Fig.4 Effect of LRP on SOD、GSH and MDA of SH-SY5Y cells induced by ACR
本实验用ACR诱导细胞后ROS水平和脂质过氧化产物MDA水平升高,抗氧化物GSH、SOD水平下降,与其他实验的结论相似[15,24]。不同浓度的LRP预处理细胞后,细胞内ROS和MDA水平下降,GSH、SOD 含量上升,显示了LRP能减轻ACR诱导引起的氧化损伤。
2.3 LRP对细胞Nrf2及其下游通路蛋白的影响
细胞通过Nrf2信号通路表达可以抑制氧化应激引起的细胞凋亡、炎症和早衰。研究发现多酚类化合物能使细胞质中的Nrf2向细胞核移动然后激活抗氧化酶[25]。
LRP组Nrf2的表达随LRP浓度升高而增加(图5)。1 000、1 500 μg/mL LRP组较对照组有显著差异(P<0.05)。说明LRP能够激活SH-SY5Y细胞Nrf2的表达。
图6表示LRP组GCLC、GCLM和HO-1蛋白的表达随LRP浓度升高而增加,与对照组有显著差异(P<0.05)。显示LRP能够提高Nrf2调节的下游抗氧化蛋白的表达。

a- Nrf2免疫印迹定性分析;b- Nrf2蛋白定量分析
图5 LRP对SH-SY5Y细胞Nrf2蛋白的影响
Fig.5 Effect of LRP on Nrf2 protein of SH-SY5Y cells

a-GCLC、GCLM和HO-1免疫印迹定性分析;b-GCLC蛋白定量分析;c-GCLM蛋白定量分析;d-HO-1蛋白定量分析
图6 LRP对SH-SY5Y细胞Nrf2下游通路蛋白的影响
Fig.6 Effects of LRP on Nrf2 downstream pathway proteins in SH-SY5Y cells
2.4 siRNA干扰Nrf2后对SH-SYSY细胞中Nrf2及下游通路蛋白表达的影响
对照组细胞转染siRNA 48 h后为si-CON组;si-ACR组转染细胞后加ACR干预12 h;si-LRP组转染后1 500 μg/mL LRP预处理24 h后加ACR干预12 h。如图7所示,ACR组Nrf2、GCLC、GCLM和HO-1蛋白表达较对照组减少,其中GCLC、HO-1蛋白表达显著降低(P<0.05);LRP组Nrf2及下游蛋白表达较ACR组增加(P<0.05),说明LRP能激活Nrf2通路减弱ACR引起的氧化应激。siRNA干扰Nrf2后各组细胞Nrf2及其下游通路蛋白表达均降低,其中si-LRP组与LRP组差异显著减弱了LRP的保护效应(P<0.05),进一步证明LRP通过激活Nrf2信号通路发挥抗氧化作用。
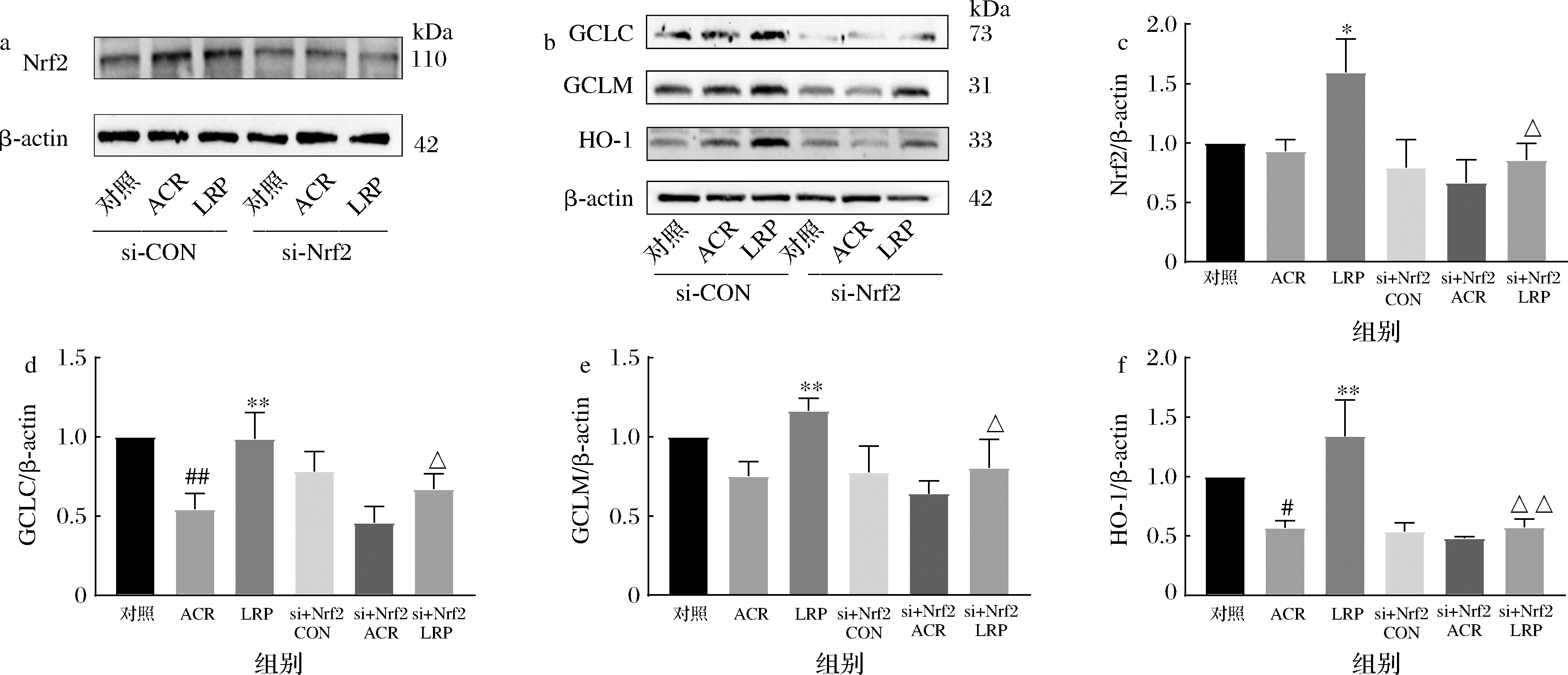
a-干扰后Nrf2免疫印迹定性分析;b-siRNA干扰后GCLC、GCLM和HO-1免疫印迹定性分析;c-siRNA干扰后Nrf2蛋白定量分析; d-siRNA干扰后GCLC蛋白定量分析;e-siRNA干扰后GCLM蛋白定量分析;f-siRNA干扰后HO-1蛋白定量分析
图7 Nrf2被siRNA干扰后对SH-SYSY细胞中Nrf2及下游蛋白表达水平的影响
Fig.7 Effect of siRNA interference on Nrf2 and downstream protein expression in SH-SYSY cells 注:△表示与LRP组相比,P<0.05;△△表示与LRP组相比,P<0.01(下同)
2.5 siRNA干扰Nrf2后对SH-SY5Y细胞JNK/p38凋亡通路蛋白的影响
CON组细胞转染siRNA 48 h后为si-CON组;si-ACR组转染细胞后加ACR干预12 h;si-LRP组转染后1 500 μg/mL LRP预处理24 h后加ACR干预12 h。Nrf2通路和其他通路的协同作用控制细胞凋亡。在Nrf2转录激活过程中,促丝裂原活化蛋白激酶是Nrf2转录激活的重要信号转导蛋白,也是Nrf2转录的上游调控因子[26-27]。图8显示,与对照组相比,ACR组JNK和p38磷酸化明显加强,半胱氨酸蛋白酶-3 (cysteinyl aspartate-specific proteinase-3,Caspase-3)蛋白表达增强(P<0.05)。与ACR组相比,LRP组JNK、p38和Caspase-3蛋白表达降低(P<0.05),抑制了ACR诱导的细胞凋亡。siRNA干扰Nrf2后各组细胞JNK、p38和Caspase-3蛋白表达均有增加,其中si-LRP组与LRP组有显著差异(P<0.05)。进一步验证了LRP可激活Nrf2关键因子,抑制细胞凋亡来缓解ACR诱导引发的细胞毒性。
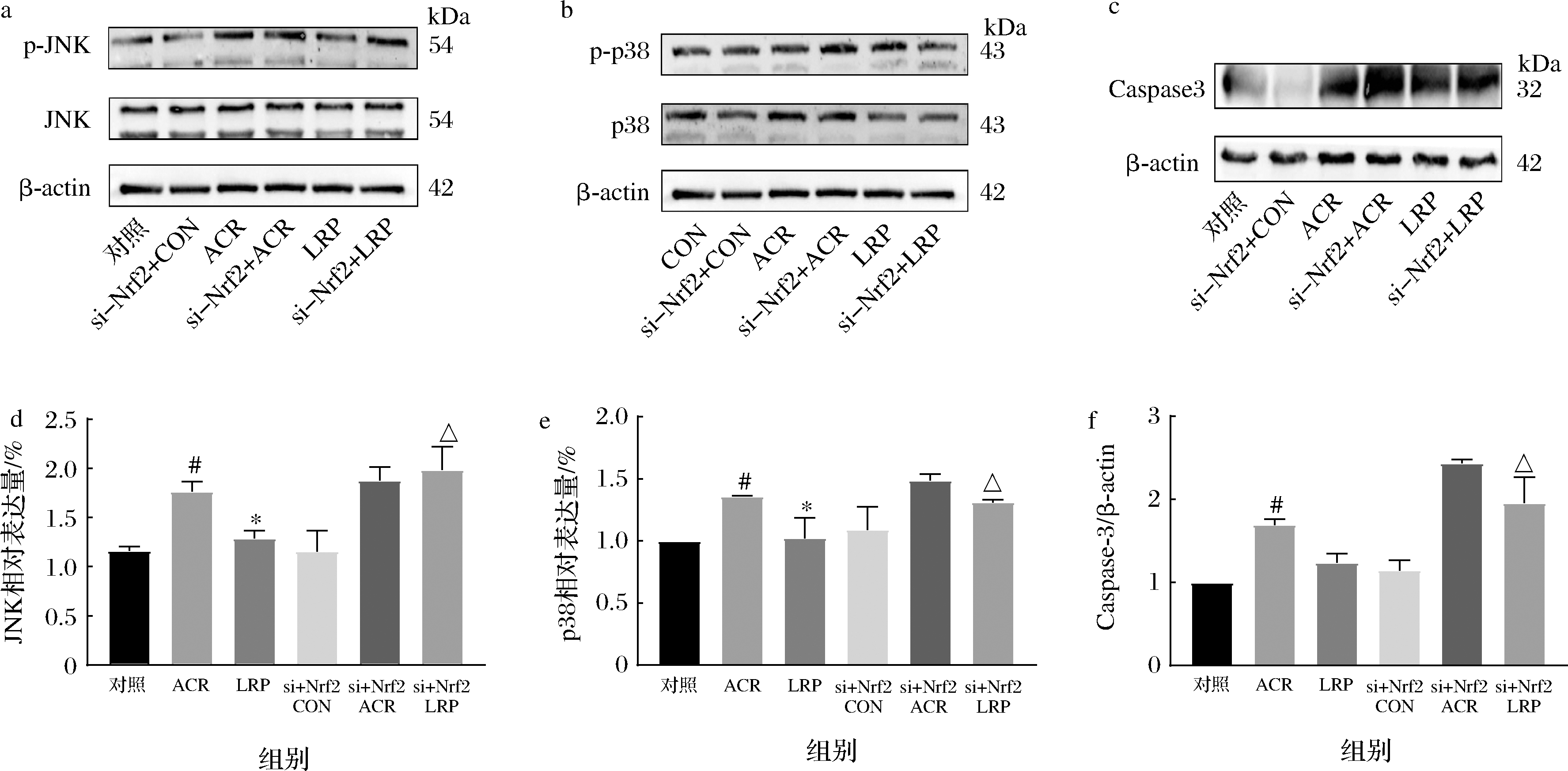
a-JNK免疫印迹定性分析;b-p38免疫印迹定性分析;c-Caspase-3免疫印迹定性分析;d-JNK蛋白定量分析;e-p38蛋白定量分析; f-Caspase-3蛋白定量分析
图8 Nrf2被siRNA干扰后对SH-SYSY细胞中JNK/p38/Caspase-3凋亡通路蛋白表达水平的影响
Fig.8 Effect of siRNA interference with Nrf2 on the expression of JNK/p38/caspase-3 apoptosis pathway protein in SH-SYSY cells
3 讨论
本研究采用ACR诱导SH-SY5Y细胞建立体外氧化应激损伤模型,探讨LRP在ACR诱导的细胞氧化应激过程中的保护机制。LRP最主要的作用物质是花青素,是花色苷的苷元。黑果枸杞鲜果花色苷含量为2 000~3 000 mg/kg [17]。花青素作为蔬果中广泛存在的一类黄酮类化合物,它具有明显自由基清除作用和抗炎功效[28]。花青素能够抑制大脑中ROS的产生以及消除小胶质细胞和星形胶质细胞介导的神经炎症,从而防止神经退行性病变和认知障碍[29]。研究显示,烘焙食品中添加黑枸杞花青素有利于抑制ACR的生成[30]。
LRP预处理后ACR诱导的细胞活力明显上升。ACR诱导细胞后ROS和脂质过氧化产物MDA水平升高,抗氧化物GSH、SOD水平下降。不同浓度的LRP预处理细胞后,细胞内ROS和MDA水平下降,GSH、SOD水平上升,显示了LRP能减轻ACR诱导的氧化损伤。本研究显示LRP能促进细胞Nrf2信号通路蛋白表达和其通路下游抗氧化蛋白GCLC、GCLM以及HO-1的表达。这表明Nrf2可能是LRP发挥抗氧化性的主要靶点。本实验进一步证明LRP激活Nrf2相关信号通路减轻氧化应激,同时抑制JNK、p38和Caspase-3等凋亡通路蛋白介导细胞凋亡。从而证明LRP能够减弱ACR对SH-SY5Y细胞的毒性。
现阶段ACR相关的研究主要针对如何处理食品来降低摄入ACR引起的代谢损害,而对生活中无法避免接触ACR时怎样降低损害的研究不多。研究者们开始关注蔬果中的天然植物化学物对ACR诱导的氧化损伤的保护作用,天然的植物化学物例如LRP逐渐成为研究热点。本研究为减少摄入ACR诱导的神经毒性提供了新的理论依据,也促进了黑果枸杞高附加值产品的开发。研究后续关于LRP减轻ACR氧化损伤的具体作用成分和机制仍需进一步研究。
[1] SEMLA M, GOC Z, MARTINIAKOV M, et al.Acrylamide:A common food toxin related to physiological functions and health[J].Physiological Research, 2017, 66(2):205-217.
M, et al.Acrylamide:A common food toxin related to physiological functions and health[J].Physiological Research, 2017, 66(2):205-217.
[2] MATOSO V, BARGI-SOUZA P, IVANSKI F, et al.Acrylamide:A review about its toxic effects in the light of Developmental Origin of Health and Disease (DOHaD) concept[J].Food Chemistry, 2019, 283:422-430.
[3] DEARFIELD K L, ABERNATHY C O, OTTLEY M S, et al.Acrylamide:Its metabolism, developmental and reproductive effects, genotoxicity, and carcinogenicity[J].Mutation Research/Reviews in Genetic Toxicology, 1988, 195(1):45-77.
[4] RIFAI L, SALEH F A.A review on acrylamide in food:Occurrence, toxicity, and mitigation strategies[J].International Journal of Toxicology, 2020, 39(2):93-102.
[5] ELSAWY H, ALZAHRANI A M, ALFWUAIRES M, et al.Analysis of silymarin-modulating effects against acrylamide-induced cerebellar damage in male rats:Biochemical and pathological markers[J].Journal of Chemical Neuroanatomy, 2021, 115:101964.
[6] LINEBACK D R, COUGHLIN J R, STADLER R H.Acrylamide in foods:A review of the science and future considerations[J].Annual Review of Food Science and Technology, 2012, 3:15-35.
[7] KUNNEL S G, SUBRAMANYA S, SATAPATHY P, et al.Acrylamide induced toxicity and the propensity of phytochemicals in amelioration:A review[J].Central Nervous System Agents in Medicinal Chemistry, 2019, 19(2):100-113.
[8] KOSZUCKA A, NOWAK A, NOWAK I, et al.Acrylamide in human diet, its metabolism, toxicity, inactivation and the associated European Union legal regulations in food industry[J].Critical Reviews in Food Science and Nutrition, 2020, 60(10):1 677-1 692.
[9] BELHADJ BENZIANE A, DILMI BOURAS A, MEZAINI A, et al.Effect of oral exposure to acrylamide on biochemical and hematologic parameters in Wistar rats[J].Drug and Chemical Toxicology, 2019, 42(2):157-166.
[10] PAN X Q, YAN D D, WANG D, et al.Mitochondrion-mediated apoptosis induced by acrylamide is regulated by a balance between Nrf2 antioxidant and MAPK signaling pathways in PC12 cells[J].Molecular Neurobiology, 2017, 54(6):4 781-4 794.
[11] AMARAL A F S, CANTOR K P, SILVERMAN D T, et al.Selenium and risk of bladder cancer:A meta-analysis of epidemiological studies[J].Toxicology Letters, 2009, 189:S117.
[12] SANTA T.Recent advances in analysis of glutathione in biological samples by high-performance liquid chromatography:A brief overview[J].Drug Discoveries &Therapeutics, 2013, 7(5):172-177.
[13] MOLAGODA I M N, LEE K T, CHOI Y H, et al.Anthocyanins from Hibiscus syriacus L.inhibit oxidative stress-mediated apoptosis by activating the Nrf2/HO-1 signaling pathway[J].Antioxidants, 2020, 9(1):42.
[14] ADAMS E F, CAI Z, MADOKA T, et al.Genetic ablation of Nrf2 exacerbates neurotoxic effects of acrylamide in mice[J].Toxicology, 2021, 456:152785.
[15] KAÇAR S, SAHINTURK V.The protective agents used against acrylamide toxicity:An in vitro cell culture study-based review[J].Cell Journal (Yakhteh), 2021, 23(4):367-381.
[16] PAN X Q, WU X, YAN D D, et al.Acrylamide-induced oxidative stress and inflammatory response are alleviated by N-acetylcysteine in PC12 cells:Involvement of the crosstalk between Nrf2 and NF-kappa B pathways regulated by MAPKs[J].Toxicology Letters, 2018, 288:55-64.
[17] WANG H Q, LI J N, TAO W W, et al.Lycium ruthenicum studies:Molecular biology, phytochemistry and pharmacology[J].Food Chemistry, 2018, 240:759-766.
[18] CHEN S S, HU N, WANG H L, et al.Bioactivity-guided isolation of the major anthocyanin from Lycium ruthenicum Murr.fruit and its antioxidant activity and neuroprotective effects in vitro and in vivo[J].Food and Function, 2022, 13(6):3 247-3 257.
[19] LU K K, WANG J, YU Y Y, et al.Lycium ruthenicum Murr.alleviates nonalcoholic fatty liver in mice[J].Food Science and Nutrition, 2020, 8(6):2 588-2 597.
[20] GAO H A, YUAN X A, WANG Z S, et al.Profiles and neuroprotective effects of Lycium ruthenicum polyphenols against oxidative stress-induced cytotoxicity in PC12 cells[J].Journal of Food Biochemistry, 2020, 44(1):e13112.
[21] XICOY H, WIERINGA B, MARTENS G J M.The SH-SY5Y cell line in Parkinson’s disease research:A systematic review[J].Molecular Neurodegeneration, 2017, 12(1):10.
[22] XIE H R, HU L S, LI G Y.SH-SY5Y human neuroblastoma cell line:In vitro cell model of dopaminergic neurons in Parkinson’s disease[J].Chinese Medical Journal, 2010, 123(8):1 086-1 092.
[23] 袁霄. 膳食丙烯酰胺暴露对神经系统的影响及黑果枸杞多酚的保护作用 [D].银川:宁夏医科大学, 2020.
YUAN X.Effects of dietary acrylamide exposure on the nervous system and protective effect of Lycium ruthenicum polyphenols [D].Yinchuan:Ningxia Medical University, 2020
[24] YAN D D, WANG N, YAO J L, et al.Curcumin attenuates the PERK-eIF2α signaling to relieve acrylamide-induced neurotoxicity in SH-SY5Y neuroblastoma cells[J].Neurochemical Research, 2022, 47: 1 037-1 048.
[25] GHASEMZADEH RAHBARDAR M, HEMADEH B, RAZAVI B M, et al.Effect of carnosic acid on acrylamide induced neurotoxicity:In vivo and in vitro experiments[J].Drug and Chemical Toxicology, 2022, 45(4):1 528-1 535.
[26] LAI M C, LIU W Y, LIOU S S, et al.The protective effects of moscatilin against methylglyoxal-induced neurotoxicity via the regulation of p38/JNK MAPK pathways in PC12 neuron-like cells[J].Food and Chemical Toxicology, 2020, 140:111369.
[27] KWON O Y, LEE S H.Ameliorating activity of Ishige okamurae on the amyloid beta-induced cognitive deficits and neurotoxicity through regulating ERK, p38 MAPK, and JNK signaling in Alzheimer′s disease-like mice model[J].Molecular Nutrition &Food Research, 2020, 64(12):1901220.
[28] LI D T, WANG P P, LUO Y H, et al.Health benefits of anthocyanins and molecular mechanisms:update from recent decade[J].Critical Reviews in Food Science and Nutrition, 2017, 57(8):1 729-1 741.
[29] FANG Z Z, LUO Y H, MA C, et al.Blueberry anthocyanins extract attenuates acrylamide-induced oxidative stress and neuroinflammation in rats[J].Oxidative Medicine and Cellular Longevity, 2022, 2022: 7340881.
[30] 刘健南, 王小博.黑枸杞花青素抑制曲奇饼干中丙烯酰胺效果的研究[J].食品研究与开发, 2020, 41(9):146-150.
LIU J N, WANG X B.Inhibitory effect of anthocyanin from Lycium ruthenicum Murray on acrylamide in cookies[J].Food Research and Development, 2020, 41(9):146-150.