可降解、可持续且可再生的包装材料的研发和应用一直以来备受关注,包装膜在保证食品质量和食品安全方面起着关键作用[1]。可生物降解的活性食品包装是创新概念之一,旨在满足消费者对更健康食品和更好环境保护的需求[2]。
精油被认为是“公认的安全”的活性包装材料的抗菌剂[3],但基于其水不溶性和挥发性的特点,开发了基于乳液的封装形式,从而提高其在包装膜中的稳定性和抗菌活性[4]。果胶因其低成本、无毒、可降解及优异的成膜性能而被认为是制备食品包装的理想聚合物[2]。此外,在纳米封装方面,果胶能够提高纳米乳液对环境、工艺应力、高温和不同pH值的稳定性[5],是制备精油活性包装的理想基质。多糖和纳米乳液制备的薄膜可以延长不同食品的保质期,但在考虑商业规模之前,薄膜的性能需要进一步提升[6]。CANDIDO等[7]利用精油乳液改善果胶基薄膜,乳液的加入使薄膜接触角减小,亲水性增强。ALMASI等[8]发现乳液形式的精油对果胶薄膜机械性能和耐水性的提升有限。在本研究之前,探索了百里香精油纳米乳液(thyme essential oil nanoemulsion,TEON)和果胶共混制膜,结果表明TEON的加入赋予了薄膜抗菌性,但在机械性能、耐水性和热稳定性等方面改善有限。因此基于单一聚合物基质的精油活性膜的性能难以满足要求,主要是果胶存在较高的刚性及亲水性的缺点,需要进一步进行改进。
凝胶多糖(curdlan,CUR)是一种微生物胞外三螺旋多糖,具有较强的热稳定性且安全无毒,近年来被广泛用作食品添加剂[9]。由于可生物降解性、可食用和独特的胶凝特性等,凝胶多糖在食品包装材料领域受到关注。虽然凝胶多糖成膜性能较差,但由于水不溶性及其膜材料的柔韧性,在食品包装领域通常用于改善其他多糖薄膜的亲水性和力学性能[10],CUR与鱼明胶[11]、CUR与魔芋葡甘露聚糖[12]、CUR与壳聚糖[9]和CUR与黄原胶[13]等薄膜已被成功制备,并有效改善了热稳定和耐水性等。CUR作为改善其他多糖薄膜缺陷的材料,具有巨大的研究潜力。
因此,本研究将不同质量的CUR加入果胶/TEON复合膜,通过一系列薄膜性能测定方法,包括力学性能、表面疏水性、热稳定性、X射线衍射、傅里叶变换红外光谱和扫描电镜等,评价薄膜结构和薄膜组分之间的分子相互作用,以及针对革兰氏阴性菌和革兰氏阳性菌进行的抗菌活性研究。
1 材料与方法
1.1 材料与试剂
氯化钠,天津北辰方正试剂厂;氯化钾,天津博迪化工股份有限公司;无水磷酸氢二钠,天津大茂化学试剂厂;磷酸二氢钾,国药集团化学试剂有限公司;琼脂粉、蛋白胨,北京奥博星生物技术有限责任公司;酵母提取物,OXOID公司;百里香精油、Tween 80,上海源叶生物科技有限公司;甘油,生工生物工程(上海)股份有限公司;CUR,上海麦克林生化科技有限公司;果胶,索莱宝生物科技有限公司;麦氏比浊管(0.5 McFrland),比克曼生物科技有限公司。
微生物菌株:大肠杆菌CMCC 44102、铜绿假单胞菌CMCC 10104、枯草芽孢杆菌CMCC 63501、金黄色葡萄球菌CMCC 26003,上海保藏技术中心。
1.2 仪器与设备
Scientz-IID超声波细胞粉碎机,宁波新芝生物科技有限公司;SPX-150B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂;全不锈钢鼓风干燥箱,上海尚普仪器设备有限公司;霉菌培养箱,上海博迅实业有限公司医疗设备厂;HJ-1磁力搅拌器,常州越新仪器制造有限公司;电子万能材料试验机,美国英斯特朗公司;吕克士接触角测量仪,德国KRUSS设备公司;透湿性测试仪,美国MOCON公司;傅里叶红外光谱仪,德国Bruker公司;扫描电子显微镜,荷兰PHENOM公司;同步热分析仪,德国NETZSCH公司;X-射线衍射,日本理学公司;XH-C旋涡混合器,金坛市医疗仪器厂。
1.3 实验方法
1.3.1 膜的制备
使用超声粉碎机对百里香精油进行超声处理,将1 mL的Tween 80和1.7 mL的百里香精油混合,定容至100 mL,于磁力搅拌器上混合5 min。反应过程通过冰水浴控制体系温度为20 ℃,混合液在20 kHz的频率、475 W的功率下超声处理20 min。
TEON作为溶剂,向20 g/L的果胶中加入0.4(PC1)、0.8(PC2)、1.2(PC3)、1.6(PC4)、2.0 g(PC5)的CUR,将不添加CUR的薄膜(PC0)作为空白对照组。40%(质量分数,基于果胶)的甘油,于磁力搅拌器上混合3 h。将混合物于水浴锅60 ℃加热30 min,立即将30 g成膜液按流延法倒入聚四氟乙烯板(10 cm×10 cm)中,在45 ℃烘箱中干燥12 h后,剥离薄膜。置于25 ℃和50%相对湿度(RH)的霉菌培养箱中48 h,平衡水分,进行后续测试。
1.3.2 接种物的制备
肉膏蛋白胨固体培养基(LB固体培养基)和磷酸盐缓冲液(PBS缓冲液)参考之前的方法进行制备[4]。
1.3.3 薄膜厚度
使用厚度测试仪随机测定薄膜5个位置取平均值,以确定每种薄膜厚度。
1.3.4 薄膜的耐水性测试
1.3.4.1 水分含量
将薄膜切成2 cm×2 cm的大小,记录下初始质量(W0)后,置于洁净的称量瓶中,再记录整体质量(W1),通过在105 ℃下干燥至恒重(W2),水分含量(water conter,WC)计算如公式(1)所示:
(1)
1.3.4.2 水溶性
切成2 cm×2 cm的薄膜,记录初始质量(W0),浸入50 mL的蒸馏水中,在室温下溶解24 h。随后取出薄膜在45 ℃下干燥以达到恒重,置于25 ℃和50%相对湿度的霉菌培养箱中平衡48 h,记录剩余膜的质量(W1),薄膜前后质量损失率,即水溶性(water solubility,WS)计算如公式(2)所示:
(2)
1.3.4.3 水蒸气透过率
薄膜的水蒸气透过率(water vapor permeability,WVP)通过透湿性测试仪,根据国家标准GB/T 1037—1988进行测定。将4 mL去离子水注量杯之中,覆盖上薄膜之后用橡胶圈进行密封。之后将量杯置于测试室之中,测试室的温度和湿度控制为25 ℃和50%。WVP计算如公式(3)所示:
(3)
式中:WVTR是水蒸气通量[g/(m2·s)],由重量变化随时间曲线的线性部分进行线性回归计算得出;L是薄膜的厚度;Δp是膜两侧的水汽压差。
1.3.4.4 水接触角测定
将薄膜裁成2 cm×2 cm的大小,通过双面胶固定在载玻片上,之后将样品放置于吕克士接触角测量仪上。通过向薄膜表面滴30 μL去离子水,立即进行薄膜的水接触角(water contact angle,WCA)测定。
1.3.5 薄膜机械性能测试
薄膜的机械性根据ASTM标准方法进行修改后进行测定。将薄膜剪成2 cm×4 cm的长条,采用电子万能材料试验机对薄膜的拉伸强度、断裂伸长率以及杨氏模量进行测定。测定时两个夹具之间的初始长度和拉伸速度分别为25 mm和30 mm/min。
1.3.6 傅里叶变换红外光谱
薄膜的傅里叶变换红外光谱(Fourier transform infrared,FT-IR)于衰减全反射模式下在4 000~400 cm-1的范围内进行记录。
1.3.7 扫描电子显微镜
薄膜在高真空下溅射镀金90 s后,通过扫描电子显微镜(scanning electron microscopy,SEM)在15 kV的加速电压下进行表面的微观形态的观察,记录放大4 000倍的图像。
1.3.8 差式扫描量热仪
薄膜的热性能通过差式扫描量热仪(differential scanning calorimetry,DSC)进行测定。测定时称取5 mg的薄膜样品于坩埚中,在15 mL/min的氮气气氛下以10 ℃/min的升温速率将温度从30 ℃升到200 ℃。
1.3.9 X射线衍射
薄膜的X射线衍射(X-ray diffraction,XRD)图谱通过X射线衍射仪在40 kV的电压、40 mA的电流下以4 °/min的速率在5 °~60 °的2θ范围内扫描薄膜样品。
1.3.10 抗菌活性的测定
薄膜的抗菌活性根据扩散法修改后进行测定。通过麦氏比浊法得到细菌悬浮液(108 CFU/mL),使用PBS缓冲液对菌悬液进行梯度稀释3次,使4种微生物的菌悬液浓度为105 CFU/mL。在无菌条件下,将菌悬液(100 μL)均匀涂布在LB平板的表面,20 min后,将裁剪为圆形的薄膜(直径1 cm)置于培养皿中心位置。将培养皿(直径9 cm)放入37 ℃培养箱中,48 h后测定抑菌圈直径。
1.4 数据处理与分析
使用OriginPro 9.0软件对试验数据进行绘图,试验每组设置3个平行,用SPSS 20.0软件进行差异显著性分析,结果以平均值±标准差表示,以P<0.05表示差异显著。
2 结果与分析
2.1 薄膜的厚度、水分含量和水溶性的测定
薄膜的厚度是影响透明度、渗透性和机械性能的重要因素[14]。如表1所示,随着CUR的增加,薄膜的厚度逐渐增加,聚合物的增加与膜的厚度呈正相关性。
WC是与薄膜网络中水分子占据的总自由体积相关的参数[15],决定包装材料耐水能力的重要指标。如表1所示,薄膜的WC随着CUR的增加逐渐减小(P<0.05)直至平衡(P>0.05),这可能是因为CUR的水不溶性或者其低温加热退火后,形成了热可逆凝胶,增强了网络结构的致密性[16],使薄膜疏水性增强,导致薄膜基质的自由体积逐渐降低,从而减少WC。SUN等[17]在CUR/壳聚糖抗菌膜中也报告了类似的结果。
WS反映了薄膜的耐水性和降解性。防水性或不溶性对于生物基薄膜在食品包装中的潜在应用通常至关重要,尤其是在潮湿的环境中[18]。由表1可以看出,未添加CUR的薄膜WS高达100%,加入CUR能有效地降低薄膜的WS,这可能是膜基质中果胶和CUR之间产生了氢键的相互作用,使游离的羟基密度降低,导致亲水位点减少,这表明分子间相互作用可以为共混膜提供更好的内聚力和稳定性[11]。
表1 复合膜的厚度、WC及WS
Table 1 Thickness、water content and solubility of composite films
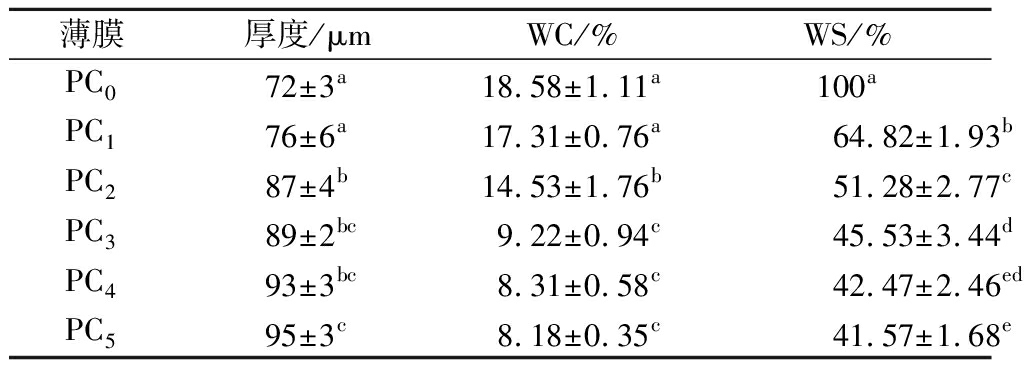
薄膜厚度/μmWC/%WS/%PC072±3a18.58±1.11a100aPC176±6a17.31±0.76a64.82±1.93bPC287±4b14.53±1.76b51.28±2.77cPC3 89±2bc9.22±0.94c45.53±3.44dPC4 93±3bc8.31±0.58c42.47±2.46edPC595±3c8.18±0.35c41.57±1.68e
注:数据表示为3次测定平均值±标准差;同列数据上标字母不同表示存在显著差异(P<0.05)(下同)
2.2 复合膜的水蒸气透过率
WVP是评估一定温度下薄膜对水蒸气的阻隔作用的基本参数。通过WVP测量,研究了CUR的加入,对薄膜阻水性能的影响[19]。如图1所示,未添加CUR的薄膜WVP为(4.84±0.22)×10-12 g·cm/(cm2·s·Pa),CUR的加入对薄膜的WVP有显著影响(P<0.05),但比例到达PC3后,效果不再显著(P>0.05),WVP在3.5×10-12~3.9×10-12 g·cm/(cm2·s·Pa)左右,表明CUR在改善WVP方面有显著效果,这可能与CUR的疏水性有关[10],从而增强了薄膜的阻水性。除此以外,水通过薄膜的扩散与薄膜网络结构也息息相关,CUR的加入使薄膜具有更紧凑和致密结构,从而更有效地降低WVP[11]。
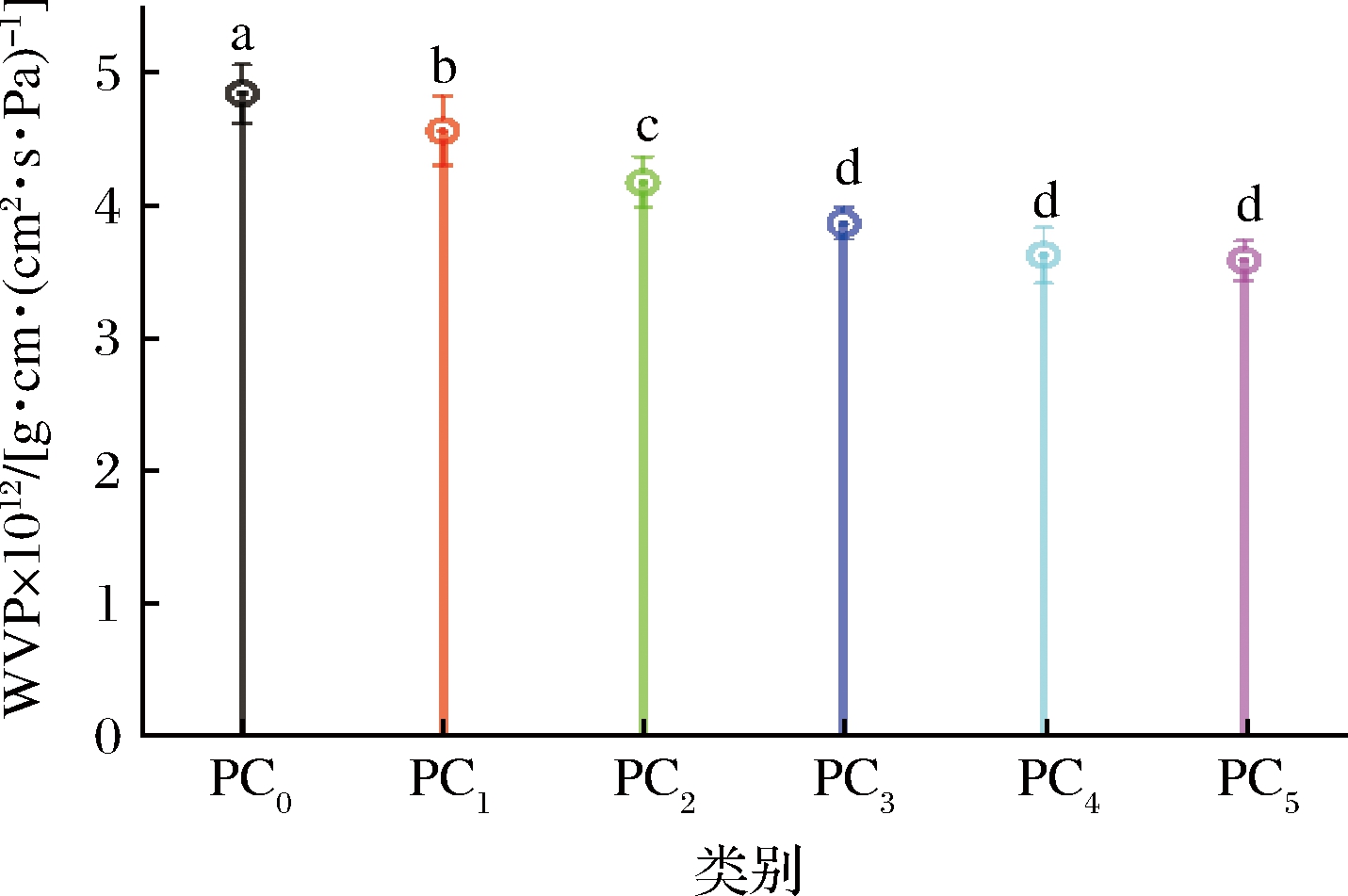
图1 复合膜的水蒸气透过率
Fig.1 Water vapor permeability of composite films 注:字母不同表示存在显著差异(P<0.05)(下同)
2.3 复合膜的水接触角测定
图2显示了添加不同质量CUR制备的薄膜的WCA。通常,WCA值较高的薄膜表现出较低的表面润湿性,而具有较低WCA值的生物聚合物薄膜表现出较高的表面润湿性[11]。结果表明,当加入CUR后,接触角值在(45.72±0.76)°~(65.45±0.47)°,薄膜的接触角逐渐增大,表明CUR的加入使薄膜的表面润湿性减小。所以当CUR的质量不断增加后,复合膜的表面接触角不断增大,其疏水性也随之增强。这与CUR的水不溶性有关,也因CUR的加入不仅促进了密度的变化,也促进内部网络结构变化,从而减少了薄膜表面对水分子的亲和力,与上述结论一致。

图2 复合膜的水接触角
Fig.2 Water contact angle of composite films
2.4 复合膜的机械性能测定
拉伸强度(tensive strength,TS)、断裂伸长率(elongation at break,EB)和弹性模量(elastic modulus,EM)是食品包装应用中最常见的机械参数,受薄膜基体之间的相互作用、成膜组分的分布和分子间网络结构等影响[2]。一般认为TS越高代表机械强度越佳,EB及EM越低表示柔韧性越差。如图3所示,随着CUR的逐渐增多,TS和EM逐渐增大至平衡,说明CUR的存在促进形成了更多的氢键,增强了分子间相互作用,形成紧密的网络结构,获得了更好的力学性能[20]。CUR的加入使EB逐渐减小至平衡,可能是聚合物链之间氢键作用抑制了分子链流动,产生了相对低伸长率的脆性基质。
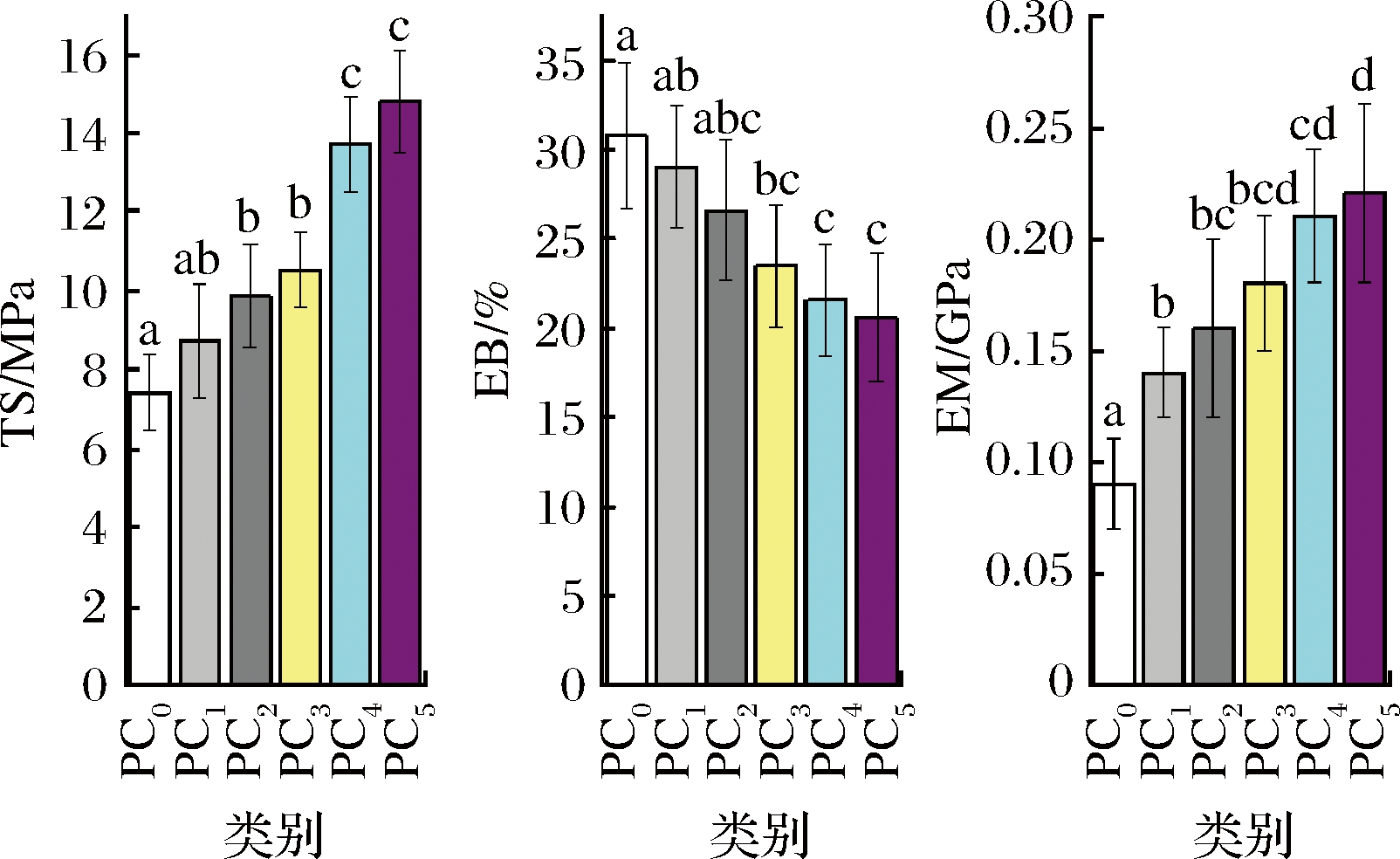
图3 复合膜的机械性能
Fig.3 Mechanical properties of composite films
2.5 复合膜的FT-IR分析
复合膜的FT-IR如图4所示,在3 319 cm-1处观察到的宽峰对应—OH的伸缩振动,在2 926 cm-1处出现的峰是由于甲基中C—H的拉伸振动,发生轻微偏移。在1 613 cm-1处出现的峰与果胶C![]() O和苯环骨架振动有关。1 096 cm-1处出现的峰可能是Tween 80或果胶上—COO—的伸缩振动,和CUR主链C—O—C的振动[14]。1 018 cm-1出现的峰与糖环上的C—O有关。850 cm-1处的吸收峰表明存在β构型,这与CUR的β-1,3-D-葡聚糖结构一致[21]。
O和苯环骨架振动有关。1 096 cm-1处出现的峰可能是Tween 80或果胶上—COO—的伸缩振动,和CUR主链C—O—C的振动[14]。1 018 cm-1出现的峰与糖环上的C—O有关。850 cm-1处的吸收峰表明存在β构型,这与CUR的β-1,3-D-葡聚糖结构一致[21]。
当化学基团在分子水平上相互作用时,光谱带会发生偏移,且宽度和强度也随之变化,这些变化可以表明聚合物具有良好的混溶性[1]。理论上,游离的—OH吸收峰在3 400 cm-1左右,但分子间和分子内氢键会导致官能团的伸缩振动发生变化,吸收峰会移动到较低的波数[22]。随着CUR的不断加入,复合膜中—OH的吸收峰从3 319 cm-1移动到3 285 cm-1,峰略微向右移动,这种现象被称为红移效应[16]。主要是因为CUR主链中大量的—OH,与果胶和TEON中的羟基产生了分子间氢键,使膜中游离的羟基的密度降低。C—O—C吸收峰的右移,也表明果胶和CUR分子间产生了强烈的氢键相互作用[23],使得吸收峰移动到较低波数。根据FT-IR的结果可知,果胶与CUR之间具有良好混溶性,主要是由于共混及成膜过程中的协同作用和分子间氢键的形成[24]。而且C—O—C随着CUR增加,峰迁移明显,也说明疏水作用逐渐加强[23]。

图4 复合膜的FT-IR谱图
Fig.4 FT-IR spectrum of composite films
2.6 复合膜的表面微观结构
SEM可以更好地了解薄膜的微观结构,以便探索生物聚合物膜基质中油滴组织对薄膜性能造成的影响。图5-a展示了精油膜的外观图,所有的复合膜光滑平整,具有良好的透明度,表面均未出现裂纹以及穿孔的现象,这表明薄膜的成功制备。未添加CUR的薄膜表面如图5-b的PC0所示,薄膜具有平坦且均匀的微观表面,其中多糖链聚集形成连续而致密的网络结构,出现部分微孔,可能与成膜(干燥)过程中TEON的蒸发有关[25]。随着CUR的加入,薄膜上的微孔逐渐减少,可能是因为CUR单链在复旋过程中包埋了部分乳液,抑制了TEON的蒸发[26]。当复配比例为PC4时,薄膜表面产生一些粗糙度,PC5比例下的薄膜表面更粗糙,出现轻微的皱纹,这可能是由于CUR过量添加,其三螺旋链发生部分聚集,使薄膜微观结构相对不均匀造成的[10]。

a-复合膜的照片;b-复合膜扫描电镜图
图5 复合膜的照片和复合膜扫描电镜
Fig.5 Photographs of composite films and scanning electron microscopy of composite films
2.7 复合膜的DSC曲线
薄膜的热稳定性反映了薄膜对温度变化的耐受程度,为生产中的实际使用提供了理论基础。如图6所示,未添加CUR的薄膜122.3 ℃处出现放热峰,随着CUR的加入,放热峰不断右移,直至PC3达到最高,对应的的熔融温度为133.1 ℃,表明此比例下复合膜具有最高的热稳定性,膜中各组分的相互作用最强,具有较好的混溶性[20]。当CUR添加量继续增加,吸收峰则发生左移,PC4的熔融温度为119.7 ℃,PC5的熔融温度为109.4 ℃,这可能是由于添加过量的CUR,结构伴随氢键断裂发生紊乱或膨胀[27],从而使热稳定性降低。

图6 复合膜的DSC曲线
Fig.6 DSC curves for composite films
2.8 XRD
结晶度与薄膜的性能和结构密切相关,是表征薄膜材料的重要参数,XRD用于研究添加CUR对果胶/TEON薄膜结晶度的影响,并评估果胶、CUR和TEON之间的相容性。结晶能够反映分子排列,结晶区域是规则排列的区域,无定形区域是随机排列的区域。具有高结晶度的物质表现出窄而高的峰形;低结晶度物质表现出峰宽和低峰形状[28]。如图7所示,未添加CUR的薄膜,在2θ=20.94°处的吸收峰为宽而低的形状,结晶度较低,具有半结晶结构[19]。当加入不同质量的CUR后,其吸收峰依次为20.91°、20.58°、19.88°、20.35°、20.54°,除PC3比例外,其余组分并没有显著改变果胶/TEON薄膜在XRD图中衍射峰的位置,说明保留了薄膜的晶体结构。PC3的吸收峰相较于其他组分发生右移,说明果胶和CUR的原始结晶域被破坏,可能是发生了氢键的相互作用,也表明两种聚合物存在良好的共混性[24]。
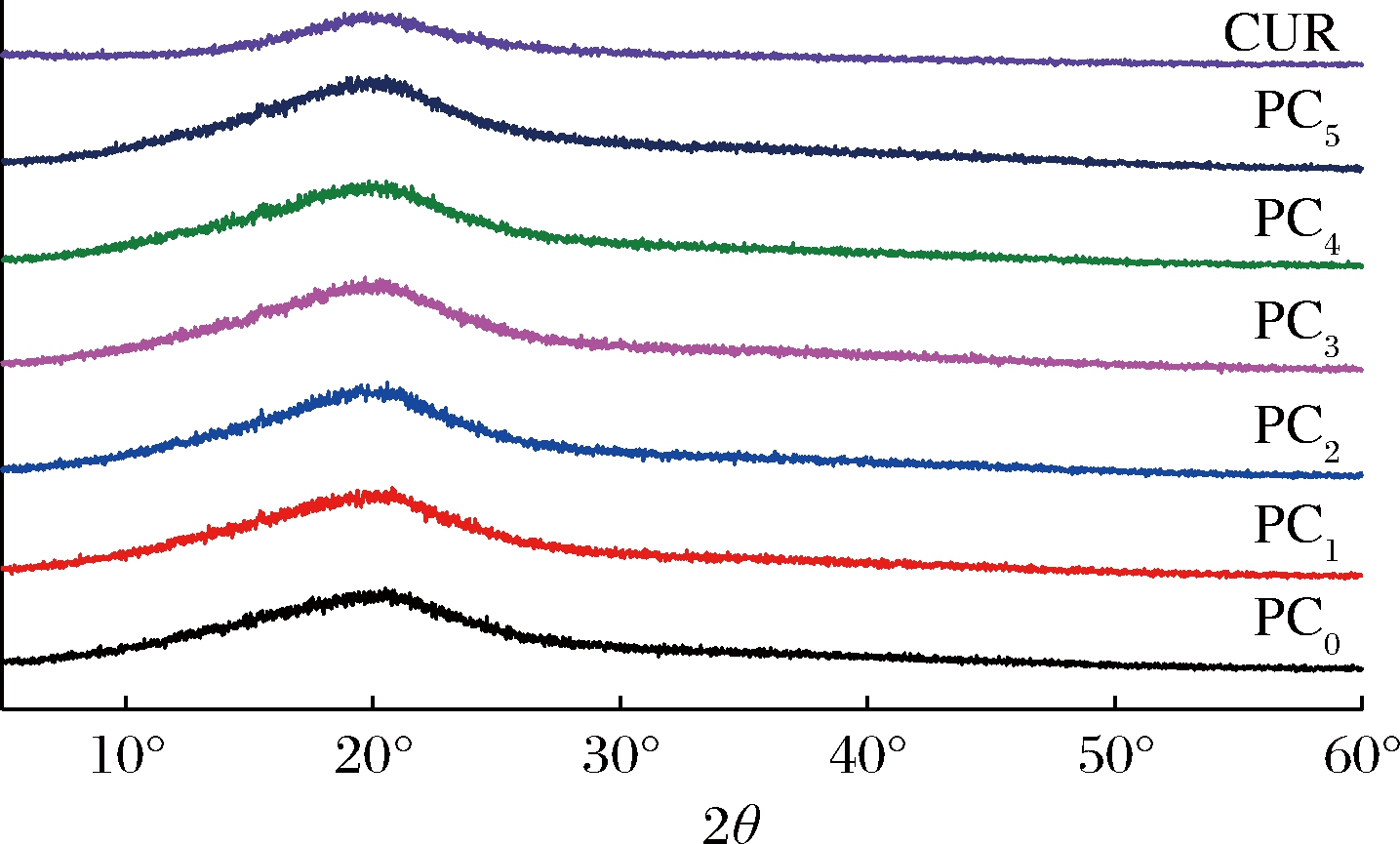
图7 复合膜的XRD图
Fig.7 X-ray diffraction of composite films
2.9 抗菌性
为探索CUR的加入对薄膜抗菌性能造成的影响,通过测量抑菌圈大小来评估对大肠杆菌(a)、铜绿假单胞菌(b)、金黄色葡萄球菌(c)和枯草芽孢杆菌(d)的抗菌效果。如图8-a和图8-b所示,果胶/CUR/TEON薄膜对革兰氏阴性菌的生长存在抑制作用,能抑制部分细菌的生长。对大肠杆菌的抑菌圈大小在(20.1±2.3) mm左右,对铜绿假单胞菌的抑菌圈大小在(19.3±1.9) mm左右,其中CUR的加入对革兰氏阴性菌的抗菌性几乎不造成影响,只有PC5的抑菌圈明显减小,可能是添加过量CUR导致TEON不易扩散,抑菌效果降低。
如图8-c和图8-d所示,能观察到薄膜对革兰氏阳性菌显示出明显的抑菌圈。对金黄色葡萄球菌的抑菌圈大小在(8.3±1.8) mm左右,对枯草芽孢杆菌的抑菌圈大小在(12.5±6.3) mm左右,随着CUR的加入PC1、PC2和PC3的抑菌圈明显增加,这表明不同的薄膜材料可以影响TEON的迁移[29],也可能是因为CUR的三螺旋结构的包埋作用,抑制了TEON的蒸发,使抗菌性增强。革兰氏阳性和革兰氏阴性细菌菌株对天然抗菌剂作用的敏感性存在差异[30],这归因于革兰氏阳性菌的细胞壁含有更具扩散性的粘膜肽层,而革兰氏阴性菌的亲脂性抗菌化合物的扩散速率被脂多糖层所降低[31]。

a-大肠杆菌;b-铜绿假单胞菌;c-金黄色葡萄球菌;d-枯草芽孢杆菌
图8 复合膜对大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌和枯草芽孢杆菌的抑制
Fig.8 Inhibition of Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, and Bacillus subtilis by composite films
3 结论
针对目前果胶/TEON复合膜在耐水性和机械性等方面的局限性,本研究探索了不同添加量的CUR对果胶/TEON薄膜性能的改进效果及其作用机制。结果表明,添加合适比例的CUR能够有效地增强果胶/TEON薄膜的疏水性和机械性能。FT-IR和XRD检测分析表明,CUR与果胶及TEON之间发生了强烈的氢键相互作用,并且CUR的加入使薄膜内部网络结构更加致密,当加入1.2 g的CUR时,复合膜的热稳定性和相容性达到最优。本研究对CUR用于改善多糖薄膜性能的有效途径进行了探索,也为复合多糖与精油乳液相结合的包装材料用于食品保鲜提供了基础数据。
[1] MONJAZEB MARVDASHTI L M, KOOCHEKI A, YAVARMANESH M.Alyssum homolocarpum seed gum-polyvinyl alcohol biodegradable composite film:Physicochemical, mechanical, thermal and barrier properties[J].Carbohydrate Polymers, 2017, 155:280-293.
[2] HUANG J Y, HU Z H, HU L P, et al.Pectin-based active packaging:A critical review on preparation, physical properties and novel application in food preservation[J].Trends in Food Science &Technology, 2021, 118:167-178.
[3] ZHANG X H, LIU D H, JIN T Z, et al.Preparation and characterization of gellan gum-chitosan polyelectrolyte complex films with the incorporation of thyme essential oil nanoemulsion[J].Food Hydrocolloids, 2021, 114:106570.
[4] 薛思雅, 张润峰, 王清, 等.不同浓度、粒径百里香精油纳米乳液的抗菌性研究 [J/OL].食品与发酵工业.https://doi.org/10.13995/j.cnki.11-1802/ts.033074.
XUE S Y,ZHANG R F,WANG Q,et al.Research on antibacterial activity of thyme essential oil nanoemulsion with different concentration and droplet size[J/OL].Food and Fermentation Industries.https://doi.org/10.13995/j.cnki.11-1802/ts.033074.
[5] MUNGURE T E, ROOHINEJAD S, BEKHIT A E D, et al.Potential application of pectin for the stabilization of nanoemulsions[J].Current Opinion in Food Science, 2018, 19:72-76.
[6] ACEVEDO-FANI A, SOLIVA-FORTUNY R, MARTIN-BELLOSO O.Nanoemulsions as edible coatings[J].Current Opinion in Food Science, 2017, 15:43-49.
[7] CANDIDO G S, NATARELLI C V L, CARVALHO E E N, et al.Bionanocomposites of pectin and pracaxi oil nanoemulsion as active packaging for butter[J].Food Packaging and Shelf Life, 2022, 32:100862.
[8] ALMASI H, AZIZI S, AMJADI S.Development and characterization of pectin films activated by nanoemulsion and pickering emulsion stabilized marjoram (Origanum majorana L.) essential oil[J].Food Hydrocolloids, 2020, 99:105338.
[9] WANG K Q, DU L C, ZHANG C, et al.Preparation of chitosan/curdlan/carboxymethyl cellulose blended film and its characterization[J].Journal of Food Science and Technology, 2019, 56(12):5 396-5 404.
[10] WU K, LI X, YAN X, et al.Impact of curdlan addition on the properties of konjac glucomannan/ethyl cellulose composite films[J].Starch-Stärke, 2022, 74(1-2):2100194.
[11] AHMAD M, NIRMAL N P, CHUPROM J.Blend film based on fish gelatine/curdlan for packaging applications:Spectral, microstructural and thermal characteristics[J].RSC Advances, 2015, 5(120):99 044-99 057.
[12] WU K, WAN Y, LI X, et al.Impact of heating and drying temperatures on the properties of konjac glucomannan/curdlan blend films[J].International Journal of Biological Macromolecules, 2021, 167:1 544-1 551.
[13] MOHSIN A, ZAMAN W Q, GUO M J, et al.Xanthan-Curdlan nexus for synthesizing edible food packaging films[J].International Journal of Biological Macromolecules, 2020, 162:43-49.
[14] ZHANG Y, ZHOU L B, ZHANG C, et al.Preparation and characterization of curdlan/polyvinyl alcohol/ thyme essential oil blending film and its application to chilled meat preservation[J].Carbohydrate Polymers, 2020, 247:116670.
[15] SARICAOGLU F T, TURHAN S.Physicochemical, antioxidant and antimicrobial properties of mechanically deboned chicken meat protein films enriched with various essential oils[J].Food Packaging and Shelf Life, 2020, 25:100527.
[16] 潘玉雪, 徐欣东, 张润峰, 等.凝胶多糖自组装作用及其应用研究进展[J]食品科学.2022, 43(15):265-274.
PAN Y X,XU X D,ZHANG R F,et al.Progress in research on self-assembly of curdlan and its application[J].Food Science,2022, 43(15):265-274.
[17] SUN Y, LIU Y, LI Y Z, et al.Preparation and characterization of novel curdlan/chitosan blending membranes for antibacterial applications[J].Carbohydrate Polymers, 2011, 84(3):952-959.
[18] HAGHIGHI H, BIARD S, BIGI F, et al.Comprehensive characterization of active chitosan-gelatin blend films enriched with different essential oils[J].Food Hydrocolloids, 2019, 95:33-42.
[19] NORCINO L B, MENDES J F, NATARELLI C V L, et al.Pectin films loaded with copaiba oil nanoemulsions for potential use as bio-based active packaging[J].Food Hydrocolloids, 2020, 106:105862.
[20] ZHOU L B, WANG K Q, BIAN L Y, et al.Improving properties of curdlan/nanocellulose blended film via optimizing drying temperature[J].Food Hydrocolloids, 2023, 137:108421.
[21] DING L, SONG S, CHEN L L, et al.A freeze-thawing method applied to the fabrication of 3-d curdlan/polyvinyl alcohol hydrogels as scaffolds for cell culture[J].International Journal of Biological Macromolecules, 2021, 174:101-109.
[22] ELIZONDO N J, SOBRAL P J A, MENEGALLI F C.Development of films based on blends of Amaranthus cruentus flour and poly(vinyl alcohol)[J].Carbohydrate Polymers, 2009, 75(4):592-598.
[23] ZHANG L, HUANG Y K, YUE L N, et al.Variation of blending ratio and drying temperature optimize the physical properties and compatibility of HPMC/curdlan films[J].Carbohydrate Polymers, 2022, 296:119951.
[24] WU C H, PENG S H, WEN C R, et al.Structural characterization and properties of konjac glucomannan/curdlan blend films[J].Carbohydrate Polymers, 2012, 89(2):497-503.
[25] SALGADO P R, L PEZ-CABALLERO M E, G
PEZ-CABALLERO M E, G MEZ-GUILLÉN M C, et al.Sunflower protein films incorporated with clove essential oil have potential application for the preservation of fish patties[J].Food Hydrocolloids, 2013, 33(1):74-84.
MEZ-GUILLÉN M C, et al.Sunflower protein films incorporated with clove essential oil have potential application for the preservation of fish patties[J].Food Hydrocolloids, 2013, 33(1):74-84.
[26] ALI GANIE S, RATHER L J, LI Q.Review on andti-cancer and anti-microbial applications of curdlan biomaterials[J].Journal of Polymers and the Environment, 2022, 30(4):1 284-1 299.
[27] JIN Y, ZHANG H B, YIN Y M, et al.Comparison of curdlan and its carboxymethylated derivative by means of Rheology, DSC, and AFM[J].Carbohydrate Research, 2006, 341(1):90-99.
[28] SALAMA H E, ABDEL AZIZ M S, SABAA M W.Novel biodegradable and antibacterial edible films based on alginate and chitosan biguanidine hydrochloride[J].International Journal of Biological Macromolecules 2018, 116:443-450.
[29] MORADI M, TAJIK H, RAZAVI ROHANI S M, et al.Antioxidant and antimicrobial effects of zein edible film impregnated with Zataria multiflora Boiss.essential oil and monolaurin[J].LWT-Food Science and Technology, 2016, 72:37-43.
[30] DU Y, SUN J S, WANG L, et al.Development of antimicrobial packaging materials by incorporation of gallic acid into Ca2+ crosslinking konjac glucomannan/gellan gum films[J].International Journal of Biological Macromolecules, 2019, 137:1 076-1 085.
[31] SUFLET D M, POPESCU I, PELIN I M, et al.Phosphorylated curdlan gel/polyvinyl alcohol electrospun nanofibres loaded with clove oil with antibacterial activity[J].Gels (Basel, Switzerland), 2022, 8(7):439.