草菇(Volvariella volvacea)又名稻草菇、中国菇[1],其子实体味道鲜美,富含蛋白质、矿物质、维生素等营养物质[2],具有抗肿瘤、提高免疫力、降血糖、降胆固醇等多种药用价值[3],深受消费者喜爱。作为我国主要栽培食用菌,草菇的产量曾位居全国第三[4]。但近年来草菇栽培面积逐年下滑,据中国食用菌协会统计,草菇年产量由2010年的33.08万t降至2019年的23.43万t,下降了29.17%,难以满足市场需求。寻找一种提高草菇产量的方法已成为草菇产业亟需解决的关键问题。
与杏鲍菇、真姬菇、金针菇等食用菌品种的高度工厂化、机械化相比,草菇生产多为传统的农户分散种植模式,且栽培菌种多为固体菌种,需经过装瓶、灭菌、接种、掏瓶等繁琐程序[5],同时存在接种点单一,菌龄不一致,菌丝活力低[6],制种、发菌周期长,投资成本高[7]等缺点,严重限制了草菇产业的发展。
相比传统固体菌种,液体菌种在食用菌生产上更具优势。文晴等[8]利用固、液体菌种对平菇进行栽培对比,结果表明液体菌种的生产周期更短、产量更高;张伟彤等[9]使用液体菌种栽培珊瑚猴头菇,发现每袋鲜重比固体菌种提高26.22%、干重提高35.35%。周峰等[10]对香菇液体菌种与固体菌种的使用效果表明,液体菌种生产成本低,适合工厂化生产。
近年来,对于草菇液体菌种的研究多有报道,但主要是以菌丝干重为评价指标,对培养基的组分和培养条件[11]进行优化。而利用草菇液体菌种进行栽培的研究鲜有报道。本文通过单因素及响应面试验,对草菇液体菌种的培养基配方进行优化,并利用草菇液体和固体菌种进行栽培试验,对比两种菌种的生产性状,本研究可为草菇液体菌种的开发和工厂化利用提供参考。
1 材料与方法
1.1 菌种
草菇V844,购自江苏省联谊食用菌推广中心。
1.2 培养基配制
PDB培养基:去皮马铃薯200.00 g/L,硫酸镁0.50 g/L,pH自然。
PDA培养基:PDB培养基中添加20.00 g/L琼脂粉。
固体菌种培养基(质量分数):棉籽壳88%,麸皮10%,石膏1%,石灰1%,含水量约65%,pH 8~9[12]。
栽培培养基(质量分数):废棉95%,石灰5%,含水量约 65%,pH 9~10[13]。
1.3 液体菌种培养基配方优化
1.3.1 种子液制备
将菌种活化后,准备3个500 mL三角瓶,每个瓶中装入300 mL PDB培养基,然后接种5个1 cm×1 cm菌丝块;30 ℃,180 r/min摇床振荡培养4 d[14],得种子液。
1.3.2 筛选最佳的碳源、氮源、无机盐
液体菌种培养基:在PDB培养基中添加20.00 g/L碳源、4.00 g/L氮源、2.00 g/L无机盐,pH自然。液体菌种培养基中的5种不同的碳源、氮源和无机盐的添加方法如下:
最佳碳源筛选:以葡萄糖、蔗糖、果糖、麦芽糖、乳糖为碳源,以蛋白胨为氮源,磷酸二氢钾为无机盐。
最佳氮源筛选:以蛋白胨、酵母粉、牛肉浸膏、尿素、硝酸铵为氮源,以葡萄糖为碳源,磷酸二氢钾为无机盐。
最佳无机盐筛选:以磷酸二氢钾、硫酸亚铁、硫酸锌、硫酸钙、亚硒酸钠为无机盐,以葡萄糖为碳源,蛋白胨为氮源。
将5 mL种子液接种于上述液体菌种培养基中,以菌丝干重为指标筛选出最佳碳源、氮源和无机盐。
1.3.3 最佳碳源、氮源、无机盐的最适浓度筛选
液体菌种培养基中最佳碳源、氮源、无机盐的浓度设置及添加方法如下:
最佳碳源浓度筛选:16.00、18.00、20.00、22.00、24.00 g/L的最佳碳源,4.00 g/L最佳氮源,2.00 g/L最佳无机盐。
最佳氮源浓度筛选:2.00、3.00、4.00、5.00、6.00 g/L的最佳氮源,20.00 g/L最佳碳源,2.00 g/L最佳无机盐。
最佳无机盐浓度筛选:1.00、1.50、2.00、2.50、3.00 g/L的最佳无机盐,20.00 g/L最佳碳源,4.00 g/L最佳氮源。
将5 mL种子液接种于上述液体菌种培养基中,装液量及培养条件同种子液制备;以菌丝干重为指标进行最适浓度的筛选。
1.3.4 响应面优化
在单因素试验的基础上选取碳源、氮源、无机盐作为试验因素,以菌丝干重为响应值,根据Box-Behnken 试验设计原理设计响应面试验[15],对草菇液体菌种培养基配方进行优化。
1.4 液、固体菌种栽培对比
以试验确定的培养基最佳配方制备液体菌种,参考LI等[16]的方法制作固体菌种。分别接种液体与固体菌种进行栽培试验,参考余昌霞等[17]的方法进行栽培管理。
1.5 指标测定
菌丝干重(g):收集菌丝,用蒸馏水洗涤3次后在60 ℃下干燥至恒重并称重[18]。
菌丝满框时间(d):记录从种子培养开始到菌丝满框所需的时间。
原基形成时间(d):记录从种子培养开始到栽培阶段第一个原基形成所需的时间。
生产周期(d):记录从种子培养开始到收获期(蛋形期)所需的时间。
子实体直径(mm):从每个栽培框随机摘取5个,用游标卡尺测量子实体直径,记录后取平均值。
平均单菇重(g):生长至蛋形期时,从每个栽培框随机摘取5个,分别称重后,取平均值。
生物学效率的计算[6]如公式(1)所示:
生物学效率![]()
(1)
1.6 数据分析
采用Origin 9.0软件作图,用Spss 19.0 统计软件对数据进行单因素方差分析显著性,用Design-Expert 12软件进行响应面试验设计。
2 结果与分析
2.1 液体菌种培养基配方优化
2.1.1 不同碳源、氮源、无机盐对草菇菌丝生长的影响
将草菇接种于分别添加5种不同碳源的液体培养基中培养,测定菌丝干重,结果如图1所示。由图1-A可知,以葡萄糖为碳源时,草菇菌丝干重最高,为4.61 g/L,显著高于以果糖、蔗糖、麦芽糖和乳糖为碳源的菌丝干重(P<0.05),表明葡萄糖是草菇液体培养的最佳碳源。由图1-B可知,以酵母粉为氮源时,草菇生长最好,菌丝干重达5.20 g/L,显著高于以蛋白胨、牛肉浸膏、硝酸铵、尿素为氮源的菌丝干重(P<0.05),表明酵母粉是草菇液体培养的最佳氮源。由图1-C可知,以磷酸二氢钾为无机盐时,草菇菌丝干重为4.64 g/L,显著高于硫酸锌、硫酸钙、硫酸亚铁、亚硒酸钠(P<0.05),表明磷酸二氢钾是草菇液体培养的最佳无机盐。
2.1.2 最佳碳源、氮源、无机盐的最适浓度筛选
对最佳碳源、氮源,无机盐的最适浓度进行筛选,结果如图2所示。随着葡萄糖、酵母粉、磷酸二氢钾浓度的增加,草菇菌丝干重均呈先升高后下降的趋势。当葡萄糖质量浓度为20.00 g/L时,菌丝干重达到最大4.64 g/L;酵母粉质量浓度为4.00 g/L时,菌丝干重达到最大5.27 g/L;当磷酸二氢钾质量浓度为2.00 g/L时,菌丝干重达到最大4.66 g/L。表明葡萄糖的最适质量浓度为20.00 g/L,酵母粉的最适质量浓度为4.00 g/L,磷酸二氢钾的最适质量浓度为2.00 g/L。

A-不同碳源菌丝干重;B-不同氮源菌丝干重;C-不同无机盐菌丝干重
图1 不同碳源、氮源、无机盐对草菇菌丝生长的影响
Fig.1 Effects of different carbon sources nitrogen sources and inorganic salts on the growth of V.volvacea mycelium 注:不同小写字母代表同一组内有显著性差异(P<0.05)

A-不同浓度葡萄糖菌丝干重;B-不同浓度酵母粉菌丝干重;C-不同浓度磷酸二氢钾菌丝干重
图2 葡萄糖、酵母粉、磷酸二氢钾最适浓度筛选
Fig.2 Screening of optimal concentrations of glucose, yeast powder, and KH2PO4
2.1.3 响应面优化试验
响应面法的基本思想是通过近似构造一个具有明确表达形式的多项式来表达隐式功能函数[16]。在单因素试验的基础上,以葡萄糖、酵母粉、磷酸二氢钾为因素,菌丝干重为响应值设计三因素三水平响应面试验,试验因素和水平如表1所示。
表1 响应面设计因素水平表
Table 1 Response surface design factor level table

水平A(葡萄糖)/(g·L-1)B(酵母粉)/(g·L-1)C(磷酸二氢钾)/(g·L-1)-118.003.001.50020.004.002.00122.005.002.50
按照表2中的Box-Behnken 试验方案进行试验,各组菌丝干重见表2。经软件分析可得到液体菌种培养基配方二次回归方程:
菌丝干重=6.21+0.598 7×A+0.555 0×B+0.633 8×C+0.270 0×AB-0.242 5×AC-0.190 0×BC-0.956 3×A2-0.893 7×B2-0.706 3×C2
表2 响应面试验设计因素水平及结果 单位:g/L
Table 2 Design factor level and results of response surface test
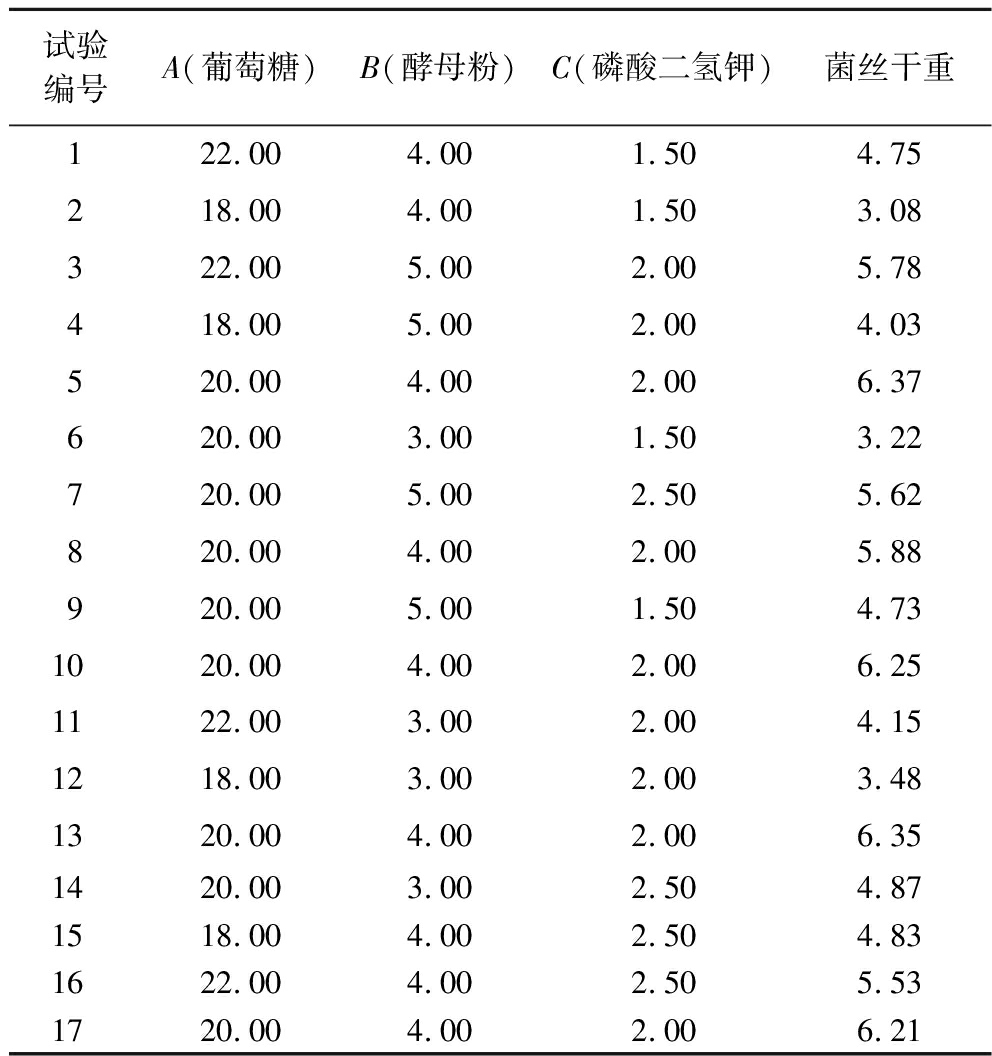
试验编号A(葡萄糖)B(酵母粉)C(磷酸二氢钾)菌丝干重122.00 4.00 1.50 4.75218.00 4.00 1.50 3.08322.00 5.00 2.00 5.78418.00 5.00 2.00 4.03520.00 4.00 2.00 6.37620.00 3.00 1.50 3.22720.00 5.00 2.50 5.62820.00 4.00 2.00 5.88920.00 5.00 1.50 4.731020.00 4.00 2.00 6.251122.00 3.00 2.00 4.151218.00 3.00 2.00 3.481320.00 4.00 2.00 6.351420.00 3.00 2.50 4.871518.00 4.00 2.50 4.831622.00 4.00 2.50 5.531720.00 4.00 2.00 6.21
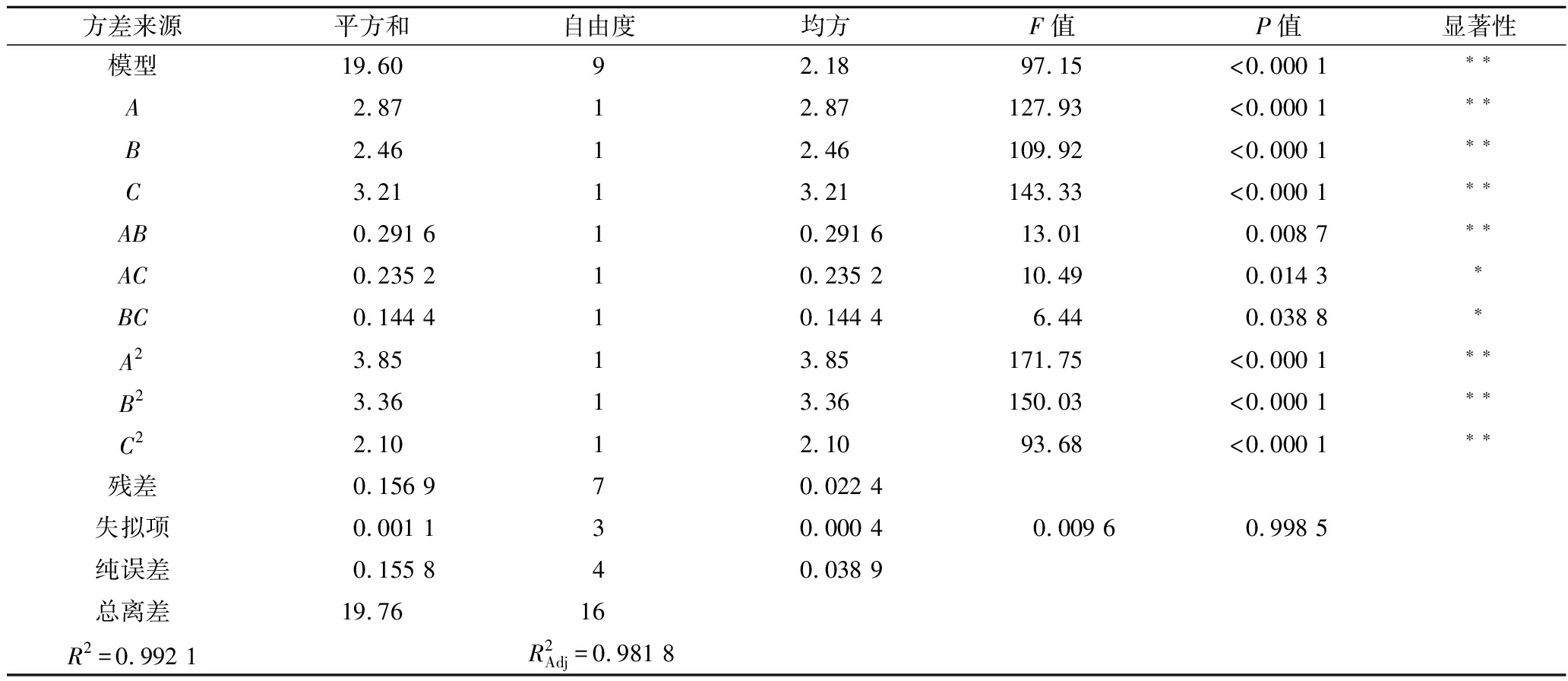
由表3可知,试验所选用的回归模型高度显著(P<0.000 1),失拟项P = 0.998 5>0.05不显著;模型![]() 说明该模型与实际相契合,建立较合理,试验误差小。由方差分析可知,葡萄糖(P<0.000 1)、酵母粉(P<0.000 1)、磷酸二氢钾(P<0.000 1)等均对草菇菌丝干重影响显著。
说明该模型与实际相契合,建立较合理,试验误差小。由方差分析可知,葡萄糖(P<0.000 1)、酵母粉(P<0.000 1)、磷酸二氢钾(P<0.000 1)等均对草菇菌丝干重影响显著。
表3 响应面试验方差分析
Table 3 Analysis of variance in response surface test
方差来源平方和自由度均方F值P值显著性模型19.6092.1897.15<0.000 1∗∗A 2.8712.87127.93<0.000 1∗∗B 2.4612.46109.92<0.000 1∗∗C 3.2113.21143.33<0.000 1∗∗AB0.291 610.291 613.010.008 7∗∗AC0.235 210.235 210.490.014 3∗BC0.144 410.144 46.440.038 8∗A23.8513.85171.75<0.000 1∗∗B23.3613.36150.03<0.000 1∗∗C22.1012.1093.68<0.000 1∗∗残差0.156 970.022 4失拟项0.001 130.000 40.009 60.998 5纯误差0.155 840.038 9总离差19.7616R2=0.992 1R2Adj=0.981 8
注:*代表同一组内有显著性差异(P<0.05),**代表同一组内有极显著性差异(P<0.01)
由图3可知,葡萄糖和酵母粉交互作用极显著(P<0.01),葡萄糖和磷酸二氢钾交互作用显著(P<0.05),酵母粉和磷酸二氢钾交互作用显著(P<0.05),F值越大影响越显著,响应面的梯度曲线曲面弯曲程度大,表示影响越显著。各因素对菌丝干重的影响顺序为磷酸二氢钾<酵母粉<葡萄糖,与回归结果分析相一致。
综合单因素及响应面试验结果,通过Design-Expert 12软件分析,影响草菇菌丝体干重的各因素最优值分别为葡萄糖20.60 g/L,酵母粉4.10 g/L,磷酸二氢钾2.30 g/L,此配方条件培养草菇,菌丝体干重(理论)达6.41 g/L。对最优配方条件组合进行5次验证试验,得草菇菌丝体干重为(6.45±0.03) g/L,相对误差为0.56 %,该结果确定采用响应面法优化草菇液体培养最佳营养条件是有效可行的。

图3 草菇菌丝液体培养基配方的响应面立体分析图
Fig.3 Stereoscopic analysis of the response surface of the formula of V.volvacea mycelium liquid medium
2.2 液体菌种与固体菌种对草菇生产性状的影响
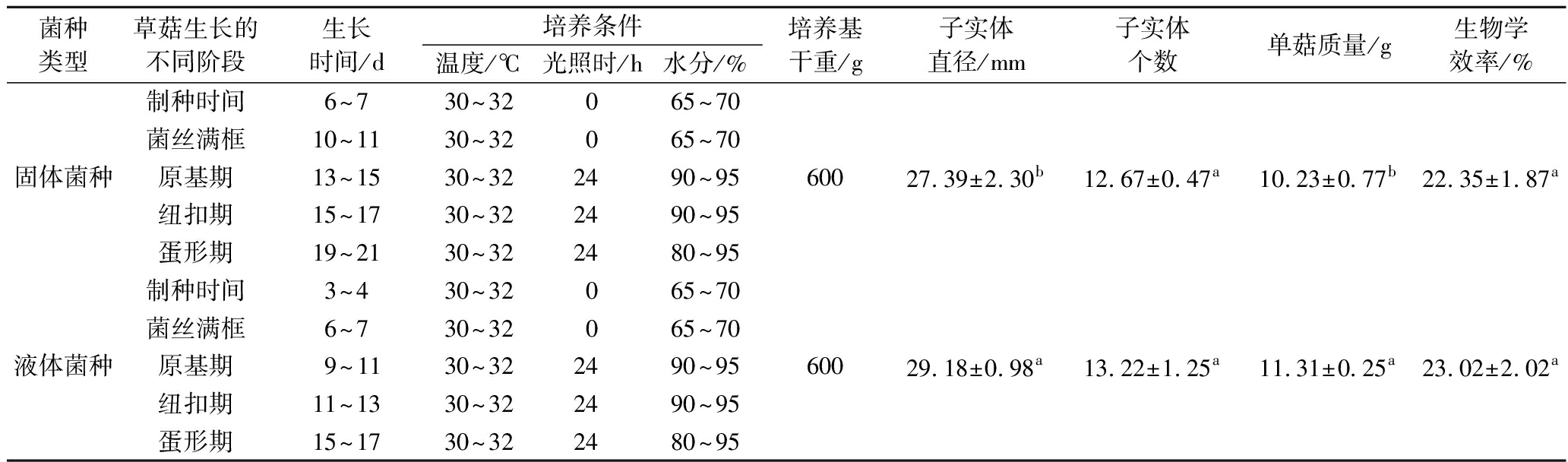
利用液体菌种和固体菌种同时进行草菇栽培试验,结果表明,两种菌种均能分化原基,长出正常子实体(图4)。由表4可知,固体菌种的制种时间较长,为6~7 d,液体菌种的制备时间仅需3~4 d,比固体菌种缩短了约3 d。以固体菌种栽培的草菇,原基出现时间为13~15 d,生产周期为19~21 d;液体菌种的原基出现时间为9~11 d,生产周期为15~17 d,较固体菌种缩短了约4 d。和固体菌种相比,液体菌种栽培的草菇子实体数目差异不显著(P>0.05);而子实体直径和单菇质量显著高于固体菌种(P<0.05);液体菌种的生物学效率为23.02%,较固体菌种提高2.3%,但差异不显著(P>0.05)。

A-固体菌种菌丝满框期;B-固体菌种原基形成期; C-固体菌种子实体蛋形期;D-液体菌种菌丝满框期; E-液体菌种原基形成期;F-液体菌种子实体蛋形期
图4 固液菌种栽培草菇
Fig.4 Cultivation of V.volvacea with solid and liquid strains
表4 固液菌种对草菇生产性状的影响
Table 4 Effects of solid and liquid strains on the production characters of V.volvacea
菌种类型草菇生长的不同阶段生长时间/d培养条件温度/℃光照时/h水分/%培养基干重/g子实体直径/mm子实体个数单菇质量/g生物学效率/%制种时间6~730~32065~70菌丝满框10~1130~32065~70固体菌种原基期13~1530~322490~9560027.39±2.30b12.67±0.47a10.23±0.77b22.35±1.87a纽扣期15~1730~322490~95蛋形期19~2130~322480~95制种时间3~430~32065~70菌丝满框6~730~32065~70液体菌种原基期 9~1130~322490~9560029.18±0.98a13.22±1.25a11.31±0.25a23.02±2.02a纽扣期11~1330~322490~95蛋形期15~1730~322480~95
注:表中数值为平均值±SD,n=3;每列中不同上标字母代表数值间的差异显著(P<0.05)
3 讨论
食用菌菌种相当于作物的种子,菌种的质量直接影响着食用菌的产量。培养基是由人工配制,为微生物的生长繁殖或积累代谢产物提供营养的基质,主要成分包括碳源、氮源、无机盐、水分等[19]。适宜的培养基营养组分和浓度是获得优质食用菌菌种的关键。响应面法可以连续地对多因素多水平进行系统分析,通过显著性检验、失拟项检测、相关性检验数据对比,找到最佳的变量组合及最优响应值[20]。焦雯姝等[21]通过响应面法优化乳酸乳球菌的液体培养基,得到乳酸乳球菌的最佳碳、氮源。代俊杰等[22]通过响应面法对羊肚菌栽培种培养基进行优化,显著提高了羊肚菌的子实体数量。本研究利用响应面法,对草菇液体菌种的培养基碳源、氮源和无机盐组分进行优化,提高了菌种质量,为草菇液体菌种生产提供参考。
碳源是食用菌最重要的营养源之一,为食用菌的生长发育提供能量。培养基中常添加的碳源有蔗糖、葡萄糖、麦芽糖、乳糖和果糖等。张萍等[23]研究表明,蔗糖、麦芽糖、葡萄糖均可作为草菇生长的碳源。余昌霞等[24]研究表明以葡萄糖为碳源时,草菇菌丝干重达到最大。本试验与以上研究结果相一致,草菇菌丝既可以利用单糖也可以利用双糖的碳源,但葡萄糖的效果最好,是草菇液体菌种的最适碳源。这可能是因为糖酵解途径可直接利用葡萄糖产生ATP,使菌丝快速生长;而双糖及多糖则需要在菌丝体分泌的胞外酶作用下水解为葡萄糖后才能被利用。
氮源是草菇细胞合成蛋白质和核酸的主要原料,在草菇菌种培养中起着关键作用。张萍等[23]研究表明,牛肉膏适宜于“草菇V110”的生长;任海霞等[11]研究发现,蛋白胨适宜于“草菇V901”菌丝生长。余昌霞等[24]研究表明,酵母浸粉是“草菇9715”的最佳氮源。本研究发现“草菇V844”以牛肉浸膏、蛋白胨、酵母粉为氮源时,菌丝均能较好地生长;以酵母粉为氮源时效果最好,草菇菌丝干重显著高于其他氮源(P<0.05)。这些结果表明,相比于单一组分的无机氮源,多组分的有机氮源因其营养物质更加丰富而更适合食用菌菌丝生长,而不同的草菇菌种,所适宜的氮源并不相同。
无机盐又称为矿物质,可以维持细胞正常的渗透压,调节细胞膜的通透性,参与生物体内许多重要的生理活动。在食用菌培养中,无机盐的添加会影响菌体的生长。CHI等[25]报道,培养基中添加磷酸二氢钾、硫酸镁时,桑黄的菌丝生物量较高。PARK等[26]研究发现,培养基中添加磷酸二氢钾,平菇的菌丝生物量最大。这与本研究结果一致,磷酸二氢钾在添加的5种无机盐中促进草菇菌丝生长的效果最好。磷酸二氢钾中含有生命活动中需要的两种重要的矿质元素——P和K。P元素是核酸、蛋白质、磷脂和ATP等成分的重要组成元素,影响着生物体的细胞分裂、能量代谢、遗传等重要过程[27]。K元素能够快速通过细胞膜,调节细胞渗透压[28];在细胞膜的K/Na 泵调节中起到重要作用,是许多酶促反应的激活剂[29]。
目前,液体菌种被越来越多地应用于食用菌工厂化、自动化生产。液体菌种生产时能及时排除菌种代谢过程中产生的CO2、挥发的醇、酮等气体[30],使菌丝体代谢旺盛,且所有菌龄相近,活力更强。而固体菌种培养时,菌丝自上而下生长,菌丝产生的气体难以排除,且菌龄上下不一致,生长速度较慢。本研究中的栽培试验发现,相比固体菌种,液体菌种能显著缩短草菇的生产周期,提高子实体的质量。这与香菇、金针菇[31]等液体菌种的生产效果相似。相对于固体菌种,液体菌种生产也有技术要求高、初期投资大、容易染菌等缺点,但随着产业化发展的需求,液体菌种广泛用于食用菌生产将是一个必然趋势。
4 结论
本研究通过单因素及响应面试验,将草菇液体菌种的培养配方优化为PDB培养基中添加葡萄糖20.60 g/L,酵母粉4.10 g/L,磷酸二氢钾2.30 g/L,此配方条件下培养草菇,其菌丝体干重达6.45 g/L,与理论值的相对误差为0.56%。依上述培养基配方制备液体菌种,以固体菌种为对照,进行栽培试验,结果表明,液体菌种的制种时间较固体菌种减少3 d,生产周期减少4 d,子实体直径和单菇重显著提高(P<0.05),生物学效率提高2.3%,但差异不显著(P>0.05)。本研究为草菇液体菌种制备和应用提供理论依据和技术支持。
[1] BAO D P, GONG M, ZHENG H J, et al.Sequencing and comparative analysis of the straw mushroom (Volvariella volvacea) genome[J].PLoS One, 2013, 8(3):e58294.
[2] 秦惠娟, 陈屏, 王琦, 等.草菇的化学成分、生物活性及栽培现状[J].食品工业, 2017, 38(3):203-206.
QIN H J, CHEN P, WANG Q, et al.The chemical composition, biological activity and cultivation situation of straw mushroom[J].The Food Industry, 2017, 38(3):203-206.
[3] CHEN P, QIN H J,LI Y W, et al.Study on chemical constituents of an edible mushroom Volvariella volvacea and their antitumor activity in vitro[J].Natural Product Research,2018,34(10):1 417-1 422.
[4] 何焕清, 肖自添, 彭洋洋, 等.草菇栽培技术发展历程与创新研究进展[J].广东农业科学, 2020, 47(12):53-61.
HE H Q, XIAO Z T, PENG Y Y, et al.Development history and innovation research progress of straw mushroom cultivation technology[J].Guangdong Agricultural Sciences, 2020, 47(12):53-61.
[5] 游华芳, 张玲, 李正鹏, 等.不同培养料培养草菇菌种及应用比较试验[J].食用菌, 2021, 43(3):33-34;37.
YOU H F, ZHANG L, LI Z P, et al.Comparative test on the cultivation of Volvariella volvacea strains with different media and their application[J].Edible Fungi, 2021, 43(3):33-34;37.
[6] 钟丽娟, 赵新海.漏斗多孔菌液体菌种培养基及其栽培条件[J].菌物学报, 2021, 40(12):3 118-3 128.
ZHONG L J, ZHAO X H.Liquid culture medium and cultivation conditions of Polyporus arcularius[J].Mycosystema, 2021, 40(12):3 118-3 128.
[7] 郭静利, 刘旭.食用菌液体和固体制种技术比较经济效益分析[J].中国农业科学, 2011, 44(4):835-841.
GUO J L, LIU X.Comparison between liquid culture and solid culture technologies for edible mushroom spawn production and analysis on their economic benefits[J].Scientia Agricultura Sinica, 2011, 44(4):835-841.
[8] 文晴, 张少康, 刘元栋, 等.平菇不同类型菌种及接种方式比较试验[J].食用菌, 2021, 43(3):43-45;48.
WEN Q, ZHANG S K, LIU Y D, et al.Comparative test of different types of Pleurotus ostreatus and inoculation methods[J].Edible Fungi, 2021, 43(3):43-45;48.
[9] 张伟彤, 姚方杰, 方明, 等.珊瑚猴头液体菌种及对栽培效果的研究[J].东北农业科学, 2021, 46(2):125-131.
ZHANG W T, YAO F J, FANG M, et al.Study on liquid culture of Hericium coralloides and its cultivation effects[J].Journal of Northeast Agricultural Sciences, 2021, 46(2):125-131.
[10] 周峰, 李巧珍, 杨仁智, 等.香菇液体菌种与固体菌种的生产成本和使用效果分析[J].食药用菌, 2017, 25(3):199-202;204.
ZHOU F, LI Q Z, YANG R Z, et al.Analysis of production cost and use effect of liquid and solid mushrooms of Lentinus edodes[J].Edible and Medicinal Mushrooms, 2017, 25(3):199-202;204.
[11] 任海霞, 杨鹏, 曲玲, 等.草菇液体菌种培养条件优化研究[J].山东农业科学, 2014, 46(1):58-60.
REN H X, YANG P, QU L, et al.Optimization of liquid culture conditions for Volvariella volvacea[J].Shandong Agricultural Sciences, 2014, 46(1):58-60.
[12] 杨明华, 毛小伟, 陈小平, 等.草菇床式栽培技术[J].食用菌, 2021, 43(2):56-57.
YANG M H, MAO X W, CHEN X P, et al.Volvariella volvacea bed cultivation techniques[J].Edible Fungi, 2021, 43(2):56-57.
[13] 余昌霞, 陈明杰, 李传华, 等.不同培养基质对草菇营养成分及呈味物质的影响[J].菌物学报, 2018, 37(12):1 731-1 740.
YU C X, CHEN M J, LI C H, et al.Effects of culture substrates on nutritional and flavor components of Volvariella volvacea[J].Mycosystema, 2018, 37(12):1 731-1 740.
[14] 余昌霞, 陈明杰, 李正鹏, 等.草菇9715液体菌种培养过程的生理变化及培养终点[J].微生物学通报, 2020, 47(2):665-672.
YU C X, CHEN M J, LI Z P, et al.Physiological changes of Volvariella volvacea 9715 during submerged spawn culture[J].Microbiology China, 2020, 47(2):665-672.
[15] 王永菲, 王成国.响应面法的理论与应用[J].中央民族大学学报(自然科学版), 2005, 14(3):236-240.
WANG Y F, WANG C G.The application of response surface methodology[J].Journal of Minzu University of China(Natural Science Edition), 2005, 14(3):236-240.
[16] LI H B, HE Z X, JIANG Y Z, et al.Bioconversion of bamboo shoot shells through the cultivation of the edible mushrooms Volvariella volvacea[J].Ecotoxicology, 2021, 30(7):1 476-1 486.
[17] 余昌霞, 李正鹏, 查磊, 等.不同光质对草菇菌丝生长及子实体性状的影响[J].食用菌学报, 2021, 28(3):72-77.
YU C X, LI Z P, ZHA L, et al.Effects of light quality on mycelial growth and fruiting body characteristics of Volvariella volvacea[J].Acta Edulis Fungi, 2021, 28(3):72-77.
[18] REN Y Y, SUN P P, LI H R, et al.Effects of Na2SeO3 on growth, metabolism, antioxidase and enzymes involved in polysaccharide synthesis of Cordyceps militaris[J].Process Biochemistry, 2020, 97:64-71.
[19] TIGINI V, PRIGIONE V, DONELLI I, et al.Influence of culture medium on fungal biomass composition and biosorption effectiveness[J].Current Microbiology, 2012, 64(1):50-59.
[20] ABE Y, EMORI K.Application of a statistical approach to the process development of futibatinib by employing quality-by-design principles.part 2:Development of design space for impurities using the response surface methodology[J].Organic Process Research and Development, 2022, 26(1):56-71.
[21] 焦雯姝, 关嘉琦, 史佳鹭, 等.响应面法优化乳酸乳球菌KLDS4.0325产叶酸的培养基成分及发酵条件[J].食品科学, 2020, 41(6):123-130.
JIAO W S, GUAN J Q, SHI J L, et al. Optimization of medium composition and fermentation conditions for folate production by Lactococcus lactis KLDS4.0325 by response surface methodology[J].Food Science, 2020, 41(6):123-130.
[22] 代俊杰, 黎智文, 李晓.响应面法优化羊肚菌栽培种培养基[J].分子植物育种, 2018, 16(24):8 162-8 167.
DAI J J, LI Z W, LI X.Optimization of Morchella cultivars medium by response surface methodology[J].Molecular Plant Breeding, 2018, 16(24):8 162-8 167.
[23] 张萍, 蒋小满,卜庆梅, 等.不同营养条件对草菇液体培养的影响[J].江苏农业科学, 2005,33(5):97-99.
ZHANG P, JIANG X M, BU Q M, et al.Effects of nutrients factors on the liquid cultivated Volvariella valvacea[J].Jiangsu Agricultural Sciences, 2005, 33(5):97-99.
[24] 余昌霞, 李正鹏, 赵妍, 等.草菇液体菌种培养基配方及培养条件的优化[J].上海农业学报, 2020, 36(5):41-45.
YU C X, LI Z P, ZHAO Y, et al.Optimization of cultivation medium and culture conditions for liquid spawn of Volvariella volvacea[J].Acta Agriculturae Shanghai, 2020, 36(5):41-45.
[25] CHI J H, HA T M, KIM Y H, et al.Studies on the main factors affecting the mycelial growth of Phellinus linteus[J].The Korean Journal of Mycology, 1996, 24(3):214-222.
[26] PARK K S, LEE J S.Optimization of media composition and culture conditions for the mycelia growth of Coriolus versicolor and Lentinus edodes[J].Korean Society for Biotechnology and Bioengineering Journal, 1991, 6 (1):91-98.
[27] S NCHEZ-BARRENA M J, CHAVES-SANJUAN A, RADDATZ N, et al.Recognition and activation of the plant AKT1 potassium channel by the kinase CIPK23[J].Plant Physiology, 2020, 182(4):2 143-2 153.
NCHEZ-BARRENA M J, CHAVES-SANJUAN A, RADDATZ N, et al.Recognition and activation of the plant AKT1 potassium channel by the kinase CIPK23[J].Plant Physiology, 2020, 182(4):2 143-2 153.
[28] SONG W Y, SEUNG H A, SHIN S J.Impact of sodium or potassium cations in culture medium to ethanol fermentation by Saccharomyces cerevisiae[J].Journal of Korea Technical Association of the Pulp and Paper Industry, 2015, 47(1):17-23.
[29] VEDOVATO N, GADSBY D C.Route, mechanism, and implications of proton import during Na+/K+ exchange by native Na+/K+ ATPase pumps[J].Journal of General Physiology, 2014, 143(4):449-464.
[30] 颜松. 真姬菇液体发酵工艺优化及发酵产物分析[D].福州:福建农林大学, 2008.
YAN S.The optimization for the liquid fermentation technics of Hypsizigus marmoreus and analysis of the fermengtation production[D].Fuzhou:Fujian Agriculture and Forestry University, 2008.
[31] 张文武, 刘艳, 邵小军, 等.金针菇液体与固体菌种制作及栽培对比试验[J].中国食用菌, 2012, 31(5):65.
ZHANG W W, LIU Y, SHAO X J, et al.Comparative experiment on production and cultivation of Flammulina velutipes liquid and solid strains[J].Edible Fungi of China, 2012, 31(5):65.