四川泡菜由于其风味独特、营养丰富以及多样的保健功效受到众多消费者的喜爱[1]。在泡菜发酵环境中,腐败微生物之间可以通过群体感应(quorum sensing, QS)系统对环境信号分子做出反应来调节其腐败潜力。QS系统是指微生物依赖于群体密度而调节其生理行为的一种机制[2]。其中LuxS/AI-2型QS系统广泛存在于革兰氏阴性菌和革兰氏阳性菌中,被认为是种内和种间的通用语言。越来越多的研究发现食品腐败可能受QS系统的调控。ZHANG等[3]发现假单胞菌和欧文氏菌通过产生AI-2信号分子调控了蔬菜的腐败表型。黎凡[4]从金华火腿中分离出了优势葡萄球菌,转录组学分析发现其中存在AI-2/LuxS群体感应系统,该系统通过调节腐生葡萄球菌醛类化合物合成通路、氨基酸代谢以及脂肪酸代谢中的相关基因,影响其产风味能力。
群体感应抑制剂(quorum sensing inhibitor, QSI)通过干扰信号分子合成、集聚或者与受体蛋白结合从而抑制由细菌QS引起的腐败表征[5]。研究发现,Stenotrophomonas maltophilia 4-1通过QS系统的调节,形成生物被膜和分泌胞外酶导致新鲜蔬菜和发酵食品的腐败[6]。荧光假单胞菌通过QS系统的调节,有效缩短了自身培养过程的延滞期,从而加速了乳制品的腐败速率[7]。以上研究表明,QS通过调控腐败菌群体性生理行为从而影响了食品的腐败变质。QSI通过干扰群体行为以及抑制相关基因的表达达到防腐的目的,因此为食品防腐开辟了新的路径。D-核糖无毒害,常被用作医药原料、保健品以及食品添加剂[8],并且与AI-2具有相似的呋喃硼酸二酯结构,而这种相似性被认为会导致AI-2与D-核糖之间竞争,因此D-核糖已被用作一种QSI来抑制各种腐败菌生物被膜的形成。
LEE等[9]研究发现,将不同浓度的D-核糖与变形链球菌(Streptococcus mutans)以及茸毛链球菌(Streptococcus sobrinus)共培养后,D-核糖有效的抑制了这两株菌生物被膜的形成,且浓度越高抑制效果越明显。同样地,LIU等[10]研究也发现,D-核糖对类植物乳杆菌(Lactobacillus paraplantarum)L-ZS9生物被膜的抑制能力与D-核糖的浓度呈正相关。本实验室前期研究发现[2],将100 mmol/L D-核糖加入泡菜发酵液中对维持泡菜中乳酸菌的比例具有积极作用。为了探究100 mmol/L D-核糖对四川泡菜腐败的影响,将实验室前期筛选的4株与泡菜腐败有关的微生物阴沟肠杆菌(Enterobacter cloacae)、克雷伯氏杆菌(Klebsiella Trevisan)、普罗维斯登菌(Providencia ewing)和弗氏柠檬酸杆菌(Citrobacter freundii)分别添加到泡菜发酵液中,并将D-核糖外源添加到含有这4株腐败微生物的泡菜发酵液中,观察其膜醭的形成以及pH的变化情况,并进一步分析D-核糖对这4株腐败菌生理特性的影响,以期为今后开发新型泡菜防腐保鲜剂提供新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 泡菜制备
泡菜原料为白皮黄瓜。将新鲜的黄瓜用清水洗净,晾干表面水分,然后把黄瓜切成长宽厚为3 cm×1 cm×1 cm的小块。对照组:取150 g黄瓜于500 mL的塑料泡菜罐中,向坛中加入195 mL 60 g/L的食盐水和5 mL老盐卤,再向坛中分别加入2 mL 1×108 CFU/mL的腐败菌菌液,共4株腐败菌。处理组:同对照组泡制方法,最后添加D-核糖,本研究采用D-核糖的有效作用浓度为100 mmol/L[2]。每组3个平行,置于25 ℃培养箱恒温发酵。
1.1.2 实验菌株
阴沟肠杆菌(Enterobacter cloacae)、克雷伯氏杆菌(Klebsiella Trevisan)、普罗维斯登菌(Providencia ewing) 和弗氏柠檬酸杆菌(Citrobacter freundii)为本实验室从腐败泡菜中分离得到。大肠杆菌(Escherichia coli) DH5α、报告菌株:哈维氏弧菌BB152(Vibrio harveyi)BB152、BB170为中国农业科学院上海兽医研究所韩先干研究员赠送。
1.1.3 培养基
LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,调节pH值至7.4,121 ℃灭菌15 min后备用。
AB培养基:A:0.05 mol/L MgSO4,0.3 mol/L NaCl,0.2%(质量分数)无维生素酪蛋白,用KOH溶液调节pH值至7.5,121 ℃灭菌15 min。B:10 mL 1 mol/L 磷酸氢二钾,10 mL 0.1 mol/L L-精氨酸,20 mL 50%(体积分数)甘油,均用0.22 μm滤器过滤,现配现用。
1.1.4 试剂
D-核糖(食品级),成都科龙化工试剂厂。
1.2 仪器与设备
JA2003电子天平,上海舜宇恒平科学仪器有限公司;冷冻离心机,美国Thermo Fisher Scientifi公司;SYD-DSX-280B立式压力蒸汽灭菌锅,上海申安医疗器械厂;DHG-9162电热恒温培养箱,上海一恒科技有限公司;SpectraMax® 酶标仪,美谷子仪器(上海)有限公司;Sigma 300扫描电子显微镜,德国ZEISS;P-4661精密pH试纸,Sigma公司。
1.3 实验方法
1.3.1 pH值的测定
每天用精密pH试纸检测pH值并记录。
1.3.2 膜醭形成情况
每天观察膜醭并记录形成情况,膜醭形态观察标准如表1所示。
表1 膜醭形成等级记录
Table 1 Grade record table of the pellicle formation
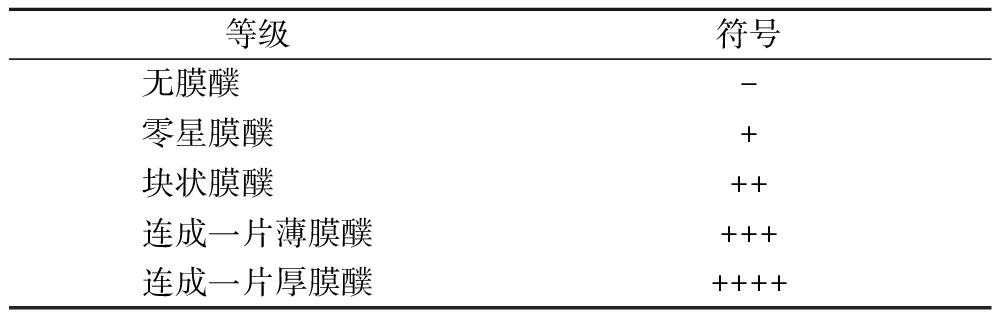
等级符号无膜醭 -零星膜醭 +块状膜醭 ++连成一片薄膜醭+++连成一片厚膜醭++++
1.3.3 生长曲线的测定
将P.ewing 、K.Trevisan 、C.freundii以及E.cloacae分别以1%的接种量接种于LB 培养基中,并添加终浓度为100 mmol/L 的D-核糖,以不添加D-核糖作为空白对照;37 ℃、180 r/min培养48 h,每3 h 取样,测定OD600nm吸光值。
1.3.4 生物膜的测定
生物被膜的测定采用结晶紫染色法[2]。将P.ewing、K.Trevisan、C.freundii以及E.cloacae分别接种于LB 培养基中,分别添加终浓度为100 mmol/L的D-核糖,以不添加D-核糖作为空白对照。将培养液加至96孔细胞培养板中,每孔200 μL,37 ℃ 静置培养36 h。培养结束后用PBS冲洗3 次,去除悬浮菌体,室温晾干。每孔加入200 μL质量分数为0.1%的结晶紫溶液,室温染色30 min,无菌水轻柔冲洗至洗液无色为止,室温晾干后加200 μL 无水乙醇充分溶解结晶紫。检测OD595nm吸光值。
1.3.5 扫描电镜观察D-核糖对4株腐败菌生物被膜形态的影响
根据ROY等[11]的方法适当调整,采用扫描电镜观察D-核糖对腐败菌生物被膜形态的影响。将无菌盖玻片放置于6孔培养板中,向其中添加终浓度为100 mmol/L D-核糖的LB培养基,以不添加D-核糖作为空白对照,最后分别接种对数生长期的4株腐败菌,37 ℃、静置培养48 h后,将盖玻片取出用2.5%(体积分数)戊二醛固定5 h,然后在20%、40%、60%、80%和100%(体积分数)乙醇中脱水3次,-20 ℃预冻12 h后再置于冷冻干燥机干燥36 h,溅射镀金后镜检拍照。
1.3.6 D-核糖对腐败微生物AI-2活性的影响
D-核糖对腐败微生物AI-2活性的影响,根据ZHU等[12]的方法做适当调整。先将4株腐败菌接种于含有100 mmol/L D-核糖的LB培养基中,其中对照组不含D-核糖。37 ℃、200 r/min振荡培养24 h,再转入含和不含100 mmol/L D-核糖12%脱脂乳培养基中37 ℃、200 r/min振荡培养72 h,期间取6、12、24、36、48、72 h的培养物上清液,4 ℃、12 000×g离心10 min,使用0.22 μm无菌水系滤头过滤,得培养上清液并且调节pH值到7.0。用AB培养基将V.harveyi BB170按1∶5 000(体积比)稀释,并将离心得到的培养上清液以1∶10(体积比)添加到稀释的BB170培养物中,28 ℃、200 r/min 振荡培养5 h后,取200 μL于白色酶标板,用多功能酶标仪生物发光模式检测发光强度,重复5孔。
将V.harveyi BB152接种于MB培养基中,28 ℃、200 r/min振荡培养24 h后,4 ℃、12 000×g离心10 min,使用0.22 μm 无菌水系滤头过滤,得阳性对照培养上清液。
E.coli DH5α阴性对照获取上清液的方法与膜醭腐败菌上清液制作方法相同。
1.4 数据分析
所有测试重复进行平行试验3次,用 GraphPad Prism 8.0软件进行统计分析(Two-way ANOVA)及作图。
2 结果与分析
2.1 泡菜pH的变化情况
在发酵初期,E.cloacae对照组以及处理组的pH值由发酵第1天的5.5逐渐降低至第3天的3.5,二者变化基本一致。随着发酵的进行,E.cloacae对照组的pH值从第7天开始逐渐升高,并最终达到发酵终点的6.5,而E.cloacae处理组的pH值却能较好的稳定在3.5左右,如图1-A所示。类似的结果出现在P.ewing 、K.Trevisan 、C.freundii 中,如图1-B~图1-D所示。以上结果表明,D-核糖能有效维持泡菜盐卤的pH值。
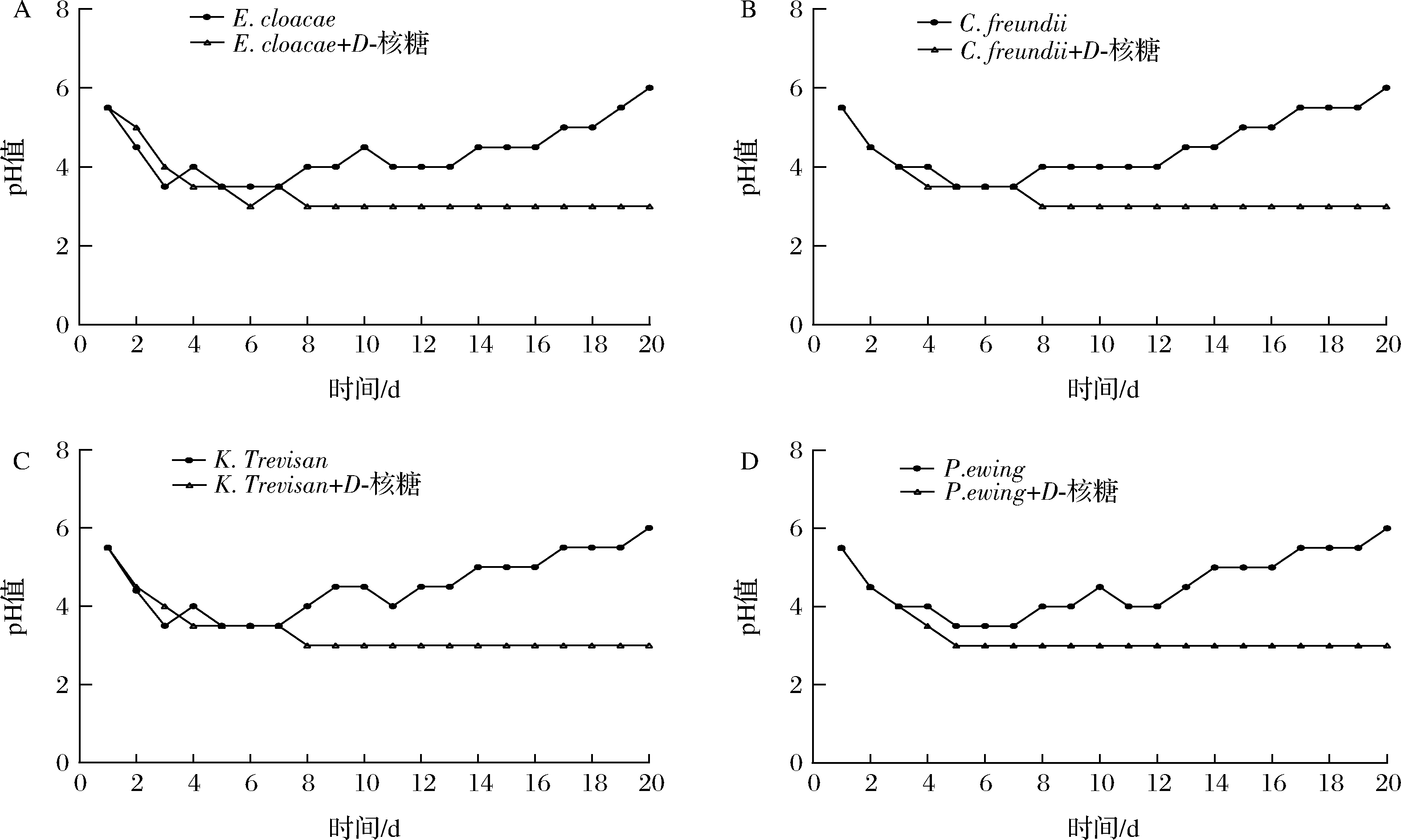
A-E.cloacae;B-C.freundii;C-K.Trevisan;D-P.ewing
图1 加入E.cloacae、C.freundii、K.Trevisan、及P.ewing后泡菜pH的变化
Fig.1 The pH changes of pickle after adding E.cloacae, C.freundii, K.Trevisan, and P.ewing
pH变化是衡量四川泡菜发酵进程的重要指标。当pH≤4时,一般认为泡菜基本成熟[13]。随着发酵的进行,pH值长时间维持在3.0~3.5左右,低pH抑制了大多数腐败微生物的生长[14]。发酵后期由于某些微生物代谢有机酸进行二次发酵使得泡菜pH升高,腐败菌开始生长[15]。本实验中泡菜盐卤pH上升可能是腐败菌代谢有机酸导致的,D-核糖对泡菜盐卤pH有效的维持,也许与其影响腐败菌利用有机酸的能力有关。
2.2 加入产膜细菌后泡菜中膜醭的形成情况
E.cloacae泡菜组、K.Trevisan泡菜组、C.freundii泡菜组以及P.ewing泡菜组陆续在第7、5、9、5 天出现膜醭,与对照组相比,D-核糖处理组膜醭形成时间分别推迟了3、2、5、9 d,如表2和图2所示。其中,D-核糖对P.ewing泡菜组膜醭抑制效果最好,对膜醭的抑制作用长达9 d。以上结果表明,D-核糖对泡菜膜醭的形成有明显的抑制作用。
表2 添加不同产膜细菌后泡菜的产膜情况
Table 2 Pellicle production of pickled after adding different pellicle-producing bacteria

时间/dE.cloacaeK.TrevisanC.freundiiP.ewing加D-核糖不加D-核糖加D-核糖不加D-核糖加D-核糖不加D-核糖加D-核糖不加D-核糖1--------2--------3--------4--------5---+---+6---++---+++7-++++---+++8-++++---+++9-++++-+-+++10+++++++-+-+++11++++++++-+-+++12++++++++-++-+++13+++++++++-++-+++14++++++++++++++++15+++++++++++++++16+++++++++++++++++17++++++++++++++++++18+++++++++++++++++++19+++++++++++++++++++20+++++++++++++++++++
膜醭即在空气与液体交界面,被细胞自身分泌的胞外大分子包裹使得单细胞个体相互黏附在一起的、有组织的细胞群体;其先形成薄的膜醭,再变厚,随后形成成熟膜醭[16]。生物被膜是指细菌不可逆的附着于惰性或活性实体表面,经繁殖、分化,并分泌一些多糖基质将菌体群落包裹于其中,而形成的细菌聚集体膜状物;其形成主要包括定殖、黏附、微菌落形成、成熟以及脱离和再定殖5个阶段[17]。膜醭是一种特殊的生物被膜[18],是发酵蔬菜腐败的最常见现象之一。研究发现,一些细菌和真菌都可以引起发酵蔬菜表面腐败膜醭的形成,枯草芽孢杆菌(Bacillus subtilis)、C. freundii、居幼虫普罗威登斯菌(Providencia vermicola)、E. cloacae等细菌能够引起发酵蔬菜表面膜醭的形成[18],克鲁维毕赤酵母(Pichia kluyveri)、白地霉(Galactomyces candidum)、膜醭毕赤酵母(Pichia membranefaciens)等真菌能够引起发酵蔬菜表面膜醭的形成[19]。本实验中,腐败菌的接入也导致了发酵蔬菜的腐败,与以上研究结果相似。此外,D-核糖对泡菜膜醭的抑制作用可能是影响了腐败菌的某些生理行为的结果。
2.3 D-核糖对4株腐败微生物生长的影响
E.cloacae 、K.Trevisan 、C.freundii以及P.ewing分别在10~12 h左右步入平稳期,如图3所示。与对照组相比,D-核糖的加入并未改变腐败微生物的生长趋势。以上结果表明D-核糖对4株腐败微生物的生长并无显著性的影响。
QSI是一类干扰细菌QS的物质的统称,不能杀死细菌或抑制细菌生长,但能干扰细菌的QS系统,从而抑制相关基因的表达而达到防腐败的目的[20]。实验室前期从四川泡菜中筛选了4株特征腐败菌热生泛菌(Pantoea calida)、Pantoea anthophila、菠萝泛菌(Pantoea ananatis)以及腐生葡萄球菌(Staphylococcus saprophyticus),发现D-核糖处理后对其生长并无显著性的影响[2];还有一些研究发现,D-核糖对枯草芽孢杆菌(Bacillus subtilis)BS-15和植物乳植杆菌(Lactiplantibacillus plantarum)RX-8以及L.paraplantarum L-ZS9的生长也无影响[10,20]。本研究结果与以上研究结果相似。综上所述,D-核糖可能是一种理想的QSI,并不会对细菌的生长造成压力。

图2 添加不同产膜细菌后泡菜的产膜情况
Fig.2 Pellicle production of pickled after adding different pellicle-producing bacteria
2.4 D-核糖对4株腐败微生物生物被膜的影响
对P.ewing、K.Trevisan、C.freundii以及E.cloacae的生物被膜形成能力进行检测发现,P.ewing的生物被膜的形成能力最强(OD595nm值为2.902),而K.Trevisan生物被膜的形成能力最弱(OD595nm值为2.164);D-核糖加入后,E.cloacae、K.Trevisan、C.freundii以及P.ewing生物被膜的形成分别降低了42.5%、42.7%、23.4%以及22.5%,如图4所示。以上结果表明,100 mmol/L D-核糖可以显著抑制P.ewing、K.Trevisan、C.freundii以及E.cloacae生物被膜的形成。
细菌生活在被称为生物被膜的密集且多样化的群落中,这是微生物生活的一种主要模式[21]。生物被膜有助于微生物在不利的环境中生存[22],因此增强了腐败菌的抗逆能力,使其在低酸、高渗透压的泡菜环境下更好的产生胞外多糖以及植物细胞壁降解酶等腐败因子,加速了泡菜的腐败进程。RYU等[23]研究表明,D-半乳糖能够显著抑制具核梭杆菌(Fusobacterium nucleatum)、牙龈卟啉单胞菌(Porphyromonas gingivalis)和福赛坦氏菌(Tannerella forsythia)生物被膜的形成;SHAO等[24]发现核糖可与AI-2竞争结合RbsB,从而导致伴放线凝聚杆菌(Aggregatibacter actinomycetemcomitan)生物被膜生成减少。本研究结果与以上研究结果相似,D-核糖可能显著抑制腐败微生物生物被膜的形成,从而延缓了四川泡菜的腐败。

A-E.cloacae;B-C.freundii;C-K.Trevisan;D-P.ewing
图3 D-核糖对E.cloacae、C.freundii、K.Trevisan及P.ewing生长曲线的影响
Fig.3 Effects of D-ribose on growth of E.cloacae, C.freundii, K.Trevisan, and P.ewing
2.5 扫描电镜观察D-核糖对4株腐败菌生物被膜的影响
扫描电镜进一步观察4株腐败菌的生物被膜发现,C.freundii、K.Trevisan、P.ewing以及E.cloacae在盖玻片上形成了紧密的生物被膜,其中P.ewing最为明显。在加入D-核糖后,4株腐败菌无法形成紧密的生物被膜,呈现单菌形式分布,如图5所示。以上结果表明,D-核糖对4株腐败菌生物被膜具有明显的抑制作用。
扫描电镜实验结果与2.4结果相同,都证明了D-核糖对腐败菌的生物被膜有明显的抑制作用。相关研究发现,D-核糖作为一种QSI,可以影响群体行为,并不会对细菌的生长造成压力[2,10,20]。综合2.3的结果,D-核糖的加入并未影响C.freundii、K.Trevisan、P.ewing以及E.cloacae的生长。因此图5中D-核糖处理后视野中细胞数量减少,不是由于D-核糖影响了腐败菌的活菌数,而可能是因为抑制了生物被膜,从而降低了黏附在载玻片上的生物量。
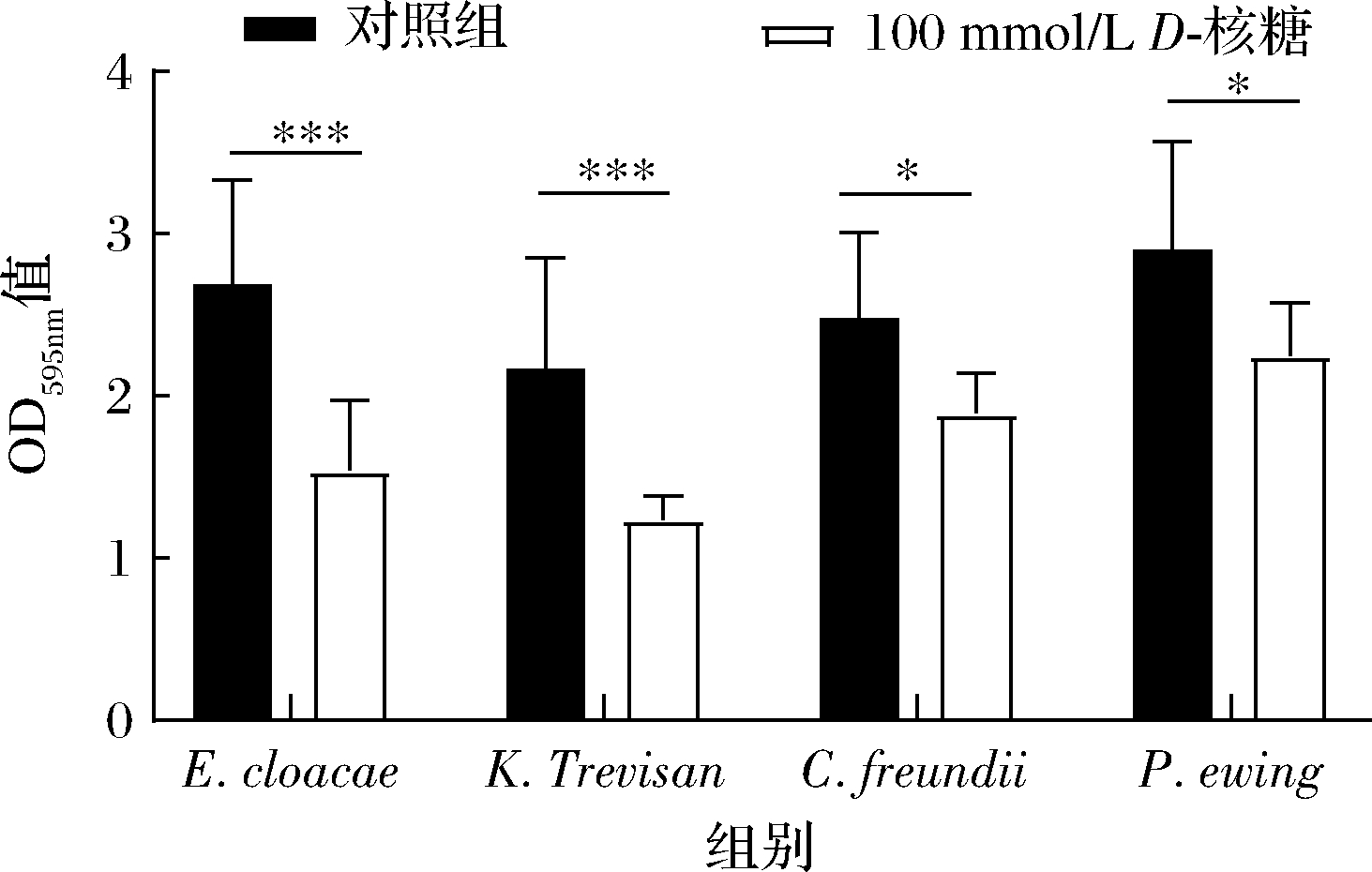
图4 D-核糖对E.cloacae 、K.Trevisan 、C.freundii及 P.ewing生物被膜的影响
Fig.4 Effects of D-ribose on biofilim formation of E.cloacae, K.Trevisan, C.freundii, and P.ewing 注:*表示差异显著(P<0.05),**表示差异很显著(P<0.01), ***表示差异十分显著(P<0.001)(下同)

图5 D-核糖对C.freundii、K.Trevisan、P.ewing以及 E.cloacae生物被膜的影响
Fig.5 Effects of D-ribose on biofilm of C.freundii, K.Trevisan, P.ewing, and E.cloacae
2.6 D-核糖对4株腐败微生物AI-2活性的影响
C.freundii、K.Trevisan、P.ewing以及E.cloacae的荧光强度在6~12 h逐渐增加,于24 h达到峰值后,又逐渐降低。与对照组相比,D-核糖存在时E.cloacae 、K.Trevisan、C.freundii以及P.ewing的荧光强度分别降低了11.57、6.39、2.84、8.68倍,如图6所示。以上结果表明,D-核糖的加入对4株腐败微生物AI-2的活性均有显著的抑制作用。

A-E.cloacae;B-C.freundii;C-K.Trevisan;D-P.ewing
图6 D-核糖对E.cloacae、C.freundii、K.Trevisan以及P.ewingAI-2活性的影响
Fig.6 Effects of D-ribose on AI-2 activity E.cloacae, C.freundii, K.Trevisan, and P.ewing
AI-2信号分子随着细菌密度的增多而增加,但当其浓度达到一定阈值时,AI-2会发生内化作用[25-26]。因此本研究4株腐败菌24 h后荧光强度减弱可能是内化作用导致的。与本研究结果相似,AN等[27]发现D-阿拉伯糖使口腔细菌口腔链球菌(Streptococcus oralis)、F. nucleatum以及P.gingivalis的AI-2活性被显著抑制。还有研究发现,呋喃酮能够抑制金黄色葡萄球菌、铜绿假单胞菌等细菌培养上清液中AI-2的活性[28]。此外,大量研究证实AI-2/LuxS型QS系统调控着腐败菌生物被膜的形成[25,28];综合2.5的研究结果分析,D-核糖可能通过影响腐败微生物的AI-2活性,从而显著抑制了其生物被膜的形成。
3 结论
本研究通过在泡菜液中外源添加群体感应抑制剂D-核糖,观察对分别加有腐败菌E.cloacae、K.Trevisan、C.freundii以及P.ewing的泡菜发酵液的影响;并对D-核糖处理后泡菜盐卤的pH、各产膜腐败微生物的生长情况、生物被膜的形成情况、AI-2的活性进行了分析。结果表明,D-核糖的加入对泡菜膜醭的形成有明显的抑制作用,有效维持了泡菜盐卤的低pH环境,延缓了泡菜腐败。同时,对于单一腐败菌,D-核糖处理后,在不影响生长的情况下,其生物被膜的形成、AI-2的活性均受到显著抑制。因此,D-核糖可能是延缓泡菜腐败的一种良好选择,并且为发酵食品防腐保鲜技术的开发提供新的思路。
[1] LIU L, TAO Y F, LI Y F, et al.Isolation and characterization of bacteria that produce quorum sensing molecules during the fermentation and deterioration of pickles[J].International Journal of Food Microbiology, 2022, 379:109869.
[2] 刘蕾, 李娅琳, 聂蓉, 等.D-核糖及肉桂醛对四川泡菜菌群多样性和生物被膜的影响[J].食品科学, 2019, 40(22):53-61.
LIU L, LI Y L, NIE R, et al.Effects of D-ribose and cinnamaldehyde on the flora diversity and biofilm of Sichuan pickle[J].Food Science, 2019, 40(22):53-61.
[3] ZHANG Y, KONG J, HUANG F, et al.Hexanal as a QS inhibitor of extracellular enzyme activity of Erwinia carotovora and Pseudomonas fluorescens and its application in vegetables[J].Food Chemistry, 2018, 255:1-7.
[4] 黎凡. 基于AI-2/LuxS群体感应系统金华火腿优势菌群风味形成机制的研究 [D].杭州:浙江工商大学, 2020.
LI F.Research on the flavor formation mechanism of Jinhua ham dominant flora based on AI-2/LuxS quorum sensing system[D].Hangzhou:Zhejiang Gongshang University, 2020.
[5] 齐莉莉, 陈炳, 王进波.群体感应抑制剂研究进展[J].生命的化学, 2016, 36(3):311-314.
QI L L, CHEN B, WANG J B.Research progress of quorum sensing inhibitors[J].Chemistry of Life, 2016, 36(3):311-314.
[6] ZHANG Y X, WEI J P, QIU Y, et al.Structure-dependent inhibition of Stenotrophomonas maltophilia by polyphenol and its impact on cell membrane[J].Frontiers in Microbiology, 2019, 10:2646.
[7] 励建荣, 李婷婷, 王当丰.微生物群体感应系统及其在现代食品工业中应用的研究进展[J].食品科学技术学报, 2020, 38(1):1-11.
LI J R, LI T T, WANG D F.Research progress of microbial quorum sensing system and its application in modern food industry[J].Journal of Food Science and Technology, 2020, 38(1):1-11.
[8] TURCK D, CASTENMILLER J, DE HENAUW S D, et al.Statement on the safety of D-ribose[J].EFSA journal European Food Safety Authority, 2018, 16(12):e05485.
[9] LEE H J, KIM S C, KIM J, et al.Synergistic inhibition of Streptococcal biofilm by ribose and xylitol[J].Archives of Oral Biology, 2015, 60(2):304-312.
[10] LIU L, WU R Y, ZHANG J L, et al.D-Ribose interferes with quorum sensing to inhibit biofilm formation of Lactobacillus paraplantarum L-ZS9[J].Frontiers in Microbiology, 2017, 8:1860.
[11] ROY P K, SONG M G, PARK S Y.Impact of quercetin against Salmonella typhimurium biofilm formation on food-contact surfaces and molecular mechanism pattern[J].Foods (Basel, Switzerland), 2022, 11(7):977.
[12] ZHU J, HUANG X, ZHANG F, et al. Inhibition of quorum sensing, biofilm, and spoilage potential in Shewanella baltica by green tea polyphenols[J]. Journal of microbiology, 2015, 53(12): 829-836.
[13] LIU L, SHE X, QIAN Y, et al.Effect of different fermenting containers on the deterioration of Sichuan pickle[J].LWT, 2019, 111:829-836.
[14] ZHAO N, LAI H M, WANG Y L, et al.Assessment of biogenic amine and nitrite production in low-salt Paocai during fermentation as affected by reused brine and fresh brine[J].Food Bioscience, 2021, 41:100958.
[15] FRANCO W, PÉREZ-D AZ I M.Microbial interactions associated with secondary cucumber fermentation[J].Journal of Applied Microbiology, 2013, 114(1):161-172.
AZ I M.Microbial interactions associated with secondary cucumber fermentation[J].Journal of Applied Microbiology, 2013, 114(1):161-172.
[16] 何鹏晖, 钱杨, 王猛, 等.腐败发酵蔬菜中产膜醭细菌的分离鉴定及其生长特性分析[J].食品科学, 2017, 38(10):92-97.
HE P H, QIAN Y, WANG M, et al.Isolation, identification and growth characteristic analysis of pellicle-forming bacteria from spoiled vegetable[J].Food Science, 2017, 38(10):92-97.
[17] FLEMMING H C, WINGENDER J.The biofilm matrix[J].Nature Reviews Microbiology, 2010, 8(9):623-633.
[18] 何鹏晖. 不同蔬菜发酵条件下腐败微生物的产醭特性分析 [D].成都:西华大学, 2018.
HE P H.Analysis of mellow production characteristics of spoilage microorganisms under different vegetable fermentation conditions[D].Chengdu:Xihua University, 2018.
[19] 杨吉霞, 曾祥平, 李玥梦, 等.生花和不生花泡菜盐水真菌群落结构的对比[J].食品与发酵工业, 2022, 48(11):58-64.
YANG J X, ZENG X P, LI Y M, et al.Contrast of fungal community structure in saltwater of flowered and non-flowered pickles[J].Food and Fermentation Industries, 2022, 48(11):58-64.
[20] LIU G, NIE R, LIU Y, et al.Bacillus subtilis BS-15 effectively improves plantaricin production and the regulatory biosynthesis in RX-8[J].Frontiers in Microbiology, 2021, 12:772546.
[21] YU T, JIANG X J, XU X B, et al.Andrographolide inhibits biofilm and virulence in Listeria monocytogenes as a quorum-sensing inhibitor[J].Molecules (Basel, Switzerland), 2022, 27(10):3234.
[22] DENG Z X, HOU K W, VALENCAK T G, et al.AI-2/LuxS quorum sensing system promotes biofilm formation of Lactobacillus rhamnosus GG and enhances the resistance to enterotoxigenic Escherichia coli in germ-free zebrafish[J].Microbiology Spectrum, 2022, 10(4):e0061022.
[23] RYU E J, SIM J, SIM J, et al.D-Galactose as an autoinducer 2 inhibitor to control the biofilm formation of periodontopathogens[J].Journal of Microbiology, 2016, 54(9):632-637.
[24] SHAO H J, LAMONT R J, DEMUTH D R.Autoinducer 2 is required for biofilm growth of Aggregatibacter (Actinobacillus) actinomycetemcomitans[J].Infection and Immunity, 2007, 75(9):4 211-4 218.
[25] 刘蕾, 桂萌, 武瑞赟,等.LuxS/AI-2型群体感应系统调控细菌生物被膜形成研究进展[J].食品科学, 2016, 37(19):254-262.
LIU L, GUI M, WU R Y, et al.Research progress on regulation of bacterial biofilm formation by LuxS/AI-2 quorum sensing system[J].Food Science, 2016, 37(19):254-262.
[26] SABIDI S, HOSHIKO Y, MAEDA T.Quorum quenching of autoinducer 2 increases methane production in anaerobic digestion of waste activated sludge[J].Applied Microbiology and Biotechnology, 2022, 106(12):4 763-4 774.
[27] AN S J, NAMKUNG J U, HA K W, et al.Inhibitory effect of D-arabinose on oral bacteria biofilm formation on titanium discs[J].Anaerobe, 2022, 75:102533.
[28] 杨安林, 张宏梅.几种常见细菌培养上清AI-2的检测及对大肠杆菌成膜影响[J].广东工业大学学报, 2016, 33(2):91-94.
YANG A L, ZHANG H M.Detection of AI-2 in culture supernatant of several common bacteria and its effect on Escherichia coli film formation[J].Journal of Guangdong University of Technology, 2016, 33(2):91-94.