D-塔格糖是D-果糖在C-4位的差向异构体,D-半乳糖的同分异构体,是近年来发现的一种罕见的具有特殊保健功能的天然酮己糖[1],被广泛应用于食品、医药、化妆品和其他领域[2-3]。D-塔格糖的甜度为蔗糖的92%,但其热值仅为1.5 kcal/g,是蔗糖热量值的30%,被美国食品和药物管理局批准的低能甜味剂,味道和甜度与蔗糖最相似[4]。
近20年来,关于D-塔格糖生产的研究大多致力于异构酶反应体系的构建,主要采用经典方法L-阿拉伯糖异构酶(L-arabinose isomerase,L-AI)催化D-半乳糖一步合成D-塔格糖[5]。然而,异构酶所涉及的生物转化往往因为热力学反应平衡问题导致底物的不完全利用[6],反应溶液中D-半乳糖与D-塔格糖的比例一般维持在7∶3~4∶6,产率较低[7]。本课题组前期利用来源Thermoanaerobacter mathranii的L-AI纯化酶体外催化D-半乳糖异构化合成D-塔格糖,转化率约为37%[8]。此外,大多数L-AIs对D-塔格糖的生产表现出严格的金属离子依赖性[9],且生产过程的操作温度较高(>60 ℃)[10-11],导致其实际应用受到很大限制。然而,研究发现利用醛糖还原酶和半乳糖醇脱氢酶(galactose dehydrogenate,GDH)[12]两步氧化还原反应,以半乳糖醇为中间产物,利用D-半乳糖生产D-塔格糖,避免了逆反应和异构酶引起的热力学反应平衡问题(图1)。

图1 异构化和氧化还原途径生产D-塔格糖
Fig.1 Isomerization and redox pathways for the production of D-tagatose
氧化还原途径中不同来源的GDHs已经被研究,如Mycobacterium smegmatis[13]、Arthrobacter globiformis[14]和Rhizobium legumenosarum[15]。而催化D-半乳糖合成半乳糖醇的专一性醛糖还原酶鲜有报道,为数不多的研究主要聚焦于底物亲和力低的木糖还原酶[12]。LIU等[12]通过在酵母中异源表达Scheffersomyces stipitis CBS 6054来源的木糖还原酶和Rhizobium leguminosarum来源的半乳糖醇脱氢酶成功实现D-半乳糖为底物合成D-塔格糖,反应液中D-半乳糖与D-塔格糖的比例为1∶9,这是目前报道基于氧化还原酶生产D-塔格糖的最高水平。但由于XRs的底物谱较广,很多糖如D-木糖、D-核糖、L-阿拉伯糖、D-半乳糖、D-葡萄糖等均可作为XRs的底物[16]。其中XR对D-木糖的底物亲和力最高,对D-半乳糖底物的亲和力较低,对D-木糖的底物亲和力约为对D-半乳糖底物亲和力的10倍[17]。因此,获得对D-半乳糖具有高亲和力的醛糖还原酶对D-塔格糖高效生产具有重要意义。传统的筛选目标酶的方法是从特定的环境样品中获取菌株,测序、异源表达从而获得目标产物,但这种方法效率低、耗时长[18]。目前,随着生物信息学的快速发展,生物数据库中的信息量激增,为生物信息学筛选建立了一条方便快捷的筛选路径[19-20]。其中,利用同源建模和分子对接技术可以有效筛选具有不同性质的新酶[21],易获得对底物亲和性高的酶。
本研究拟以Scheffersomyces stipitis CBS 6054来源的SsXR作为模板,基于氨基酸同源性分析,从美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)中筛选同源序列,并进一步采用蛋白-配体对接的方法,分析与筛选具有D-半乳糖高亲和力的木糖还原酶,并考察其酶学性质以及用于D-塔格糖合成的能力,以期为未来D-塔格糖酶促合成方法的“范式转换”提供新酶资源。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
木糖还原酶SsXR(UniProt P31867)与SgXR(UniProt A0A173DUJ9)以及半乳糖醇脱氢酶RlGDH(UniProt Q1MLL4)的基因序列均由安徽通用生物股份有限公司合成,并分别连接至pETDuet1与pCDFDuet1质粒,构建重组质粒pETDuet-1-SsXR、pETDuet1-SgXR和pCDFDuet1-RlGDH。E.coli DH5α和E.coli BL21(DE3)购自南京诺唯赞生物科技有限公司。
1.1.2 试剂
2×Phanta Flash Master Mix,Dpn I,南京诺唯赞生物科技有限公司;1 mL Ni-NTA spin柱,十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)蛋白胶试剂盒,上海生工生物工程股份有限公司;D-半乳糖、D-塔格糖标准品、氨苄青霉素钠,上海源叶生物科技有限公司;半乳糖醇、硫酸链霉素等其他化学品,上海西格玛奥德里奇公司。
1.1.3 培养基
LB(Luria-Bertani)培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10,121 ℃高压蒸汽灭菌20 min。氨苄青霉素和硫酸链霉素在LB培养基中的最终质量浓度分别为100和50 μg/mL。
1.1.4 仪器和设备
T960型PCR仪,杭州晶格科学仪器有限公司;HN-150Y超声波细胞破碎仪,上海汗诺仪器有限公司;DYCZ-25D蛋白电泳仪,北京六一生物科技有限公司;EPS300电泳槽,上海天能科技有限公司;QuickGel 6100凝胶成像系统,苏州莫纳生物科技有限公司;1510酶标仪,上海赛默飞世尔仪器有限公司;LC-20AT高效液相色谱仪,日本岛津公司。
1.2 实验方法
1.2.1 SsXR定点突变体的构建
以pETDuet1-SsXR为模板,采用全质粒PCR扩增法获得SsXR突变体D47A、Y48A和H110A。温度程序如下:95 ℃,5 min,1个循环;95 ℃,15 s、56 ℃,15 s、72 ℃,35 s,35个循环。Dpn I在37 ℃下消化模板2 h,将剩余PCR产物导入E.coli DH5ɑ进行基因克隆。将含有正确变体基因的质粒导入E.coli BL21(DE3)中进行蛋白表达。
1.2.2 同源建模
采用文献研究报道的S.stipitis CBS 6054 来源的XR[22](SsXR,PDB ID:5z6t)为模板。通过NCBI服务器(https://blast.ncbi.nlm.nih.gov/Blast.cgi)获得不同来源的11个XR序列。用ESPript 3.0 (https://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)[23]对12个氨基酸序列进行blast分析。使用RosettaCM(Rosetta 2020.08.61146)[24]构建11个XRs模型。每个模型计算数设为1 000,得分最低的模型作为输出模型。
1.2.3 XRs和D-半乳糖之间蛋白-配体对接
使用AutoDock 4.2.6进行XRs与D-半乳糖的对接,对接数量设置为100,选择能量最低的复合体作为输出模型。利用PyMol计算底物与活性位点之间的空间距离。
1.2.4 SsXR和SgXR的表达纯化
将含有重组质粒的工程菌株以4%接种量接种到50 mL LB培养基中,37 ℃(200 r/min)培养至OD600为0.5~0.6。将终浓度为0.25 mmol/L异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)加入到培养液中,16 ℃下诱导蛋白表达24 h,8 000×g离心10 min收集细胞,丢弃上清液。然后,用10 mL 50 mmol/L三羟甲基氨基甲烷盐酸盐缓冲液(Tris-HCl,pH=7.0)洗涤细胞2次,并在3 mL Tris-HCl中重悬。超声波破碎重悬细胞(超声波3 s,间隔5 s),12 000×g离心20 min后收集上清液,用1 mL亲和Ni-NTA柱纯化。用5 mL洗涤缓冲液(20 mmol/L磷酸盐缓冲液,500 mmol/L NaCl,20 mmol/L咪唑,pH 8.0)洗去非特异性结合蛋白后,用3 mL洗脱缓冲液(20 mmol/L磷酸盐缓冲液,500 mmol/L NaCl,300 mmol/L咪唑,pH 8.0)洗脱得到纯化的XRs。用SDS-PAGE对纯化的XRs进行分析。
1.2.5 SsXR和SgXR的表征
通过测定反应过程中辅酶烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)在340 nm处吸光度的变化来测定XRs活性。将酶添加到终浓度为50 mmol/L的不同pH的磷酸盐缓冲液中,加入0.2 mmol/L的NADPH,测定酶的活性以确定最适pH值。在最适pH下变化温度30~70 ℃以确定最适温度。采用上述方法研究金属离子对SsXR和SgXR活性的影响,在反应体系中分别加入Fe2+、Mn2+、Zn2+、Cu2+、Ca2+、Mg2+、Ni2+、Co2+,最终浓度分别为1 mmol/L。用EDTA代替金属离子时酶活定为100%,并测定了各种金属离子对酶活的影响。酶活单位定义:在最佳反应条件下,每分钟消耗1 μmol NADPH所需的酶量为1 XR活性单位(U)。
1.2.6 SsXR和SgXR 动力学参数测定
为了研究SsXR和SgXR的辅酶偏好(NADH或NADPH),按照上述标准酶活测定方法,在最佳反应条件下,以50 mmol/L D-半乳糖为底物,辅酶浓度为0.01~0.5 mmol/L,在1 min内测定辅酶含量的变化。为了研究SsXR和SgXR对D-半乳糖的底物特异性,根据上述标准酶活测定方法,在最适条件下,以浓度在5~100 mmol/L的D-半乳糖为底物,NADPH保持在0.2 mmol/L,在1 min内测定辅酶含量的变化。通过非线性曲线拟合,在Origin 2018中获得SsXR和SgXR对底物D-半乳糖或辅酶(NADH和NADPH)的米氏方程。
1.2.7 摇瓶中共表达酶催化性能研究
将质粒pETDuet1-SsXR和pETDuet1-SgXR分别转化到含有质粒pCDFDuet1-RlGDH的E.coli BL21(DE3),构建重组菌株SsXR/RlGDH和SgXR/RlGDH。按照上述培养方法,当OD600=0.5~0.6,加入0.25 mmol/L的IPTG于16 ℃诱导24 h后添加10 g/L的D-半乳糖,摇瓶置于30 ℃下催化D-塔格糖的生产。D-塔格糖采用配备Carbomix Ca-NP10(10 μm,交联度8%,7.8 mm×300 mm)柱的高效液相色谱仪(示差折光检测器)测定。流动相为100%水,流速0.4 mL/min,85 ℃,洗脱35 min。
2 结果与分析
2.1 XRs催化活性位点的鉴定
本研究以SsXR(PDB ID:5z6t)为模板,采用蛋白-配体对接的方法将D-半乳糖与SsXR(蛋白与NADPH共晶体结构)进行对接,输出能量最低的复合体结构。通过PyMol观察其结构,可清晰地看出D-半乳糖对接在NADPH的烟酰胺环上(图2-a),D-半乳糖与SsXR具有良好的契合度。通过分析配体与氨基酸之间的相互作用,观察到残基Asp47、Tyr48和His110可以通过氢键与D-半乳糖相互作用(图2-b)。为了进一步确定SsXR的活性位点,将Asp47、Tyr48和His110突变为Ala,其中当Tyr48和His110突变为Ala时,SsXR失去了酶活性,而D47A突变体仅有约20%的相对活性,这表明Asp47、Tyr48和His110残基在氧化还原反应中起着至关重要的作用。用XR催化还原反应时,烟酰胺环上的质子通过传递在“推拉”催化机制下还原D-半乳糖的羰基(图2-c,参考文献[22]制图),最终得到半乳糖醇[25]。
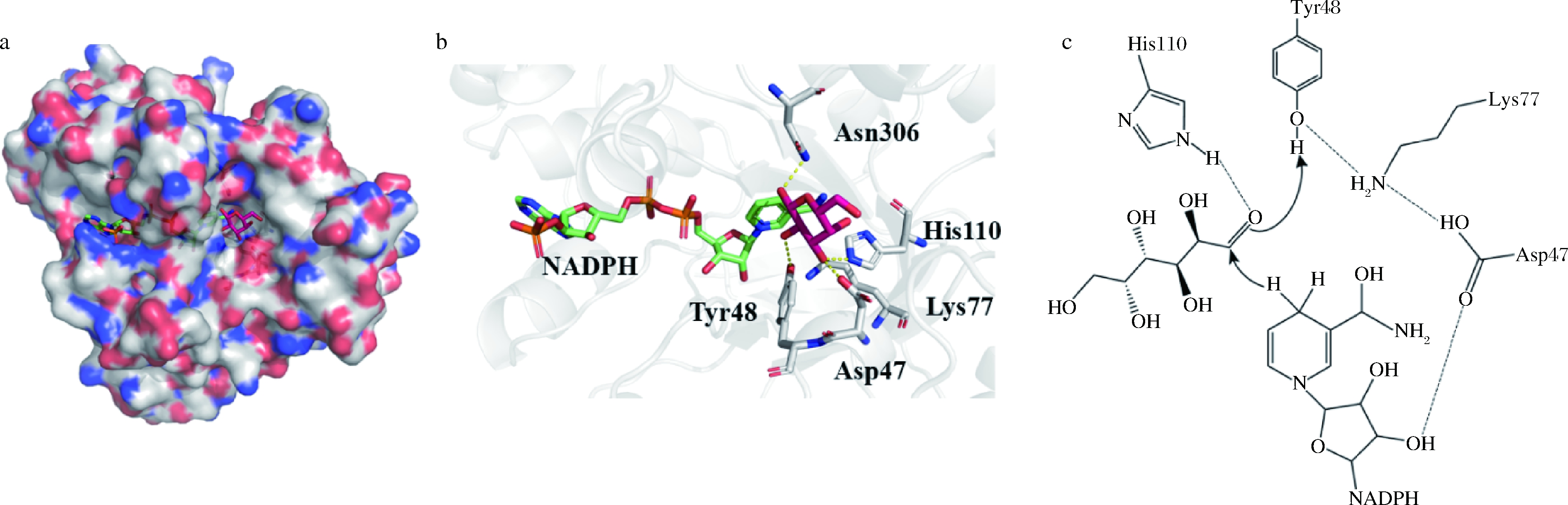
a-SsXR/NAPDH复合物与D-半乳糖之间的蛋白-配体对接模型;b-D-半乳糖与SsXR相关氨基酸残基的相互作用图;c-SsXR/NAPDH/ D-半乳糖复合物的“推拉”催化机制
图2 D-半乳糖转化成半乳糖醇还原反应的机理
Fig.2 The mechanism of reduction reaction that the D-galactose was transferred to galactitol
2.2 对D-半乳糖具有高底物特异性的XR的筛选
SsXR的底物偏好倾向于D-木糖,为了获得对D-半乳糖具有底物特异性的XR,以SsXR的序列为模板,在NCBI中进行BLAST,选取了11个具有不同序列一致性的XRs(60%~80%),分别来源于Scheffersomyces shehatae,Spathaspora roraimanensis,Yamadazyma tenuis,Spathaspora arborariae,Spathaspora passalidarum,Spathaspora suhii,Spathaspora sp.JA1,Candida tropicalis,Spathaspora gorwiae,Candida tropicalis MYA-3404和Kluyveromyces marxianus。在ESPript 3.0中进行多序列比对,比对数据显示上述蛋白-配体对接鉴定的活性位点Asp47,Tyr48和His110是这12个XRs中的保守位点(图3)。因此,蛋白-配体对接可以帮助本研究筛选目标XR。


图3 十二种XRs的多重序列比对
Fig.3 Multiple sequence alignment of 12 XRs
本研究使用Rosetta构建11个XR模型,在AutoDock中进行蛋白-配体对接。对D-半乳糖的特异性由催化位点与D-半乳糖之间的空间距离决定,结合自由能也用于评价对接质量。最后,来源于S.gorwiae的XR活性位点与D-半乳糖之间的空间距离最小(图4-a),同时结合自由能相对较低(图4-b)。因此,本研究选择来源于S.gorwiae的XR作为目标XR进行进一步研究,命名为SgXR。
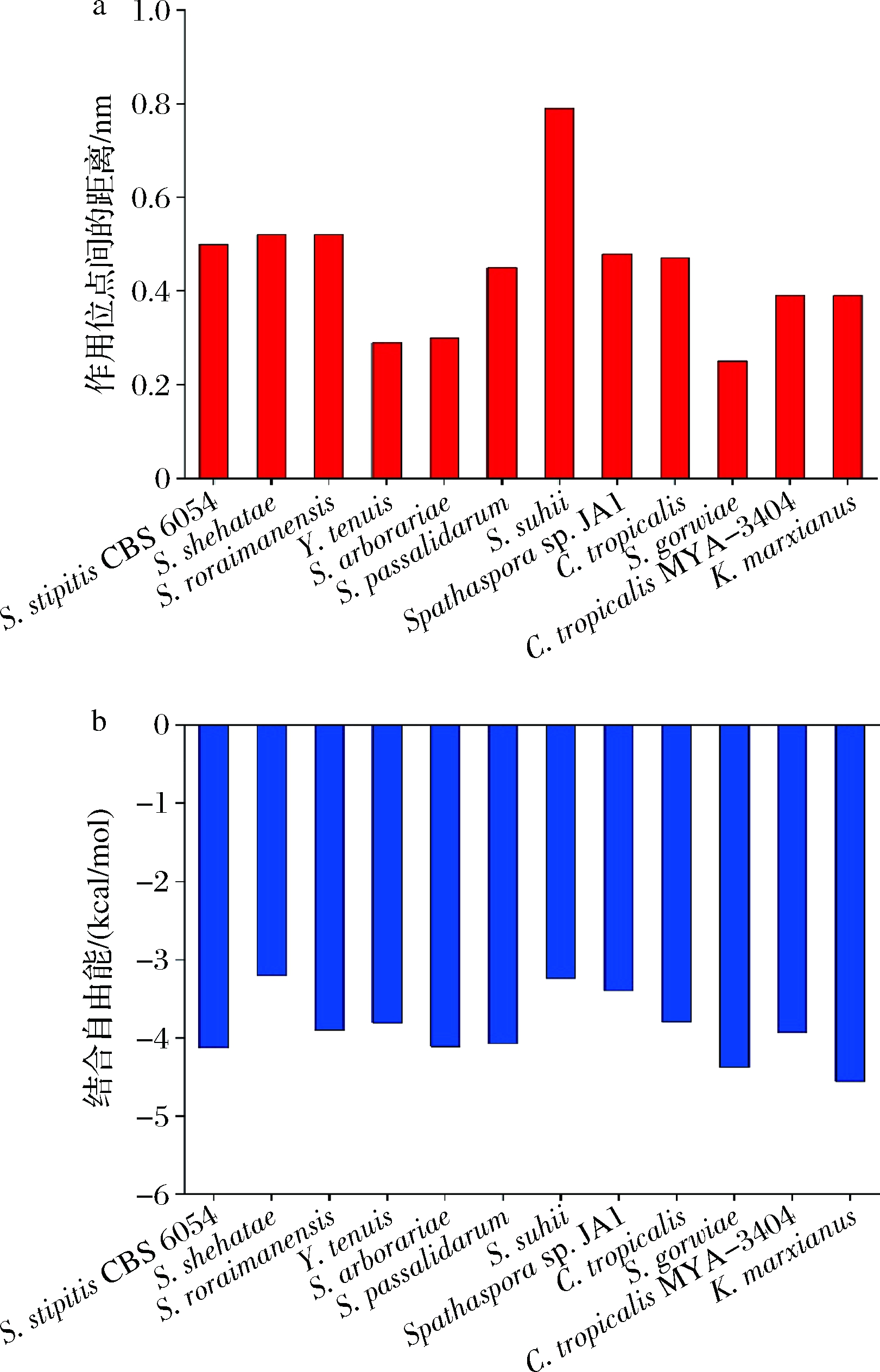
a-D-半乳糖与XRs作用位点间的距离;b-D-半乳糖与XRs结合自由能
图4 D-半乳糖与XRs作用位点间的距离和结合自由能比较
Fig.4 The binding free energy and the distance of action sites between D-galactose and XRs
2.3 蛋白纯化和辅酶偏好性
体外获得并纯化SsXR和SgXR,并用SDS-PAGE进行验证。SDS-PAGE结果表明,可以成功纯化SsXR和SgXR,分子质量约为36 kDa和39 kDa,与理论分子质量为37.4 kDa和39.5 kDa相近(图5-a)。

a-SsXR和SgXR的SDS-PAGE分析(M-蛋白marker;1-SsXR;2-SgXR);b-金属离子对SsXR和SgXR酶活力的影响;c-pH对SsXR和SgXR酶活力的影响;d-温度对SsXR和SgXR酶活力的影响
图5 SsXR和SgXR的表征
Fig.5 The characterization of SsXR and SgXR
在探索SsXR和SgXR的辅酶偏好性之前,首先研究了最适反应条件。SsXR和SgXR的最适pH均为7.0,而当pH低于5.0时,SgXR的相对酶活力大于60%,在30 ℃时,SsXR的相对酶活力小于50%。SsXR和SgXR的最适温度分别为35和40 ℃。此外,还测试了不同金属离子对酶活性的影响,常见影响酶活性的金属离子对SsXR和SgXR都有不同程度的抑制作用(图5-b~图5-d)。
醛糖还原酶通常需要辅酶的参与才能发生反应,NADPH常被用作XR的辅酶,一小部分XR利用NADH作为辅酶,也有些XR两种辅酶都可利用[26]。在本研究中,为了研究SsXR和SgXR的辅酶偏好(NADH或NADPH),以NADH和NADPH作为辅酶进行动力学参数测定。纯化的SsXR和SgXR可同时利用NADH和NADPH,且如大部分报道的XR一样,偏好NADPH。SsXR和SgXR对NADH具有相似的特异性(Vmax),当辅酶为NADPH时,SsXR的Km值是SgXR的1.56倍,SgXR的kcat值是SsXR的1.47倍(表1)。这些数据表明,SsXR和SgXR的辅酶偏好均为NADPH,且SgXR的酶活性优于SsXR。
表1 重组SsXR和SgXR的辅酶偏好
Table 1 Coenzyme preference of recombinant SsXR and SgXR
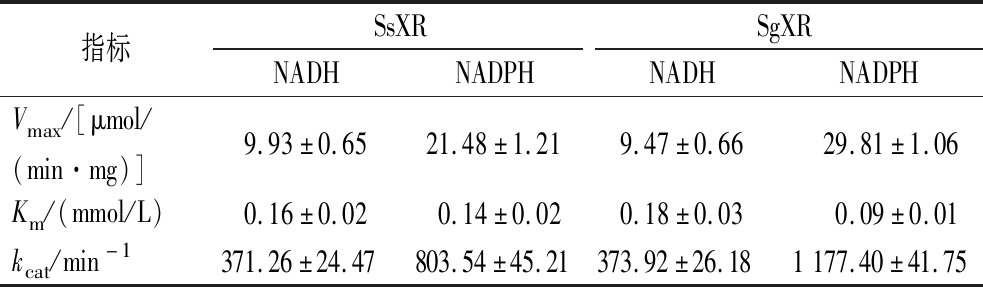
指标SsXRSgXRNADHNADPHNADHNADPHVmax/[μmol/(min·mg)]9.93±0.6521.48±1.219.47±0.66 29.81±1.06Km/(mmol/L)0.16±0.020.14±0.020.18±0.030.09±0.01kcat/min-1371.26±24.47803.54±45.21373.92±26.181177.40±41.75
2.4 底物特异性验证
在NADPH为辅酶的条件下,研究了SsXR和SgXR对D-半乳糖的特异性。通过非线性拟合得到SsXR和SgXR 对D-半乳糖的米氏方程(图6)。
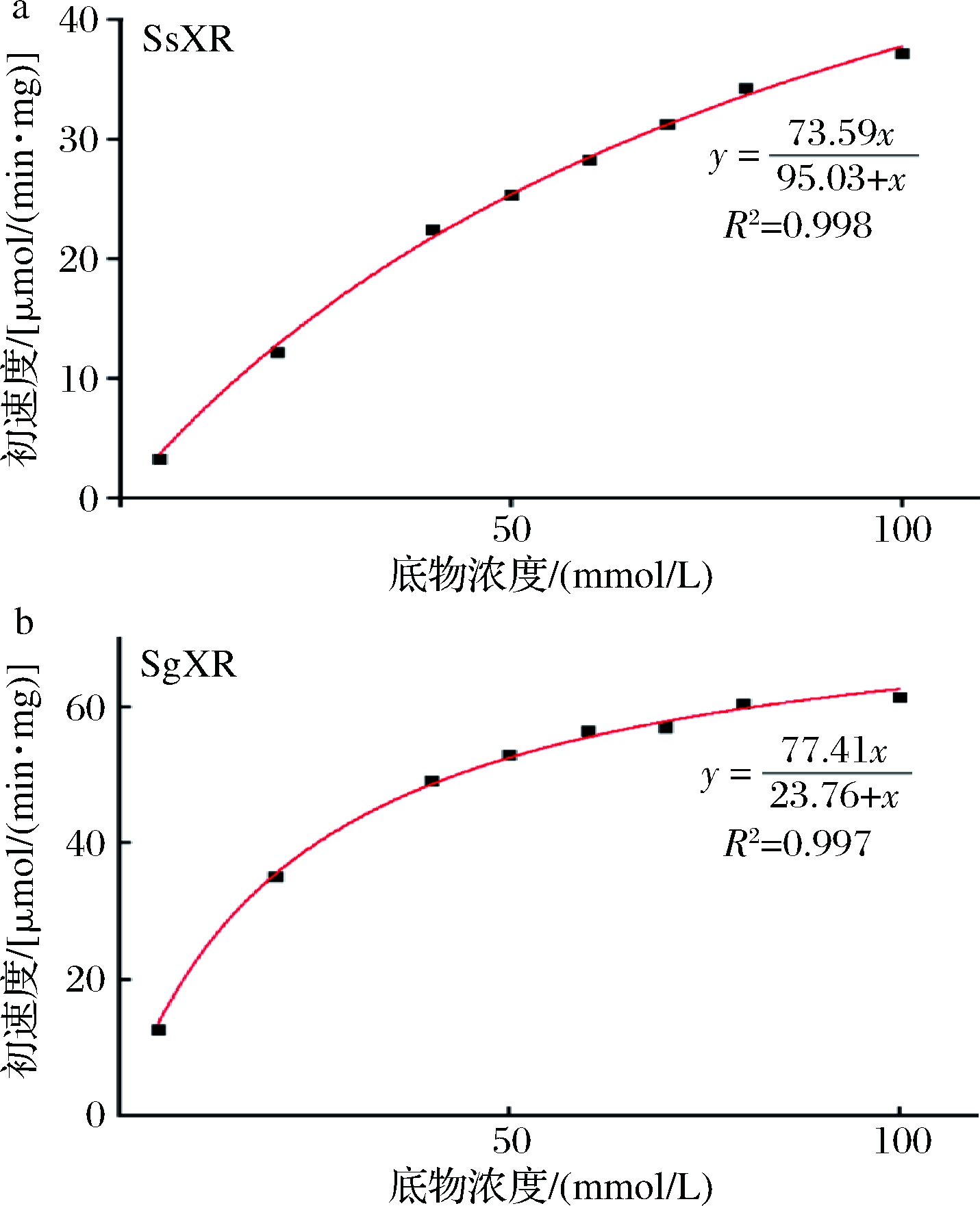
a-SsXR的米氏方程曲线;b-SgXR的米氏方程曲线
图6 SsXR、SgXR的米氏方程曲线
Fig.6 Michaelis-Menten plots of SsXR and SgXR
由图6可知,SsXR和SgXR的Vmax无显著差异。众所周知,Km值通常用来表示底物与酶的亲和度,Km越小,酶对底物的亲和力越大。SgXR对D-半乳糖的Km值是SsXR的1/4,说明SgXR对D-半乳糖亲和力是SsXR的4倍。在NADPH存在的情况下,SgXR的kcat值(3 057.05 min-1)是SsXR(2 752.61 min-1)的1.11倍(表2)。结果表明,在相同条件下,以D-半乳糖为底物,利用SgXR的酶促反应更容易进行。
表2 最佳反应条件下SsXR和SgXR的动力学参数
Table 2 Kinetic parameters of SsXR and SgXR under optimum reaction conditions

指标SsXRSgXRVmax/[μmol/(min·mg)]73.59±3.71 77.41±1.49Km/(mmol/L)95.03±8.1823.76±1.50kcat/min-12752.61±138.823057.05±58.67
2.5 SsXR和SgXR在D-塔格糖合成中的应用评估
SsXR与SgXR以D-半乳糖为底物得到半乳糖醇,为了评估其在D-塔格糖合成中的应用能力,进一步在E.coli BL21(DE3)中引入半乳糖醇脱氢酶RlGDH,以催化半乳糖醇合成D-塔格糖,分别得到SsXR/RlGDH和SgXR/RlGDH重组菌。SDS-PAGE结果表明,SsXR/RlGDH和SgXR/RlGDH在大肠杆菌中成功共表达(图7-a)。HPLC结果显示,2种重组菌均能将D-半乳糖转化为D-塔格糖(图7-b)。用0.25 mmol/L IPTG在16 ℃诱导24 h后,在培养基中加入10 g/L D-半乳糖于30 ℃下发酵,发酵至48 h时,SgXR/RlGDH重组菌的D-塔格糖积累速率高于SsXR/RlGDH,产量为5.47 g/L,是SsXR/RlGDH的1.23倍,转化率约54.7%(图7-c)。这是首次在大肠杆菌中进行基于氧化还原途径生物合成D-塔格糖,该游离氧化还原酶系统从D-半乳糖中产生D-塔格糖的转化率比大多数报道的异构酶途径高[7],但摇瓶中相对较低的细胞浓度可能影响其转化效率,后续实验可聚焦于高密度发酵以及静息细胞转化等方法的应用,强化其转化率与生产效率。
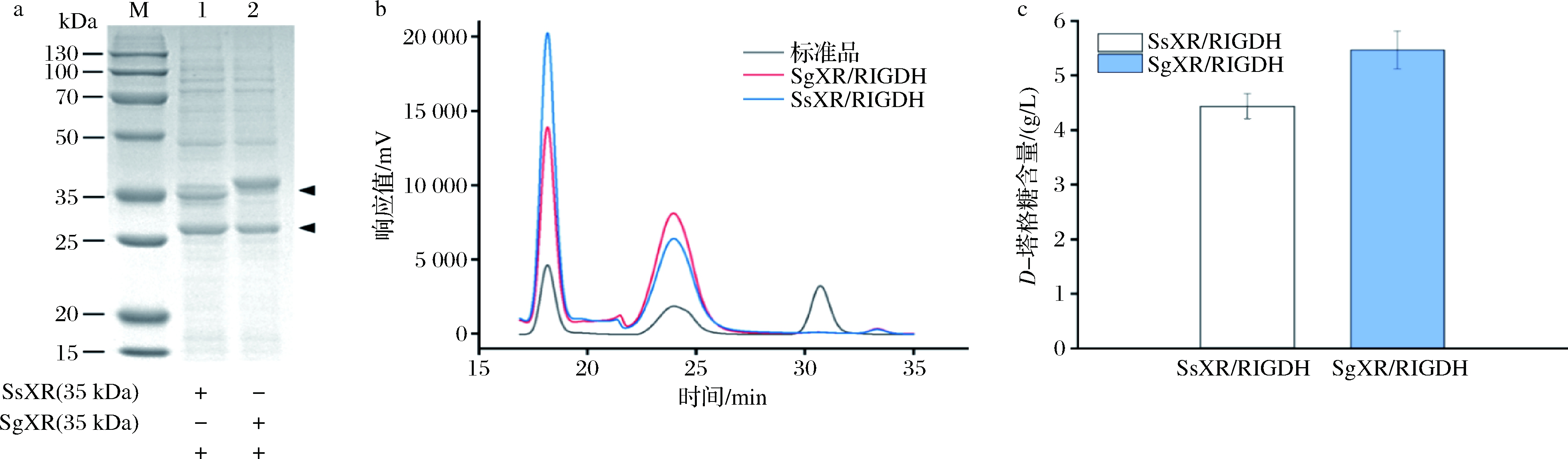
a-SsXR/RlGDH和SgXR/RlGDH共表达SDS-PAGE验证图(M-蛋白marker;1-SsXR/RlGDH;2-SgXR/RlGDH);b-摇瓶中SsXR/RlGDH和SgXR/RlGDH共催化体系HPLC产物鉴定图;c-SsXR/RlGDH和SgXR/RlGDH共催化体系D-塔格糖产量
图7 SsXR/RlGDH和SgXR/RlGDH重组菌在D-塔格糖合成中的应用评估
Fig.7 Evaluation of strains SsXR/RlGDH and SgXR/RlGDH in D-tagatose synthesis
3 结论
在本研究中,利用蛋白-配体对接的方法,以S.stipitis CBS 6054来源的木糖还原酶XR为模板,在NCBI中基于氨基酸同源性分析挑选了11个不同来源的XR,利用RosettaCM对11条序列进行模型的构建,AutoDock进行底物D-半乳糖和XRs的对接,挖掘到对D-半乳糖亲和力较高的来源于S.gorwiae的XR。其对D-半乳糖的底物亲和力提高4倍。最后,通过级联半乳糖醇脱氢酶,初步探究其在大肠杆菌体内双酶催化合成D-塔格糖,相比较对照组,D-塔格糖的产量提升23%,对底物D-半乳糖的转化率达到54.7%。本文首次证明来源于S.gorwiae的XR可以用于以D-半乳糖为底物合成半乳糖醇,并且对D-半乳糖有较高亲和力,为D-塔格糖的合成提供新的木糖还原酶资源,本文的研究对于开发基于氧化还原反应的高效D-塔格糖的合成工艺具有借鉴意义。
[1] ZHAN Y J,XU Z,LI S,et al.Coexpression of β-D-galactosidase and L-arabinose isomerase in the production of D-tagatose:A functional sweetener[J].Journal of Agricultural and Food Chemistry,2014,62(11):2412-2417.
[2] 袁尔东.功能性甜味剂塔格糖的生产及应用[J].食品与发酵工业,2005,31(1):109-113.
YUAN E D.Manufacturing and application of functional sweetener:Tagatose[J].Food and Fermentation Industries,2005,31(1):109-113.
[3] LEE D W,JANG H J,CHOE E A,et al.Characterization of a thermostable L-arabinose (D-galactose) isomerase from the hyperthermophilic eubacterium Thermotoga maritima[J].Applied and Environmental Microbiology,2004,70(3):1397-1404.
[4] 徐铮,徐恺,陈昱金,等.异构酶在生物制造中的研究进展[J].食品与发酵工业,2021,47(5):244-251.
XU Z,XU K,CHEN Y J,et al.Recent advances on isomerases for bio-manufacturing[J].Food and Fermentation Industries,2021,47(5):244-251.
[5] ROY S,CHIKKERUR J,ROY S C,et al.Tagatose as a potential nutraceutical:Production,properties,biological roles,and application[J].Journal of Food Science,2018,83(11):2699-2709.
[6] ROBINSON P K.Enzymes:Principles and biotechnological applications[J].Essays in Biochemistry,2015:59:1-41.
[7] RAVIKUMAR Y,PONPANDIAN L N,ZHANG G Y,et al.Harnessing-arabinose isomerase for biological production of-tagatose:Recent advances and its applications[J].Trends in Food Science &Technology,2021,107:16-30.
[8] LIU W,JIANG C,ZHANG Y W,et al.Self-assembling protein scaffold-mediated enzymes’ immobilization enhances in vitro d-tagatose production from lactose[J].Food Bioengineering,2022,1(1):47-57.
[9] OH D K.Tagatose:Properties,applications,and biotechnological processes[J].Applied Microbiology and Biotechnology,2007,76(1):1-8.
[10] LU F Z,XU W,ZHANG W L,et al.Polyol dehydrogenases:Intermediate role in the bioconversion of rare sugars and alcohols[J].Applied Microbiology and Biotechnology,2019,103(16):6473-6481.
[11] HONG Y H,LEE D W,LEE S J,et al.Production of d-tagatose at high temperatures using immobilized Escherichia coli cells expressing l-arabinose isomerase from Thermotoga neapolitana[J].Biotechnology Letters,2007,29(4):569-574.
[12] LIU J J,ZHANG G C,KWAK S,et al.Overcoming the thermodynamic equilibrium of an isomerization reaction through oxidoreductive reactions for biotransformation[J].Nature Communications,2019,10(1):1-8.
[13] IZUMORI K,TSUZAKI K.Production of D-tagatose from D-galactitol by Mycobacterium smegmatis[J].Journal of Fermentation Technology,1988,66(2):225-227.
[14] IZUMORI K,MIYOSHI T,TOKUDA S,et al.Production of D-tagatose from dulcitol by Arthrobacter globiformis[J].Applied and Environmental Microbiology,1984,48(5):1055-1057.
[15] JAGTAP S S,SINGH R,KANG Y C,et al.Cloning and characterization of a galactitol 2-dehydrogenase from Rhizobium legumenosarum and its application in D[J].Enzyme and Microbial Technology,2014,58-59:44-51.
[16] VERDUYN C,VAN KLEEF R,FRANK J,et al.Properties of the NAD(P)H-dependent xylose reductase from the xylose-fermenting yeast Pichia stipitis[J].The Biochemical Journal,1985,226(3):669-677.
[17] SEIBOTH B,GAMAUF C,PAIL M,et al.The D-xylose reductase of Hypocrea jecorina is the major aldose reductase in pentose and D-galactose catabolism and necessary for beta-galactosidase and cellulase induction by lactose[J].Molecular Microbiology,2007,66(4):890-900.
[18] SUKUMAR M,JEYASEELAN A,SIVASANKARAN T,et al.Production and partial characterization of extracellular glucose isomerase using thermophilic Bacillus sp.isolated from agricultural land[J].Biocatalysis and Agricultural Biotechnology,2013,2(1):45-49.
[19] GONG J S,LU Z M,LI H,et al.Metagenomic technology and genome mining:Emerging areas for exploring novel nitrilases[J].Applied Microbiology and Biotechnology,2013,97(15):6603-6611.
[20] 孙小洁,郑方强,曾健明.基于R语言的基因表达芯片注释流程[J].生物加工过程,2021,19(1):17-22.
SUN X J,ZHENG F Q,ZENG J M.An R workflow for annotation of gene expression microarray[J].Chinese Journal of Bioprocess Engineering,2021,19(1):17-22.
[21] KUMAR L,DUTT D,TAPAS S,et al.Purification,bio-chemical characterization,homology modeling and active site binding mode interactions of thermo-alkali-tolerant β-1,4 endoxylanase from Coprinus cinereus LK-D-NCIM-1369[J].Biocatalysis and Agricultural Biotechnology,2013,2(3):267-277.
[22] SON H F,LEE S M,KIM K J.Structural insight into D-xylose utilization by xylose reductase from Scheffersomyces stipitis[J].Scientific Reports,2018,8(1):1-11.
[23] ROBERT X,GOUET P.Deciphering key features in protein structures with the new ENDscript server[J].Nucleic Acids Research,2014,42(W1):W320-W324.
[24] SONG Y F,FRANK D,RAY Y R,et al.High-resolution comparative modeling with RosettaCM[J].Structure,2013,21(10):1735-1742.
[25] PENNING T M.The aldo-keto reductases (AKRs):Overview[J].Chemico-Biological Interactions,2015,234:236-246.
[26] WATANABE S,PACK S P,SALEH A A,et al.The positive effect of the decreased NADPH-preferring activity of xylose reductase from Pichia stipitis on ethanol production using xylose-fermenting recombinant Saccharomyces cerevisiae[J].Bioscience,Biotechnology,and Biochemistry,2007,71(5):1365-1369.