植物乳植杆菌(Lactiplantibacillus plantarum)是乳酸菌的一种,长期摄入可对宿主产生有益功效[1],主要具有改善肠道菌群平衡、抑制致病菌生长、提高人体免疫力以及改善认知能力等益生功能[2-3]。植物乳植杆菌P-8(原分类学名为植物乳杆菌P-8)分离自草原上牧民家庭的自然发酵酸牛乳中,其具有良好的胃肠转运耐受特性和抗菌活性[4],以及较强的体内定植能力,可有效缓解肠道疾病[5-6],改善人体肠道健康,同时还具有降血糖辅助治疗Ⅱ型糖尿病[7]以及缓解压力、焦虑[8-9]等功能。
存活率是影响益生菌产品在制备及贮藏运输过程中品质的关键因素[10],而植物乳植杆菌不形成芽孢,抗逆性差、易失活,在制备过程中极易受到周围环境的影响,进而限制其发挥益生功能。因此,研究益生菌加工技术以保护其在生产加工、贮藏运输及人体消化等过程中的活性具有重要意义。目前,国内外发酵剂生产商在商业上依然选用冷冻干燥这种传统干燥技术,然而冷冻干燥耗时长、耗能高,生产成本较高[11]。低温喷雾干燥是一种新型干燥技术,是通过雾化器将物料分散成细小液滴,在干燥室内与热空气经过传热传质后,完成脱水过程,具有生产成本低、高效快速、可连续生产等优点,符合大规模工业化生产的要求[12-13]。并且雾化器位于干燥室内部[14],形成一个密闭的环境,使得整个干燥过程能够在真空条件下进行,通过改变真空度,降低干燥室温度的方法,减少干燥过程中热应力及高温胁迫所带来的损伤,从而有效地提升菌体细胞活性。
本研究以植物乳植杆菌P-8为研究对象,采用低温喷雾干燥法对其干燥工艺参数进行优化,筛选出最佳的工艺条件。从干燥前后菌体形态、存活率、胃肠转运耐受性、贮藏稳定性等方面进行研究,以期为植物乳植杆菌P-8工业化生产提供技术支持。
1 材料与方法
1.1 材料与试剂
植物乳植杆菌(Lactiplantibacillus plantarum)P-8,内蒙古农业大学乳酸菌菌种资源库(Lactic Acid Bacteria Collection Center,LABCC)。
MRS培养基,青岛海博生物;NaCl、吐温-80、酵母粉、脱脂乳、胃蛋白酶、胰蛋白酶、胆汁盐、胃液模拟液(SGF粉剂)、肠液模拟液(SIF粉剂),晓东宜健(苏州)仪器设备有限公司。
1.2 仪器与设备
Avanti JXN-26高速冷冻离心机,美国Beckman Coulter有限公司;YC-2000低温喷雾干燥器,上海雅程仪器设备有限公司;DHSI-IV动态仿生人胃肠消化系统,晓东宜健(苏州)仪器设备有限公司;MB27水分测定仪,上海奥豪斯仪器有限公司;HD-3A型智能水分活度测量仪,无锡市华科仪器仪表有限责任公司;SU8100扫描电子显微镜、MC1000离子溅射仪,日本株式会社HITACHI制作所。
1.3 实验方法
1.3.1 菌种活化及增殖培养
将-80 ℃冷冻的试验菌株缓慢升温溶解于MRS液体培养基中,37 ℃恒温培养12~14 h,并连续传2代后,以5%的接种量进行接种培养。为保证供试菌的纯度,对传代期间的微生物形态进行观察。
1.3.2 菌悬液制备
高密度发酵完成后,将增殖培养液4 ℃、4 000 r/min离心15 min,得到菌泥,用无菌磷酸缓冲液(pH 6.5)洗涤2次后,第3次离心将菌泥与保护剂按1∶1.5的比例混合制备菌悬液,保护剂主要为脱脂乳粉、海藻糖和谷氨酸钠。
1.3.3 响应面试验设计
根据单因素试验结果,设计3因素3水平的Box-Behnken试验,以进料速度、干燥温度和雾化压强为因素,存活率为响应值,对植物乳植杆菌P-8低温喷雾干燥工艺进行优化。
表1 响应面试验因素与水平
Table 1 Factors and levels of response surface test
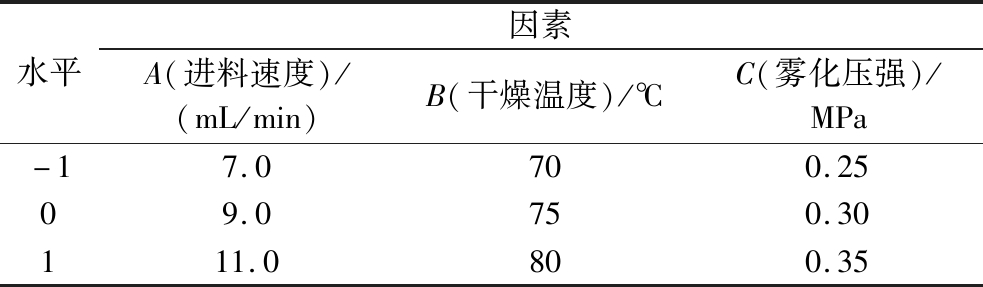
水平因素A(进料速度)/(mL/min)B(干燥温度)/℃C(雾化压强)/MPa-17.0700.2509.0750.30111.0800.35
1.3.4 活菌计数及存活率计算
采用稀释平板菌落计数法对干燥后的菌粉进行活菌计数,并接种于MRS琼脂培养基37 ℃恒温培养48 h。存活率计算如公式(1)所示:
存活率/%=N/N0×100
(1)
式中:N,干燥后活菌数,CFU/g;N0,干燥前活菌数,CFU/g。
1.3.5 水分含量及水分活度测定
取3~5 g菌粉,用水分含量测定仪测量菌粉的含水量,重复3次;采用智能水分活度仪对试样进行水分活度测试,在正式测试之前,将适量的脱脂乳粉加入到仪器中预热,然后称取适量的待测样品,将其均匀地放在平板上进行测定,重复测定3次。
1.3.6 形态观察
利用扫描电子显微镜,在不同放大倍数条件下观察干燥前后样品形貌变化。将预处理完成后的样品置于电子显微镜样品室中观察(电压15 kV)。
1.3.7 动态体外消化测定
1.3.7.1 体外模拟消化液配制
制备电解质储备液(胃):将胃消化液粉剂完全溶解后,加入0.825 g的MgCl2·6H2O成品溶液以及3.25 mL的6 mol/L HCl溶液,并在1 L的容量瓶内定容。
胃液模拟液制备:取295 mL的胃液电解质储备液,加入150 μL的CaCl2·2H2O成品溶液,用HCl溶液调节pH至1.58,并按照800 U/mL的浓度比例加入胃蛋白酶,充分溶解后过滤除菌。
制备电解质储备液(肠):将肠消化液粉剂完全溶解后,加入1.76 g的MgCl2·6H2O溶液以及1.75 mL的6 mol/L HCl溶液,并在1 L的容量瓶内定容。
肠液模拟液制备:取588 mL的肠液电解质储备液,加入1.2 g的CaCl2·2H2O溶液,用6 mol/L HCl溶液调节pH至6.8,并分别按照200 U/mL、20 mmol/L的浓度比例加入胰蛋白酶和胆汁盐,充分溶解后过滤除菌。
1.3.7.2 消化过程中胃肠pH及食糜固含量的检测
不间断地测定胃部和小肠内食糜消化过程pH值变化,并测定在消化60和120 min的食糜固含量变化。
1.3.7.3 活菌浓度及存活率的检测
将取出的食糜混合均匀后,各取1 mL样品梯度稀释,并进行活菌计数,每组样品6个平行。最后将一定浓度的稀释液定量接种于MRS琼脂培养基,混匀后于37 ℃恒温培养48 h。不同时期的菌落数用N0、N60、N120表示,单位CFU/mL。不同消化时间胃液存活率用公式(2)、公式(3)进行计算,肠液存活率用公式(4)、公式(5)进行计算。
(2)
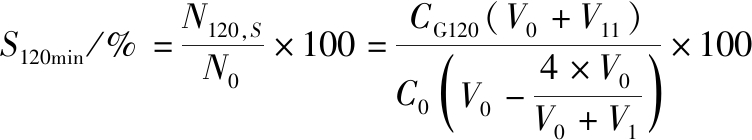
(3)
(4)
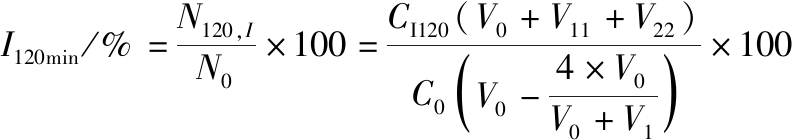
(5)
式中:C0,初始样品活菌浓度,CFU/mL;CG60、CG120分别为60、120 min胃液样品活菌浓度,CFU/mL;V0,样品体积(120 mL);V1、V11分别为60、120 min内进入胃内的模拟胃液体积(含酸),mL;CI60、CI120分别为60、120 min小肠样品活菌浓度,CFU/mL;V2、V22为60、120 min内进入小肠内的模拟肠液体积(含碱),mL。
1.3.8 贮藏稳定性测定
在最优工艺下制备菌粉,将样品混匀后用无菌铝箔袋分装,每份约30 g,分别贮藏在4和25 ℃恒温环境中,间隔7 d测定1次样品活菌数,并计算不同贮藏温度对植物乳植杆菌P-8活性的影响。
2 结果与分析
2.1 工艺条件对菌粉存活率的影响
在低温喷雾干燥过程中,泵料速度、进风温度、风机速度、雾化压强等因素对细菌活性有极大影响[15]。剪切力、脱水、热应力以及氧气损伤等会导致益生菌存活率的急剧下降,其中高温对细胞膜、核糖体、蛋白质等会造成不可逆的损伤,致使细胞死亡。雾化压强是指在干燥过程中,对输送到雾化器内的物料持续地施加的额外压力。压强可将物料分散成极小的雾状液滴,增大干燥面积,以减少与热空气的接触时间,降低热损伤。雾化器在干燥室内部,通过雾化压强控制液滴分散程度,但压强的改变会使细胞受到不同程度的机械损伤,导致菌株细胞膜受损,影响细菌活性。因此,生产工艺对于微生物的活性及功能发挥至关重要。
2.1.1 进料速度对植物乳植杆菌P-8菌粉的影响
在喷嘴直径为1.5 mm、雾化压强为0.3 MPa、干燥温度70 ℃的条件下,进行低温喷雾干燥试验。由图1可知,在干燥温度、喷嘴直径、雾化压强及加热器温度一定的条件下,进料速度越大菌粉的水分含量与水分活度越高,分析原因可能是进料速度的增加导致物料干燥不充分,较高的水分含量及水分活度不利于菌粉的贮藏。当进料速度达到9 mL/min时,菌粉存活率达到最高,随着进料速度的继续增大,干燥效果变差,延长了干燥时间,导致存活率显著降低(P>0.05)。
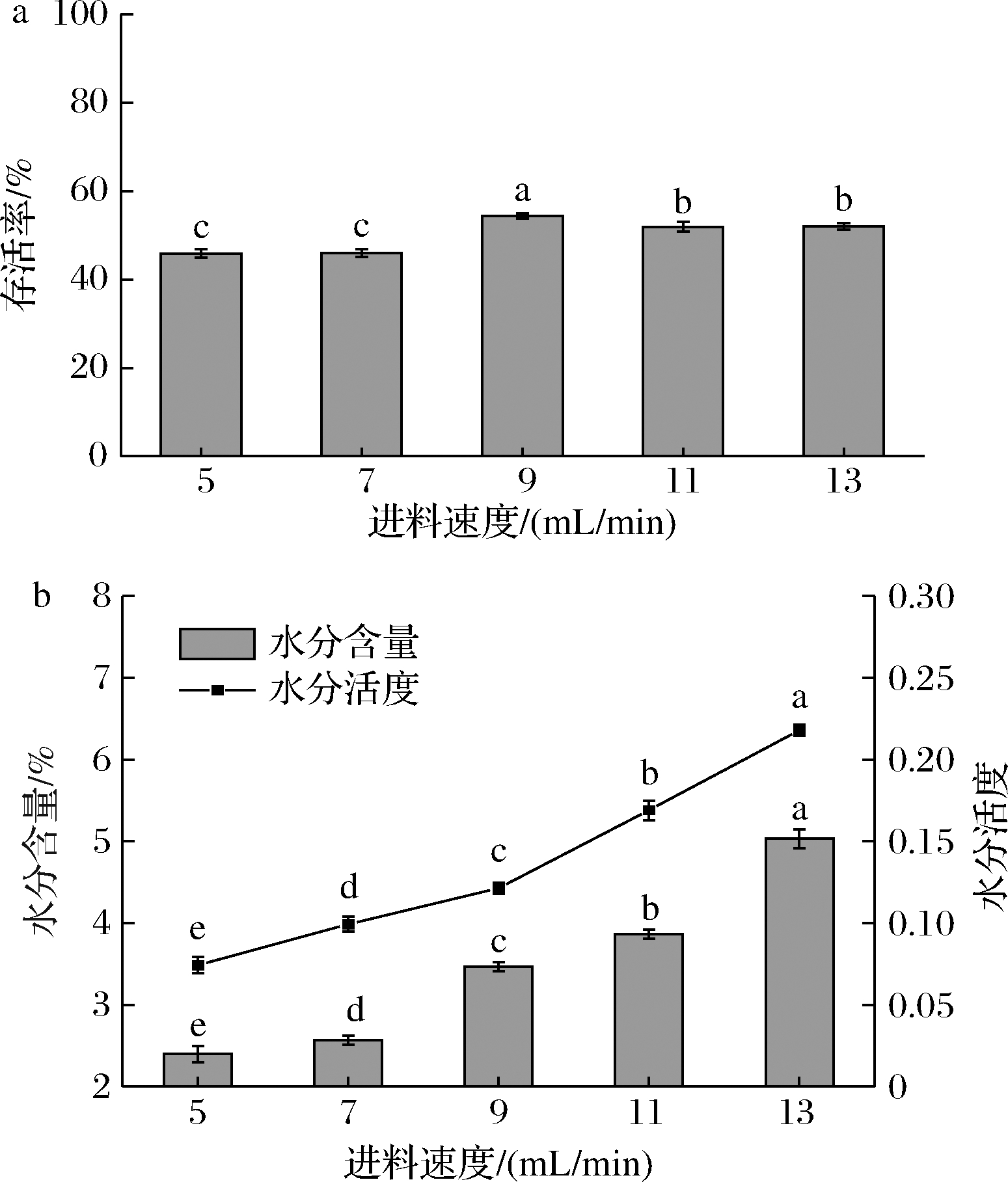
a-存活率;b-水分含量
图1 进料速度对植物乳植杆菌P-8菌粉品质的影响
Fig.1 Effect of feed rates on the quality of L.plantarum P-8 powder
注:不同小写字母表示组间差异显著(P<0.05)(下同)。
2.1.2 雾化压强对植物乳植杆菌P-8菌粉的影响
在喷嘴直径为1.5 mm、进料速度9 mL/min、干燥温度70 ℃的条件下,进行低温喷雾干燥,确定最佳雾化压强。在低温喷雾过程中,不同的雾化压强导致菌株存活率存在明显差异。由图2可知,雾化压强为0.3 MPa时,存活率最高为56.3%。干燥过程中雾化压强低,导致液滴分散程度不高,所需干燥时间长,增加了菌体与热空气接触时间,对细菌活性损伤较大。雾化压强过高,则会对细胞造成额外机械损伤,破坏细菌结构,导致存活率下降。因此,选取雾化压强为0.3 MPa。

a-存活率;b-水分含量
图2 雾化压强对植物乳植杆菌P-8菌粉品质的影响
Fig.2 Effect of atomization pressure on the quality of L.plantarum P-8 powder
2.1.3 干燥温度对植物乳植杆菌P-8菌粉的影响
在进料速度为9 mL/min、喷嘴直径为1.5 mm、雾化压强为0.3 MPa的条件下,进行低温喷雾干燥,结果如图3所示。
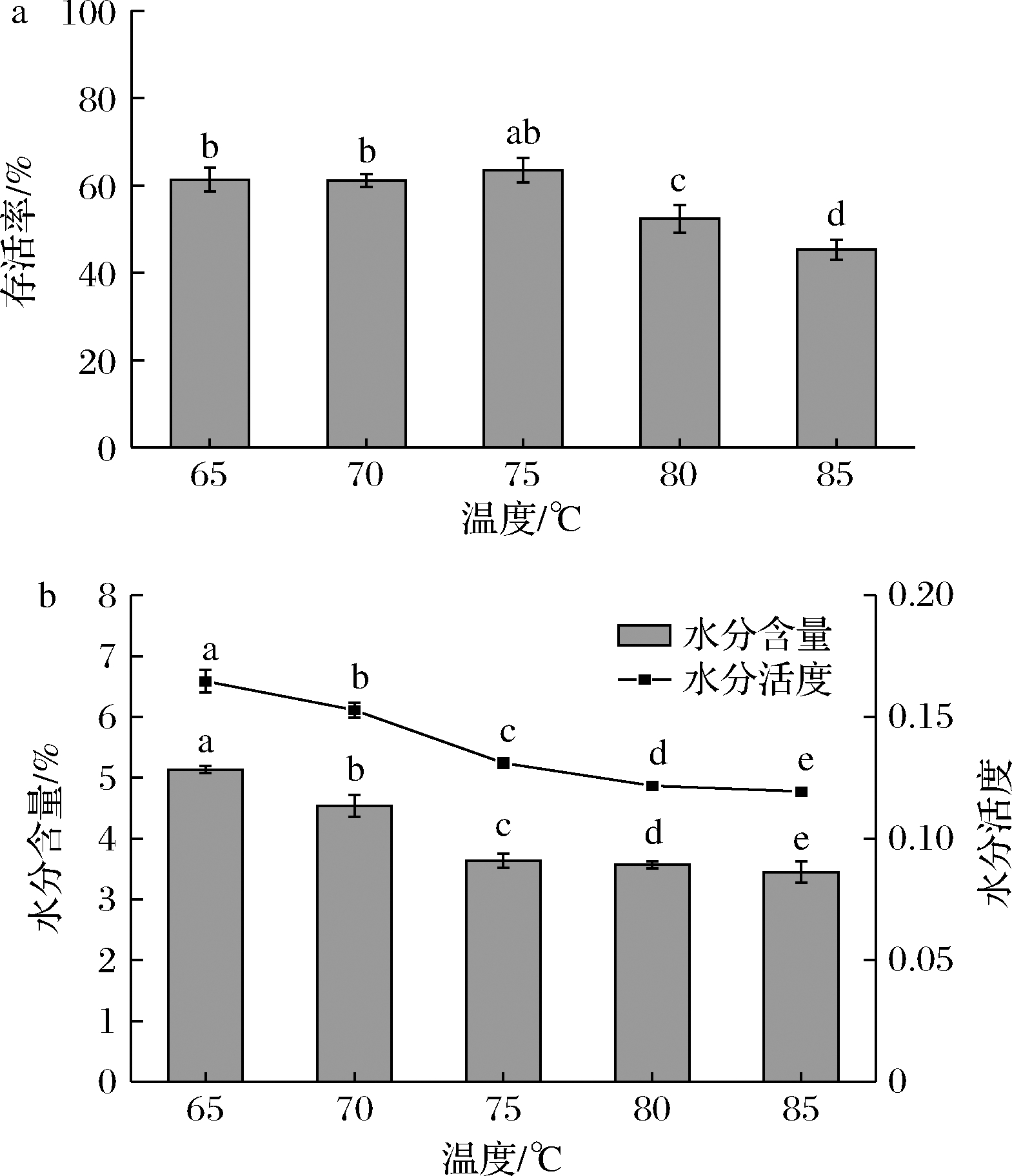
a-存活率;b-水分含量
图3 干燥温度对植物乳植杆菌P-8菌粉品质的影响
Fig.3 Effect of drying temperatures on the quality of L.plantarum P-8 powder
由图3可知,随着干燥温度的不断提升,菌粉水分含量及水分活度呈下降趋势,在65和70 ℃干燥的菌粉水分含量均在4.8%以上,显著高于(P<0.05)其他实验组,不利于菌粉的贮藏[16]。干燥温度过低,同样增加了菌体干燥脱水的时间,致使益生菌活性受损;干燥温度过高,则会破坏菌体结构,导致存活率急剧下降。高品质益生菌不仅要有较高活菌数,还要具有良好的贮藏稳定性,因此综合考虑,确定最佳的干燥温度为75 ℃,此时菌体存活率达到最高63.53%,且水分含量也小于4%。
2.2 响应面法优化低温喷雾干燥制备植物乳植杆菌P-8工艺研究
根据单因素试验结果,设计3因素3水平共17个试验点的响应面分析,具体设计及结果见表2。
表2 旋转中心组合设计结果
Table 2 Design results of combined rotation center
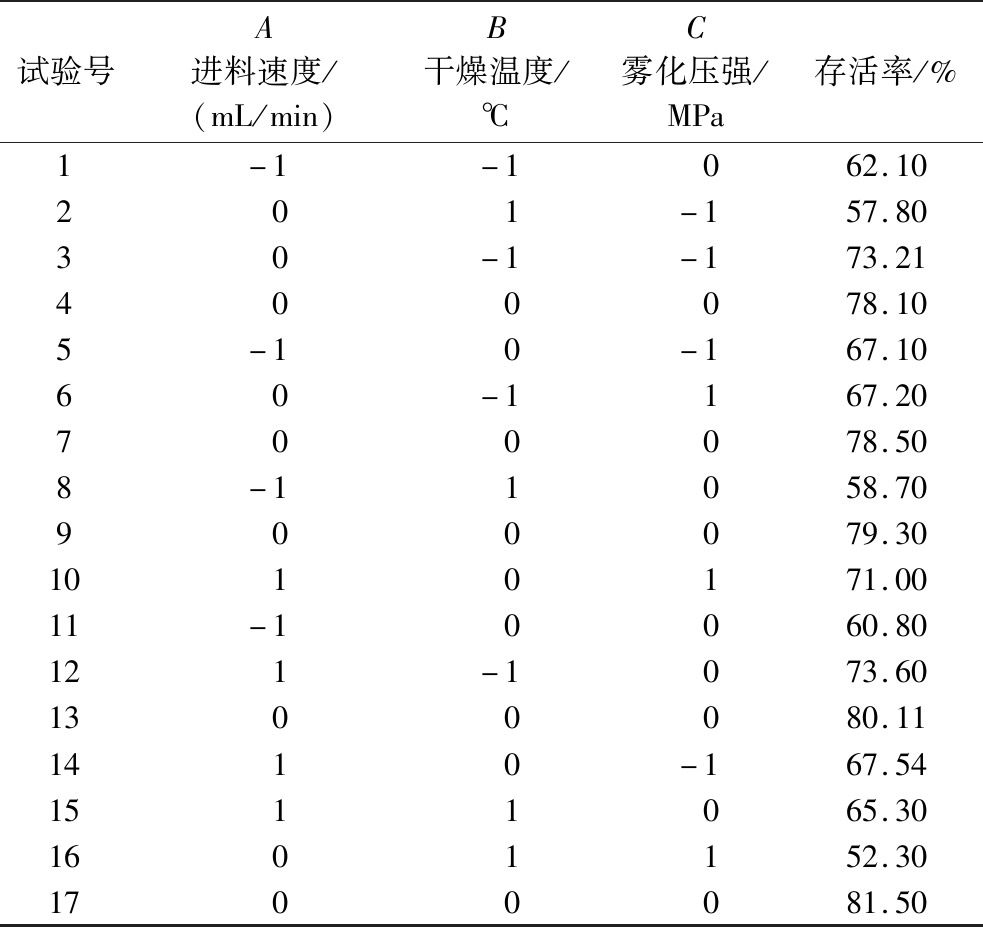
试验号A进料速度/(mL/min)B干燥温度/℃C雾化压强/MPa存活率/%1-1-1 062.10201-157.8030-1-173.21400078.105-10-167.1060-1167.20700078.508-11058.70900079.301010171.0011-10060.80121-1073.601300080.111410-167.541511065.301601152.301700081.50
采用Design Expert 13.0软件对试验数据进行多元回归拟合,获得如下回归方程:
存活率/%=79.50+2.599A+3.50B-1.04C+0.225 0AB+1.44AC-2.63BC-7.55A2-8.03B2-6.34C2
由表3可知,模型F值为32.15且P<0.01,表明回归模型中自变量与因变量有良好的线性关系,达到极显著水平;失拟项F值为2.97,P=0.159 9>0.05,表明该模型拟合度较好与实际情况基本符合;方差结果表明,进料速度与干燥温度对菌体存活率影响极显著(P<0.01),雾化压强对菌体存活率影响不显著(P>0.05),各因素间对存活率影响程度大小为干燥温度>进料速度>雾化压强;二次项A2、B2、C2对菌体存活率也均有极显著影响(P<0.01);该模型决定系数R2=0.976 4,调整后Radj2=0.946 0,说明该模型预测值与实际值拟合度高,能反映94.6%的响应面值变化,因此,回归方程可用于低温喷雾干燥法制备植物乳植杆菌P-8菌粉存活率的预测。
表3 二次回归模型方差分析
Table 3 Variance analysis of quadratic regression model

方差来源平方和自由度均方F值P值模型984.529109.3932.15<0.0001A103.251103.2530.250.0009B128.081128.0837.650.0005C2.3712.370.69520.4319AB6.0016.001.760.2258AC23.81123.817.000.0332BC27.62127.628.120.0247A2180.491180.4953.050.0002B2271.481271.4879.79<0.0001C2169.501169.5049.820.0002残差项23.8073.40失拟项16.4435.482.970.1599误差7.3741.84和1008.3316R2=0.9764Radj2=0.9460
注:P<0.05差异显著,P<0.01差异极显著。
图4-a为干燥温度与进料速度对存活率的相互作用图,并且响应面为凸形曲面,表明存在极值点,此时存活率最高。从图4-b可以看出,进料速度与雾化压强的相互作用曲线斜率值不高,说明二者的相互作用对存活率影响较小。图4-c可知,存活率随干燥温度与雾化压强的增大而提高,当达到顶点时存活率达到最大值,继续增大则呈现下降趋势。

a-干燥温度与进料速度;b-雾化压强与进料速度;c-雾化压强与干燥温度
图4 因素交互作用响应面图
Fig.4 Response surface plot of interactive effects of various factors
通过响应面试验最终得到,进料速度为9 mL/min、雾化压强为0.3 MPa、干燥温度75 ℃时,预测存活率为81.93%,并对最佳工艺条件进行多次试验,发现平均存活率为81.5%,与理论预测数值相比较无明显差别(P>0.05),符合方程的预测值。并且在此条件下制备的菌粉水分含量及水分活度分别为3.7%和0.14,符合菌粉的贮藏要求[16]。
2.3 颗粒形貌观察
如图5所示,低温喷雾干燥前植物乳植杆菌P-8呈短杆状,形态饱满、表面无裂纹,与保护剂混合均匀后,菌体表面被薄层所包裹,在一定程度上保护了细胞,降低了与外部环境的接触,同时能够维持细胞形态的完整性[17]。图5-b可知,干燥后颗粒表面出现褶皱和凹陷,这是因为在干燥过程中,物料与热空气接触水分被快速蒸发,温度降低后表面急速收缩所形成的,并不会对内部菌体造成损伤。干燥后的颗粒未出现破裂和空洞现象,说明保护剂以及干燥工艺参数的优化使得菌体在干燥过程中得到了良好的保护作用,能够有效防止在贮藏过程中发生脂质过氧化[18]。快速干燥同样也使得菌粉颗粒含水量小,无明显粘连现象。

a-干燥前;b-干燥后
图5 植物乳植杆菌P-8干燥前后微观形态
Fig.5 Morphorlogy of L.plantarum P-8 before and after spray drying
2.4 动态体外胃肠液耐受性
2.4.1 食糜固含量及pH的变化
如图6所示,模拟消化过程中样品的固含量随消化时间呈现上升趋势,这是由于胃蛋白酶、胰蛋白酶和胆汁盐增加样品的固含量。pH在胃液消化60 min内由5.76急速下降至1.35左右,而进入小肠后pH又在模拟肠液的作用下急剧回升到8.5左右。pH值的急剧变化是因为菌粉的载体主要是水不具备缓冲能力,无法像以发酵乳[19]为载体,能够抵御强酸强碱环境对其活性的影响。
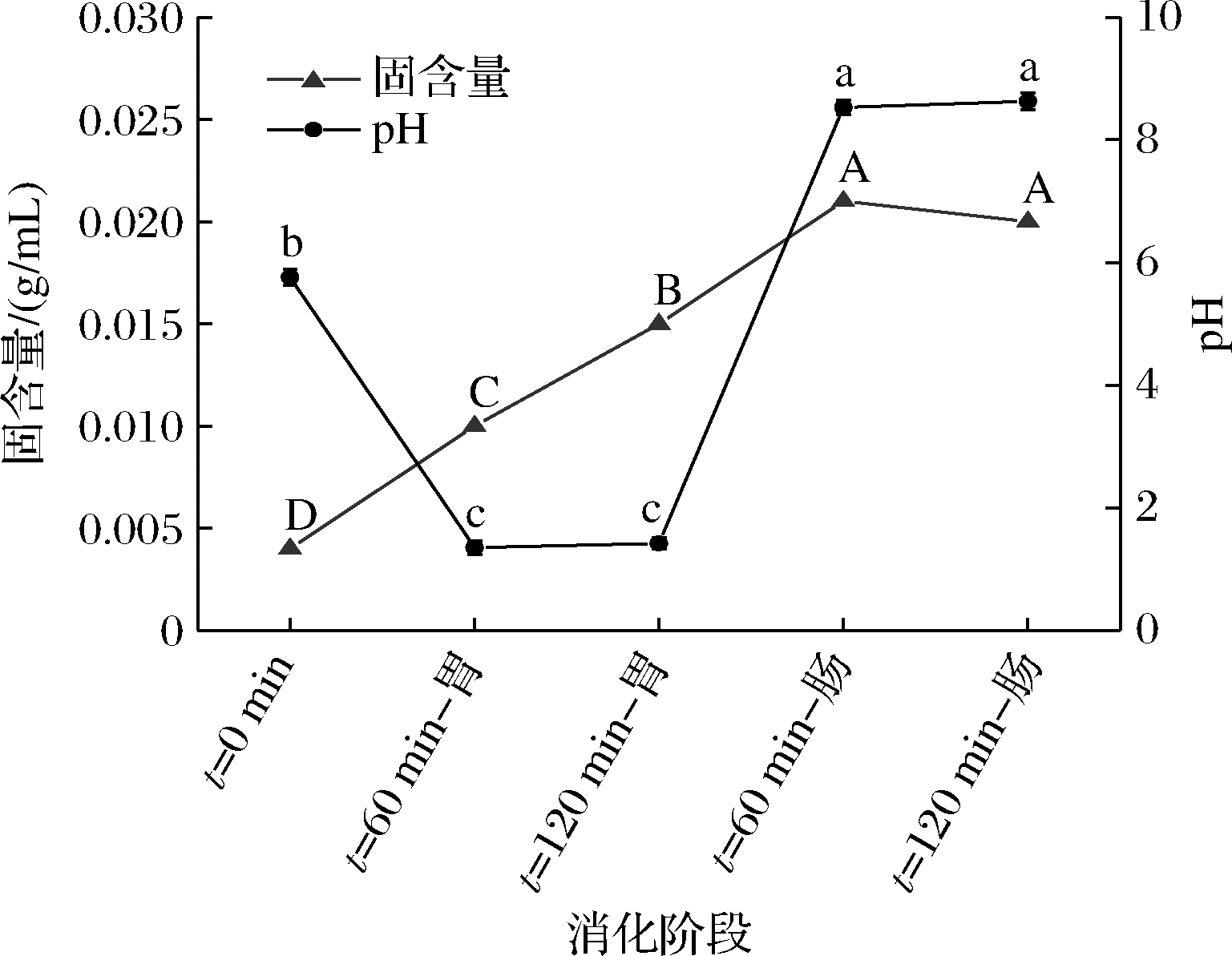
图6 胃和肠道内pH值以及固含量变化
Fig.6 Changes in pH and solid content in the stomach and intestine
2.4.2 活菌浓度及存活率变化
相较于传统的静态模拟胃、肠液耐受性试验,体外仿生胃肠消化系统DHSI-IV,通过高度模拟真实人体的胃、肠道蠕动和收缩的消化过程,实时监控胃部以及肠道的pH动态变化,避免了静态实验的局限性,能够更精确的研究益生菌的胃肠道存活特性[20]。
将优化后工艺制备的菌粉作为实验组,优化前工艺进料速度为7 mL/min、干燥温度75 ℃、雾化压强为0.35 MPa作为对照组,进行后续试验。由表4可知,实验组样品在经过动态模拟胃肠道消化120 min后,胃内及小肠内存活率分别为37%和11%,与对照组相比,存活率提高了6%和3%,这与伍鹏等[19]的实验结果类似。实验表明,植物乳植杆菌P-8本身具有良好的胃肠液耐受特性,工艺优化处理后这一特性并未显著提高,分析原因,耐受性的提高可能是保护性载体的作用。有研究表明,功能性低聚糖类一般都具有良好的耐热耐酸性,不仅可以减少干燥过程中益生菌所受到的热损伤,还可以一定程度上抵御胃酸的侵蚀,提高菌株的胃肠液耐受性[21]。
表4 植物乳植杆菌P-8在胃肠道消化过程中活菌浓度及存活率变化
Table 4 Changes of viable concentrations and survival rate of L.plantarum P-8 during gastrointestinal digestion

胃液环境肠液环境活菌浓度/(lgCFU/mL)存活率/%活菌浓度/(lgCFU/mL)存活率/%0min60min120minS60minS120min60min120minI60minI120min实验组8.608.147.7264±11a37±4b7.706.9935±3b11±3c对照组8.538.007.5658±4a31±7b7.536.7829±4b8±3c
注:组别间字母不同表示差异显著(P<0.05)。
2.5 贮藏稳定性测定
高品质的益生菌产品不仅要保证其具有高活菌数,还需要具有良好的贮藏稳定性[22]。在贮藏过程中,温度是影响存活率的关键因素。本试验将低温喷雾干燥后所制备的菌粉分别贮藏于冷藏环境(4 ℃)和常温环境(25 ℃)中,7 d为一周期,贮藏35 d,测定其存活率。

a-4 ℃贮藏;b-25 ℃贮藏
图7 植物乳植杆菌P-8菌粉贮藏期间存活率变化
Fig.7 Changes of survival rate of L.plantarum P-8 powder during storage
注:不同小写字母表示同一组别不同时间差异显著,不同大写字母表示相同时间不同组别差异显著(P<0.05)。
由图7可知,不同温度贮藏菌粉存活率变化差异显著。其中实验组存活率在各个时期都显著高于对照组(P<0.05),这表明经工艺优化后菌粉的贮藏稳定性有显著提高。在4和25 ℃环境下贮藏35 d后,实验组存活率分别为92.18%和87.49%。与本试验相类似的QUINTANA等[23]对Lactobocillus plantarum CIDCA进行喷雾干燥贮藏实验,结果发现4 ℃保存90 d存活率显著高于25 ℃保存90 d,贮藏时间与温度的增加,导致了菌株存活率下降显著。这是由于贮藏温度的升高会加剧细胞膜的脂质氧化,影响菌株活性,而在低温条件下酶活性受到抑制,微生物的代谢活动也会减少[24-25]。
3 结论
本试验探究了低温喷雾干燥法制备植物乳植杆菌P-8的生产工艺,并对其受损伤情况以及贮藏稳定性进行了评价,研究表明在进料速度为9 mL/min、干燥温度75 ℃、雾化压强为0.3 MPa条件下制备的菌粉存活率最高达到81.5%,水分含量为3.7%,水分活度为0.14。并且菌粉颗粒形态完整、表面虽有褶皱但无破损,有利于维持菌粉的贮藏稳定性。通过测定菌粉在体外仿生胃肠消化模型中的耐受性,结果表明实验组存活率均高于对照组,具有更好的耐受能力。4 ℃贮藏35 d菌株存活率为92.18%,25 ℃贮藏35 d菌株存活率为87.49%,均高于对照组,低温贮藏有利于保持益生菌粉的活性。低温喷雾干燥法具有制备高品质益生菌制剂的潜力,能够为益生菌的应用及工业化生产提供理论支持与指导作用。
致谢:本文得到2021年度自治区本级事业单位引进高层次人才科研支持经费。
[1] KHEM S,WOO M W,SMALL D M,et al.Agent selection and protective effects during single droplet drying of bacteria[J].Food Chemistry,2015,166:206-214.
[2] FRITZEN-FREIRE C B,PRUD NCIO E S,AMBONI R D M C,et al.Microencapsulation of bifidobacteria by spray drying in the presence of prebiotics[J].Food Research International,2012,45(1):306-312.
NCIO E S,AMBONI R D M C,et al.Microencapsulation of bifidobacteria by spray drying in the presence of prebiotics[J].Food Research International,2012,45(1):306-312.
[3] WANG L F,LIU C H,CHEN M,et al.A novel Lactobacillus plantarum strain P-8 activates beneficial immune response of broiler chickens[J].International Immunopharmacology,2015,29(2):901-907.
[4] BAO Y,ZHANG Y,LI H P,et al.In vitro screen of Lactobacillus plantarum as probiotic bacteria and their fermented characteristics in soymilk[J].Annals of Microbiology,2012,62(3):1311-1320.
[5] CHEN P,XU H Y,TANG H,et al.Modulation of gut mucosal microbiota as a mechanism of probiotics-based adjunctive therapy for ulcerative colitis[J].Microbial Biotechnology,2020,13(6):2032-2043.
[6] XU H Y,MA C,ZHAO F Y,et al.Adjunctive treatment with probiotics partially alleviates symptoms and reduces inflammation in patients with irritable bowel syndrome[J].European Journal of Nutrition,2021,60(5):2553-2565.
[7] CHEN Y,WANG Y J,YOU L J,et al.Effect of combination treatment with metformin and probiotics Probio-Fit® on clinical symptoms and gut microbiota structure in type 2 diabetes[J].Journal of Chinese Institute of Food Science and Technology,2019,19(4):16-26.
[8] ZHANG J C,ZHAO J S,JIN H,et al.Probiotics maintain the intestinal microbiome homeostasis of the sailors during a long sea voyage[J].Gut Microbes,2020,11(4):930-943.
[9] LEW L C,HOR Y Y,YUSOFF N A A,et al.Probiotic Lactobacillus plantarum P8 alleviated stress and anxiety while enhancing memory and cognition in stressed adults:A randomised,double-blind,placebo-controlled study[J].Clinical Nutrition,2019,38(5):2053-2064.
[10] 王淑敏,桑跃,侯彩云,等.冷冻干燥乳双歧杆菌A04菌粉的贮藏活性研究[J].中国食品学报,2021,21(9):192-202.
WANG S M,SANG Y,HOU C Y,et al.Studies on survival of freeze-dried Bifidobacterium lactis A04 powder during storage[J].Journal of Chinese Institute of Food Science and Technology,2021,21(9):192-202.
[11] FU N,HUANG S,XIAO J,et al.Producing powders containing active dry probiotics with the aid of spray drying[J].Advances in Food and Nutrition Research,2018,85:211-262.
[12] KESHANI S,DAUD W R W,NOUROUZI M M,et al.Spray drying:An overview on wall deposition,process and modeling[J].Journal of Food Engineering,2015,146:152-162.
[13] SCHUCK P,DOLIVET A,MÉJEAN S,et al.Spray drying of dairy bacteria:New opportunities to improve the viability of bacteria powders[J].International Dairy Journal,2013,31(1):12-17.
[14] PEIGHAMBARDOUST S H,TAFTI A G,HESARI J.Application of spray drying for preservation of lactic acid starter cultures:A review[J].Trends in Food Science &Technology,2011,22(5):215-224.
[15] 陈光宇,宋毓涛,刘又嘉,等.响应面设计试验法优化沙棘固本速溶茶低温喷雾干燥工艺[J].中国现代应用药学,2019,36(12):1516-1521.
CHEN G Y,SONG Y T,LIU Y J,et al.Optimization of low-temperature spray-drying process of sea-buckthorn strengthening tea granules by response surface methodology[J].Chinese Journal of Modern Applied Pharmacy,2019,36(12):1516-1521.
[16] 吴德龙,王志耕,梅林,等.真空低温喷雾干燥法制备乳酸菌微胶囊的工艺参数优化[J].江苏农业科学,2015,43(10):367-370.
WU D L,WANG Z G,MEI L,et al.Optimization of technological parameters for preparation of lactic acid bacteria microcapsules by vacuum low temperature spray drying[J].Jiangsu Agricultural Sciences,2015,43(10):367-370.
[17] RAJAM R,ANANDHARAMAKRISHNAN C.Microencapsulation of Lactobacillus plantarum (MTCC 5422) with fructooligosaccharide as wall material by spray drying[J].LWT -Food Science and Technology,2015,60(2):773-780.
[18] 郭帅,王昊乾,徐鹏飞,等.真空低温喷雾干燥制备乳双歧杆菌Probio-M8微胶囊[J].中国食品学报,2021,21(12):164-172.
GUO S,WANG H Q,XU P F,et al.Preparation of Bifidobacterium lactis Probio-M8 microcapsule by vacuum low temperature spray drying[J].Journal of Chinese Institute of Food Science and Technology,2021,21(12):164-172.
[19] 伍鹏,王娟,王晶晶,等.基于仿生胃肠道模型的发酵乳中益生菌存活率评价[J].食品与发酵工业,2021,47(12):147-153.
WU P,WANG J,WANG J J,et al.Evaluation of probiotics viability in fermented milk based on a biomimetic gastrointestinal model[J].Food and Fermentation Industries,2021,47(12):147-153.
[20] AFZAAL M,KHAN A U,SAEED F,et al.Survival and stability of free and encapsulated probiotic bacteria under simulated gastrointestinal conditions and in ice cream[J].Food Science &Nutrition,2020,8(3):1649-1656.
[21] WANG Y C,YU R C,CHOU C C.Viability of lactic acid bacteria and bifidobacteria in fermented soymilk after drying,subsequent rehydration and storage[J].International Journal of Food Microbiology,2004,93(2):209-217.
[22] 张晓宁.不同干燥方式及贮藏环境对植物乳杆菌LIP-1活性影响的研究[D].呼和浩特:内蒙古农业大学,2019.
ZHANG X N.Effects of Lactobacillus plantarum LIP-1 activity during storage in different drying methods[D].Hohhot:Inner Mongolia Agricultural University,2019.
[23] QUINTANA G,GERBINO E,G MEZ-ZAVAGLIA A.Okara:A nutritionally valuable by-product able to stabilize Lactobacillus plantarum during freeze-drying,spray-drying,and storage[J].Frontiers in Microbiology,2017,8:641.
MEZ-ZAVAGLIA A.Okara:A nutritionally valuable by-product able to stabilize Lactobacillus plantarum during freeze-drying,spray-drying,and storage[J].Frontiers in Microbiology,2017,8:641.
[24] OKURO P K,THOMAZINI M,BALIEIRO J C C,et al.Co-encapsulation of Lactobacillus acidophilus with inulin or polydextrose in solid lipid microparticles provides protection and improves stability[J].Food Research International,2013,53(1):96-103.
[25] 傅楠,陈晓东.益生菌在喷雾干燥过程中的活性变化与保护策略[J].化工进展,2018,37(5):1633-1645.
FU N,CHEN X D.Changes in the viability of probiotics during spray drying process and the strategies to protect probiotic cells[J].Chemical Industry and Engineering Progress,2018,37(5):1633-1645.