榨取菜籽油后所剩的粮油副产物称为菜籽粕,其富含有价值的化合物,例如蛋白质(32%~48%)、氨基酸等[1-2]。然而,菜籽粕中因硫甙、植酸等多种抗营养因子及高纤维的存在降低了它的营养价值,这些抗营养因子可以使消化酶失活,降低营养物质的利用率[3]。大量研究发现微生物发酵法具有一定的脱毒效果,可降解抗营养因子,同时在发酵过程中微生物分泌多种酶,如纤维素酶、蛋白酶等,能做到有效地降解纤维且产生大量蛋白[4]。在粕类发酵中,主要的菌种为乳酸菌属、芽孢杆菌属、曲霉类和酵母类[5]。乳酸菌被认为是传统生物安全的能产生乳酸的菌种,它是能够利用碳水化合物进行发酵的细菌,产生短链脂肪酸如乳酸,迅速降低环境pH并控制病原微生物的生长,是最早得到商业应用的益生菌;芽孢杆菌是一种具有高抗逆性的好氧菌,可分泌α-淀粉酶、蛋白酶、脂肪酶和单宁酶等;丝状真菌是一类重要的工业微生物,被广泛应用于酶类、有机酸、抗生素等生产,其中曲霉是主要的产酶微生物,其分泌大量水解酶可达到降解菜籽饼粕中抗营养因子和提高蛋白质、多肽含量的目的[6]。
传统发酵中多以单菌发酵为主,发酵无法充分进行,很难同时解决多元问题,效果显著性有待提高。近年来,2种或者2种以上的微生物共同发酵具有良好的效果,主要是多菌协同,产生的酶系丰富,厌氧和好氧菌共同发酵,在不同发酵阶段发挥作用,缩短发酵周期的同时可能使新的物质产生,发酵品中的营养物质更加丰富,发酵效果更明显[7]。液态与固态发酵中,固态发酵的方式是一种简单、经济、可控、高效的方法,可提高多种豆类和谷物的功能特性和营养价值[8]。混菌固态发酵过程中会发生许多生化变化,例如,抗营养因子能被有效降解,蛋白质可以被蛋白酶有效水解,从而产生短链低分子质量化合物[9-10]。
目前对于菜籽粕的研究主要集中在抗营养因子去除、营养物质提高和作为动物饲料进行饲养的研究上[11],缺乏对于菜籽粕蛋白作为植物蛋白的开发利用上的研究。本试验旨在通过三菌混合接种来研究发酵对菜籽粕可溶性蛋白(soluble protein,SP)含量的优化工艺,从而提高菜籽粕蛋白的提取率,并对发酵过程进行测定,探究蛋白质、硫苷、微生物的变化,为扩大菜籽粕的应用提供技术支撑。
1 材料与方法
1.1 主要材料与试剂
菜籽粕(粗蛋白含量40.0%),四川富顺廖杨洋粮油有限公司;植物乳杆菌(Lactobacillus plantarum)、枯草芽孢杆菌(Bacillus subtilis)与米曲霉(Aspergillus oryzae),均来自河南省工业微生物菌种保藏中心;牛血清蛋白(≥ 98%),索莱宝生物科技有限公司;考马斯亮蓝G-250,上海蓝季科技发展有限公司;氯化钯,国药集团化学试剂有限公司;其他化学试剂均为分析纯,天津市科密欧化学试剂有限公司等。
1.2 仪器与设备
BCM1000超净工作台,北京华仪兴创科技有限公司;TDL-5-A离心机,上海安亭科学仪器厂;HH-4型恒温水浴摇床,河南智城科技发展有限公司;UV-5500PC紫外可见分光光度计,上海元析仪器有限公司;DNP-9272BS-Ⅲ电热恒温培养箱,上海新苗医疗器械制造有限公司;JP-100A-2高速多功能粉碎机,永康市久品工贸有限公司;LS-75HD型立式压力蒸汽灭菌器,江阴滨江医疗设备有限公司。
1.3 试验方法
1.3.1 菌种活化
取少量植物乳杆菌、枯草芽孢杆菌、米曲霉的冻干粉分别接种于MRS培养基(液体)、LB培养基(液体)、察氏培养基(固体)中,封口后分别置于37 ℃静置培养、37 ℃振荡培养、30 ℃静置培养到24 h,作为第一代种子液。接种环挑取米曲霉的一代菌种划线,其他重复上述操作,作为第二代菌种。
1.3.2 固态发酵制备
1)菜籽粕预处理
将采购回来的菜籽粕放入烘箱65 ℃烘干,进行50目过筛后于4 ℃保存备用。
2)制备工艺
发酵菌液的制备:将活化的植物乳杆菌、枯草芽孢杆菌吸取1 mL菌液于100 mL相应液体培养基中,在相应条件下培养 24 h后,制成发酵菌液。米曲霉接种于固体培养基中,30 ℃静置培养,培养到长满孢子,刮取孢子于生理盐水中,血球计数板在显微镜下调整孢子数为1×107~2×107 CFU/g。
发酵步骤:称取25 g经过预处理的菜籽粕于三角瓶中,121 ℃灭菌20 min,冷却后按比例加入各菌液和灭菌的葡萄糖水,玻璃棒搅匀后用2层纱布加报纸封口,在培养箱中进行发酵,定期翻料,发酵结束后65 ℃下烘干,粉碎后过60目筛,保存备用。
1.3.3 可溶性蛋白的测定
参照徐亚等[12]的方法,采用考马斯亮蓝法测定,取1 g样品置于50 mL离心管中,加40 mL蒸馏水,35 ℃振荡2 h,以5 000 r/min离心10 min,取100 μL上清液,加5 mL考马斯亮蓝溶液,摇匀,静置2 min后在595 nm处测定吸光度。相同条件下,以牛血清白蛋白为标准品,配制0、20、40、60、80、100 μg/mL的标准溶液,制作标准曲线。SP含量按照公式(1)计算:
(1)
式中:ω,从标准曲线查得的蛋白质含量,μg/g;N,稀释倍数;m,样品质量,g。
1.3.4 多肽的测定
参考秦卫东等[13]的方法,采用双缩脲试剂法,取4 g发酵样品,加40 mL蒸馏水,磁力搅拌15 min,5 000 r/min离心10 min,取3 mL上清液加入等体积的100 g/L三氯乙酸,混匀后于5 000 r/min离心10 min。取1 mL上清液加4 mL双缩脲试剂混匀,避光静置30 min后于波长540 nm处测其吸光度,空白为蒸馏水。以牛血清蛋白为标样,配制0、2、4、6、8、10 mg/mL的标准样品,制作标准曲线。多肽含量按照公式(2)计算:
多肽![]()
(2)
式中:ρ,上清液中多肽的的质量浓度,mg/mL;V,溶解样品提取多肽所用蒸馏水体积,mL;m,原料发酵后称取测定的样品质量,g。
1.3.5 聚丙烯酰胺凝胶电泳(SDS-PAGE)
参考刘晨星等[14]的方法,取1 g样品加0.1 mol/L缓冲液20 mL,充分混匀后37 ℃振荡3 h,5 000 r/min离心10 min。取上清液以体积比1∶1加上样缓冲液,沸水浴3~5 min,以4 000 r/min离心5 min,用微量注射器取20 μL样品加入梳槽中。SDS-PAGE采用体积分数5%浓缩胶以及体积分数12%分离胶,开始80 V电压,后电压改为100 V,溴酚蓝到达底部后结束电泳,染色过夜,脱色后采集图像[15]。
1.3.6 蛋白二级结构的测定
参考FEVZIOGLU等[16]的方法,空晶体作为背景进行采集后,将发酵烘干粉碎处理后的样品放在晶体中压成薄片,光谱采集的分辨率为4 cm-1,频率范围为4 000~750 cm-1,每个样品重复3次试验。利用Peak Fit 软件,对1 600~1 700 cm-1区域的红外谱图进行二阶导数峰值拟合,得到蛋白质二级结构相关数据信息。
1.3.7 硫苷的测定
参考孙宏[17]的方法,称取0.1 g菜籽粕于10 mL离心管中,沸水浴干热15 min,加入约95 ℃热蒸馏水8 mL,再置沸水浴中30 min,冷却后稀释至10 mL,混匀后,5 000 r/min离心10 min。取2 mL滤液于10 mL试管中,加1 g/L羧甲基纤维素钠4 mL,再加入2 mL PdCl2显色液,放置60 min后摇匀。在540 nm下,以PdCl2加蒸馏水做为空白测定吸光度A1。再分别取2 mL滤液于另一10 mL试管中,加入1 g/L羧甲基纤维素钠4 mL,0.03 mol/L HCl溶液2 mL,在室温下放置120 min后,以蒸馏水加羧甲基纤维素钠做空白标定,测定吸光值A2,则A=A1-A2。按公式(3)计算:
硫苷含量/(μmol/g)=0.2+185.2A
硫苷降解率![]()
(3)
式中,m前,菜籽粕发酵前硫苷含量,μmol/g;m后,菜籽粕发酵后硫苷含量,μmol/g。
1.3.8 活菌群数测定
乳酸菌数[18]:MRS培养基,按GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》涂布法平板计数。枯草芽孢杆菌[19]:LB培养基,按GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》使用涂布法平板计数。米曲:PDA培养基,按GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》采用涂布法平板计数。
1.4 实验设计
1.4.1 接种比例的确定
试验选用植物乳杆菌、枯草芽孢杆菌、米曲霉3菌进行发酵,在优化发酵前应先确定合适的各菌接种比例,设计L9(34)正交试验如表1所示。
表1 正交试验因素和水平
Table 1 Orthogonal test factors and levels
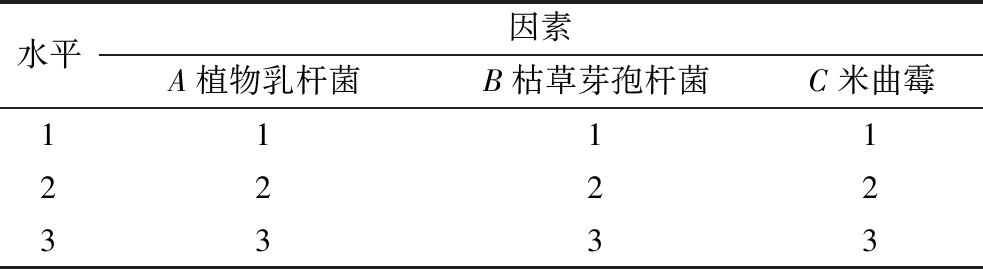
水平因素A植物乳杆菌B枯草芽孢杆菌C米曲霉111122223333
1.4.2 单因素试验
以SP提取率为指标进行单因素试验设计。分别研究料液比(1∶0.8、1∶1、1∶1.2、1∶1.4、1∶1.6,g∶mL)、接种量(6%、8%、10%、12%、14%)、发酵温度(28、31、34、37、40 ℃)、发酵时间(24、48、72、96、120 h)对混菌固态发酵提取SP的影响。
1.4.3 响应面优化
在单因素试验的基础上,根据方差分析结果,选择对SP提取率影响显著的因素,以SP提取率为响应值,设计4因素3水平的响应面实验。其因素水平及编码设计如表2所示。
表2 响应面实验因素和水平
Table 2 Experimental factors and levels of response surface
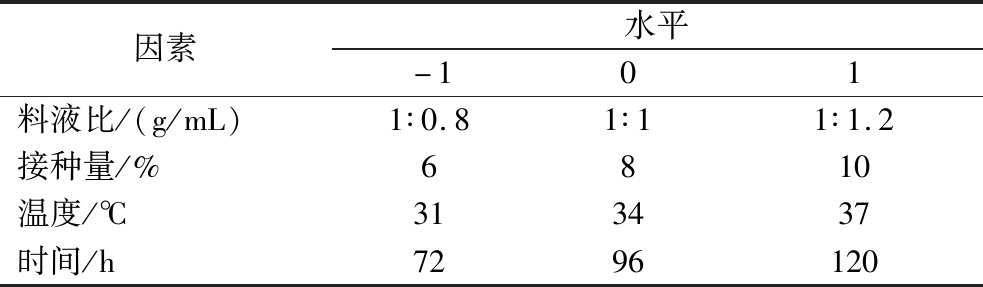
因素水平-101料液比/(g/mL)1∶0.81∶11∶1.2接种量/%6810温度/℃313437时间/h7296120
1.5 数据处理
所有试验组均进行3次重复,以平均值±标准偏差表示,在Excel中进行数据整理后,使用SAS 9.2中的(One way ANOVA)对单因素及发酵过程中各组分变化进行统计学分析,Design-Expert 8.0.6进行响应面设计及分析,采用Fisher’s LSD的方法进行多重比较,采用Origin 2018进行数据分析,其中P<0.05表示差异显著。
2 结果与讨论
2.1 接种比例的确定
通过正交试验得到,各因素的影响大小结果依次为B>C>A,即枯草芽孢杆菌对发酵菜籽粕的影响最大,其次为米曲霉,最小为植物乳杆菌。最佳接种方案为A2B2C1,L. plantarum、B. subtilis、A. oryzae的最佳接种比例为2∶2∶1。
2.2 工艺参数对固态发酵菜籽粕SP提取率的影响
2.2.1 料液比对SP的影响
由图1可知,在料液比1∶1时SP提取率达到最高(22.175±0.63)%,显著高于其他处理组(P<0.05)。出现此情况,可能是因为料液比较低时,发酵基质没达到菌生长的最适水分,且后期水分蒸发变得干燥更难以生长,造成SP处于低水平;随着料液比的升高,基质中透气性差导致含氧量降低,好氧的B. subtilis和A. oryzae的生长受限,且有可能不利于次级代谢物的产生[20]。
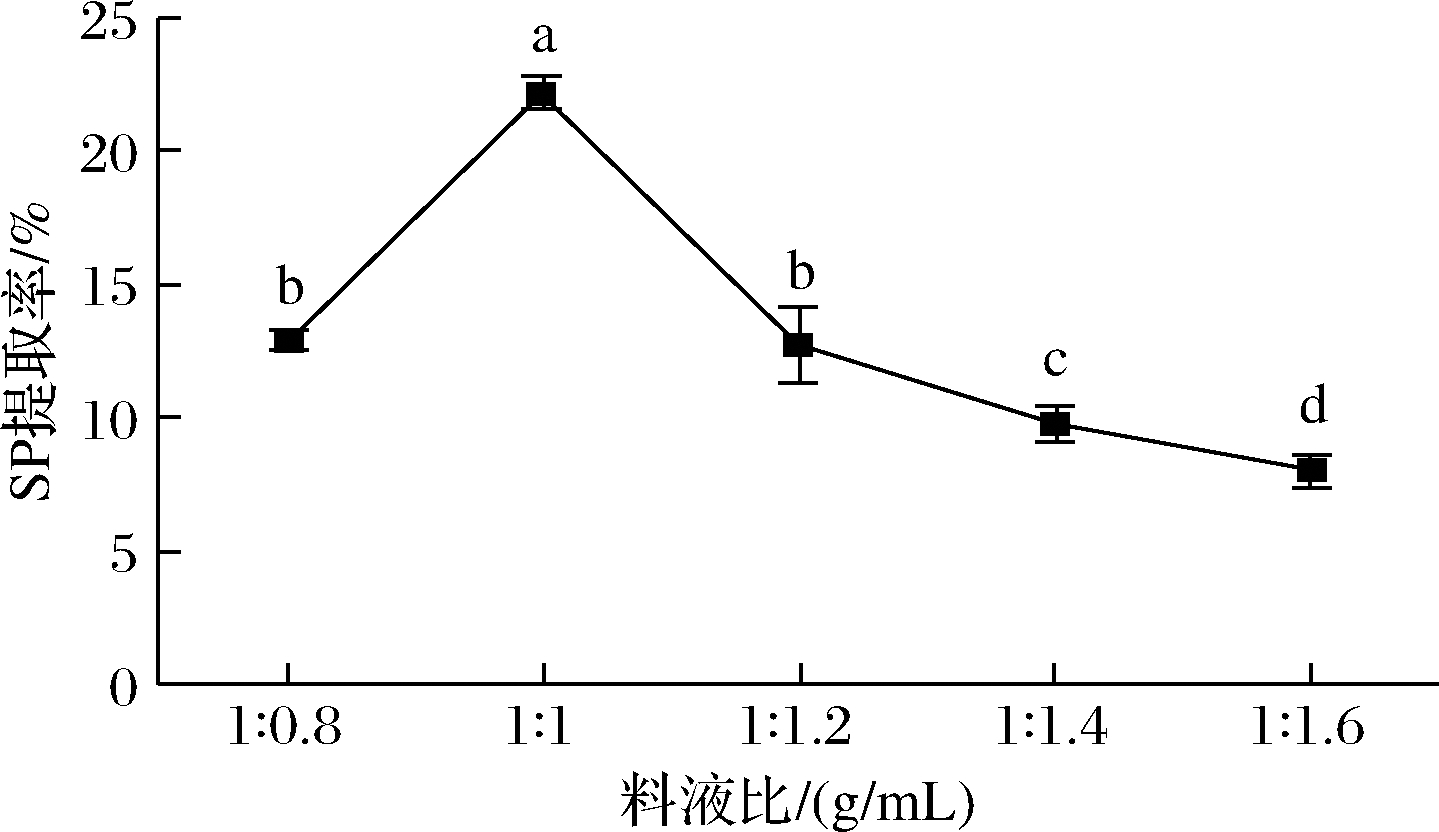
图1 料液比对SP提取率的影响
Fig.1 Influence of the ratio of material to water on SP
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2.2 接种量对SP的影响
如图2所示,在接种量为8%时,SP提取率为(18.08±0.29)%,达到最大。在接种量为8%、14%时,SP为(12.83±0.63)%。出现此现象,可能是低接种量时,起始菌量少,未能短时间快速发酵,SP还处于低水平;在适宜接种量中,菌体生长迅速,发酵效果最佳,SP达到最大;随着接种量的增加,菌的起始密度过大,繁殖迅速,后期出现缺氧和营养物质消耗过度、有害物质代谢积累等情况,SP回归到低接种量时的水平。
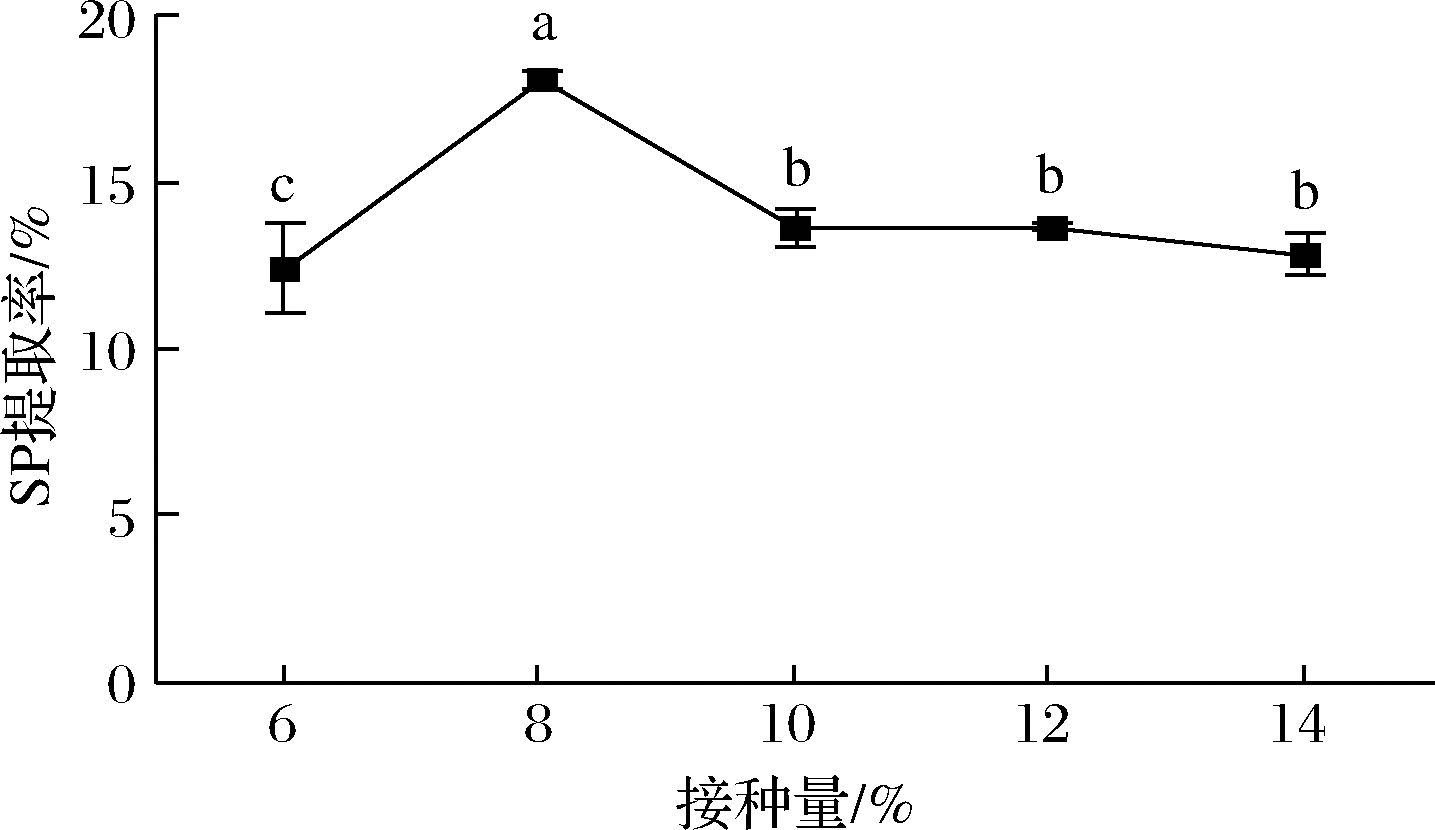
图2 接种量对SP提取率的影响
Fig.2 Effect of inoculation amount on SP
2.2.3 发酵温度对SP的影响
如图3所示,发酵温度为34 ℃时,得到SP提取率最高为(20±1.39)%。发酵温度为31 ℃时,SP最低为(14.75±1.15)%。可能是在28 ℃时适宜米曲霉的生长,米曲霉大量繁殖,菜籽粕的发酵不至于为最差组别;枯草芽孢杆菌最适培养温度为25~37 ℃,植物乳杆菌为30~37 ℃,但随着温度的上升,水分蒸发得越快,培养基中的环境越来越不适宜菌的生长,发酵出现不完全的情况,导致蛋白提取率在34 ℃时表现出最高。
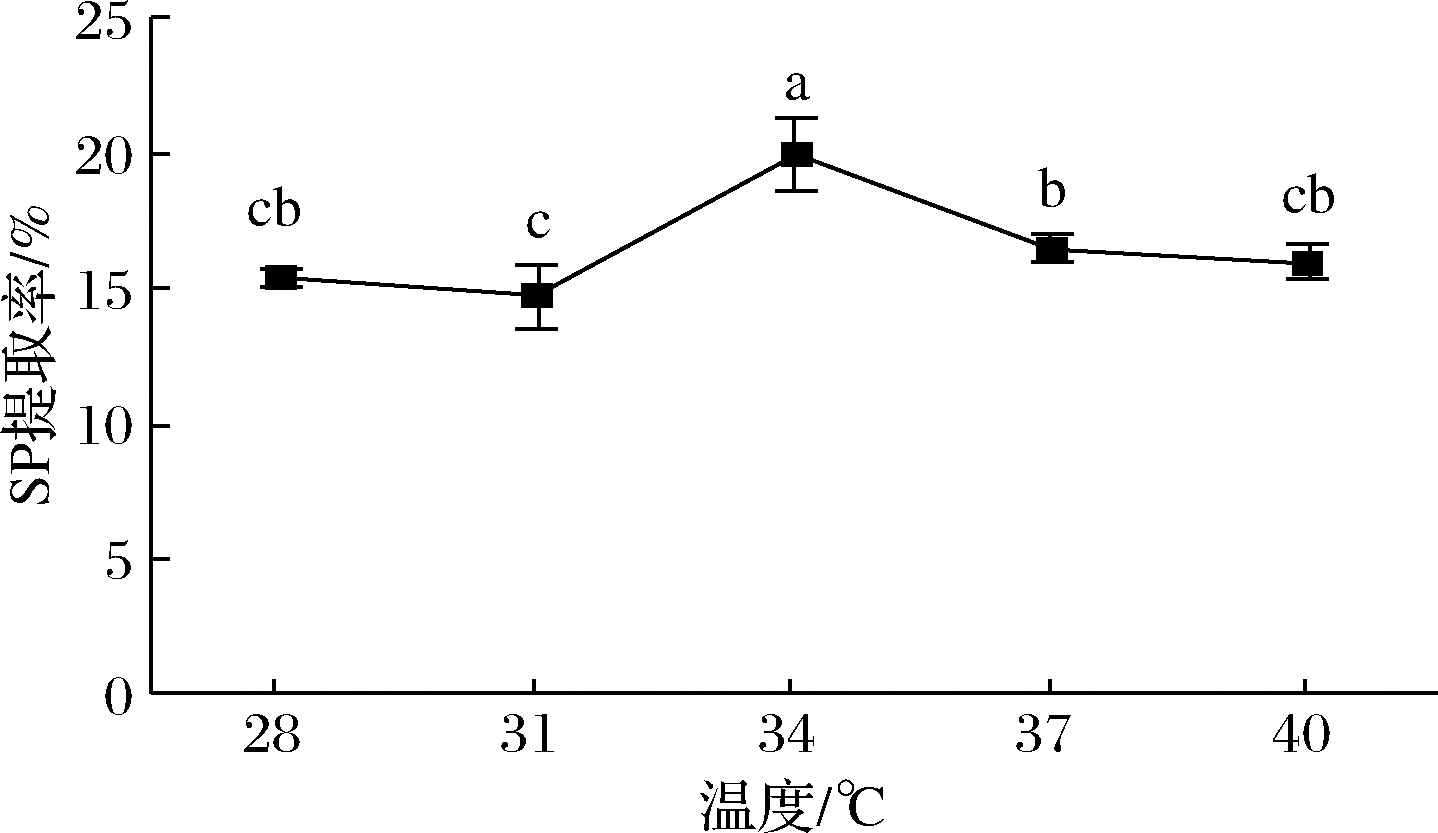
图3 温度对SP提取率的影响
Fig.3 Effect of temperature on SP
2.2.4 发酵时间对SP的影响
如图4所示,96 h时出现SP提取率最高为(14.25±1.42)%,24 h时SP较低为(7.75±0.5)%。可能是在24 h时,菌开始迅速生长,菌体未能分泌大量的酶等物质,导致出现SP较低的情况;直至发酵到96 h时,菌的生长旺盛,分泌的蛋白酶等物质充足,使得蛋白的含量较高;随着发酵时间的延长,微生物的生长过分地利用菜籽粕培养基中的营养物质,同时开始利用已分解的SP,导致蛋白流失过度,最终SP降低。
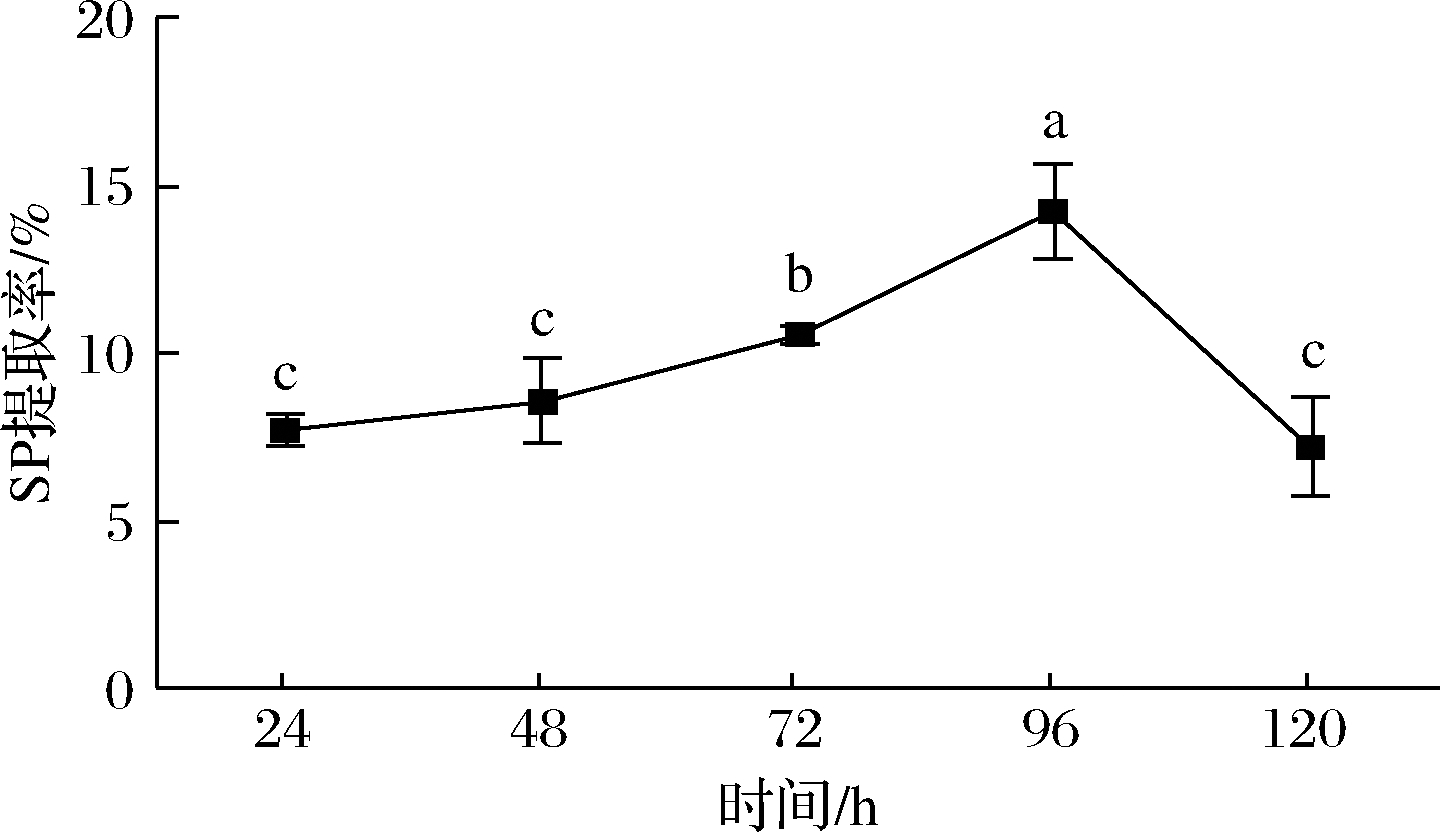
图4 时间对SP提取率的影响
Fig.4 Effect of time on SP
2.3 响应面优化试验结果
在单因素试验基础上,以料液比(x1)、接种量(x2)、发酵温度(x3)、发酵时间(x4)4个因素为自变量,以SP为响应值(Y),设计四因素三水平试验。Design-Expert 8.06进行多元回归拟合,得到回归方程:Y=-627.502 31+156.656 25x1+15.219 377x2+26.883 52x3+1.180 26x4+0.343 75x1x2+0.437 50x1x3-0.019 531x1x4-0.011 042x2x3+8.333 33E-003x2x4-8.628 47E-003x3x4-85.239 58x12-1.004 27x22-0.388 50x32-4.972 15E-003X42
对方程进行方差分析,得到如表3结果,其中x4显著,x12、x22、x32、x42对SP含量影响极显著(P<0.01),由表可知模型P<0.000 1,极显著;决定系数为R2=0.962 8,说明有96.28%的响应值变化来自所选的变量,表明试验条件的变化能通过模型有效的反映出来;失拟项P = 0.266 1(P>0.05),则为不显著,方程拟合度高,可用此模型来预测实验结果。
表3 回归模型方差分析及回归方程系数显著性检验
Table 3 Regression model variance analysis and regression equation coefficient significance test

方差来源平方和自由度均方F值P值显著性模型139.71149.9822.19<0.0001∗∗x11.7811.783.960.0697x20.3110.310.690.4211x3 0.01910.0190.0430.8398x42.9412.946.540.0251∗x1x20.07610.0760.170.689
续表3
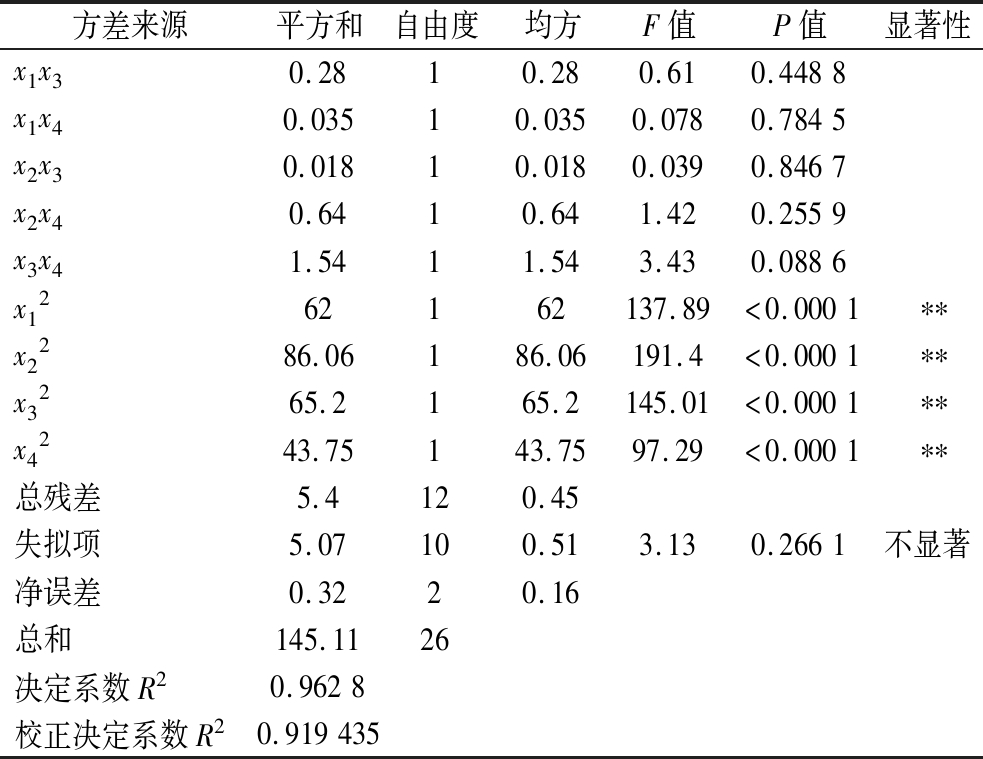
方差来源平方和自由度均方F值P值显著性x1x30.2810.280.610.4488x1x40.03510.0350.0780.7845x2x30.01810.0180.0390.8467x2x40.6410.641.420.2559x3x41.5411.543.430.0886x1262162137.89<0.0001∗∗x2286.06186.06191.4<0.0001∗∗x3265.2165.2145.01<0.0001∗∗x4243.75143.7597.29<0.0001∗∗总残差5.4120.45失拟项5.07100.513.130.2661不显著净误差0.3220.16总和145.1126决定系数R20.9628校正决定系数R20.919435
注:*表示显著,P<0.05;**表示极显著,P<0.01。
2.4 菜籽粕发酵过程中蛋白质的变化结果
2.4.1 多肽及SP
多肽的活性高于普通蛋白,经过蛋白酶的水解作用,可将大分子蛋白酶解为小分子的多肽类物质[21],在发酵过程中,3种微生物对菜籽粕进行发酵,对多肽进行测定,可知发酵菜籽粕营养品质。SP有着调节渗透的作用,还是重要的营养物质。如图5所示,未发酵菜籽粕多肽含量初始值为(51.55±1.47) mg/g,随发酵时间的进行,在72 h时达到最高,为(106.01±4.06) mg/g,提高了105.65%,所测的多肽含量显著增加(P<0.01)。SP随发酵时间不断增加,从0 h的(2.59±0.12) mg/g到120 h的(41.03±1.36) mg/g,增加了38.44 mg/g,显著增加(P<0.05)。表明经过混菌固态发酵处理,菜籽粕的营养物质增加,提高了其营养价值。
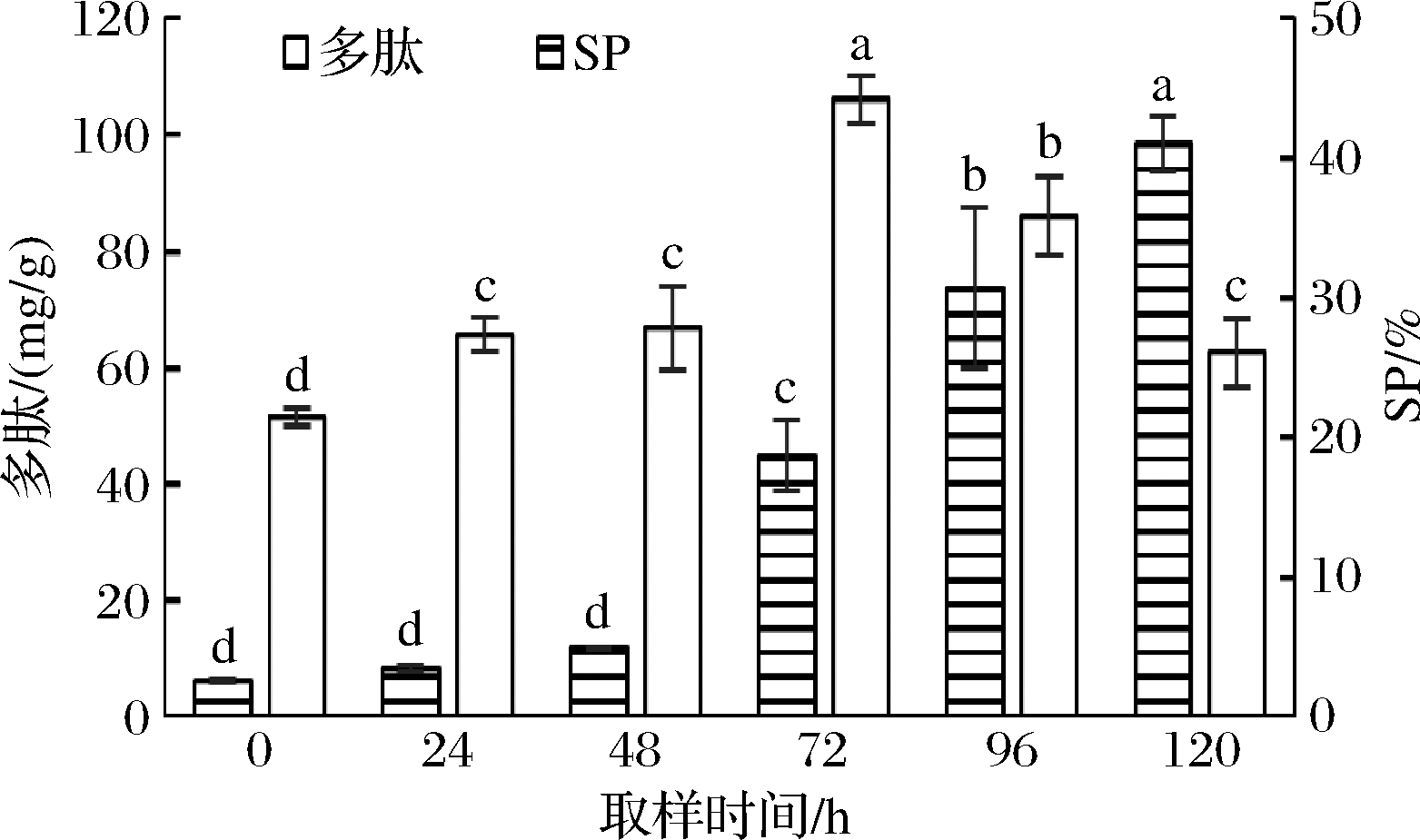
图5 发酵过程中多肽及SP含量变化
Fig.5 Changes of polypeptide and SP content in fermentation process
2.4.2 SDS-PAGE分析
SDS-PAGE常用来测定蛋白的分子质量,为探究发酵过程中菜籽粕蛋白质分子质量变化,对其进行SDS-PAGE分析,可推测发酵过程中蛋白质营养组分的变化。发酵过程中条带具有明显差异(P<0.05),如图6所示,未发酵(0 h)的菜籽粕中蛋白条带较少,出现在45 kDa以下,在24 h时,分子质量分布和0 h时无明显差异,48 h时,总体趋势和24 h基本一致,但是可明显看到条带更加粗壮,菜籽粕蛋白含量增加,在14 kDa尾端的条带消失,开始出现降解。在继续发酵的过程中,条带变淡,大分子蛋白几乎无明显分布,出现在14 kDa以下,可能是随着发酵的进行,蛋白变为更小分子质量的肽类。
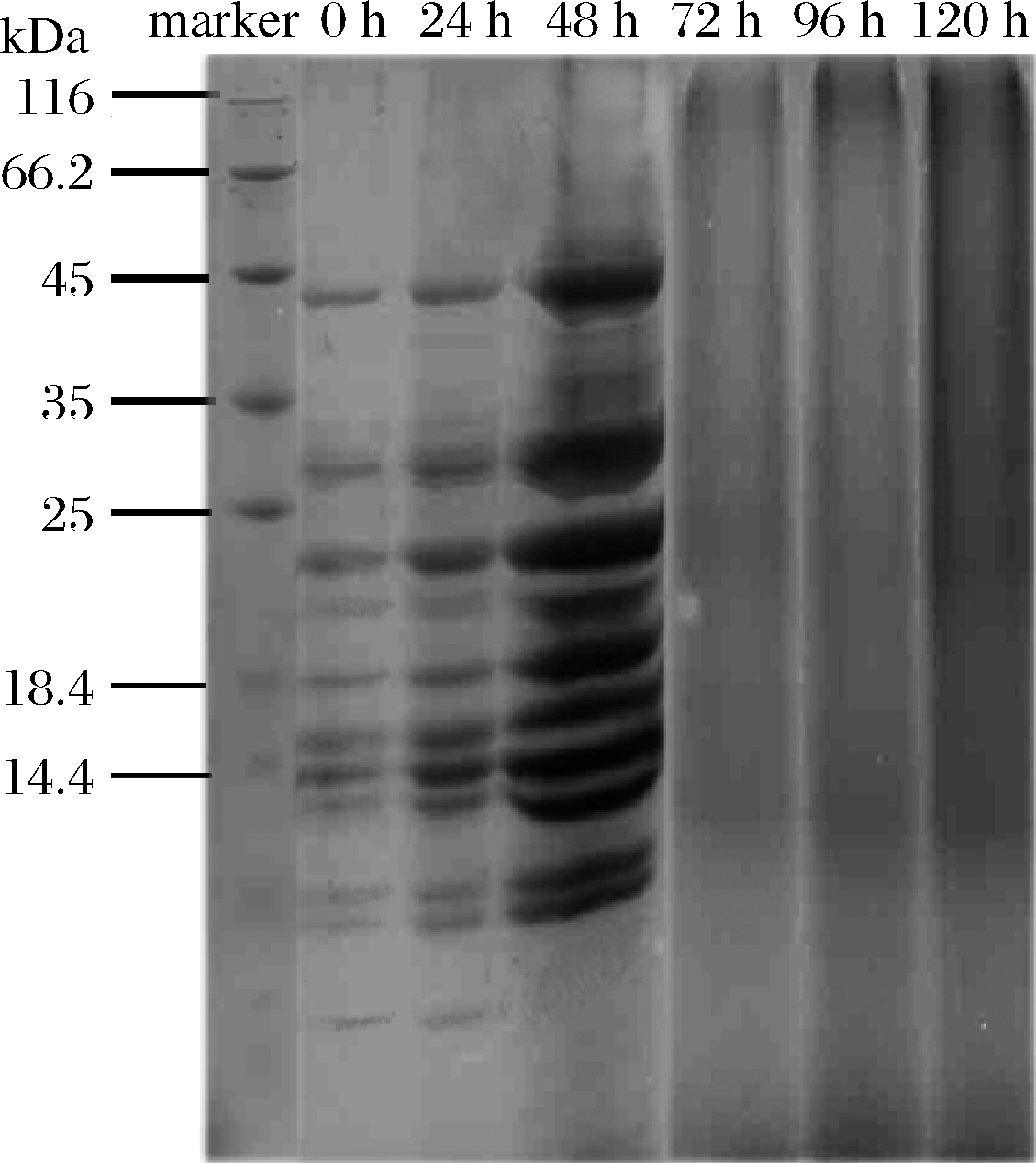
图6 发酵过程中菜籽粕蛋白SDS-PAGE图
Fig.6 SDS-PAGE result of rapeseed meal protein during fermentation
2.4.3 傅里叶红外蛋白二级结构
傅里叶变换红外光谱,可用来测定蛋白质二级结构,试验选用酰胺Ⅰ带区(1 600~1 700 cm-1)进行分析,酰胺Ⅰ带主要表示蛋白质二级结构中,其中β-折叠(1 600~1 640 cm-1)、无规则卷曲(1 640~1 650 cm-1)、α-螺旋(1 650~1 660 cm-1)、β-转角(1 660~1 700 cm-1),参照ALIX等[22]的方法计算菜籽粕中蛋白二级结构相对含量,如图7-b所示,与未发酵(0 h)相比,经发酵处理后,β-折叠的含量均降低,无规则卷曲在48、120 h时有所增加,分别为19.12%、10.47%,α-螺旋在24、48、120 h时含量均减少,β-转角在48、72 h时减少,其他均增加。经发酵处理后,蛋白质的有序结构被破坏,二级结构改变,α-螺旋大部分转变为β-折叠、无规则卷曲、β-转角。蛋白质二级结构的变化,与SP的含量有一定的关系,根据含量占比大小,可判断其分子的延展性强度,从而可知与水分子的作用,进而提高SP含量。

a-红外全波长扫描图;b-蛋白二级结构相对含量图
图7 发酵过程中红外全波长扫描图、蛋白二级结构相对含量图
Fig.7 Infrared full-wavelength scanning and protein secondary structure relative content during fermentation
2.5 菜籽粕发酵过程中硫苷含量的变化
从图8中可知,硫苷降解率在72 h时降解率达到最大值(85.06±1.63)%,显著差异(P<0.05),此时发酵菜籽粕中的硫苷含量显著降低,混菌固态发酵的效果良好,之后的96~120 h时间段内,降解率基本不变。本试验结果与李燕等[23]用多菌进行混菌发酵所得到硫甙降解率(92.12%)的结果相近,同时高于肖萌[24]利用混合益生菌发酵菜籽粕的降解率(42.50%),表明混菌固态发酵可大幅度降低硫苷含量。
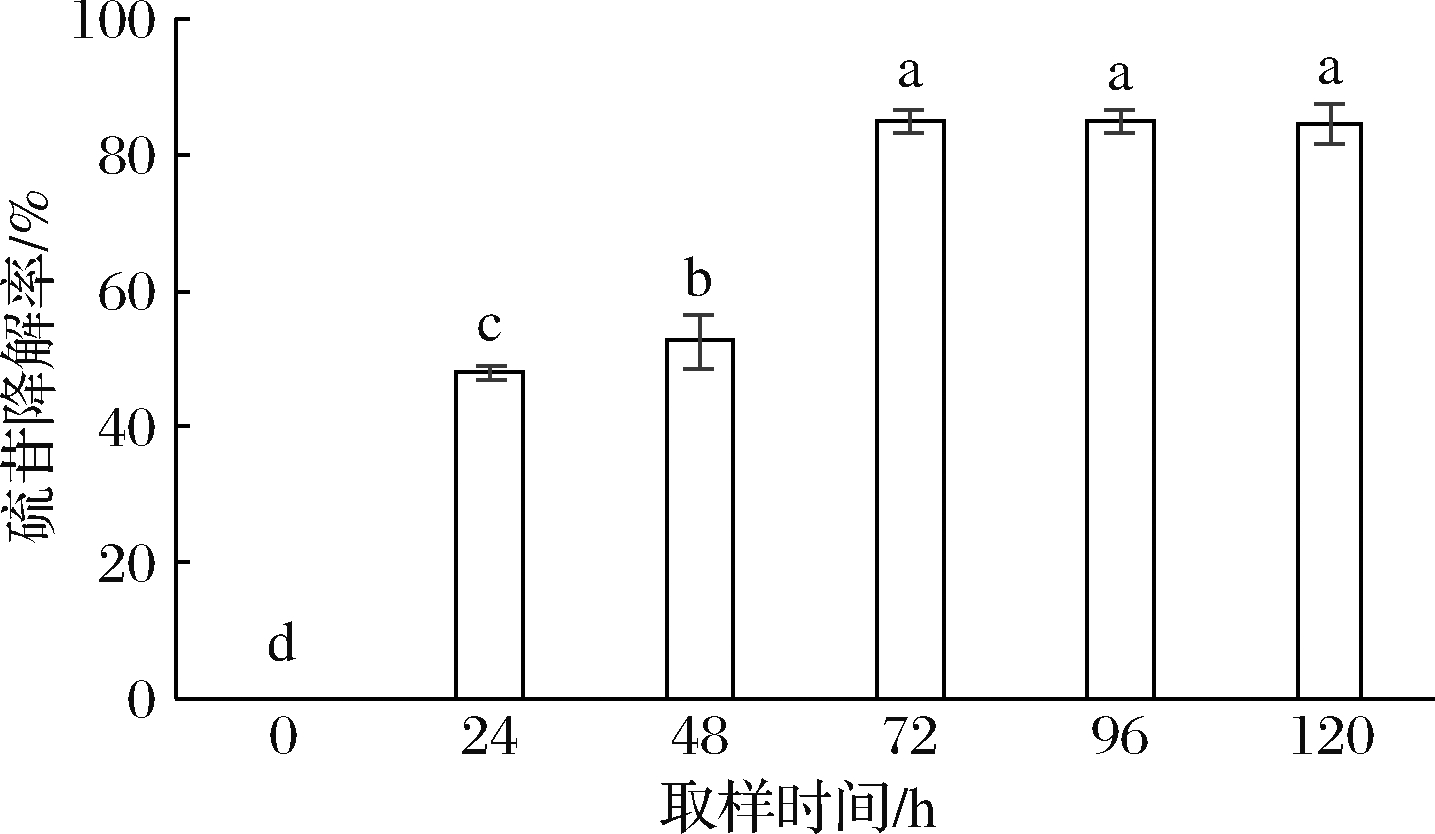
图8 发酵过程中硫苷降解率变化
Fig.8 Degradation rate of glucosinolate during fermentation
2.6 菜籽粕发酵过程中活菌群数的变化
活菌数的变化反映实际发酵中微生物的数量,可通过微生物的变化,了解各个时间段中起主导作用的菌种,分析其与抗营养因子的去除和蛋白物质增加之间的关系。如图9-a,发酵过程中微生物数量先增加,后逐渐平稳至下降。研究发现,在第3天(72 h)时,3菌种的活菌数最大,相对于24 h时显著增加(P<0.05)。在72 h后,微生物利用了大多数的营养物质,发酵接近充分,菌体产生大量蛋白,说明在本实验中设计发酵96 h较为合理,在后期120 h时,3菌体活菌数明显下降,此时的发酵菜粕中生长代谢物质较多,氧气缺乏,营养物质被大部分分解利用。在发酵过程中,可由图9-b观察到3菌种协同发酵。
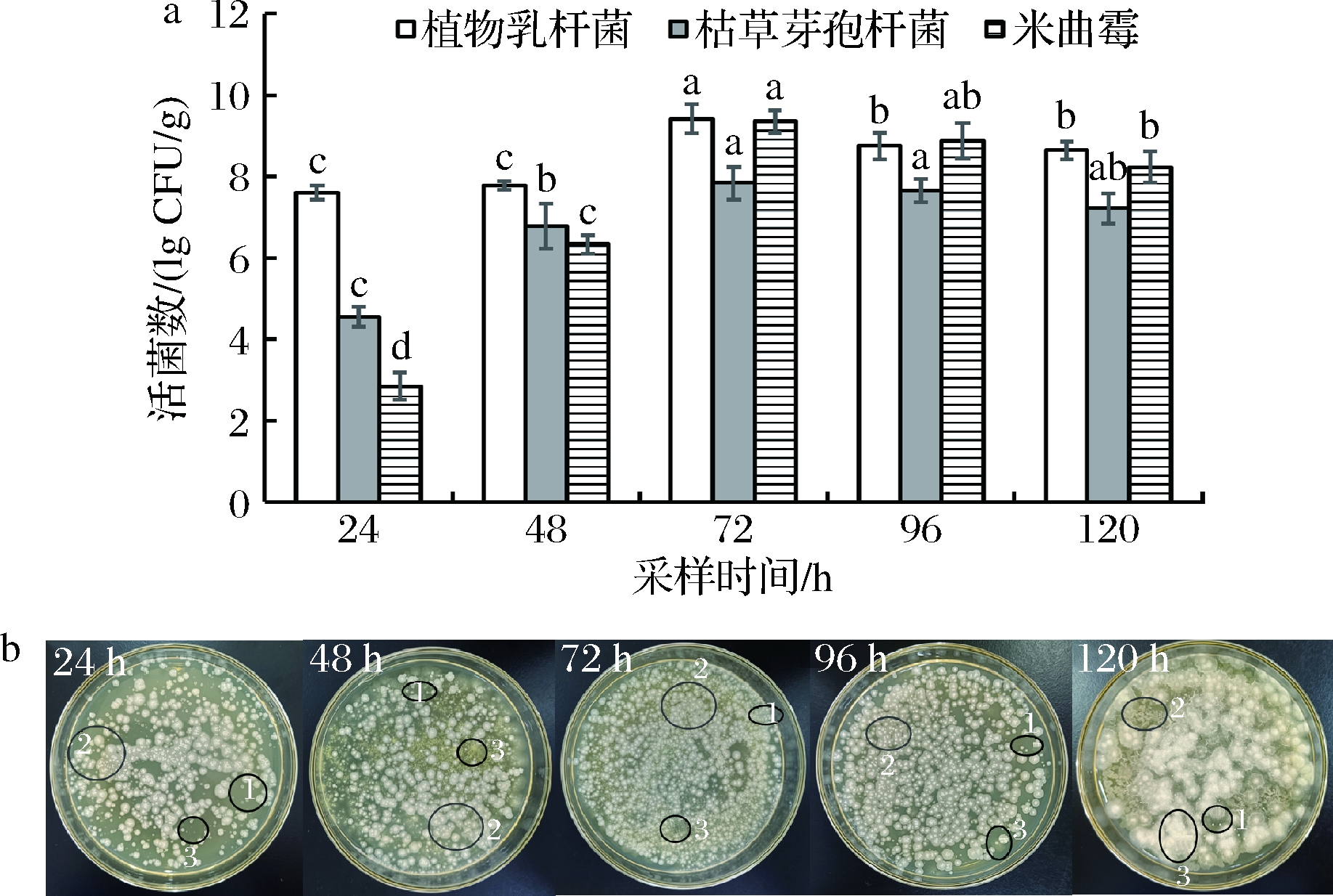
a-活菌群数图;b-平板涂布活菌群数的变化图
(1-植物乳杆菌;2-枯草芽孢杆菌;3-米曲霉)
图9 发酵过程中活菌群数图、发酵过程中平板涂布活菌群数的变化图
Fig.9 The number of viable bacteria in the fermentation process,the change of the number of viable bacteria in plate coating during the fermentation process
3 结论
以菜籽粕为原料,选用植物乳杆菌、枯草芽孢杆菌和米曲霉3菌混合,进行固态发酵,并对其蛋白质、多肽、硫苷及微生物的变化进行探讨,结果如下:
1)3菌的最佳接种比例为L. plantarum∶B. subtilis∶A. oryzae=2∶2∶1。
2)通过试验和响应面优化分析得到,在混菌固态发酵的条件下得到最优料液比1∶1.01,接种量7.95%(质量分数),发酵温度34.02 ℃,发酵时间93.86 h,SP含量为24.835%。
3)发酵过程中SP含量相对于未发酵菜籽粕显著提高22.335%(P<0.05),其中多肽含量提高了105.65%(P<0.01),SDS-PAGE中前期条带基本一致,在48 h时14 kDa尾端的条带消失,在后期亚基的电泳条带变得模糊甚至无法检出,在<14 kDa尾端以下更小分子质量区域尾端出现条带。傅里叶红外分析可知蛋白质的二级结构改变,α-螺旋大部分转变为β-折叠、无规则卷曲、β-转角。
4)硫苷降解率最高达到(85.06±1.63)%(P<0.05),经过发酵处理的菜籽粕中硫苷含量得到显著降低。
5)发酵过程中微生物的总数显著增长,在72 h时达到最大值,由平板涂布结果观察到3菌种协同发酵。
因此,植物乳杆菌、枯草芽孢杆菌和米曲霉有效协同发酵菜籽粕,可有效提高SP含量,同时增加了多肽含量,有效降解硫苷,而且在发酵过程中蛋白亚基,二级结构都发生不同变化。这为菜籽粕综合开发利用提供可靠的技术支持和数据参考。
[1] 田刚,王乐成,余冰,等.比较研究固态发酵菜籽粕和菜籽粕对生长肉兔的营养价值[J].动物营养学报,2017,29(3):798-805.
TIAN G,WANG L C,YU B,et al.Comparison of nutritional value between rapeseed meal and solid-state fermented rapeseed meal for growing rabbits[J].Chinese Journal of Animal Nutrition,2017,29(3):798-805.
[2] REDDY N,CHEN L H,YANG Y Q.Thermoplastic films from peanut proteins extracted from peanut meal[J].Industrial Crops and Products,2013,43:159-164.
[3] WONGSIRICHOT P,GONZALEZ-MIQUEL M,WINTERBURN J.Recent advances in rapeseed meal as alternative feedstock for industrial biotechnology[J].Biochemical Engineering Journal,2022,180:108373.
[4] CHOURASIA R,PHUKON L C,ABEDIN M M,et al.Whey valorization by microbial and enzymatic bioprocesses for the production of nutraceuticals and value-added products[J].Bioresource Technology Reports,2022,19:101144.
[5] 孙汝江,吕月琴,肖发沂.微生物发酵饲料的研究进展[J].山东畜牧兽医,2012,33(6):85-86.
SUN R J,LYU Y Q,XIAO F Y.Research progress of microbial fermented feed[J].Shandong Journal of Animal Science and Veterinary Medicine,2012,33(6):85-86.
[6] 王萌,奚钊,万楚筠,等.微生物发酵在菜籽饼粕饲用品质改良中的应用研究进展[J].中国油料作物学报,2020,42(2):313-324.
WANG M,XI Z,WAN C Y,et al.Research progress on application of microbial fermentation in improving feed quality of rapeseed cake and meal[J].Chinese Journal of Oil Crop Sciences,2020,42(2):313-324.
[7] 崔亚鹏.金银花的混菌发酵及发酵液特性研究[D].开封:河南大学,2022.
CUI Y P.Study on mixed strain fermentatiom of lonicera japonica thumb and characteristics of fermentation broth[D].Kaifeng:Henan University,2022.
[8] AGUIRRE L,GARRO M S,SAVOY DE GIORI G.Enzymatic hydrolysis of soybean protein using lactic acid bacteria[J].Food Chemistry,2008,111(4):976-982.
[9] LI W,WANG T.Effect of solid-state fermentation with Bacillus subtilis lwo on the proteolysis and the antioxidative properties of chickpeas[J].International Journal of Food Microbiology,2021,338:108988.
[10] XIAO Y,SUN M M,ZHANG Q Q,et al.Effects of Cordyceps militaris (L.) Fr.fermentation on the nutritional,physicochemical,functional properties and angiotensin I converting enzyme inhibitory activity of red bean (Phaseolus angularis[Willd.]W.F.Wight.) flour[J].Journal of Food Science and Technology,2018,55(4):1244-1255.
[11] 高冬余,李吕木,许发芝,等.微生物固态厌氧发酵菜籽粕的研究[J].食品与发酵工业,2010,36(3):75-79.
GAO D Y,LI L M,XU F Z,et al.Study on solid-state anaerobic fermentation of rapeseed meal with microorganism[J].Food and Fermentation Industries,2010,36(3):75-79.
[12] 徐亚,范会芬,赵玎玲,等.考马斯亮蓝法测定大豆水溶性蛋白提取方法的优化[J].大豆科学,2022,41(2):196-202.
XU Y,FAN H F,ZHAO D L,et al.Optimization of extraction method for water-soluble protein determination by coomassie bright blue method[J].Soybean Science,2022,41(2):196-202.
[13] 秦卫东,陈学红,马利华,等.黑曲霉发酵豆粕制备抗氧化肽研究[J].食品科学,2010,31(23):289-293.
QIN W D,CHEN X H,MA L H,et al.Preparation of antioxidant peptides from soybean meal by Aspergillus niger fermentation[J].Food Science,2010,31(23):289-293.
[14] 刘晨星,陈诚,姚凯勇.发酵黄酒糟中蛋白营养组分及电泳分析[J].中国奶牛,2022(2):1-5.
LIU C X,CHEN C,YAO K Y.Analysis of drotein nutritive ingredient and electrophoresis in fermented yellow-wine-lees[J].China Dairy Cattle,2022(2):1-5.
[15] SADEGHI A A,NIKKHAH A,SHAWRANG P,et al.Protein degradation kinetics of untreated and treated soybean meal using SDS-PAGE[J].Animal Feed Science and Technology,2006,126(1-2):121-133.
[16] FEVZIOGLU M,OZTURK O K,HAMAKER B R,et al.Quantitative approach to study secondary structure of proteins by FT-IR spectroscopy,using a model wheat gluten system[J].International Journal of Biological Macromolecules,2020,164:2753-2760.
[17] 孙宏.微生物发酵法对菜粕脱毒及蛋白品质改良的研究[D].武汉:华中农业大学,2009.
SUN H.Study on detoxification of rapeseed meal and improvement of its protein quality by fermentation[D].Wuhan:Huazhong Agricultural Universtity,2009.
[18] 高梦颖,王浩宇,谭小琴,等.自然及人工接种发酵对细菌型豆豉食用品质的影响研究[J/OL].食品与发酵工业,2023.DOI:10.13995/j.cnki.11-1802/ts.033191.
GAO M Y,WANG H Y,TANG X Q,et al.Study on the effect of natural and artificial inoculation fermentation on the quality of bacterial fermented douche[J/OL].Food and Fermentation Industries,2023.DOI:10.13995/j.cnki.11-1802/ts.033191.
[19] 陈晨.豆豉功能微生物的筛选与应用[D].吉林:吉林大学,2015.
CHEN C.Screening and application of functional microbes in douche[D].Jilin:Jilin University,2015.
[20] 洪奕,夏海华,田洁萍,等.响应面法优化豆粕固体发酵产纳豆激酶培养条件[J].中国调味品,2022,47(8):41-45.
HONG Y,XIA H H,TIAN J P,et al.Optimization of culture conditions for nattokinase production from soybean meal by solid fermentation using response surface methodology[J].China Condiment,2022,47(8):41-45.
[21] 王耀冉,陈明杰,查磊,等.响应面法优化草菇抗氧化肽的酶法制备工艺[J].食品工业科技,2022,43(15):227-233.
WANG Y R,CHEN M J,ZHA L,et al.Optimization of enzymatic preparation of antioxidant peptides from Volvariella volvacea by response surface methodology[J].Science and Technology of Food Industry,2022,43(15):227-233.
[22] ALIX A J P,PEDANOU G,BERJOT M.Fast determination of the quantitative secondary structure of proteins by using some parameters of the Raman Amide I band[J].Journal of Molecular Structure,1988,174:159-164.
[23] 李燕,熊巍,高冰,等.多菌种混合发酵对菜籽饼脱毒效果的初步研究[J].饲料工业,2009,30(20):33-35.
LI Y,XIONG W,GAO B,et al.Preliminary study on detoxification effect of rapeseed cake by multi-strain mixed fermentation[J].Feed Industry,2009,30(20):33-35.
[24] 肖萌.益生菌混合发酵菜籽粕及其营养特性的研究[D].长沙:湖南农业大学,2014.
XIAO M.Study on probiotic fermented rapeseed meal and nutritional analysis[D].Changsha:Hunan Agricultural University,2014.