嗜热链球菌(Streptococcus thermophilus)是一种兼性厌氧的同型发酵乳酸菌,目前被广泛应用于发酵乳制品的生产中,具有快速酸化凝乳、改善产品品质等特性;并且能有效提高乳糖不耐症患者对乳糖的消化能力,缓解溃疡和炎症,降低肠道和生殖道感染概率[1]。然而,乳酸菌普遍对生长条件的要求比较苛刻,容易受pH值、温度、各种消化酶及宿主的饮食和情绪等因素的影响,从而无法充分发挥其健康功效[2-3]。因此,近年来越来越多的研究聚焦于挖掘能有效促进菌体增殖和维持活性稳定物质方面[4-7]。
促生长因子(growth-promoting factors)是一类能促进乳酸菌增殖且在结构和性质方面不完全相同的物质,可用于促进体外发酵体系中乳酸菌增殖,也可用于提高人体胃肠道的乳酸菌丰度。植物源的促生长因子主要包括天然植物提取物、抗消化性糖、蛋白质、多酚、皂苷和相关代谢产物,其中植物多糖促生长因子的开发利用是目前的研究热点[2,8-9]。
淮山(Dioscorea opposite Thunb.)又名山药,是我国传统的药食同源物。淮山中的部分成分和水提物已被初步证实对乳酸菌具有促生长作用,是潜在的促生长因子[10-12]。本文以不同来源的淮山全粉为材料,研究其对嗜热链球菌的促生长作用差异,并结合相关性比较和偏相关分析,明确全粉中主要活性成分与促生长作用的相关性;同时对潜在的促生长因子进行筛选与验证。试验旨在为嗜热链球菌促生长因子的挖掘和新型功能性食品的开发提供依据,并为淮山资源的高值化利用开辟新途径。
1 材料与方法
1.1 材料与试剂
12份淮山产自国内6个省份的不同地区,将其编号为GH-1、GH-2、GH-3、ZH-1、ZH-2、HS-1、HS-2、HS-3、HS-4、HS-5、HS-6和HS-7。淮山清洗、去皮后,切成3 mm左右的均匀薄片,55 ℃热泵干燥10 h,粉碎过筛,密封保存备用。
M17肉汤、琼脂,青岛海博生物技术有限公司;标准品(HPLC≥98%):葡萄糖、芦丁、没食子酸、尿囊素、薯蓣皂苷元,上海源叶生物科技有限公司;山药多糖标准品(UV≥90%)、α-淀粉酶、糖化酶,北京索莱宝科技有限公司;Folin酚,博美生物科技有限责任公司;色谱纯甲醇和其余分析纯试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
RST-100RB热泵烘干除湿箱,上海湿腾电器有限公司;JXFSTPRP-Ⅱ-01全自动液氮冷冻研磨机,上海净信实业发展有限公司;Centrifuge 5804 R高速冷冻离心机,德国Eppendorf 公司;RE 5298A旋转蒸发仪,上海亚荣生化仪器厂;Agilent-1260高效液相色谱仪,美国Agilent科技有限公司;GI54DWS自动压力蒸汽灭菌器,致微(厦门)仪器有限公司;SW-CJ-2FD双人单面净化工作台,苏州净化设备有限公司;HPX-30085-Ⅲ恒温恒湿箱,上海新苗医疗器械制造有限公司;Multuskan MK3酶联免疫检测仪,美国Thermo Fisher科技有限公司;Modulyod-230冷冻干燥机,美国Thermo Electron公司;BT100L-CE智能蠕动泵,保定雷弗流体科技有限公司。
1.3 实验方法
1.3.1 淮山全粉对嗜热链球菌的促生长作用评价
以M17肉汤作为空白对照(control check,CK),参照其成分表,采用不同来源的淮山全粉完全替代乳糖作为碳源,121 ℃灭菌20 min。嗜热链球菌的菌株接种量为3%(体积分数),42 ℃恒温培养24 h。参考GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》对嗜热链球菌活菌数进行测定,并依此评价淮山全粉对嗜热链球菌的促生长作用。
1.3.2 淮山全粉中主要活性成分质量分数的测定
粗多糖的提取采用低共熔溶剂法[13]:将氯化胆碱与尿素按摩尔比1∶5混合,水的质量分数调整为20%,60 ℃溶解后备用。称取1.000 g淮山全粉,按照料液比1∶40(g∶mL)加入低共熔溶剂,超声30 min,90 ℃水浴40 min;依次添加1.00 mL α-淀粉酶(150 U/mL)和0.40 mL糖化酶(2 500 U/mL),分别在50和55 ℃条件下酶解1 h;加入4倍无水乙醇,静置过夜;离心(3 000 r/min,5 min),沉淀用乙醇反复洗涤,复溶后再经Sevag试剂[V(正丁醇)∶V(三氯甲烷)=1∶4]除去蛋白质,加入4倍无水乙醇,静置4 h,离心(3 000 r/min,5 min),沉淀复溶后即得粗多糖溶液。多糖质量分数采用苯酚硫酸法测定,并采用市售山药多糖作为标准品,以多糖实际质量分数与其中葡萄糖质量分数的比值作为换算系数(1.57)。
黄酮质量分数采用NaNO2-Al(NO3)3比色法测定,多酚质量分数采用Folin-Ciocalteu比色法测定[14]。薯蓣皂苷元与尿囊素质量分数采用液相色谱法测定,所用色谱柱均为Zorbax SB-C18色谱柱(250 mm×4.6 mm,5 μm);薯蓣皂苷元测定所用流动相为V(水)∶V(甲醇)=1∶9,流速1.00 mL/min,波长203 nm,柱温35 ℃,尿囊素测定所用流动相为V(水)∶V(甲醇)=95∶5,流速0.80 mL/min,波长210 nm,柱温30 ℃。
1.3.3 不同来源的淮山粗多糖对嗜热链球菌的促生长作用评价
淮山粗多糖的提取方法同1.3.2节,经H2O2脱色和冷冻干燥后,得到粗多糖冻干粉。采用不同来源的淮山粗多糖完全替代乳糖作为碳源,其余试验条件同1.3.1节。
1.3.4 不同添加量的淮山粗多糖对嗜热链球菌的促生长作用评价
采用HS-4淮山粗多糖替代乳糖作为碳源,使得多糖最终质量分数为0.1%、0.2%、0.3%、0.4%和0.5%(0.5%为完全替代乳糖),其余试验条件同1.3.1节。
1.3.5 淮山粗多糖的分离纯化
称取100.00 mg HS-4粗多糖,溶于5.00 mL蒸馏水,并缓慢加入DEAE-52离子交换层析柱中。分别用3倍柱体积的去离子水和0.20、0.50、1.00 mol/L NaCl 溶液进行梯度洗脱,洗脱速度为1.00 mL/min,采用苯酚硫酸法进行跟踪检测并绘制洗脱曲线;根据洗脱曲线收集不同组分,浓缩、冻干后备用[15]。
1.3.6 淮山多糖组分对嗜热链球菌的促生长作用评价
采用HS-4多糖组分部分替代乳糖(质量分数为0.1%)作为碳源,其余试验条件同1.3.1节;并采用等量的HS-4粗多糖(crude yam polysaccharide,CYP)作为阳性对照。
1.4 数据统计与分析
试验数据以平均值±标准差表示。采用Origin和 SPSS软件进行数据处理和绘图,采用Duncan检验法进行组间的统计学差异分析,显著性水平为P<0.05。
2 结果与分析
2.1 全粉对嗜热链球菌的促生长作用
采用不同来源淮山全粉替代乳糖作为碳源时,嗜热链球菌的活菌数呈现出较大差异,其中以HS-4全粉作为替代碳源时最高,活菌数达到(9.42±0.04)lg CFU/mL,相比CK组提高了11.7%;而其余处理组的结果均与CK组的相接近,说明它们对嗜热链球菌的促生长能力较弱或无促生长作用(图1)。不同来源的全粉在化学组成上存在较大差异,对乳酸菌生长繁殖的影响程度也明显不同[16]。研究表明多种薯类全粉能选择性提高Akkermansia等有益菌在结直肠区域的相对丰度,也能在体外试验中促进多株乳酸菌的有效增殖,其具体促生长效果因品种来源和化学组成不同而存在差异[17-18]。HS-4全粉的显著促生长作用可归因于促生长成分的富集或者促生长成分在结构和功能上的差异,也可能是因为HS-4全粉具有更好的营养配比,加入培养基后能对嗜热链球菌的生长代谢产生协同促进作用。

图1 淮山全粉对嗜热链球菌增殖的影响
Fig.1 Effect of Chinese yam flour on the proliferation of S.thermophilus
注:不同字母代表差异显著(P<0.05)(下同)。
2.2 主要活性成分含量与促生长作用的相关性分析
2.2.1 多糖含量与促生长作用的相关性分析
淮山多糖的质量分数因为淮山来源不同而存在显著差异(图2-a),其中HS-4全粉的多糖质量分数达到(128.92±1.10) mg/g,远高于其他淮山全粉,这说明淮山多糖质量分数受到淮山品种和产地的影响[19]。对比分析发现,多糖质量分数最高的HS-4全粉所对应的嗜热链球菌活菌数也最高;其余多糖质量分数处于相对较高水平的全粉所对应的活菌数也普遍较高,而多糖质量分数较低的全粉则对应着相对较低的菌株活菌数。结果说明淮山全粉的多糖质量分数能明显影响嗜热链球菌的增殖,但两者之间并不存在严格的线性对应关系。因此可以推测,多糖可能是淮山全粉中主要的促生长因子。

a-多糖;b-黄酮;c-多酚;d-薯蓣皂苷元;e-尿囊素
图2 不同来源淮山全粉中活性成分的质量分数
Fig.2 Mass fraction of active ingredients in Chinese yam flour
2.2.2 黄酮含量与促生长作用的相关性分析
12种淮山全粉的黄酮质量分数均在0.25~2.75 mg/g,其中ZH-1和ZH-2全粉的黄酮质量分数最高,GH-1、GH-2和GH-3全粉的则相对较低(图2-b)。结合促生长效果分析发现,菌株活菌数与淮山全粉的黄酮质量分数之间几乎不存在正向对应关系,HS-4全粉对应最高的活菌数,其黄酮质量分数却处于较低水平[(0.41±0.01) mg/g];HS-5试验组的活菌数最低,对应的黄酮质量分数却处于较高水平;ZH-2全粉的黄酮质量分数[(2.70±0.01) mg/g]高于其余淮山全粉的2倍以上,但ZH-2全粉并没有明显的促生长作用。由此推测,黄酮可能不是淮山全粉中的促生长因子,与嗜热链球菌增殖无明显相关性。
2.2.3 多酚含量与促生长作用的相关性分析
多酚及其活性化合物已被认为是促生长因子的良好来源,能有效促进乳酸菌的生长繁殖[20]。不同来源淮山全粉的多酚质量分数总体上相差较大,其中ZH-1和ZH-2全粉的多酚质量分数明显高于其他淮山全粉的,其次为HS-4,而GH-1全粉的则最低(图2-c)。综合分析发现,活菌数相对较低的试验组所对应的多酚质量分数基本均处于较低水平;HS-4组具有最高的活菌数,对应着较高的多酚质量分数,说明两者之间可能存在正向对应关系。由此推测,淮山多酚可能具有一定的促生长作用,但不是淮山全粉中最主要的促生长因子;与多糖相比,多酚质量分数与菌株活菌数之间的关联性相对较弱。
2.2.4 薯蓣皂苷元含量与促生长作用的相关性分析
不同来源淮山全粉的薯蓣皂苷元质量分数总体上存在较大差异(图2-d),其中ZH-2全粉的最高[(2.46±0.01) mg/g],其次为GH-3,HS-4的则最低[(0.15±0.01) mg/g]。对比分析发现,薯蓣皂苷元质量分数和菌株活菌数之间并无正向对应关系,HS-4组具有最高的活菌数,却对应着最低的薯蓣皂苷元质量分数;GH-3薯蓣皂苷元质量分数相对较高,对应的活菌数却处于较低水平。由此推测,薯蓣皂苷元可能不是淮山全粉中的促生长因子,与嗜热链球菌的增殖无明显相关性。研究发现,皂苷水解脱去的糖基可作为乳酸菌生长所需的碳源,具有促进乳酸菌增殖的作用[21]。本研究与此结论存在差异,可能是因为淮山中存在与薯蓣皂苷元具有拮抗效应的物质,或者不同的薯蓣皂苷元在生物活性方面存在差异。
2.2.5 尿囊素质量分数与促生长作用的相关性分析
12种淮山全粉的尿囊素质量分数具有较大差异(图2-e),其中HS-3全粉的最高[(6.11±0.06) mg/g],而HS-7全粉的则最低[(2.20±0.01) mg/g]。结合促生长效果分析发现,尿囊素质量分数与菌株活菌数之间并不存在明显的对应关系,HS-4组具有最高的活菌数,其尿囊素质量分数却处于较低水平;HS-3全粉中尿囊素质量分数最高,并未对应最高的活菌数;HS-5组的活菌数最低,其尿囊素质量分数却相对较高。由此推测,尿囊素可能并不是促生长因子,与嗜热链球菌的增殖无明显相关性。
2.2.6 活性成分与促生长作用的偏相关分析
偏相关分析的目的在于研究单一活性成分与菌株活菌数的关系时,将其他因素的影响剔除,保证相关性结果更加准确。淮山多糖与嗜热链球菌活菌数的偏相关系数为0.807(P<0.05),表明多糖质量分数与菌株活菌数之间存在明显正相关关系;除此之外,其余活性成分质量分数与活菌数的偏相关系数均相对较小,并在0.05水平上不具有显著性,其中尿囊素、薯蓣皂苷元与菌株活菌数之间甚至呈现负相关关系(表1)。因此,综合分析得出,淮山多糖是淮山全粉中主要的促生长因子。
表1 偏相关分析结果
Table 1 The results of partial correlation analysis
活性成分多糖多酚黄酮薯蓣皂苷元尿囊素偏相关系数0.807∗0.3890.103-0.047-0.111
注:* 表示差异显著(P<0.05)。
2.3 粗多糖对嗜热链球菌的促生长作用
乳酸菌生长与碳水化合物利用之间存在较强的相关性,乳酸菌产生的酶能将多糖分解为单糖分子,为发酵体系提供更多持续性的可发酵碳源,同时有利于其后续的生长繁殖[22]。当不同来源淮山粗多糖作为碳源时,嗜热链球菌活菌数均得到明显提高(P<0.05),说明淮山多糖确实具有促生长作用。不同来源淮山粗多糖表现出不同程度的促生长作用,其中HS-4粗多糖的促生长作用最显著,菌株活菌数达到(9.27±0.06)lg CFU/mL;而HS-2和HS-5粗多糖的促生长作用相对较弱,所对应的菌株活菌数相对较低(图3)。这可以归因于不同来源淮山粗多糖在其纯度和结构方面存在差异,HS-4粗多糖中含有的单糖种类和构型可能使其具有更高的促生长活性[23-24]。HS-4多糖组的活菌数相比于全粉组的略低(P>0.05),可能是因为全粉中存在其他具有促生长作用的协同成分(例如多酚),与多糖同时存在时能产生协同促生长作用;另外,HS-4全粉可能具有更好的营养配比。后续试验将采用HS-4多糖进行研究。
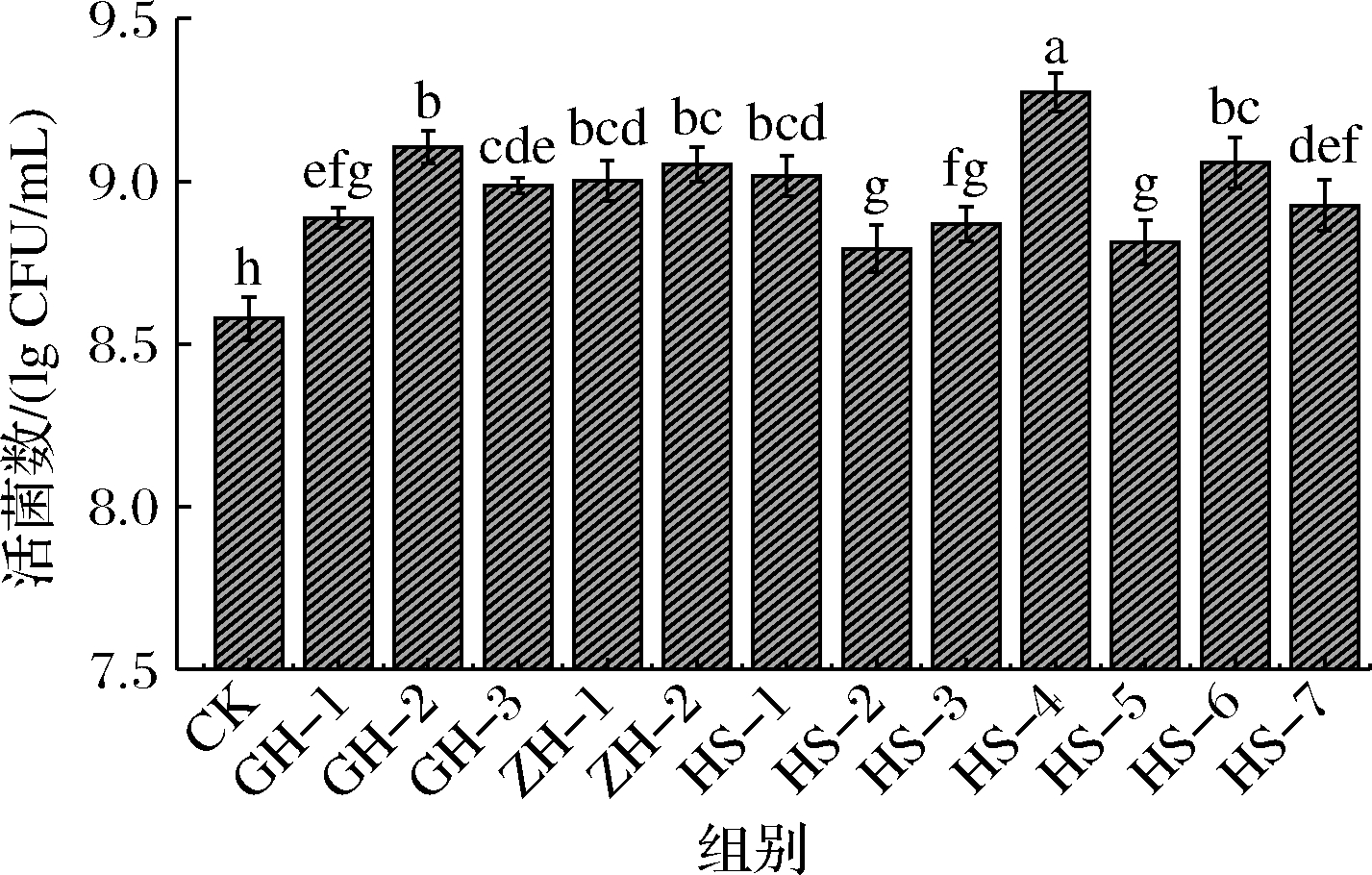
图3 淮山粗多糖对嗜热链球菌增殖的影响
Fig.3 Effects of yam crude polysaccharides on the proliferation of S.thermophilus
2.4 粗多糖添加量对嗜热链球菌增殖的影响
粗多糖添加量的改变能明显影响嗜热链球菌的增殖,当粗多糖添加量为0.1%和0.2%(质量分数)时,嗜热链球菌的活菌数能达到9.00 lg CFU/mL以上;粗多糖添加量继续增加时,菌株活菌数却不升反降(图4)。采用淮山多糖部分替代乳糖作为碳源时,培养体系中同时存在多糖和乳糖,此时嗜热链球菌会优先利用分子质量较小的乳糖进行生长代谢,同时产生水解多糖的糖苷酶;而多糖水解后产生的小分子糖可能比乳糖具有更高的促生长活性,能提供更丰富、更持续的碳源,从而有利于菌株的进一步增殖。然而,多糖含量过高则会间接减少培养体系中的乳糖含量,导致嗜热链球菌在生长初期可直接利用的基础碳源含量不足;并且多糖结构相对复杂,嗜热链球菌水解多糖的速率低于其消耗乳糖的速率,因而使得促生长效果相对减弱,菌株活菌数相对降低[6]。此外,淮山多糖也可能不只是一种比乳糖活性更高的碳源物质,同时还能充当促生长信号因子,当其在培养体系中存在时,嗜热链球菌即可在一定程度实现增殖。结果表明,添加适量HS-4粗多糖能有效促进嗜热链球菌的生长,后续试验将选择0.1%作为适宜的多糖添加量。
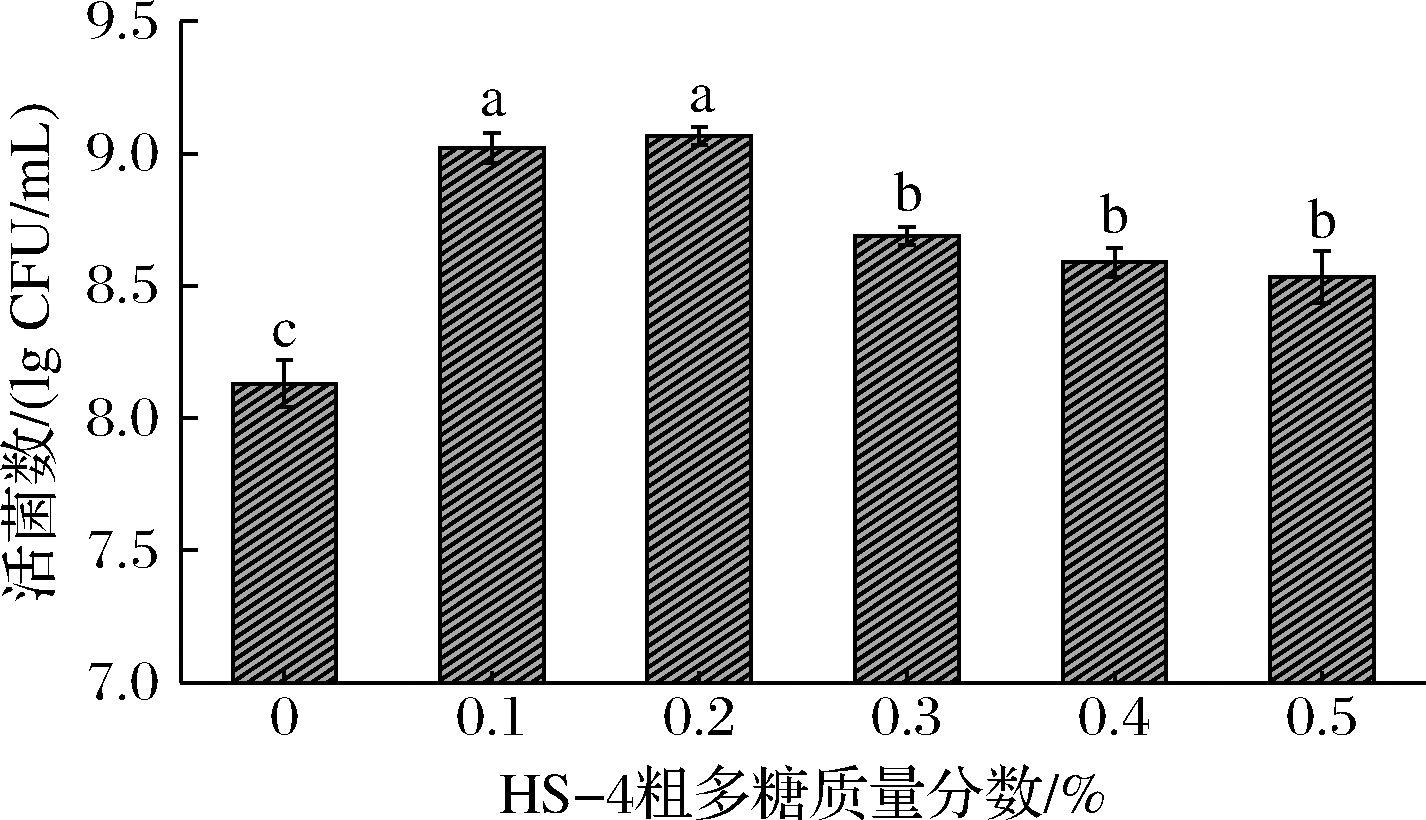
图4 HS-4粗多糖添加量对嗜热链球菌增殖的影响
Fig.4 Effect of HS-4 crude polysaccharides addition on the proliferation of S.thermophilus
2.5 多糖组分对嗜热链球菌的促生长作用
如图5-a所示,HS-4粗多糖经分离纯化后得到1种中性多糖和3种酸性多糖,分别命名为YPN、YPA-Ⅰ、YPA-Ⅱ和YPA-Ⅲ。
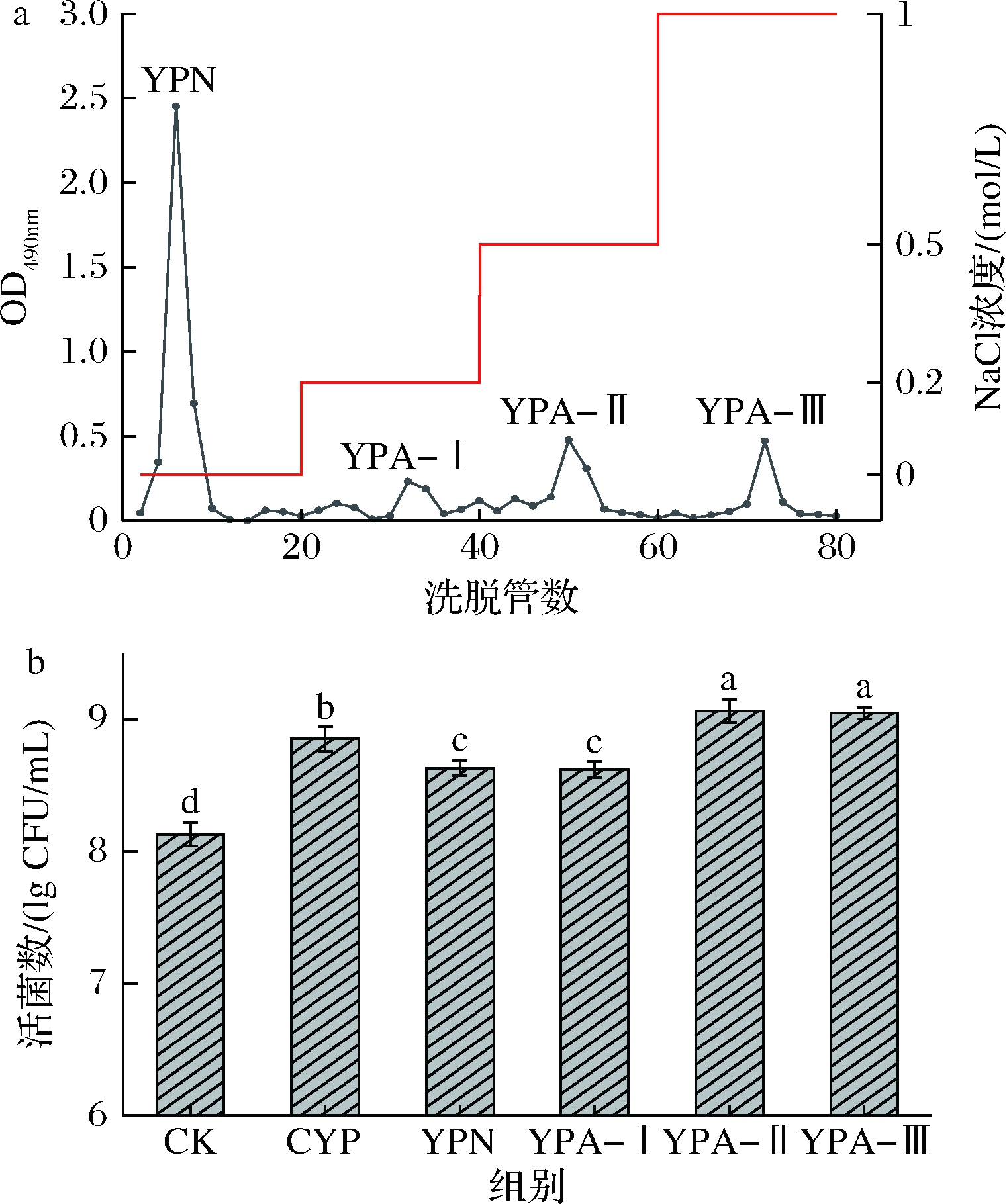
a-洗脱曲线;b-组分对嗜热链球菌增殖的影响
图5 HS-4粗多糖的洗脱曲线及其组分对嗜热链球菌增殖的影响
Fig.5 Elution curve of HS-4 polysaccharides and its fractions on the proliferation of S.thermophilus
等量(0.1%)的多糖组分均能在不同程度上促进嗜热链球菌的生长,其对应的活菌数较CK组提高了6.03%~11.48%;与粗多糖相比,YPA-Ⅱ和YPA-Ⅲ具有更好的促生长效果,对应的菌株活菌数达到9.00 lg CFU/mL以上,但YPN和YPA-Ⅰ的促生长效果相对较弱(图5-b)。多糖组分之所以产生不同的促生长效果,主要原因可能在于不同组分在理化性质和精细结构上存在差异,主要包括分子质量、单糖组成和糖苷键类型等,而菌株利用多糖的效果又与多糖的精细结构及聚合度密切相关[23,25-27]。以上结果进一步说明多糖是淮山中主要的促生长因子,而其具体促生长效果会受到化学组成和精细结构的影响。
3 结论与讨论
本试验研究了淮山全粉及其主要活性成分对嗜热链球菌的促生长作用。不同来源淮山全粉对嗜热链球菌增殖的影响存在差异,其中HS-4全粉具有明显的促生长效果;淮山多糖与促生长效果存在明显正相关关系,而其余活性成分与促生长效果的正相关关系不显著或呈现负相关关系。不同来源淮山粗多糖均能明显促进嗜热链球菌的增殖,其中HS-4粗多糖的效果最好;多糖添加量是影响HS-4多糖促生长效果的重要因素,并且分离纯化得到的纯组分也表现出不同程度的促生长效果。综合得出,淮山多糖是使得淮山全粉对嗜热链球菌起到促生长作用的主要活性物质,而这又与其化学组成和精细结构密切相关。
[1] 《乳业科学与技术》丛书编委会,乳业生物技术国家重点实验室.益生菌[M].北京:化学工业出版社.2015:9.
Editorial Board of Dairy Science and Technology Series,State Key Laboratory of Dairy Biotechnology.Probiotics[M].Beijing:Chemical Industry Press.2015:9.
[2] 欧阳佳,王钰,吴广,等.乳酸菌促生长因子的研究[J].激光生物学报,2021,30(2):110-116.
OUYANG J,WANG Y,WU G,et al.Research on growth promoting factors of lactic acid bacteria[J].Acta Laser Biology Sinica,2021,30(2):110-116.
[3] SUEZ J,ZMORA N,ZILBERMAN-SCHAPIRA G,et al.Post-antibiotic gut mucosal microbiome reconstitution is impaired by probiotics and improved by autologous FMT[J].Cell,2018,174(6):1406-1423.
[4] LI Y H,WANG S,SUN Y,et al.Apple polysaccharide could promote the growth of Bifidobacterium longum[J].International Journal of Biological Macromolecules,2020,152:1186-1193.
[5] LEE J M,JANG W J,LEE E W,et al.β-glucooligosaccharides derived from barley β-glucan promote growth of lactic acid bacteria and enhance nisin Z secretion by Lactococcus lactis[J].LWT,2020,122:109014.
[6] 王轶帆,邓媛元,张雁,等.龙眼多糖与燕麦多糖的结构特征及其益生活性比较[J].中国食品学报,2020,20(12):62-71.
WANG Y F,DENG Y Y,ZHANG Y,et al.Comparison of structure characteristics and probiotic activity of Longan polysaccharides and oat polysaccharides[J].Journal of Chinese Institute of Food Science and Technology,2020,20(12):62-71.
[7] LIU C,DU P,GUO Y H,et al.Extraction,characterization of aloe polysaccharides and the in-depth analysis of its prebiotic effects on mice gut microbiota[J].Carbohydrate Polymers,2021,261:117874.
[8] 刘露,张雁,魏振承,等.肠道益生菌体外发酵山药低聚糖产短链脂肪酸的研究[J].食品科学技术学报,2019,37(4):49-56.
LIU L,ZHANG Y,WEI Z C,et al.Study on production of short chain fatty acids from yam oligosaccharides by intestinal probiotics fermentation in vitro[J].Journal of Food Science and Technology,2019,37(4):49-56.
[9] 沈月,蔡丹,李雪,等.植物成分对乳酸菌生长促进作用研究进展[J].粮食与油脂,2021,34(2):14-17.
SHEN Y,CAI D,LI X,et al.Research progress on the growth promoting effects of plant components on lactic acid bacteria[J].Cereals &Oils,2021,34(2):14-17.
[10] OUYANG J,WANG F,LI W J,et al.Structure characterization of polysaccharide from Chinese yam (Dioscorea opposite Thunb.) and its growth-promoting effects on Streptococcus thermophilus[J].Foods,2021,10(11):2698.
[11] BIPLAB B,KUMAR M P,VIVEKANDA M,et al.Novel fructooligosaccharides of Dioscorea alata L.tuber have prebiotic potentialities[J].European Food Research and Technology,2021,247(12):3099-3112.
[12] HUANG C H,CHENG J Y,DENG M C,et al.Prebiotic effect of diosgenin,an immunoactive steroidal sapogenin of the Chinese yam[J].Food Chemistry,2012,132(1):428-432.
[13] 汪涛,周新群,孙君社,等.低共熔溶剂提取黄精多糖工艺优化及抗氧化活性研究[J].食品科学技术学报,2020,38(6):111-120.
WANG T,ZHOU X Q,SUN J S,et al.Study on optimal process and antioxidant activity of Polygonatum sibiricum polysaccharides extracted by deep eutectic solvents[J].Journal of Food Science and Technology,2020,38(6):111-120.
[14] 邱俊凯,隋伟策,木泰华,等.58个不同品种甘薯茎叶营养与功能成分的研究[J].核农学报,2021,35(4):911-922.
QIU J K,SUI W C,MU T H,et al.Comparative study on the nutritional and functional components of sweet potato leaves from fifty-eight cultivars[J].Journal of Nuclear Agricultural Sciences,2021,35(4):911-922.
[15] ZHOU S Y,HUANG G L,CHEN G Y.Extraction,structural analysis,derivatization and antioxidant activity of polysaccharide from Chinese yam[J].Food Chemistry,2021,361:130089.
[16] 石梦玄,张璐,田美玲,等.基于体外模拟肠道微生态体系比较不同果蔬全粉的益生元功效[J].中国食品学报,2020,20(2):87-94.
SHI M X,ZHANG L,TIAN M L,et al.The comparison of prebiotic roles of different vegetable and fruit powders using in vitro simulation intestinal microecology system[J].Journal of Chinese Institute of Food Science and Technology,2020,20(2):87-94.
[17] DE ALBUQUERQUE T M R,BORGES C W P,CAVALCANTI M T,et al.Potential prebiotic properties of flours from different varieties of sweet potato (Ipomoea batatas L.) roots cultivated in Northeastern Brazil[J].Food Bioscience,2020,36:100614.
[18] XU T,HUANG W S,LIANG J J,et al.Tuber flours improve intestinal health and modulate gut microbiota composition[J].Food Chemistry:X,2021,12:100145.
[19] 杨雅蛟,孔维军,李先恩,等.不同品种山药中多糖及小分子有效成分的含量比较[J].食品科技,2020,45(9):181-187.
YANG Y J,KONG W J,LI X E,et al.Comparison of polysaccharides and small molecule active ingredients in different varieties of yam[J].Food Science and Technology,2020,45(9):181-187.
[20] GIBSON G R,HUTKINS R,SANDERS M E,et al.Expert consensus document:The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics[J].Nature Reviews Gastroenterology &Hepatology,2017,14(8):491-502.
[21] 王静涵,张斯童,滕利荣,等.益生菌发酵中药的研究现状及产品开发[J].食品工业科技,2020,41(14):337-343;348.
WANG J H,ZHANG S T,TENG L R,et al.Research status and product development of probiotic fermentation of traditional Chinese medicine[J].Science and Technology of Food Industry,2020,41(14):337-343;348.
[22] JAYAMANOHAR J,DEVI P B,KAVITAKE D,et al.Prebiotic potential of water extractable polysaccharide from red kidney bean (Phaseolus vulgaris L.)[J].LWT,2019,101:703-710.
[23] AKBARI-ALAVIJEH S,SOLEIMANIAN-ZAD S,SHEIKH-ZEINODDIN M,et al.Pistachio hull water-soluble polysaccharides as a novel prebiotic agent[J].International Journal of Biological Macromolecules,2018,107(Part A):808-816.
[24] 丁伯乐,蔡为荣,闻志莹,等.山药低聚糖制备分离及对五种益生菌的增殖作用[J].食品与发酵工业,2020,46(24):74-79.
DING B L,CAI W R,WEN Z Y,et al.Preparation and isolation of yam oligosaccharides and its proliferation effect on five probiotics strains[J].Food and Fermentation Industries,2020,46(24):74-79.
[25] THAMBIRAJ S R,PHILLIPS M,KOYYALAMUDI S R,et al.Yellow lupin (Lupinus luteus L.) polysaccharides:Antioxidant,immunomodulatory and prebiotic activities and their structural characterisation[J].Food Chemistry,2018,267:319-328.
[26] ZHANG J Y,CHEN H L,LUO L,et al.Structures of fructan and galactan from Polygonatum cyrtonema and their utilization by probiotic bacteria[J].Carbohydrate Polymers,2021,267:118219.
[27] WEI B B,XIA W,WANG L,et al.Diverse prebiotic effects of isomaltodextrins with different glycosidic linkages and molecular weights on human gut bacteria in vitro[J].Carbohydrate Polymers,2022,279:118986.