氧化应激是机体氧化和还原失衡导致大量活性氧(reactive oxygen species,ROS)无法清除而引发的,研究表明85%的慢性疾病都受氧化压力的影响,因此清除ROS是维持内环境稳定的重要途径。抗氧化肽具有广泛的生物活性,除了可以有效地清除自由基、抑制脂质过氧化外,还可以起到抗疲劳[1]、抗衰老[2]、降血糖[3]、抗炎[4]、抗癌[5]、抗肿瘤[6]、增强机体免疫力、保护神经系统[7]等作用,可应用于食品、医疗、健康管理等领域,具有广阔的应用前景。目前,很多食物蛋白被证实存在抗氧化肽,如亚麻籽[8]、虾肉[9]、鸭血浆[10]、甘薯蛋白[11]等。食源性抗氧化肽具备高水溶性、低发泡性的优点,而且来源安全、结构简单、稳定性强、易被机体吸收,从而得到广泛研究[12]。
乳蛋白是一种重要的食源蛋白,乳源生物活性肽的开发与制备是当前的研究热点[13]。BALLATORE等[14]发现浓缩乳清蛋白经胰蛋白酶水解产生的肽具有抗氧化和保护细胞抵御氧化应激的作用。此外,我国种植了大量农作物,加工过程中往往产生丰富的蛋白副产物,利用这些植物蛋白开发具有高附加值的功能性食品是充分利用资源的良好方法[15-16]。JIANG等[17]研究表明玉米蛋白肽可以在体内发挥良好的抗氧化作用,是可靠的天然抗氧化剂。因此,从乳源和植物副产物中制备抗氧化肽具有十分重要的价值。
抗氧化肽在其母体蛋白结构中并不具备活性,需要经过加工处理释放后才能发挥活性[18]。酶解法是实验室乃至工业生产中最为常用的肽的制备方法,但酶解样品中通常含有灭活的酶、盐等杂质,需要经过分离纯化才能深入了解样品中多肽的性质。CHAI等[19]对菠萝蜜种子蛋白水解物进行纯化和测序分析,得到了一条具有ABTS阳离子自由基清除能力的肽序列,并评估了其胃肠道消化稳定性。DING等[20]从豌豆蛋白水解物中分离出14条多肽,证明了酪氨酸-丝氨酸-丝氨酸-脯氨酸-异亮氨酸-组氨酸-异亮氨酸-色氨酸(YSSPIHIW)等是影响水解物抗氧化活性的主要原因。
本研究以α-乳白蛋白、酪蛋白、米糠蛋白、麦谷蛋白和火麻仁蛋白5种食源性蛋白质为研究对象,分别使用碱性蛋白酶和胃肠道消化酶制备水解产物并评估其抗氧化活性,进一步鉴定高活性酶解产物中的抗氧化肽序列,为蛋白质的功能性开发提供理论依据。
1 材料与方法
1.1 材料与试剂
α-乳白蛋白,北京中柏创业化工产品有限公司;酪蛋白,上海阿拉丁化学试剂有限公司;米糠蛋白,陕西三原龙生生物技术有限责任公司;麦谷蛋白,盈芯生物科技有限公司;火麻仁蛋白,江西省富之源生物科技公司;蛋白酶、葡聚糖凝胶,索莱宝科技有限公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
D-8紫外分光光度计,南京菲勒仪器有限公司;PB-10型pH计,赛多利斯仪器有限公司;HH-4型数显恒温磁力搅拌水浴锅,常州赛普实验仪器厂;Multiskan FC多功能酶标仪,瑞士TECAN集团;AKTA蛋白纯化仪,美国通用电气公司;液质联用仪,美国Thermo Fisher公司。
1.3 实验方法
1.3.1 蛋白的选择
使用ExPASy ProtParam(https://web.expasy.org/protparam/)在线软件计算实验室常见的乳源蛋白质(α-乳白蛋白、酪蛋白)和植物蛋白(米糠蛋白、麦谷蛋白和火麻仁蛋白)的各种氨基酸组成,根据氨基酸占比选择合适的蛋白源。该工具可以自动计算包括分子质量、氨基酸组成、原子组成、脂肪族指数和亲水性的均值等参数。
1.3.2 蛋白质水解
将α-乳白蛋白、酪蛋白、米糠蛋白、麦谷蛋白和火麻仁蛋白配制成2%的蛋白溶液,第一组使用碱性蛋白酶水解,水解时间为10 h。第二组先使用胃蛋白酶水解蛋白2 h,调节胰液素至最适pH后灭酶加入胰液素继续水解3 h。蛋白酶添加量为5 000 U/g,水解时加入适量的0.1 mol/L NaOH或0.1 mol/L HCl溶液使反应体系处于酶反应的最适pH,每隔一段时间取水解液1 mL于沸水浴中灭酶5 min,作为水解样品用于测定水解度,水解结束后,将最终的蛋白水解液冻干备用。
1.3.3 水解度的测定
采用邻苯二甲醛(o-phthalaldehyde,OPA)法。配制L-亮氨酸标准储备液,取各浓度的储备液3 mL与等体积的OPA试剂混匀后准确计时反应5 min,以去离子水为空白,于340 nm测定OD值,绘制标准曲线。将蛋白水解液适当稀释,取3 mL蛋白稀释液以相同的操作步骤测定OD值,游离氨基的含量计算方式如公式(1)和公式(2)所示:
(1)
(2)
式中:c,游离氨基含量,mmol/g;ρ(亮氨酸),从标准曲线中计算出的亮氨酸的含量,μg/mL;N,蛋白水解液的稀释倍数;131.17,亮氨酸摩尔质量,g/mol;X,样品的蛋白含量,g/L;c1,样品水解后的游离氨基含量,mmol/g;c2,样品水解前的游离氨基酸含量,mmol/g;htot,蛋白的肽键含量,mmol/g。
1.3.4 水解样ABTS阳离子自由基清除活性的测定
将蛋白水解液冻干粉复溶,测定其ABTS阳离子自由基清除活性。样品溶液的质量浓度为1 mg/mL,4 ℃存放。PBS配制的过硫酸钾与ABTS混合作为ABTS储备液,于37 ℃恒温培养箱中静置过夜,使用时ABTS储备液用PBS稀释,作为ABTS工作液,避光放置。向96孔板中每孔加入180 μL ABTS工作液和各样品溶液,以PBS缓冲溶液作为对照,每组设置3个平行,混合均匀并于温室孵育,在750 nm测定OD值。ABTS阳离子自由基清除率按公式(3)计算:
ABTS阳离子自由基清除率![]()
(3)
式中:A1,实验组OD值;A2,对照组OD值;A3,空白组OD值。
以Trolox浓度为横坐标,清除率或吸光值变化量为纵坐标绘制标准曲线,根据标准曲线求得三肽的Trolox当量,单位为μmol TE/μmol。
1.3.5 蛋白水解物的分离纯化
1.3.5.1 抗氧化肽的凝胶色谱分离
室温条件下,将葡聚糖凝胶粉末于去离子水中浸泡24 h使其充分溶胀,洗净后装入层析柱备用,柱子规格为Φ10 mm×300 mm。将上述得到的蛋白水解样冻干粉配制成25 mg/mL的溶液,经0.45 μm滤膜过滤后,利用恒流泵缓慢进样,上样结束后以去离子水作为流动相进行洗脱,流速设定为1 mL/min,紫外检测波长为280 nm,以每管3 mL为单位回收洗脱液并将同一分离峰合并,冷冻干燥后测定各个组分的ABTS阳离子自由基清除能力。
1.3.5.2 抗氧化肽的序列鉴定
采用LC-MS/MS对抗氧化肽进行序列鉴定。色谱条件:液相色谱柱(0.15 mm×150 mm,RP-C18,Column Technology Inc.)以95%的A液(0.1%甲酸水溶液)进行平衡,样品由自动进样器上样到Zorbax 300SB-C18 peptide traps (Agilent Technologies,Wilmington,DE),再经过液相色谱柱分离,液相梯度设置如下:0~50 min,4%~50%B液(0.1%甲酸乙腈水溶液);50~54 min,50%~100%B液;54~60 min,100%B液。质谱条件:用Q Exactive质谱仪(Thermo Fisher)进行质谱分析,分析时长60 min;检测方式为正离子;一级离子质量容差0.1 Da。
1.4 实验数据统计与分析
采用Excel、Origin软件处理和分析数据并绘图,用Statistix 8软件进行显著性分析,显著性水平为α=0.05。
2 结果与分析
2.1 蛋白原料和酶的选择
肽的抗氧化能力受很多因素影响,如蛋白质和蛋白酶种类、蛋白质的氨基酸组成和序列、水解程度等[21]。ZHENG等[22]通过实验发现来源于蛋白的游离氨基酸中,只有Trp、Tyr、Cys和Met具有ABTS阳离子自由基清除能力,其中Trp和Tyr清除能力最强。Trp的吲哚环(—NH)、Tyr的酚羟基(—OH)和Cys的巯基(—SH)都是良好的供氢体,可以起到清除自由基的作用,当它们位于肽链的端基时,更多的基团暴露在外,进而发挥更有效的抗氧化功能[23]。
通过ExPASy ProtParam计算5种蛋白源的氨基酸占比如表1所示。
表1 蛋白质的各种氨基酸占比 单位:%
Table 1 Proportion of various amino acids in proteins
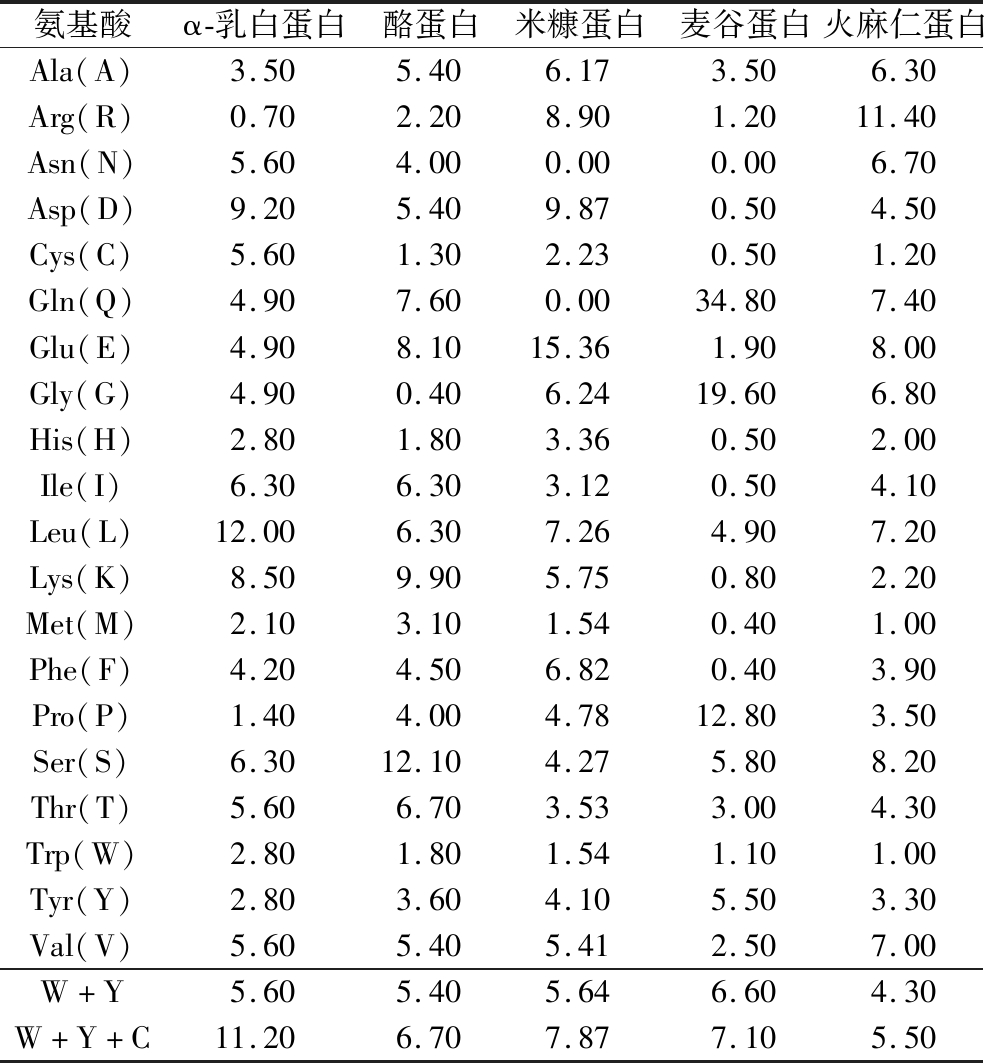
氨基酸α-乳白蛋白酪蛋白米糠蛋白麦谷蛋白火麻仁蛋白Ala(A)3.505.406.173.506.30Arg(R)0.702.208.901.2011.40Asn(N)5.604.000.000.006.70Asp(D)9.205.409.870.504.50Cys(C)5.601.302.230.501.20Gln(Q)4.907.600.0034.807.40Glu(E)4.908.1015.361.908.00Gly(G)4.900.406.2419.606.80His(H)2.801.803.360.502.00Ile(I)6.306.303.120.504.10Leu(L)12.006.307.264.907.20Lys(K)8.509.905.750.802.20Met(M)2.103.101.540.401.00Phe(F)4.204.506.820.403.90Pro(P)1.404.004.7812.803.50Ser(S)6.3012.104.275.808.20Thr(T)5.606.703.533.004.30Trp(W)2.801.801.541.101.00Tyr(Y)2.803.604.105.503.30Val(V)5.605.405.412.507.00W+Y5.605.405.646.604.30W+Y+C11.206.707.877.105.50
由表1可知,酪蛋白、麦谷蛋白、α-乳白蛋白和米糠蛋白的Trp与Tyr的比重和均在5%以上,3种优势氨基酸占比之和也在6%以上,高于火麻仁蛋白。因此本研究选取α-乳白蛋白、酪蛋白、米糠蛋白和麦谷蛋白作为潜在的优势蛋白原料,水解制备抗氧化肽,火麻仁蛋白作为阴性对照。此外,蛋白酶的选择对水解产物的活性也会有很大影响。碱性蛋白酶的专一性较差而且价格低,是使用极为广泛的蛋白水解酶,而且其主要水解位点为芳香族氨基酸,符合实验需求。胃蛋白酶的水解位点虽然满足要求,但其水解位点相当有限,因此本实验使用胃蛋白酶与胰液素双酶解的方式制备抗氧化肽。另一方面,这2种酶属于胃肠道消化酶,可以起到模拟人体消化的作用。
2.2 蛋白水解度变化趋势
如图1所示,碱性蛋白酶水解组中,α-乳白蛋白的水解度最高,达到47.38%,其水解曲线与麦谷蛋白十分贴近;火麻仁蛋白最低,其在水解发生180 min后的水解度几乎不变。双酶解实验中,所有蛋白的最终水解度较单酶水解样品均有升高(图2)。前120 min由胃蛋白酶水解得到的样品水解度仅有12%~15%,灭酶后调节体系的反应条件,加入胰液素继续水解,水解度迅速上升,酪蛋白的最终水解度最大,为66.89%,而火麻仁蛋白的水解度只有30%左右。双酶解组虽然水解时间短(300 min),但是水解度显著高于碱性蛋白酶水解组,这是由于当使用胃蛋白酶水解蛋白时,蛋白的结构被初步打开,一些位点得以暴露,而胰液素作为复合酶,水解位点比较广泛,在加入水解体系后未被完全展开的蛋白结构被迅速打开,使得水解度容易达到非常高的水平。
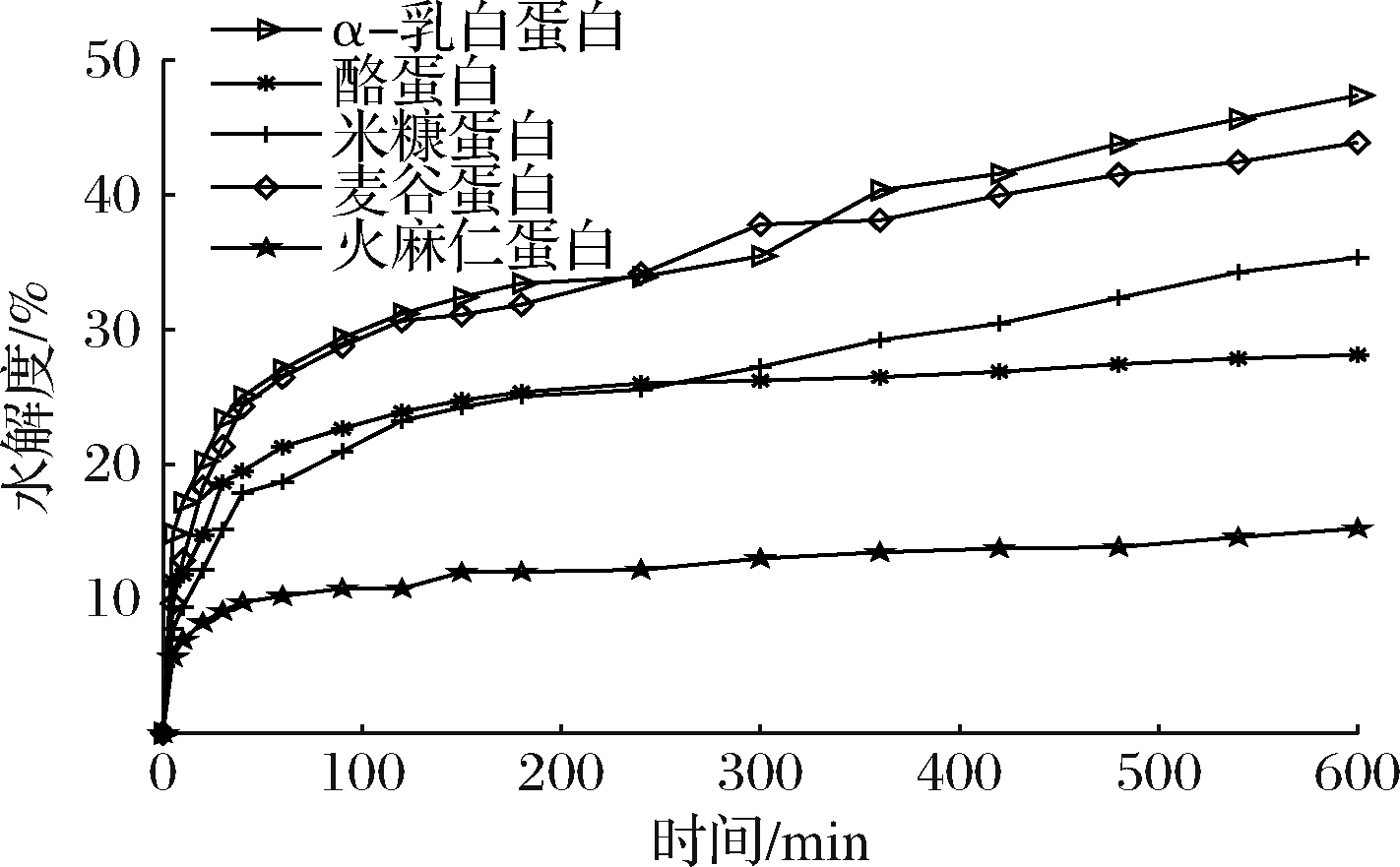
图1 碱性蛋白酶水解曲线
Fig.1 The trend of hydrolysis degree of the hydrolysates obtained by alkaline protease hydrolysis

图2 胃蛋白酶与胰液素两步水解条件下的水解曲线
Fig.2 The trend of hydrolysis degree by two-step hydrolysis with pepsin and pancreatin
注:右图为局部放大图。
2.3 蛋白水解产物抗氧化活性的测定
本研究选择ABTS法评价样品的抗氧化活性,分析蛋白水解样品的自由基清除能力,结果如图3所示。碱性蛋白酶的水解样品抗氧化活性更高,这说明不同蛋白酶水解条件下的样品的水解度大小与活性无关,而且碱性蛋白酶可以更好地促使高活性抗氧化肽的释放。这可能是因为胃蛋白酶的水解位点是Phe、Tyr、Trp、Leu羧基端,胰液素的水解位点是Trp、Tyr、Phe,而碱性蛋白酶的作用位点较广,更有利于含Trp、Tyr、Cys和Met氨基酸的释放。两组样品中,α-乳白蛋白、酪蛋白、米糠蛋白和麦谷蛋白的活性非常接近且显著高于火麻仁蛋白(P<0.05)。单酶水解样品中,酪蛋白的活性最高,为1.784 2 μmol TE/mg,其次是α-乳白蛋白和米糠蛋白,火麻仁蛋白水解产物的活性最低,为1.403 2 μmol TE/mg。这可能是由于火麻仁蛋白的溶解度和水解度都比较低,酶切时不利于活性肽段的释放。双酶解样品中,酪蛋白的活性最高,其次是米糠蛋白和麦谷蛋白,火麻仁蛋白水解物的活性为1.302 8 μmol TE/mg。
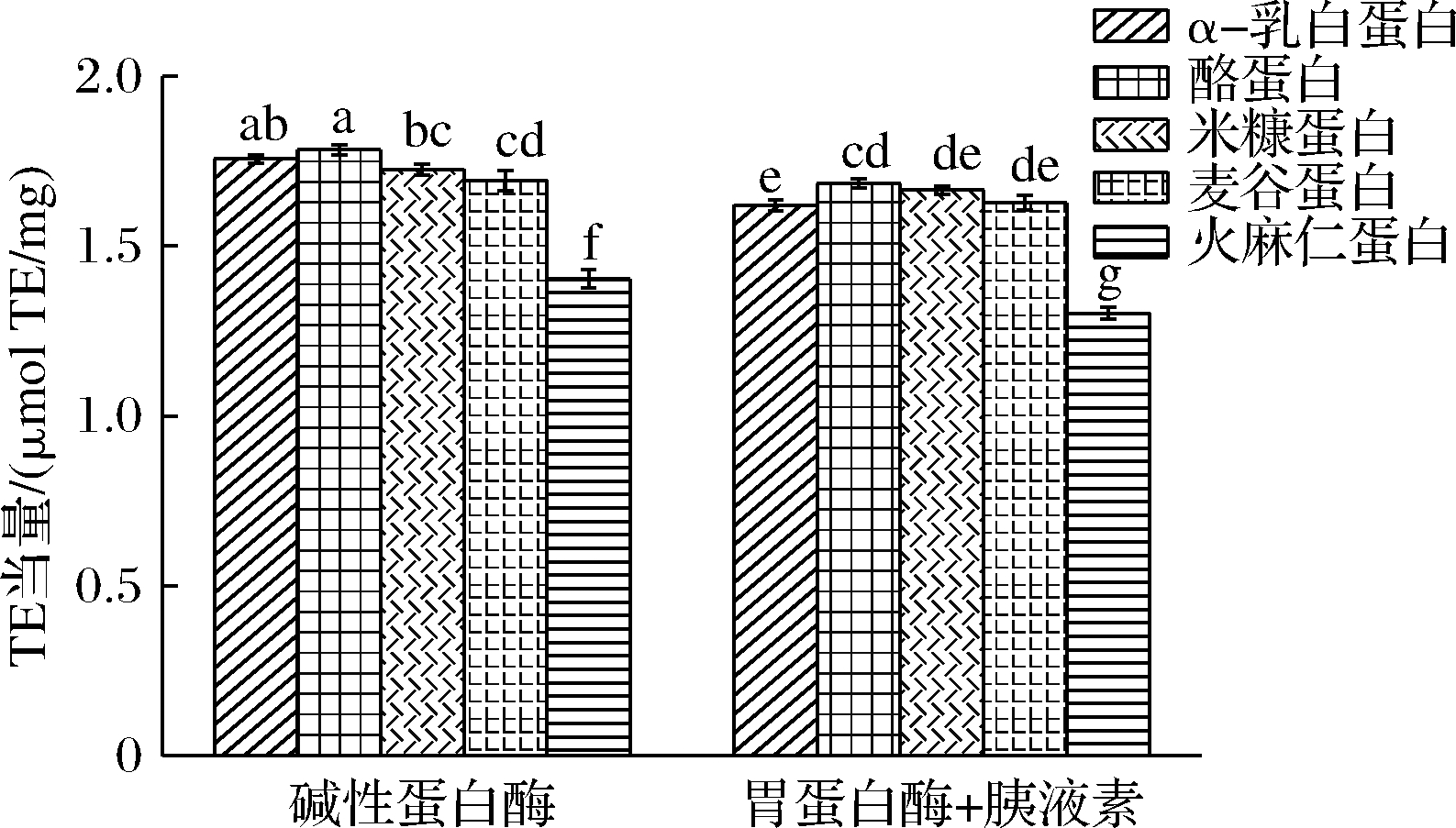
图3 不同水解条件下样品的抗氧化活性
Fig.3 Antioxidant activities of the samples under different hydrolysis conditions
注:小写字母相同表示差异不显著(P>0.05)。
2.4 蛋白水解物的凝胶色谱分离
将上述4种抗氧化活性较强的水解样品进行凝胶色谱分离,纯化过程中以体积为单位回收洗脱液,色谱图如图4所示。可见每种蛋白样品可以得到2~4个分离组分,其中将米糠蛋白水解产物的第2个和第3个分离峰进行合并,记为一个组分,所有组分从左至右依次由F1、F2、F3表示。
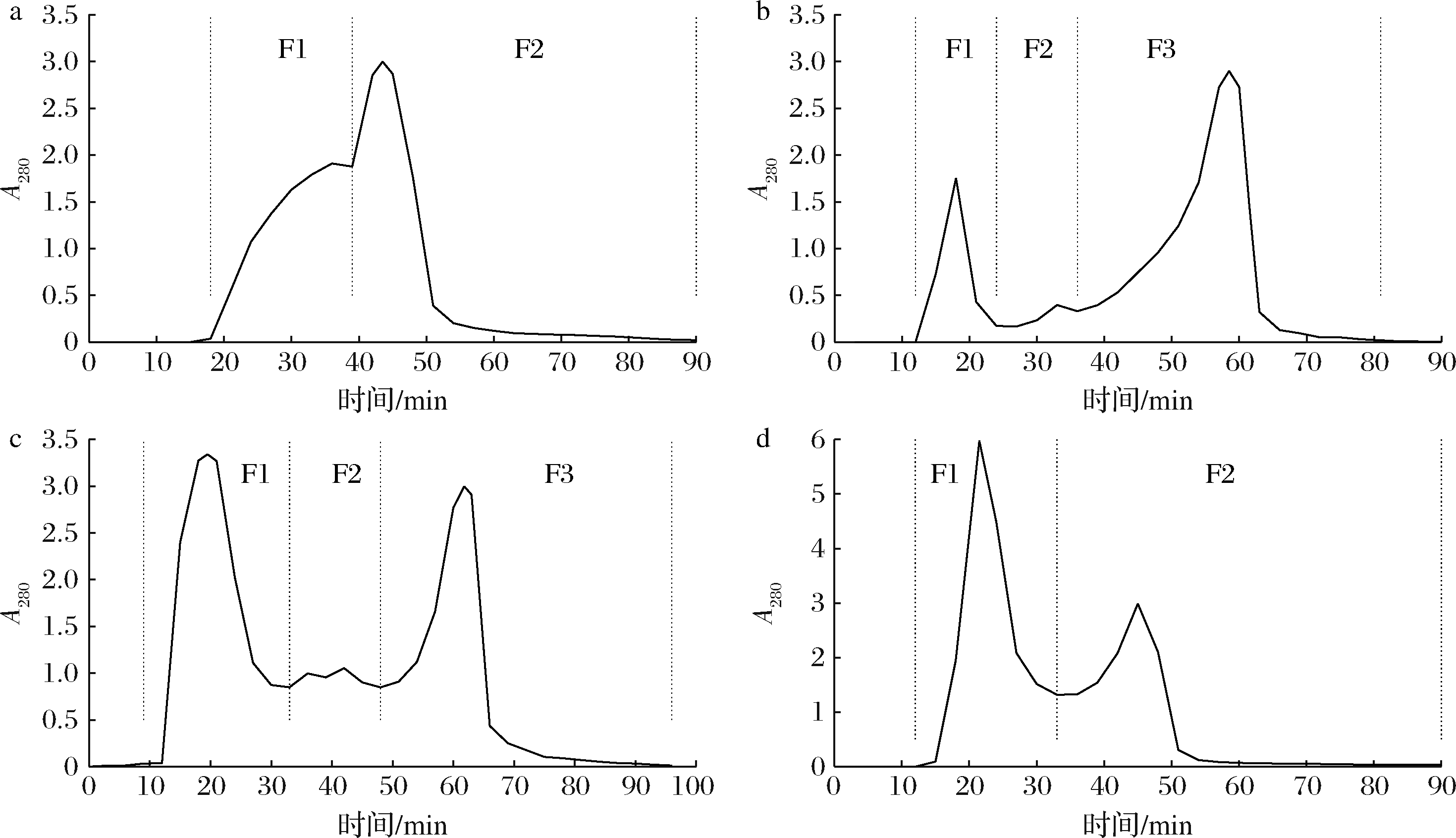
a-α-乳白蛋白;b-酪蛋白;c-米糠蛋白;d-麦谷蛋白
图4 蛋白水解样的凝胶色谱图
Fig.4 Chromatograms of hydrolysates
2.5 蛋白纯化产物的抗氧化活性测定
测定水解物各个分离组分的抗氧化活性,结果如表2所示。
表2 蛋白各分离组分的抗氧化活性
Table 2 Antioxidant activity of each fraction of proteins
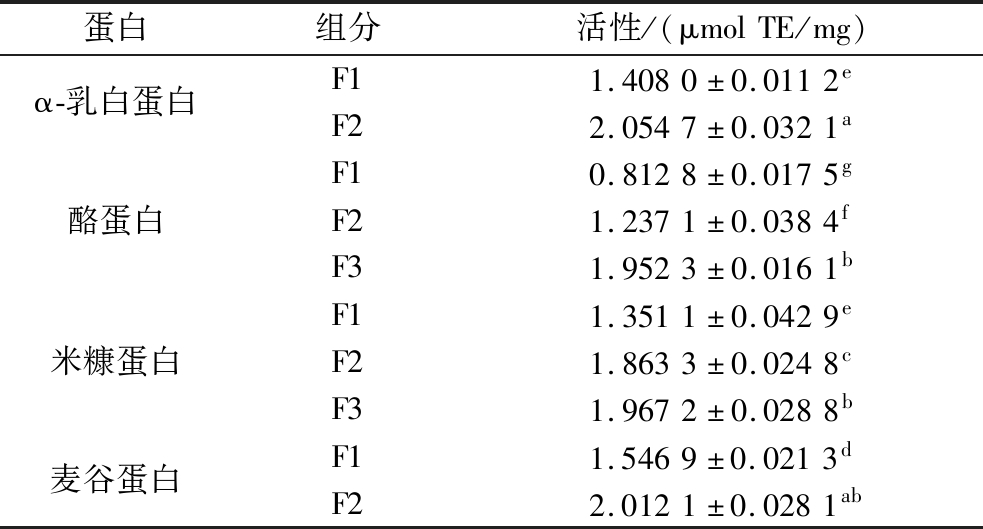
蛋白组分活性/(μmolTE/mg)α-乳白蛋白F11.4080±0.0112eF22.0547±0.0321a酪蛋白F10.8128±0.0175gF21.2371±0.0384fF31.9523±0.0161b米糠蛋白F11.3511±0.0429eF21.8633±0.0248cF31.9672±0.0288b麦谷蛋白F11.5469±0.0213dF22.0121±0.0281ab
注:小写字母相同表示差异不显著(P>0.05),不同表示差异显著(P<0.05)。
由表2结果可知,α-乳白蛋白的F2活性最高,为2.054 7 μmol TE/mg,说明这部分组分包含了丰富的高活性抗氧化肽。还可以发现这4种蛋白水解物分离得到的最后一个组分的活性最强,明显高于未纯化的水解样品,说明纯化有利于提高样品活性,而且小分子质量肽段集中的组分抗氧化活性更强,这与IRSHAD等[24]的研究结果一致。在另一项类似的研究中,研究者将小麦蛋白的胃蛋白酶水解产物分离成4种不同分子质量范围的组分,结果表明分子质量越低的组分表现出的抗氧化活性越强,验证了蛋白活性与其分子质量分布密切相关[25]。
2.6 抗氧化肽的序列鉴定
高效色谱技术联合质谱技术已经被广泛应用于蛋白样品中的生物活性肽鉴定,SHAZLY等[26]从水牛和奶牛酪蛋白水解物中鉴定出具有抗氧化活性的肽段;ORSINI DELGADO等[27]从苋菜红蛋白胃肠道模拟水解中鉴定出7条具有氧化自由基清除能力的多肽;AHMED等[28]从羊乳蛋白酶解物中鉴定出了抗氧化肽,这些研究结果表明液质联用技术是鉴定蛋白中的生物活性肽的有效方式,在深入研究蛋白质的结构与功能方面发挥重要作用。
采用LC-MS/MS对活性最高的α-乳白蛋白F2进行序列鉴定。由于F2所包含的肽段过短,在数据库中无法搜索到匹配的肽段,需要采用二级质谱分析结合De novo手动从头测序来分析肽段序列。肽段在母离子与惰性气体碰撞的能量作用下断裂后会生成一个b、y离子对,N-端的碎片为b离子,C-端的碎片为y离子,根据b、y碎片离子对多肽序列进行分析。在组分F2中,共鉴定出11条多肽,其中6条三肽(WVC、FVF、LFY、LFQ、QWL和YWL),5条四肽(WLAH、LLLL、YGLF、NYWL和LLLV),所有肽段均带1个电荷([M+H]+),肽段的二级质谱(MS/MS)如图5所示。多项研究表明,当Trp、Tyr和Cys这3种氨基酸位于三肽的端基时,肽的抗氧化活性通常较高[29-30]。综上所述,本研究获得三肽中WVC、LFY、YWL具有抗氧化活性潜力。
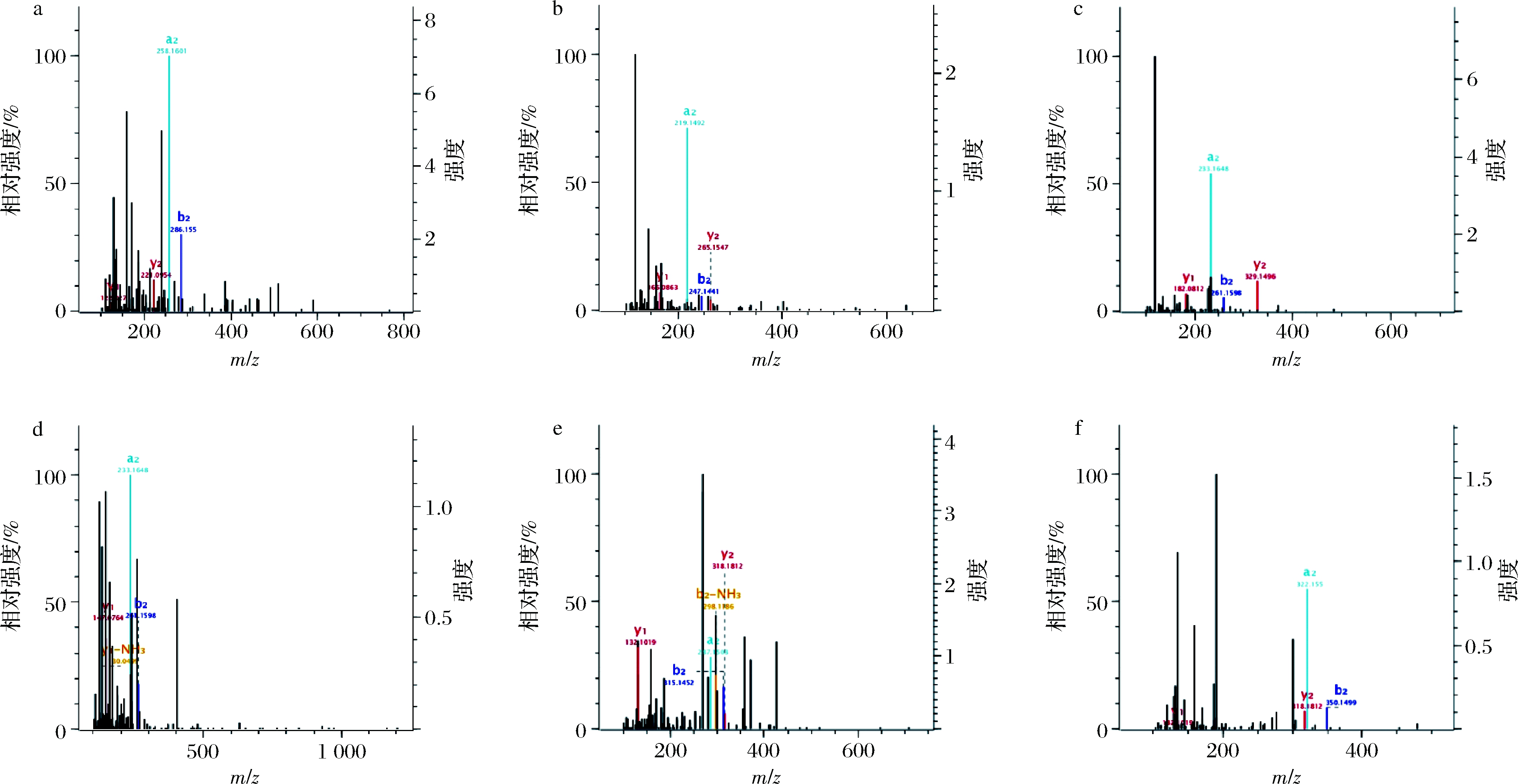

a-WVC(m/z=406.18);b-FVF (m/z=412.22);c-LFY (m/z=443.24);d-LFQ (m/z=407.86);e-QWL (m/z=446.24);f-YWL (m/z=481.24);g-WLAH (m/z=528.28);h-LLLL (m/z=472.18);i-YGLF (m/z=498.90);j-NYWL (m/z=595.29);k-LLLV (m/z=456.69)
图5 多肽的二级质谱图
Fig.5 MS/MS spectra of polypeptide
3 结论
本研究分别使用碱性蛋白酶、胃蛋白酶与胰液素双酶水解α-乳白蛋白、酪蛋白、米糠蛋白、麦谷蛋白和火麻仁蛋白,制备抗氧化肽。对比不同样品的抗氧化活性发现,在以碱性蛋白酶、胃蛋白酶与胰液素双酶解条件下,α-乳白蛋白、酪蛋白、米糠蛋白和麦谷蛋白更适合作为制备抗氧化肽的原料,且碱性蛋白酶水解得到的样品活性更高。通过凝胶色谱法分离水解样品并测定活性,结果表明低分子质量的分离组分活性更高。利用LC-MS/MS在α-乳白蛋白纯化组分中鉴定出6条三肽和5条四肽,其中WVC、LFY和YWL具有较高的抗氧化活性潜力。本实验成功从α-乳白蛋白纯化组分中鉴定出具有高抗氧化活性潜力的肽段。结合本研究的结果可以用于指导天然抗氧化肽蛋白原料的选择。
[1] WANG L,SONG X,CUI H,et al.Antifatigue effects of peptide isolated from sheep placenta[J].Chinese Herbal Medicines,2018,10(3):279-284.
[2] CHEN H Q,WANG S,ZHOU A M,et al.A novel antioxidant peptide purified from defatted round scad (Decapterus maruadsi) protein hydrolysate extends lifespan in Caenorhabditis elegans[J].Journal of Functional Foods,2020,68:103907.
[3] 曹月.棉籽肽的制备及其对Ⅱ型糖尿病小鼠治疗作用的研究[D].长春:吉林大学,2016.
CAO Y.Preparation cottonseed peptide and its therapeutic effect in mice of type Ⅱ diabetes[D].Changchun:Jilin University,2016.
[4] AHN C B,JE J Y,CHO Y S.Antioxidant and anti-inflammatory peptide fraction from salmon byproduct protein hydrolysates by peptic hydrolysis[J].Food Research International,2012,49(1):92-98.
[5] 张艳.两种海洋抗氧化肽预防UVB致小鼠皮肤癌的效应及可能机理研究[D].青岛:青岛大学,2016.
ZHANG Y.The preventive effects of two marine anti-oxidant peptides against UVB induced mouse skin cancer and exploration of potential mechanism[D].Qingdao:Qingdao University,2016.
[6] ROZEK T,WEGENER K L,BOWIE J H,et al.The antibiotic and anticancer active aurein peptides from the Australian Bell Frogs Litoria aurea and Litoria raniformis the solution structure of aurein 1.2[J].European Journal of Biochemistry,2000,267(17):5330-5341.
[7] ZHANG Q,SU G W,ZHAO T T,et al.Neuroprotection of round scad (Decapterus maruadsi) hydrolysate in glutamate-damaged PC12 cells:Possible involved signaling pathways and potential bioactive peptides[J].Journal of Functional Foods,2020,64:103690.
[8] 张文敏,张健,周浩纯,等.亚麻籽粕制备小分子抗氧化活性肽[J].食品科学,2020,41(8):36-44.
ZHANG W M,ZHANG J,ZHOU H C et al.Preparation of small molecular antioxidant peptides from flaxseed meal[J].Food Science,2020,41(8):36-44.
[9] WU D,LI M Q,DING J,et al.Structure-activity relationship and pathway of antioxidant shrimp peptides in a PC12 cell model[J].Journal of Functional Foods,2020,70:103978.
[10] YANG J,HUANG J C,DONG X L,et al.Purification and identification of antioxidant peptides from duck plasma proteins[J].Food Chemistry,2020,319:126534.
[11] HABINSHUTI I,MU T H,ZHANG M.Ultrasound microwave-assisted enzymatic production and characterisation of antioxidant peptides from sweet potato protein[J].Ultrasonics Sonochemistry,2020,69:105262.
[12] ZENG W C,SUN Q,ZHANG W H,et al.Antioxidant activity in vivo and biological safety evaluation of a novel antioxidant peptide from bovine hair hydrolysates[J].Process Biochemistry,2017,56:193-198.
[13] 于洋,祁艳霞,靳艳.乳源生物活性肽研究进展[J].食品与发酵工业,2017,43(9):259-266.
YU Y,QI Y X,JIN Y.Milk-derived bioactive peptides:A review[J].Food and Fermentation Industries,2017,43(9):259-266.
[14] BALLATORE M B,DEL ROSARIO BETTIOL M,VANDEN BRABER N L,et al.Antioxidant and cytoprotective effect of peptides produced by hydrolysis of whey protein concentrate with trypsin[J].Food Chemistry,2020,319:126472.
[15] 陈季旺,姚惠源.几种常见植物蛋白生物活性肽的研究概述[J].中国油脂,2003,28(1):37-40.
CHEN J W,YAO H Y.Research summarize of several familiar active peptides derived from vegetable protein[J].China Oils and Fats,2003,28(1):37-40.
[16] 张美莉,侯文娟,杨立风.植物蛋白源生物活性肽的研究进展[J].中国食物与营养,2010,16(11):33-36.
ZHANG M L,HOU W J,YANG L F.Research advancement of bioactive peptides derived from plant protein[J].Food and Nutrition in China,2010,16(11):33-36.
[17] JIANG X,CUI Z Q,WANG L H,et al.Production of bioactive peptides from corn gluten meal by solid-state fermentation with Bacillus subtilis MTCC5480 and evaluation of its antioxidant capacity in vivo[J].LWT,2020,131:109767.
[18] JI D W,UDENIGWE C C,AGYEI D.Antioxidant peptides encrypted in flaxseed proteome:An in silico assessment[J].Food Science and Human Wellness,2019,8(3):306-314.
[19] CHAI T T,XIAO J B,MOHANA DASS S,et al.Identification of antioxidant peptides derived from tropical jackfruit seed and investigation of the stability profiles[J].Food Chemistry,2021,340:127876.
[20] DING J,LIANG R,YANG Y Y,et al.Optimization of pea protein hydrolysate preparation and purification of antioxidant peptides based on an in silico analytical approach[J].LWT,2020,123:109126.
[21] GUO H Q,WANG Y X,HE Q X,et al.In silico rational design and virtual screening of antioxidant tripeptides based on 3D-QSAR modeling[J].Journal of Molecular Structure,2019,1193:223-230.
[22] ZHENG L,ZHAO Y J,DONG H Z,et al.Structure-activity relationship of antioxidant dipeptides:Dominant role of Tyr,Trp,Cys and Met residues[J].Journal of Functional Foods,2016,21:485-496.
[23] DENG B C,LONG H R,TANG T Y,et al.Quantitative structure-activity relationship study of antioxidant tripeptides based on model population analysis[J].International Journal of Molecular Sciences,2019,20(4):995.
[24] IRSHAD I,KANEKANIAN A,PETERS A,et al.Antioxidant activity of bioactive peptides derived from bovine casein hydrolysate fractions[J].Journal of Food Science and Technology,2015,52(1):231-239.
[25] KONG X Z,ZHOU H M,HUA Y F.Preparation and antioxidant activity of wheat gluten hydrolysates (WGHs) using ultrafiltration membranes[J].Journal of the Science of Food and Agriculture,2008,88(5):920-926.
[26] SHAZLY A B,MU H B,LIU Z M,et al.Release of antioxidant peptides from buffalo and bovine caseins:Influence of proteases on antioxidant capacities[J].Food Chemistry,2019,274:261-267.
[27] ORSINI DELGADO M C,NARDO A,PAVLOVIC M,et al.Identification and characterization of antioxidant peptides obtained by gastrointestinal digestion of amaranth proteins[J].Food Chemistry,2016,197:1160-1167.
[28] AHMED A S,EL-BASSIONY T,ELMALT L M,et al.Identification of potent antioxidant bioactive peptides from goat milk proteins[J].Food Research International,2015,74:80-88.
[29] SAITO K,JIN D H,OGAWA T,et al.Antioxidative properties of tripeptide libraries prepared by the combinatorial chemistry[J].Journal of Agricultural and Food Chemistry,2003,51(12):3668-3674.
[30] CHEN N,CHEN J,YAO B,et al.QSAR study on antioxidant tripeptides and the antioxidant activity of the designed tripeptides in free radical systems[J].Molecules,2018,23(6):1407.