咸鸭蛋清以蛋清蛋白为主,蛋白组成与鲜鸭蛋清无异[1],但咸鸭蛋清含盐量较高,利用率较低,仅有少量咸蛋清被加工成添加剂或饲料[2]。每年上千万吨的剩余咸鸭蛋清被丢弃,造成资源浪费和环境污染[3]。咸鸭蛋清中存在大量天然抗氧化肽[4],可利用咸鸭蛋清制备蛋源性抗氧化肽,对蛋白质资源开发利用具有重要意义。
目前,常用水解法制备食源性抗氧化肽,但由于不同蛋白酶的底物特异性和作用的酶切位点不同,水解后产生多肽的种类、数量及氨基酸序列不同[5],因此分离纯化难度较大。在蛋源性抗氧化肽的分离纯化研究中,常将超滤、离子交换、凝胶层析和高效液相等方法联用,如梅辉等[6]利用离子交换柱和凝胶层析分离鸭蛋水解液,得到小分子抗氧化活性粗肽;NIMALARATNE等[7]利用超滤和高效液相,ZHANG等[8]利用超滤和凝胶层析柱,对水解蛋清液进行连续分离得到抗氧化肽。中压柱层析是近年应用于中草药活性成分、多肽、小分子药物有效成分分离纯化的一种新技术。其具有仪器要求配置较低,且适用于多种填料,分离效果好等优点,可实现高效高产的目的[9-10],但在蛋清活性肽的分离纯化中却鲜少使用。
基于此,本实验首先以脱盐蛋清粉为原料,筛选出最适蛋白酶并确定水解条件,酶解制备具有抗氧化活性的水解粗肽。再通过超滤和中压柱层析联用依次对水解粗肽进行分级和纯化。最后确定所得抗氧化肽的纯度和氨基酸序列,旨在为咸鸭蛋清的综合利用提供一定的参考。
1 材料与方法
1.1 材料
脱盐蛋清粉(蛋白质含量约为93.81 g/100 g、NaCl含量约为3.02 g/100 g),实验室自制;菠萝蛋白酶(bromelain,3.5×104 U/g)、风味蛋白酶(flavor enzyme,4.5×104 U/g)、木瓜蛋白酶(papain,4×104 U/g)、酸性蛋白酶(acid protease,2×104 U/g)、碱性蛋白酶(alkaline protease,8.5×104 U/g)、中性蛋白酶(neutral protease,8.5×104 U/g),合肥博美生物科技有限责任公司;Sephadex LH-20,北京瑞达恒辉有限公司;DPPH、ABTS、抗坏血酸,北京沃凯生物科技有限公司;PTIO,上海阿拉丁生化科技股份有限公司。
1.2 仪器
UVmini—1280紫外分光光度计,日本岛津有限公司;Multiskan FC型酶标仪,赛默飞世尔(上海)仪器有限公司;真空冷冻干燥机,松源华兴科技发展有限公司;超滤离心管(3、10、50 kDa),美国Millipore公司;Quiksep-50IID中高压液相色谱仪、Quiksep玻璃中压层析柱(600 mm ×20 mm),北京慧德易科技有限责任公司;Waters高效液相色谱仪,美国Waters公司;Q-Exactive四极杆高分辨质谱仪,美国赛默飞世尔公司。
1.3 实验方法
1.3.1 蛋白酶的筛选
选用菠萝蛋白酶、风味蛋白酶、木瓜蛋白酶、酸性蛋白酶、碱性蛋白酶、中性蛋白酶,分别在各蛋白酶最适合pH和温度基础上,底物质量浓度为50 g/L、酶添加量为1×104 U/g的条件下,酶解时间为4 h,以DPPH自由基清除率作为主要指标,水解度(degree of hydrolysis,DH)为参考指标,考察各蛋白酶酶解产物的抗氧化能力,选取最适蛋白酶。采用三氯乙酸沉淀法测定DH[11],DH计算中氮含量采用GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的方法测定。
1.3.2 酶解条件的确定及优化
取脱盐蛋清粉以超纯水配制溶液,添加蛋白酶,恒温酶解一定时间,酶解过程中以NaOH/柠檬酸保持pH=3.0±0.1,酶解结束后,沸水浴15 min灭酶,冷却后4 000 r/min离心15 min,取上清液冻干得蛋清粗肽。考察在酶解温度(40、45、50、55 ℃)、底物质量浓度(10、30、50、80 g/L)、酶添加量(5、10、15、20 kU/g)及酶解时间(1、2、4、6、8 h)条件下所得酶解产物的DPPH自由基清除率和DH。在此基础上,通过正交试验进行工艺优化,确定最适酶解条件。
1.3.3 体外抗氧化活性的测定
DPPH自由基清除率测定[12]:在96孔板中每孔先后加入样品100 μL和0.5 mmol/L DPPH甲醇溶液100 μL,室温下,暗处反应30 min,采用酶标仪在517 nm处检测吸光度,记作实验组As;以甲醇溶液替代DPPH甲醇溶液,记作对照组Ac;以甲醇替代样品,记作空白组Ab。
自由基清除率![]()
(1)
ABTS阳离子自由基清除率测定[13]:ABTS阳离子自由基工作液的配制参考文献[13],在96孔板中每孔先后加入样品50 μL和ABTS阳离子自由基工作液200 μL,室温下,暗处反应5 min,在734 nm处检测吸光度,记作实验组As;以超纯水替代ABTS阳离子自由基工作液,记作对照组Ac;以超纯水替代样品,记作空白组Ab,清除率按公式(1)计算。
PTIO自由基清除率测定[14]:超纯水配制0.65 mmol/L的PTIO溶液,充分混匀。在96孔板中每孔先后加入样品100 μL和0.65 mmol/L的PTIO水溶液100 μL,37 ℃条件下反应30 min,在557 nm处检测吸光度,记作实验组As;以超纯水替代PTIO溶液,记作对照组Ac;以超纯水替代样品,记作空白组Ab,清除率按公式(1)计算。
1.3.4 超滤分级
蛋清粗肽依次通过截留分子质量为50、10、3 kDa的50 mL超滤离心管,4 000×g离心20 min,收集各膜管截留液和滤过液,得到截留分子质量大于50 kDa(UF-1)、10~50 kDa(UF-2)、3~10 kDa(UF-3)及<3 kDa组分(UF-4),冻干后测定各组分得率及抗氧化活性。
1.3.5 中压柱层析分离
扫描超滤样品最大吸收峰作为洗脱液检测波长,将处理好的Sephadex LH-20装填至600 mm×20 mm中压层析柱,配制样品浓度200 mg/mL,0.22 μm滤膜过滤,以流速为0.5 mL/min的超纯水作为洗脱液,检测波长226 nm,每5 min收集1管,收集各洗脱组分冻干,测定各组分体外自由基清除能力。
1.3.6 抗氧化肽纯度测定
HPLC色谱条件:Waters C18柱(250 mm×4.6 mm,5 μm);流动相A为纯水(含体积分数为0.05%三氟乙酸溶液),流动相B乙腈溶液(含体积分数为0.05%三氟乙酸溶液);梯度洗脱条件:0~5 min,0%~2% B;5~45 min,2%~25% B;45~50 min,25%~50% B;50~55 min,50%~100% B;55~60 min,100%~2% B;柱温30 ℃,进样量10 μL,流速1 mL/min;检测波长220 nm。
1.3.7 抗氧化肽结构测定
质谱条件[15]:电喷雾电离源,正离子模式,质核比扫描范围50~1 000,气流温度350 ℃,干燥气体流速9 L/min,雾化器压力0.28 MPa,毛细管电压4 000 V,裂解电压150 kV,锥孔电压40 V。
1.4 统计分析
图表绘制采用Origin 9.0软件完成,数据采用SPSS 25.0进行ANOVA分析,差异性显著采用Ducan多重比较检验,结果以平均值±标准差表示。
2 结果与讨论
2.1 蛋白酶的筛选
不同蛋白酶水解产物对DPPH自由基的清除能力如图1所示,酸性蛋白酶水解所得水解液对DPPH自由基清除率最高,达83.24%,显著优于其他蛋白酶(P<0.05),蛋白肽的生物活性与其分子质量、氨基酸组成和序列密切相关,酸性蛋白酶其标志性活性位点基序Asp-Thr-Gly[16],天冬氨酸对肽的抗氧化活性起到重要作用[17]。酸性蛋白酶的DH略低于木瓜蛋白酶,指数较高仅表明短肽含量越高[5],有研究表明多肽的水解度和抗氧化能力相关性不高[18],即与清除自由基能力无直接关系。因此,选取酸性蛋白酶进行后续实验。

图1 不同蛋白酶水解产物的自由基清除率和水解度
Fig.1 DPPH scavenging activity and DH of hydrolyzed products of different proteases
注:同一内容下不同字母表示差异显著(P<0.05)。
2.2 酶解条件的确定及优化
酶解温度对DPPH自由基清除能力的影响较明显(图2-a),DPPH自由基清除率在温度达45 ℃时达到最大值,不同蛋白酶的最适温度不同,温度过低或过高均会影响蛋白酶活性。DPPH自由基清除率在底物质量浓度30 g/L时达到最大值,随浓度的增加,清除率趋于平稳(图2-b)。DH随底物浓度升高先略有上升后下降,可能是当浓度较低时,酶与底物结合几率大,DH高;随着浓度继续增加,酶与底物碰撞几率降低,DH降低。当质量浓度为30 g/L时DH最大,说明适当增加底物浓度有利于水解反应而获得DPPH自由基清除率较高的肽。在图2-c中,底物浓度一定时,随着酶添加量的增加,可溶性短肽比例增加,自由基清除能力上升。添加量在1.5×104 U/g后上升趋势变缓,且在酶添加达到2×104 U/g时清除率高于90%,考虑到蛋白酶成本,不再继续提高酶添加量。DPPH自由基清除率和DH有相似的趋势,均随时间增加先上升,随后在4 h后趋于稳定(图2-d)。因此,在最适酶解温度45 ℃下,选取底物质量浓度为(10、30、50 g/L)、酶添加量(1×104、1.5×104、2×104 U/g)、酶解时间(2、4、6 h)进行酶解条件优化。
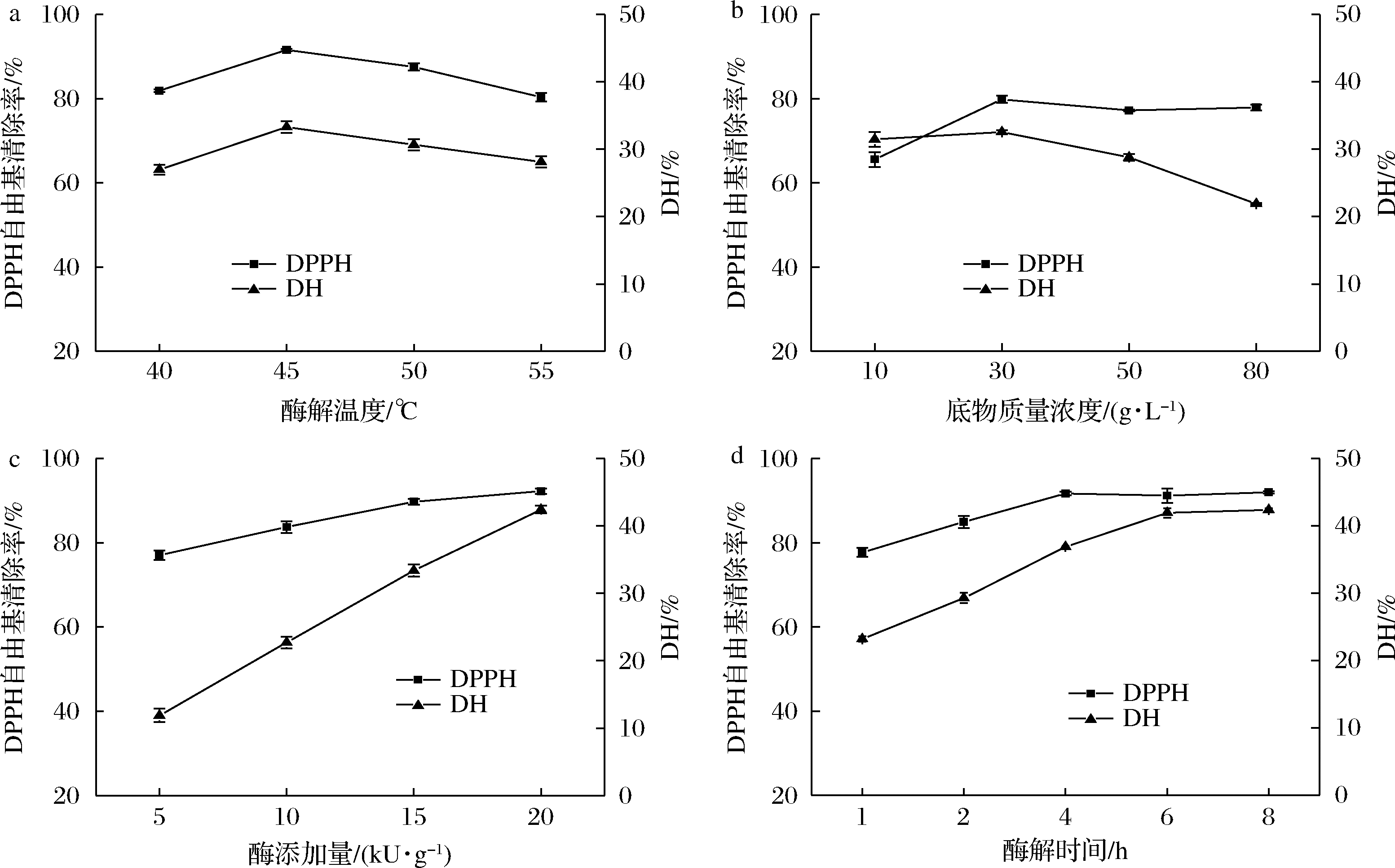
a-酶解温度;b-底物浓度;c-酶添加量;d-酶解时间
图2 水解条件对水解产物DPPH自由基清除率和DH的影响
Fig.2 Effects of hydrolysis conditions on DPPH scavenging activity and DH of hydrolysate
正交试验设计及结果见表1,不同指标下最优组合不同,DPPH自由基清除率各因素水平的最优组合为A2B3C3,DH因素水平的最优组合为A3B3C1。但本实验以制备抗氧化肽为主要目的,因此选取A2B3C3为最优组合,即底物质量浓度30 g/L、酶添加量2×104 U/g、酶解时间6 h,在此条件下进行验证,所得产物的DPPH自由基清除率为(94.23±0.89)%,DH为33.52%。
表1 正交试验设计及结果
Table 1 Orthogonal experimental design and results
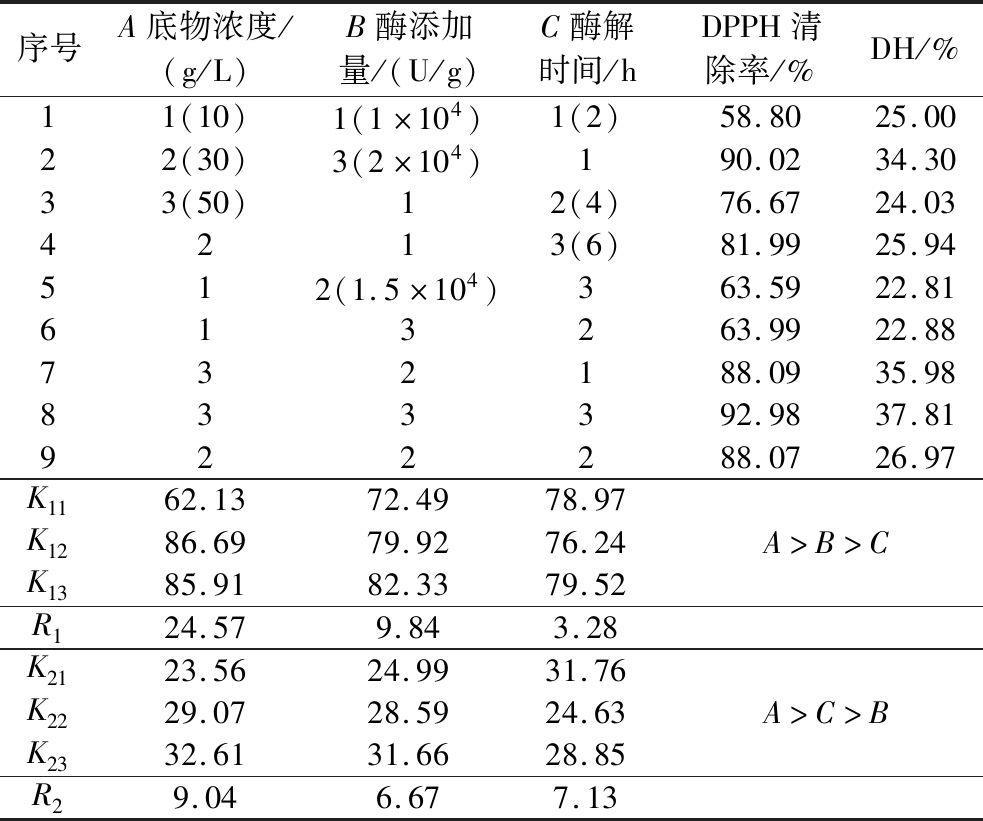
序号A底物浓度/(g/L)B酶添加量/(U/g)C酶解时间/hDPPH清除率/%DH/%11(10)1(1×104)1(2)58.8025.0022(30)
2.3 超滤分级
活性肽中不同氨基酸可以利用单电子转移(single electron transfer,SET)和氢电子转移(hydrogen atom transfer,HAT)机制猝灭自由基[19]。超滤4个组分分子质量范围、保留率及对3种不同自由基的IC50见表2。分级对水解产物的抗氧化性能有明显的影响,其中UF-4对DPPH、PTIO、ABTS 3种自由基能力显著高于UF-1、UF-2、UF-3和未分级的水解液(P<0.05)。UF-4的保留率达48.57%,分子质量小于3 kDa,表明酶解蛋清所得抗氧化活性肽多以小分子质量肽为主,且有研究证实,抗氧化活性的肽分子质量一般在1~2 kDa或更小[20]。综上,选用UF-4继续分离纯化。
表2 超滤分级组分抗氧化活性(n=3)
Table 2 Antioxidant activity of ultrafiltration fractional components (n=3)
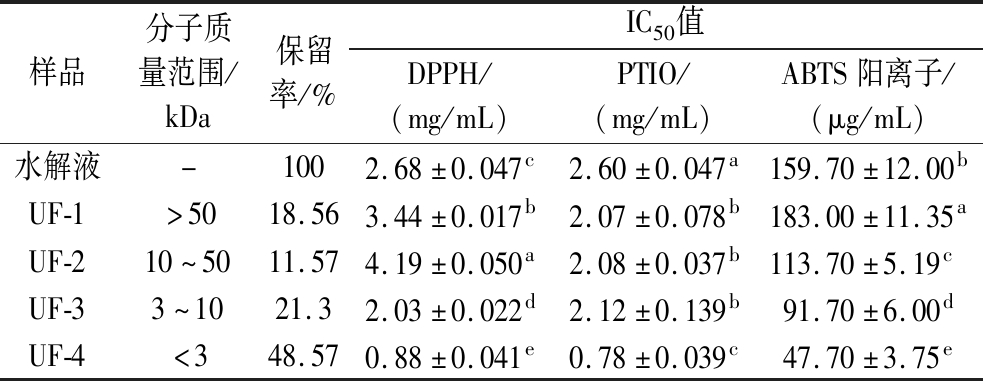
样品分子质量范围/kDa保留率/%IC50值DPPH/(mg/mL)PTIO/(mg/mL)ABTS阳离子/(μg/mL)水解液-1002.68±0.047c2.60±0.047a159.70±12.00bUF-1>5018.563.44±0.017b2.07±0.078b183.00±11.35aUF-210~5011.574.19±0.050a2.08±0.037b113.70±5.19cUF-33~1021.32.03±0.022d2.12±0.139b91.70±6.00dUF-4<348.570.88±0.041e0.78±0.039c47.70±3.75e
注:列肩标不同字母表示差异显著(P<0.05)(下同)。
2.4 中压柱层析分离纯化
UF-4在226 nm处有最大吸收峰,作为检测波长。SephadexLH-20具有凝胶过滤与反向分配作用(超纯水洗脱),在压力与重力的作用下,根据分子质量大小将不同组分分离。UF-4经中压柱层析纯化获得的UF-41、UF-42、UF-43和UF-44四个组分(图3),对不同自由基清除能力的IC50见表3。各组分对DPPH自由基清除力均优于分离前的UF-4;UF-43的PTIO自由基和ABTS阳离子自由基清除力优于UF-41、UF-42和UF-44,且有显著性差异(P<0.05)。不同自由基的原理不同,在进行抗氧化活性测定时可能存在不同的最优结果[21],同一种抗氧化肽在不同方法下得到结果相关性不高[22]。综合来看,UF-43对3种自由基清除的IC50均低于分离前的超滤样品UF-4(<3 kDa组分),呈现优异的清除自由基活性。
表3 中压柱层析分离UF-4组分的抗氧化活性(n=3)
Table 3 Antioxidant activity of UF-4 components separated by medium pressure column chromatography (n=3)
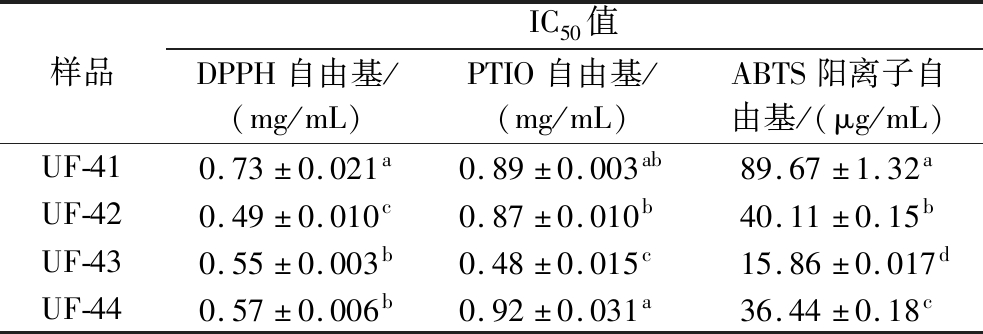
样品IC50值DPPH自由基/(mg/mL)PTIO自由基/(mg/mL)ABTS阳离子自由基/(μg/mL)UF-410.73±0.021a0.89±0.003ab89.67±1.32aUF-420.49±0.010c0.87±0.010b40.11±0.15bUF-430.55±0.003b0.48±0.015c15.86±0.017dUF-440.57±0.006b0.92±0.031a36.44±0.18c
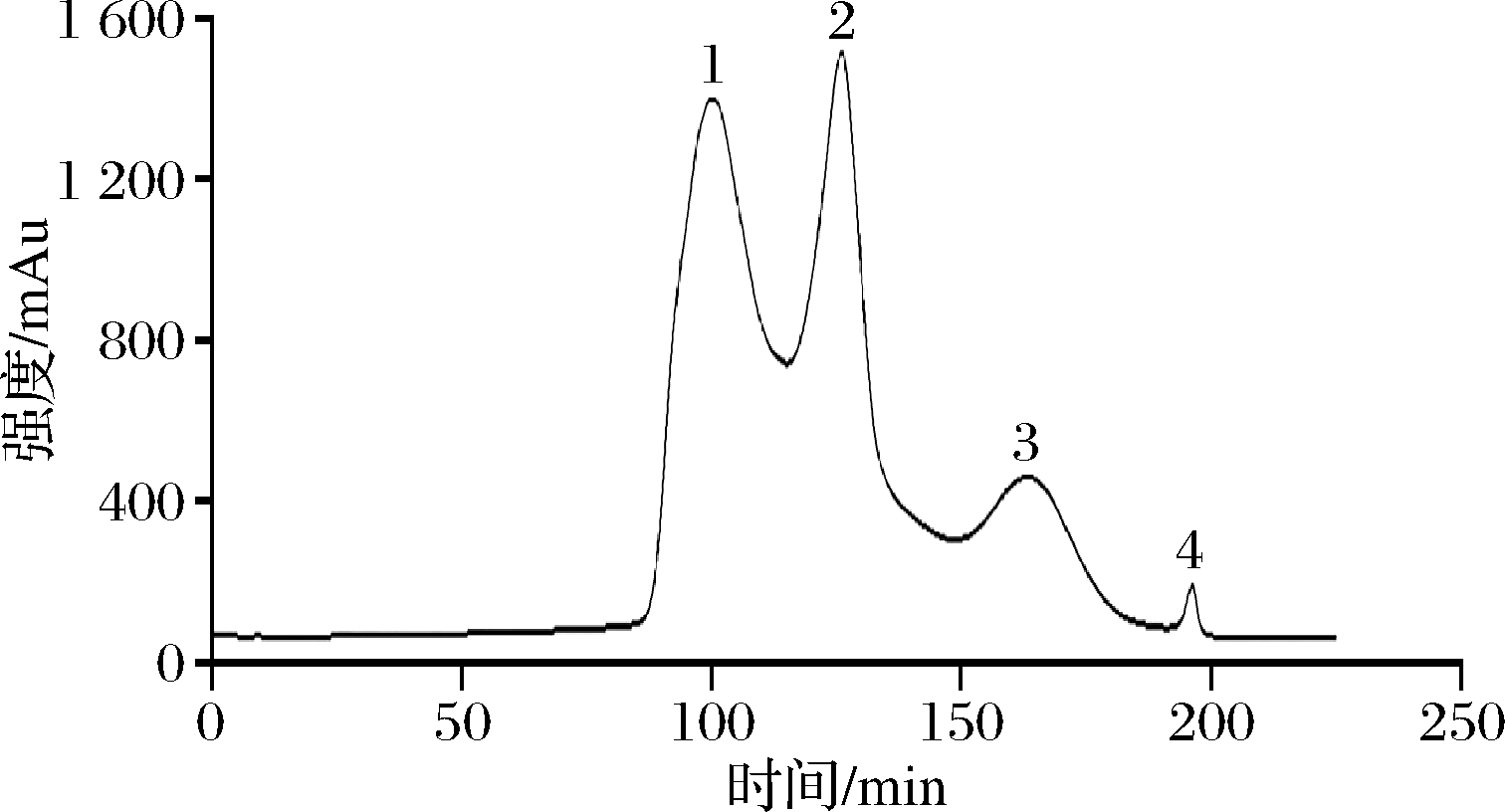
图3 中压柱层析分离纯化
Fig.3 Purification by medium pressure column chromatography
2.5 样品纯度
制备并收集最优组分UF-43。采用分析型反向高效液相色谱进行纯度检测,图4为UF-43的高效液相图,经凝胶纯化后,各物质因分子排阻,分子质量不同大多数物质被分离。液相图中可得较明显的单峰,经计算该峰的峰面积中达91.97%,纯度较高。
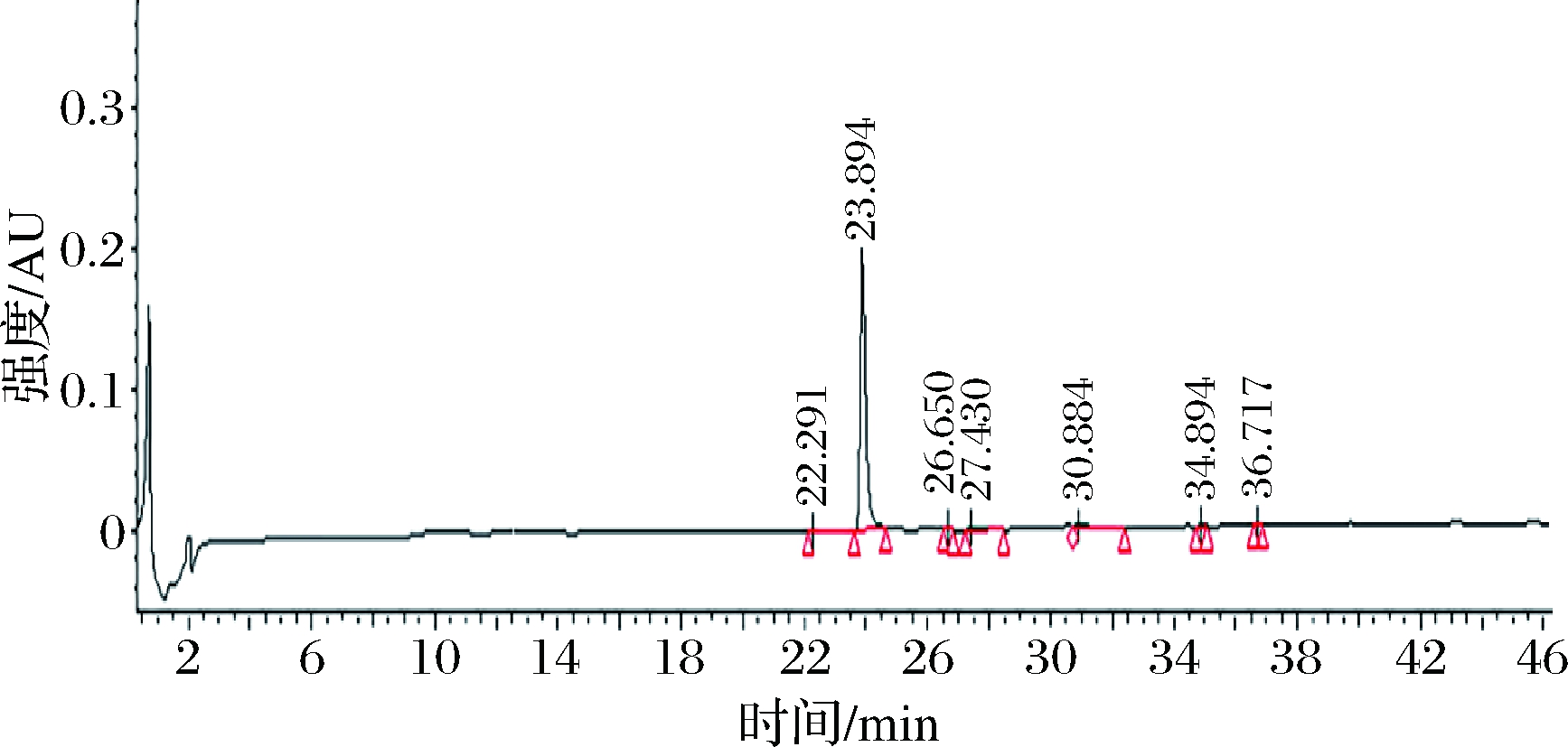
图4 UF-43反相高效液相色谱图
Fig.4 Reversed phase high performance liquid chromatography of UF-43
2.6 质谱鉴定
根据二级质谱图中的信号峰相对丰度、质荷比,以及碎片离子峰间相对分子质量之差为一个氨基酸残基相对分子质量[23],样品UF-43的LC-MS/MS质谱图(图5)显示,分子离子峰为[M]+ 409.18 m/z ([M]+),3个碎片离子峰分别为262 m/z ([M-147]+)、205 m/z ([M-147-57]+)、118 m/z ([M-147-57-87]+),即分别为该肽段碎片离子依次丢失苯丙氨酸残基(Ph—(—NH)—CH—CO—)、丢失甘氨酸残基(—NH—CH2—CO—)、再丢失丝氨酸残基(—NH—CH (—CH2—OH)—CO—)。碎片离子峰118 m/z是缬氨酸Val,所得结果再手动计算确认。初步推断整个多肽序列为Phe-Gly-Ser-Val (PGSV),即苯丙氨酸-甘氨酸-丝氨酸-缬氨酸,肽段分子质量为408 Da。205 m/z、118 m/z ([M-87]+)碎片离子峰与XUE等[24]从鸡胚胎蛋白中分离出的抗氧化肽SV一致。
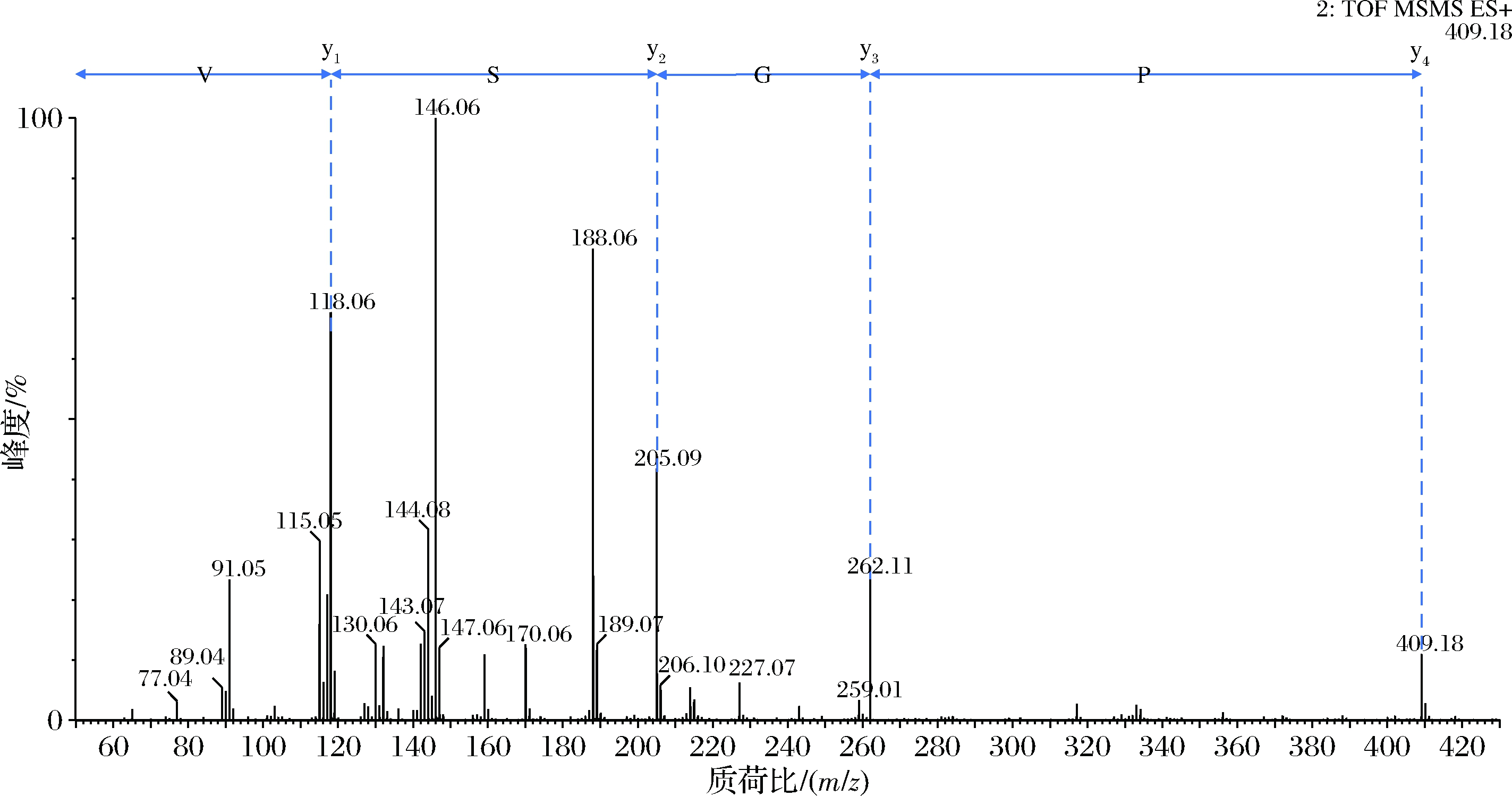
图5 UF-43的二级质谱图
Fig.5 Secondary mass spectrometry of UF-43
3 结论
本研究在6种常用蛋白酶中筛选出酸性蛋白酶,确定了水解条件为酶解温度45 ℃、底物质量浓度为30 g/L、酶添加量2×104 U/g、酶解时间6 h。该条件下所得具备抗氧化活性的粗肽依次通过超滤与中压柱层析进行分离纯化,得到目标蛋白肽较未经分离的粗肽抗氧化活性提高约5倍。得到活性肽氨基酸序列为Phe-Gly-Ser-Val (PGSV),样品纯度大于90%,分子质量为408 Da。因此,在制备咸鸭蛋清抗氧化活性肽时,可选择超滤联用中压柱层析对其活性组分进行分级和纯化,为咸鸭蛋清抗氧化活性肽的生产和综合利用提供一定的参考。
[1] 周冰.咸鸭蛋清的脱盐、特性及应用研究[D].无锡:江南大学,2015.
ZHOU B.Studies on the desalination,characteristics and application of salted duck egg white[D].Wuxi:Jiangnan University,2015.
[2] XIAO N H,HUANG X,HE W,et al.A review on recent advances of egg byproducts:Preparation,functional properties,biological activities and food applications[J].Food Research International,2021,147:110563.
[3] VENKATACHALAM K.Influence of prolonged salting on the physicochemical properties of duck egg white[J].Brazilian Archives of Biology and Technology,2018,61:e18180134.
[4] ZHENG J X,BU T T,LIU L,et al.Naturally occurring low molecular peptides identified in egg white show antioxidant activity[J].Food Research International,2020,138:109766.
[5] 金嫘,王晶,李新华.Alcalase碱性蛋白酶酶解蛋清制备抗氧化活性肽[J].食品研究与开发,2009,30(6):59-62.
JIN L,WANG J,LI X H.Study on the anti-oxidative activity of peptide from egg white hydrolysised by alcalase[J].Food Research and Development,2009,30(6):59-62.
[6] 梅辉,王海滨.酶解鸭蛋清制备抗氧化肽的研究[J].食品科技,2013,38(8):113-117;122.
MEI H,WANG H B.Preparation on antioxidant peptides from duck egg white by proteases[J].Food Science and Technology,2013,38(8):113-117;122.
[7] NIMALARATNE C,BANDARA N,WU J P.Purification and characterization of antioxidant peptides from enzymatically hydrolyzed chicken egg white[J].Food Chemistry,2015,188:467-472.
[8] ZHANG B Y,WANG H Y,WANG Y,et al.Identification of antioxidant peptides derived from egg-white protein and its protective effects on H2O2-induced cell damage[J].International Journal of Food Science &Technology,2019,54(6):2219-2227.
[9] 周婧.高纯度蛋黄卵磷脂的制备工艺[D].北京:北京化工大学,2011.
ZHOU J.The preparation approach of high purity egg yolk phosphatidylcholine[D].Beijing:Beijing University of Chemical Technology,2011
[10] 朱玉婷,李茂星,王建,等.中压柱层析快速分离纯化肉苁蓉提取物中的松果菊苷和毛蕊花苷[J].解放军药学学报,2018,34(6):491-493.
ZHU Y T,LI M X,WANG J,et al.Rapid separation and purification of echinacoside and verbascoside from Cistanche extract by medium pressure column chromatography[J].China Industrial Economics,2018,34(6):491-493.
[11] 李皖光,汪桃花,王新文,等.4种大米蛋白水解度测定方法比较[J].粮食科技与经济,2017,42(5):35-37.
LI W G,WANG T H,WANG X W,et al.The comparison of four methods in testing degree of hydrolysis[J].Grain Science and Technology and Economy,2017,42(5):35-37.
[12] LI X C.Comparative Study of 1,1-diphenyl-2-picryl-hydrazyl radical scavenging capacity of the antioxidant xanthones family[J].ChemistrySelect,2018,3(46):13081-13086.
[13] LI X C,OUYANG X J,CAI R X,et al.3′,8″-dimerization enhances the antioxidant capacity of flavonoids:Evidence from acacetin and isoginkgetin[J].Molecules (Basel,Switzerland),2019,24(11):2039.
[14] 王钦波,王晓东.PTIO自由基清除分析法的PH值效应与黄芩素及黄芩苷的构效分析[J].现代医院,2019,19(1):145-148;153.
WANG Q B,WANG X D.pH effect of PTIO free radical scavenging analysis and structure-activity analysis between Ba-icalein and baicalin[J].Modern Hospitals,2019,19(1):145-148;153.
[15] 陈宁,孙一,刘淑莹.核桃蛋白酶解物的制备及抗氧化活性[J].高等学校化学学报,2013,34(1):72-76.
CHEN N,SUN Y,LIU S Y.Preparation and antioxidant activities of walnut protein hydrolysates[J].Chemical Journal of Chinese Universities,2013,34(1):72-76.
[16] 史丹.酸性蛋白酶的表达及其在大豆蛋白和虾壳酶解中的应用研究[D].广州:华南理工大学,2020.
SHI D.Expression of aspartic proteases and their application in soybean protein and shrimp shell hydrolysis[D].Guangzhou:South China University of Technology,2020.
[17] 张强,李伟华.抗氧化肽的研究现状[J].食品与发酵工业,2021,47(2):298-304.
ZHANG Q,LI W H.Research progress of antioxidant peptides[J].Food and Fermentation Industries,2021,47(2):298-304.
[18] LIU X W,JIANG D S,PETERSON D G.Identification of bitter peptides in whey protein hydrolysate[J].Journal of Agricultural and Food Chemistry,2014,62(25):5719-5725.
[19] ASHAOLU T J.Antioxidative peptides derived from plants for human nutrition:Their production,mechanisms and applications[J].European Food Research and Technology,2020,246(5):853-865.
[20] 黄明,王璐莎.动物蛋白源抗氧化肽的研究进展[J].中国农业科学,2013,46(22):4763-4773.
HUANG M,WANG L S.A review of the antioxidant peptides derived from animal protein[J].Scientia Agricultura Sinica,2013,46(22):4763-4773.
[21] 高涵.常用测定抗氧化肽活性方法的比较[D].保定:河北农业大学,2019.
GAO H.Comparison of commonly used methods for measuring antioxidant peptide activity[D].Baoding:Hebei Agricultural University,2019.
[22] YOU S J,UDENIGWE C C,ALUKO R E,et al.Multifunctional peptides from egg white lysozyme[J].Food Research International,2010,43(3):848-855.
[23] 李亚会,李积华,吉宏武,等.远东拟沙丁鱼抗氧化肽的分离纯化及结构解析[J].中国食品学报,2021,21(2):229-238.
LI Y H,LI J H,JI H W,et al.Isolation,purification and structural analysis of antioxidant peptides from Sardinops sagax[J].Journal of Chinese Institute of Food Science and Technology,2021,21(2):229-238.
[24] XUE H,WANG J J,XIE J Y,et al.Isolation,purification,and structure identification of antioxidant peptides from embryonated eggs[J].Poultry Science,2019,98(6):2360-2370.