青钱柳(Cyclocarya paliurus),别名青钱李,胡桃科青钱柳属落叶乔木,广泛分布于两湖、两广及云贵川等地区[1],2013年国家卫计委公布“青钱柳叶”为新资源食品,进一步推动了对青钱柳的研究与开发。青钱柳叶含有多糖、黄酮、三萜等次生代谢产物[2-3],具有降血糖、降血脂、抗氧化、抗炎等生物活性[2-5]。
LIU等[6]研究发现青钱柳醇提物中总黄酮含量较高,具有显著的降血糖活性;王胤康等[7]建立IRHepG2细胞模型,比较模型组与实验组间ΔGC与ΔGC/OD,提示青钱柳多糖与青钱柳黄酮均能够抑制α-葡萄糖苷酶活性;李燕等[8]报道青钱柳叶水提物可促进胰岛RIN-m5F细胞增殖、降低2型糖尿病小鼠的血糖水平;秦帅等[9]研究发现青钱柳水提物可降低db/db小鼠空腹血糖(fasting blood glucose,FBG)、血清总胆固醇(serum total cholesterol,TC)、游离脂肪酸(free fatty acid,FFA)、空腹胰岛素(fasting insulin,FINS)及胰岛抵抗指数,增加肝糖原含量,抑制糖异生。
青钱柳叶醇提物、水提物都有降血糖活性,醇提物中活性成分为黄酮,水提物活性成分为多糖。青钱柳多糖降血糖的研究大都利用的是水提醇沉的粗多糖[6,8-10],针对其进一步的分离鉴定未见报道。本实验以青钱柳叶为原料提取青钱柳多糖,分离并筛选出一个降血糖多糖CPP-1,并通过动物实验,评价其降血糖作用。为青钱柳新产品的研究和开发提供理论依据。
1 材料与方法
1.1 实验动物
SPF级4周龄雄性ICR小鼠,体重18~22 g,由北京维通利华实验动物技术有限公司提供。小鼠饲养于江南大学实验动物中心[许可证编号:SYXK(苏)2021-0056],饲养温度(22±2)℃,相对湿度40%~70%。饲料组成为粗纤维29 g/kg、粗蛋白质201.8 g/kg、粗脂肪42 g/kg、水分98 g/kg、粗灰分60 g/kg、总磷7.1 g/kg和钙11.8 g/kg,由江苏省协同医药生物工程有限公司提供。动物实验由江南大学实验动物伦理委员会审议通过,审批编号JN.No20210430i0800720[107],JN.No20210915i1201125[293]。
1.2 材料与试剂
青钱柳叶购于江西修水。
DEAE-纤维素柱、HW-55F凝胶柱,日本TOSOH公司;Sephacryl S400凝胶柱,美国GE公司。
链脲佐菌素(streptozotocin,STZ),Sigma-Aldrich化学有限公司;二甲双胍,中石化药业集团有限公司;糖化血红蛋白(glycosylated hemoglobin,HbA1c)试剂盒,上海酶联生物科技有限公司;其他试剂均为国产分析纯。
1.3 仪器与设备
RAT-100型萃取罐,无锡申科仪器有限公司;SYB106-100型恒流泵,天津市科器高新技术公司;罗氏卓越金采血糖仪及试纸,罗氏诊断产品上海有限公司;核磁共振仪,Avance 500 MHz,德国Bruker公司。
1.4 实验方法
1.4.1 青钱柳粗多糖的制备与粗分离
称取青钱柳叶10 kg粉碎后过40目筛,加入提取罐中与水以1∶10(g∶mL)料液比混合,60 ℃、150 r/min搅拌提取3 h,过滤,收集滤液,滤渣再次提取,合并两次滤液,减压浓缩至合适体积,边搅拌边加入3倍体积的无水乙醇,静置12 h后离心,沉淀以75%乙醇洗涤3次,干燥,得青钱柳粗多糖A,于-25 ℃保存。
取适量青钱柳粗多糖A用去离子水溶解,配置成浓度适当的溶液,上样至DEAE-纤维素柱,以去离子水、0.1、0.3、0.5、1.0 mol/L NaCl溶液为洗脱液进行梯度洗脱,流速5 mL/min,自动收集器收集洗脱液,每管10 mL,采用苯酚-硫酸法跟踪监测多糖浓度,以管数为横坐标(x),吸光度为纵坐标(y)绘制多糖分级流出的洗脱曲线[11],根据洗脱曲线合并洗脱液,减压浓缩至合适体积,得到水洗脱样品B和盐洗脱样品C。
1.4.2 青钱柳粗多糖降血糖活性研究
1.4.2.1 动物模型的建立和分组处理
小鼠适应性饲养7 d,第8天禁食不禁水12 h,随机选取50只小鼠腹腔注射150 mg/kg的STZ溶液(0.1 mol/L、pH 4.5的柠檬酸缓冲液以10 mg/mL的溶解度溶解STZ,现用现配),剩余10只作为正常对照组(NC组)腹腔注射等剂量柠檬酸缓冲溶液。腹腔注射72 h后禁食不禁水12 h,尾静脉采血测定FBG含量,FBG>11.1 mmol/L即为造模成功[12-14]。
将糖尿病小鼠按照体重和血糖浓度随机分为糖尿病模型组(DC组)、二甲双胍阳性对照组(PC组)、实验组(A、B、C),每组10只小鼠。实验组A、B、C分别灌胃500 mg/kg青钱柳粗多糖A[10]、300 mg/kg样品B、300 mg/kg样品C,PC组灌胃150 mg/kg二甲双胍[15],NC组与DC组灌胃饮用水,各组小鼠每日灌胃1次,灌胃体积为0.1 mL/kg,共灌胃30 d。
1.4.2.2 空腹血糖监测
每周同一时间尾静脉采血测定小鼠FBG[16]。
1.4.2.3 口服葡萄糖耐量实验
实验结束前4 d进行小鼠葡萄糖耐量实验(oral glucose tolerance test,OGTT)[16-17]:小鼠禁食不禁水12 h后给予2 g/kg葡萄糖,分别于0、0.5、1、2 h尾静脉采血测血糖,以血糖曲线下面积(area under the curve,AUC)表示OGTT结果,AUC计算如公式(1)所示:
(1)
式中:bg0、bg0.5、bg1、bg2分别代表给予葡萄糖后0、0.5、1、2 h后的血糖值,mmol/L。
1.4.3 样品B的分离
将样品B上样至HW-55F凝胶柱[18],去离子水以5 mL/min流速洗脱,自动收集器收集洗脱液,每管10 mL,采用苯酚-硫酸法跟踪监测多糖浓度,并绘制洗脱曲线。根据洗脱曲线合并洗脱液,减压浓缩至合适体积,干燥后得到B-1与B-2两组样品。
将B-1与B-2分别上样至Sephacryl S400凝胶柱,去离子水以3 mL/min流速洗脱,自动收集器收集洗脱液,每管10 mL,采用苯酚-硫酸法跟踪监测多糖浓度,反复上样进行纯化,根据洗脱曲线分别合并洗脱液,得到多糖CPP-1与CPP-2。
1.4.4 多糖CPP-1与CPP-2降血糖活性研究
1.4.4.1 动物实验造模及分组处理
采用1.4.2.1中方法进行造模。动物分组包括空白对照组(NC组)、糖尿病模型组(DC组)、二甲双胍阳性对照组(PC组)、多糖1组(CPP-1组)、多糖2组(CPP-2组),每组10只小鼠。PC组灌胃150 mg/kg二甲双胍,CPP-1组、CPP-2组分别灌胃200 mg/kg CPP-1、CPP-2,NC组与DC组灌胃饮用水。各组小鼠每日灌胃1次,灌胃体积为0.1 mL/kg,共灌胃30 d。
1.4.4.2 体重、摄食摄水量及空腹血糖监测
于造模前、造模后、灌胃第10天、第20天、第30天记录小鼠体重,每天同一时间记录水和食物的摄入量,每周同一时间尾静脉采血测定小鼠FBG。
1.4.4.3 糖化血红蛋白测定
灌胃第30天,所有小鼠禁食不禁水12 h过夜,次日麻醉后摘眼球取血,于抗凝管中保存,按照试剂盒说明书测定糖化血红蛋白。
1.4.4.4 口服葡萄糖耐量实验
糖耐量实验方法及AUC计算同1.4.2.3。
1.4.5 多糖CPP-1的结构鉴定
取样品适量经重水交换3次后,溶解于重水中,进行1H-NMR、13C-NMR、13DEPT-NRM波谱分析。
1.5 数据处理与分析
采用SPSS 22.0软件进行统计学分析,所有数据均采用单因素方差分析(One Way ANOVA),试验数据以“平均值±标准差![]() 表示,其中P<0.05表示存在统计学差异,P<0.01表示存在显著性差异。
表示,其中P<0.05表示存在统计学差异,P<0.01表示存在显著性差异。
2 结果与分析
2.1 DEAE-纤维素柱分离结果
如图1所示,水洗脱部分峰面积大,盐洗脱部分存在多个洗脱峰但各峰面积都较小,故推测青钱柳粗多糖A主要成分存在于水洗脱部位。根据洗脱曲线,将水洗脱部分、所有盐洗脱部分分别合并得到样品B与样品C。

图1 DEAE-纤维素柱洗脱曲线
Fig.1 Elution curve of DEAE-cellulose gel column
2.2 青钱柳粗多糖降血糖活性
2.2.1 对糖尿病小鼠空腹血糖的影响
如图2-a所示,与NC组相比,所有糖尿病小鼠空腹血糖均显著提高(P<0.01),表明糖尿病小鼠模型造模成功。灌胃7 d后DC组及实验组空腹血糖仍持续上升,而PC组空腹血糖维持在灌胃前水平。灌胃14 d后PC组空腹血糖较灌胃前明显下降(P<0.05),A组、B组空腹血糖下降至灌胃前水平,灌胃21 d后,PC组空腹血糖降至(17.95±3.7) mmol/L,较DC组存在显著性差异(P<0.01),A组、B组空腹血糖分别降至(23.05±1.91) 和(22.40±2.17) mmol/L,与DC组存在统计学差异(P<0.05)。灌胃30 d后,所有实验组空腹血糖均低于DC组,其中A、B组与DC组存在显著性差异(P<0.01),C组DC组存在统计学差异(P<0.05),这表明青钱柳粗多糖A具有显著的降血糖活性,经DEAE-纤维素柱洗脱后主要活性成分存在于水洗脱部位中。

a-对FBG的影响;b-对AUC的影响
图2 青钱柳粗多糖对糖尿病小鼠FBG、AUC的影响
Fig.2 Effect of crude polysaccharide of C. paliurus on FBG and AUC in diabetic mice
注:与DC组相比*P<0.05,**P<0.01,与NC组相比#P<0.05,##P<0.01(以下各图表相同)。
2.2.2 对糖尿病小鼠口服葡萄糖糖耐量的影响
青钱柳粗多糖对糖尿病小鼠OTGG的影响如表1所示,各组小鼠血糖值在口服葡萄糖后均显著上升,并在0.5 h时达到顶峰。NC组血糖值随后逐渐下降,2 h时恢复至正常水平,与NC组相比,所有糖尿病小鼠在各个时间段血糖值均更高(P<0.01)且在2 h时后仍未能恢复至正常水平,表明糖耐量受损。与DC组相比,PC组、A组、B组血糖峰值有所降低,且均在接下来的1.5 h内血糖值有明显的下降(P<0.05),平均血糖值较初始值下降分别为15.4%(PC),17.5%(A),18.2%(C)。图2-b表明所有糖尿病小鼠AUC较NC组均呈现极显著升高(P<0.01),PC组、A组、B组AUC较DC组显著下降(P<0.01)。
表1 青钱柳粗多糖对糖尿病小鼠OTGG的影响
Table 1 Effect of crude polysaccharide of C. paliurus on OTGG in diabetic mice
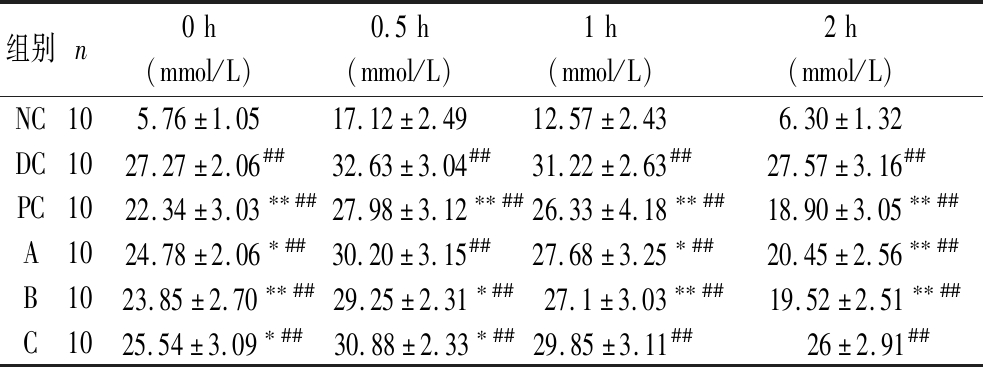
组别n0h(mmol/L)0.5h(mmol/L)1h(mmol/L)2h(mmol/L)NC105.76±1.0517.12±2.4912.57±2.436.30±1.32DC1027.27±2.06##32.63±3.04##31.22±2.63##27.57±3.16##PC1022.34±3.03∗∗##27.98±3.12∗∗##26.33±4.18∗∗##18.90±3.05∗∗##A1024.78±2.06∗##30.20±3.15##27.68±3.25∗##20.45±2.56∗∗##B10 23.85±2.70∗∗## 29.25±2.31∗## 27.1±3.03∗∗## 19.52±2.51∗∗##C10 25.54±3.09∗## 30.88±2.33∗## 29.85±3.11## 26±2.91##
2.3 样品B的分离结果
HW-55F凝胶柱洗脱曲线如图3所示,样品B经HW-55F分离后获得B-1、B-2两组样品,根据洗脱曲线的出峰顺序可知,B-1分子质量大于B-2。将上述两组样品分别经Sephacryl S400反复分离纯化,最终得到多糖CPP-1与多糖CPP-2,洗脱曲线如图4所示。多糖CPP-1、CPP-2洗脱曲线具有单一对称峰,表明多糖CPP-1、CPP-2为均一多糖。
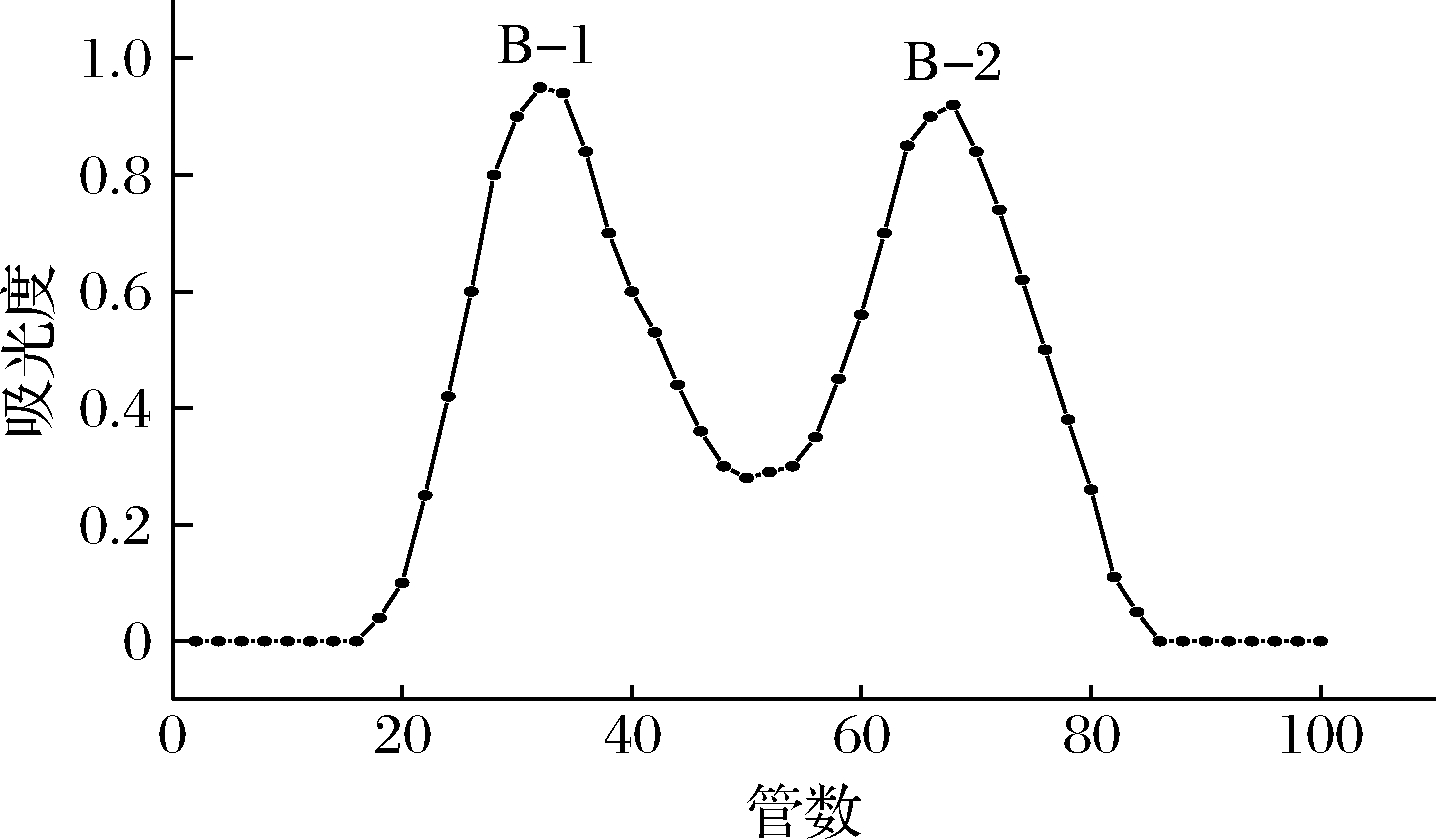
图3 HW-55F柱洗脱曲线
Fig.3 Elution curve of HW-55F column
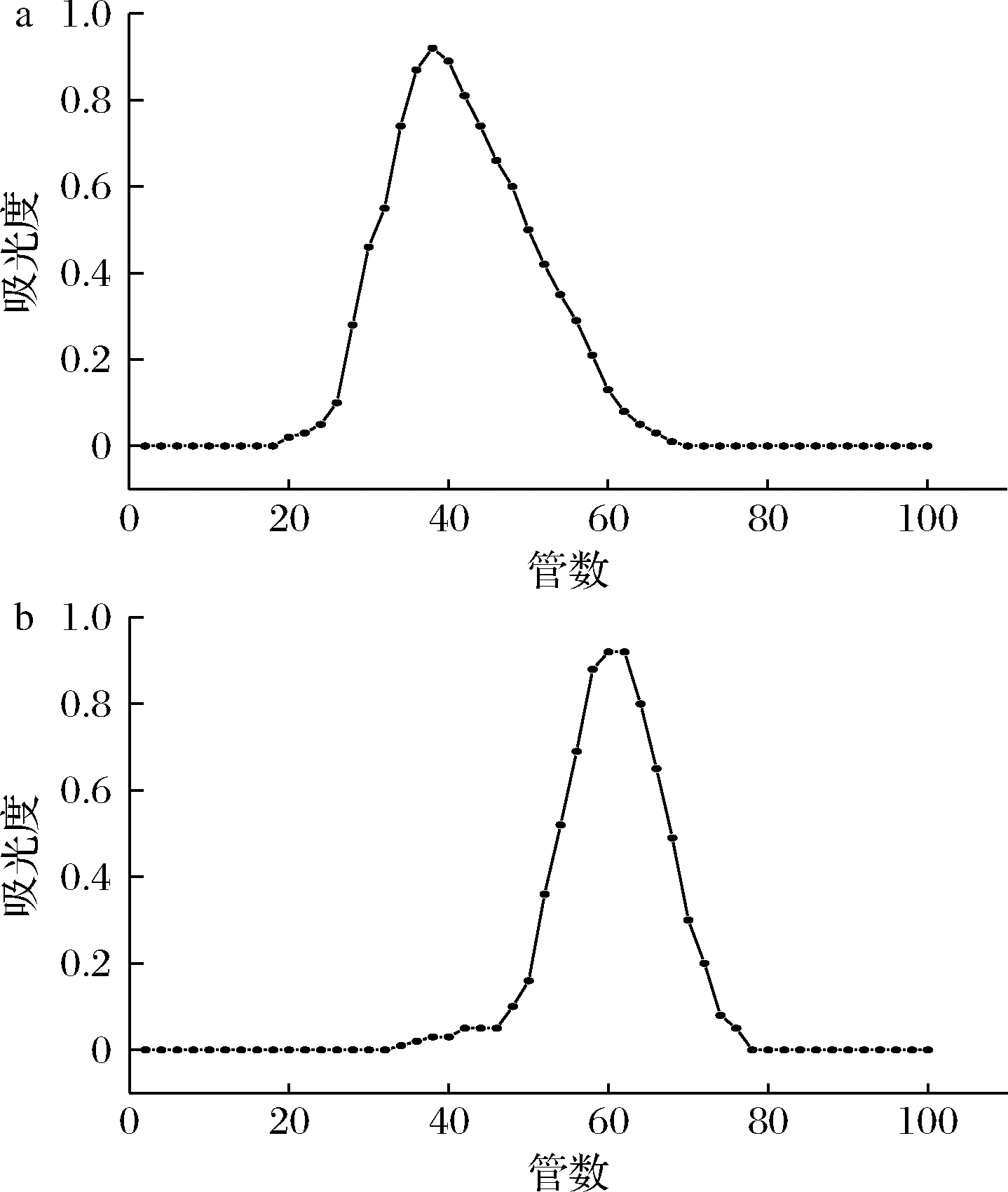
a-CPP-1;b-CPP-2
图4 Sephacryl S400凝胶树脂柱层析洗脱曲线
Fig.4 Elution curve of Sephacryl S400 column
2.4 多糖CPP-1与CPP-2降血糖活性
2.4.1 对糖尿病小鼠体重、水和食物摄取量的影响
CPP-1、CPP-2对糖尿病小鼠体重影响如图5所示。经STZ诱导后,所有造模小鼠体重较NC组均呈现显著的负增长(P<0.01)。灌胃30 d后,所有糖尿病小鼠体重均低于NC组小鼠,存在显著性差异(P<0.01),其中CPP-1组小鼠体重较PC组体重下降更小,存在显著性差异(P<0.01)。

图5 CPP-1,CPP-2对糖尿病小鼠体重影响
Fig.5 Effect of CPP-1、CPP-2 on boby weight in diabetic mice
糖尿病小鼠在高血糖状态下,会出现“多饮、多食”现象,因此通过比较不同组糖尿病小鼠“多饮、多食”症状的程度,可以初步推测小鼠糖尿病情况。各组小鼠水和食物摄取量如图6所示,经造模后糖尿病小鼠饮水量、摄食量显著增加(P<0.01),灌胃给药后,PC组、CPP-1组饮水量、摄食量表现出明显的下降趋势,灌胃30 d后,PC组、CPP-1组与DC组相比,饮水量、摄食量显著减少(P<0.01),这表明CPP-1能够显著改善糖尿病小鼠“多饮、多食”症状。
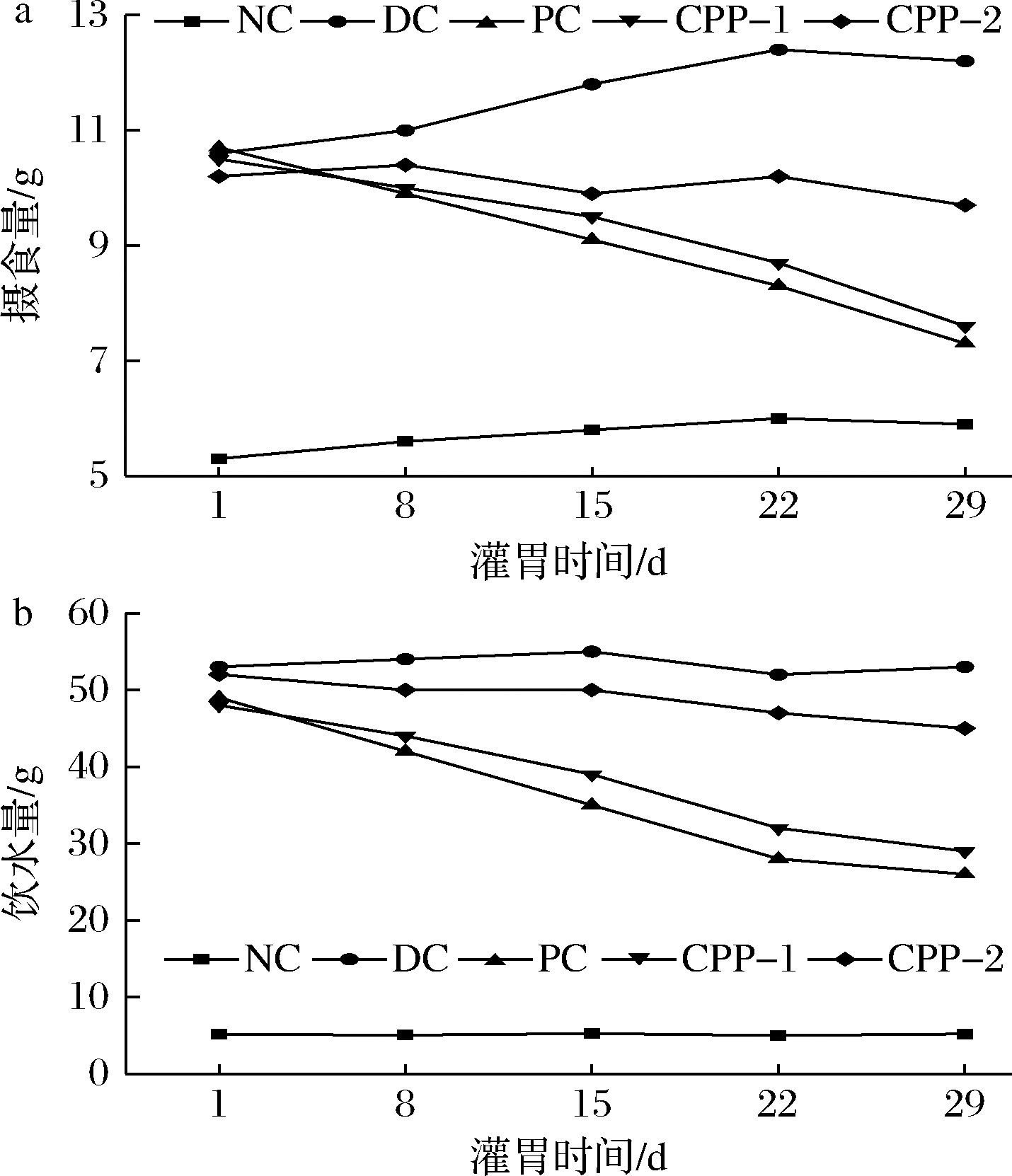
a-摄食量;b-饮水量
图6 CPP-1、CPP-2对糖尿病小鼠饮水量、摄食量的影响
Fig.6 Effect of CPP-1,CPP-2 on water intake,food intake in diabetic mice
2.4.2 对糖尿病小鼠空腹血糖及糖化血红蛋白的影响
CPP-1、CPP-2对糖尿病小鼠空腹血糖影响如图7-a所示,经STZ诱导后,所有造模小鼠空腹血糖均高于NC组(P<0.01),灌胃4周后,各给药组小鼠空腹血糖均低于DC组。PC组与CPP-1组小鼠空腹血糖表现出明显的下降趋势,在灌胃4周后两组小鼠空腹血糖均显著下降(P<0.01),血糖水平分别为(17±2.43)和(19.5±2.56) mmol/L,表明CPP-1具有显著的降血糖活性。CPP-2组小鼠在灌胃4周后血糖水平尽管低于DC组,但不存在显著性差异,表明CPP-2不具备显著的降血糖活性。

a-对FBG的影响;b-对HbA1c的影响;c-对AUC的影响
图7 CPP-1、CPP-2对糖尿病小鼠FBG、AUC、HbA1c的影响
Fig.7 Effect of CPP-1,CPP-2 on FBG,AUC,and HbA1c in diabetic mice
糖化血红蛋白测定结果如图7-b所示。PC组与CPP-1组小鼠糖化血红蛋白水平显著低于DC组小鼠(P<0.01),这表明CPP-1能够显著降低糖尿病小鼠较长时间内的平均血糖水平[19-21],这一结果与空腹血糖监测结果相一致,进一步证明了CPP-1的降血糖活性。CPP-2组小鼠糖化血红蛋白水平也低于DC组小鼠,但不具备显著性。
2.4.3 对糖尿病小鼠口服葡萄糖糖耐量的影响
CPP-1、CPP-2对糖尿病小鼠AUC的影响如图7-c所示,所有造模小鼠AUC面积均显著增加,其中,PC组、CPP-1组与DC组相比AUC显著降低(P<0.01),平均血糖较初始值下降分别为12.3%(PC),17.1%(CPP-1)表明其对小鼠的糖耐量有明显的改善作用,CPP-2组AUC也低于DC组(P<0.05),表明CPP-2对小鼠糖耐量有一定的改善作用。CPP-1、CPP-2对糖尿病小鼠OTGG的影响如表2所示,PC组与CPP-1组在各个时段血糖含量与DC组相比均产生了明显的减小趋势(P<0.01、P<0.05)。
表2 CPP-1、CPP-2对糖尿病小鼠OTGG的影响 单位:mmol/L
Table 2 Effect of CPP-1,CPP-2 on OTGG in diabetic mice
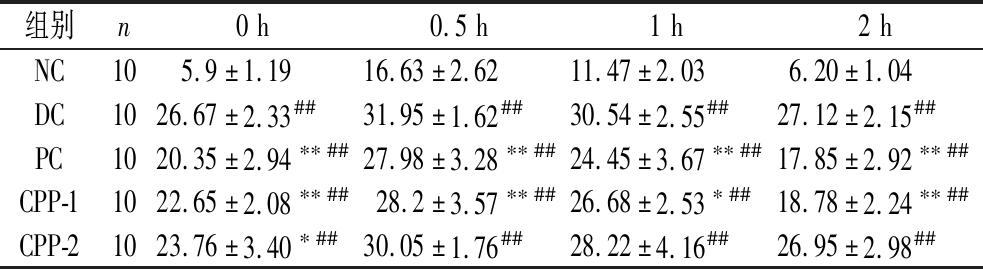
组别n0h0.5h1h2hNC105.9±1.1916.63±2.6211.47±2.036.20±1.04DC1026.67±2.33##31.95±1.62##30.54±2.55##27.12±2.15##PC1020.35±2.94∗∗##27.98±3.28∗∗##24.45±3.67∗∗##17.85±2.92∗∗##CPP-11022.65±2.08∗∗##28.2±3.57∗∗##26.68±2.53∗##18.78±2.24∗∗##CPP-21023.76±3.40∗##30.05±1.76##28.22±4.16##26.95±2.98##
2.5 多糖CPP-1的NMR分析
1H NMR图谱中δ5.61(1H,d,J=8.0),δ5.47(1H,d,J=7.5),δ5.34(1H,d,J=7.5)有3个H信号,应为糖的端基信号,从偶合常数看都为β构型。δ1.07(3H,t,J=6.5)有一个甲基信号。13C NMR图谱(图8)中δ176.1有一个羧基信号,表明存在糖醛酸的可能,δ107.0,105.9,102.4有3个糖的端基碳信号,表明化合物由3个糖残基组成,δ86.6,84.0,80.7有3个碳信号,δ85.5表明有1→3成键,δ82.8,80.3应为1→2成键。δ63.2,60.1两个CH2信号,其中δ63.2为糖的C6信号,而δ60.1的碳信号与δ19.5形成—CH2CH3结构。该多糖DEAE分离时由水洗脱,说明为中性多糖,判断δ176.2有一个羧基与—CH2CH3形成酯而呈中性,也就是说一部分糖的C6形成了糖醛酸酯。
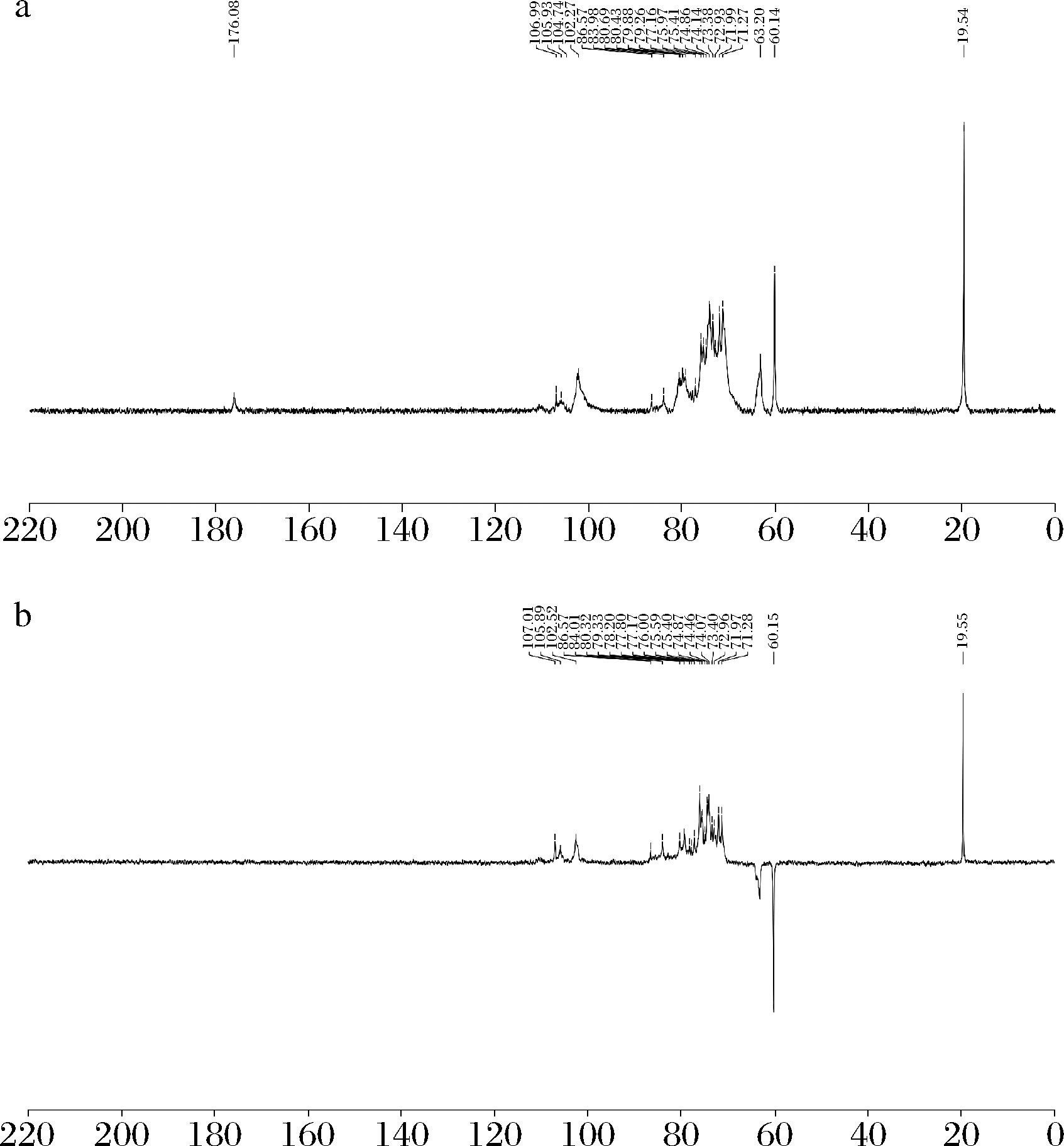
a-13C-NMR;b-13DEPT-NMR
图8 CPP-1的NMR谱图
Fig.8 NMR spectrum of CPP-1
从碳信号的丰度看δ82.8,80.3的1→2成键为主链,1→3为侧链,糖醛酸酯连接在侧链上,由于侧链的连接导致C2的化学位移向高场移动,因此初步推断多糖CPP-1的片段结构如图9所示。
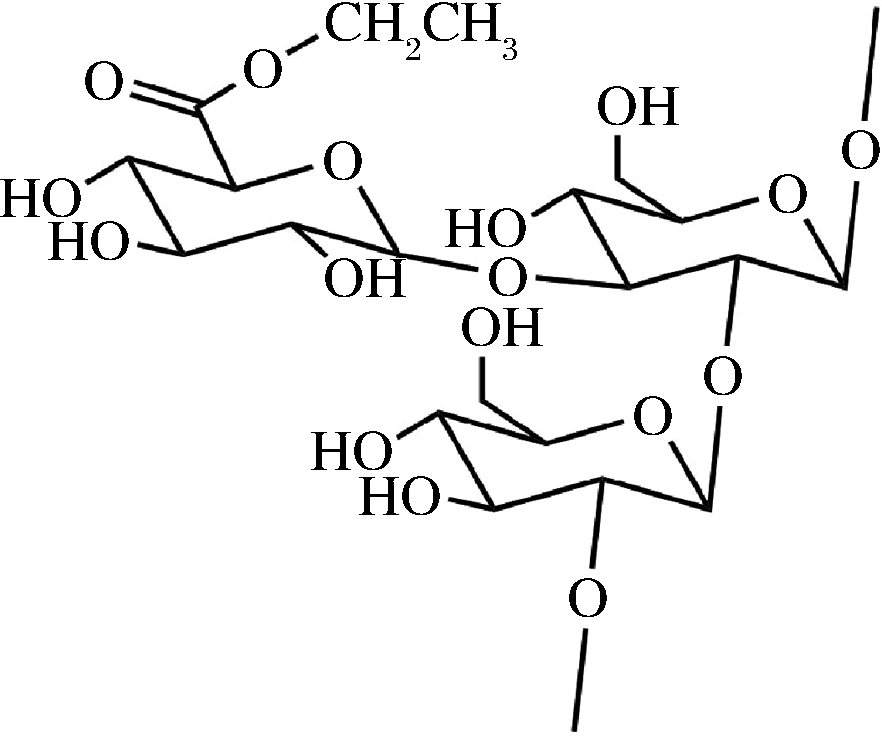
图9 CPP-1的片段结构
Fig.9 Fragment structure of CPP-1
3 结论
动物实验结果表明青钱柳粗多糖A具有显著的降血糖活性,降血糖活性存在于DEAE水洗脱部位中,该组分进一步分离纯化后得到2个均一多糖CPP-1与CPP-2,其中CPP-1可显著降低小鼠空腹血糖与糖化血红蛋白,提高糖尿病小鼠葡萄糖耐受能力,改善其“多饮、多食”症状,这表明CPP-1是粗多糖A主要的降血糖活性成分。通过对CPP-1的NMR图谱分析,初步推断多糖CPP-1由(1→2)-β-D-葡萄糖构成主链,由β-D-葡萄糖醛酸乙酯构成侧链,侧链连接在主链β-D-葡萄糖C3上。这在青钱柳多糖的研究中为首次报道,但具体空间结构还有待深入研究。
[1] WU Y,LI Y Y,WU X,et al.Chemical constituents from Cyclocarya paliurus (Batal.) iljinsk[J].Biochemical Systematics and Ecology,2014,57:216-220.
[2] CHEN Z L,JIAN Y Q,WU Q,et al.Cyclocarya paliurus (batalin) iljinskaja:Botany,ethnopharmacology,phytochemistry and pharmacology[J].Journal of Ethnopharmacology,2022,285:114912.
[3] 聂小华,吴聪聪,林胜利,等.青钱柳中活性物质及其功能特性研究进展[J].浙江工业大学学报,2022,50(2):222-227.
NIE X H,WU C C,LIN S L,et al.Advance on active compounds and functional properties of Cyclocarya paliurus (Batal.) Iljinskaja[J].Journal of Zhejiang University of Technology,2022,50(2):222-227.
[4] 唐梅,赵立春,扈芷怡,等.青钱柳化学成分及药理作用研究进展[J].国际药学研究杂志,2017,44(9):851-859.
TANG M,ZHAO L C,HU Z Y,et al.Chemical constituents and pharmacological activities of Cyclocarya paliurus(Batal.)Iljinskaja:Research advances[J].Journal of International Pharmaceutical Research,2017,44(9):851-859.
[5] WANG H,TANG C,GAO Z Z,et al.Potential role of natural plant medicine Cyclocarya paliurus in the treatment of type 2 diabetes mellitus[J].Journal of Diabetes Research,2021,2021:1655336.
[6] LIU Y,CAO Y N,FANG S Z,et al.Antidiabetic effect of Cyclocarya paliurus leaves depends on the contents of antihyperglycemic flavonoids and antihyperlipidemic triterpenoids[J].Molecules,2018,23(5):1042.
[7] 王胤康,吕萌,许琦,等.青钱柳活性成分对IR-HepG2细胞葡萄糖消耗量及α-葡萄糖苷酶活性的影响[J].食品与生物技术学报,2019,38(2):120-125.
WANG Y K,LYU M,XU Q,et al.Effects of Cyclocarya paliurus(Batal.) iljinskaja extracts on glucose consumption of insulin resistance HepG2 cell and activity of alpha-glucosidase[J].Journal of Food Science and Biotechnology,2019,38(2):120-125.
[8] 李燕,蔡儒安,潘如梨,等.青钱柳水提物降血糖及抗发炎功效研究[J].中国食品学报,2021,21(9):102-109.
LI Y,CAI R A,PAN R L,et al.Studies on hypoglycemic and anti-inflammatory effects of Cyclocarya paliurus extract[J].Journal of Chinese Institute of Food Science and Technology,2021,21(9):102-109.
[9] 秦帅,秦灵灵,吴丽丽,等.青钱柳对糖尿病小鼠肝脏糖脂代谢影响及机制研究[J].世界科学技术-中医药现代化,2020,22(10):3443-3449.
QIN S,QIN L L,WU L L,et al.Effect and mechanism of aqueous extract from Cyclocarya paliurus on glucose and lipid metabolism in the liver of diabetic mice[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2020,22(10):3443-3449.
[10] 上官新晨,陈木森,蒋艳,等.青钱柳多糖降血糖活性的研究[J].食品科技,2010,35(3):82-84.
SHANGGUAN X C,CHEN M S,JIANG Y,et al.Hypoglycemic effect of Cyclocarya paliurus(Batal) ijinskaja polysaccharide on diabetic and normal mice[J].Food Science and Technology,2010,35(3):82-84.
[11] 刘涵,张苗,刘晓娟,等.雨生红球藻多糖的分离纯化和免疫活性组分鉴定[J].食品科学,2019,40(2):52-58.
LIU H,ZHANG M,LIU X J,et al.Isolation,purification and identification of immunologically active polysaccharides from Haematococcus pluvialis[J].Food Science,2019,40(2):52-58.
[12] 葛莹,张雷,王欢欢,等.乌骨鸡活性肽对糖尿病小鼠血液生化指标和组织病理学的影响[J].浙江大学学报(农业与生命科学版),2022,48(1):78-85.
GE Y,ZHANG L,WANG H H,et al.Effects of bioactive peptides from black-bone chicken on blood biochemical parameters and histopathology in diabetic mice[J].Journal of Zhejiang University (Agriculture and Life Sciences),2022,48(1):78-85.
[13] SHI G J,ZHENG J,WU J,et al.Beneficial effects of Lycium barbarum polysaccharide on spermatogenesis by improving antioxidant activity and inhibiting apoptosis in streptozotocin-induced diabetic male mice[J].Food &Function,2017,8(3):1215-1226.
[14] LIU Y T,SUN J,RAO S Q,et al.Antidiabetic activity of mycelia selenium-polysaccharide from Catathelasma ventricosum in STZ-induced diabetic mice[J].Food and Chemical Toxicology,2013,62:285-291.
[15] DU L,LI C C,QIAN X,et al.Quercetin inhibited mesangial cell proliferation of early diabetic nephropathy through the Hippo pathway[J].Pharmacological Research,2019,146:104320.
[16] 刘迪迪,邱军强,张华,等.红松松仁提取物对糖尿病小鼠的降血糖活性[J].中国食品学报,2019,19(7):20-28.
LIU D D,QIU J Q,ZHANG H,et al.Hypoglycemic activity of the extracts from Korean pine nut on diabetic mice[J].Journal of Chinese Institute of Food Science and Technology,2019,19(7):20-28.
[17] 夏晴,王箴言,王玉,等.桦褐孔菌多糖对糖尿病小鼠的干预作用及机制[J].中国食品学报,2021,21(3):71-78.
XIA Q,WANG Z Y,WANG Y,et al.Intervention effect and mechanism of polysaccharides from Inonotus obliquus on diabetic mice[J].Journal of Chinese Institute of Food Science and Technology,2021,21(3):71-78.
[18] 吴盼盼,段元锋,徐德平.油菜蜂花粉多糖的分离鉴定及免疫活性研究[J].食品与生物技术学报,2015,34(10):1040-1044.
WU P P,DUAN Y F,XU D P.Isolate,identify and the immune improving activity of polysaccharides from rape bee pollen[J].Journal of Food Science and Biotechnology,2015,34(10):1040-1044.
[19] 陆姣.糖化血红蛋白在2型糖尿病肾病中的检测价值研究[D].长春:吉林大学,2021.
LU J.Study on the detection value of glycosylated hemoglobin in type 2 diabetic kidney disease[D].Changchun:Jilin University,2021.
[20] SHERWANI S I,KHAN H A,EKHZAIMY A,et al.Significance of HbA1c test in diagnosis and prognosis of diabetic patients[J].Biomarker Insights,2016,11:95-104.
[21] 张钟,黄丽花,张玲,等.荔枝肉水溶性多糖降血糖作用[J].食品科学,2013,34(15):303-306.
ZHANG Z,HUANG L H,ZHANG L,et al.Hypoglycemic effect of water-soluble polysaccharides from litchi flesh[J].Food Science,2013,34(15):303-306.