维生素B6是6种化合物的统称,包括吡哆醇(pyridoxine,PN)、吡哆醛(pyridoxal,PL)和吡哆胺(pyridoxamine,PM),及其相应的磷酸酯形式,5-磷酸吡哆醇(pyridoxine 5-phosphate,PNP)、5-磷酸吡哆醛(pyridoxal 5-phosphate,PLP)和5-磷酸吡哆胺(pyridoxamine 5-phosphate,PMP)。其中,PLP是主要的生物活性形式,是许多重要酶促反应的辅因子。PN较为稳定,是主要的商品生产形式[1]。由于动物和人自身不能合成维生素B6需从食物中获取[2],因此维生素B6在食品和畜牧行业中具有广泛的商业应用价值;另外维生素B6可用来治疗维生素B6缺乏症、皮炎和婴儿惊厥等疾病,在医药临床中具有重要的应用[3]。目前,工业生产维生素B6主要使用噁唑法[4]。该方法生产过程中使用了氯氧磷等有毒有害物质,不符合环境友好型发展趋势,而工程化模式微生物合成能避开以上缺点,受到广泛关注。本研究利用大肠杆菌作为底盘细胞合成维生素B6,可以减少生产中存在的隐患,进而实现环境友好型生产[5]。
维生素B6存在2条从头合成途径:1-脱氧-D-木酮糖-5-磷酸(1-deoxyd-d-xylose-5-phosphate,DXP)依赖性途径和DXP非依赖性途径。其中,在大肠杆菌中,维生素B6是通过DXP依赖性途径从头合成,该途径包括2个分支和7个酶组成(详见电子增强出版中的附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.034781)[6]。较长的分支是利用4-磷酸赤藓糖脱氢酶(erythritose 4-phosphate dehydrogenase,Epd)、4-磷酸赤藓酸酯脱氢酶(erythrate 4-phosphate dehydrogenase,PdxB)和磷酸丝氨酸转氨酶(phosphoserine transaminase,SerC)将4-磷酸-赤藓糖(4-phospho-erythritose,E4P)转化为4-磷酸羟基-L-苏氨酸(4-hydroxy-L-threonine,4HTP)[7]。4HTP被4-磷酸羟基苏氨酸脱氢酶(4-phosphohydroxy-l-threoninedehydrogenase,PdxA)氧化并脱羧生成3-氨基-2-氧代丙基磷酸酯(3-amino-2-oxy-propyl phosphate,PHA)[8]。短分支中,1-脱氧-D-木酮-5-磷酸酯(1-deoxyd-d-xylose-5-phosphate,DXP)在1-脱氧-D-木酮糖-5-磷酸合酶(1-deoxyd-D-xylose-5-phosphate synthase,Dxs)的催化下由甘油醛-3-磷酸和丙酮酸合成。紧接着,5-磷酸吡哆醇合酶(pyridoxine 5-phosphate synthase,PdxJ)将PHA和DXP合成PNP。最后,磷酸水解酶将PNP脱磷酸生成较为稳定的PN形式[9]。利用微生物细胞工厂合成维生素B6,受限于产量较低[10],工业化生产具有一定的难度,因此本研究通过代谢工程提高维生素B6产量具有重要的研究意义和价值。

图1 优化的BglBrick元件组装技术
Fig.1 Standard assembly of BglBrick
注:蓝色位点为限制酶BamH Ⅰ特异性切割序列,红色位点为限制酶Xho Ⅰ特异性切割序列。蛋白支架[SH3]x-[PDZ]y-[GBD]z在 质粒pRSFDuet1-SC0中,x∶y∶z=1∶1∶1。
维生素B6代谢工程改造的瓶颈之一在于中间代谢产物4HTP具有一定的毒性[11],其在细胞中的过度积累,会对菌体的生长造成影响,而根据酶动力学结果表明,4HTP下游酶PdxA对底物的结合能力较差,催化效率较低,是DXP依赖性途径合成维生素B6的重要限制因素[12]。蛋白支架本身是一个非催化亚单位,但它可以利用相互作用的蛋白结构域使途径酶共定位[13],在多个酶催化的代谢途径中,通过灵活地调控支架中结合结构域的比例,优化途径酶的化学计量数。基于蛋白互作原理构建的支架蛋白,能够在空间上将途径酶组装在一起,增加酶的局部浓度,并加快中间代谢产物的转化,从而提高底物的转化速率[14],平衡代谢流。有研究通过蛋白支架技术将甲羟戊酸的产量提高了77倍[15],葡萄糖酸[16]和白藜芦醇[17]的生产也得到了明显的改善。
本研究拟采用整合型蛋白支架,构建带有蛋白支架配体的途径酶组装体,对其中的关键酶PdxA进行筛选和随机突变,以获取高效突变体PdxA3mut,并将组装体与途径中其余酶共同过表达后进行发酵。本研究采用整合型蛋白支架技术,以期为提高维生素B6的发酵产量,进一步构建维生素B6高产菌株奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验菌株与质粒
研究中涉及的菌株见电子增强出版中的附表1,质粒见附表2,引物见附表3 (https://doi.org/10.13995/j.cnki.11-1802/ts.034781)。
1.1.2 主要培养基
LB(Luria-Bertani)培养基(g/L):酵母提取物5,NaCl 10,蛋白胨10,121 ℃灭菌20 min。
发酵培养基PY30(g/L):甘油20,酵母提取物5,NaCl 5,蛋白胨10,葡萄糖1,MgSO4·7H2O 0.2,FeSO4·7H2O 0.01,MnSO4·7H2O 0.01,121 ℃灭菌20 min。
1.1.3 仪器与设备
GET3XG三槽独立梯度基因扩增仪,杭州柏恒科技有限公司;水平电泳仪,北京市六一仪器厂;94-Z水平摇床,宁波新芝生物科技股份有限公司;V-1600可见分光光度仪,上海美谱达仪器有限公司;UltiMate 3000 HPLC,赛默飞世尔科技公司。
1.2 实验方法
1.2.1 PdxA随机突变体文库的构建
以实验室储存的pRSFDuet-1-pdxA 3(S.meliloti来源)质粒为模板,设计引物PdxA-F和PdxA-R,扩增了pdxA基因片段,胶回收的PCR片段作为易错PCR模板。我们设计了特异性引物Er-PdxA-F和Er-PdxA-R,采用不同浓度的模板(总量分别为100、50、20、10 ng)对pdxA进行易错PCR扩增,以确定最适模板浓度。参照易错PCR试剂盒说明书进行扩增。易错PCR产物经琼脂糖凝胶电泳验证后进行胶回收,用Dpn Ⅰ消化胶回收产物和载体pRSFDuet-1。用Gibson组装试剂盒于37 ℃组装30 min,最终产物热激转化大肠杆菌DH5α感受态细胞,涂布于含卡那霉素(50 μg/mL)的平板,37 ℃倒置培养12~16 h。刮取平板上的所有的单克隆位点,接入对应抗性的LB试管中,过夜培养,次日提取全部试管菌质粒转化工程菌LL216,涂布于含卡那霉素(50 μg/mL)的平板,即为随机突变体文库。
1.2.2 PdxA随机突变文库的孔板筛选
将培养皿上的单克隆挑出至装有发酵培养基PY30的96深孔板中进行发酵,800 r/min,70 h,每个孔内接种培养基的体积为2 mL。发酵结束后,先对每个96深孔板的每个单克隆吸取20 μL进行留菌保存,剩余部分将进行孔板离心,12 000 r/min离心3 min。由于维生素B6产物可分泌在胞外,所以离心后吸取200 μL上清液至96孔紫外酶标板中进行检测。预先对标准品进行全波长扫描,发现在414 nm处有较高吸收峰,故检测时以野生型为对照组测定OD414值,初步筛选高于对照组的正向突变体。
1.2.3 蛋白支架的构建
采用优化的Bglbrick方法进行[SH3]x-[PDZ]y-[GBD]z蛋白支架的构建[18],受体结构域SH3和PDZ均来自小鼠,GBD来自大鼠的N-WASP[19]。受体结构域部分[20]通过公司合成目标片段,并在目标片段的5′端设置酶切位点及保护碱基,保证经过限制酶酶切过后能与载体片段产生相同的黏性末端。通过不同的限制酶产生相同的黏性末端,从而生成6个核苷酸所组成的疤痕(Scar)复合序列,而这部分Scar序列所编码的是甘氨酸和丝氨酸,属于一种大多数蛋白质融合后的肽段连接物,不会影响正常的转录翻译。所用到的限制酶BamH Ⅰ切割G↓GATCC,限制酶Xho Ⅰ切割C↓TCGAG,以及限制酶Bgl Ⅱ切割A↓GATCT。最后再通过T4 DNA连接酶与通用载体pRSFDuet-1进行连接,从而完成构建。
1.2.4 菌株的摇瓶发酵培养
将质粒转化至工程菌LL216中。挑选阳性单克隆菌株,接种至种子培养基于37 ℃,220 r/min恒温振荡培养箱过夜培养。次日转接至培养基PY30中,当OD600值达到0.6~0.8时,添加0.8 mmol/L异丙基β-D-1-硫代吡喃半乳糖苷(isopropyl β-D-1-thiopyranogalactoside,IPTG)诱导蛋白表达,培养48 h取样并检测。
1.2.5 PN浓度的测定
取1 mL发酵液于无菌EP管中,8 000 r/min,离心3 min,吸取700 μL上清液,用1 mL注射器进行无机滤膜过滤,备用。所用检测色谱柱为耐酸型COSMOSIL 5C18-AR-Ⅱ Packed Column色谱柱(Cosmosil,4.6 mm×250 mm,5 μm)。HPLC检测维生素B6的条件[21]:柱温35 ℃,进样量20 μL,荧光检测激发波长293 nm,发射波长395 nm,流速0.8 mL/min,检测时间共30 min。流动相组分A为含有1-辛烷磺酸钠(8 mmol/L)和磷酸(33 mmol/L)的混合盐溶液,然后用KOH调pH至2.5。流动相组分B为80%的乙腈水溶液。
1.2.6 CRISPR-Cas9质粒的构建
本实验以CRISPR-Cas9-SC0(1∶1∶1支架)为例子,进行CRISPR-Cas9应用的展开介绍。以实验室原有质粒CRISPR-Cas9为模板,更换原始质粒中的gRNA序列和待编辑基因pta2位点的上下游300 bp同源臂序列,上游同源臂记为up片段,下游同源臂记为down片段,将CRISPR-Cas9载体骨架分为两部分,记为Cas9-V1和Cas9-V2,在扩增同时将目的基因待编辑位点pta2的N20序列引入,即目的基因序列上任意NGG上游的20 bp碱基。同时,将SC0受体结构域片段分别进行扩增连接,组装成为SH3-PDZ-GBD,最后使用Gibson组装试剂盒将Cas9质粒骨架两部分与插入的蛋白支架受体结构域SH3-PDZ-GBD以及up和down片段进行多片段组装,连接产物再转化至DH5α中,次日进行验证测序,测序成功后即为完成质粒的构建。
2 结果与分析
2.1 不同来源 PdxA 的筛选
4HTP是具有一定毒性的中间代谢产物,其下游酶PdxA的Kcat/KM=0.019[10],对底物结合能力和催化能力较弱,是维生素B6代谢途径中的关键酶[12]。本实验首先对pdxA基因进行了筛选,选取具有天然高产维生素B6特征的苜蓿中华根瘤菌(S.meliloti)[22],其包含3个pdxA同源基因。通过将E.coli内源基因pdxA以及S.meliloti来源的同源基因过表达后导入底盘LL216,37 ℃培养12 h后挑取单克隆,接入种子液过夜培养,再转入装有PY30培养基的三角瓶中培养。通过HPLC检测发酵上清液中维生素B6的产量,所有菌株均进行了2~3次平行实验,液相测定结果如表1所示。发现引入S.meliloti 来源PdxA3蛋白(NCBI:WP_127890821.1)后,产量高于其他菌株,达到2.24 mg/L。
表1 不同来源PdxA的发酵验证
Table 1 Fermentation validation of PdxA from different sources
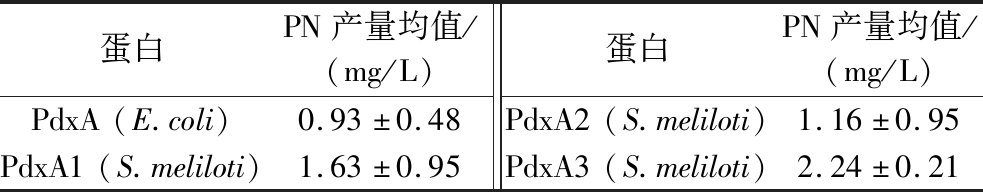
蛋白PN产量均值/(mg/L)蛋白PN产量均值/(mg/L)PdxA(E.coli)0.93±0.48PdxA2(S.meliloti)1.16±0.95PdxA1(S.meliloti)1.63±0.95PdxA3(S.meliloti)2.24±0.21
2.2 PdxA3随机突变体文库的筛选
为了进一步提升PdxA3的活性,构建了随机突变文库并对突变体进行了筛选。易错PCR(error-prone PCR)是一种应用广泛的体外随机突变技术,我们通过调整易错PCR体系中模板浓度Mn2+和Mg2+使碱基随机错配,从而构建pdxA随机突变体文库。当模板质量浓度为10 ng/μL时,随机突变体文库的氨基酸突变率最高,且处于合理突变范围内。将随机突变片段与pRSFDuet-1载体连接,转化大肠杆菌DH5α。提取DH5α的质粒转入工程菌LL216,获得随机突变体文库。本实验共挑取了1 180个单克隆,首先通过96孔细菌培养板发酵培养,测定所有单克隆的OD414进行初步筛选,挑选出8个OD414高于野生型的突变体(表2);再通过摇瓶发酵培养后,液相定量检测PN进行复筛,对所有复筛的菌株均进行2~3次平行实验,最终找到一个产量提升最高的突变体,命名为PdxA3 mut,与野生型PdxA3相比提升了60%,维生素B6产量提升至3.92 mg/L。经测序比对,PdxA3 mut含有双突变位点R139C/K292N。
表2 PdxA3随机突变筛选
Table 2 Screening for random mutations
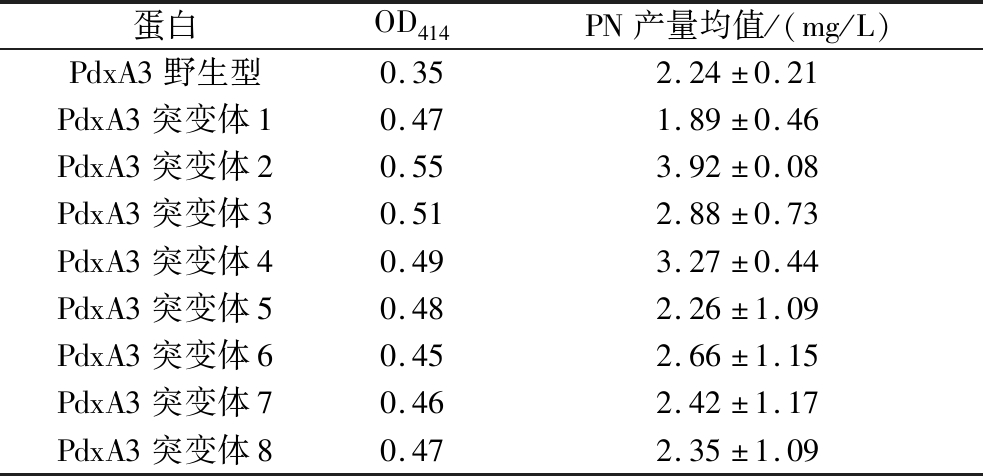
蛋白OD414PN产量均值/(mg/L)PdxA3野生型0.352.24±0.21PdxA3突变体10.471.89±0.46PdxA3突变体20.553.92±0.08PdxA3突变体30.512.88±0.73PdxA3突变体40.493.27±0.44PdxA3突变体50.482.26±1.09PdxA3突变体60.452.66±1.15PdxA3突变体70.462.42±1.17PdxA3突变体80.472.35±1.09
2.3 新型蛋白支架的构建
构建蛋白支架一般通过传统的BioBrick策略叠加合成元件,使用EcoR Ⅰ、Xba Ⅰ、Spe Ⅰ和Pst Ⅰ以切割载体和片段。Xba Ⅰ、Spe Ⅰ是同尾酶,生成疤痕序列TCTAGA,其中AGA编码的精氨酸在大肠杆菌中属于稀有密码子,而且Xba Ⅰ位点存在被Dam甲基化阻断的风险[23]。本研究对重复合成元件的构建方法进行了创新,采用BglBrick构建方法,仅使用了3个限制性内切酶Bgl Ⅱ和BamH Ⅰ和Xho Ⅰ,更加灵活高效,且不受Dam甲基化影响[18]。首先以pRSFDuet-1-SH3-PDZ、pRSFDuet-1-PDZ、pRSFDuet-1-GBD三个质粒为载体得到基本的合成元件SH3-PDZ、PDZ以及GBD,以此为基础构建1∶1∶1的蛋白支架[SH3]1-[PDZ]1-[GBD]1。如图1所示,以x∶y∶z=1∶1∶1(pRSFDuet1-SC0)的蛋白支架为实例,其载体片段是以pRSFDuet-1-SH3-PDZ为模板,通过BamH Ⅰ与Xho Ⅰ双酶切获得;其GBD目标片段是以pRSFDuet-1-GBD为模板,通过Bgl Ⅱ与Xho Ⅰ双酶切。
目的是在原有1∶1基础上添加一个受体结构域GBD,使得经过酶切后的载体片段与GBD形成相同的黏性末端,以便于最终通过T4 DNA连接酶进行连接,最终形成质粒pRSFDuet1-SC1。利用CRISPR-Cas9系统将构建的蛋白支架质粒整合至LL216基因组中。
含蛋白支架配体(ligand,lig)的酶的选择上,采用了4HTP上下游的合成酶,包括PdxB,SerC及PdxA(图2)。有研究报道[24],PdxB是一种NAD+依赖性酶,催化生成NADH会与PdxB保持紧密结合从而影响其继续参与反应,而α-酮酸类如α-酮戊二酸可协助NADH的解离;其中,转氨酶SerC能够催化谷氨酸脱氨基生成α-酮戊二酸,因此通过蛋白支架将PdxB,SerC及PdxA共定位,改变酶的空间组织形式,从而解决PdxB的周转问题,加速4HTP的转化。另外,在PdxB的选择上,同时采用了PdxR,其是S.meliloti来源的PdxB同源蛋白,在高产菌株中曾有报道[25]。本研究构建了2种不同的结合配体质粒包括pTrc-pdxB-serC-pdxA和pTrc-pdxR-serC-pdxA3 mut。此外我们将其余途径酶Epd、Dxs与PdxJ也构建在另一载体pRSFDuet1-epd-dxs-serC以增加维生素B6合成途径的代谢流量。

a-过表达途径酶Epd-Dxs-PdxJ;b-组装体PdxB-SerC-PdxA与蛋白支架SH3-PDZ-GBD的适配(x、y和z分别代表对应蛋白支架比例)
图2 蛋白支架与途径酶的适配组装
Fig.2 Adaptive assembly of protein scaffolds and pathway enzymes
注:图中红蓝绿三色分别代表SH3、PDZ和GBD受体结构域及其对应配体。
2.4 蛋白支架与维生素B6途径酶的适配
为了确定蛋白支架[SH3]x-[PDZ]y-[GBD]z与维生素B6途径酶的适配比例,共设计了9种比例数的蛋白支架,其中x∶y∶z比例分别为1∶1∶1,1∶1∶2,1∶1∶3,1∶2∶1,1∶2∶2,1∶2∶3,1∶3∶1,1∶3∶2,1∶3∶3,为减少代谢负担,将蛋白支架整合在LL216菌中,共形成9种底盘细胞。本实验首先将构建成功的pRSFDuet1-epd-dxs-pdxJ和途径酶组装体pTrc-pdxB-serC-pdxA共同导入整合过蛋白支架的菌株中,再对这9种含有途径酶的蛋白支架进行发酵以及液相检测,选取最优比例数的合成支架。共进行了2~3次平行实验。途径酶组装体与蛋白支架的适配结果见图3。在与蛋白支架进行适配的过程中,途径酶组装体的表达与1∶3∶1的蛋白支架最适配,产量提升至15.72 mg/L。
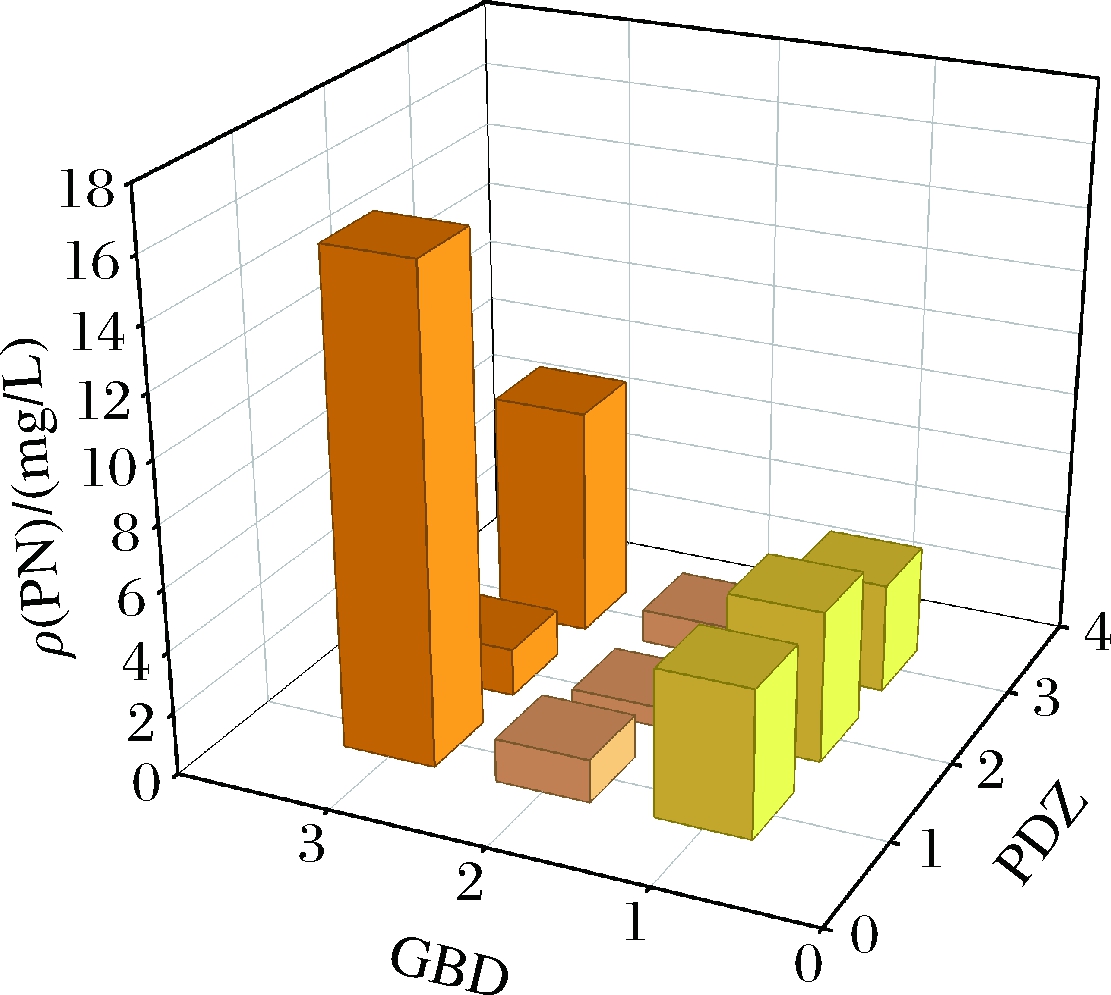
图3 途径酶PdxB-SerC-PdxA与蛋白支架的适配与优化
Fig.3 Adaptation and optimization of the pathway enzyme PdxB-SerC-PdxA with protein scaffolds
注:X轴与Y轴代表蛋白支架比例,Z轴代表对应比例下PN产量。
我们针对途径酶组装体pTrc-pdxR-serC-pdxA3 mut,同样采用上述9种比例的蛋白支架(图4)。共进行了2~3次平行实验。发酵结果表明,途径酶PdxR-SerC-PdxA3 mut的表达与1∶1∶2的蛋白支架最适配,使得产量提升至21.23 mg/L。蛋白支架在空间上对游离的酶具有一定的招募能力,不同的酶需要适配不同的蛋白支架比例;通过靶向束缚途径酶蛋白,增加了酶与底物的有效局部浓度,加快了有毒中间代谢物的转化,提升了关键酶的催化效果。
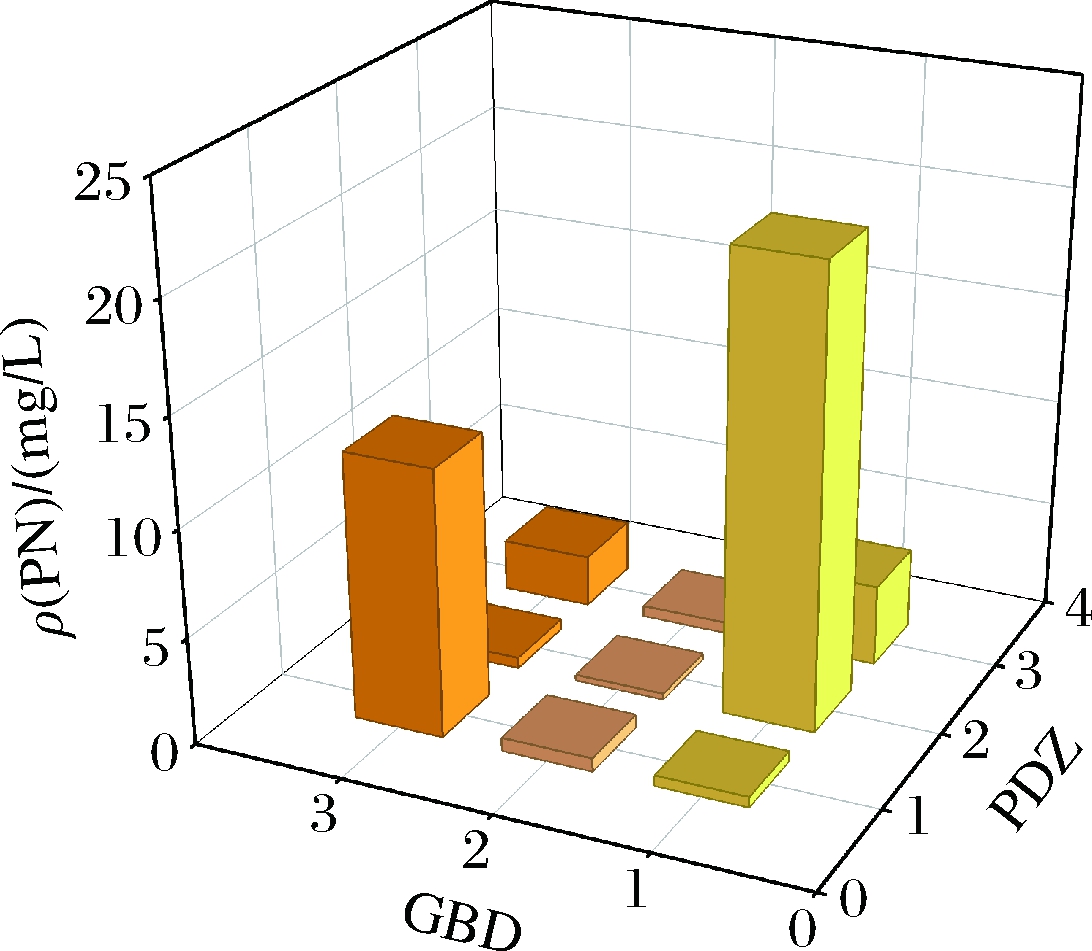
图4 途径酶PdxR-SerC-PdxA3 mut与蛋白支架的适配与优化
Fig.4 Adaptation and optimization of the pathway enzyme PdxR-SerC-PdxA3 mut with protein scaffolds
3 结果与讨论
维生素B6生产过程中,4HTP的细胞毒性限制了发酵产量的提升,是维生素B6合成的瓶颈之一。本研究通过易错PCR方式对S.meliloti来源的PdxA进行非理性改造,增加关键酶PdxA对底物4HTP的活性,从而提高PN产量。通过测定OD414开展快速筛选,得到1株高产菌株,经过测序,该菌株含有双突变位点R139C/K292 N,产量提升了60%。
为了加快合成途径酶的催化速率,我们利用了蛋白支架技术。本实验首先构建了不同比例数的蛋白支架,以及途径酶组装体PdxB-SerC-PdxA和PdxR-SerC-PdxA3 mut。对发酵结果进行分析,当组装体蛋白全部为大肠来源的野生型时,途径酶组装体与蛋白支架最佳适配性的产量为15.72 mg/L,该蛋白支架所对应的比例为1∶3∶1。当组装体蛋白中引入S.meliloti来源PdxR与PdxA3 mut后,途径酶组装体与蛋白支架最佳适配性的产量提升至21.23 mg/L,该蛋白支架所对应的比例为1∶1∶2。可以看出本实验所构建的蛋白支架,使得带有配体的关键酶以特定的位置附着在支架的骨架上,一方面拉近了酶与底物空间距离,另一方面也有效避免了有毒代谢物的伤害,提高了催化反应速率。在构建蛋白支架的过程中,不同来源的酶需要不同的表达调控,找到最适比例能使产量大幅提升,达到事半功倍的效果。
在代谢工程的发展历史中,涌现了很多以生物设计为原则的工具,其中蛋白支架已经能成功应用于各种初级或次级代谢产物的合成。在宿主菌株(如大肠杆菌)中构建合成代谢途径时,宿主菌株会出现通量失衡、中间产物损失和次生代谢物毒性等问题,从而导致目标产量降低。蛋白支架本身不具有酶催化活性,但它可以同时结合多个具有酶活性的信号分子,能够在空间上募集酶分子,使得酶分子可直接或间接地相互影响[13]。本研究通过构建不同途径酶组装体与多种比例数的蛋白支架进行适配,再利用蛋白质与蛋白质之间的天然相互作用,使得途径中的有毒中间产物4HTP不会过度积累,解决了代谢改造中的瓶颈问题,提升了催化效率,提高了整体代谢流,对维生素B6的生物合成具有重要意义。
[1] FITZPATRICK T,AMRHEIN N,KAPPES B,et al.Two independent routes of de novo vitamin B6 biosynthesis:Not that different after all[J].Biochemical Journal,2007,407(1):1-13.
[2] KRAEMER K,SEMBA R D,EGGERSDORFER M,et al.Introduction:The diverse and essential biological functions of vitamins[J].Annals of Nutrition &Metabolism,2012,61(3):185-191.
[3] ACEVEDO-ROCHA C G,GRONENBERG L S,MACK M,et al.Microbial cell factories for the sustainable manufacturing of B vitamins[J].Current Opinion in Biotechnology,2019,56:18-29.
[4] ZOU Y,SHI X J,ZHANG G B,et al.Improved “oxazole”method for the practical and efficient preparation of pyridoxine hydrochloride (vitamin B6)[J].Organic Process Research &Development,2013,17(12):1498-1502.
[5] PARRA M,STAHL S,HELLMANN H.Vitamin B6 and its role in cell metabolism and physiology[J].Cells,2018,7(7):84.
[6] ROSENBERG J,YEAK K C,COMMICHAU F M.A two-step evolutionary process establishes a non-native vitamin B6 pathway in Bacillus subtilis[J].Environmental Microbiology,2018,20(1):156-168.
[7] ZHAO G,PEASE A J,BHARANI N,et al.Biochemical characterization of gapB-encoded erythrose 4-phosphate dehydrogenase of Escherichia coli K-12 and its possible role in pyridoxal 5′-phosphate biosynthesis[J].Journal of Bacteriology,1995,177(10):2804-2812.
[8] JOHN R A.Pyridoxal phosphate-dependent enzymes[J].Biochimica et Biophysica Acta,1995,1248(2):81-96.
[9] TRAMONTI A,NARDELLA C,DI SALVO M L,et al.Knowns and unknowns of vitamin B6 metabolism in Escherichia coli[J].EcoSal Plus,2021,9(2).DOI:10.1128/ecosalplus.ESP-0004-2021.
[10] ROSENBERG J,ISCHEBECK T,COMMICHAU F M.Vitamin B6 metabolism in microbes and approaches for fermentative production[J].Biotechnology Advances,2017,35(1):31-40.
[11] WEI L,WANG Q,XU N,et al.Combining protein and metabolic engineering strategies for high-level production of O-acetylhomoserine in Escherichia coli[J].ACS Synthetic Biology,2019,8(5):1153-1167.
[12] MUKHERJEE T,HANES J,TEWS I,et al.Pyridoxal phosphate:Biosynthesis and catabolism[J].Biochimica et Biophysica Acta (BBA) -Proteins and Proteomics,2011,1814(11):1585-1596.
[13] 王琛,赵猛,丁明珠,等.生物支架系统在合成生物学中的应用[J].化工进展,2020,39(11):4557-4567.
WANG C,ZHAO M,DING M Z,et al.Application of biological scaffold system on synthetic biology[J].Chemical Industry and Engineering Progress,2020,39(11):4557-4567.
[14] CHEN A H,SILVER P A.Designing biological compartmentalization[J].Trends in Cell Biology,2012,22(12):662-670.
[15] DUEBER J E,WU G C,MALMIRCHEGINI G R,et al.Synthetic protein scaffolds provide modular control over metabolic flux[J].Nature Biotechnology,2009,27(8):753-759.
[16] MOON T S,DUEBER J E,SHIUE E,et al.Use of modular,synthetic scaffolds for improved production of glucaric acid in engineered E.coli[J].Metabolic Engineering,2010,12(3):298-305.
[17] WANG Y C,YU O.Synthetic scaffolds increased resveratrol biosynthesis in engineered yeast cells[J].Journal of Biotechnology,2012,157(1):258-260.
[18] ANDERSON J C,DUEBER J E,LEGUIA M,et al.BglBricks:A flexible standard for biological part assembly[J].Journal of Biological Engineering,2010,4(1):1.
[19] HORN A H C,STICHT H.Synthetic protein scaffolds based on peptide motifs and cognate adaptor domains for improving metabolic productivity[J].Frontiers in Bioengineering and Biotechnology,2015,3:191.
[20] ZEKE A,LUK CS M,LIM W A,et al.Scaffolds:Interaction platforms for cellular signalling circuits[J].Trends in Cell Biology,2009,19(8):364-374.
CS M,LIM W A,et al.Scaffolds:Interaction platforms for cellular signalling circuits[J].Trends in Cell Biology,2009,19(8):364-374.
[21] ITO T,YAMAMOTO K,HORI R,et al.Conserved pyridoxal 5′-phosphate-binding protein YggS impacts amino acid metabolism through pyridoxine 5′-phosphate in Escherichia coli[J].Applied and Environmental Microbiology,2019,85(11):e00430-e00419.
[22] TAZOE M,ICHIKAWA K,HOSHINO T.Production of vitamin B6 in Rhizobium[J].Bioscience,Biotechnology,and Biochemistry,1999,63(8):1378-1382.
[23] SHETTY R P,ENDY D,JR KNIGHT T F.Engineering BioBrick vectors from BioBrick parts[J].Journal of Biological Engineering,2008,2:5.
[24] RUDOLPH J,KIM J,COPLEY S D.Multiple turnovers of the nicotino-enzyme PdxB require α-keto acids as cosubstrates[J].Biochemistry,2010,49(43):9249-9255.
[25] COMMICHAU F M,ALZINGER A,SANDE R,et al.Overexpression of a non-native deoxyxylulose-dependent vitamin B6 pathway in Bacillus subtilis for the production of pyridoxine[J].Metabolic Engineering,2014,25:38-49.