虾青素(3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素)是一种由β-胡萝卜素氧化而成的类胡萝卜素,广泛存在于藻类、真菌、虾蟹及鱼类中,其主要以立体异构体、几何异构体、游离或酯化形式存在[1]。雨生红球藻是一种绿色微藻,是自然界中虾青素含量最高的生物,雨生红球藻中累积的虾青素含量约为30 g/kg干细胞,是天然虾青素的主要来源之一[2]。人工合成虾青素(synthetic astaxanthin,S-AST)由化学合成,与雨生红球藻中天然累积虾青素有很大不同。首先,雨生红球藻源虾青素(Haematococcus pluvialis ester astaxanthin,E-AST)主要以酯化的形式存在,S-AST则为游离态;其次,E-AST主要以3S,3S′结构存在,而S-AST中(3S,3′S)∶(3R,3′R)∶(3S,3′R)的比例约为1∶2∶1[3]。
正常代谢反应中,生物体内会生成高反应性活性氧(reactive oxygen species,ROS),如·OH、·O2-和H2O2,过多的自由基和ROS的累积会引起机体氧化损伤[4]。虾青素是自由基清除剂、断链抗氧化剂、ROS和活性氮的淬灭剂[5]。研究发现,虾青素能够抑制幽门螺杆菌(Helicobacter pylori)诱导人胃上皮AGS细胞线粒体中ROS的生成,并可能与上调细胞内抗氧化酶活性相关[6]。高温(41 ℃)诱导牛卵母细胞活性降低,细胞内ROS含量升高,并使细胞处于热休克状态,而虾青素可通过清除ROS保护细胞,使牛卵母细胞恢复活性[7]。虾青素的共轭多烯结构使其更容易与游离的电子配对,显著增加了虾青素可淬灭的自由基电子数,因此与β-胡萝卜素、叶黄素、维生素E等常见抗氧化剂相比,虾青素具有更高的抗氧化活性[3]。值得注意的是,不同来源的虾青素抗氧化能力之间也存在差异。体外化学实验表明,E-AST猝灭单氧自由基和清除自由基能力优于S-AST,E-AST的抗氧化活性比S-AST强14倍左右,而S-AST对过氧亚硝酸盐和·OH的清除能力更强[3]。
线粒体是细胞的能量中心,也是细胞内ROS的主要来源[8]。荧光探针作为一种高灵敏度的检测方法,在ROS的检测中发挥了重要作用。DCFH-DA是一种常见的用于检测细胞线粒体和细胞质中总ROS(·OH、H2O2、RO2-)含量的荧光探针,DHR123可以检测细胞线粒体中的H2O2和HClO,DHE则是特异的·O2-检测探针[9]。利用DCFH-DA、DHR123和DHE检测龙葵碱对HepG2细胞内ROS含量的影响,结果发现龙葵碱诱导HepG2细胞质和线粒体中·OH和H2O2的增加,但对线粒体中·O2-无显著影响[10]。已有诸多研究利用DCFH-DA荧光探针检测发现,虾青素可以通过清除细胞内的ROS发挥其抗氧化能力[11-12],却鲜有研究报道利用不同特异性荧光探针检测不同来源虾青素对细胞内ROS分子含量的影响。
HepG2细胞增殖能力强,易于获得,是一种分析天然活性产物抗氧化活性的理想细胞模型。因此,本研究以HepG2细胞为模型,利用3种特异性荧光探针检测2种不同来源虾青素处理后细胞内ROS含量的变化,并通过细胞内抗氧化法(cellular antioxidant activity,CAA)比较2种不同来源虾青素细胞内抗氧化能力的差异,以期为虾青素进一步开发和合理利用提供理论依据。
1 材料和方法
1.1 材料
1.1.1 实验对象
人肝癌HepG2细胞(编号:SCSP-510),购自中国科学院干细胞库。
1.1.2 试剂
E-AST(纯度:50%),云南爱尔发生物技术股份有限公司;S-AST,西格玛奥德里奇(上海)贸易有限公司;MEM培养基、胎牛血清、无菌D-Hank′s平衡盐溶液,赛默飞世尔科技(中国)有限公司;MTT、Formazan溶解液,上海碧云天生物技术有限公司;荧光探针:二氯二氢荧光素-乙酰乙酸酯[2-(3,6-diacetoxy-2,7-dichloro-9 h-xanthen-9-yl)benzoic acid,DCFH-DA]、二氢罗丹明(dihydrorhodamine,DHR123)、二氢乙啶(dihydroethidium,DHE),江苏凯基生物技术股份有限公司;2,2-偶氮二(2-甲基丙基咪)二盐酸盐[2,2′-azobis(2-methylpropionamidine) dihydrochloride,ABAP],国药集团化学试剂有限公司。
1.1.3 主要仪器
CO2恒温培养箱,赛默飞世尔科技(中国)有限公司;倒置显微镜,麦克奥迪实业集团有限公司;Synergy2多功能酶标仪,美国伯腾仪器有限公司。
1.2 方法
1.2.1 MTT法检测HepG2细胞存活率
取对数生长期的HepG2细胞,以1×104个/mL的密度接种于96孔细胞培养板中,置于37 ℃、5% CO2培养箱中预培养24 h后,吸去孔内培养基,加入100 μL含有0、2.5、5、10 μmol/L不同来源虾青素的无血清培养液,同时设置对照组和空白组,每组4个重复。2种虾青素处理24 h后,每孔加入10 μL MTT溶液,继续培养4 h,吸弃上清液,向所有孔内加入100 μL Formazan溶解液,混匀后放回细胞培养箱中孵育4 h左右,直至在倒置显微镜中观察没有紫色晶体。使用酶标仪测定各孔在570 nm波长下的吸光度,并计算不同来源不同浓度虾青素对HepG2细胞存活率的影响,计算如公式(1)所示:
细胞存活率![]()
(1)
式中:OD实、OD空、OD对分别表示实验组、空白组、对照组在570 nm下的吸光度。
1.2.2 细胞内ROS含量测定
将HepG2细胞以1×104个/mL的密度接种于无菌的全黑96孔板中,待细胞生长融合至80%左右时,加入100 μL含有0、2.5、5、10 μmol/L不同来源虾青素的无血清培养液,2种虾青素处理24 h后,吸弃旧的培养液,分别加入100 μL浓度为10 μmol/L荧光探针,在培养箱中孵育一定时间(DCFH-DA、DHR123、DHE荧光探针的孵育时间分别为20、30、40 min左右)。孵育结束后,使用PBS清洗1~2次以除去未进入细胞的探针。最后,每孔加入100 μL PBS,在避光条件下使用荧光酶标仪分别检测荧光强度,3种荧光探针的激发和发射波长分别为DCFH-DA:495 nm/529 nm、DHR123:507 nm/529 nm、DHE:518 nm/605 nm。然后,计算2种不同来源虾青素处理后,HepG2细胞内ROS水平,计算如公式(2)所示:
相对荧光强度![]()
(2)
式中:F实、F空、F对分别表示实验组、空白组、对照组的荧光强度值。
1.2.3 CAA值测定
取对数生长期的HepG2细胞,将细胞密度调整为6×104个/mL接种于无菌的全黑96孔板中。参考WOLFE等[13]的实验方法,在细胞培养结束后,去除孔内旧培养基,使用无菌D-Hank’s溶液洗涤细胞1~2次以清洗未完全贴壁以及死亡的细胞。实验组中加入100 μL含有不同来源不同浓度(0、2.5、5、10 μmol/L)虾青素以及DCFH-DA探针(25 μmol/L)的无血清培养液,对照组和空白组中加入100 μL无血清培养液稀释的DCFH-DA探针。将细胞置于37 ℃、5% CO2培养箱中孵育1 h后,使用无菌D-Hank’s溶液清洗细胞2~3次,向实验组和对照组中加入100 μL ABAP溶液(600 μmol/L),空白组中加入100 μL无菌D-Hank′s溶液,随后立即置于荧光酶标仪读取实时荧光,设定时间间隔为5 min,实时测定1 h,激发波长为485 nm,发射波长为538 nm。CAA值的计算如公式(3)所示:
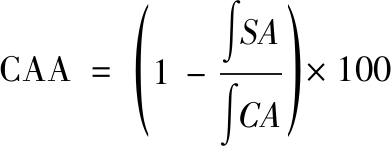
(3)
式中:![]() 添加不同来源虾青素后的荧光值与时间形成曲线的面积;
添加不同来源虾青素后的荧光值与时间形成曲线的面积;![]() 空白组的荧光值与时间形成曲线的面积。
空白组的荧光值与时间形成曲线的面积。
1.3 数据处理与统计分析
所有数据以平均数±标准误差表示,使用SPSS 25.0对实验数据进行统计分析,分别采用ANOVA法和Duncan法及t-检验对实验结果进行方差分析和多重比较,P<0.05被认为具有显著性差异。使用GraphPad Prism 8软件对统计结果进行作图。
2 结果与分析
2.1 不同来源虾青素对HepG2细胞存活率的影响
如图1所示,经不同来源虾青素处理24 h后,细胞存活率均在85%以上,而且10 μmol/L E-AST处理组与对照组相比细胞存活率显著上升(P<0.05),其余处理组与对照组相比没有显著性差异(P>0.05)。这说明在本实验中各处理组所使用虾青素浓度条件下,2种不同来源虾青素对HepG2细胞无明显毒副作用。

图1 不同来源虾青素对HepG2细胞存活率的影响
Fig.1 Effect of different sources of astaxanthin on cell viability
注:不同字母表示差异显著(P<0.05)(下同)。
2.2 不同来源虾青素对HepG2细胞内ROS含量的影响
添加不同浓度的E-AST和S-AST处理HepG2细胞24 h后,DCFH-DA的检测结果如图2-a所示,与对照组相比,经E-AST处理后,HepG2细胞中ROS含量降低,并且随着E-AST浓度增加呈先下降后上升再下降的趋势,其中2.5和10 μmol/L组细胞内ROS含量显著低于对照组(P<0.05),5 μmol/L处理组中ROS含量最高,但仍低于对照组;而5和10 μmol/L S-AST处理组细胞内ROS含量与对照组相比显著降低(P<0.05);但是相同浓度不同来源虾青素处理组之间不存在显著性差异(P>0.05)。DHR123的检测结果如图2-b所示,与对照组相比,不同浓度E-AST处理HepG2细胞24 h后,细胞内H2O2含量显著降低(P<0.05),并且在浓度为5 μmol/L时细胞内H2O2含量最低;而使用S-AST处理后,细胞内H2O2含量略有减少,但是仅在5 μmol/L时具有显著性差异(P<0.05);同时,2种虾青素处理浓度为5 μmol/L时,E-AST组中H2O2含量显著低于S-AST组(P<0.05)。DHE的检测结果显示,虽然添加2种不同来源虾青素处理后,细胞内·O2-含量减少,但是仅在2.5 μmol/L S-AST处理时与对照组相比具有显著性差异(P<0.05);同一浓度不同来源虾青素处理组之间不存在显著性差异(P>0.05)(图2-c)。
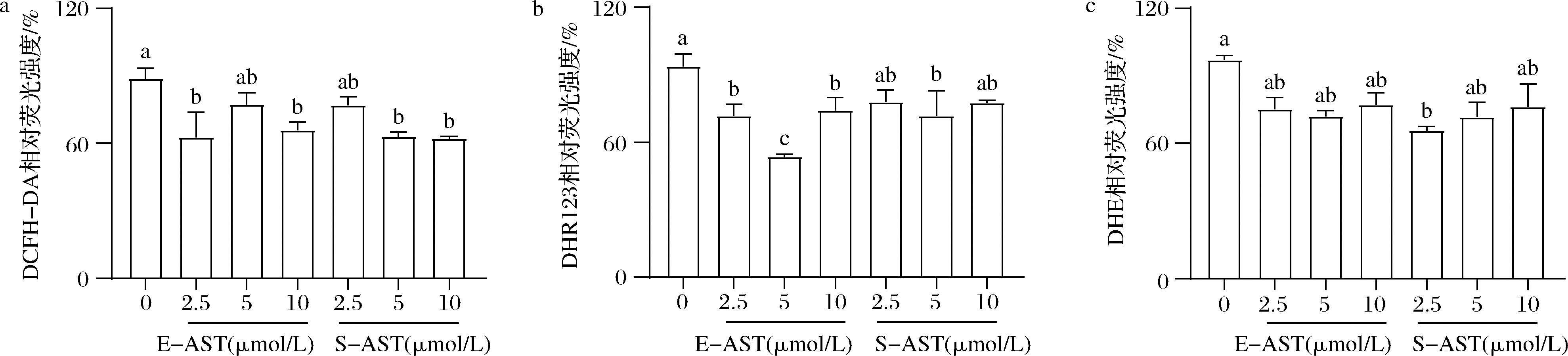
a-DCFH-DA探针检测结果;b-DHR123探针检测结果;c-DHE探针检测结果
图2 不同来源虾青素处理后HepG2细胞内ROS水平的变化
Fig.2 Changes of ROS levels in HepG2 cells treated with two astaxanthin
2.3 不同来源虾青素处理后HepG2细胞内抗氧化活性的变化
如图3所示,E-AST以剂量依赖性的方式抑制了DCF生成量增多所引起的荧光强度增加(图3-a),S-AST处理浓度为5 μmol/L时的氧化抑制能力要优于2.5 μmol/L组和10 μmol/L组(图3-b)。

a-E-AST处理组;b-S-AST处理组
图3 不同来源虾青素对HepG2细胞内ROS变化的影响
Fig.3 Effects of two astaxanthin on changes in intracellular ROS of HepG2 cells
添加不同来源虾青素后,CAA值显著性升高,并且在浓度为10 μmol/L时具有显著性差异(P<0.05),但是同一浓度不同来源虾青素之间没有显著性差异(P>0.05)(图4)。

图4 不同来源虾青素对HepG2细胞CAA值的影响
Fig.4 Effects of two astaxanthin on CAA value of HepG2 cells
3 讨论与结论
本研究利用3种特异性荧光探针(DCFH-DA、DHR123、DHE)对2种不同来源虾青素处理24 h后HepG2细胞内ROS含量进行检测,结果显示,2种不同来源虾青素均可以在不对细胞产生明显毒副作用的条件下,降低细胞内ROS的含量。研究发现,虾青素可以抑制双酚A诱导的正常人皮肤成纤维细胞中ROS的含量[14]。SUDHARSHAN等[12]在酵母细胞中使用DCFH-DA探针检测发现,虾青素通过降低细胞内ROS含量抑制H2O2诱导的酵母细胞氧化应激和DNA损伤;而LI等[15]通过DHE荧光探针对小鼠肝脏细胞进行染色发现,虾青素可以减少细胞内ROS含量并抑制缺血再灌注诱导的肝脏细胞凋亡和自噬;MACEDO等[16]利用DHE检测·O2-含量,酚红检测法测定细胞内H2O2水平以评估虾青素对中性粒细胞的影响,结果发现虾青素能够减少细胞内·O2-和H2O2的含量,并且降低细胞脂质和蛋白质的损伤,这些结果均与本研究相似。值得注意的是,DHR123的检测结果显示,不同来源虾青素对H2O2的清除能力存在差异,使用5 μmol/L虾青素处理时,E-AST处理组细胞内H2O2含量显著低于S-AST处理组。最后,通过比较不同探针的检测结果发现,当虾青素处理浓度为5 μmol/L时,E-AST对H2O2的清除能力较强(53.47%),而S-AST对细胞内ROS的清除能力较强(62.96%)。以上结果提示,2种不同来源虾青素对ROS的清除能力存在差异。
CAA法是WOLFE等[13]开发的一种用于量化植物、食物提取物和膳食补充剂的抗氧化活性的实验方法。RÉGNIER等[17]采用CAA法比较天然虾青素提取物与S-AST的细胞内抗氧化能力,发现在人内皮细胞(human umbilical vein endothelial cells,HUVECs)中E-AST的CAA值高于S-AST。YANG等[18]基于Caco-2/HT-29细胞共培养模型使用CAA法比较不同立体构型(全反式虾青素、13Z-虾青素及9Z-虾青素)虾青素的细胞内抗氧化能力,发现13Z-虾青素的细胞内抗氧化能力高于全反式虾青素和9Z-虾青素,9Z-虾青素的细胞内抗氧化能力最低,这可能与细胞对不构型虾青素的累积效率存在差异有关。上述研究表明,虾青素的细胞内抗氧化能力与其来源、构型或存在形式密切相关。本研究发现,E-AST的浓度越高,荧光值越低,提示其清除细胞内活性氧能力越强;S-AST则在处理浓度为5 μmol/L时清除能力最强。2种不同来源虾青素的CAA值均随着虾青素处理浓度的升高而升高,但是2种不同来源虾青素之间却不存在显著差异,这可能与2种虾青素的存在形式或者在HepG2细胞内的累积效率不同有关。
研究表明,虾青素对HepG2、PC12、U937和Huh7等细胞中ROS含量、GSH水平以及Nrf2-ARE信号通路的影响不同,这提示虾青素对不同细胞的抗氧化作用存在差异[19]。在HUVECs中E-AST通过诱导微量ROS产生激活Nrf2信号通路发挥其抗氧化作用,但S-AST对Huh7细胞内Nrf2靶基因的mRNA表达无影响[20-21]。本研究的结果进一步说明2种不同来源虾青素抗氧化能力存在差异,并可能与2种虾青素对细胞内ROS的清除能力不同有关。因此,有必要通过离体或在体实验,比较研究不同来源、不同构型或存在形式的虾青素的抗氧化能力差异,并进一步解析其具体的作用机制。
[1] HIGUERA-CIAPARA I,FÉLIX-VALENZUELA L,GOYCOOLEA F M.Astaxanthin:A review of its chemistry and applications[J].Critical Reviews in Food Science and Nutrition,2006,46(2):185-196.
[2] AMBATI R R,PHANG S M,RAVI S,et al.Astaxanthin:Sources,extraction,stability,biological activities and its commercial applications:A review[J].Marine Drugs,2014,12(1):128-152.
[3] CAPELLI B,TALBOTT S,DING L.Astaxanthin sources:Suitability for human health and nutrition[J].Functional Foods in Health and Disease,2019,9(6):430-445.
[4] SIES H,JONES D P.Reactive oxygen species (ROS) as pleiotropic physiological signalling agents[J].Nature Reviews Molecular Cell Biology,2020,21(7):363-383.
[5] FASSETT R G,COOMBES J S.Astaxanthin:A potential therapeutic agent in cardiovascular disease[J].Marine Drugs,2011,9(3):447-465.
[6] KIM S H,LIM J W,KIM H.Astaxanthin prevents decreases in superoxide dismutase 2 level and superoxide dismutase activity in Helicobacter pylori-infected gastric epithelial cells[J].Journal of Cancer Prevention,2019,24(1):54-58.
[7] ISPADA J,RODRIGUES T A,RISOLIA P H B,et al.Astaxanthin counteracts the effects of heat shock on the maturation of bovine oocytes[J].Reproduction,Fertility,and Development,2018,30(9):1169-1179.
[8] KIM S H,KIM H.Inhibitory effect of astaxanthin on oxidative stress-induced mitochondrial dysfunction-a mini-review[J].Nutrients,2018,10(9):1137.
[9] 刘佳琳,杜春梅.荧光探针法测定活性氧的研究进展[J].中国农学通报,2018,34(33):160-164.
LIU J L,DU C M.The detection of reactive oxygen with fluorescent probes:Research progress[J].Chinese Agricultural Science Bulletin,2018,34(33):160-164.
[10] MENG X Q,ZHANG W,ZHANG F,et al.Solanine-induced reactive oxygen species inhibit the growth of human hepatocellular carcinoma HepG2 cells[J].Oncology Letters,2016,11(3):2145-2151.
[11] HU Y Y,SHEN L,LI L,et al.Astaxanthin protects against diabetic cardiomyopathy via activation of Akt pathway in H9c2 cells[J].Tropical Journal of Pharmaceutical Research,2018,17(11):2151-2156.
[12] SUDHARSHAN S J,DYAVAIAH M.Astaxanthin protects oxidative stress mediated DNA damage and enhances longevity in Saccharomyces cerevisiae[J].Biogerontology,2021,22(1):81-100.
[13] WOLFE K L,LIU R H.Cellular antioxidant activity (CAA) assay for assessing antioxidants,foods,and dietary supplements[J].Journal of Agricultural and Food Chemistry,2007,55(22):8896-8907.
[14] LIM S R,KIM D W,SUNG J,et al.Astaxanthin inhibits autophagic cell death induced by bisphenol A in human dermal fibroblasts[J].Antioxidants (Basel,Switzerland),2021,10(8):1273.
[15] LI J J,WANG F,XIA Y J,et al.Astaxanthin pretreatment attenuates hepatic ischemia reperfusion-induced apoptosis and autophagy via the ROS/MAPK pathway in mice[J].Marine Drugs,2015,13(6):3368-3387.
[16] MACEDO R C,BOLIN A P,MARIN D P,et al.Astaxanthin addition improves human neutrophils function:In vitro study[J].European Journal of Nutrition,2010,49(8):447-457.
[17] RÉGNIER P,BASTIAS J,RODRIGUEZ-RUIZ V,et al.Astaxanthin from Haematococcus pluvialis prevents oxidative stress on human endothelial cells without toxicity[J].Marine Drugs,2015,13(5):2857-2874.
[18] YANG C,ZHANG L F,ZHANG H,et al.Rapid and efficient conversion of all-E-astaxanthin to 9Z-and 13Z-isomers and assessment of their stability and antioxidant activities[J].Journal of Agricultural and Food Chemistry,2017,65(4):818-826.
[19] VISIOLI F,ARTARIA C.Astaxanthin in cardiovascular health and disease:Mechanisms of action,therapeutic merits,and knowledge gaps[J].Food &Function,2017,8(1):39-63.
[20] DOSE J,MATSUGO S,YOKOKAWA H,et al.Free radical scavenging and cellular antioxidant properties of astaxanthin[J].International Journal of Molecular Sciences,2016,17(1):103.
[21] NIU T T,XUAN R R,JIANG L G,et al.Astaxanthin induces the Nrf2/HO-1 antioxidant pathway in human umbilical vein endothelial cells by generating trace amounts of ROS[J].Journal of Agricultural and Food Chemistry,2018,66(6):1551-1559.