大黄鱼(Larimichthys crocea)又称黄花鱼、石首鱼。据2021年中国渔业统计年鉴记载[1],2020年我国大黄鱼养殖总产量突破25万t,位居海水养殖鱼类产量第一。鱼卵是大黄鱼加工主要副产物,其含有丰富的蛋白质、不饱和脂肪酸、磷脂等重要营养成分,但大黄鱼鱼卵腥味重、品相差等原因致使其利用率低。
磷脂具有双亲分子结构,是一种被广泛应用的表面活性剂[2],主要包括磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰肌醇等,具有良好的乳化能力[3-5]。黄璐瑶等[6]研究了大黄鱼鱼卵磷脂(large yellow croaker roe phospholipids,LYCRPLs)对姜黄素的乳化特性,结果表明LYCRPLs具有较优的乳化能力。此外,与大豆磷脂和蛋黄磷脂相比,LYCRPLs对虾青素(astaxanthin,AST)的乳化能力更优,且LYCRPLs-AST乳液具有良好的稳定性[7]。
AST高不饱和的结构使其稳定性差、生物利用度低,限制了其在食品中的应用。递送系统的设计被认为是提高AST稳定性和生物利用度的良好策略,但液体食品在包装、储存和运输等方面受到一定的限制,而微胶囊技术在保护芯材稳定性的同时还能够增强其运输便利性和储存稳定性等[8],在食品行业应用范围广泛。常见的微胶囊壁材有麦芽糊精(maltodextrin,MD)、海藻酸钠、壳聚糖等。其中,MD具有低成本、中性香气、低黏度、抗氧化保护和包埋效果好等优点[9],常被用作微胶囊壁材。但由于其乳化能力较弱,在作为壁材使用时与其他壁材复配[10],可协同增加乳化能力。课题组前期研究结果表明LYCRPLs具备成为新型天然乳化剂和微胶囊新型壁材的潜力,但目前关于LYCRPLs在新型微胶囊壁材领域的研究鲜有报道。
实验以LYCRPLs/MD为微胶囊新型壁材,AST为芯材,采用喷雾干燥法制备LYCRPLs/MD-AST微胶囊后,进行理化性质表征和消化稳定性分析,为开发LYCRPLs微胶囊产品提供理论依据,并进一步拓展水产磷脂的应用。
1 材料与方法
1.1 材料与试剂
LYCRPLs由福建农林大学水产品加工实验室制备(磷脂酰胆碱 70.96%,磷脂酰乙醇胺 7.23%,溶血磷脂酰胆碱 11.27%,磷脂酰肌醇 9.37%,二十碳五烯酸+二十二碳六烯酸 39.35%);MD,耀辉生物科技有限公司;AST(纯度≥97%),美国Sigma公司;玉米油,益海嘉里金龙鱼粮油食品股份有限公司;NaCl、KCl、NaHCO3、胃蛋白酶、KH2PO4、胰蛋白酶、HCl、NaOH、丙酮、正己烷、石油醚,均为分析纯,光谱纯KBr,国药集团化学试剂有限公司。
1.2 仪器与设备
HN-3K型手持均质机,上海汗诺仪器有限公司;FB-110Q型超高压均质机,上海励途超高压设备有限公司;UV-1601型紫外可见分光光度计,北京瑞利分析仪器有限公司;Nova NanoSEM 230型场发射扫描电子显微镜,美国FEI公司;Nicolet iS50型傅里叶红外光谱仪,美国赛默飞世尔科技有限公司;STA 449-F5型同步热分析仪,德国耐驰仪器制造有限公司。
1.3 试验方法
1.3.1 LYCRPLs-AST微胶囊的制备
称取适量AST溶解于玉米油中,常温条件下置于磁力搅拌器中搅拌2 h。利用注射器和0.45 μm的滤膜过滤玉米油溶液,得到AST油相;将LYCRPLs和MD按一定比例分散在水溶液中,置于磁力搅拌器中搅拌2 h,得到LYCRPLs/MD水相。两相按比例混合,并使用磁力搅拌器搅拌1 h后,调整手持式均质仪转速在20 000 r/min均质5 min得到粗乳液,后通过超高压均质机均质得到AST乳液。采用实验室喷雾干燥器制备微胶囊,具体条件:加热温度120 ℃,进口空气温度80 ℃,出口空气温度65 ℃,压缩机气压0.3 MPa,进料流速15 g/min。
1.3.2 LYCRPLs-AST微胶囊的表征
1.3.2.1 水分含量的测定
取一定量微胶囊置于烘箱中,105 ℃烘干至恒重,根据样品烘干前、后的质量差计算水分含量[11]。
1.3.2.2 过氧化值的测定
称取10.0 g微胶囊粉末倒入广口瓶中,加入30 mL石油醚并摇匀,充分混合后静置浸提12 h,经装有Na2SO4的漏斗过滤,将滤液置于40 ℃的水浴中,用旋转蒸发仪减压蒸干石油醚,残留物即为待测试样。再根据GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》中的滴定法测定微胶囊的过氧化值。
1.3.2.3 酸价的测定
称取10.0 g微胶囊粉末,加入30 mL石油醚,搅拌直至粉末完全溶解,静置12 h,取上层提取液,置于40 ℃的水浴中,用旋转蒸发仪减压去除石油醚,残留物即为待测试样。再根据GB 5009.229—2016《食品安全国家标准 食品中酸价的测定 滴定法》中的冷溶剂指示剂法测定微胶囊的酸价。
1.3.2.4 溶解度的测定
根据KANHA等[12]的方法并稍作修改,测定微胶囊的溶解度。取1.0 g微胶囊粉末添加至10 mL蒸馏水中,利用磁力搅拌器搅拌30 min。将悬浮液以4 000 r/min离心10 min,收集上清液于蒸发皿中并在105 ℃下干燥24 h。溶解度根据公式(1)计算:
溶解度![]()
(1)
式中:m,样品质量,g;m1,蒸发皿的质量,g;m2,蒸发皿与不溶物的质量,g;B,样品的水分含量,%。
1.3.2.5 包埋率的测定
AST标准曲线的绘制:准确称取AST粉末0.005 g于50 mL棕色容量瓶中,用V(丙酮)∶V(石油醚)=1∶1,混合有机溶剂定容至50 mL,之后配制1.0、2.0、3.0、4.0、5.0 μg/mL的AST溶液,分别测定在470 nm波长处的吸光度。得到回归方程y=0.191 3x+0.085 5(y为吸光度,x为AST质量浓度),R2=0.999 2。
参照AST含量标准曲线,测得微胶囊表面AST含量。包埋率根据公式(2)计算:
包埋率![]()
(2)
1.3.3 微观结构的观察
将适量粉末置于覆盖有薄金层的导电胶上进行喷金处理,利用场发射扫描电子显微镜观察制备的粉末的微观结构特性。
1.3.4 傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
分别称取已制备的LYCRPLs、微胶囊粉末和MD 1.0~2.0 mg,与干燥的光谱纯KBr粉末混合均匀,用压片机压制成1 mm薄片并进行FTIR分析。测量范围为4 000~400 cm-1,光谱分辨率为4 cm-1。
1.3.5 微胶囊热稳定性分析
根据HUANG[13]等的方法稍作修改。使用同步热分析仪在氩气气氛下对微胶囊进行差示扫描量热法(differential scanning calorimetry,DSC)/热重分析(thermogravimetric-differential thermal gravity,TG-DTG)实验。每次测试的样品质量为8.0~10.0 mg。TG-DTG分析条件:在25~600 ℃的温度范围内以10 ℃/min的加热速率和20 mL/min的氩气流速对样品进行称重和扫描。DSC分析条件:加热样品至25~300 ℃,加热速率10 ℃/min,氩气以50 mL/min的流速流动。
1.3.6 微胶囊体外消化稳定性的分析
1.3.6.1 体外模拟消化液的配制
模拟胃液(simulated gastric fluid,SGF)的配制:准确称取2.0 g NaCl和3.2 g胃蛋白酶,加入到200 mL蒸馏水中,搅拌溶解后用1.0 mol/L的HCl溶液调节pH至1.2,倒入500 mL容量瓶并定容。
模拟肠液(simulated intestinal juice,SIF)的配制:准确称取3.4 g KH2PO4和5.0 g胰蛋白酶,加入到200 mL蒸馏水中,搅拌溶解后用0.5 mol/L的NaOH溶液调节pH至7.0,倒入500 mL容量瓶并定容。
1.3.6.2 体外模拟消化实验
参考黄进宝等[14]的方法,并稍作修改。称取5.0 g微胶囊粉末置于50 mL SGF中,使用振荡水槽(37±0.5) ℃连续振荡2 h。每0.5 h过滤取出微胶囊进行称质量。再过滤加到50 mL SIF中,同样条件下振荡3 h,每0.5 h过滤取出微胶囊进行称质量。
微胶囊释放率测定:每隔0.5 h取混合均匀消化液,将酶灭活后移入分液漏斗并加入25 mL正己烷混合萃取。重复3次后,将有机相合并,40 ℃旋蒸法去除正己烷,并用N2干燥样品,得到消化过程中释放的油脂含量,释放率根据公式(3)计算:
释放率![]()
(3)
2 结果与分析
2.1 LYCRPLs-AST微胶囊的性质表征
2.1.1 微胶囊的基本理化性质
水分含量是微胶囊的一个重要特征,与水的活性、流动性、黏性、干燥效率、生物活性剂的氧化和微生物的生长有关[15]。由表1可知,微胶囊粉末的水分含量较低。这说明产品在喷雾过程中水分充分蒸发,达到了所需的干燥状态,有利于产品的贮藏。过氧化值和酸价分别用于衡量产品氧化和水解程度的指标,微胶囊的过氧化值和酸价均符合食品安全国家标准GB 28401—2012《食品添加剂 磷脂》。微胶囊的溶解度达(90.86±0.49)%,说明其溶解度良好,从而改善了AST在水中的溶解性。实验测得包埋率为(90.12±2.01)%,说明以LYCRPLs/MD作为壁材可以有效包埋AST,从而起到了对AST的保护作用。
表1 LYCRPLs/MD-AST微胶囊的理化性质
Table 1 Physicochemical properties of LYCRPLs/MD-AST microcapsules

水分含量/%过氧化值/(mmol/kg)酸价/(mg/g)溶解度/%AST包埋率/%1.1±0.045.18±0.188.62±0.0490.86±0.4990.12±2.01
2.1.2 微观结构分析
通过场发射扫描电镜对微胶囊的表面形态结构进行表征分析,如图1所示,LYCRPLs/MD成功地封装了AST。微胶囊整体呈近球形结构,直径约为2~3 μm,表面致密,无明显裂纹,但部分微胶囊表面有轻微的压痕,这可能是由于电子显微镜对微胶囊施加真空压力[9],使其表面发生改变。颗粒聚结可能是由于水分的吸收和表面油的存在[16]。LYCRPLs提高了其封装效率,使其表面更均匀,颗粒更小。进一步在50 000倍条件下可以直观地看到微胶囊表面有明显的孔洞,这可能是喷雾干燥过程中水分瞬间蒸发造成的。喷雾干燥器入口温度的升高促进了颗粒外壳的快速形成。由于蒸汽产生的速度快,微胶囊表面迅速膨胀,导致其表面产生收缩现象。BAJAC等[17]认为微胶囊表面的孔隙有助于其形成更好的分散性和再水合性。再结合微胶囊粉末外观(图2)表明,喷雾干燥能够制备出干燥的微胶囊粉末,相较于乳液稳定性更高、更便携。
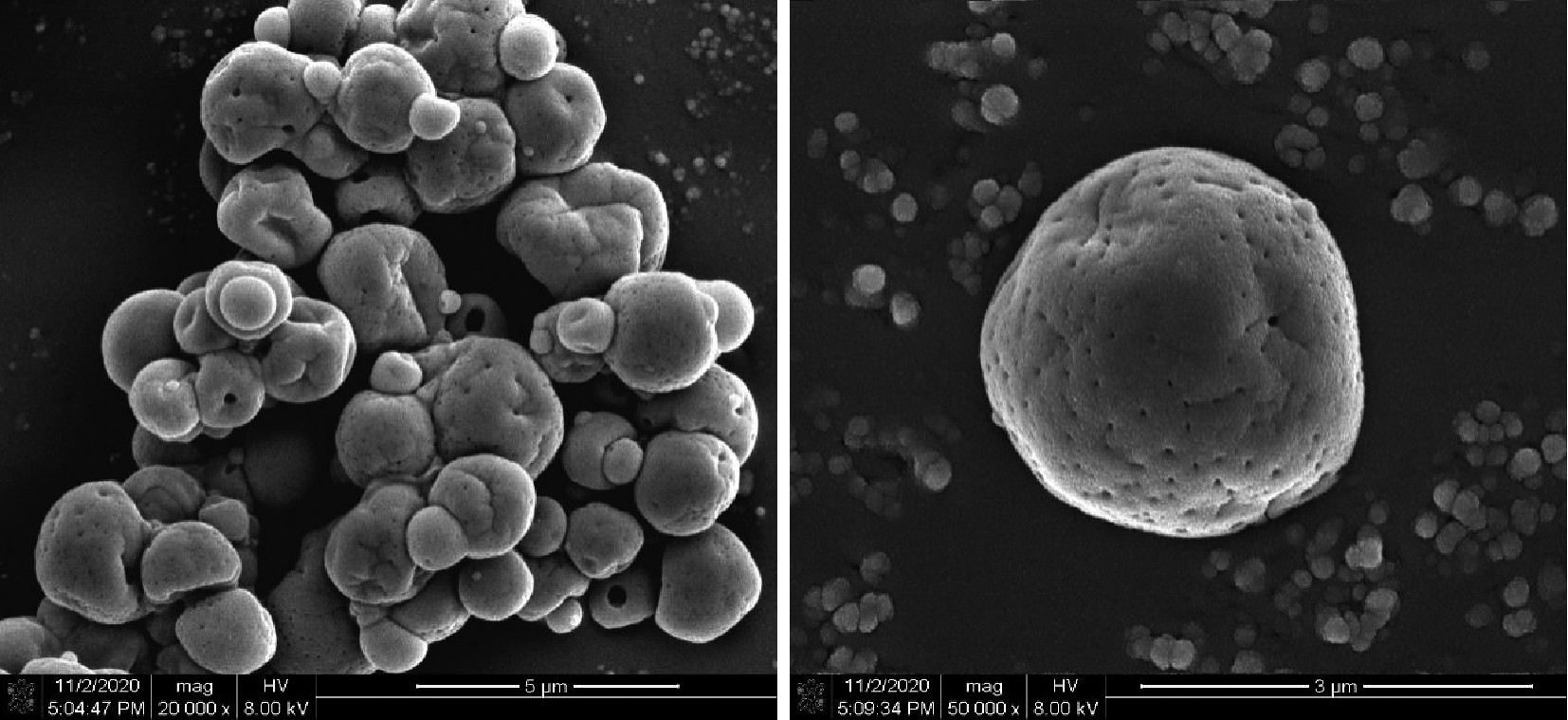
图1 LYCRPLs/MD-AST微胶囊的场发射扫描电镜图
Fig.1 FSEM micrograph of LYCRPLs/MD-AST microcapsules

图2 微胶囊粉末的外观
Fig.2 The visual appearance of microcapsule powder
2.1.3 FTIR分析
由图3可观察到微胶囊和LYCRPLs、MD具有相似的特征吸收峰,而几乎没有观察到AST的大部分特征峰,这证实了AST成功地被LYCRPLs/MD包封。波数在3 300~3 500 cm-1的宽吸收带是多分子缔合—OH伸缩振动的特征吸收峰;波数在2 930 cm-1左右的是—CH2—官能团伸缩振动的特征吸收峰;AST的光谱在975~1 654 cm-1处显示出连续的特征峰,在微胶囊的光谱中发生了明显的减弱现象,推测这可能是由于LYCRPLs/MD混合壁材掩盖了AST的特征吸收峰导致的[18]。在1 627.70 cm-1附近微胶囊出现了双键伸缩振动,是由C![]() O键和P
O键和P![]() O键伸缩振动所引起。这些结果表明LYCRPLs/MD分子之间存在氢键相互作用[19],AST被LYCRPLs/MD包裹,故AST的特征带在制备成微胶囊后发生改变。
O键伸缩振动所引起。这些结果表明LYCRPLs/MD分子之间存在氢键相互作用[19],AST被LYCRPLs/MD包裹,故AST的特征带在制备成微胶囊后发生改变。
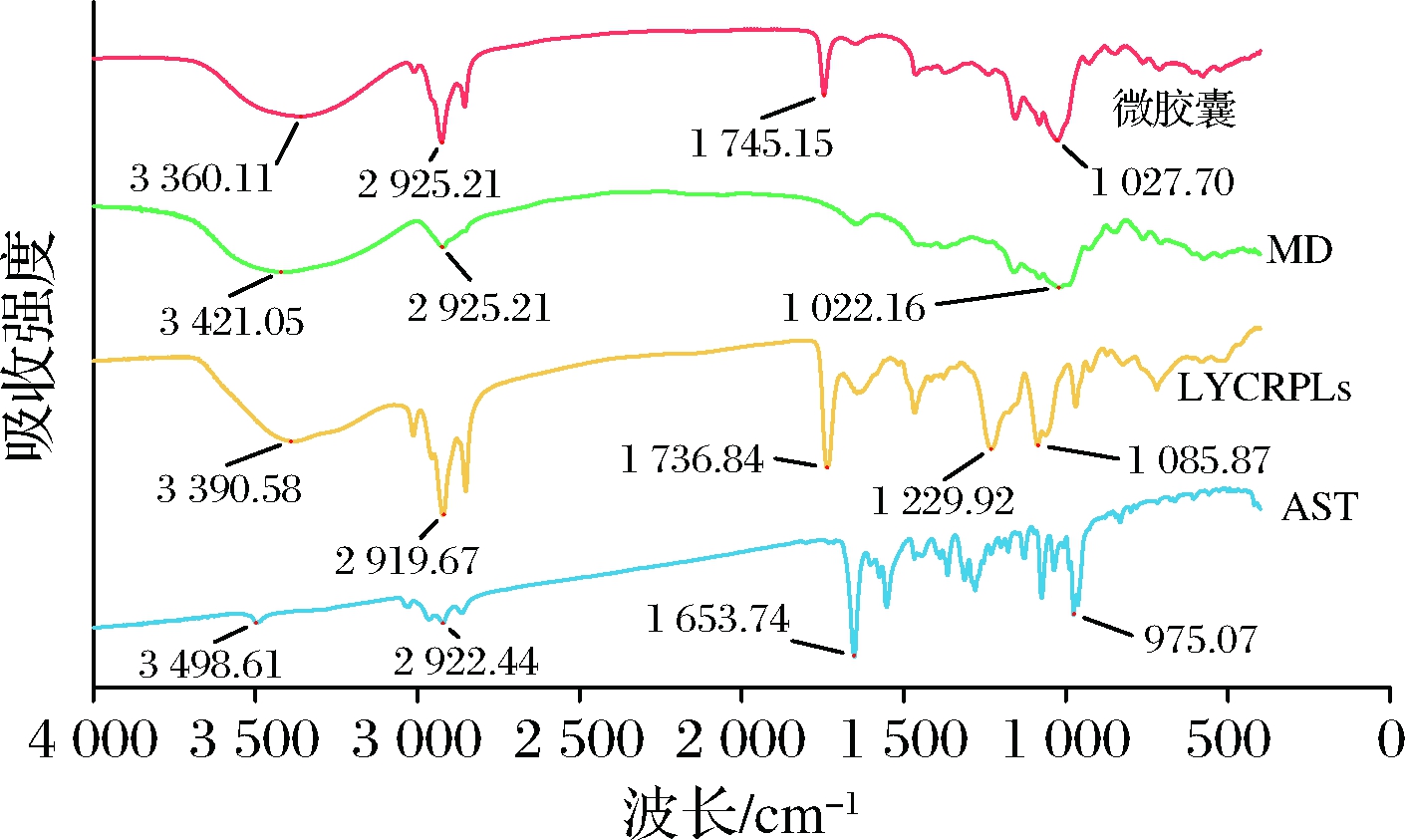
图3 微胶囊、MD、LYCRPLs和AST的红外图谱
Fig.3 FTIR spectra of microcapsule,MD,LYCRPLs,and AST
根据以上实验得出,LYCRPLs/MD-AST可以形成稳定的微胶囊体系。
2.1.4 DSC/DTG-TG分析
由图4可见,在整个热重分析过程中,微胶囊、MD和LYCRPLs有相似的热分解阶段,微胶囊的DSC、DTG和TG曲线形状受MD和LYCRPLs影响较大。

a-DSC图谱;b-TG图谱;c-DTG图谱
图4 MD、LYCRPLs、AST和微胶囊的DSC/DTG-TG分析图谱
Fig.4 DSC/DTG-TGspectra of MD,LYCRPLs,AST and microcapsules
开始发生相转变的温度即为玻璃化转变温度[20]。从DSC曲线(图4-a)可知,AST在50 ℃左右发生玻璃态转变,而微胶囊在90 ℃左右发生玻璃态转变。这表明微胶囊能够在常温下保持稳定的玻璃态,在这种状态下,微胶囊的分子流动阻力和分子黏度都很高,整个体系的分子扩散速率和分子间反应速率都很低,从而能够保证微胶囊芯材活性物质的稳定。
图4-c中AST的峰面积显著大于微胶囊的峰面积,说明AST质量损失显著大于包埋后的微胶囊,表明微胶囊能够较好地保护芯材AST的质量损失。从微胶囊TG曲线(图4-b)可知,在150~230 ℃内曲线略有下降,微胶囊开始失重,大约有4%~5%的质量损失,推测其质量损失原因是微胶囊粉末中自由水的蒸发。随着温度的继续升高,270~450 ℃,微胶囊质量损失速率加快,这个过程包括了2个阶段,第1阶段可能是微胶囊结构受到严重破坏,表面壁材化学键开始断裂,MD和LYCRPLs发生热分解并伴随着AST的受热分解释放,从而导致质量发生变化。第2阶段可能是第1阶段生成的中间产物进一步分解并最终碳化[20]。直到温度上升至500 ℃时,失重曲线开始趋于平缓即微胶囊样品质量改变逐渐平稳,分解基本完成。在整个失重过程,微胶囊的质量损失为78.17%。由此可见,微胶囊在一般高温条件下仍然能够保持良好的稳定性。
2.2 体外缓释性能分析
由图5可知,在体外SGF消化2 h,AST释放缓慢,释放率为15.12%,在SIF消化过程中,AST释放速度加快。肠道环境中的胰蛋白酶对LYCRPLs/MD进一步水解,导致壁材破裂,微胶囊结构发生变化从而促进AST的大量释放[21]。在模拟胃肠消化5.5 h后,微胶囊中AST释放率达74.6%。结果表明,微胶囊包埋对AST的保留率有显著影响。在低pH条件下,AST释放量相对较少,而在SIF条件下,其释放量增加,因此可以推测胶囊化后的AST能在小肠内被吸收。SIF的pH较高,可能增加了水分子之间的相互作用、微胶囊的润湿性和溶解度[22]。综上所述,以LYCRPLs/MD作为壁材可以保护AST活性物质并缓慢释放活性物质。因此,LYCRPLs/MD可用于制备活性物质缓释的递送系统。
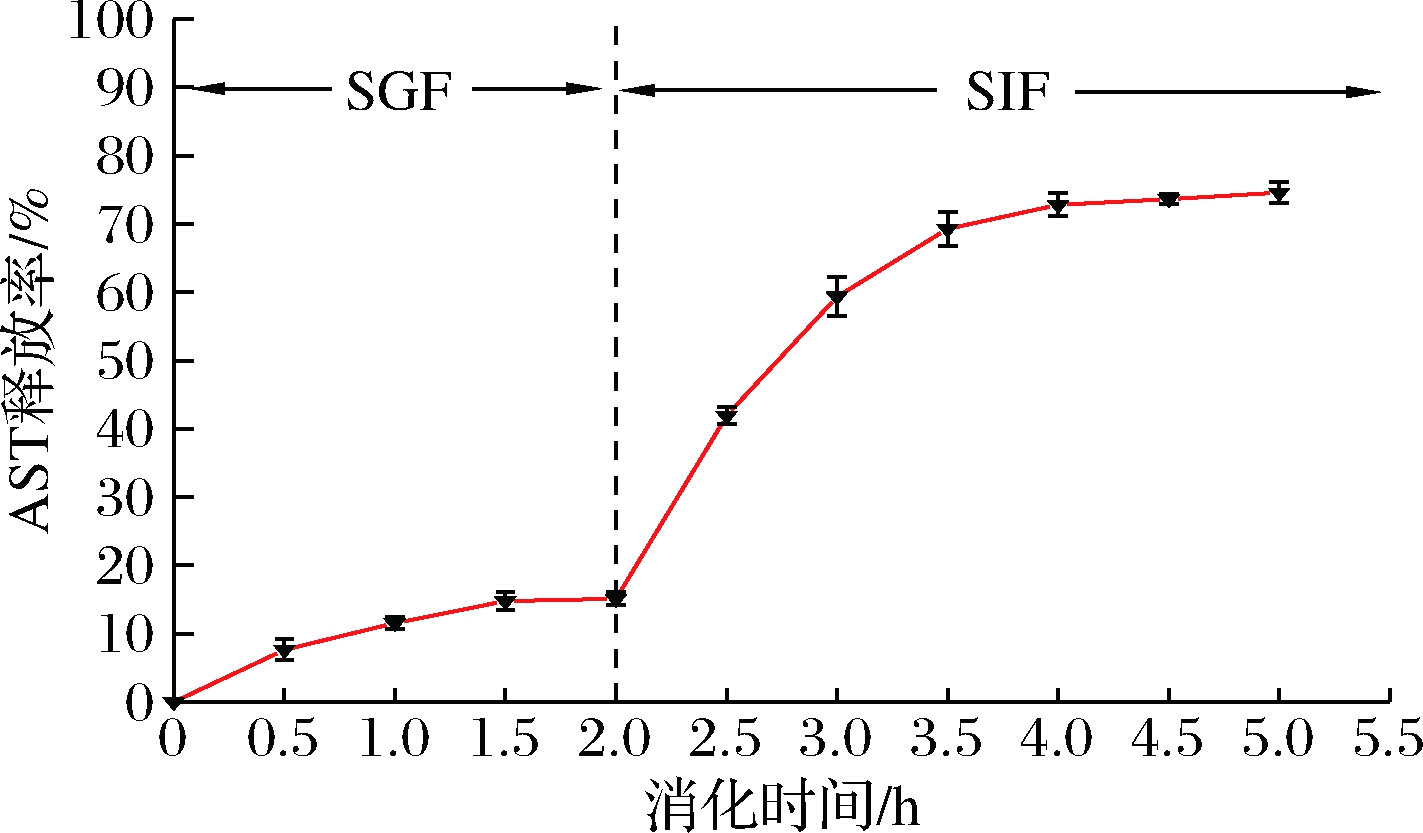
图5 微胶囊在模拟体外消化过程中的释放情况
Fig.5 Microcapsules release curve in simulated gastrointestinal tract environments
3 结论
实验研究了LYCRPLs/MD-AST微胶囊的理化特性、微观结构、红外光谱、热稳定性等指标,并考察了该微胶囊在模拟胃肠道条件下的释放能力。结果表明:LYCRPLs/MD-AST微胶囊含水量较低、溶解度较高、包埋率为(90.12±2.01)%,其过氧化值和酸价均符合国标要求;微观结构、红外光谱以及热稳定性分析表明LYCRPLs/MD能够较好地包封AST;模拟消化结果表明微胶囊对AST的释放有较好的缓释作用。研究结果为LYCRPLs的高值化利用提供理论指导,也为水产磷脂资源开发提供了新方向。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会编制.中国渔业统计年鉴-2021[M].北京:中国农业出版社,2021.
[2] 王然然,王琦,王学东,等.鲢鱼头磷脂的提取工艺优化及乳化性能研究[J].中国油脂,2020,45(4):102-108.
WANG R R,WANG Q,WANG X D,et al.Preparation process optimization and emulsification properties of phospholipids from silver carp head[J].China Oils and Fats,2020,45(4):102-108.
[3] FRANCESCA B,DANIEL C,O’MAHONY JAMES A.Inter-relationships between composition,physicochemical properties and functionality of lecithin ingredients[J].Trends in Food Science &Technology,2021,111:261-270.
[4] LI J B,PEDERSEN J N,ANANKANBIL S,et al.Enhanced fish oil-in-water emulsions enabled by rapeseed lecithins obtained under different processing conditions[J].Food Chemistry,2018,264:233-240.
[5] ZÜGE L C B,MAIEVES H A,SILVEIRA J L M,et al.Use of avocado phospholipids as emulsifier[J].LWT-Food Science and Technology,2017,79:42-51.
[6] 黄璐瑶,杜艳瑜,陆晓丹,等.大黄鱼鱼卵磷脂乳化姜黄素工艺的研究[J].食品与发酵工业,2020,46(13):196-202.
HUANG L Y,DU Y Y,LU X D,et al.Study on the technology of emulsifying curcumin in phospholipids of large yellow croaker roe[J].Food and Fermentation Industries,2020,46(13):196-202.
[7] HUANG L Y,LU X D,ZHANG L Y,et al.Insight into the emulsifying properties of DHA-enriched phospholipids from large yellow croaker (Larimichthys crocea) roe[J].LWT,2021,150:111984.
[8] GUO B Z,ZHU C Y,HUANG Z H,et al.Microcapsules with slow-release characteristics prepared by soluble small molecular starch fractions through the spray drying method[J].International Journal of Biological Macromolecules,2022,200:34-41.
[9]  LVAREZ-HENAO M V,SAAVEDRA N,MEDINA S,et al.Microencapsulation of lutein by spray-drying:Characterization and stability analyses to promote its use as a functional ingredient[J].Food Chemistry,2018,256:181-187.
LVAREZ-HENAO M V,SAAVEDRA N,MEDINA S,et al.Microencapsulation of lutein by spray-drying:Characterization and stability analyses to promote its use as a functional ingredient[J].Food Chemistry,2018,256:181-187.
[10] 应欣,卢玉,李义,等.麦芽糊精的功能特性及其应用研究进展[J].中国粮油学报,2019,34(12):131-137.
YING X,LU Y,LI Y,et al.Research advance in maltodextrins functionality and application[J].Journal of the Chinese Cereals and Oils Association,2019,34(12):131-137
[11] 唐宏刚,陈伊凡,李欢欢,等.蛋黄卵磷脂微胶囊贮藏稳定性研究[J].中国食品学报,2020,20(9):166-172.
TANG H G,CHEN Y F,LI H H,et al.Research on storage stability of egg yolk lecithin microcapsules[J].Journal of Chinese Institute of Food Science and Technology,2020,20(9):166-172.
[12] KANHA N,REGENSTEIN J M,SURAWANG S,et al.Properties and kinetics of the in vitro release of anthocyanin-rich microcapsules produced through spray and freeze-drying complex coacervated double emulsions[J].Food Chemistry,2021,340:127950.
[13] HUANG S S,WEI R C,XIE T,et al.Evaluation of fire hazards in typical vegetable oil residues[J].Process Safety and Environmental Protection,2021,154:223-235.
[14] 黄进宝,唐冬,刘香菊,等.茶籽油微胶囊的制备及其产品特性研究[J].中国粮油学报,2021,36(4):82-89.
HUANG J B,TANG D,LIU X J,et al.Preparation of camellia seed oil microcapsules and product properties[J].Journal of the Chinese Cereals and Oils Association,2021,36(4):82-89.
[15] ALI MAHDI A,MOHAMMED J K,AL-ANSI W,et al.Microencapsulation of fingered citron extract with gum Arabic,modified starch,whey protein,and maltodextrin using spray drying[J].International Journal of Biological Macromolecules,2020,152:1125-1134.
[16] ZHU J,LI X,LIU L,et al.Preparation of spray-dried soybean oil body microcapsules using maltodextrin:Effects of dextrose equivalence[J].LWT-Food Science and Technology,2022,154:111984.
[17] BAJAC J,NIKOLOVSKI B,LON AREVI
AREVI I,et al.Microencapsulation of juniper berry essential oil (Juniperus communis L.) by spray drying:Microcapsule characterization and release kinetics of the oil[J].Food Hydrocolloids,2022,125:107430.
I,et al.Microencapsulation of juniper berry essential oil (Juniperus communis L.) by spray drying:Microcapsule characterization and release kinetics of the oil[J].Food Hydrocolloids,2022,125:107430.
[18] 杨小斌,周爱梅,王爽,等.蓝圆鲹鱼油微胶囊的结构表征与体外消化特性[J].食品科学,2019,40(1):117-122.
YANG X B,ZHOU A M,WANG S,et al.Structure characterization and in vitro digestibility of microencapsulated Decapterus maruadsi fish oil[J].Food Science,2019,40(1):117-122.
[19] XIE H J,LIU C Z,GAO J,et al.Fabrication of Zein-Lecithin-EGCG complex nanoparticles:Characterization,controlled release in simulated gastrointestinal digestion[J].Food Chemistry,2021,365:130542.
[20] 王姝杰.牡丹籽油微胶囊的制备及其释放行为研究[D].南昌:南昌大学,2017.
WANG S J.Preparation and release behavior of peony seed oil Microencapsulation[D].Nanchang:Nanchang University,2017.
[21] KARACA A C,NICKERSON M,LOW N H.Microcapsule production employing chickpea or lentil protein isolates and maltodextrin:Physicochemical properties and oxidative protection of encapsulated flaxseed oil[J].Food Chemistry,2013,139(1-4):448-457.
[22] YADAV K,BAJAJ R K,MANDAL S,et al.Encapsulation of grape seed extract phenolics using whey protein concentrate,maltodextrin and gum Arabica blends[J].Journal of Food Science and Technology,2020,57(2):426-434.